[推荐学习]2019高考化学总复习08水溶液中的离子平衡28盐类的水解2含解析
近年高考化学总复习第八章水溶液中的离子平衡8-3-1考点一盐类的水解及规律学后即练新人教版(202

2019高考化学总复习第八章水溶液中的离子平衡8-3-1 考点一盐类的水解及规律学后即练新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学总复习第八章水溶液中的离子平衡8-3-1 考点一盐类的水解及规律学后即练新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学总复习第八章水溶液中的离子平衡8-3-1 考点一盐类的水解及规律学后即练新人教版的全部内容。
8—3—1 考点一盐类的水解及规律1.0。
1 mol下列气体分别与1 L 0。
1 mol·L-1的NaOH溶液反应,形成的溶液pH最小的是()A.NO2B.SO2C.SO3D.CO2解析:A项,NO2和NaOH溶液发生反应:2NO2+2NaOH===NaNO3+NaNO2+H2O,二者恰好反应得到的是NaNO3和NaNO2的混合溶液,NaNO2是强碱弱酸盐,水溶液显碱性;B项,发生反应:SO2+NaOH===NaHSO3,该物质是强碱弱酸盐,由于HSO 错误!电离大于水解作用,所以溶液显酸性;C项,发生反应:SO3+NaOH===NaHSO4,该盐是强酸强碱的酸式盐,完全电离出H+溶液显酸性,相当于一元强酸,所以酸性比NaHSO3强;D项,发生反应:CO2+NaOH===NaHCO3,该物质是强碱弱酸盐,由于HCO错误!电离小于水解作用,所以溶液显碱性。
因此溶液的酸性最强的是NaHSO4,溶液的酸性越强,pH越小。
答案:C2.有一种酸式盐AHB,它的水溶液呈弱碱性。
则以下说法:①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;②H2B 不是强酸;③HB-的电离程度大于HB-的水解程度;④该盐溶液的电离方程式一般写成:AHB A++HB-,HB-H++B2-。
2019高考化学总复习08水溶液中的离子平衡28盐类的水解2含解析新人教版word版本

盐类的水解(2)含解析李仕才1.(2017年高考·课标全国卷Ⅰ)常温下将NaOH 溶液滴加到己二酸(H 2X)溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是( )A .K a2(H 2X)的数量级为10-6B .曲线N 表示pH 与lg c HX -c H 2X的变化关系C .NaHX 溶液中c (H +)> c (OH -)D .当混合溶液呈中性时,c (Na +)>c (HX -)>c (X 2-)>c (OH -)=c (H +) 解析:H 2X 的电离方程式为H 2XH ++HX -,HX-H ++X 2-。
当c HX -c H 2X =c X 2-c HX -=1时,即横坐标为0.0时,K a1=c (H +),K a2=c ′(H +),因为K a1>K a2,故c (H +)>c ′(H +),即pH<pH′,结合图像知,曲线N 代表第一步电离,曲线M 代表第二步电离,K a2≈10-5.4,A 项正确;由上述分析知,B 项正确;选择曲线M 分析,当NaHX 、Na 2X 浓度相等时,溶液pH 约为5.4,溶液呈酸性,所以,NaHX 溶液中c (H +)>c (OH -),C 项正确;电荷守恒式为c (Na +)+c (H +)=c (OH -)+c (HX -)+2c (X 2-),中性溶液中存在c (H +)=c (OH -),故有c (Na +)=c (HX-)+2c (X 2-),假设c (HX -)=c (X 2-)或c (HX -)>c (X 2-)(见C 项分析),则溶液一定呈酸性,故中性溶液中c (HX -)<c (X 2-),D 项错误。
答案:D2.(2017年高考·课标全国卷Ⅱ)改变0.1 mol·L -1二元弱酸H 2A 溶液的pH ,溶液中H 2A 、HA -、A 2-的物质的量分数δ(X)随pH 的变化如图所示[已知 δ(X)=c Xc H 2A +c HA -+c A 2-]。
2019高考化学总复习 08 水溶液中的离子平衡(28)盐类的水解(1)(含解析)新人教版

2.下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终一定能得到纯净物的是()
A.向FeSO4溶液中通入过量Cl2
B.向NaHCO3溶液中加入一定质量的Na2O2粉末
C.向NaI和NaBr混合溶液中通入过量Cl2
D.向NaOH溶液中加入过量AlCl3溶液
解析:A项,发生变化FeSO4 Fe2(SO4)3+FeCl3,蒸干反应后的溶液,得到Fe2(SO4)3和Fe(OH)3的混合物,灼烧后得到Fe2(SO4)3和Fe2O3的混合物;B项,发生反应2Na2O2+2H2O===4NaOH+O2↑、NaHCO3+NaOH===Na2CO3+H2O,蒸干溶液并充分灼烧后,得到Na2CO3或Na2CO3和NaOH的混合物;C项,发生反应2NaI+Cl2===2NaCl+I2、2NaBr+Cl2===2NaCl+Br2,蒸干溶液并灼烧后,Br2挥发,I2升华,最终得到NaCl;D项,发生反应AlCl3+3NaOH(少量)===Al(OH)3↓+3NaCl,由于AlCl3过量,反应后溶液中存在Al(OH)3、NaCl和AlCl3,蒸干溶液并充分灼烧后最终得到NaCl和Al2O3的混合物。
盐类的水解
李仕才
基础巩固
1.在一定条件下,Na2CO3溶液中存在水解平衡:CO +H2OHCO +OH-。下列说法正确的是()
A.稀释溶液,上述可逆反应平衡常数不变
B.通入CO2,溶液pH增大
C.加入NaOH固体,平衡向正反应方向移动
D.升高温度, 不变
解析:B项,通入CO2与OH-反应,右移,pH减小;C项,加入NaOH(s)左移,pH变大;D项,升温,右移, 变大。
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
高考化学总复习 08 水溶液中的离子平衡(28)盐类的水解(2)课件

第二十七页,共三十三页。
总结提升:
分析盐溶液蒸干后固体成分的思路 (1)盐水解同时生成易挥发性酸和难溶性碱时,溶液蒸干灼烧后得对应的氧化物,如 AlCl3(aq)―蒸―干→Al(OH)3―灼―烧→Al2O3。但只生成易挥发性或只生成难溶性产物时,溶液蒸 干灼烧后可得到原溶质,如 Na2CO3 溶液蒸干、CuSO4 溶液蒸干。 (2)考虑盐受热时是否分解,如 Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl 固体受热易 分 解 , 因 此 蒸 干灼 烧 后 分 别为 Ca(HCO3)2―→CaCO3(CaO) ; NaHCO3―→Na2CO3 ; KMnO4―→K2MnO4+MnO2;NH4Cl―→NH3↑+HCl↑。 (3)考虑盐在蒸干时是否会被 O2 氧化,如 Na2SO3(aq)―蒸―干→Na2SO4(s)。
解析:Kh=cH+c·cNNHH4+3·H2O=KKwb,c(NH4+)≈1 mol·L-1,
所以 c(H+)= Kh=
10-14 1.8×10-5
mol·L-1
c(H+)≈c(NH3·H2O),c(H+)≈ 5.56×10-5 mol·L-1≈2.36×10-5 mol·L-1。
答案:2.36×10-5
第十五页,共三十三页。
【解析】 A 选项,明矾溶液中铝离子水解使溶液呈酸性,加热后铝离子的水解程度 增大,溶液的酸性增强,故无颜色变化;B 选项,醋酸钠溶液中醋酸根离子水解使溶液呈 碱性,加热,醋酸根离子的水解程度增大,溶液的碱性增强,溶液的颜色加深;C 选项, 加入氯化铵固体,氨水的电离程度减弱,碱性减弱,溶液颜色变浅;D 选项,加入 NaCl 固体,小苏打溶液的酸碱性不变,溶液的颜色没有变化。
第二十六页,共三十三页。
高考化学总复习 第八章 水溶液中的离子平衡 (2)

目夺市安危阳光实验学校课时3 盐类的水解[2018备考·最新考纲]1.了解盐类水解的原理及其一般规律。
2.了解影响盐类水解程度的主要因素。
3.掌握水解离子方程式的书写。
4.了解盐类水解的应用。
考点一盐类的水解及其规律(考点层次B→共研、理解、整合)1.定义在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应。
2.实质→c (H +)≠c(OH-)→溶液呈碱性或酸性3.特点4.规律有弱才水解,越弱越水解,谁强显谁性,同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCl、KNO3否中性pH=7强酸弱碱盐NH4Cl、Cu(NO3)2是NH+4、Cu2+酸性pH<7弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、CO2-3碱性pH>75.水解方程式的书写(1)一般要求如NH4Cl的水解离子方程式为NH+4+H2O NH3·H2O+H+。
(2)三种类型的盐水解方程式的书写。
①多元弱酸盐水解:分步进行,以第一步为主,一般只写第一步水解方程式。
如Na2CO3的水解离子方程式为CO2-3+H2O HCO-3+OH-。
②多元弱碱盐水解:水解离子方程式一步写完。
如FeCl3的水解离子方程式为Fe3++3H2O Fe(OH)3+3H+。
③阴、阳离子相互促进的水解:水解程度较大,书写时要用“===”、“↑”、“↓”等。
如Na2S溶液与AlCl3溶液混合反应的水解离子方程式为2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑。
教材VS高考1.(RJ 选修4·P 521改编)现有浓度为0.1 mol·L -1的五种电解质溶液①Na 2CO 3 ②NaHCO 3 ③NaAlO 2④CH 3COONa ⑤NaOH这五种溶液的pH 由小到大的顺序是( ) A .⑤③①②④ B .①④②③⑤ C .④②①③⑤ D .②④①③⑤答案 C2.(RJ 选修4·P 591改编)下列水解的离子方程式正确的是( ) A .HCO -3+H 2O CO 2↑+OH -B .S 2-+2H 2O H 2S +2OH-C .Fe 3++3H 2O Fe(OH)3↓+3H +D .CO 2-3+H 2O HCO -3+OH-答案 D3.(溯源题)判断下列说法是否正确(1)向盐酸中加入氨水至中性,溶液中c NHo\al(+,4)c Cl ->1(×)(2016·课标全国Ⅲ,13C)(2)0.1 mol/L CH 3COONa 溶液pH>7,证明乙酸是弱酸(√)(2016·上海,6B)(3)饱和NaClO 溶液pH 约为11:ClO -+H 2O HClO +OH -(√)(2015·北京理综,11B 改编)(4)25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液的pH =7(×) (2015·重庆理综,3B)探源:本高考题组源于教材RJ 选修4 P 55“思考与交流”及其拓展,对盐溶液的酸碱性及水解方程式的书写进行了考查。
2019版高中化学讲义:第八章 水溶液中的离子平衡 第28讲 含答案

第28讲盐类水解考纲要求 1.了解盐类水解的原理。
2.了解影响水解程度的主要因素。
3.了解盐类水解的应用。
考点一盐类水解及其规律1.定义在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应.2.实质盐电离―→错误!―→破坏了水的电离平衡―→水的电离程度增大―→溶液呈碱性、酸性或中性3.特点4.规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCl、KNO3否中性pH=7强酸弱碱盐NH4Cl、Cu(NO3)2是NH错误!、Cu2+酸性pH<7弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、CO错误!碱性pH〉75。
盐类水解离子方程式的书写要求(1)一般来说,盐类水解的程度不大,应该用可逆号“”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
(3)多元弱碱阳离子的水解简化成一步完成。
(4)水解分别显酸性和碱性的离子组由于相互促进水解程度较大,书写时要用“==="“↑"“↓”等。
(1)溶液呈中性的盐一定是强酸、强碱生成的盐(×)(2)酸式盐溶液可能呈酸性,也可能呈碱性(√)(3)某盐溶液呈酸性,该盐一定发生了水解反应(×)(4)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同(√)(5)常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液,水的电离程度相同(×)(6)NaHCO3、NaHSO4都能促进水的电离(×)(7)向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成(×) (8)S2-+2H2O H2S+2OH-(×)(9)Fe3++3H2O Fe(OH)3↓+3H+(×)(10)明矾溶液显酸性:Al3++3H2O Al(OH)3+3H+(√)1.怎样用最简单的方法区别NaCl溶液、氯化铵溶液和碳酸钠溶液?答案三种溶液各取少许分别滴入紫色石蕊溶液,不变色的为NaCl溶液,变红色的为氯化铵溶液,变蓝色的为碳酸钠溶液。
高考化学一轮复习第8章水溶液中的离子平衡第29讲盐类的水解课件新人教版

5,c(H+)=10-5 mol·L-1,c(OH-)=10-9 mol·L-1,而 c(NH3·H2O)=
c(H+)-c(OH-)≈c(H+)=10-5 mol·L-1,故 c(NH3·H2O)>c(OH-)。
返回
题号 1 2
3
4
1.(2019·河北石家庄调研)漂白粉在溶液中存在下列平衡:ClO-+
A.Na2S
B.Na3PO4
C.Na2CO3
D.AlCl3
【解析】Na3PO4 所含离子种类最多,因它的水解有三级:
PO34-+H2O
HPO24-+OH-
HPO24-+H2O
H2PO- 4 +OH-
H2PO- 4 +H2O
H3PO4+OH-
再加水的电离 H2O
H++OH-,所以磷酸钠溶液中,除 Na+外还有
(2)①由 NH4Cl===NH+ 4 +Cl-及 NH+ 4 +H2O NH3·H2O+H+知
c(Cl-)>c(NH+ 4 );②由于 NH+ 4 水解程度较小,因此有 c(NH4+)>c(H+);
③由 NH4++H2O
NH3·H2O+H+,H2O
H++OH-知
c(H+)>c(NH3·H2O)。
④由 NH4++H2O NH3·H2O+H+,H2O H++OH-,由于 pH=
返回
题号 1 2
3
4
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变
浅,则下列叙述正确的是________(填字母)。
A.水解反应为放热反应
B.水解反应为吸热反应
C.NH4NO3 溶于水时放出热量 D.NH4NO3 溶于水时吸收热量 (3)向 0.01 mol·L-1 CH3COONa 溶液中分别加入 NaOH 固体、 Na2CO3 固体、FeSO4 固体,使 CH3COO-水解平衡移动的方向分 别为______、______、_____ (填“左”“右”或“不移动”)。
(通用版)高考化学一轮复习-第八章 水溶液中的离子平衡 第27讲 盐类的水解课件

酸性
pH<7
________ _______
盐的 类型
实例
是否
溶液的 溶液的
水解的离子
水解
酸碱性 pH
弱酸 强碱盐
C H3COON
a、
__是___
_CC___HO___233__-C___O___O____-__、___碱__性__ __p_H_>__7_
Na2CO3
5.水解离子方程式的书写
(1)书写盐类水解方程式一般要用“ ” 号连接,产物 不标“↑”或“↓”,其一般形式为:弱离子+水
(4)Na2CO3 溶液显碱性的原因:CO23-+2H2O +2OH-。( × )
H2CO3
(5)向 AlCl3 溶液中滴加 NaHCO3溶液,有沉淀和气体生成。
( √) (6)常温下,由 0.1 mol·L-1HA 溶液的 pH=3,可推知 NaA
溶液中存在 A-+H2O
HA+OH-。( √ )
第八章 水溶液中的离子平衡
第27讲 盐类的水解
第八章 水溶液中的离子平衡
[考纲要求] 1.了解盐类水解的原理及其一般规律。 2. 了解影响盐类水解程度的主要因素。 3.掌握水解离子方 程式的书写。 4.了解盐类水解的应用。
考点一 盐类的水解及其规律
1.定义 在溶液中盐电离出来的离子跟水电离产生的 H+或 OH-结 合生成__弱__电__解__质___的反应。
(4)将 NaHCO3 溶液与 AlCl3 溶液混合 __A_l_3+_+__3_H__C_O__-3_=_=_=_A_l_(_O_H__)3_↓__+__3_C_O__2↑________________。
(5)实验室制备 Fe(OH)3 胶体 ___F_e_3+_+__3_H__2_O_=_=_△=_=_=_F_e_(_O_H__)_3(_胶__体__)_+__3_H_+_____________。
2019届高考化学总复习第8章水溶液中的离子平衡第3讲盐类的水解8.3.1盐类的水解及其规律考点课件新人教版

考(题20探15源·北京源理于综教,材11BR改J选编修) 4 P55“思考与交流”及其拓展 考查视角 盐溶液的酸碱性及水解方程式的书写 高考启示 理解盐类水解的原理、实质、规律,准确书写水解方程式
二、典例剖析
4.25 ℃时,浓度均为0.1 mol·L-1的溶液,其pH如下表所示。有关说
法正确的是( C )
盐类的水解及其规律
01 教材 高考 02 典例剖析 03 反思归纳 04 拓展提升
一、教材 高考
3.(溯源题)判断下列说法是否正确 (1)取 20.00 mL 盐酸的方法:在 50 mL 酸式滴定管中装入盐酸,调整初始读为 30.00
mL 后,将剩余盐酸放入锥形瓶( )(2017·课标全国Ⅲ,9A 改编) 大于20ml
四、拓展提升
同浓度的 Na2CO3、NaHCO3 ② Na2CO3 溶液中 c(CO23-) > c(HCO- 3 ) ②NaHCO3 溶液中 c(CO32-)< c(H2CO3) ③将二者混合,混合液中 c(CO32-) < c(HCO- 3 )
3.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程 度的相对大小。 (1)若电离程度小于水解程度,溶液呈碱性。如 NaHCO3 溶液中: HCO3- H++CO23-(次要),HCO3-+H2O H2CO3+OH-(主要)。 (2)若电离程度大于水解程度,溶液显酸性。如 NaHSO3 溶液中:HSO- 3
近年高考化学第8章(水溶液中的离子平衡)第3节盐类的水解考点(2)盐类水解的应用讲与练(含解析)(

2019高考化学第8章(水溶液中的离子平衡)第3节盐类的水解考点(2)盐类水解的应用讲与练(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学第8章(水溶液中的离子平衡)第3节盐类的水解考点(2)盐类水解的应用讲与练(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学第8章(水溶液中的离子平衡)第3节盐类的水解考点(2)盐类水解的应用讲与练(含解析)的全部内容。
第8章(水溶液中的离子平衡)李仕才错误!错误!错误!考点二盐类水解的应用1.下面提到的问题中,与盐的水解有关的是()①明矾和FeCl3可作净水剂②为保存FeCl3溶液,要在溶液中加少量盐酸③实验室配制AlCl3溶液时,应先把它溶在盐酸中,而后加水稀释④NH4Cl与ZnCl2溶液可作焊接中的除锈剂⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂⑦在NH4Cl或AlCl3溶液中加入金属镁会产生氢气⑧长期使用硫酸铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性A.①④⑦B.②⑤⑧C.③⑥⑨D.全部解析:①Al3+和Fe3+水解产生Al(OH)3胶体和Fe(OH)3胶体,吸附水中的悬浮杂质.②加盐酸可抑制FeCl3水解。
③AlCl3溶解在盐酸中可抑制Al3+的水解。
④NH+4和Zn2+水解产生的H+与锈反应.⑤Na2CO3、Na2SiO3溶液水解显碱性,和玻璃中的一氧化硅反应,把玻璃瓶塞和瓶口粘在一起。
【K12教育学习资料】2019高考化学总复习第八章水溶液中的离子平衡8—3—1考点一盐类的水解及规律

8-3-1 考点一盐类的水解及规律一、盐类水解实质及水解离子方程式的书写1.在盐类发生水解的过程中,正确的说法是( )A.盐的电离平衡被破坏B.水的电离程度逐渐增大C.溶液的pH发生了较大改变D.水解后溶液一定呈酸性或碱性解析:盐类水解是盐电离出的某些离子结合水所电离出的H+或OH-,破坏了水的电离平衡,促进了水的电离,A错误,B正确;但水解程度是微弱的,故pH改变不大,C错误;醋酸铵水解后,溶液仍呈中性,D错误。
答案:B2.下列反应不属于水解反应或水解方程式不正确的是( )①HCl+H23O++Cl-②AlCl3+3H2O===Al(OH)3+3HCl③Na2CO3+2H2O H2CO3+2NaOH④碳酸氢钠溶液:HCO-3+H2O CO2-3+H3O+⑤NH4Cl溶于D2O中:NH+4+D2O NH3·D2O+H+⑥HS-的水解:HS-+H2O S2-+H3O+⑦将饱和FeCl3溶液滴入沸腾的水中:FeCl3+3H2OFe(OH)3(胶体)+3HClA.①②③④ B.①②③C.②③⑤⑥⑦ D.全部解析:①④⑥是电离方程式且①应用“===”;②是水解反应方程式,但应用;③的水解方程式错误,应分步进行;⑤应为NH+4+D23·HDO+D+;⑦应用“===”。
答案:D二、盐类水解的影响因素3.在一定条件下,Na2S溶液中存在水解平衡:S2-+H2-+OH-。
下列说法正确的是( )A.稀释溶液,水解平衡常数增大B.通入H2S,HS-浓度减小C .升高温度,c HS -c S 2-增大D .加入NaOH 固体,溶液pH 减小解析:水解平衡常数只与温度有关,因此稀释溶液,水解平衡常数不变,A 项错误;通入H 2S ,HS -浓度增大,B 项错误;升高温度,水解平衡向右移动,溶液中c (HS -)增大、c (S2-)减小,故c HS -c S 2-增大,C 项正确;加入NaOH 固体,溶液碱性增强,pH 增大,D 项错误。
2019高考化学 第8章(水溶液中的离子平衡)第3节 盐类的水解 考点(1)盐类的水解及规律讲与练(含解析)
第8章(水溶液中的离子平衡)李仕才第三节盐类的水解考点一盐类的水解及规律1.盐类水解及其规律2.表示方法——水解离子方程式(1)一般来说,盐类水解的程度很微弱,应该用可逆号“”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如Cu2++2H2O Cu(OH)2+2H+;NH+4+H2ONH3·H2O+H+。
若水解程度较大,书写时要用“===”“↑”或“↓”,主要有:Al3+与HCO-3、CO2-3、HS-、S2-、AlO-2等发生相互促进的水解反应,Fe3+与HCO-3、CO2-3、SiO2-3、AlO-2等发生相互促进的水解反应。
如NaHCO3溶液与AlCl3溶液混合的离子方程式为3HCO-3+Al3+===Al(OH)3↓+3CO2↑。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
如Na2CO3水解的离子方程式为CO2-3+H2O HCO-3+OH-(主要)、HCO-3+H2O H2CO3+OH-(次要);不能写成CO2-3+2H2O H2CO3+2OH-。
(3)多元弱碱阳离子的水解简化成一步完成,如FeCl3水解:Fe3++3H2O Fe(OH)3+3H +。
总之,水解离子方程式的书写规律为:谁弱写谁,都弱都写;阳离子水解生成弱碱,阴离子水解生成弱酸。
3.影响盐类水解的因素(1)内因:生成的弱酸或弱碱越弱,其对应的弱酸根离子或弱碱阳离子的水解程度越大,溶液的碱性或酸性越强。
(2)外因:例如:对于NH+4+H2O NH3·H2O+H+判断正误(正确的打“√”,错误的打“×”)1.溶液呈中性的盐一定是强酸、强碱生成的盐。
( × ) 2.含有弱酸根盐的水溶液一定呈碱性。
( × )3.盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱。
( √ ) 4.某盐的溶液呈酸性,该盐一定发生了水解反应。
( × )5.将0.1 mol 氯化铁溶于1 L 水中,所得溶液含Fe 3+数为0.1N A 。
2019高考化学一轮复习第八单元水溶液中的离子平衡8.3盐类的水解课件

考点一
考点二
考点三
-8-
基础梳理 考点突破
自主巩固
有下列物质的溶液:①NaCl ②K2CO3 ③CuSO4 ④KNO3 ⑤ NH4Cl ⑥CH3COONa ⑦FeCl3 ⑧Na2S
(1)溶液呈中性的有①④,溶液呈碱性的有②⑥⑧,溶液呈酸性的
有③⑤⑦;
(2)分别写出⑥⑦⑧三种物质水解的离子方程式:
CH3COO-+H2O CH3COOH+OH-, Fe3++3H2O Fe(OH)3+3H+, S2-+H2O HS-+OH-、HS-+H2O H2S+OH-。
。
已知:H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7 HClO Ki1=2.95×10-8 H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11 (2)相同条件下等浓度的碳酸钠溶液的pH
0.1 mol·L-1
NaHCO3溶液的pH,NH4CN溶液显碱性的原因: 方程式进行回答)。
考点一
考点二
考点三
-7-
基础梳理 考点突破
特别提醒(1)判断盐溶液的酸碱性,需先判断盐的类型,因此需熟
练记忆常见的强酸、强碱和弱酸、弱碱。
(2)盐溶液呈中性,无法判断该盐是否水解。例如:NaCl溶液呈中
性,是因为NaCl是强酸强碱盐,不水解。又如CH3COONH4溶液呈中 性,是因为CH3COO-和NH4+的水解程度相当,即水解过程中H+和OH消耗量相等,所以CH3COONH4溶液仍呈中性。
例 1(1)室温下,0.1 mol·L-1 NaClO 溶液的 pH
(选填“大
于”“小于”或“等于”,下同)0.1 mol·L-1 Na2SO3 溶液的 pH。浓度均为
人教版2019高考化学总复习08水溶液中的离子平衡28盐类的水解2含解析
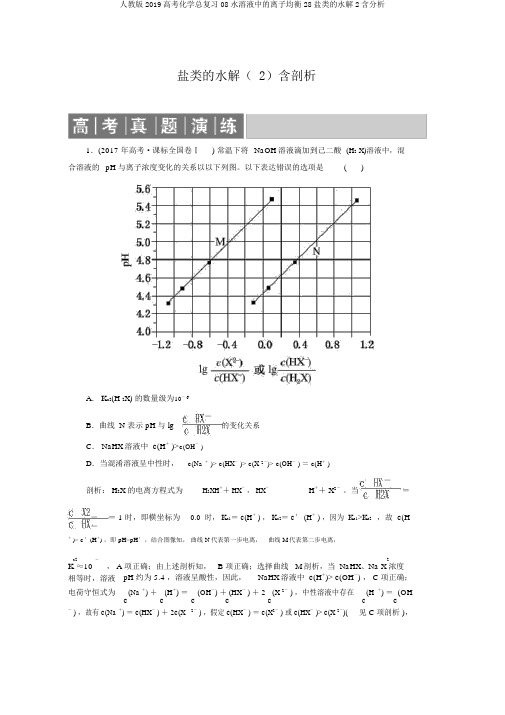
盐类的水解( 2)含剖析1.(2017 年高考·课标全国卷Ⅰ) 常温下将NaOH溶液滴加到己二酸(H2 X)溶液中,混合溶液的pH 与离子浓度变化的关系以以下列图。
以下表达错误的选项是()A.K a2(H 2X) 的数量级为10-6-B.曲线 N 表示 pH 与 lg的变化关系C. NaHX溶液中c(H+ )>c(OH-)D.当混淆溶液呈中性时,c(Na+)> c(HX-)> c(X2-)> c(OH-)= c(H+)剖析: H2X 的电离方程式为H2XH++ HX-, HX-H++ X2-。
当-=-= 1 时,即横坐标为0.0 时,K a1=c(H+ ) ,K a2=c′ (H+ ) ,因为K a1>K a2,故 c(H -+)> c′(H+) ,即 pH<pH′,结合图像知,曲线 N代表第一步电离,曲线 M代表第二步电离,a2-2K ≈10, A 项正确;由上述剖析知, B 项正确;选择曲线 M剖析,当 NaHX、Na X 浓度相等时,溶液pH 约为 5.4 ,溶液呈酸性,因此,NaHX溶液中c(H+)> c(OH-) , C 项正确;电荷守恒式为c (Na +) +c(H+) =c(OH-) + (HX- ) + 2c(X 2- ) ,中性溶液中存在c(H+) =(OHc c- ) ,故有c(Na +) =c(HX- ) + 2c(X2- ) ,假定c(HX- ) =c(X2- ) 或c(HX- )> c(X 2-)(见C项剖析 ),则溶液必然呈酸性,故中性溶液中c(HX-)< c(X2-),D项错误。
答案: D2.(2017年高考·课标全国卷Ⅱ) 改变- 1二元弱酸2mol·L HA 溶液的 pH,溶液中-2-的物质的量分数δ(X) 随 pH的变化以以下列图H2A、HA、 A[ 已知δ(X) =+-+c-] 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐类的水解(2)含解析李仕才1.(2017年高考·课标全国卷Ⅰ)常温下将NaOH 溶液滴加到己二酸(H 2X)溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是( )A .K a2(H 2X)的数量级为10-6B .曲线N 表示pH 与lg c HX -c H 2的变化关系C .NaHX 溶液中c (H +)> c (OH -)D .当混合溶液呈中性时,c (Na +)>c (HX -)>c (X 2-)>c (OH -)=c (H +)解析:H 2X 的电离方程式为H 2++HX -,HX-H ++X 2-。
当c HX -c H 2=c X 2-c HX -=1时,即横坐标为0.0时,K a1=c (H +),K a2=c ′(H +),因为K a1>K a2,故c (H +)>c ′(H +),即pH<pH′,结合图像知,曲线N 代表第一步电离,曲线M 代表第二步电离,K a2≈10-5.4,A 项正确;由上述分析知,B 项正确;选择曲线M 分析,当NaHX 、Na 2X 浓度相等时,溶液pH 约为5.4,溶液呈酸性,所以,NaHX 溶液中c (H +)>c (OH -),C 项正确;电荷守恒式为c (Na +)+c (H +)=c (OH -)+c (HX -)+2c (X 2-),中性溶液中存在c (H +)=c (OH -),故有c (Na +)=c (HX-)+2c (X 2-),假设c (HX -)=c (X 2-)或c (HX -)>c (X 2-)(见C 项分析),则溶液一定呈酸性,故中性溶液中c (HX -)<c (X 2-),D 项错误。
答案:D2.(2017年高考·课标全国卷Ⅱ)改变0.1 mol·L -1二元弱酸H 2A 溶液的pH ,溶液中H 2A 、HA -、A 2-的物质的量分数δ(X)随pH 的变化如图所示[已知 δ(X)=c Xc H 2+c HA +c A]。
下列叙述错误的是( ) A .pH =1.2时, c (H 2A)=c (HA -) B .lg[K 2(H 2A)]=-4.2C .pH =2.7时, c (HA -)>c (H 2A)=c (A 2-) D .pH =4.2时, c (HA -)=c (A 2-)=c (H +)解析:从图像中可以看出pH =1.2时,δ(H 2A)=δ(HA -),则c (H 2A)=c (HA -),A 项正确;根据HA-H ++A 2-,可确定K 2(H 2A)=c H +·c A 2-c HA -,从图像中可以看出pH =4.2时,δ(HA -)=δ(A 2-),则c (HA -)=c (A 2-),即lg[K 2(H 2A)]=lg c (H +)=-4.2,B 项正确;从图像中可以看出pH =2.7时,δ(HA -)>δ(H 2A)=δ(A 2-),则c (HA -)>c (H 2A)=c (A 2-),C 项正确;从图像中可以看出pH =4.2时,δ(HA -)=δ(A 2-),则c (HA -)=c (A 2-)≈0.05 mol·L-1,而c (H +)=10-4.2mol·L -1,D 项错误。
答案:D3.(2017年高考·江苏卷)(双选)常温下,K a (HCOOH)=1.77×10-4,K a (CH 3COOH)=1.75×10-5,K b (NH 3·H 2O)=1.76×10-5,下列说法正确的是( )A .浓度均为0.1 mol·L -1的HCOONa 和NH 4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者B .用相同浓度的NaOH 溶液分别滴定等体积pH 均为3的HCOOH 和CH 3COOH 溶液至终点,消耗NaOH 溶液的体积相等C .0.2 mol·L -1HCOOH 与0.1 mol·L -1NaOH 等体积混合后的溶液中:c (HCOO -)+c (OH-)=c (HCOOH)+c (H +)D.0.2 mol·L-1CH3COONa与0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO -)>c(Cl-)>c(CHc(H+)3COOH)>解析:HCOONa溶液中存在c(Na+)+c(H+)=c(HCOO-)+c(OH-),NH4Cl溶液中存在c(NH+4)+c(H+)=c(Cl-)+c(OH-),两溶液中有c(Na+)=c(Cl-),只要比较HCOONa溶液中c(H+)与NH4Cl溶液中c(OH-)的大小即可,由电离常数可知,NH+4的水解程度比HCOO-的大,则NH4Cl 溶液中c(H+)较HCOONa溶液中c(OH-)大,即NH4Cl溶液中c(OH-)较HCOONa溶液中c(H+)小,所以有c(Na+)+c(H+)>c(Cl-)+c(OH-)=c(NH+4)+c(H+),A项正确;CH3COOH的电离平衡常数比HCOOH的小,即CH3COOH的酸性弱,则相同pH的CH3COOH溶液的浓度大于HCOOH 的,和NaOH反应时,CH3COOH溶液消耗NaOH溶液的体积较大,B项错误;反应后得到c(HCOOH)与c(HCOONa)相等的混合溶液,溶液呈酸性,由电荷守恒得:c(HCOO-)+c(OH-)=c(Na+)+c(H+),由物料守恒得:2c(Na+)=c(HCOOH)+c(HCOO-),则c(HCOO-)>c(Na+)>c(HCOOH),所以c(HCOO-)+c(OH-)>c(HCOOH)+c(H+),C项错误;反应后得到c(CH3COONa)=c(CH3COOH)=c(NaCl)的混合溶液,由物料守恒得:c(CH3COO-)+c(CH3COOH)=2c(Cl-),pH<7,则CH3COOH 的电离程度大于CH3COO-的水解程度,即c(CH3COO-)>c(Cl-)>c(CH3COOH),电离和水解均很微弱,故c(H+)小于c(CH3COOH),D项正确。
答案:AD4.(2016年高考·江苏卷)(双选)H2C2O4为二元弱酸。
20℃时,配制一组c(H2C2O4)+c(HC2O-4)+c(C2O2-4)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。
下列指定溶液中微粒的物质的量浓度关系一定正确的是( )A.pH=2.5的溶液中:c(H2C2O4)+c(C2O2-4)>c(HC2O-4)B.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O2-4)C.c(HC2O-4)=c(C2O2-4)的溶液中:c(Na+)>0.100 mol·L-1+c(HC2O-4)D.pH=7.0的溶液中:c(Na+)>2c(C2O2-4)解析:在溶液中存在浓度关系:物料守恒:c (H 2C 2O 4)+c (HC 2O -4)+c (C 2O 2-4)=0.1 mol/L 电荷守恒:c (Na +)+c (H +)=c (HC 2O -4)+2c (C 2O 2-4)+c (OH -)A .pH =2.5时,由图像得,c (HC 2O -4)>0.08 mol/L ,因此c (H 2C 2O 4)+c (C 2O 2-4)=0.1 mol/L -c (HC 2O -4)<0.02 mol/L<c (HC 2O -4),故A 错误;B .c (Na +)=0.1 mol/L 时有:c (Na +)=c (H 2C 2O 4)+c (HC 2O -4)+c (C 2O 2-4)=0.1 mol/L ,代入c (Na +)+c (H +)=c (HC 2O -4)+2c (C 2O 2-4)+c (OH -)后可得:c (C 2O 2-4)+c (OH -)=c (H 2C 2O 4)+c (H +),故B 正确;C .c (HC 2O -4)=c (C 2O 2-4)时,由图像得c (H 2C 2O 4)=0 mol/L ;所以有c (HC 2O -4)=c (C 2O 2-4)=0.05 mol/L ,由电荷守恒c (Na +)+c (H +)=c (HC 2O -4)+2c (C 2O 2-4)+c (OH -)得:c (Na +)=c (HC 2O -4)+2c (C 2O 2-4)+c (OH -)-c (H +)=0.15 mol/L +c (OH -)-c (H +),此时pH<7,c (OH -)<c (H +),因此有:c (Na +)=0.15 mol/L +c (OH -)-c (H +)<0.15 mol/L ,又因为c (HC 2O -4)=c (C 2O 2-4)=0.05 mol/L ,所以有:c (Na +)<0.15 mol/L =0.1 mol/L +c (HC 2O -4),故C 错误;D .pH =7的溶液中溶质为草酸钠,草酸根离子水解减少,则c (Na +)>2c (C 2O 2-4),故D 正确。
答案:BD5.(2016年高考·四川卷)向1 L 含0.01 mol NaAlO 2和0.02 mol NaOH 的溶液中缓慢通入CO 2,随n (CO 2)增大,先后发生三个不同的反应,当0.01 mol <n (CO 2)≤0.015 mol 时发生的反应是2NaAlO 2+CO 2+3H 2O,2Al(OH)3↓+Na 2CO 3。
下列对应关系正确的是( )22的反应为NaOH 和CO 2反应生成Na 2CO 3和H 2O,0.02 mol NaOH 消耗0.01 mol CO 2,生成0.01 mol Na 2CO 3;然后NaAlO 2和CO 2反应生成Al(OH)3和Na 2CO 3,0.01 mol NaAlO 2消耗0.005 mol CO 2,生成0.005 mol Na 2CO 3;再通入CO 2,CO 2和Na 2CO 3反应生成NaHCO 3,消耗0.015 mol CO 2,生成0.03 mol NaHCO 3。
A 项,未通入CO 2时,根据溶液中的电荷守恒有c (Na +)+c (H +)=c (AlO -2)+c (OH -) ,c (Na +) <c (AlO -2)+c (OH -),故错误;B 项,当通入CO 2为0.01 mol 时,则溶液为含有0.01 mol Na 2CO 3和0.01 mol NaAlO 2 的混合液,c (OH -) < c (CO 2-3),故错误;C 项,当通入CO 2为0.015 mol 时,溶液中含有0.015 mol Na 2CO 3,离子浓度的关系为c (Na +) >c (CO 2-3)>c (OH -)>c (HCO -3) ,故错误;D 项,当通入CO 2为0.03mol 时,溶液为NaHCO 3溶液,溶液显碱性,离子浓度的关系为c (Na +)>c (HCO -3)>c (OH -)>c (H +),故正确。
