S区元素在周期表中的位置
元素周期表分组

元素周期表分组元素周期表是一张按照元素的原子序数、电子结构和化学性质等规律排列的表格。
它通过将元素分为不同的分组,使得我们能够更好地理解和研究元素的性质。
本文将探讨元素周期表中的分组以及它们的特点和意义。
第一分组:碱金属碱金属是元素周期表中位于第一列的元素,包括氢(H)、锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素的共同特点是在化学反应中容易失去一个电子,形成+1价阳离子。
碱金属具有低密度、低熔点和较强的金属活性。
它们与水反应会放出氢气,并且在氧气中燃烧。
第二分组:碱土金属碱土金属是元素周期表中位于第二列的元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
这些元素的共同特点是它们容易失去两个电子,形成+2价阳离子。
碱土金属具有较高的熔点和较低的密度。
它们与水反应不像碱金属那样剧烈,但在氧气中也会燃烧。
第三至第十二分组:过渡金属第三至第十二分组是元素周期表中的过渡金属。
这些元素位于主族元素之间,具有特殊的化学性质。
过渡金属包括钛(Ti)、铬(Cr)、铁(Fe)、铜(Cu)等。
它们的特点是具有可变的氧化态和复杂的配位化合物形成能力。
过渡金属在催化剂、合金制备和生物系统等方面都具有重要的应用价值。
第十三至第十八分组:主族元素第十三至第十八分组是元素周期表中的主族元素。
它们包括硼(B)、硅(Si)、碳(C)等。
主族元素的特点是它们的电子结构包含着完整的s或p电子壳层。
除了碳、硅和锗可以形成共价键外,其他主族元素倾向于失去或获得电子,形成相应的离子。
内过渡金属:f-区在元素周期表的底部,是一系列的内过渡金属,也被称为f-区元素。
这些元素包括镧系和锕系元素,它们的最外层电子是f电子。
内过渡金属具有丰富的氧化态和磁性,并广泛应用于核能、光学材料和催化剂等领域。
总结元素周期表的分组方式使得我们可以更好地理解元素的性质和规律。
不同分组的元素具有各自独特的特点和反应性质。
化学元素周期表解读

化学元素周期表解读化学元素周期表是化学家们整理归纳出来的一种系统性的工具,用于描述和分类所有已知的化学元素。
它是化学研究中至关重要的一部分,可以帮助我们深入了解元素的性质和特征。
本文将对元素周期表进行解读,介绍其构成和组织方式,以及对元素周期表中各个区块的解释和含义。
一、元素周期表的构成和组织方式元素周期表由一系列化学元素按照一定的规则排列而成。
每个元素由其原子序数和原子量唯一标识,并提供了元素的名称和符号。
元素周期表通常由横行称为周期和纵列称为族的区块组成。
元素周期表的构成主要分为两部分:长周期表和短周期表。
长周期表中总共有18个纵列,可以分为s、p、d和f四个区块,其中s和p区块被称为主体元素,d和f区块被称为过渡元素。
短周期表则只包括前两个主体元素区块。
二、周期表中的区块解释1. 主体元素区块(s和p区块)主体元素区块是元素周期表中最为常见的区块,包含了大部分元素。
其中,s区块位于周期表左侧,包含有一至两个电子的元素,例如氢和锂。
p区块位于s区块右侧,包含了三至八个电子的元素,例如氧和氟。
主体元素区块中的元素通常具有明显的化学性质差异,有利于化学反应的分类和理解。
2. 过渡元素区块(d和f区块)过渡元素区块包含了d和f区块,这些区块中的元素通常具有复杂的化学性质。
d区块位于主体元素区块的右侧,包含了一至十个电子的元素,例如铁和铜。
f区块位于d区块的下方,包含了十四个电子的元素,例如镧系和锕系元素。
过渡元素区块中的元素常常具有多种氧化态和配位数,广泛应用于催化剂、合金和电池等领域。
3. 稀有气体区块稀有气体区块位于元素周期表的最右侧,包含了氦、氖、氩、氪、氙和氡这六个元素。
这些元素具有非常稳定的电子配置,很少参与化学反应,因此被称为稀有气体。
4. 超重原子区块超重原子区块是元素周期表中放在底部的两行,由于这些元素的核外电子结构尚不完全了解,所以被放在较晚的位置。
这其中包括了人造元素和放射性元素,如镆、鈽和锔等。
元素周期表的主族元素

元素周期表的主族元素
主族元素是化学上对元素的一种分类,是指周期表中s区及p区的元素。
主族元素另外一种定义是除了最外层电子层以外的电子层的电子数都是满电子的化学元素。
周期表中除了过渡金属、镧系元素、锕系元素、惰性气体之外的都是主族元素。
第一主族:氢锂钠钾铷铯钫
第二主族:铍镁钙锶钡镭
第三主族:硼铝镓铟铊
第四主族:碳硅锗(zhě)锡铅
第五主族:氮磷砷锑(tī)铋(bì)
第六主族:氧硫硒碲(dì)钋(pō)
第七主族:氟氯溴碘砹
元素周期表上的0族元素属于稀有气体(惰性气体)。
在常温常压下,它们都是无色无味的单原子气体,很难进行化学反应。
稀有气体共有七种,它们是氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、氡(Rn,放射性)、气奥(Og,放射性,人造元素)。
化学元素周期表元素位置推断:
1. 元素周期数等于核外电子层数;
2. 主族元素的序数等于最外层电子数;
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
元素的
最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
核电荷数=质子数=核外电子数=原子序数
相对原子质量≈质子数+中子数(不可作为公式)。
s区和ds区元素

密度d:0.089 g/L
NaH(s) + H2O(l) → NaOH(aq) + H2(g)
H2 from ?
天 然 气
• (a) CH4(g) + H2O(g) → CO(g) +3H2(g) – Ni catalyst (synthesis gas合成气) • (b) CO(g) + H2O(g) → CO2(g) + H2(g)
2M(s) + 2H2O(l) → 2MOH(aq) + H2(g)
Li
Na
K
M-O-H 是一般氧化物的水化物的键联形式, 究竟是酸 式还是碱式解离, 取决于M 的电场. M 的电场强, 吸引氧的负电荷, 从而加强 M-O 键, 同时 削弱了 O-H 键, 易酸式电离: M——O—|—H M 的电场弱, 吸引氧的负电荷能力差, 而相对而言, O 对 H 的吸引增强, 结果是碱式电离: M—|—O——H 可用离子势φ来表征M的电场强弱:
Ca + H2O
The 1st and 2nd 电离能
Be shows a hint of nonmetallic character, but the other elements are all typical metals. The vigor of reaction (反应活性) with water and oxygen increase down the group. 两性的
体心立方
Li – Cs, Ba = Fe
bcc
面心立方 立方密堆
Ca, Sr
ccp
六方密堆
Be, Mg
hcp
Melting points A Na-K alloy is a liquid at RT
第九章s区元素

碱金属含氧酸盐:一般热稳定性高,除碳酸氢盐、 硝酸盐。
碱土金属含氧酸盐:热稳定性低,并且随半径增大, 分解温度升高。
BeCO3 MgCO3 CaCO3 SrCO3 B分解温度
升高
含氧酸盐热稳定性变化规律可用离子极化来解释:
以碳酸盐(MCO3)为例:CO32-为平面三角形,C4+ 对三个O2-产生极化,M2+与其接近时,对邻近的一个 O2-也产生极化作用,该极化与C4+对O2-的极化作用方 向相反,称为反极化。
正常氧化物 MO(M=Be,Mg,Ca,Sr,Ba)
2.与H2反应
除Be,Mg,在高温下均与氢化合,生成离子
型氢化物。 2Na+H2 = 2NaH
Ca+H2 = CaH2
离子型氢化物与水反应,放出H2
NaH + H2O = NaOH + H2
离子型氢化物是强还原剂
TiCl4+4NaH 高温 Ti + 4NaCl +2H2
锂与水反应速率慢的主要原因有:(1)反应产物 LiOH溶解度较小,阻碍反应进行,(2)锂的熔点高, 反应产生的热量不能使其熔化。铍、镁与冷水作用 很慢,也是因为产物在水中溶解度小。
9.3 氧化物和氢氧化物
9.3.1 氧化物 9.3.2 氢氧化物
9.3.1 氧化物
1.正常氧化物
锂和碱土金属在空气中燃烧,得到正常氧化物。
2、都能与N2直接化合生成氮化物(Li3N, Mg3N2),其 他碱金属不与N2直接化合。 • 3、氟化物、碳酸盐、磷酸盐均难溶于水。其它碱金 属相应盐均为易溶盐。
4、氢氧化物均为中强碱,在水中溶解度不大,加热 易分解为氧化物,其它碱金属氢氧化物均为强碱, 不分解。
S区元素

混合盐密度增大,液Na浮在熔盐表面,
易于收集
金属钾能否采用类似制钠的方法制备呢?
不能采用同类方法,其原因是: (1)金属 K 与 C 电极可生成羰基化合物 (2)金属 K 易溶在熔盐中,难于分离 (3)金属 K 蒸气易从电解槽逸出造成爆炸
N2K合金 (或K)蒸气
Na N2
排泄阱 NaCl 渣 热
热
1. 燃烧反应的△G负值大小决定。Na生成Na2O、
Na2O2 和 NaO2的△G分别是 ―376 kJ·mol-1,
― 430 kJ·mol-1和― 389.2 kJ·mol-1, 因此燃烧产 物就是 Na2O2 。 2. △G 的大小由 rGm rHm TrSm 决定。 其中 △G的大小主要由 rHm来决定。rHm 则要由玻 恩-哈伯循环来决定。
二、氧化物
正常氧化物(O2-):1s2 2s2 2p6
过氧化物(O22-):
“能KK量(σ效2s )应2 (σ”*2要s )2求(σ 2体p )2积(π较2p )大4 (π的*2过p )4氧 离超子氧、化超物(氧O2离-) 子和臭氧离子更易被较 大的金K属K(阳σ 2s离)2 (子σ *所2s )2稳(σ定2p )。2 (π 2p )4 (π *2p )3
类型
在空气中 直接形成
间接形成
正常氧化物
Li、Be、Mg Ca、Sr、Ba
ⅠA、ⅡA族 所有元素
过氧化物
Na
除Li Be外的 所有元素
超氧化物
Na、K、 除Be、Mg、 Rb、Cs Li外所有元素
Na2O2 + 2Na 2Na2O 2KNO3 +10K 6K2O + N2
过氧化物和超氧化物 1. 在碱性介质中是强氧化剂,常用作 熔矿剂。 例 2Fe(CrO2)2+7Na2O2 →
元素在周期表中位置的判断

元素在周期表中位置的判断元素在周期表中位置的判断,是一个考点,掌握方法,解题非常快捷。
1.根据原子结构示意图判断此法适用于主族元素。
电子层数对应周期数,最外层电子数对应主族序数。
例:判断Cl元素的位置:Cl的原子结构示意图为根据电子层数对应周期数,此元素在第三周期,根据最外层电子数对应主族序数,此元素在第ⅦA族,即此元素在第三周期第ⅦA族。
2.根据原子序数判断元素周期表中,按原子序数依次增大,编排成18列,7行。
18列,共16族,自左向右对应顺序如下:7行,共七个周期,自上向下对应顺序如下:例:原子序数为39的元素:39在36与54之间,所以此元素在第五周期。
39与36接近,36对应18列,则37对应1列,以此类推,39对应3列,即第ⅢB族。
即此元素在第五周期第ⅢB族。
注:(1)第六周期中,镧系57-71号只占据第ⅢB族一个位置,所以72-86号之间的元素须先减去14,然后再对应列。
(2)第七周期中,锕系89-103号只占据第ⅢB族一个位置,所以103号以上的元素须先减去14,然后再对应列。
3.根据原子电子排布式判断:元素周期表根据价电子特征分成5个区:根据价电子先判断区,无论哪一区,价电子中的n值对应周期。
S区中,价电子数对应主族序数。
d区中,价电子数对应副族序数,但价电子数为8,9,10的在第Ⅷ族。
ds 区中,价电子的s上的电子数对应副族序数。
P区中,价电子数对应主族序数,但价电子数为8的在0族。
f区包括镧系和锕系,都在第ⅢB族,只需根据价电子的n值判断周期即可。
例:价电子为5d66s2的元素在周期表中的位置?根据价电子,首先可判断在d区,则价电子对应副族序数,价电子数为4,在第ⅣB族。
再根据n值为6,所以在第六周期,即此元素在第六周期第ⅣB 族。
类题训练:根据所给信息,判断元素在周期表中的位置(1)判断C元素的位置(2)判断90号元素的位置(3)判断价电子为3d104s1元素的位置答案:(1)C元素的位置:第二周期第ⅣA族。
元素周期表口诀歌

元素周期表口诀歌元素周期表口诀歌元素周期表是学习化学必须掌握的一个知识点,接下来店铺搜集了元素周期表口诀歌,仅供大家参考,希望帮助到大家。
元素周期表口诀歌我是氢,我最轻,火箭靠我运卫星;我是氦,我无赖,得失电子我最菜;我是锂,密度低,遇水遇酸把泡起;我是铍,耍赖皮,虽是金属难电离;我是硼,有点红,论起电子我很穷;我是碳,反应慢,既能成链又成环;我是氮,我阻燃,加氢可以合成氨;我是氧,不用想,离开我就憋得慌;我是氟,最恶毒,抢个电子就满足;我是氖,也不赖,通电红光放出来;我是钠,脾气大,遇酸遇水就火大;我是镁,最爱美,摄影烟花放光辉;我是铝,常温里,浓硫酸里把澡洗;我是硅,色黑灰,信息元件把我堆;我是磷,害人精,剧毒列表有我名;我是硫,来历久,沉淀金属最拿手;我是氯,色黄绿,金属电子我抢去;我是氩,活性差,霓虹紫光我来发;我是钾,把火加,超氧化物来当家;我是钙,身体爱,骨头牙齿我都在;我是钛,过渡来,航天飞机我来盖;我是铬,正六铬,酒精过来变绿色;我是锰,价态多,七氧化物爆炸猛;我是铁,用途广,不锈钢喊我叫爷;我是铜,色紫红,投入硝酸气棕红;我是砷,颜色深,三价元素夺你魂;我是溴,挥发臭,液态非金我来秀;我是铷,碱金属,沾水烟花钾不如;我是碘,升华烟,遇到淀粉蓝点点;我是铯,金黄色,入水爆炸容器破;我是钨,高温度,其他金属早呜呼;我是金,很稳定,扔进王水影无形;我是汞,有剧毒,液态金属我为独;我是铀,浓缩后,造原子弹我最牛;我是镓,易融化,沸点很高难蒸发;我是铟,软如金,轻微放射宜小心;我是铊,能脱发,投毒出名看清华;我是锗,可晶格,红外窗口能当壳;我是硒,补人体,口服液里有玄机;我是铅,能储电,子弹头里也出现。
元素周期表相关记忆技巧1、化合价实质之歌化合价实质要记准,金正非负单质零;氢一氧二应记住,正负总价和为零;许多元素有变价,条件不同价不同。
注:“金正”指金属的化合价通常显正价:“非负”指非金属的化合价通常显负价。
原子结构和该元素在周期表中位置的关系.

原子结构与元素在周期 表中位置的关系
一、原子结构和周期
周期数 = 最外电子层数
例:Na
1s22s22p63s1
第三周期
二、原子结构和族
主族,ⅠB ,ⅡB 例:Na 族数=最外层电子数 1s22s22p63s1 ⅠA
Ⅲ B ~ Ⅶ B 例:Ti Ⅷ (包括三列) 例:Fe 零族 例:Ne
(一)s 区元素:最后一个电子填充在s轨道上的元素 (二)p 区元素: 最后一个电子填充在p轨道上的元素 (三)d 区元素:最后一个电子填充在d轨道上的元素
(四)ds 区元素: 最后一个电子填充在d轨道上的元素
(五)f 区 元素:最后一个电子填充在f轨道上的元素
谢
制作人:
谢
陈先玉
族数 = 最外层电子数 + (n-1)d电子数 ⅣB (n-1)d6~8 ns2 Ⅷ
3d24s2
3d64s2
ns2np6
2s22p6 0
三、原子结构和元素的分区
ห้องสมุดไป่ตู้ns1~2
(n-1)d1~8 ns2
(n-1)d10 ns1~2
ns2np1~6
(n-2)f 1~14 ns 2
三、原子结构和元素的分区
化学元素周期表112个速记(注音、谐音口诀法)高中必备

化学元素周期表112个速记(注音、谐音口诀法)高中必备化学元素周期表速读速记(本图可放大)中文谐音第一周期氢H氦He ----侵害第二周期锂Li铍Be硼B碳C氮N氧O氟F氖Ne ----鲤皮捧碳蛋养福奶第三周期钠Na镁Mg铝Al硅Si磷S硫P氯Cl氩Ar ----那美女桂林留绿牙(那美女鬼流露绿牙)第四周期钾K钙Ca钪钛钒铬锰----嫁改XXX反革命铁钴镍铜锌镓锗----铁姑捏痛新嫁者砷硒溴氪----生气休克第五周期铷锶钇锆铌----如此一告你XXX----不得了铑钯银镉铟锡锑----老把银哥印西堤碲碘氙----地点仙第六周期铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇----但(见)乌(鸦)(引)来鹅铱铂金汞砣铅----一白巾供它牵铋钋砹氡----必不爱冬(天)第七周期钫镭锕----很简朴了~就是----防雷啊!汉语拼音第一周期元素1氢(qīng) 2氦(hài)元素周期表正确金属汉字写法第二周期元素3锂(lǐ) 4铍(pí) 5硼(péng) 6碳(tàn) 7氮(dàn) 8氧(yǎng) 9氟(fú) 10氖(nǎi)tàn第三周期元素11钠(nà) 12镁(měi) 13铝(lǚ) 14硅(guī) 15磷(lín) 16硫(liú) 17氯(lǜ) 18氩(yà)第四周期元素19钾(jiǎ) 20钙(gài) 21钪(kàng) 22钛(tài) 23钒(fán) 24铬(gè) 25锰(měng) 26铁(tiě) 27钴(gǔ) 28镍(niè)29铜(tóng) 30锌(xīn) 31镓(jiā) 32锗(zhě) 33砷(shēn) 34硒(xī) 35溴(xiù) 36氪(kè)第五周期元素37铷(rú) 38锶(sī) 39钇(yǐ) 40锆(gào) 41铌(ní) 42钼(mù) 43锝(dé) 44钌(liǎo) 45铑(lǎo) 46钯(bǎ) 47银(yín) 48镉(gé) 49铟(yīn) 50锡(xī) 51锑(tī) 52碲(dì) 53碘(diǎn) 54氙(xiān)第六周期元素55铯(sè) 56钡(bèi) 57镧(lán) 58铈(shì) 59镨(pǔ) 60钕(nǚ) 61钷(pǒ) 62钐(shān) 63铕(yǒu) 64钆(gá) 65铽(tè) 66镝(dī) 67钬(huǒ) 68铒(ěr) 69铥(diū) 70镱(yì) 71镥(lǔ) 72铪(hā) 73钽(tǎn) 74钨(wū) 75铼(lái) 76锇(é) 77铱(yī)78铂(bó) 79金(jīn) 80汞(gǒng) 81铊(tā) 82铅(qiān) 83铋(bì) 84钋(pō) 85砹(ài) 86氡(dōng)第七周期元素87钫(fāng) 88镭(léi) 89锕(ā) 90钍(tǔ) 91镤(pú) 92铀(yóu) 93镎(ná) 94钚(bù) 95镅(méi) 96锔(jú) 97锫(péi) 98锎(kāi) 99锿(āi) 100镄(fèi) 101钔(mén) 102锘(nuò) 103铹(láo) 104鑪(lú) 105 (dù) 106 (xǐ) 107 (bō) 108 (hēi) 109䥑(mài) 110鐽(dá) 111錀(lún) 112 (仍未有中文名)元素周期表表格申明周期表的编排表现出分歧元素的化学性子的周期性,在周期表中,元素按原子序(即原子核内的质子数量递增序次布列,并分为多少列和栏,在统一行中的称为统一周期,按照量子力学,周期对应着元素原子的电子排布,表现出该原子的已装填电子层数量。
《s区和p区元素》课件

欢迎来到《S区和P区元素》PPT课件!在本节中,我们将探索元素周期表中的 S区和P区元素,素
元素周期表中分为S区和P区两个区域,S区元素包含具有特殊电子结构的元素,而P区元素则包含一般元素。
S区元素的特点
S区元素具有特殊的电子结构,导致其在物理和化学性质上有独特的表现。
P区元素的特点
P区元素的电子结构与S区元素不同,因此它们在物理和化学性质上与S区元素 有所不同。
S区元素的分类
S区元素可以进一步分为碱金属元素、碱土金属元素、过渡金属元素和内过渡 金属元素。
P区元素的分类
P区元素包括典型非金属元素、金属loid元素和金属元素,它们具有不同的性 质和特点。
应用举例
通过几个具体的例子,我们将探讨S区和P区元素在现实生活中的应用。
总结
通过对S区和P区元素的比较,我们可以更好地理解它们的区别和联系,并分析它们在未来的应用前景。
无机化学s区和p区元素

7.3.4 二氧化硫亚硫酸及其盐
● SO2 的结构(类似臭氧)
S O O O
S O
4 3
SO2为无色有强烈刺激性气味的气体,能和有机色素结 合,是一种漂白剂。 二氧化硫中硫为+4价,可作氧化剂,又可作还原剂,主 要是还原剂。 亚硫酸同样既有氧化性,又有还原性,主要是还原性。 亚硫酸钠:常用作还原剂,抗氧剂 2Na2SO3+O2→2Na2SO4
上页 下页 目录 返回
NH3的性质 ● 加合反应(路易斯碱):氨分子中的孤电子倾向 于和别 的分子或离子配位形成各种氨合物 ● 取代反应:取代反应可从两种不同角度考虑: 一种是 将 NH3 分子看作三元酸,另一种是看作其他化合物中的某 些原子或原子团被氨基或亚氨基所取代 ● 氧化反应: NH3 分子中的 N 原子虽处于最低氧化态 ,但还原性却并非其化学的主要特征 ●弱碱性: 肼、羟氨:它们的氧化值分别为-2,-1
上页 下页 目录 返回
浓硫酸配成稀硫酸时,应将浓硫酸慢慢倒入水中,并不断搅
拌。 冷浓硫酸不与铁、铝等金属作用,这是因为在冷的浓硫酸 中,铁、铝表面生成一层致密的保护膜保护了金属,使之 不与硫酸继续反应,这种现象称为钝化,所以可用铁、铝 制的器皿盛放浓硫酸。 稀硫酸基本无氧化性、吸水性和脱水性。 大多数硫酸盐为无色结晶,易溶于水,但PbSO4,BaSO4, SrSO4和CaSO4微溶于水,其中BaSO4溶 解度最小。
上页 下页 目录 返回
概述
共性: (1) 热稳定性 含氧酸稳定性差,大多只能存在于水溶 液中,至今未制得游离纯酸。 (2) 氧化性 对同一元素不同氧化态而言,低氧化态的 氧化能力强(需要断的Cl-O键少)。 ① 在酸性介质中的氧化性一般都远大于的碱性介质中 的氧化性,说明含氧酸的氧化性强于盐。 ② 许多中间氧化数的物质如XO-、X2, 存在歧化反应 的可能性。 (3)酸性 HClO是很弱的酸,HClO3是强酸,接近于 盐酸和硝酸,HClO4是已知含氧酸中最强的酸。
元素周期表的结构(周期、族、区).

∴是ⅣB 族元素
Ⅷ族:价电子数为8、9、10((n-1)d6~8 ns2 )。
三、原子的外层电子构型和元素的分区
ns1~2
(n-1)d1~8 ns2
(n-1)d10 ns1~2
ns2np1~6
(n-2)f 1~14 ns 2
三、原子的外层电子构型和元素的分区
1. s 区元素 最后一个电子填充在s能级上的元素 元素周期表左侧,包括IA, IIA 结构特点:ns1~2 化学性质:易失电子成离子,活泼金属 2. p 区元素: ⅢA~ⅦA、零族元素 电子构型特点: ns2np1~6
一、周期与能级组
周期的划分和轨道能级组的关系
周期 数 1 2 原子 序数 1~2 3~10 元素 数目 2 8 1s 2s,2p 最高能级组 第一能级组 第二能级组 最大电子 容量 2 8
3
4
11~18
19~
8
18
3s,3p
4s,3d,4p
第三能级组
第四能级组
8
18
5
6 7
37~54
55~86 87~109
18
32 23
5s,4d,5p
6s,4f,4d,6p 7s,5f,5d,7p
第五能级组
第六能级组 第七能级组
18
32 32
元素周期的划分,实质上是按原子结构中能级组数由低到高的 顺序划分的结果
一、周期与能级组
同一周期元素的特点: 电子层数相同,从左到右,最外层电子的填充都是从 ns1开始,到np6结束,即从碱金属开始,到惰性气体结 束。 元素原子的最外电子层数等于该元素所在的周期数,周 期表中每一新周期的出现,相当于一个新的能级组的建 立。
元素周期表
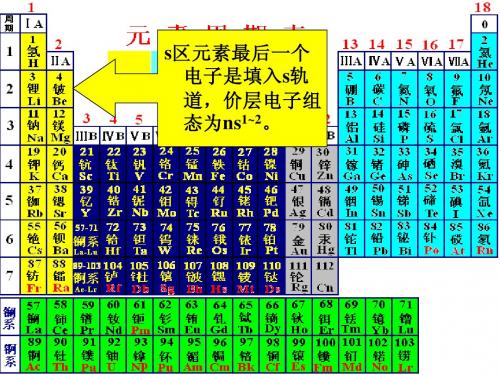
p区元素最后一个 区 电子是填入p轨 电子是填入 轨 道,价层电子组 态ns2np1~6 。
d区元素最后一个电子是填入d轨道来自 区元素最后一个电子是填入 轨道 轨道, 价层电子组态为(n-1)d1~9ns1 ~ 2,只 价层电子组态为 有钯Pd特殊为 特殊为: 有钯 特殊为:(n-1)d10ns0。
ds区元素最后一个电子是填入d 区元素最后一个电子是填入 轨道, 轨道,价层电子组态为 (n-1)d10ns1~2
f区元素最后一个电子是填入f轨 区元素最后一个电子是填入 轨 价层电子组态为: 道,价层电子组态为: (n-2)f1~14(n-1)d0~1ns2,只有钍 只有钍Th 特殊为: 特殊为: (n-2)f0(n-1)d2ns2
元素分区

s区元素蓝色代表s区元素,氦也属于s区元素。
s区元素主要包括元素周期表中IA族元素和IIA族元素,IA族元素包括氢、锂、钠、钾、铷、铯、鍅七种元素,由于钠和钾的氢氧化物是典型的碱,因此除氢外的这六种元素又称碱金属,IIA族元素包括铍、镁、钙、锶、钡、镭六种元素,由于钙,锶,钡的氧化物之性质介于碱金属与稀土元素之间,因此又称碱土金属。
由于氦的电子排布为1s2,故被分为S区元素。
钫和镭都是放射性元素。
锂最重要的矿石是锂辉石(LiAlSi2O6)。
钠主要以氯化钠溶液的形式存在于海洋,盐湖及岩石中。
钾的主要矿物是钾石盐(2KCl·MgCl2·6H2O)。
铍的主要矿物是绿柱石(3BeO·Al2O3·6SiO2)。
镁的主要矿石是菱镁矿(MgCO3)及白云石。
另外,钙,锶,钡则主要以碳酸盐及硫酸盐的形式存在,如方解石(碳酸钙),石膏(二水合硫酸钙),天青石(硫酸锶),重晶石(硫酸钡)。
在本区元素中同一主族从上到下、同一周期从左至右性质的变化都呈现明显的规律性。
p区元素p区元素包括元素周期表中IIIA族元素~VIIIA族元素。
IIIA族元素又称为硼族元素,包括硼、铝、镓、铟、铊等元素;IVA族元素又称作碳族元素,包括碳、硅、锗、锡、铅等元素;VA族元素又称作氮族元素,包括氮、磷、砷、锑、铋等元素;VIA族元素又称为氧族元素,包括氧、硫、硒、碲、钋等元素;VIIA族元素又称卤素,包括氟、氯、溴、碘、砹等元素;VIIIA族元素或0族元素,又称为稀有气体或惰性气体,包括氦、氖、氩、氪、氙、氡等元素。
d区元素d区元素是元素周期表中的副族元素,即第3至第12族元素。
这些元素中具有最高能量的电子是填在d轨道上的。
这些元素有时也被称作过渡金属。
D区的D来自英语的“diffuse”。
ds区元素ds区元素是指元素周期表中的ⅠB、ⅡB两族元素,包括铜、银、金、锌、镉、汞6种自然形成的金属元素和錀、鎶2种人工合成元素。
厦门大学无机化学s区元素

厦门⼤学⽆机化学s区元素第⼋章s区元素8.1 S区元素概述 (1)8.2 S区元素的⼀些规则 (3)8.3 重要单质与化合物 (10)8.4 制备 (18)8.5 S区元素的⽣物作⽤ (20)8.1 S区元素概述8.1.1 碱⾦属S区元素价电⼦构性、氧化还原性及其变化规律S区元素包括周期系中的ⅠA族-碱⾦属和ⅡA族-碱⼟⾦属。
表8-1ⅠA和ⅡA的特征氧化态为+1和+2,但还存在低氧化态,如等。
从标准电极电势(E),均具有较⼤的负值。
⾦属单质都是强的还原剂,如纳、钾、钙等常⽤作化学反应的还原剂。
表8-2 S区元素电极电势由于它们都是活泼的⾦属元素,只能以化合状态存在于⾃然界。
如钠和钾的主要来源分别为熔盐NaCl 、海⽔;天然氯化钾、光卤⽯KCl·MgCl 2·6H 2O 等。
钙和镁主要存在于⽩云⽯、⽅解⽯、菱镁矿、⽯膏等矿物中,锶和钡的矿物有天青⽯和重晶⽯等。
岩盐⽩云⽯菱镁矿重晶⽯8.1.2 碱⼟⾦属2.碱⼟⾦属碱⾦属和碱⼟⾦属元素在化合时,多以形成离⼦键为主要特征。
氢氧化物除具有两性,为中强碱外,其他均是强碱。
【问题1】铍与锂具有⼀定的共价性,为什么?由于锂和铍原⼦半径和离⼦半径⼩,且为2电⼦构型,有效核电荷⼤,极化⼒强,因此它们的化合物,具有⼀定的共价性。
碱⾦属元素的原⼦也可以共价键结合成分⼦,如等碱⾦属单质的双原⼦分⼦就是共价分⼦。
IA 和IIA 族⾦属的⼀些基本性质列于表中。
表8-3 碱⾦属与碱⼟⾦属的基本性质【问题2】为什么ⅡA ⾦属的熔沸点升华热⾼于IA ?ⅡA 离⼦⽔合放热更多?因为ⅡA ⾦属中有两个电⼦参与形成⾦属键,⾦属键较强,所以熔沸点及升华热均⾼于IA 。
ⅡA 离⼦带有两个正电荷,更容易与⽔结合,会放出更多的热量。
8.2 S 区元素的⼀些规则8.2.1 对⾓线规则(1)锂和镁的相似性 S 区元素的⼀些规律1.对⾓线规则第⼆周期元素Li 、Be 、B 的性质和第三周期处于对⾓位置的元素Mg 、Al 、Si ⼀⼀对应,它们的相似性称为对⾓线规则。
