高中物理、化学、生物学科绘图元件
高中生物知识结构网络图

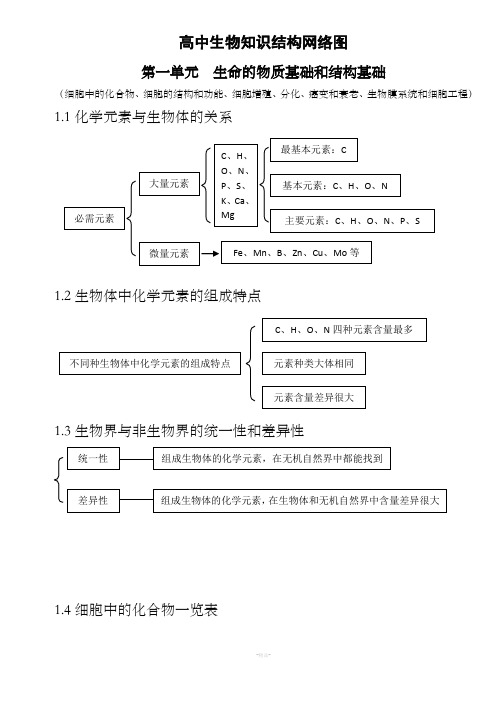
高中生物知识结构网络图第一单元 生命的物质基础和结构基础(细胞中的化合物、细胞的结构和功能、细胞增殖、分化、癌变和衰老、生物膜系统和细胞工程)1.1化学元素与生物体的关系1.2生物体中化学元素的组成特点1.3生物界与非生物界的统一性和差异性1.4细胞中的化合物一览表1.5蛋白质的相关计算设 构成蛋白质的氨基酸个数m ,构成蛋白质的肽链条数为n ,构成蛋白质的氨基酸的平均相对分子质量为a , 蛋白质中的肽键个数为x , 蛋白质的相对分子质量为y ,控制蛋白质的基因的最少碱基对数为r ,则 肽键数=脱去的水分子数,为 n m x -= …………………………………①蛋白质的相对分子质量 x ma y 18-= ………………………………………②或者 x a ry 183-=………………………………………③1.6蛋白质的组成层次1.7核酸的基本组成单位1.8生物大分子的组成特点及多样性的原因1.9生物组织中还原性糖、脂肪、蛋白质和DNA的鉴定1.10选择透过性膜的特点水被选择的离子和小分子其它离子、小分子和大分子1.111.12线粒体和叶绿体共同点1、具有双层膜结构2、进行能量转换3、含遗传物质——DNA4、能独立地控制性状5、内含核糖体6、有相对独立的转录翻译系统7、能自我分裂增殖1.13真核生物细胞器的比较亲脂小分子高浓度——→低浓度 不消耗细胞能量(ATP ) 离子、不亲脂小分子 低浓度——→高浓度 需载体蛋白运载消耗细胞能量(ATP )1.14细胞有丝分裂中核内DNA 、染色体和染色单体变化规律1.15理化因素对细胞周期的影响注:+ 表示有影响1.16细胞分裂异常(或特殊形式分裂)的类型及结果1.17细胞分裂与分化的关系G 21.18已分化细胞的特点1.19分化后形成的不同种类细胞的特点1.20分化与细胞全能性的关系1.21分化程度越低全能性越高,分化程度越高全能性越低分化程度高,全能性也高分化程度最低(尚未分化),全能性最高1.22癌细胞的特点1.23衰老细胞的特点水分减少,细胞萎缩,体积变小,代谢减慢 酶的活性降低色素积累,阻碍细胞内物质交流和信息传递细胞核体积增大,染色体固缩,染色加深 细胞膜通透性改变,物质运输功能降低扁平梭形 球形成纤维细胞癌变如癌细胞膜糖蛋白减少,细胞黏着性降低,易转移扩散。
高中生物知识结构网络图(完整版)
脱氧核 苷
一分子核糖
一分子含氮碱基 (A、G、C、U)
核糖核 苷
1.8 生物大分子的组成特点及多样性的原因
名称 多糖
蛋白质 核酸
基本单位 葡萄糖
氨基酸 核苷酸
化学通式 C6H12O6
R NH2 C COOH
H
-精品-
聚合方式 脱水缩合
多样性的原因 ①葡萄糖数目不同 ②糖链的分支不同 ③化学键的不同 ①氨基酸数目不同 ②氨基酸种类不同 ③氨基酸排列次序不 同 ④肽链的空间结构 ①核苷酸数目不同
分裂方式 有丝分裂 有丝分裂、减数分裂 有丝分裂、减数分裂 有丝分裂 有丝分裂
离子和(或)分子
基本成分 其它成分
蛋白质
1.7 核酸的基本组成单位
名称
核酸
核苷酸(8 种)
DNA
脱氧核苷酸 (4 种)
RNA
核糖核苷酸 (4 种)
基本组成单位 一分子磷酸(H3PO4)
一分子五碳糖 (核糖或脱氧核糖)
一分子含氮碱基 (5 种:A、G、C、T、U)
核苷
一分子磷酸
一分子脱氧核糖
一分子含氮碱基 (A、G、C、T)
②组成细胞(如骨细胞)
③参与化学反应
④维持细胞和内环境的渗透压)
①供能(淀粉、糖元、葡萄糖等)
C、H、O
②组成核酸(核糖、脱氧核糖) ③细胞识别(糖蛋白)
④组成细胞壁(纤维素)
C、H、O C、H、O、N、P C、H、O
①供能(贮备能源) ②组成生物膜 ③调节生殖和代谢(性激素、Vit.D) ④保护和保温
则 肽键数=脱去的水分子数,为 x m n …………………………………①
蛋白质的相对分子质量 y m a18x ………………………………………②
(完整word版)高中化学必修一知识网络结构图.doc
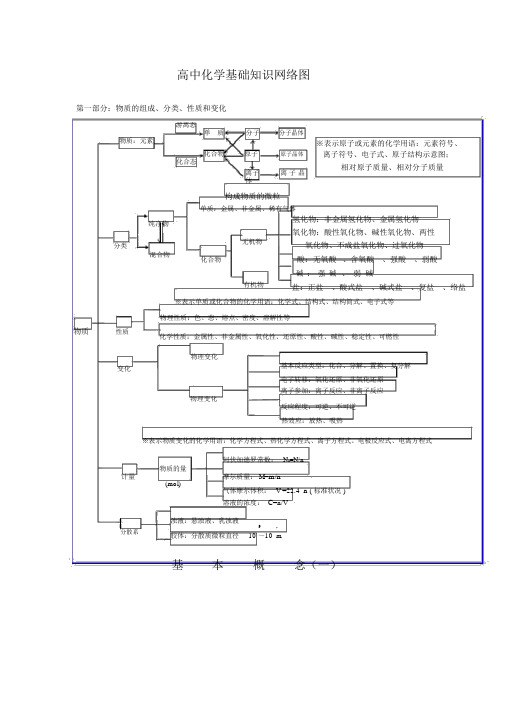
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化游离态分子分子晶体单质物质:元素化合物原子原子晶体化合态离子离子晶体构成物质的微粒单质:金属、非金属、稀有气体※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图;相对原子质量、相对分子质量纯净物氢化物:非金属氢化物、金属氢化物氧化物:酸性氧化物、碱性氧化物、两性分类无机物氧化物、不成盐氧化物、过氧化物混合物化合物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱有机物盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化变化基本反应类型:化合、分解、置换、复分解电子转移:氧化还原、非氧化还原离子参加:离子反应、非离子反应物理变化反应程度:可逆、不可逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式计量分散系阿伏加德罗常数:N A=N/n物质的量摩尔质量: M=m/n(mol)气体摩尔体积:V =22.4 n ( 标准状况 )溶液的浓度: C=n/V浊液:悬浊液、乳浊液-9-7胶体:分散质微粒直径10 ~10 m基本概念(一)色、态、味溶解度、熔点、沸点密度、硬度、导电性导热性、塑性游离态物理性质单质宏观元素金属性、非金属性氧化性、还原性酸性、碱性稳定性、可燃性金属化学性质单质非金属纯净物稀有气体化合物化合态化合物组大多数有机物稀有气体分子晶体分酸子气态及挥发性物质原子晶体原石墨(混合晶体)子微观金属晶体大多数盐强碱离子晶体离碱性氧化物子部分过氧化物性质分类无机物物质氢化物氧化物变化酸碱盐有机物金属氢化物酸性非金属氢化物碱性成盐氧化物两性特殊不成盐氧化物含氧酸、无氧酸强酸、弱酸强碱、弱碱可溶碱、难容碱正盐酸式盐碱式盐复盐;络盐潮解、分馏混合物升华、萃取有机、无机物理变化化学变化化合、分解、置换、复分解风化、干馏氧化还原;非氧化还原溶解、盐析裂化、裂解分子、离子基本概念(二)吸热、放热可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)物质结构分子化分分分子子子学的的间运键形极作成性用动力状共离金(态范价子属极非德特键键键性极华殊分性共离金力性子分)价子属子电化化单影子合合质物物及响云合物金理性晶质体结构简图类型电子式金分原离属子子子晶晶晶晶横:周期体体体体原子核外电子原子核(分排层布)规律最次各能外外层量层层最最不不多低超超容原过过纳理8 18 2n个个 2个表示方法表的结构元素种类起止序号中子质量数同位素核电荷数元素质子性规质原子序数变律化元素周期律表现形式元素实周质期律元编元元核素素归素决外周制周纳性定电期期质子表律的排周布期周性期性n=1 n=2 n=3 n=4 n=5 n=6 n=7 纵:族2短周期1~ 28 3~10周元素性质8 11~ 18 原18长周期19~36 期子18 37~54 表结位32 55~86 构置21 不完全周期87~111主族:ⅠA ~Ⅶ A副族:ⅢB ~Ⅶ B 、Ⅰ B Ⅱ BⅧ族0族比较类型离子晶体原子晶体分子晶体构成晶体微粒阴、阳离子原子分子形成晶体作用力离子键共价键范德华力熔沸点较高很高低硬度硬而脆大小物导电性不良熔融.导电绝缘体 ( 半导体 ) 不良理水溶液性传热性不良不良不良质延展性不良不良不良溶解性易溶于极性溶剂不溶于任何溶剂相似相溶典型实例NaCl ,KBr 单质:金刚石、 SiC 、单质:H2、O2 Si 、SiO2 化合物:冰、干冰化表示方法学反特点速率算:v A =△c A /△t 位: mol/L ·s(min 或 h )是平均速率,均取正同一反用不同的物表示速率,数可能不同各物表示的速率比等于反方程式的系数比化和化学化反学学反平衡速率影响因素用条合件成的氨化适于学平衡内因 (主 )外因()可逆反化学平衡建立的条件: v 正=v 逆≠ 0化学平衡的特征(平衡志的判断)反物的构、性度温度催化其他条件光、超声波、激光、放射⋯定各成分百分含量保持不等v 正 =v 逆≠ 0平衡条件改,平衡状改化学平衡、化学反应速率度影响化学平衡因素平衡移原理(勒沙特列原理 )温度强电解质(完全电离 ) AB A -+B -已电离的弱电解质分子数(电离度的定义 (电离度α = ×100%)电离平衡 AB A -+B - 弱电解质的分子总数电 弱 部解 电 分电离度平衡的移动化 质解 电质 离水的离子积 K W =1× 10-14(25℃ )合物) 水的电离平衡 H 2OH ++OH-溶液的酸碱性: PH=-log[H + ]实质装置发生条件表示方式-离子方程式离子反应非氧化还原常见类型氧化还原类型盐类的水解规律(酸碱性性判断)影响因素复分解反应水解反应络合反应置换反应溶液中氧化还原反应原理蓄电池化 能应用电源干电池高能电池学 的 原电池能 转化学能电解池电能与 换原理氯碱工业(电解饱和食盐水)电 :电镀应用非电解精练(精练铜)电解 电冶炼金属(冶炼铝)质电解 质 溶 液比较装置能量转换 (实质) 装置特点电极名称电子流向电极反应原电池 电解池化学能→电能电能→化学能(两极分别发生氧化还原反应产生电流) (在电流作用下两极分别发生氧化还原反应)外电路无电源;两极为活泼性不同 外电路必须有直流电源;两极材料均(或其中之一为能导电的非金属)的金属 能导电即可负极(-)——较活泼 阴极——连接电源负极正极(+)较不活泼 阳极——连接电源正极e ee负极(-)→正极(+)电源负极→阴极电源正极→阳极氧化n+活泼金属失去电子+还原n+还原负极: M -ne → M 阴极: 2H +2e →H 2 ↑或 M + ne → M被氧化、被溶解、被腐蚀。
高中生物器官绘图教案设计

高中生物器官绘图教案设计
教学目标:
1. 了解人体器官的组成和功能
2. 掌握人体器官的结构和位置
3. 提高学生绘图技能和观察能力
教学内容:
1. 人体器官的分类及功能
2. 人体主要器官的结构和位置
3. 制作人体器官绘图
教学准备:
1. 展示图片或模型,让学生了解不同器官的位置和外观
2. 提供实验器材如铅笔、橡皮、彩色笔等
教学过程:
1. 介绍人体器官的分类及功能
2. 展示器官的图片或模型,让学生观察并描述不同器官的位置和功能
3. 引导学生开始绘制人体器官图,可以先画出人体的轮廓,然后填入各个器官的位置及结构
4. 鼓励学生互相交流并比较彼此的绘图,讨论其中的差异和改进方法
5. 老师可以展示一些优秀学生的绘图,进行点评和鼓励
教学总结:
通过本次教学,学生们对人体器官的结构和功能有了更深入的了解,同时也提高了他们的绘图技能和观察能力。
希望学生们能够继续保持热情,不断探索人体的奥秘。
生物教学中常见的图形类型及其绘制

生物教学中常见的图形类型及其绘制在新课程改革大背景下,对教师计算机操作能力有了更高、更强的要求;而对于生物来说,教师在制作试卷、课件、教案等过程中,经常会遇到图形、图表等问题,较为棘手。
现笔者就这一问题谈自己的几点看法。
一、生物教学中常见的图形类型1.坐标曲线图。
坐标曲线图是生物教学中常见的图形,主要有以下两种:这两种坐标图的主要区别是有无刻度和交叉网格,绘制难度在于:(1)曲线的弯度和拐点难以准确地掌握;(2)坐标轴上的刻度很难画得准确精细;(3)特殊点的位置把握不准确,如拐点、终点、最高点、交点、最低点等。
2.形态结构图。
形态结构图指生物教学中常出现的细胞形态结构图、染色体形态变化图、实物图、示意图、模式图等(图略)。
该类图形常见且常用,绘制难度是其中的标号是否到位清晰;染色体形态是否可观、清楚;在画实物图时,着色是否到位、结构比例是否准确等。
3.生理过程图。
生物课程有别于物理、化学,重在考查生物的生理过程,而这些过程的考查以示意图为主,如光合作用、呼吸作用、细胞分化、植物体细胞杂交等。
该类图形制作过程中的主要问题是规则和不规则的线条较多,尤其是弧形线条,如果用自由线条画,往往不够平滑,操作难度较大。
4.生化反应图。
生化反应图指与化学器材结合起来,考查各种仪器、装置的连接,以及实验中涉及的化学仪器的用法。
如呼吸作用类型的测定,DNA的提取,还原糖、蛋白质的鉴定等。
该类图形绘制的难度在于很难准确把握细小的部分,如烧杯两侧的拐弯处不一致,广口瓶的玻璃管是否深入到液面以下,或者装置的比例把握不当,致使绘制出的图形准确度、美观度下降。
二、生物教学中常见图形的绘制针对以上问题,本人在长期的探索中发现使用“绘图助手”“化学、生物金排”“中学物理作图工具”绘制以上图形有一定的帮助,下面对其使用作一说明。
1.坐标曲线图可用“绘图助手”来绘制。
对“绘图助手”来说,不论是哪一种图,都会快而准确地绘制出来,其优点在于其中的“绘制贝塞尔曲线”按钮能准确而又快速地描出曲线图,对其中的拐点、最高点等能很好把握;其“字”按钮也可以对横纵坐标轴的名称作一编辑。
高中化学必修一知识网络结构图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化氧化物、不成盐氧化物、过氧化物酸:无氧酸、含氧酸、强酸、弱酸决表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等反应程度:可逆、不可逆决表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式阿伏加德罗常数:M=N/n念(一)物质:元素化章L ►纯净物|—刑I 物有机物•盐:正盐、酸式盐、碱式盐、复盐、络盐物质 生质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化-变化基本反应类型:化合、分解、置换、复分解 电子转移:氧化还原、非氧化还原物理变化离子参加:离子反应、非离子反应物质的量摩尔质量:M=m/n (mol)---- 气体摩尔体积:V =22.4 n (标准状况)色、态、味溶解度、熔点、沸点 密度、硬度、导电性导热性、塑性「单质兀素游离态宏观化合态原子晶体物质变化分类石墨(混合晶体)金属晶体微观大多数盐离子晶体pl 纯净物-无机物碱性氧化物*6分过氧化新潮解、分储升华、萃取溶解、盐析裂化、裂解念(二)第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)金属 稀有气体-氢化物--氧化物一不成盐氧化物含氧酸、无氧酸 强酸、弱酸,可溶碱、难容碱 正盐 酸式盐 碱式盐 复盐;络盐物质结构荷电 一实质.Si排布规律、分层1能 量最低原理层最多容纳29个次外层不超过18个最外层不超过8个一运动状态——特殊性•,电子云分子间作用力{范德华力•分子的极性L分子的形成属键一L葛子健 化学键I n ———共价键核外电子排布周期性元素性质的周期性元素周期律编制一 元素周期表表的结构示方法,影响物理性质2812---8188213Bn ABw WA BI m••族族族族 、王副o族 56 7 一一 一一 一L化学反应速率和化学平衡表示方法 :V A = △ C A /△ t 单位:mol/L - s(min 或 h是平均速率,均取正值同一反应选用不同的物质表示速率,数值可能不同 各物质表示的速率比等于该反应方程式的系数比化学平衡件学平衡、化学 反应速率反应物的结构、性质 浓度温度]催化剂 ___________________ 其他条件—光、超声 波、激光、放射线…影响化学平衡因素压强 温度平衡移动原理强电解质(完全电离)AB -^A '+B化合物电解质弱电解质装:能的转换:化学能与电化学能非电解质电冶炼金属(冶炼铝)电解质溶液第三部分:元素化合物转化关系H2O H2OMg(OH) ------ MgCO3NaOH /H2O/HCI/ CO:/ HCl .. /OHCaCl2 ・JHClCl2 为/ HCl Na2CO3HClCl* CaCO3飞CO2+ H2OAlCl 3(AI 3+)[、NaOHHClHCW " Ji/电解1Al 2O3.、O2NaOHCl HCl *Fl H2°(沸腾).»OH)3NaOH 或H C z^C02ZT S^u NaOHNaAl O 2NaOHKSCNFe(ScN)3FeSNa2SH2SO4FeONaOH H2SO4Fe3O4Fe(OH) 2O2 和H2O・ FeCl2Cl FeKSCNFeCl3 :Fe(SCN)3NaOH HCl♦ Fe(OH)3SCU2S 一HNO3 或H2SO4(浓NH3H2O 2+• Cu(OH) 2 ■ [Cu(NH 3)4]CuS ♦Na2S Cu2+(NO3、S°42)金属部分:按照单质-氧化物一氢氧化物一►盐为线索进行搜罗寻找关系非金属:按照化合价寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐第四部分:有机化学—醇 (官能团:一OH ):饱和一元醇C n H 2n+1OH (n 法1)R — OH 酬 C n H 2n+2O (n A2)R O R _____ 酚(苯酚)(官能团:OH ) C n H 2n-6。
高中化学必修一知识网络结构图
化不物成 盐 氧
机
酸
碱 性两 性特 性
原子晶 物质石墨(混合晶
大体多)数盐体金属子晶 离 强碱体 离子晶
碱性氧化 部分过氧 体
物
化物
微化 观
物 酸
含氧酸、无 殊 化强物酸、弱
碱
强 氧碱 酸、弱 可酸溶 碱 、难
正碱
盐
酸容碱式 盐 碱 式
盐 复盐;络
盐
潮解、分
混合盐
升馏华、萃 溶取解、盐 基 析 本
物理变
质
质 变
性、碱物性、理稳定性、可燃基性本反应类型:化合、分解、
变化
电子转移:氧化还原、
化
物理
置 离换 子、 参复 加分 :解 离子反应、 非 反氧 应化 程还 度原:可逆、
※表示物质变变化化的化学用语非 不热 吸:离 可效 热化子 逆应学反:方放应程热式、、热化学方程式、离子
计 方程物式、质电极反摩 阿应尔式伏质、加量电德:离M罗方=m程/常n式
炼铝)
比
装 置
原电池
电解池
较
能量转 化学能→电能 换
电能→化学能
(两极分别发生氧化还原 (在电流作用下两极分别发生
( 实 反应产生电流)
氧化还原反应)
质)
装置特 外电路无电源;两极为活泼 外电路必须有直流电源;两极
点
性不同
材料均
(或其中之一为能导电的 能导电即可 非金属)的金属
电极名 负极(-)——较活泼 称
为多同糖分:淀异粉构、) 纤维素(C6H12O6)n
蛋 白 质 :C1多2H2肽2O1、1(互氨为基同酸分(异官构能) 团 : — NH2 (n 值不天同然) 高分子:橡胶(聚异戊二
新高考高中生物原创试题绘图教程必备
各位学科网的同事和同仁们,如果您对绘图工作感兴趣,希望你们在绘 图过程中,边绘图边思考,才能熟能生巧,才能学以致用,在今后的试题解 析和替换图工作中,必然会遇到许多难搞的图片,只要我们善于动脑,发散 思维,动手操作,再复杂的图片,总有解决之法。
土壤如何才能画得像呢? 怎样绘制锥形瓶和试管等化学仪器?
任意插入一个多边形,然后在关键点位置添加顶点, 尽可能都设置为角部顶点再耐心的调整平滑度、角度等。
只要你有足够的耐心, 右图中的化学仪器均可以成 功绘制。
绘图示例
组合图形或复杂图形
注:复杂繁琐的图片,总结解决思路就是拆 分法,先完成各个小部分,然后组合生成即可。 不过前提是我们要有足够的耐心才行。有很多元 素部件一旦保存后,以后在绘制时便可直接使用。
1.选中数据点击插入簇状柱形图。
2.左图是利用图表本身的选项进行调整的结果。 (主要有去表格横线、去表格边框线、删除图 表标题、将横轴和纵轴改为实线并将刻度线选 择为外部、并将横坐标标签删除。
有时需要将两个柱形靠拢,则做如下操作:
3.点击某种颜色的柱形图,使其进入选中状态。 右侧会显示如左下图,点击图示所示项目,调整 系列重叠的百分比。
下图即调整后的柱形图
下图是调整后尽可能与原图保持一致的处理结果
有时我们遇到的柱形图或曲线图的横纵坐标比较特殊时,我们又该怎么办呢?如果只是在柱 形图相关选项中操作就很难绘出下图中坐标的效果图。
接下来我们就想一个办法让自由的改变横纵轴的单位长度、原点位置以及坐标数据标签等 项目成为可能。
选择肘形线条,然后按右图所示 过程操作调整。
预祝各位绘图成功,工作愉快!朝某个方向进行拉动, 所示的虚线就是拉动后产生
高中生物学绘图元件(出试题绘图)

染色体及细胞分裂AA ⅠⅡa E EaⅠⅡ AAⅠA a甲乙丙A a bbA a bBA a BbA a BBA B CD①卵原细胞③Ⅰ图一ⅡⅣ精原细精原细① ② 染色体 复制 染色体 平均分染色体复制初级精母细胞生殖细胞减数第一次减数第二次精(卵)原细ABCDEFG异常卵子 携带有X 染色体XO 型合子异常卵子 携带有YO 型合子mF基因工程相关甲m FF①②乙a外源农杆EcoRI 目的基EcoRI含抗虫基因的DNA复制原MetI 目的基抗四环素基因图Ec目的PstI Sma甲XYL1基因坐标系元件AmBg1II基因A基因C35' 3有义链 反义链图2温度(℃)0 1 2 3 4 5 6 7 8 9 10 11 12胰白酶酶胃蛋白酶淀粉酶 ︵唾︶反应速淀粉酶︵植物︶种群增长速种群数0123 4时提取葡萄糖溶液提取葡萄糖溶液CO 吸收速率光强度表观光合速率(O 2)μm o l ⋅g ^(−1)⋅净光合速率 μm o l C O _2⋅m ^(−2)⋅s ^(−1)0 10 12 14 16 2 4 6 8 图光照强度(×μmol ⋅m ^(−2)⋅s时间/d乙烯释放量(m L ·g -1·h -1)ABA 处理蒸馏水 合成NaHCO 3浓度表观光合速率(O 2)/μm o l ⋅g ^(−1)⋅速率(O 2)/μm o l ⋅g ^(−1)⋅h ^(−1)表观光合速pH膜电位时间4 8 1122233443322还原糖含量时间4 8 1122蔗糖含量(%)时促进生抑制生10 20 30 40 50时间/d 赤霉素含量(μg/10g 干重) 脱落酸8 6 4伸长长度(m m ) 20 40 60 80 100 120时间(min)250C h l ·h -1)0 40 80 120 160 200 240NaHCO 3(mg·L -1) 图3净光合速率(μm o l O 2m g -1·C h lO 2释放速率3 5 79 淀粉含量A 小鼠存活率最大存活天数Y 1 Y 2 Y 3C时间/ms膜电位/m Va b转运速率4胞间CO 2浓度(相对单光合速率光照强度(千勒克司)丙CO 2的吸收速率 (mg/小时 · 单位叶面积 )中C O 2的浓度遗传学系谱图元件容器中反应时间 图2/minⅡⅠ正常正女女内环境元件5Ⅲ Ⅳ女男652 341B血流方向核质交换蛋白①R神经调节abA刺激细ABCD①②中心法则DNRN蛋白复转录翻译DNA RNA 蛋白质④⑤③② ①丙图1 图2Ⅳ②③级精细胞次级精母细胞精细胞携带有Y染色体合子MG2G1 S②A B 甲A B乙bc d农杆愈伤组转基因香④⑤愈伤组转基因①② 目的基因PstI质图目的基外源DNA 基因方乙BmaHAmp^iBg1II223344间X0X1Y3数Y1 Y2 Y3B正常女性正常男性女甲病患男甲病患女红绿色盲患者女红绿色盲患者男红绿色盲患者t血管B端蛋白RNA细胞细胞Na + K + Cl - A -Na + K + Cl - A- 150m 150m 150m 5mME ②蛋白白质图3 图4AB丙d基因。
高中化学基础知识网络图完整版

(实质) (两极分别发生氧化还原反应产生电流)
装置特点
外电路无电源;两极为活泼性不同
(或其中之一为能导电的非金属)的金属
电极名称 电子流向
负极(-)——较活泼 正极(+)较不活泼 负极(-)→e 正极(+)
负极:M-ne→Mn+活泼金属失去电子
被氧化、被溶解、被腐蚀。
电极反应 正极:2H++2e→H2↑(酸性电解质溶液) 或 M n++ne→M(不活泼金属的盐溶液)
不良
不良 不良 相似相溶 单质:H2、O2 化合物:冰、干冰
化
学
表示方法 :vA=△cA/△t 单位:mol/L·s(min
反 应 速 率
特或点h )
是平均速率,均取正 值同一反应选用不同的物质表示速率,数值可
和 化 学 平 衡
化 学化 反学 应反 速应 率
计
改变,平衡状态 衡
反应速率
(平衡标志的判
浓 改变
断影)响化学平衡因 度压
平衡移动原
素
强温
理
度
(勒沙特列原
理)
强电解质(完全电离 )5AB A-
离(
质
电质 解
)
弱电+B部分-
电离平衡 AB A-
物化
解 电 +B-
电离度的定 (电离度α= 义电离度平衡的移
×100%)
比较 装置
能量转换
原电池 化学能→电能
※表示单质或化合物的化学用语:化碱学式、结构式、结构简式、电子式等
物理性质:色、态、熔点、密度、溶解性络等盐
性质
物
化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性
中学化学各仪器矢量图大全

中学化学仪器装置图大全一、成套装置 (2)1.制氯气: (2)2.实验室制乙烯: (2)3.蒸馏、分馏 (3)4.氢气还原氧化铜: (4)5.制SO3 (4)6.喷泉 (4)7.酯化 (4)8.制Fe(OH)2 (5)9.合成无水三氯化铁: (5)10.合成无水四氯化锡: (5)11.其它 (6)12.原电池、电解池 (6)二、组合装置 (8)1.两通管加热 (8)2.固~固加热,制气 (8)3.固~液、液~液加热,制气 (9)4.固~液不加热,制气 (9)5.启普发生器 (9)6.水浴加热 (10)7.洗气瓶 (11)8.干燥装置 (11)9.集气装置 (11)10.量气装置 (12)11.尾气吸收 (12)三、容器 (12)1.试管 (12)2.烧杯 (13)3.烧瓶、蒸馏瓶 (13)4.锥形瓶 (13)5.试剂瓶 (13)6.U形管 (14)7.干燥类 (14)8.冷凝管、牛角管 (14)9.漏斗 (14)10.水槽 (15)11.计量类 (15)12.加热类 (16)13.导管 (17)14.橡管、塞、活塞、接口 (17)15.其它 (17)一、成套装置1.制氯气:2.实验室制乙烯:3.蒸馏、分馏4.氢气还原氧化铜:5.制SO 36.喷泉7.酯化338.制Fe(OH)29.合成无水三氯化铁:10.合成无水四氯化锡:NaOHH 2SO 411.其它气球12.原电池、电解池24A B C D水准管溶液颗粒 3 NaOH 溶液 4溶液ABH 2SO 4 CH 2SO 4 AH 2SO 4 2甲CuSO 4溶液Fe(OH)3胶体饱和NaCl 溶液乙丙丁直流电源A 氢氧化钠溶液直流电源B氢氧化钠溶液润湿的 S 2 F蒸馏水 沸腾 蒸馏水 硅胶干燥剂 食盐水 自来水 自来水 ① ②③ ④ ⑤⑥24ZnSO 4CuSO 4DC 24二、组合装置1.两通管加热2.固~固加热,制气3.固~液、液~液加热,制气4.固~液不加热,制气5.启普发生器6.水浴加热多孔隔板多孔隔板7.洗气瓶8.干燥装置9.集气装置10.量气装置11.尾气吸收三、容器1.试管水准管2O 4这二个是自画2.烧杯3.烧瓶、蒸馏瓶4个自画4.锥形瓶自制)5.试剂瓶6.U形管2个自画7.干燥类8.冷凝管、牛角管3个自画9.漏斗10.水槽11.计量类这行是自画14.橡管、塞、活塞、接口15.其它.Al气球A苹果块4A B C D水准管。
高中化学必修一知识网络结构图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系第四部分:有机化学有机抓住官能团的性质烃 烃的衍生物糖 蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH ) 高分子化合物链烃(脂肪烃) 环烃 饱和链烃烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2) OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H2n O 2(n ≥2)R —COOR ’硝基化合物(官能团—NO 2)R —NO 2胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n(n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
