硫酸法生产钛白所产废酸浸取铂钯矿浸出液中镁和铁的回收
新教材适用2024版高考化学二轮总复习题型能力提升训练二化学工艺流程综合题

题型能力提升训练(二)1. (2023·河北邯郸二模)Be被主要用于原子能反应堆材料、宇航工程材料等,有“超级金属、尖端金属、空间金属”之称。
硫酸法是现代工业用绿柱石(主要成分为3BeO·Al2O3·6SiO2,还含有铁等杂质)生产氧化铍的方法之一,其简化的工艺流程如下:已知几种金属阳离子的氢氧化物沉淀时的pH如下表:金属阳离子Fe3+Al3+Fe2+Be2+开始沉淀时pH 1.5 3.3 6.5 5.2沉淀完全时pH 3.7 5.0 9.7 —_适当增加硫酸的浓度、搅拌、适当升高温度等__(除粉碎外,任写一点)。
(2)滤渣1成分的化学式为_H2SiO3__。
(3)步骤③中加入H2O2的目的是_将Fe2+氧化为Fe3+__。
(4)步骤④不宜使用NaOH溶液来沉淀Be2+,原因是 Be(OH)2能与强碱发生反应:Be(OH)2+2OH-===BeO2-2+2H2O,难以控制强碱的用量使Be2+恰好完全沉淀(用必要的文字和离子方程式说明);已知K sp[Be(OH)2]=1.6×10-22,则Be2+沉淀完全时,溶液中c(OH-)=_4×10-9__mol·L-1(通常认为溶液中离子浓度小于1.0×10-5mol·L-1时为沉淀完全)。
【解析】绿柱石经石灰石熔炼后再粉碎、硫酸酸浸,得到滤渣H2SiO3和滤液(含有Be22+被氧化为Fe3+,用氨水调节pH,Fe3+、Al3+生成+、Fe2+、Al3+、H+、SO2-4),加入H2O2后Fe沉淀,Be2+留在滤液,继续加氨水调节pH可使Be2+生成Be(OH)2沉淀,灼烧后生成BeO。
(1)步骤②中还可以采取适当增加硫酸的浓度、搅拌、适当升高温度等措施提高反应速率。
(2)滤渣1成分的化学式为H2SiO3。
(3)步骤③中加入H2O2的目的是将Fe2+氧化为Fe3+。
(4)Be(OH)2能与强碱发生反应:Be(OH)2+2OH-===BeO2-2+2H2O,难以控制强碱的用量使Be2+恰好完全沉淀,故不宜使用NaOH溶液来沉淀Be2+。
九年级化学工业流程题经典题目汇编(含答案)

九年级化学工业流程题经典题目汇编(含答案)一、 选择题1. (·泰安)从海水中制备纯碱和金属镁的流程如下图所示:第1题下列说法错误的是( )A. 流程Ⅰ依次向粗盐水中加入过量Ca(OH)2溶液、Na 2CO 3溶液和适量稀盐酸去除杂质B. 流程Ⅱ吸氨是使溶液呈碱性,有利于吸收二氧化碳C. 上述流程涉及三种基本反应类型D. 流程 Ⅳ、Ⅴ是通过化学方法富集氯化镁2. 下图是一种吸收废气中SO 2并得到H 2SO 4的方法。
下列说法不正确的是( )第2题A. 电解过程中化学能转化为电能B. 吸收时的反应为Na 2SO 3+SO 2+H 2O===2NaHSO 3C. 阴极区产生的气体X 是O 2D. 该方法可减少酸雨的形成3. (·呼和浩特)黄铁矿的主要成分为二硫化亚铁(FeS 2),工业上可利用黄铁矿煅烧的产物冶炼铁和生产浓硫酸,其工业流程如下:第3题下列说法错误的是( )A. 反应②不是置换反应,反应③④为化合反应B. 反应①中各元素的化合价均发生了改变C. 该工业生产过程产生的废气中的SO 2可以用熟石灰溶液吸收D. 向制得的100 g 98%的浓硫酸中加入100 g 蒸馏水,配制49%的稀硫酸4. (·黄冈)金属钨(W)可做白炽灯泡的灯丝。
用黑钨矿[主要含有FeWO 4(钨酸亚铁)]制得金属钨(W)的工艺流程如下图所示:第4题其主要反应原理如下:① 4FeWO 4+4Na 2CO 3+O 2=====高温4Na 2WO 4+2Fe 2O 3+4CO 2② Na 2WO 4+2HCl(热浓)===H 2WO 4+2NaCl③ H 2WO 4=====△H 2O +WO 3④ 3H 2+WO 3=====1 000 ℃W +3H 2O下列说法不正确的是( )A. 反应③属于分解反应B. 反应①②③④的产物都有氧化物C. 反应①④中有元素的化合价发生改变D. 为加快反应的速率,可将黑钨矿石碾成粉末二、 填空题5. (·滨州)建造“辽宁”舰需要大量的金属钛,钛因其密度小,熔点高,常温下耐酸碱,耐腐蚀等优良性能,被誉为“未来金属”。
硫酸法钛白工艺中浓废酸利用途径

工艺技 术、 应用情况及存在 的问题作 出了 比较详 细地分析 , 对未来的 发展趋势作 出了预测性分析 。
关键词 硫 酸法 中国分 类号 T 3 . 1 Q14 1 文献标识码
1 前 言
二氧化钛是一种性能非常优异 的白色颜料 , 广 泛地应用于涂料 、 塑料 、 纸、 造 油墨、 色浆 、 橡胶 等领 域…。 自20 00年以来 , 我国的钛 白工业得到 了快速
做 了大量的研究 , 中王家琪 研究 了利用钛 白废 其 酸与软锰矿 、 菱锰矿制取硫酸锰 , 姚福琪 研究了利 J
用低品位软锰矿制取硫酸锰 和碳酸 锰 , 张玉林 研 究了利用钛白废酸处理铝土矿生产硫酸铝 的方法 。
这些方法中 , 由于受废酸 中大量钛 、 、 铁 镁等 杂质 的
维普资讯
20 0 6年 1 2月
贵 州 化 工
G i o h mi l n u t u huC e c ds y z aI r ・2 ・ 9
第3 1卷第 6期
硫酸法钛 白工艺中浓废酸利用途径
肖永华 余雪梅
(. 1攀枝 花学 院 , 四川攀枝花 ,10 0 2 四川大学 , 6 70 ;. 四川成都 ,10 1 6 05 ) 摘 要 系统地分析 了 目前 我 国钛 白生产过程中产生 的大量酸解废酸的处理方法 和应用 途径 , 每种方法 的 对 钛 白 浓废酸 利用 途径 A 文章编号 10 0 8—9 1 ( 06 0 0 2 0 4 1 2 0 ) 6— 0 9— 2
很高等问题 , 导致产品生产成本很高 , 因此难 以被厂
家 接受 。
此外 , 为了消除浓缩过程 中废酸 , 萃取 法等方法也得到了广泛 的研究 , 取得 了一定程度 的 进展。但扩散渗析法 回收 的硫酸浓 度低 , 以直接 难
邯郸市中考化学流程题试题及答案解答

邯郸市中考化学流程题试题及答案解答一、中考化学流程题1.工业上用闪锌矿(主要成分是ZnS、FeS)冶炼锌,主要流程如下:(1)焙烧炉中,ZnS转化为ZnO。
补全该反应的化学方程式。
___________ZnS+___________高温___________ZnO+___________SO2(2)酸浸槽中,硫酸与锌焙砂反应得到用于电解的酸浸液。
反应过程中需不断搅拌,其目的是___________。
(3)酸浸渣的主要成分是铁酸锌(ZnFe2O4,其中Fe为+3价)。
底吹炉中,主要发生如下反应:①3ZnFe2O4+C 高温2Fe3O4+3ZnO+CO↑②ZnFe2O4+CO 高温2FeO+ZnO+CO2③ZnO+CO 高温Zn(蒸气)+CO2反应①~③中,化合价发生改变的元素有___________。
(4)最终可以获得锌的设备有___________。
2.稀土金属因其独特的性能而被誉为“新材料之母”。
稀士金属镧的氧化物([La2O3)广泛应用于军事、民用、医疗等领域,其颗粒大小决定了产品的质量。
利用独居石(含La2O3等金属氧化物及P2O5、SiO2等非金属氧化物)生产超细La2O3颗粒的一种工艺如下:(1)“酸溶”过程中,La2O3与稀硫酸反应的化学方程式是_____;(2)通过调节滤液1的pH,可将镧的盐溶液转化为镧的氢氧化物并以沉淀的形式析出,该反应的化学方程式是_____;(3)“调pH”时加入烧碱溶液使溶液的 pH_____(填“增大”、“减小”或“不变”);(4)将镧的氢氧化物固体溶于稀硝酸,可得到硝酸镧溶液,该反应的化学方程式是______。
(5)实验室使用加柠檬酸作燃料的方法,在马福炉中进行硝酸镧的煅烧,马福炉的温度设置只能为100℃的整数倍。
为获得适当大小的氧化镧颗粒,某小组研究了条件对产品粒径的影响,相关数据如下:实验编号123456789硝酸镧浓度(g/L)165330495165165165165165165煅烧温度/℃700700700600800900700700700煅烧时间/h1111110.523氧化镧粒径/nm426375不纯65803875133①实验1、5、6研究的结论是:其它实验条件相同时,______;②分析以上数据可知,若将实验条件变更为以下条件:硝酸镧浓度165g/L,煅烧温度700℃,煅烧1.5h,则氧化镧粒径最有可能的数值为_____(填序号);A 30nmB 50nm C.80nm D 110nm③要获得更小粒径的高纯氧化镧,在上述最佳条件的基础上,研究方向可以是____。
回收、提纯类工艺流程题思路详解

MgO、CaO、Fe2O3 转化为相应的硫酸盐,写出 Al2O3 转化
为 NH4Al(SO4)2 的化学方程式
。
(2)“水浸”后“滤液”的 pH 约为 2.0,在“分步沉淀”
时用氨水逐步调节 pH 至 11.6,依次析出的金属离子是 。
(3)“母液①”中 Mg2+ 浓度为
mol·L-1。
(c=1×10-5 mol·L-1)时,溶液 pH 为 11.1 可知,氢氧化镁的
溶度积为 1×10-5×(1×10-2.9)2=1×10—10.8;当溶液 pH 为 11.6
时,溶液中镁离子的浓度为
1×10-10.8 (1×10-2.4)2
【例】(2021 · 全国高考乙卷理综)磁选后的炼铁高钛炉 渣,主要成分有 TiO2、SiO2、Al2O3、MgO、CaO 以及少量 的 Fe2O3。为节约和充分利用资源,通过如下工艺流程回收 钛、铝、镁等。
(NH4)2SO3
热水
氨水
高钛炉渣
焙烧
滤液
水浸
分步沉淀
氢氧化物沉淀
尾气
水浸渣 酸溶
母液① 水解
第一步,从题干中提取信息,明确化工流程“有什么” 和“要什么”
“有什么”即待回收的原料中含有的物质,“要什么” 即化工流程最终想要回收的物质,其往往是单质或化合物, 根据题目信息进行确定。本题从题干可知是回收类化工流
47
Copyright©博看网 . All Rights Reserved.
(1)Al2O3+4(MH4)2SO4 焙烧 2NH4Al(SO4)2+6NH3↑+3H2O↑ (2)Fe3+、Al3+、Mg2+ (3)1.0×10-6
阳极泥中钯铂的浸出工艺

阳极泥中钯铂的浸出工艺
阳极泥中钯铂的浸出工艺一般包括以下几个步骤:
1. 预处理:将阳极泥经过粉碎处理,使其颗粒度较细。
2. 酸浸:使用浓硫酸对阳极泥进行酸浸处理。
一般采用浸液温度高、酸浸时间长、酸液浓度较高的条件进行浸出,以提高金属的浸出率。
3. 过滤:将浸出液经过过滤,去除其中的固体杂质。
4. 脱铅:加入适量的二硫化物(如二硫化钠)或有机螯合剂(如巯基丙酸)使铅与螯合剂生成络合物,从而将铅浸出。
5. 去铑:加入适量的硝酸或氯化物,在酸性条件下将铑溶解。
6. 脱铂:采用还原法或溶液交换法脱除残留的铂。
7. 沉淀回收:将浸出液中的钯铂沉淀出来,通常采用还原沉淀法,将钯铂还原成金属沉淀。
8. 精炼提纯:对得到的钯铂沉淀进行精炼提纯,一般采用电解法或微量氧气法。
以上是钯铂浸出工艺的一般步骤,具体的操作条件和工艺参数需要根据具体情况进行调整。
具体工艺过程需要根据实际情况和所用设备来确定。
2025年中考化学二轮复习课件专题三工艺流程题

9.[2024·泸州中考]陶瓷是火与土的结晶,是化学与艺术的融合,是中华文明的象征 之一。颜料赋予陶瓷精彩。一种用焙烧黄铁矿产生的红渣块(主要成分为Fe2O3和SiO2, SiO2不溶于水和常见的酸)为原料制备颜料铵铁蓝的工艺流程如图所示。
已知:①Zn+2FeCl3===ZnCl2+2FeCl2 ②Fe+2FeCl3===3FeCl2 ③Cu+2FeCl3===CuCl2+2FeCl2 (1)为加快“酸浸”的反应速率,可采取的措施是
5.[2024·烟台中考]CO2“捕集”技术为实现CO2的资源化利用提供支持。图1为 “氨法”捕集CO2生产甲醇(CH4O)的流程图。
资料:①氨气极易溶于水,水溶液呈碱性;②NH4HCO3受热分解为NH3、H2O和CO2。 (1)“吸收室”中为了提高CO2的吸收率,应该先通入的是 NH3 (选填“NH3”或 “CO2”)。 (2)“合成室”中除了生成甲醇外,还生成水。该反应的化学方程式是
专题三 工艺流程题
回收与利用流程 1.[2024·内蒙古中考]某工厂排放的废液中含有硫酸铜和硫酸亚铁,将废液转化为硫 酸锌溶液的流程图如图,请回答下列问题。
(1)步骤Ⅰ和步骤Ⅲ的操作名称是 过滤 。 (2)步骤Ⅱ用磁铁吸引分离出的固体B是 Fe (填化学式)。 (3)写出步骤Ⅲ中反应的化学方程式: Zn+H2SO4===ZnSO4+H2↑ 。
4.[2024·新疆中考]硫酸亚铁广泛应用于医学、农业等领域,可利用菱铁矿进行制备。 菱铁矿的主要成分是碳酸亚铁(FeCO3),还含有少量的二氧化硅(SiO2)和氧化铁 (Fe2O3)。以菱铁矿为原料制备硫酸亚铁的工艺流程如图所示。
回答下列问题。
(1)硫酸亚铁可为人体补充铁元素,在医学上可用于治疗 贫血 (填病症名称)。
(名师整理)最新人教版化学冲刺中考《工艺流程题》专题复习考点精讲精练(含答案)

2.(2021·广安中考)工业上处理黄铜渣(含 Cu、Zn、CuO、ZnO 和杂质)废料时, 通常将其转化为硫酸锌并回收铜(黄铜渣中的杂质不溶于水,也不参与反应),其 主要流程如图所示: 查阅资料: 2Cu+2H2SO4+O2==△=== 2CuSO4+2H2O CuO+H2SO4==△=== CuSO4+H2O ZnO+H2SO4==△=== ZnSO4+H2O
3.(2021·东营中考)海洋是人类宝贵的自然资源,海水“晒盐”和海水“制碱”体现了 人类利用和改造自然的智慧,请根据粗盐“制碱”的流程图(如图)回答问题:
(1)步骤Ⅰ除杂中,常见的方法有两种:一是物理方法,即用NaCl溶液浸洗粗 盐,溶解除去其中的可溶性杂质,则浸洗溶液应选用NaCl的___饱__和____(填“饱 和”或“不饱和”)溶液;二是化学方法,操作步骤依次为加水溶解→加过量试剂 ①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是 ___A_D___。 A.①Ca(OH)2 ②Na2CO3 B.①Na2CO3 ②Ca(OH)2 C.①KOH ②Na2CO3 D.①NaOH ②Na2CO3
B.固体 B 是 Mg(OH)2,试剂 X 是盐酸
C.加入 NaOH 溶液应过量,其目的是使 MgCl2 完全反应 D.处理等量海水,若将 NaOH 溶液换成石灰乳,既能节约成本又能提高镁的产量
2.(2021·梧州中考)1926 年,我国化工专家侯德榜创造出的“侯氏制碱法”,结束 了由美、英、法等国垄断世界纯碱市场的时代。其基本工业流程如图:
4.碱:去油污,调节pH、除去溶液中可溶性杂质。 5.煮沸:除去溶解在溶液中的气体,如氧气。 6.趁热过滤:减少结晶损失,提高纯度。 7.过量:将某物质完全反应。 三、工业流程常见的操作 1.原料的预处理: (1)溶解:通常用水、酸溶,如用硫酸、盐酸等。 (2)煅烧:如煅烧石灰石改变结构,使一些物质能溶解。并使一些杂质高温下氧 化、分解。
中考化学流程题知识点及练习题及解析(4)

中考化学流程题知识点及练习题及解析(4)一、中考化学流程题1.某电镀厂为减少水污染及节约成本,从含有 CuSO4、 MgSO4、FeSO4的废液中回收重要原料MgSO4和有关金属,工艺流程如图。
请回答:(1)写出步骤①中发生反应的化学方程式:______________。
(2)固体B的成分是______________。
(填写化学式)(3)固体D中加入稀硫酸可以观察到的现象是______________。
(4)若固体B比加入的镁粉质量增加184g,固体D比固体B质量减少112g,则加入的镁粉至少需要______________g。
2.硫酸锌是木材保存剂的主要成分。
某工厂产生的废渣(主要成分为ZnO,少量Fe2O3,CuO)可用于制备ZnSO4,其工艺流程如图所示。
(1)“粉碎”的目的是_____。
(2)“浸取”所得溶液的金属阳离子有_____和_____(填离子符号);(3)“除铁”步骤中加入氨水的化学方程式是_____;之后的操作是_____在实验室该操作必须用到的玻璃仪器是漏斗、烧杯和_____。
(4)“除铜”时发生反应的化学方程式是_____。
(5)将90g废渣进行以上流程实验,最终得到6.4g铜和161g的ZnSO4,假设废渣中金属元素没有损失,则该废渣中ZnO的质量分数是_____。
3.NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣[除含镍外,还含有Cu、Fe、Fe2O3、铬(Cr)等杂质]为原料浸出获得。
工艺流程如图:已知:①已知Ni和Cr是位于氢以前的金属;②H2O2溶液有比较强的氧化性;③NiSO4·6H2O难溶于乙醇,受热易分解;④25℃时,几种金属氢氧化物完全沉淀的pH 范围如下表所示。
Fe(OH)2Fe(OH)3Cr(OH)3Ni(OH)2完全沉淀pH≥9.6≥3. 2≥5. 6≥8.4请回答下列问题:(1)操作A是____,下列措施可行,且能提高废渣浸出速率的有________ (填编号)。
2021届高三化学二轮温习 工业流程题每日一练(2)(1)

2021届高三化学二轮温习工业流程题每日一练(2)1.(14分)利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。
其生产步骤如下:已知:TiOSO4可溶于水,在水中能够电离为TiO2+和SO42—。
请回答:(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是。
(2)滤渣的要紧成份为TiO2•x H2O,写出TiOSO4水解生成TiO2•x H2O的化学方程式。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反映中氧化剂和还原剂的物质的量之比为。
(4)用平稳移动的原理说明步骤⑤中加乳酸能取得乳酸亚铁的缘故。
(5)步骤④的离子方程式是。
(6)步骤⑥必需操纵必然的真空度,缘故是有利于蒸发水和。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成mL溶液,掏出mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反映)。
假设消耗mol•L-1KMnO4溶液mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)。
二、(16分)合成氨尿素工业生产进程中涉及到的物质转化进程如以下图所示。
(1)天然气在高温、催化剂作用下与水蒸气反映生成H2和CO的化学方程式为。
(2)在合成氨生产中,将生成的氨及时从反映后的气体中分离出来。
运用化学平稳的 知识分析如此做的是不是有利于氨的合成,说明理由: 。
(3)右图为合成氨反映在不同温度和压强、利用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
① 假设别离用υA (NH 3)和υB (NH 3)表示从反映开始至达平稳状态A 、B 时的化学反映速度,则υA (NH 3) υB (NH 3)(填“>”、“<”或“=”)。
②在相同温度、当压强由p 1变成p 3时,合成氨反映的化学平稳常数 。
(填“变大”、“变小”或“不变”)。
2020-2021备战中考化学 流程图 培优练习(含答案)含答案

一、中考初中化学流程图1.工业上采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3)来制取绿矾(FeSO4·7H2O),实现变废为宝,减少环境污染。
简易流程如下:(1)反应①和反应③都要进行的操作是_______________;(2)写出反应②中发生反应的化学方程式为_______________;(3)用NaOH溶液控制pH的目的是___________________________________。
【答案】过滤Fe+H2SO4=FeSO4+H2↑ Fe+ Fe2(SO4)3=3FeSO4使Al3+完全转化为Al(OH)3沉淀【解析】(1)反应①和反应③后都是生成难溶性物质和可溶性物质,所以要进行过滤操作,以便将两者分离开来;(2)由于前面加入的硫酸是过量的,且和矿石反应生成了硫酸铝和硫酸铁,铁能够和剩余的硫酸以及生成的硫酸铁反应都生成硫酸亚铁。
所以反应②中发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑和Fe+Fe2(SO4)3=3FeSO4;(3)由于溶液中既有亚铁离子也有铝离子,这两者遇到氢氧根离子都会反应生成沉淀,所以要通过加入氢氧化钠溶液控制溶液的pH来实现只让铝离子沉淀,而不让亚铁离子沉淀。
2.我国每年报废的手机超过1亿部。
废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。
化学兴趣小组为回收其中的铜,设计并进行了如下实验。
已知:Cu+H2O2+H2SO4=CuSO4+2H2O;不考虑金、银发生类似反应。
(1)将电路板粉碎成粉末的目的是___________________________________________。
(2)步骤①所得滤液中的溶质除硫酸外,还有__________________________。
(3)步骤②中的实验现象是:固体部分溶解,_____________________。
用萃取法从硫酸法钛白废酸中提取钪

用萃取法从硫酸法钛白废酸中提取钪冯彦琳 王靖芳 王海林Ξ(山西大学化学系 太原 030006) 钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。
国内钪资源丰富,大部分伴生于其它矿中,钪是由多种金属生产过程中回收。
钛白水解母液中含有几十个ppm的钪,具有回收价值,但所含杂质元素很多,量大,其中铁量为钪的3000倍,钛量为钪的500倍[1]。
从而钪与铁、钛分离最为突出。
酸液中酸性膦类萃取剂对二价金属的萃取能力较小,与铁的分离在于同Fe( )的分离。
萃取法提取钪已有报导[2,2,4]。
本文提出P507-N7301-煤油混合萃取剂提取钪,并对沁县钛白粉厂的废酸液进行了试验。
在母液具有酸度大、杂质含量高的情况下萃取钪,结果令人满意。
并获得制备Sc2O3产品的工艺流程,该工艺具有经济、简便的特点。
1 实验部分萃取均在60~1000mL分液漏斗中进行,在振荡器上振荡5m in,静置分层,取样分析,钪—偶氮氯膦 分光光度法[5]测定,钛、铁测定采用通常方法。
2 实验结果及讨论211 萃取条件的选择21111 萃取剂的选择酸性膦类萃取剂P507对钪具有很好的萃取性能,酸度大时,钪的萃取率有所下降。
钛白水解母液酸度较高,P507不易离解,母液中的硫酸根可能与钪形成配阴离子Sc(SO4)-2, Sc(SO4)3-3等[6],从而影响P507对钪的萃取。
P507经皂化并加入叔胺N7301,从而提高了钪的萃取率,并改善了分相性能,经多次实验,结果表明:P507-N7301-煤油萃取钪萃取率可达9510%以上。
21112 萃取剂用量的选择用废酸液和选定的萃取剂进行不同的相比试验,如图1所示,结果表明O A在1 1~1 5萃取率基本恒定,我们选择相比为1 5。
图1 萃取剂用量的选择 21113 钪的萃取平衡时间的选择用选定的萃取剂,O A=1 5,室温、不同时间钪的萃取率随时间的变化如图2所示,图2 振荡时间与萃取率的关系64稀 土 1997年第18卷第2期Ξ冯彦琳 女 43岁 讲师 山西大学化学系 邮编:030006钪的萃取5m in 已达到平衡。
高中化学考点14 化工流程选择题(解析版)

考点14 化工流程选择题1.(2018课标Ⅰ)硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A. 合理处理废旧电池有利于保护环境和资源再利用B. 从“正极片”中可回收的金属元素有Al、Fe、LiC. “沉淀”反应的金属离子为Fe3+D. 上述流程中可用硫酸钠代替碳酸钠【答案】D【解析】废旧电池中含有重金属,随意排放容易污染环境,因此合理处理废旧电池有利于保护环境和资源再利用,A正确;根据流程的转化可知从正极片中可回收的金属元素有Al、Fe、Li,B正确;得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,因此“沉淀”反应的金属离子是Fe3+,C正确;硫酸锂能溶于水,因此上述流程中不能用硫酸钠代替碳酸钠,D错误。
一定要分析清楚原料的主要成分是什么,含有的杂质有哪些,反应中每一步加入了什么试剂,与哪些物质发生了反应,生成了什么物质,生成的物质在下一步到哪里去了。
1、考查原料的处理:典例1(湖北省黄冈中学2018届高三5月第二次模拟考试)利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。
制备流程图如下:己知:Zn及其化合物的性质与Al及其化合物的性质相似。
下列相关说法错误的是()A.用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层B.调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnOC.由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化D.Fe3O4胶体粒子能用减压过滤法实现固液分离【答案】D【解析】A. NaOH溶液可以洗涤油污、与锌发生反应,故A正确;B. 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧,氢氧化锌分解得到ZnO,故B正确;C. Fe2+易被氧气氧化,故C正确;D. Fe3O4胶体粒子能透过滤纸,无法用减压过滤法实现固液分离,故D错误。
工艺流程
自学阅读大二轮P123
• 1、解题技能 • 2、备考策略 • 3、考点分析
排放物的无 害化处理
题目构成
• 题头介绍 • 流程图示 • 问题设计
• 呈现形式:流程图、表格、图像 • 设问方式:措施、成分、物质、原因 • 能力考查:获取信息的能力、分解问题的
能力、表达能力
• 知识落点:基本理论、元素化合物、实验
解题思路
首先,要粗读试题,尽量弄懂流程图,确定 该流程的目的,但不必将每一种物质都推 出;了解流程图以外的文字描述、表格信 息、后续设问中的提示性信息,并在下一 步分析和解题中随时进行联系和调用 • 其次,再精读试题,根据问题去精心研究 •在答题时应注意: 流程图并思考:从原料到产品依次进行了 •对于比较陌生且复杂的流程图,宏观把握整个 什么反应?利用了什么原理(氧化还原? 流程,不必要把每个环节的原理都搞清楚,针对 溶解度?溶液中的平衡?)。每一步操作 进行到什么程度最佳?每一步除目标物质 问题分析细节。 外还产生了什么杂质或副产物?杂质或副 •前一问回答不了,并不一定会影响回答后面的 产物是怎样除去的? 问题。 • 第三,要看清所问题,不能答非所问,并 注意语言表达的科学性
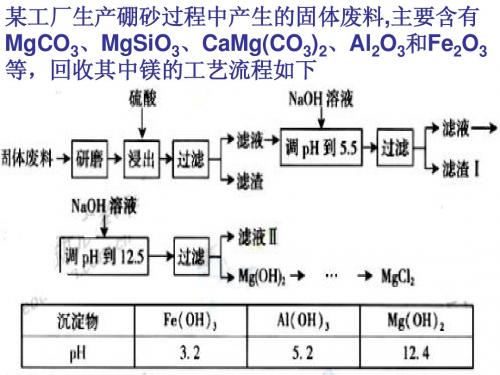
某工厂生产硼砂过程中产生的固体废料,主要含有 MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3 等,回收其中镁的工艺流程如下
(1)“浸出”步骤中,为提高镁的浸出率,可采 取的措施有______(要求写出两条)。 (2)滤渣I的主要成分有_________。 (3)从滤液Ⅱ中可回收利用的主要物质有______
原料
预处理
分离提纯
单一物质
(或其溶液)
目标产品
一.原料:固体混合物;主要成分及杂质 二.预处理:研磨、焙烧(灼烧)、 溶解(酸溶或碱溶) 三.分离提纯:氧化还原反应、沉淀法、 调pH法、电解法、结晶法 四.单一溶质溶液得产品:加热分解法、 结晶法
填空题(13)工艺流程——2022届中考化学二轮复习题型速练

填空题(13)工艺流程——2022届中考化学二轮复习题型速练1.中国首款完全自主知识产权的民用客机C919飞机钛合金用量达9.3%。
工业上利用钛白粉制备海绵钛的工艺流程如下:(1)构成金属钛的微粒是________(填“分子”“原子”或“离子”);钛白粉的主要成分为2TiO ,2TiO 中钛元素的化合价为________。
(2)反应Ⅱ可获得海绵钛,该反应在高温下进行,其化学方程式为________,所属的基本反应类型是________反应。
(3)反应Ⅲ是在熔融状态下电解氯化镁,该反应的化学方程式为________。
(4)该流程中可以循环利用的物质是________。
2.科学家提出了一种“绿色自由”的构想,先把空气吹入碳酸钾溶液中,再把二氧化碳从溶液中提取出来,在合成塔中转化为甲醇(3CH OH )。
具体流程如下: (已知碳酸盐和碳酸氢盐能发生类似如下的反应:()32232CaCO CO H O Ca HCO ++、()33222Ca HCO CaCO CO H O +↑+△)(1)吸收池的作用是_______。
(2)分解池中反应的化学方程式为_______。
(3)在合成塔中,2CO 与2H 反应生成水和甲醇,写出合成塔中反应的化学方程式:_______。
(4)该流程中可以循环利用的物质(水除外)是_______。
(5)如果空气不经过吸收池和分解池,直接通入合成塔,从安全的角度考虑不可行,理由是_______。
3.某工厂的废水中含有4MgSO 和3FeCl ,技术人员逐渐加入NaOH 溶液调节废水的pH ,先后分离出两种沉淀,并通过系列处理得到有价值的产品。
操作流程如下图所示。
(1)固体A 与某酸反应的化学方程式为__________。
(2)实验室在进行操作②时,当__________即可停止加热。
(3)固体B 加热的产物是两种常见氧化物,则另一种氧化物的化学式为__________。
(4)溶液a 除了可能含有NaOH 外,还一定含有的溶质是__________(填化学式)。
2024年中考化学专题复习----化工流程题

2024年中考化学专题复习-化工流程题1.碳酸钡是一种重要的化工产品,某厂用含二氧化硅杂质的碳酸钡原料生产碳酸钡产品,采用了如图所示的工艺流程:(二氧化硅不溶于水也不与盐酸反应)(1)气体X是(用符号表示)。
(2)加入过量的盐酸目的是。
(3)溶液A中的阳离子是。
(4)生成沉淀B的化学方程式。
2.我国科学家成功研发“液态太阳燃料合成”技术,其部分工艺流程如图所示。
分析流程回答问题。
(1)太阳能电池板的作用是将太阳能转化为能。
(2)电解器中发生的化学方程式为:。
(3)氢气作为高能燃料的优点(写出一条即可)3.我国海域辽阔,海洋资源丰富,开发前景十分远大。
利用海洋中的贝壳及食盐可以制得纯碱,请根据下列部分流程图回答问题。
(1)贝壳在煅烧前进行粉碎,目的是。
(2)操作a的名称是。
该操作过程玻璃棒的作用是。
(3)写出NH4Cl的一种用途。
4.为了除去粗盐水中的CaC12、MgCl2、Na2SO4易溶性杂质中的一种或几种,为了提纯粗盐,化学兴趣小组拟用下列试验方案达成实验目的:(1)写出操作的名称。
(2)请分析该粗盐水中含有的易溶性杂质。
(3)NaCl是无机化工生产之母,通电电解饱和氯化钠溶液可以得到氢氧化钠、氢气和氯气(Cl2),写出该反应的化学方程式。
5.学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。
实验一:粗盐提纯(1)操作①中玻璃棒的作用是,操作③的名称为;实验二:溶液配制(2)用氯化钠固体配制100g质量分数为5%的氯化钠溶液,需要氯化钠 g;(3)生理盐水可用于补充人体所需电解质,生理盐水中的溶质为。
6.煤中硫的存在形态分为有机硫和无机硫(CaSO4、硫化物及微量单质硫等)。
库仑滴定法是常用的快速检测煤中全硫含量的方法,其主要过程如下图所示。
(1)煤样需研磨成细小粉末,目的是。
(2)在催化剂作用下,煤在管式炉中充分燃烧,出口气体中主要含有、O2、H2O、N2、SO2。
(3)高温下,煤中的FeS2完全转化为SO2,补全该反应的化学方程式:4FeS2+11O2高温+8SO2。
2024年中考化学二轮专题复习流程题

2024年中考化学二轮专题复习--流程题1.海水素有“液体工业原料”之美誉。
工业“从海水中提取铁”的主要流程如下图。
已知:贝壳的主要成分是碳酸钙。
(1)①中发生反应的化学方程式为,该反应属于(填基本反应类型)。
(2)①中加入的石灰乳应过量,目的是;操作a的名称是。
(3)①中发生反应的化学方程式为。
CO气体,CO2排放(4)该反应生产生石灰的主要原料来源于海洋中的贝壳,优点是。
煅烧贝壳时,会产生2过多可造成的环境问题是。
我国在联合国大会上提出:努力争取在2060年前实现“碳中和”。
请提出一条实现“碳中和”的措施。
2.保护金属资源的有效途径是回收利用。
某电镀厂排放的废液中含有CuSO4、FeSO4和ZnSO4三种溶质,为减少水体污染并节约成本,回收硫酸锌、金属铁和铜。
设计流程如下图所示:(1)流程中四步操作都用到的玻璃仪器是。
(2)操作过程①中加入过量Y,Y是。
(3)试写出滤液b与适量的X发生的化学反应方程式。
(任写一个)3.某工厂用碳酸钙和木头制取氢氧化钾的流程如图所示。
(1)在使用前将木头粉碎,目的是。
(2)操作 a 的名称是 ,写出该操作中使用的一种玻璃仪器: 。
(3)反应①的化学方程式为 。
(4)整个流程中能够循环利用的物质是 。
4.2023兔年春晚武术《演武》按照春夏秋冬四个季节编排,大部分内容都是根据《武僧演武图》壁画来量身打造。
该画采用了炭黑、赭石(主要成分23Fe O ),孔雀石[主要成分(]223Cu OH)CO 等矿物颜料。
实验室现有炭黑和孔雀石的固体混合物,某同学设计了如下探究实验。
(1)研磨是为了 (填“增大”或“减小”)反应物的接触面积,使反应更充分。
(2)溶液A 中的阳离子有 (填符号),气体B 的化学式为 。
(3)矿物颜料用于画作能避免虫蛀的主要原因 ______(填序号)。
A .炭黑有吸附性B .赭石有吸水性C .孔雀石有毒性(4)反应②生成铜分成二步完成,其中发生分解反应的化学方程式为 。
2025届高三化学三轮复习 培优2 工业流程专题+综合练习
培优2 工业流程专题1、海水开发利用的部分过程如图所示。
下列说法错误的是A .向苦卤中通入Cl 2是为了提取溴B .粗盐可采用除杂和重结晶等过程提纯C .工业生产中常选用NaOH 作为沉淀剂D .富集溴一般先用空气和水蒸气吹出单质溴,再用SO 2将其还原吸收2、二氧化钛(2TiO )是一种重要的工业原料,某学习小组由酸性含钛废液(含2TiO +、2Fe +、3Fe +、24SO -)制备2TiO 的主要流程如下,已知23H TiO 不溶于水和硫酸。
下列说法正确的A .加入铁粉时可以加热,温度越高越好B .结晶时可在坩埚中蒸干溶剂获得绿矾C .“洗涤”时先将沉淀转移至烧杯中再加入洗涤剂D .该方法中24H SO 可以循环使用3、以印刷线路板酸性蚀刻废液(含有CuCl 2、FeCl 2、FeCl 3)为原料制备纳米CuO 的流程如图:下列说法错误的是A .“沉淀”产生的CuC 2O 4,不洗涤直接灼烧不影响产品质量B .“在空气中灼烧”时发生了非氧化还原反应C .调节pH 为3.2~4.7的目的是使Fe 3+完全沉淀,Cu 2+不沉淀D .“沉淀”过程中用Na 2C 2O 4代替(NH 4)2C 2O 4,得到的CuC 2O 4中可能混有Cu(OH)24、实验室用NH 4Cl 、盐酸、NaClO 2(亚氯酸钠)为原料,通过以下过程制备ClO 2:①电解时发生反应的化学方程式为 。
②溶液X 中大量存在的阴离子有__________。
NaClO 2与NCl 3反应的化学方程式为_______________________。
③除去ClO 2中的NH 3可选用的试剂是 (填标号)。
a .水b .碱石灰c .浓硫酸d .饱和食盐水5、以含钴废催化剂(主要成分为Co 、Fe 、SiO 2)为原料,制取氧化钴的流程如下:(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是_________________,所得滤渣的主要成分是_________(写化学式)。
高考化学大题

化学工艺流程流程中原料的预处理1.某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:试回答在“浸出”步骤中,为提高镁的浸出率,可采取的措施有____(两条即可)。
2.稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域。
一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如下:已知:废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表所示:成分含量/% Y2O3ZnO Al2O3PbO2MgO预处理前24.28 41.82 7.81 1.67 0.19预处理后68.51 5.42 4.33 5.43 0.50 试回答步骤Ⅰ中进行原料预处理的目的为___________________。
3.硫化镍矿的主要成分是NiS,还含有MgS、FeS、一些不溶性物质等,工业上用硫化镍矿制备金属镍的工艺流程如图所示:(1)硫化镍矿粉磨的目的是__________________。
(2)“酸浸”时,硫化镍与稀盐酸反应的化学方程式为______________。
归纳总结方法目的研磨、雾化将块状或颗粒状的物质磨成粉末或将液体分散成微小液滴,增大反应物接触面积,以加快反应速率或使反应更充分水浸与水接触反应或溶解酸浸与酸接触反应或溶解,使可溶性金属离子进入溶液,不溶物通过过滤除去碱浸除去油污,溶解酸性氧化物、铝及其氧化物灼烧除去可燃性杂质或使原料初步转化,如从海带中提取碘时的灼烧就是为了除去可燃性杂质煅烧改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解,如煅烧高岭土流程中反应条件的控制1.碳酸锂(相对分子质量为74)广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业。
制备流程如图。
已知:碳酸锂的溶解度见下表。
温度/℃0 10 20 30 40 50 60 80 100Li2CO3溶解度/ (g·L-1)1.54 1.43 1.33 1.25 1.17 1.08 1.01 0.85 0.72(1)硫酸化焙烧反应温度控制在250~300 ℃,主要原因是________________;同时,硫酸用量为理论耗酸量的115%左右,硫酸如果加入过多则________(填字母)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸法生产钛白所产废酸浸取铂钯矿浸出液中镁和铁的回收孙力军,胡显智,谢海云,刘殿文,张文彬(昆明理工大学,云南昆明 650093)摘要: 用硫酸法钛白生产的废酸作浸取剂浸取某铂钯矿时,浸出液中Fe 2+含量高达40~50g/L ,Cr 3+、Mn 2+、TiO 32+等杂质含量也高达每升数克,使浸出液综合回收的难度增大。
试验证明:用黄铵铁矾法能够很好地实现除铁和铁镁分离。
比其它方法能够制得质量更好的铁红,而含镁溶液经过这一步净化以后,采用混沉镁剂,可成功地沉镁,并制取优质的轻质氧化镁。
关键词: 钛白;废酸;浸取剂;铁红;轻质氧化镁中图分类号:TF11113,TF12311+2 文献标识码:A 文章编号:1007-7545(2004)02-0037-02R ecovery of Magnesium and Iron from Leaching Solution of Pt 2Pd Orewith the W aste Sulf uric Acid Discharged from Titanium WhiteSUN Li 2jun ,HU Xian 2zhi ,XIE Hai 2yun ,L IU Dian 2wen ,ZHAN G Wen 2bin(Kunming University of Science and Technology ,Kunming 650093,China )Abstract : In the process of leaching the platinum -palladium ore with the waste sulfuric acid as leaching a 2gent ,a majority of the Mg and Fe contained in the ore is leached into solution 1The recovery of Mg and Fe from the solution ,however ,has proved very difficult due to the complication in composition ,with Fe 2+being as high as 40~50g/L ,and Cr 3+,Mn 2+,TiO 32+in the order of g/L in the solution 1The test results shown that the removal of Fe and the separation of Fe from Mg can be successfully realized by jarosite process ,and the iron red obtained can be in a better quality 1A high quality light magnesium oxide can be produced from the Mg 2contain 2ing solution ,after which being further purified by using mixed magnesium precipitant 1K eyw ords : Titanium white ;Waste acid ;Leaching agent ;Iron oxide ;Light magnesium oxide基金项目:云南省教育厅重点项目(9912086)作者简介:孙力军(1956-),女,重庆市人,教授 在文献1中,作者对硫酸法生产钛白废酸的性质以及利用该废硫酸浸出某铂钯矿的效果作了介绍。
用废酸浸取铂钯矿所得浸出液的特点是Fe 2+、Cr 3+、Mn 2+和TiO 32+等杂质含量高,这与用新酸浸出时有很大的不同。
因此,在镁、铁回收技术和工艺上必须进行调整。
本文介绍从浸取液中回收铁和镁的技术和试验结果。
1 浸出液中铁和镁的回收111 浸出液中铁的回收在试验研究中曾先采用Fe 3+水解法分离浸出液中的铁和镁并回收铁。
试验流程为:先用氧化剂将Fe 2+氧化成Fe 3+,然后用氨水调节p H 值至5~6,此时Fe 3+就形成Fe 2O 3・nH 2O 凝胶。
整个过程都在水浴(93℃左右)中进行。
氧化剂及氨水均采用在搅拌下的滴加方式。
再对所形成的Fe 2O 3・nH 2O 凝胶进行过滤、洗涤、滤饼经过110℃左右烘干、800℃煅烧2h 即得铁红。
试验发现按照此法回收浸出液中的铁存在一些问题:Fe 2O 3・nH 2O 凝胶聚沉缓慢,过滤较为困难;由于Fe2O3・nH2O的胶体性质,沉铁过程中浸出液中部分MgSO4被夹带入Fe2O3・nH2O胶体中,导致Mg的损失;也正是由于这种夹带导致所产铁红产品的主含量α2Fe2O3较低。
考虑到采用上述办法分离Fe、Mg产业化可能难以实现,经过反复探索改用黄铵铁矾法除铁。
结果表明,采用该法除铁效果好。
黄铵铁矾属难溶性结晶物质,其生成化学反应为:3Fe2(SO4)3+6H2O=6Fe(OH)SO4+3H2SO4(1)4Fe(OH)SO4+4H2O=2Fe2(OH)4SO4+ 2H2SO4(2) 2Fe(OH)SO4+2Fe2(OH)4SO4+2N H3・H2O= (N H4)2Fe6(SO4)4(OH)12(3)上述三个反应方程式相加即得黄铵铁矾法除铁的总反应:3Fe2(SO4)3+10H2O+2N H3・H2O=(N H4)2Fe6(SO4)4(OH)12+5H2SO4(4)用此方法所得黄铵铁矾沉淀易于过滤。
滤饼用少量水洗涤后取下于110℃烘干,然后于800℃左右燃烧2h,燃烧所得粗制铁红用5%稀酸洗涤烘干后,即为铁红产品。
铁红产品就其主含量而言明显高于水解法所制铁红。
比较结果见表1。
表1 不同方法制备的铁红α2Fe2O3含量对比T able1 Content ofα2Fe2O3in iron redobtained by different processes编号铁红制备方法α2Fe2O3/%1Fe3+水解法771402Fe3+水解法681163Fe3+水解法721924黄铵铁矾法88126112 浸出液中镁的回收浸出液经过Fe、Mg分离后的滤液中主要是粗制MgSO4,但其中仍有一定量的Cr3+、Mn2+等杂质。
多次滤液分析结果表明,Cr3+含量在015g/L 左右,而Mn2+含量往往高达1g/L以上。
这些杂质在沉Mg前必须除去,否则会影响最终Mg产品———轻质氧化镁的质量。
净化上述粗制MgSO4溶液的方法是采用一定量的氧化剂将Mn2+氧化成MnO2,同时,用N H3・H2O调节体系p H值至7左右,这样即可将Mn2+及Cr3+以沉淀方式去除,滤除上述沉淀(量少)后的滤液即为纯净的MgSO4溶液。
将上述纯净的MgSO4溶液置于93℃左右水浴中,搅拌下以细流方式加入计量的沉镁剂,加完后继续搅拌10min,然后停止搅拌,继续热解30min后取出,冷却至室温过滤,滤饼(即碱式碳酸镁)用蒸馏水洗涤至洗液中无SO42-为止。
滤饼于110℃左右烘干后置于箱式电阻炉内于700℃下燃烧2~3h即得轻质氧化镁。
为了降低成本,沉镁剂采用混沉镁剂,加入量按Mg2+所需量的120%加入。
净化后的MgSO4溶液经过上述中和沉淀后的残液Mg2+浓度<l g/L,中和沉镁过程镁收率可达90%以上。
铂钯矿中MgO经上述钛白废酸浸出———除铁———净化———沉镁———烘干———煅烧制备轻质氧化镁,MgO 的总的收率达70%以上。
上述所制轻质氧化镁经云南省化工产品质量监督检验站检验,达到一等品质量标准(HG/T2573—94),结果见表2。
表2 轻质氧化镁检验结果T able2 Analysis of light magnesium oxide检验项目一等品标准检验结果单项判定氧化镁(以MgO计)/%≥93109615合格氧化钙(以CaO计)/%≤115015合格盐酸不溶物/%≤01200102合格筛余物(150μm试验筛)/%≤01050101合格铁(Fe)含量/%≤01060101合格锰(Mn)含量/%≤01010合格氯化物(以Cl计)含量/%≤0110010043合格灼烧失量/%≤510016合格堆积密度/(g・mL-1)≤01200120合格2 从沉镁余液中回收硫酸铵上述沉镁余液中主要成分为(N H4)2SO4。
该溶液经蒸发浓缩后可结晶析出白色晶体硫酸铵。
该晶体过滤并用少量水淋洗后即得(N H4)2SO4。
所制(N H4)2SO4为白色粒状结晶。
经检测,(N H4)2SO4晶体中N含量可达17173%,如果将此晶体再进行重结晶则可制备高质量的硫酸铵。
回收(N H4)2SO4后的滤液及洗液,无色清亮透明,p H值为7~8,可直接排放。
3 结论(1)用废酸浸出某铂钯矿时,所得浸出液杂质含量高,给镁和铁的回收带来新的困难;(2)用黄铵铁矾法除铁,可圆满地实现镁铁分离,并可进一步制取质量较好的铁红产品;(3)经过除铁的浸出液,再进一步除Mn2+、Cr3+以后,可用混沉镁剂有效地回收镁,并制取优质的轻质氧化镁;(下转第43页)3 结论铝合金中添加稀土元素可以有效提高所得铝合金的强度。
稀土的种类及添加量等对所得稀土合金的强度影响较大。
用熔体发泡法制备泡沫铝时,添加合金增黏剂可得气孔率较大的稀土泡沫合金。
增黏剂、发泡剂种类及用量、发泡剂微粒的大小等对所得稀土泡沫合金的气孔率影响较大。
要获得均匀的孔结构,控制熔体黏度是关键。
参考文献[1]张勇,赵增典,杨思一1新型泡沫铝材料的性能研究[J]1铸造,1998(3):10[2]何德坪,马立群,余兴泉1新型通孔泡沫铝的传热特性[J]1材料研究学报,1997,11(4):431[3]马立群,何德坪1新型泡沫铝材料的制备及其孔结构的控制[J].材料研究学报,1994,8(1):11[4]王录才,柴跃生,张淡,等1预热温度对泡沫铝成形影响的研究与分析[J]1铸造设备研究,2000(1):41[5]赵玉园1制备泡沫铝的一种新方法:烧结溶解法[J]1世界科技研究与发展,2003(2):66[6]吴春山1新型材料———泡沫铝[J]1世界有色金属1995,25(1):30(上接第38页)(4)上述余液,尚可制取结晶硫酸铵,进一步提高经济效益;(5)用钛白废酸浸取某铂钯矿及浸出液综合利用工艺,流程畅通,无设备难关,易于实现产业化,整个工艺不产生新的废渣、废气,尾水可达标排放。
致谢:本文得到攀钢钛业公司支持,特表谢意。
参考文献[1]孙力军,胡显智,谢海云,等1硫酸法生产钛白所产废酸浸出某铂钯矿石的研究[J]1有色金属(冶炼部分),2004(1):2[2]葛龙桂,徐杰1钛白废酸中硫酸亚铁的分离及废酸回收[J]1化工环保,1989,9(3),141[3]王家琪,刘兴运1利用钛白废流酸生产工业硫酸锰[J]1化工环保,1993(13):[4]张玉林1钛白废酸用于硫酸铝生产[J]1无机盐工业,1993(4),37[5]胡显智1高镁矿石酸浸降镁及浸出液综合利用[D]1云南昆明:昆明理工大学博士论文,2001。
