上海交通大学无机化学课件第十一章配位化学物2.ppt
合集下载
无机化学配合物课件

-
4
配位化合物与简单化合物的本质区别是分子中含有配 位键。
通常把一定数目的阴离子或中性分子与阳离子或原子 以配位键所形成的复杂分子或离子称为配位单元,含 有配位单元的化合物称为配合物。
配位单元可以是中性分子,也可以是带电荷的离子。 不带电荷的配位单元也称配位分子,配位分子本身就 是配合物。带电荷的配位单元称为配离子,其中带正 电荷的配离子称为配阳离子,带负电荷的配位单元称 为配阴离子。
如[Ag(NH3)]+ 、Fe(CO)5、HCo(CO)4, [SiF6]2+
-
8
(三)配体和配位原子
在配位单元中,与中心原子形成配位键的阴离子 或分子称为配体,配体中提供孤对电子的原子称为配 位原子。配位原子的最外电子层中都含有孤对电子, 一般常见的配位原子是电负性较大的非金属元素的原 子或离子。
将CoCl3.6NH3溶于水,加入Ag+能检查出AgCl,而且 AgCl的量正好等于其中Cl-的总量,证明化合物Cl-是自 由的。
化合物NH3含量高,但水溶液呈中性,加OH-,无NH3放 出,加入CO32-检查不出Co3+,证明Co3+和NH3已形成配 合物[Co(NH3)6]3+ ,而且一定程度上丧失了Co3+和NH3各 自独立存在时的化学性质。
影响中心原子配位数的主要因素:
-
11
(1)中心原子的价电子层结构:第二周期元素的价电
子层最多只能容纳 4对电子,其配位数最大为 4,第三
周期及以后的元素,其配位数常为4,6 。
(2)空间效应:中心原子的体积越大,配体的体积越
小时,中心原子能结合的配体越多,配位数也就越大。
如[BF4]-、[AlF6]3- ;如[AlF6]3-,[AlCl4]-。 (3)静电作用:中心原子的电荷越多,对配体的吸引
有机化学课件:第11章 配位化合物
(可形成两个及两个以上的配位键)
如: 乙二胺 H2NCH2CH2NH2
(en)
二基配体
乙二胺四乙酸
(HOOCCH2)2 NCH2CH2N (CH2COOH)2 (EDTA)
六基配体
多基配体和螯合物 单基配体:只有一个配位原子的配体(NH3,H2O); 双基配体:含有二个配位原子的配体 (C2O42- ,en)等; 多基配体:含有多个配位原子的配体 (EDTA)。
配体的命名顺序为:
罗马数字
先无机配体,后有机配体;先阴离子,后中性分子。
若配体均为阴离子或中性分子时,可按配位原 子元素符号英文字母顺序排列。
如: en 、H2O NH3、H2O
先 H2O 后 en 先 NH3 后 H2O
[CoCl2(NH3)2(H2O)2]Cl 氯化二氯·二氨·二水合钴(Ⅲ) 复杂配体均加括号
胺
H2C H2N
NH2 CH2 2
Cu
H2C H2N
NH2 CH2
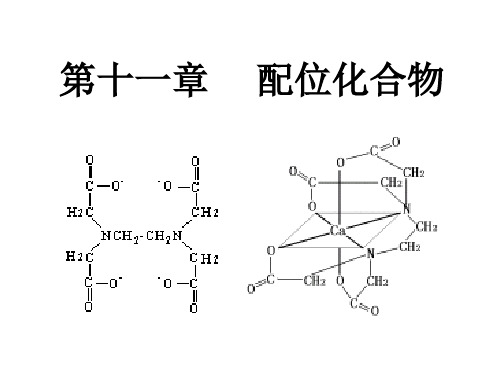
由中心原子与多齿配 体形成的环状配合物 称为螯合物
形成的环 以5元环 和 6元环稳定
常见的多齿配体:乙二胺四乙酸(EDTA)
HOOCH2C
CH2COOH
NCH2-CH2N
HOOCH2C
CH2COOH
[Ca(edta)]2
5个 5元环
几何异构 光学异构
电离异构
[CoSO4(NH3)5]Br [CoBr(NH3)5]SO4
水合异构
[Cr(H2O)6]Cl3 [CrCl(H2O)5]Cl2·H2O [CrCl2(H2O)4]Cl·2H2O [CrCl3(H2O)3]·3H2O
配位异构
[Co(NH3) 6][Cr(C2O4)3] Cr (NH3) 6][Co (C2O4)3]
如: 乙二胺 H2NCH2CH2NH2
(en)
二基配体
乙二胺四乙酸
(HOOCCH2)2 NCH2CH2N (CH2COOH)2 (EDTA)
六基配体
多基配体和螯合物 单基配体:只有一个配位原子的配体(NH3,H2O); 双基配体:含有二个配位原子的配体 (C2O42- ,en)等; 多基配体:含有多个配位原子的配体 (EDTA)。
配体的命名顺序为:
罗马数字
先无机配体,后有机配体;先阴离子,后中性分子。
若配体均为阴离子或中性分子时,可按配位原 子元素符号英文字母顺序排列。
如: en 、H2O NH3、H2O
先 H2O 后 en 先 NH3 后 H2O
[CoCl2(NH3)2(H2O)2]Cl 氯化二氯·二氨·二水合钴(Ⅲ) 复杂配体均加括号
胺
H2C H2N
NH2 CH2 2
Cu
H2C H2N
NH2 CH2
由中心原子与多齿配 体形成的环状配合物 称为螯合物
形成的环 以5元环 和 6元环稳定
常见的多齿配体:乙二胺四乙酸(EDTA)
HOOCH2C
CH2COOH
NCH2-CH2N
HOOCH2C
CH2COOH
[Ca(edta)]2
5个 5元环
几何异构 光学异构
电离异构
[CoSO4(NH3)5]Br [CoBr(NH3)5]SO4
水合异构
[Cr(H2O)6]Cl3 [CrCl(H2O)5]Cl2·H2O [CrCl2(H2O)4]Cl·2H2O [CrCl3(H2O)3]·3H2O
配位异构
[Co(NH3) 6][Cr(C2O4)3] Cr (NH3) 6][Co (C2O4)3]
无机化学 配位化合物 ppt课件

配合物与我们的生命活动息息相关。人体中 的酶、微量元素等,都是以配合物的形式存在并 控制着体内极其重要的化学作用。
人体必需的微量元 素:锌、碘、硒、 铜、氟、钼、镉、 镍、钒、锡、砷、
酶 钴、锰、锶等。
临床使用的药物中配合物相当普遍
顺铂
含钴维生素B12
枸橼酸钠
再如体内氧气的存储与运输,也是借助于 血红素与氧分子的配合来完成的。
[Cu(NH3)4] SO4
中心 原子
配体
H3N
Cu
H3N
NH3SBiblioteka 4NH3配位单元,或内界
外界
书1.总写体时来,说内配界合用物方是括由号配框位住单,元是(配内合界物)和 的与核内心界部带分相,反方电括荷号的以外外界的两部大分部为分外组界成。
H3N
Cu
H3N
NH3
SO4
NH3
内界(正/负电荷) 外界(负/正电荷)
获1913年诺贝尔化学奖
1893年苏黎世大学维尔纳 (Werner A)教授对这类化 合物本性提出了天才见解, 被后人称为维尔纳配位学 说,成为配位化学的奠基 人。维尔纳因此而获得 1913年诺贝尔化学奖。
维尔纳 (Werner, A, 1866-1919)
配位化学的奠基人—维尔纳
配位化学是当今化学学科的前沿领域之一, 配合物在医疗、药物、分离分析、染料、化学合 成等诸多方面具有极为广泛的应用。
具体问题具体分析!
单齿配体:配位数=配体的数目
[Co(NH3)6]3+
CO与铁的配位能力是氧气的200-300倍,
极易形成碳氧血红蛋白,使血红素丧失携氧能 力碳,氧而血造红成蛋组织白窒息,甚至引起死亡。
• CO浓度>30mg/m3
无机化学课件第十一章

I2(g) + H2(g) 催化剂,Δ 2 HI(g)
3. 存在、分离、性质
氟广泛存在于自然界 萤石(CaF2) 冰晶石(Na3AlF6) 氟磷灰石(Ca3(PO4)2CaCFCl)2
氯: 主要以海水和内地盐湖中的NaCl形式存在
溴,碘:以Na,K,Mg的无机盐形 式存在于海水中
分离:从卤化物中分离卤素单质
2 P(s) + 3 Br2(g) 2 P(s) + 5 I2(g)
2 PBr3(l) 2 PCl3(s)
(无色发烟) (红色)
与 H2 的反应 在低温下,暗处,F2 可与 H2 发生剧烈反应,放出大
量热,导致爆炸。
F2(g) + H2(g)
2 HF(g)
Cl2 在常温下与H2 缓慢反应, 但在紫外光照射下,可
1.强氧化性 F ,Cl ,Br ,I 能力依次减弱
2
2 22
2.与单质作用
F2 在任何温度下都可与金属直接化合,生成高价氟 化物。F2 与 Cu、Ni、Mg 作用时由于金属表面生成一层 致密氟化物保护膜而中止反应。所以 F2 可储存在 Cu、 Ni、Mg 或合金制成的容器中。
Cl2 可与各种金属作用,但干燥的 Cl2 不与 Fe 反应, 因此,Cl2 可储存在铁罐中。
烈。
2 S(s) + Cl2(g)
S2Cl2(l)
(红黄色液体)
S(s) + Cl2(g)(过量)
SCl2(l) (深红色发烟液体)
2 P(s) + 3 Cl2(g)
2 PCl3(l) (无色发烟液体)
2 P(s) + 5 Cl2(g)(过量)
2 PCl5(s) (淡黄色固体)
3. 存在、分离、性质
氟广泛存在于自然界 萤石(CaF2) 冰晶石(Na3AlF6) 氟磷灰石(Ca3(PO4)2CaCFCl)2
氯: 主要以海水和内地盐湖中的NaCl形式存在
溴,碘:以Na,K,Mg的无机盐形 式存在于海水中
分离:从卤化物中分离卤素单质
2 P(s) + 3 Br2(g) 2 P(s) + 5 I2(g)
2 PBr3(l) 2 PCl3(s)
(无色发烟) (红色)
与 H2 的反应 在低温下,暗处,F2 可与 H2 发生剧烈反应,放出大
量热,导致爆炸。
F2(g) + H2(g)
2 HF(g)
Cl2 在常温下与H2 缓慢反应, 但在紫外光照射下,可
1.强氧化性 F ,Cl ,Br ,I 能力依次减弱
2
2 22
2.与单质作用
F2 在任何温度下都可与金属直接化合,生成高价氟 化物。F2 与 Cu、Ni、Mg 作用时由于金属表面生成一层 致密氟化物保护膜而中止反应。所以 F2 可储存在 Cu、 Ni、Mg 或合金制成的容器中。
Cl2 可与各种金属作用,但干燥的 Cl2 不与 Fe 反应, 因此,Cl2 可储存在铁罐中。
烈。
2 S(s) + Cl2(g)
S2Cl2(l)
(红黄色液体)
S(s) + Cl2(g)(过量)
SCl2(l) (深红色发烟液体)
2 P(s) + 3 Cl2(g)
2 PCl3(l) (无色发烟液体)
2 P(s) + 5 Cl2(g)(过量)
2 PCl5(s) (淡黄色固体)
无机化学第十一章

(二)中心原子
中心原子位于配位个体的中心位置,是配位 个体的核心部分。中心原子一般是金属离子,特 别是副族元素的离子;某些副族元素的原子和高 氧化值的非金属元素的原子也可以作中心原子。
无机化学第十一章
(三)配体和配位原子
在配位个体中,与中心原子结合的阴离子或 分子称为配体。配体中直接与中心原子相结合的 原子称为配位原子。
为 d 轨道。
无机化学第十一章
图 11-2 正八面无机体化学负第十电一场章 对中心原子 d 轨道的影响
图 11-3 中心原子的 d 轨道在正八面体 负电场中的分裂
无机化学第十一章
在晶体场中,分裂后能量最高的 d 轨道与能 量最低的 d 轨道之间的能量差称为晶体场分裂能。
中心原子由场强相等的球形负电场转入八面 体负电场中,中心原子的 d 轨道发生能级分裂。 d 轨道在分裂前后的总能量应保持不变,以球形 负电场中 d 轨道的能量为比较标准,则有:
无机化学第十一章
(1)无机配体在前,有机配体在后。 (2)在无机配体或有机配体中,先列出阴离子, 后列出中性分子。 (3)在同类配体中,按配位原子的元素符号的英 文字母顺序排列。 (4)在同类配体中,若配位原子相同,则将含较 少原子数的配体排在前面,较多原子数的配体列后。 (5)在同类配体中,若配位原子相同,配体中含 原子的数目也相同,则按结构式中与配位原子相连的 原子的元素符号的英文字母顺序排列。
无机化学第十一章
(五)配位个体的电荷数
配位个体的电荷数,等于中心原子和配体的 电荷数的代数和。
由于配合物是电中性的,可根据外界离子的 电荷数来确定配位个体的电荷数。
无机化学第十一章
三、配位化合物的命名
配合物的命名,关键在于配位个体的命名。 对配位个体命名时,配体名称写在中心原子名 称之前,二者之间用“合”字联系。配体的数目用 倍数词头二、三、四……表示,并写在配体名称之前; 中心原子的氧化值用带括号的罗马数字表示,写在 中心原子名称后面。配位个体的命名顺序为: 倍数词头→配体名称→合→中心原子名称→(氧化值) 对于较复杂的配体,倍数词头所标配体名称应写 在括号内,读时在数词后加“个”字。 如果配体不止一种,则不同配体名称之间用符号 “ ·” 分开,配体名称列出顺序为:
中心原子位于配位个体的中心位置,是配位 个体的核心部分。中心原子一般是金属离子,特 别是副族元素的离子;某些副族元素的原子和高 氧化值的非金属元素的原子也可以作中心原子。
无机化学第十一章
(三)配体和配位原子
在配位个体中,与中心原子结合的阴离子或 分子称为配体。配体中直接与中心原子相结合的 原子称为配位原子。
为 d 轨道。
无机化学第十一章
图 11-2 正八面无机体化学负第十电一场章 对中心原子 d 轨道的影响
图 11-3 中心原子的 d 轨道在正八面体 负电场中的分裂
无机化学第十一章
在晶体场中,分裂后能量最高的 d 轨道与能 量最低的 d 轨道之间的能量差称为晶体场分裂能。
中心原子由场强相等的球形负电场转入八面 体负电场中,中心原子的 d 轨道发生能级分裂。 d 轨道在分裂前后的总能量应保持不变,以球形 负电场中 d 轨道的能量为比较标准,则有:
无机化学第十一章
(1)无机配体在前,有机配体在后。 (2)在无机配体或有机配体中,先列出阴离子, 后列出中性分子。 (3)在同类配体中,按配位原子的元素符号的英 文字母顺序排列。 (4)在同类配体中,若配位原子相同,则将含较 少原子数的配体排在前面,较多原子数的配体列后。 (5)在同类配体中,若配位原子相同,配体中含 原子的数目也相同,则按结构式中与配位原子相连的 原子的元素符号的英文字母顺序排列。
无机化学第十一章
(五)配位个体的电荷数
配位个体的电荷数,等于中心原子和配体的 电荷数的代数和。
由于配合物是电中性的,可根据外界离子的 电荷数来确定配位个体的电荷数。
无机化学第十一章
三、配位化合物的命名
配合物的命名,关键在于配位个体的命名。 对配位个体命名时,配体名称写在中心原子名 称之前,二者之间用“合”字联系。配体的数目用 倍数词头二、三、四……表示,并写在配体名称之前; 中心原子的氧化值用带括号的罗马数字表示,写在 中心原子名称后面。配位个体的命名顺序为: 倍数词头→配体名称→合→中心原子名称→(氧化值) 对于较复杂的配体,倍数词头所标配体名称应写 在括号内,读时在数词后加“个”字。 如果配体不止一种,则不同配体名称之间用符号 “ ·” 分开,配体名称列出顺序为:
大学一年级无机化学PPT课件-第十一章-配合化合物

[CoF6]3- t2g4eg2 CFSE = 4×(-4Dq) + 2×6Dq = -4Dq
[Co(CN)6]3-的CFSE =? 强场, t2g6eg0
CFSE = 6×(-4Dq) + 2P = -24Dq + 2P 通式:CFSE = (-4n1+6n2)Dq + (m1-m2)P 式中m1为八面体场中d 轨道中的成对电子数,
m2为球形体场中d轨道中的成对电子数。
八面体场的CFSE
dn
弱场
强场
构型 电子对数 CFSE 构型 电子对数
m1 m2
m1 m2
d1
t21g
0
0
-4Dq
t
1 2g
00
d2
t22g
0
0
-8Dq
t
2 2g
00
d3
t23g
0
0
-12Dq
t
3 2g
00
d4 t23geg1
0
0
-6 Dq
t
4 2g
10
d5
t
况不同,且Δ值也不同。
Δt < Δo < Δsquare planer
4. 高自旋与低自旋配合物及其d 电子分布 排布原则:①最低能量原理 ②Hund规则 ③Pauli不相容原理
电子成对能(P): 两个电子进入同一轨道时需要消耗的能量。 强场:o > P 弱场:o < P
八面体场中电子在t2g和eg轨道中的分布
3 2g
eg2
0
0 0 Dq t25g
20
d6
t
4 2g
eg2
1
1
-4 Dq
[Co(CN)6]3-的CFSE =? 强场, t2g6eg0
CFSE = 6×(-4Dq) + 2P = -24Dq + 2P 通式:CFSE = (-4n1+6n2)Dq + (m1-m2)P 式中m1为八面体场中d 轨道中的成对电子数,
m2为球形体场中d轨道中的成对电子数。
八面体场的CFSE
dn
弱场
强场
构型 电子对数 CFSE 构型 电子对数
m1 m2
m1 m2
d1
t21g
0
0
-4Dq
t
1 2g
00
d2
t22g
0
0
-8Dq
t
2 2g
00
d3
t23g
0
0
-12Dq
t
3 2g
00
d4 t23geg1
0
0
-6 Dq
t
4 2g
10
d5
t
况不同,且Δ值也不同。
Δt < Δo < Δsquare planer
4. 高自旋与低自旋配合物及其d 电子分布 排布原则:①最低能量原理 ②Hund规则 ③Pauli不相容原理
电子成对能(P): 两个电子进入同一轨道时需要消耗的能量。 强场:o > P 弱场:o < P
八面体场中电子在t2g和eg轨道中的分布
3 2g
eg2
0
0 0 Dq t25g
20
d6
t
4 2g
eg2
1
1
-4 Dq
《大学化学教学课件》11配位化合物

配位化合物合成过程中可能存在有毒有害物质,操作时应 佩戴个人防护用品,如实验服、化学防护眼镜、化学防护 手套等。
试剂管理
严格管理化学试剂,避免交叉污染和意外事故发生。
实验环境
保持实验室内空气流通,避免长时间吸入有害气体。
操作规范
遵循实验操作规程,正确使用实验器具,避免发生意外事 故。
05
配位化合物的发展趋势与 展望
《大学化学教学课件》 11配位化合物
目录
• 配位化合物的定义与特性 • 配位化合物的组成与分类 • 配位化合物的结构与性质
目录
• 配位化合物的合成与制备 • 配位化合物的发展趋势与展望 • 配位化合物的教学策略与建议
01
配位化合物的定义与特性
定义
01
02
03
配位化合物
是由中心原子或离子与配 位体通过配位键结合形成 的复杂化合物。
06
配位化合物的教学策略与 建议
教学策略
实例解析
通过具体的配位化合物实例,如二氯二氨合铂(II)酸钾,来解析 配位化合物的组成、结构和性质。
实验辅助
设计实验,让学生通过观察实验现象,理解配位化合物的性质和 反应机理。
互动讨论
组织学生进行小组讨论,引导学生主动思考和交流,提高课堂互 动性。
教学建议
磁性和导电性
一些配位化合物具有特殊的磁性 和导电性,这些性质可用于研究 配位化合物的结构和性质。
配位化合物的应用
催化剂
许多配位化合物可用作催化剂,如过渡金属配合物在烯烃的聚合 反应中用作催化剂。
药物
一些配位化合物可用作药物,如一些含过渡金属的配合物具有抗癌 活性。
颜料和染料
一些配位化合物可用作颜料和染料,如许多过渡金属的配合物具有 鲜艳的颜色,可用于染色和涂料。
试剂管理
严格管理化学试剂,避免交叉污染和意外事故发生。
实验环境
保持实验室内空气流通,避免长时间吸入有害气体。
操作规范
遵循实验操作规程,正确使用实验器具,避免发生意外事 故。
05
配位化合物的发展趋势与 展望
《大学化学教学课件》 11配位化合物
目录
• 配位化合物的定义与特性 • 配位化合物的组成与分类 • 配位化合物的结构与性质
目录
• 配位化合物的合成与制备 • 配位化合物的发展趋势与展望 • 配位化合物的教学策略与建议
01
配位化合物的定义与特性
定义
01
02
03
配位化合物
是由中心原子或离子与配 位体通过配位键结合形成 的复杂化合物。
06
配位化合物的教学策略与 建议
教学策略
实例解析
通过具体的配位化合物实例,如二氯二氨合铂(II)酸钾,来解析 配位化合物的组成、结构和性质。
实验辅助
设计实验,让学生通过观察实验现象,理解配位化合物的性质和 反应机理。
互动讨论
组织学生进行小组讨论,引导学生主动思考和交流,提高课堂互 动性。
教学建议
磁性和导电性
一些配位化合物具有特殊的磁性 和导电性,这些性质可用于研究 配位化合物的结构和性质。
配位化合物的应用
催化剂
许多配位化合物可用作催化剂,如过渡金属配合物在烯烃的聚合 反应中用作催化剂。
药物
一些配位化合物可用作药物,如一些含过渡金属的配合物具有抗癌 活性。
颜料和染料
一些配位化合物可用作颜料和染料,如许多过渡金属的配合物具有 鲜艳的颜色,可用于染色和涂料。
大学无机化学课件第十一章配位化学物2.ppt

交界酸
交界碱
Fe2+,Co2+,Ni2+,Cu2+,Zn2+
Br-,NO2-
配位体的影响
• 配位体的电负性: 配位原子的电负性越大,其越易与硬酸形成电价 键形式的配位化合物;
• 配位体的碱性: 配位体的碱性大,根据路易斯酸碱理论,越容易 给出电子对,形成共价键形式的配位化合物;
• 配位体的空间效应: 成环(5、6员环),1:1,配位体分子较小不互 相排斥则稳定。
• 稳定化能(CFSE)的特点:
一份额外的能量降低效应; 一个相对的数值,CFSE=10Dq (Δo);
• 在八面体场中,稳定化能的计算方法:
△o=Eeg-Et2g=10Dq 4Eeg+6Et2g=0 Eeg=6Dq Et2g=- 4Dq
不同晶体场的能量关系
• △t=4/9 △o; • △s=1.72 △o; • △的大小: △s> △o> △t; • 不同晶体场的轨道次序(eg,t2g); • 不同晶体场的d轨道能量——均与分裂能的相对
-d--x2y-2--d z2eg
△o
-d-x-y ---d yz --- d xz
八面体场中的d轨道 t2g
四面体场d轨道的分裂
四面体场d轨道的分裂
d轨道的不同分裂
Ni(H2O)6在八面体场中电子排布
d8电子
填完第三个电子 以后,第四个电 子填在哪里?
高自旋、低自旋的排布--3d4
3d5
软酸
软碱
与CN–成配合物稳定
常见的软硬酸碱
硬酸
Al 3+,Ca 2+,Mg 2+ , Fe3+,Cr3+,Co3+,Ti4+等
无机化学教学11章.配位化合物PPT课件

制造发光材料和显示器。
电池材料
一些配位化合物可作为电池材料, 如镍镉电池中的镉离子和镍离子
形成的配位化合物。
05
配位化合物与配合物之间的 关系
配位化合物的形成条件
配位化合物的形成需要一个中心 原子(通常为金属)和几个配位 体分子或离子,通过配位键结合。
中心原子必须有空轨道,可以接 受电子对,而配位体则提供孤对
配位化合物的颜色变化是由于电子跃迁所引起的。
详细描述
配位化合物的颜色变化是由于其组成配体和中心金属的电子跃迁所引起的。不 同的配体和金属元素会产生不同的颜色,因此可以通过观察颜色来判断配位化 合物的组成和结构。
磁性
总结词
配位化合物的磁性主要取决于其组成的金属离子和配体的性质。
详细描述
一些配位化合物具有明显的磁性,这与其组成和结构密切相关。一般来说,含有铁、钴、镍等过渡金属的配位化 合物具有明显的磁性。此外,配体的性质和配位化合物的结构也会影响其磁性。了解配位化合物的磁性对于其在 化学、物理和材料科学等领域的应用具有重要意义。
配位体
提供孤对电子与中心原子 或离子形成配位键的分子 或离子。
特性
稳定性
配位化合物具有较高的稳定性 ,主要由于配位键的形成使得
整个分子更加稳定。
多样性
配位化合物的种类繁多,可以由 不同的中心原子、配位体和配位 数组成,形成各种不同的结构。
可预测性
根据中心原子和配位体的性质 ,可以预测配位化合物的性质 和稳定性。
诊断成像
生物分析
配位化合物可用于检测生物体内的金 属离子和蛋白质等生物分子的含量和 活性。
配位化合物可用于医学影像技术,如 核磁共振成像和X射线造影剂。
在材料科学上的应用
电池材料
一些配位化合物可作为电池材料, 如镍镉电池中的镉离子和镍离子
形成的配位化合物。
05
配位化合物与配合物之间的 关系
配位化合物的形成条件
配位化合物的形成需要一个中心 原子(通常为金属)和几个配位 体分子或离子,通过配位键结合。
中心原子必须有空轨道,可以接 受电子对,而配位体则提供孤对
配位化合物的颜色变化是由于电子跃迁所引起的。
详细描述
配位化合物的颜色变化是由于其组成配体和中心金属的电子跃迁所引起的。不 同的配体和金属元素会产生不同的颜色,因此可以通过观察颜色来判断配位化 合物的组成和结构。
磁性
总结词
配位化合物的磁性主要取决于其组成的金属离子和配体的性质。
详细描述
一些配位化合物具有明显的磁性,这与其组成和结构密切相关。一般来说,含有铁、钴、镍等过渡金属的配位化 合物具有明显的磁性。此外,配体的性质和配位化合物的结构也会影响其磁性。了解配位化合物的磁性对于其在 化学、物理和材料科学等领域的应用具有重要意义。
配位体
提供孤对电子与中心原子 或离子形成配位键的分子 或离子。
特性
稳定性
配位化合物具有较高的稳定性 ,主要由于配位键的形成使得
整个分子更加稳定。
多样性
配位化合物的种类繁多,可以由 不同的中心原子、配位体和配位 数组成,形成各种不同的结构。
可预测性
根据中心原子和配位体的性质 ,可以预测配位化合物的性质 和稳定性。
诊断成像
生物分析
配位化合物可用于检测生物体内的金 属离子和蛋白质等生物分子的含量和 活性。
配位化合物可用于医学影像技术,如 核磁共振成像和X射线造影剂。
在材料科学上的应用
上交大基础化学电子课件第11章章物质结构基础

6(b)所示。
11.5 化 学 键
11.5.3.3 价键理论的要点
(1)电子配对原理 两个原子接近时,只有自旋方向相反的两个单电子可以相
互配对,从而使核间的电子云密度增大,系统的能量降低, 形成稳定的共价键,即电子配对原理。
(2)最大重叠原理 它是指形成共价键时,尽可能使成键电子的原子轨道按对
称性匹配原则进行最大程度的重叠,这样所形成的共价键较 牢固。
变化规律
11.4 元素周期表和元素基本性质的周期性
思考题
11-3 共价半径长短的主要决定因素是什么?有 什么规律?
11.4 元素周期表和元素基本性质的周期性
2. 元素的电离能和电子亲和能
(1)电离能。
(2)电子亲和能
11.4 元素周期表和元素基本性质的周期性
3. 电负性
电离能和电子亲和能都是从一 个侧面反映元素原子失去或得到电 子能力的大小。
11.3 原子核外电子的排布
(2) 能量最低原理
(1) 泡利不相容原理
Ad(d Y3o)ur Text 洪特规则
11.4 元素周期表和元素基本性质的周期性
11.4.1 多电子原子轨道的能级
1. 元素的周期
长式周期表共有7个横行,每个横行为1个周期,共有7个周期,即电子 层数相同且按照原子序数递增的顺序排列的一系列元素称为1个周期。
11.1 微观粒子的运动特征
思考题
11-1 经典物理学在研究微观物体的运动时遇到 过哪些困难?举例说明。如何正确对待量子论?
11.2 核外电子的运动状态
11.2.1 波函数与原子轨道
(1)波函数Ψ是描述核外电子 运动状态的数学函数式。
(2)每个波函数Ψ都具有对应 的能量E。
11.5 化 学 键
11.5.3.3 价键理论的要点
(1)电子配对原理 两个原子接近时,只有自旋方向相反的两个单电子可以相
互配对,从而使核间的电子云密度增大,系统的能量降低, 形成稳定的共价键,即电子配对原理。
(2)最大重叠原理 它是指形成共价键时,尽可能使成键电子的原子轨道按对
称性匹配原则进行最大程度的重叠,这样所形成的共价键较 牢固。
变化规律
11.4 元素周期表和元素基本性质的周期性
思考题
11-3 共价半径长短的主要决定因素是什么?有 什么规律?
11.4 元素周期表和元素基本性质的周期性
2. 元素的电离能和电子亲和能
(1)电离能。
(2)电子亲和能
11.4 元素周期表和元素基本性质的周期性
3. 电负性
电离能和电子亲和能都是从一 个侧面反映元素原子失去或得到电 子能力的大小。
11.3 原子核外电子的排布
(2) 能量最低原理
(1) 泡利不相容原理
Ad(d Y3o)ur Text 洪特规则
11.4 元素周期表和元素基本性质的周期性
11.4.1 多电子原子轨道的能级
1. 元素的周期
长式周期表共有7个横行,每个横行为1个周期,共有7个周期,即电子 层数相同且按照原子序数递增的顺序排列的一系列元素称为1个周期。
11.1 微观粒子的运动特征
思考题
11-1 经典物理学在研究微观物体的运动时遇到 过哪些困难?举例说明。如何正确对待量子论?
11.2 核外电子的运动状态
11.2.1 波函数与原子轨道
(1)波函数Ψ是描述核外电子 运动状态的数学函数式。
(2)每个波函数Ψ都具有对应 的能量E。
学习_课件11配位化学2张

低配位数的离子可忽略不计。
3、利用综合平衡反应方程式计算时,反应方程式
中的系数并不代表溶液中的各物种实际的物质的量
之比。
4、只有配离子的类型相同时,才可以通过K稳比较
2、配合平衡的移动
无机化 第11章 学
(1)配合平衡与酸碱解离平衡
2CuSO4 +2NH3 + 2H2O=Cu(OH)2·CuSO4↓+ (NH4)2SO4 Cu(OH)2·CuSO4 +(NH4)2SO4 + 6NH3=2Cu(NH3)4SO4 +2
K+ Be2+ Mg2+ Ca2+
1 109 8 102 6 105 3 108
Mn2+ Fe2+ Co2+ Ni2+
2 107 4 106 3 106 4 104
无机化 第11章 学
(3)配位平衡与氧化还原平衡:主要体现在
配合物的生成对于半反应的电极电势上。
氧化型 + ze- = 还原型
= 0.059 lg [氧化型]
z
[还原型]
若氧化型生成配合物, 值减小;若还原型生 成配合物, 值增大。
无机化 第11章 学
例11-14:已知Hg2+ + 2e- = Hg EӨ = 0.85 V,
说明:通常情况下,酸效应对配位平衡的影 响是主要的。
无机化 第11章 学
(2)配合平衡和沉淀-溶解平衡
两种平衡的关系实质是配合剂与沉淀剂争夺Mn
+ 的问题,和 Ksp、K稳 的值有关。
例11-15:计算CuI在1.0 moldm-3 氨水中的溶解 度。
无机化 第11章 学
AgF Cl- AgCl NH3 Ag(NH3)2+ Br- AgBr S2O32- Ag(S2O3)23- IAg(S2O3)23- I- AgI CN- Ag(CN)2- S2- AgS
相关主题
