探索碱的性质(第一)精品PPT优质课件
合集下载
九年级科学碱的性质1(PPT)5-3
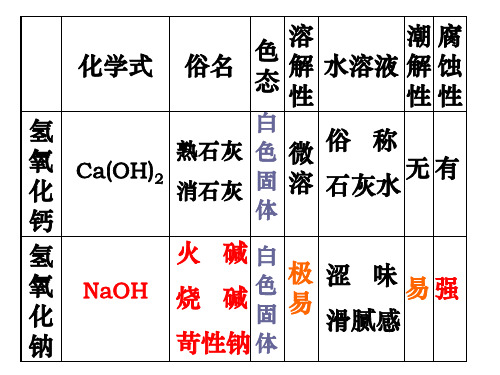
化学式
俗名
色 态
溶 解 性
白
Ca(OH)2
熟石灰 消石灰
色 固
微 溶
俗称 石灰水 无 有
钙
体
氢 氧 化
NaOH
火 烧
碱 碱
白 色 固
极 易
涩 味 易强 滑腻感
钠
苛性钠 体
长,家庭教师和家长,店员和店主)。 【宾服】ī〈书〉动服从;归附。 【宾服】ī?〈方〉动佩服:你说的那个理,俺不~。 【宾馆】ī名招待来宾住宿的地 方。现指较大而设施好的旅馆。 【宾客】ī名客人(总称):迎接八方~。 【宾朋】ī名宾客;朋友:~满座。 【宾语】ī名动词的一种连带成分,一般在动词 后边,用来回答“谁?”或“什么?”例如“我找; / 笔趣阁小说阅读网;厂长”的“厂长”,“他开拖拉机”的“拖拉机”,“接 受批评”的“批评”,“他说他不知道”的“他不知道”。有时候一个动词可以带两个宾语,如“教我们化学”的“我们”和“化学”。 【宾至如归】īī客 人到了这里就像回到自己的家一样,形容旅馆、饭馆等招待周到。 【宾主】ī名客人和主人:~双方进行了友好的会谈。 【彬】ī①[彬彬](īī)〈书〉形文 雅的样子:~有礼|文质~。②(ī)名姓。 【傧】(儐)ī[傧相](ī)名①古代称接引宾客的人,也指赞礼的人。②举行婚礼时陪伴新郎新娘的人: 男~|女~。 【斌】ī同“彬”。 【滨】(濱)ī①水边;近水的地方:海~|湖~|湘江之~。②靠近(水边):~海|~江。③(ī)名姓。 【缤】(繽) ī[缤纷](ī)〈书〉形繁多而凌乱:五彩~|落英(花)~。 【槟】(檳、梹)ī[槟子](ī?)名①槟子树,花红的一种,果实比苹果小,红色,熟后转 紫红,味酸甜带涩。②这种植物的果实。 【镔】(鑌)ī[镔铁](ī)名精炼的铁。 【濒】(瀕)ī①紧靠(水边):~湖|东~大海。②临近;接近:~ 危|~行。 【濒绝】ī动濒临灭绝或绝迹:~物种。 【濒临】ī动紧接;临近:我国~太平洋|精神~崩溃的边缘。 【濒死】ī动临近死亡:从~状态下抢救过 来。 【濒危】ī动接近危险的境地,指人病重将死或物种临近灭绝:病人~|~动物。 【濒于】ī动临近;接近(用于坏的遭遇):~危境|~绝望|~破产。 【豳】ī古地名,在今陕西彬县、旬邑一带。也作邠。 【摈】(擯)〈书〉抛弃;排除:~诸门外|~而不用。 【摈斥】动排斥:~异己。 【摈除】动排除; 抛弃:~陈规陋习。 【摈弃】动抛弃:~旧观念。 【殡】(殯)停放灵柩;把灵柩送到埋葬或火化的地方去:出~|~车。 【殡车】名出殡时运灵柩的车。 【殡殓】动入殓和出殡:办理~事宜。 【殡仪馆】名供停放灵柩和办理丧事的机构。 【殡葬】动出殡和埋葬:~工|~管理处。 【膑】(臏)同“髌”。 【髌】(髕)①髌骨。②古代削去髌骨的酷刑。 【髌骨】名膝盖部的一块骨,略呈三角形,尖
俗名
色 态
溶 解 性
白
Ca(OH)2
熟石灰 消石灰
色 固
微 溶
俗称 石灰水 无 有
钙
体
氢 氧 化
NaOH
火 烧
碱 碱
白 色 固
极 易
涩 味 易强 滑腻感
钠
苛性钠 体
长,家庭教师和家长,店员和店主)。 【宾服】ī〈书〉动服从;归附。 【宾服】ī?〈方〉动佩服:你说的那个理,俺不~。 【宾馆】ī名招待来宾住宿的地 方。现指较大而设施好的旅馆。 【宾客】ī名客人(总称):迎接八方~。 【宾朋】ī名宾客;朋友:~满座。 【宾语】ī名动词的一种连带成分,一般在动词 后边,用来回答“谁?”或“什么?”例如“我找; / 笔趣阁小说阅读网;厂长”的“厂长”,“他开拖拉机”的“拖拉机”,“接 受批评”的“批评”,“他说他不知道”的“他不知道”。有时候一个动词可以带两个宾语,如“教我们化学”的“我们”和“化学”。 【宾至如归】īī客 人到了这里就像回到自己的家一样,形容旅馆、饭馆等招待周到。 【宾主】ī名客人和主人:~双方进行了友好的会谈。 【彬】ī①[彬彬](īī)〈书〉形文 雅的样子:~有礼|文质~。②(ī)名姓。 【傧】(儐)ī[傧相](ī)名①古代称接引宾客的人,也指赞礼的人。②举行婚礼时陪伴新郎新娘的人: 男~|女~。 【斌】ī同“彬”。 【滨】(濱)ī①水边;近水的地方:海~|湖~|湘江之~。②靠近(水边):~海|~江。③(ī)名姓。 【缤】(繽) ī[缤纷](ī)〈书〉形繁多而凌乱:五彩~|落英(花)~。 【槟】(檳、梹)ī[槟子](ī?)名①槟子树,花红的一种,果实比苹果小,红色,熟后转 紫红,味酸甜带涩。②这种植物的果实。 【镔】(鑌)ī[镔铁](ī)名精炼的铁。 【濒】(瀕)ī①紧靠(水边):~湖|东~大海。②临近;接近:~ 危|~行。 【濒绝】ī动濒临灭绝或绝迹:~物种。 【濒临】ī动紧接;临近:我国~太平洋|精神~崩溃的边缘。 【濒死】ī动临近死亡:从~状态下抢救过 来。 【濒危】ī动接近危险的境地,指人病重将死或物种临近灭绝:病人~|~动物。 【濒于】ī动临近;接近(用于坏的遭遇):~危境|~绝望|~破产。 【豳】ī古地名,在今陕西彬县、旬邑一带。也作邠。 【摈】(擯)〈书〉抛弃;排除:~诸门外|~而不用。 【摈斥】动排斥:~异己。 【摈除】动排除; 抛弃:~陈规陋习。 【摈弃】动抛弃:~旧观念。 【殡】(殯)停放灵柩;把灵柩送到埋葬或火化的地方去:出~|~车。 【殡车】名出殡时运灵柩的车。 【殡殓】动入殓和出殡:办理~事宜。 【殡仪馆】名供停放灵柩和办理丧事的机构。 【殡葬】动出殡和埋葬:~工|~管理处。 【膑】(臏)同“髌”。 【髌】(髕)①髌骨。②古代削去髌骨的酷刑。 【髌骨】名膝盖部的一块骨,略呈三角形,尖
探索碱的性质 PPT教学课件 浙教版

3.在氢氧化钠溶液里加入1~2滴酚酞试 液,然后逐渐滴入稀盐酸,直到反应完全.在 整个过程中溶液的颜色变化为( C )
A.红色→无色→红ቤተ መጻሕፍቲ ባይዱ B.红色→无色→无色
C.无色→红色→无色 D.无色→蓝色→无色
4.某溶液能使紫色石蕊试液变蓝色,则 该溶液能使无色酚酞试液变( D )
A.无色 B.蓝色 C.紫色 D.红色
•
13、认识到我们的所见所闻都是假象,认识到此生都是虚幻,我们才能真正认识到佛法的真相。钱多了会压死你,你承受得了吗?带,带不走,放,放不下。时时刻刻发悲心,饶益众生为他人。
•
14、梦想总是跑在我的前面。努力追寻它们,为了那一瞬间的同步,这就是动人的生命奇迹。
•
15、懒惰不会让你一下子跌倒,但会在不知不觉中减少你的收获;勤奋也不会让你一夜成功,但会在不知不觉中积累你的成果。人生需要挑战,更需要坚持和勤奋!
2、用滴管吸取反应后的溶液滴在蒸发皿中,在 小火上烘干,蒸发皿上留下了什么?
白色的晶体。
化学方程式
NaOH+HCl=NaCl+H2O
碱
酸
盐
水
2NaOH+H2SO4=Na2SO4+2H2O
碱
酸
盐
水
性质二:碱能和酸反应生成盐和水。
结论: 碱跟酸作用生成盐和水的 反应叫做中和反应
读图: 根据下图说出中和反应的实质。
你知道这其中的奥秘吗?
探究题
被蚊虫叮咬处肿成大包,这是蚊虫 在人的皮肤内分泌出蚁酸,从而使皮肤 肿痛。
可涂一些碱性物质(如NH3·H2O) 的药水,可减轻痛痒,你知道其中的原 因吗?
探究题
早晨空腹时,为什么要少吃苹果 或酸性食物较好?
碱的化学性质 (共13张PPT)

检验方H+HCl=NaCl+H2O,反 应但无现象 NaOH与Ca(OH)2不反应 Na CO Na2CO3+2HCl=2NaCl+H2O+CO2
2 3
现象:冒气泡
Na2CO3+Ca(OH)2=CaCO3+2NaOH 现象:产生白色沉淀
检验氢氧化钠是否变质的方法
怎样判断两者是否反应?
步骤:将氢氧化钠倒入盛有CO2的塑料 瓶中,拧紧瓶盖,振荡,观察现象。 现象:塑料瓶变瘪。 结论:NaOH与CO2能发生化学反应。
NaOH的化学性质 1、与指示剂反应 2、与某些非金属氧化物反应 Ca(OH)2+CO2=CaCO3 +H2O 2NaOH + CO2 == Na2CO3 + H2O (NaOH暴露在空气中变质) 2NaOH + SO2 == Na2SO3 + H2O (NaOH吸收SO2) 碱 + 非金属氧化物 → 盐 + 水
碱的性质
你听说过《石灰吟》吗?它指的是哪个反应?
千锤万凿出深山, 烈火焚烧若等闲。 粉身碎骨浑不怕,
要留清白在人间。
探究活动一:
1、观察烧杯中NaOH、Ca(OH)2的颜色、状态。
2、加水溶解,触摸烧杯外壁。 颜色 状态 露置在 在水中的 羊毛线与氢 俗 空气中 溶解情况 氧化钠的作 称 的变化 用 氢氧 白色 固体 易潮解 易溶于水 易段 化钠 氢氧 白色 固体 无 化钙 微溶于水 易段
活动三
氢氧化钠和氢氧化钙的化学性质
生锈铁钉 CuCl2溶液 Na2CO3溶液
加入 NaOH溶 液后的现 象
无现象
蓝色沉淀
无现象
加入 Ca(OH)2 溶液后的 现象
探索碱的性质(第一课时)PPT课件

2020年10月2日
1
1.写出下列化学反应方程式 ①硫酸和铝反应②稀硝酸和氧化镁反应 ③盐酸和氢氧化铁反应④碳酸钠和硝酸反应
2Al+3H2SO4=Al2(SO4)3+3H2↑ MgO+2HNO3=Mg(NO3)2+H2O 3HCl+Fe(OH)3=FeCl3+3H2O Na2CO3+2HNO3=2NaNO3+H2O+CO2↑
2020年10月2日
4
你还知道生活中碱性的食物 吗?
常见食物的碱性: 牛乳、茶、柿 子、黄瓜、胡萝卜、萝卜、菠菜、 柑橘类、葡萄、芋头、海带、葡萄 干、马铃薯、卷心菜、笋、香菇类、 油菜、南瓜、豆腐、苹果、梨、香 蕉、樱桃等。
2020年10月2日
5
你去尝一个未成熟的柿子,会有 什么感觉?
这是因为柿子里含有 碱性 物质
2020年10月2日
19
二、碱的性质 1.碱能跟酸碱指示剂反应
碱溶液能使紫色石蕊试液变蓝色, 无色酚酞变红色.
2、碱能跟酸反应
通式: 碱+ 酸 = 盐 + 水
3.中和反应:
1)定义:碱跟酸作用生成盐和水的反应叫 中和反应。
Mg(20O20年H10月)2日2+2HCl=MgCl2+2H2O
3
你知道生活中酸性的食物吗?
常见食物的酸性:牛肉、猪肉、鸡肉、金枪 鱼、牡蛎、目鱼、奶酪、米、麦、面包、酒 类、花生、薄肠、糖、饼干、白糖等。火腿、 鸡蛋、龙虾、章鱼、鱿鱼、奶油、豌豆、鳗 鱼、河鱼、巧克力、葱、粉、炸豆腐等。
上述所写的化学方程式都是有关酸的性质, 今天这节课开始学习有关碱的知识.
食用碱性食品时会感到涩味,洗澡时不 小心有肥皂泡溅到嘴里也有这种感觉。
1
1.写出下列化学反应方程式 ①硫酸和铝反应②稀硝酸和氧化镁反应 ③盐酸和氢氧化铁反应④碳酸钠和硝酸反应
2Al+3H2SO4=Al2(SO4)3+3H2↑ MgO+2HNO3=Mg(NO3)2+H2O 3HCl+Fe(OH)3=FeCl3+3H2O Na2CO3+2HNO3=2NaNO3+H2O+CO2↑
2020年10月2日
4
你还知道生活中碱性的食物 吗?
常见食物的碱性: 牛乳、茶、柿 子、黄瓜、胡萝卜、萝卜、菠菜、 柑橘类、葡萄、芋头、海带、葡萄 干、马铃薯、卷心菜、笋、香菇类、 油菜、南瓜、豆腐、苹果、梨、香 蕉、樱桃等。
2020年10月2日
5
你去尝一个未成熟的柿子,会有 什么感觉?
这是因为柿子里含有 碱性 物质
2020年10月2日
19
二、碱的性质 1.碱能跟酸碱指示剂反应
碱溶液能使紫色石蕊试液变蓝色, 无色酚酞变红色.
2、碱能跟酸反应
通式: 碱+ 酸 = 盐 + 水
3.中和反应:
1)定义:碱跟酸作用生成盐和水的反应叫 中和反应。
Mg(20O20年H10月)2日2+2HCl=MgCl2+2H2O
3
你知道生活中酸性的食物吗?
常见食物的酸性:牛肉、猪肉、鸡肉、金枪 鱼、牡蛎、目鱼、奶酪、米、麦、面包、酒 类、花生、薄肠、糖、饼干、白糖等。火腿、 鸡蛋、龙虾、章鱼、鱿鱼、奶油、豌豆、鳗 鱼、河鱼、巧克力、葱、粉、炸豆腐等。
上述所写的化学方程式都是有关酸的性质, 今天这节课开始学习有关碱的知识.
食用碱性食品时会感到涩味,洗澡时不 小心有肥皂泡溅到嘴里也有这种感觉。
碱的性质PPT课件

氢氧化钙不能和金属(Fe)以及金属氧化物(Fe2O3)反 应
(二)碱的化学性质: 碱溶液中都含有OH(1)碱溶液与酸碱指示剂反应 (2)碱 + 非金属氧化物 → 盐 + 水 2NaOH + CO2 = Na2CO3 + H2O Ca(OH)2 + CO2 = CaCO3 ↓+ H2O (3)碱 + 酸 → 盐 + 水 NaOH + HCl = NaCl + H2O Ca(OH)2+ H2SO4 = CaSO4 + 2H2O (3)碱 + 盐 → 新碱 + 新盐 2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3
CaCO3
CaO +CO2↑
(二)碱的化学性质 1、氢氧化钠的化学性质: 2、氢氧化钙的化学性质:
氢氧化钠的化学性质: (1)氢氧化钠与酸碱指示剂反应 (2)氢氧化钠与酸反应( HCl、H2SO4)
NaOH + HCl = NaCl + H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O (3)氢氧化钠与二氧化碳反应 2NaOH + CO2 = Na2CO3 + H2O (4)氢氧化钠与某些盐反应 (CuSO4) 2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 产生蓝色沉淀
碱的性质
二、碱的性质
常见的碱:
氢氧化钠
NaOH
氢氧化钙
氢氧化钾 氨水
Ca(OH)2
KOH NH3· H 2O
探索碱的性质(第一课时)PPT课件(初中科学)

2.碱能与酸反应
实验2:氢氧化钠溶液与酸反应 1)、在2支分别盛有少量氢氧化钠稀溶
液的试管里,各滴入1滴酚酞试液,溶液变
( 红色 ),分别向2支试管里逐滴加稀盐 酸和稀硫酸,边滴边振荡,直到( 红色 )
刚好消失。
这说明溶液的酸碱性产生了什么变化?变成中性 2)、用滴管吸取反应后的溶液滴在蒸发皿中, 在小火上烘干,蒸发皿上留下了什么? 白色的晶体。
也可以用PH试纸来检验,反应完后, 若PH>7时,说明是碱过量,若PH <7时,说明是酸过量.
请你阅读教材后,能说出中和反应的 实质吗?
3)中和反应的实质: 实质是酸电离的H+与碱电离的OH-结合 成中性的水。
H++OH-=H2O
H2SO4
HCl
HNO3
H3PO4
NaOH Ca(OH)2 Cu(OH)2 Fe(OH)3
Al(OH)3+3HCl=AlCl3+3H2O 6HCl+Fe2O3=2FeCl3+3H2O Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 ACagCNOO3+3+2HCl=ACagCl2↓+H+H2ON+OC3O2↑
Mg(OH)2+2HCl=MgCl2+2H2O
1、由下列各组中的三种元素组成的化合物,属 于碱的一组是( B )
这种反应也叫中和反应。 3、非金属氧化物跟碱反应生成盐和水
4、碱和盐反应生成另一种碱 和另 一种盐
注意:
⑴只有可溶性碱才能满足以上四条性 质,难溶性碱只能满足第2条 ⑵第4条参加反应的盐和碱必需都是 可溶性的。
1.下列物质不属于碱类物质的是(A ) A.纯碱(Na2CO3) B.氢氧化铁[Fe(OH)3] C.氢氧化钡[Ba(OH)2] D.消石灰[Ca(OH)2]
碱的性质PPT教学课件

A.2(M F ) g
C.2M F g
B.M 2F g
D.0
答案:A
解析:设减少的质量为m,气球匀速下降和上升时受到的阻力
大小为Ff.下降时有Mg=F+Ff,上升时有F=(M-m)·g+Ff,联立解 得 m 2(M F ), A正确.
g
3.如图所示,在水平桌面上叠放着木块P和Q,水平力F推动两 个木块一起做匀速运动,下列说法正确的是( ) A.P受3个力,Q受3个力 B.P受3个力,Q受4个力 C.P受2个力,Q受5个力 D.P受4个力,Q受6个力
名师提示:处理平衡状态中的临界问题和极值问题,要正确进 行受力分析,弄清临界条件,利用好临界条件列出平衡方程求 解.
的条件 Fx 0, 此方法多用于三个以上共点力作用下的
Fy多的
力落在x、y轴上,被分解的力尽可能是已知力,不宜分解待求
力.
疑难点四.动态平衡问题、临界问题、极值问题有何特征?如何 处理这些问题? 名师在线:1.动态平衡问题 通过控制某些物理量,使物体的状态发生缓慢的变化,而在这 个过程中物体又始终处于一系列的平衡状态,在问题的描述 中常用“缓慢”等语言叙述.
疑难点二.受力分析时常用的方法有:整体法和隔离法、假设 法,如何使用这两种方法分析物体受力呢? 名师在线:1.“隔离法”与“整体法” (1)“隔离法” 为了弄清系统(连接体)内某个物体的受力和运动情况,一般 可采用隔离法,运用隔离法解题的基本步骤: ①明确研究对象或过程、状态; ②将某个研究对象或某段运动过程、某个状态从全过程中隔 离出来; ③画出某状态下的受力图或运动过程示意图; ④选用适当的物理规律列方程求解.
答案:B
解析:物体保持静止,处于平衡状态,由平衡条件知其合外力 保持为零.斜面对物体的支持力FN=mgcosθ,减小;斜面对物 体的静摩擦力为Ff=mgsinθ,增大.
探索碱的性质时PPT课件

3 . NaOH + FeCl3 = Fe OH 2↓ + 3NaCl 3NaOH + FeCl3 = Fe OH 3↓ + 3NaCl
2.用化学方程式表示: 1 检验二氧化碳的存在
CO2 + Ca OH 2 = CaCO3 ↓ + H2O 2 除去较多的二氧化碳
CO2 + 2NaOH = Na2CO3 + H2O
CaO + H2O=Ca OH 2,氧化钙本身不能直接 扩散溶解到水中,
课堂练习:
1、下列对氢氧化钠的描述中,不正确的是
A、ANaOH固体极易溶于பைடு நூலகம்,溶解时吸收大量的热
B、其水溶液有涩味和滑腻感 C、对皮肤、衣服都有强烈的腐蚀性 D、其水溶液能使紫色石蕊试液变蓝色
2、下列气体其中能用氢氧化钠干燥的是
1.指出下列化学方程式的错误所在: 1 . SO2 + 2NaOH = Na2SO4 + H2O
SO2 + 2NaOH = Na2SO3 + H2O
2 . CuO + 2KOH = Cu OH 2↓ +K2O KOH是碱,只能跟某些非金属氧化物反应, 而不能跟金属氧化物反应,所以这个反应 不能进行.
实验室根据氢氧化钠易潮解的性质,常用它来作干 燥剂,但它不能干燥酸性类气体,如:CO2、SO2、 H2S、HCl.
我们已经讨论了常见的碱──氢 氧化钠的俗称、用途、个性; 下面接着讨论常见的碱──氢氧 化钙的相关知识,
二、氢氧化钙 化学式:Ca OH 2
1 .俗名:熟石灰、消石灰、石灰浆、石灰乳
3 检验某酸溶液是盐酸 HCl + AgNO3 = AgCl ↓+ HNO3
2.用化学方程式表示: 1 检验二氧化碳的存在
CO2 + Ca OH 2 = CaCO3 ↓ + H2O 2 除去较多的二氧化碳
CO2 + 2NaOH = Na2CO3 + H2O
CaO + H2O=Ca OH 2,氧化钙本身不能直接 扩散溶解到水中,
课堂练习:
1、下列对氢氧化钠的描述中,不正确的是
A、ANaOH固体极易溶于பைடு நூலகம்,溶解时吸收大量的热
B、其水溶液有涩味和滑腻感 C、对皮肤、衣服都有强烈的腐蚀性 D、其水溶液能使紫色石蕊试液变蓝色
2、下列气体其中能用氢氧化钠干燥的是
1.指出下列化学方程式的错误所在: 1 . SO2 + 2NaOH = Na2SO4 + H2O
SO2 + 2NaOH = Na2SO3 + H2O
2 . CuO + 2KOH = Cu OH 2↓ +K2O KOH是碱,只能跟某些非金属氧化物反应, 而不能跟金属氧化物反应,所以这个反应 不能进行.
实验室根据氢氧化钠易潮解的性质,常用它来作干 燥剂,但它不能干燥酸性类气体,如:CO2、SO2、 H2S、HCl.
我们已经讨论了常见的碱──氢 氧化钠的俗称、用途、个性; 下面接着讨论常见的碱──氢氧 化钙的相关知识,
二、氢氧化钙 化学式:Ca OH 2
1 .俗名:熟石灰、消石灰、石灰浆、石灰乳
3 检验某酸溶液是盐酸 HCl + AgNO3 = AgCl ↓+ HNO3
探索碱的性质共24页PPT

探索碱的性质
51、山气日夕佳,飞鸟相与还。 52、木欣欣以向荣,泉涓涓而始流。
53、富贵非吾愿,帝乡不可期。 54、雄发指危冠,猛气冲长缨。 55、土地平旷,屋舍俨然,有良田美 池桑竹 之属, 阡陌交 通,鸡 犬相闻 。
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
ห้องสมุดไป่ตู้
谢谢!
51、山气日夕佳,飞鸟相与还。 52、木欣欣以向荣,泉涓涓而始流。
53、富贵非吾愿,帝乡不可期。 54、雄发指危冠,猛气冲长缨。 55、土地平旷,屋舍俨然,有良田美 池桑竹 之属, 阡陌交 通,鸡 犬相闻 。
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
ห้องสมุดไป่ตู้
谢谢!
第三节探索碱的性质(第一课时)

二.碱的命名:氢氧化某
三.碱的分类:
强碱: KOH、 NaOH、 Ba(OH)2
中强碱: Ca(OH)2
弱碱: 水 和 氨 ( N H 3 · H 2 O ) 、 氢 氧 化 铝 [Al(OH)3]、氢氧化锌[Zn(OH)2]等。
四、碱的性质
[实验1]在四支盛有氢氧化钠溶液、澄清石 灰水的试管中分别滴入紫色石蕊试液和无色酚 酞试液,观察溶液颜色的变化。再取两片PH试 纸,分别放入两支试管中,再分别在试管中滴 入氢氧化钠溶液、澄清的石灰水,观察颜色变 化。
第3节
探索碱的性质
(第一课时)
几种常见的碱
NaOH
KOH Ca(OH)2 Cu(OH)2
一、碱的涵义:
NaOH = Na+ + OH— KOH = K+ + OH— Ca(OH)2 = Ca2+ +2 OH— Cu(OH)2 = Cu2+ +2 OH—
碱:电离时所生成的阴离子全部是氢
氧根离子(OH-)的一类化合物。
1、碱性物质能使酸碱指示剂呈一定的颜色;
(碱溶液能使紫色石蕊试液变蓝色, 使无色酚酞试液变红)
思考:这里为什么要说成“碱溶液”, 而不直接说成“碱”?
因为有些碱不能溶于水,如氢氧化铜、氢 氧化铁,由于不溶于水,它们不能使பைடு நூலகம்色 石蕊试液、无色酚酞试液变色。
根据下图说出中和反应的实质。
H+ + OH- = H2O
1、下列关于碱的叙述中,错误的是( )
A.只要含有OH-的化合物如Cu2(OH)2CO3就是碱 B.电离时产生的阴离子全部是OH-的化合物 C.电离时产生的金属阳离子和的OH-个数相等 D.电离时产生的金属阳离子所带的电荷数和OH-所 带的电荷数相等
九年级科学上册 1.3探索碱的性质课件

解质
第十五页,共三十一页。
一、氢氧化钠(qīnɡ yǎnɡ huà nà)(化学式:NaOH )
俗名:烧碱(shāo jiǎn)、火碱和苛性钠 2、氢氧化钠(qīnɡ yǎnɡ huà nà) 用途
烧 碱
第十六页,共三十一页。
1、阅读氢氧化钠试剂瓶标签。 2、用药匙取一小块氢氧化钠固体,放在表面皿上,观察它的颜色、状 态等。几分钟以后再观察这块(zhè kuài)氢氧化钠,你发现有什么现象? _____氢__氧__化__钠_表__面__(biǎomiàn)变得潮湿(潮解)
酸 盐+水
盐
新碱 + 新盐
第十页,共三十一页。
课内练习:
1、以Ba(OH)2为例,分别(fēnbié)写出它与CO2、 HCl、H2SO4和CuCl2、FeCl3的反应。
2、硫酸铜溶液中加入(jiārù)少量的氢氧化钠溶液, 立即生成( B )
红褐色沉淀 A
(chéndiàn)
B 蓝色沉淀
C 绿色沉淀
开始墙面变得潮湿,过几天墙壁就变得又硬 又白了。在这个(zhè ge)过程中发生了哪些化学变 化?写出有关的化学方程式。
点燃
C + O2 == CO2 CO2 + Ca(OH)2 = CaCO3 + H2O
第二十三页,共三十一页。
练习(liànxí):写出下列化学方程式: 1、氢氧化钠和氯化铁反应 2、氢氧化钙和盐酸反应 3、氢氧化铜和硫酸反应
么不能用玻璃塞?而是用橡皮塞或木塞。
SiO2+2NaOH=Na2SiO3+H2O
第七页,共三十一页。
思考:请你找出下列(xiàliè)化学方程式的共同点:(从 物质的种类来分析)
CO2 + Ca(OH)2 = CaCO3↓+ H2O CO2 + 2NaOH = Na2CO3 +H2O SO2 + 2NaOH = Na2SO3+ H2O
第十五页,共三十一页。
一、氢氧化钠(qīnɡ yǎnɡ huà nà)(化学式:NaOH )
俗名:烧碱(shāo jiǎn)、火碱和苛性钠 2、氢氧化钠(qīnɡ yǎnɡ huà nà) 用途
烧 碱
第十六页,共三十一页。
1、阅读氢氧化钠试剂瓶标签。 2、用药匙取一小块氢氧化钠固体,放在表面皿上,观察它的颜色、状 态等。几分钟以后再观察这块(zhè kuài)氢氧化钠,你发现有什么现象? _____氢__氧__化__钠_表__面__(biǎomiàn)变得潮湿(潮解)
酸 盐+水
盐
新碱 + 新盐
第十页,共三十一页。
课内练习:
1、以Ba(OH)2为例,分别(fēnbié)写出它与CO2、 HCl、H2SO4和CuCl2、FeCl3的反应。
2、硫酸铜溶液中加入(jiārù)少量的氢氧化钠溶液, 立即生成( B )
红褐色沉淀 A
(chéndiàn)
B 蓝色沉淀
C 绿色沉淀
开始墙面变得潮湿,过几天墙壁就变得又硬 又白了。在这个(zhè ge)过程中发生了哪些化学变 化?写出有关的化学方程式。
点燃
C + O2 == CO2 CO2 + Ca(OH)2 = CaCO3 + H2O
第二十三页,共三十一页。
练习(liànxí):写出下列化学方程式: 1、氢氧化钠和氯化铁反应 2、氢氧化钙和盐酸反应 3、氢氧化铜和硫酸反应
么不能用玻璃塞?而是用橡皮塞或木塞。
SiO2+2NaOH=Na2SiO3+H2O
第七页,共三十一页。
思考:请你找出下列(xiàliè)化学方程式的共同点:(从 物质的种类来分析)
CO2 + Ca(OH)2 = CaCO3↓+ H2O CO2 + 2NaOH = Na2CO3 +H2O SO2 + 2NaOH = Na2SO3+ H2O
九年级科学上册《 探索碱的性质》课件

第十页,共二十二页。
碱的通性(tōnɡ xìnɡ)
• (1) 碱溶液(róngyè)能使紫色的石蕊试液变
蓝色,无色的酚酞试液变红。
• (2) 碱+酸=盐+水 (中和反应)
第十一页,共二十二页。
3、碱与非金属氧化物能否(nénɡ 反应? fǒu) 活动:向盛有澄清石灰水的试管中通入二氧化碳,
有什么现象?
实验(shíyàn)现象:澄清石灰水变浑浊 反应 方程式: (fǎnyìng)
Ca(OH)2 + CO2 = CaCO3↓+H2O
应用: 检验二氧化碳CO2
第十二页,共二十二页。
若要吸收或除去二氧化碳可用氢氧化 钠溶液(为何(wèihé)不用氢氧化钙溶 液?)
第十三页,共二十二页。
生产硫酸的工厂排放的废气中含有的 二氧化硫,可用氢氧化钠 溶 (qīnɡ yǎnɡ huà nà) 液吸收,请写出反应方程式
1、碱能使紫色石蕊试液变蓝色
使无色酚酞(fēn tài)试液变红色
第四页,共二十二页。
2、碱与酸的反应(fǎnyìng)
活动:向盛有氢氧化钠溶液的试管中滴加
酚酞,有什么现象? 逐滴滴加稀盐酸,直到红色刚好褪去 用滴管吸取反应后ห้องสมุดไป่ตู้溶液在蒸发皿中烘
干,蒸发皿上留下什么?
红色 实验现象 :酚酞变 (xiànxiàng)
探索(tàn suǒ)碱的性质
第一页,共二十二页。
一、什么 是碱? (shén me)
NaOH =Na+ + OHCa(OH)2=Ca2+ + 2OHBa(OH)2=Ba2+ + 2OH-
碱:电离(diànlí)时产生的阴离子全部
碱的通性(tōnɡ xìnɡ)
• (1) 碱溶液(róngyè)能使紫色的石蕊试液变
蓝色,无色的酚酞试液变红。
• (2) 碱+酸=盐+水 (中和反应)
第十一页,共二十二页。
3、碱与非金属氧化物能否(nénɡ 反应? fǒu) 活动:向盛有澄清石灰水的试管中通入二氧化碳,
有什么现象?
实验(shíyàn)现象:澄清石灰水变浑浊 反应 方程式: (fǎnyìng)
Ca(OH)2 + CO2 = CaCO3↓+H2O
应用: 检验二氧化碳CO2
第十二页,共二十二页。
若要吸收或除去二氧化碳可用氢氧化 钠溶液(为何(wèihé)不用氢氧化钙溶 液?)
第十三页,共二十二页。
生产硫酸的工厂排放的废气中含有的 二氧化硫,可用氢氧化钠 溶 (qīnɡ yǎnɡ huà nà) 液吸收,请写出反应方程式
1、碱能使紫色石蕊试液变蓝色
使无色酚酞(fēn tài)试液变红色
第四页,共二十二页。
2、碱与酸的反应(fǎnyìng)
活动:向盛有氢氧化钠溶液的试管中滴加
酚酞,有什么现象? 逐滴滴加稀盐酸,直到红色刚好褪去 用滴管吸取反应后ห้องสมุดไป่ตู้溶液在蒸发皿中烘
干,蒸发皿上留下什么?
红色 实验现象 :酚酞变 (xiànxiàng)
探索(tàn suǒ)碱的性质
第一页,共二十二页。
一、什么 是碱? (shén me)
NaOH =Na+ + OHCa(OH)2=Ca2+ + 2OHBa(OH)2=Ba2+ + 2OH-
碱:电离(diànlí)时产生的阴离子全部
九年级科学上册 1.3 探索碱的性质(课时1)课件

MgSO4 +2 NaOH = Na2SO4 + Mg(OH)2↓ ZnSO4 +2 NaOH = Na2SO4 + Zn(OH)2↓
第二十二页,共三十四页。
请你找出如下(rúxià)四个化学方程式的共同点:(从反应 物、生成物所属的物质类型考虑)
CuCI2 + 2NaOH = Cu(OH)2↓ + 2NaCI
白色的晶体。 第七页,共三十四页。
化学 方程式: (huàxué) NaOH + HCI = NaCI + H2O 2NaOH + H2SO4 = Na2SO4 + 2H2O
结论 : (jiélùn) 2、碱能跟酸反应(fǎnyìng) 通式: 碱+ 酸 = 盐 + 水
第八页,共三十四页。
思考:请你找出下列两个(liǎnɡ ɡè)化学方程式 的共同点:
4)三氧化硫气体和氢氧化钠溶液反应。 SO3 + 2NaOH = Na2SO4 + H2O
第三十二页,共三十四页。
6、20克硫酸铜溶液与10克氢氧化钠溶液混合(hùnhé)后恰
好完全反应,得到1·96克沉淀,求:
(1)生成(shēnɡ chénɡ)硫酸钠的质量。 (2)硫酸铜溶液(róngyè)和氢氧化钠溶液(róngyè)的质量分 数。
它们各显什么颜色?
氯化铜显蓝绿色,氯化铁显黄色(huángsè)。 2、在上述2支试管中分别滴加1毫升氢氧化钠 (NaOH)溶液(róngyè),试管中发生了什么变化?
现象:盛氯化铜溶液的试管出现蓝色絮状沉淀;
盛氯化铁溶液的试管出现红褐色絮状沉 淀.
第二十页,共三十四页。
化学反应 方程式: (huàxué fǎnyìng)
第二十二页,共三十四页。
请你找出如下(rúxià)四个化学方程式的共同点:(从反应 物、生成物所属的物质类型考虑)
CuCI2 + 2NaOH = Cu(OH)2↓ + 2NaCI
白色的晶体。 第七页,共三十四页。
化学 方程式: (huàxué) NaOH + HCI = NaCI + H2O 2NaOH + H2SO4 = Na2SO4 + 2H2O
结论 : (jiélùn) 2、碱能跟酸反应(fǎnyìng) 通式: 碱+ 酸 = 盐 + 水
第八页,共三十四页。
思考:请你找出下列两个(liǎnɡ ɡè)化学方程式 的共同点:
4)三氧化硫气体和氢氧化钠溶液反应。 SO3 + 2NaOH = Na2SO4 + H2O
第三十二页,共三十四页。
6、20克硫酸铜溶液与10克氢氧化钠溶液混合(hùnhé)后恰
好完全反应,得到1·96克沉淀,求:
(1)生成(shēnɡ chénɡ)硫酸钠的质量。 (2)硫酸铜溶液(róngyè)和氢氧化钠溶液(róngyè)的质量分 数。
它们各显什么颜色?
氯化铜显蓝绿色,氯化铁显黄色(huángsè)。 2、在上述2支试管中分别滴加1毫升氢氧化钠 (NaOH)溶液(róngyè),试管中发生了什么变化?
现象:盛氯化铜溶液的试管出现蓝色絮状沉淀;
盛氯化铁溶液的试管出现红褐色絮状沉 淀.
第二十页,共三十四页。
化学反应 方程式: (huàxué fǎnyìng)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
16
用盐酸中和NaOH溶液的过程中,可用 什么方法检验酸或碱是否过量?
答:可用酸碱指示剂来检验,如再滴入 紫色石蕊试液变红色说明是酸过量,变 蓝色,说明是碱过量.也可以用PH试 纸来检验,反应完后,若PH>7时, 说明是碱过量,若PH<7时,说明是 酸过量.
2020/12/6
17
请你阅读教材后,能说出中和反应的 实质吗?
3)中和反应的实质: 实质是酸电离的H+与碱电离的OH-结合 成中性的水。
H++OH-=H2O
2020/12/6
18
一.什么是碱
1.未成熟的柿子中存在碱性物质,家用的洗涤 剂中也存在着碱性物质;常见的物质中,NaOH、 Ca(OH)2等物质都属于碱。 2.碱的电离
3.碱的涵义:碱是电离时产生的阴离 子全部是OH-的化合物。
2020/12/6
4
你还知道生活中碱性的食物 吗?
常见食物的碱性: 牛乳、茶、柿 子、黄瓜、胡萝卜、萝卜、菠菜、 柑橘类、葡萄、芋头、海带、葡萄 干、马铃薯、卷心菜、笋、香菇类、 油菜、南瓜、豆腐、苹果、梨、香 蕉、樱桃等。
2020/12/6
5
你去尝一个未成熟的柿子,会有 什么感觉?
这是因为柿子里含有 碱性 物质
3.碱的涵义:碱是电离时产生的 阴离子全部是OH-的化合物。
2020/12/6
8
上面讲到碱有涩味,那么碱还有哪些性质呢?
二、碱的性质
1.碱能跟酸碱指示剂反应
[实验]在四支盛有氢氧化钠溶液、澄清石 灰水的试管中分别滴入紫色石蕊试液和无色 酚酞试液,观察溶液颜色的变化。再取两片 PH试纸,分别放入两支试管中,再分别在试 管中滴入氢氧化钠溶液、澄清的石灰水,观 察颜色变化,现象填入下表中。
2020/12/6
19
二、碱的性质 1.碱能跟酸碱指示剂反应
碱溶液能使紫色石蕊试液变蓝色, 无色酚酞变红色.
2、碱能跟酸反应
通式: 碱+ 酸 = 盐 + 水
3.中和反应:
1)定义:碱跟酸作用生成盐和水的反应叫 中和反应。
2020/12/6
20
2).中和反应的应用:
Mg(20O20/12H/6 )2+2HCl=MgCl2+2H2O
3
你知道生活中酸性的食物吗?
常见食物的酸性:牛肉、猪肉、鸡肉、金枪 鱼、牡蛎、目鱼、奶酪、米、麦、面包、酒 类、花生、薄肠、糖、饼干、白糖等。火腿、 鸡蛋、龙虾、章鱼、鱿鱼、奶油、豌豆、鳗 鱼、河鱼、巧克力、葱、粉、炸豆腐等。
上述所写的化学方程式都是有关酸的性质, 今天这节课开始学习有关碱的知识.
2020/12/6
9
试液 酚酞试液
氢氧化
钠溶液 变红色
紫色石蕊 试液
变篮色
PH试纸 PH > 7
澄清石 灰水
变红色
变篮色
PH > 7
2020/12/6
10
结论:
碱溶液能使紫色石蕊试液变蓝色, 无色酚酞变红色.
思考:这里为什么要说成“碱溶液”, 而不直接说成“碱”? 因为有些碱不能溶于水,如氢氧化铜、氢氧 化铁,由于不溶于水,它们不能使紫色石蕊 试液、无色酚酞试液变色。
NaOH是碱, HCI、 H2SO4都属酸, NaCI、 Na2SO4都是盐,它们都是酸与 碱反应生成盐和水。
3.中和反应:
1)定义:碱跟酸作用生成盐和
水的反应叫中和反应。
2020/12/6
14
判定:MgO和H2SO4反应,生成了 MgSO4和H2O(生成盐和水),这 个反应是中和反应吗?
答:这不是中和反应,因为中和反应应该 是酸和碱作用生成盐和水的反应,不能单 看生成物是盐和水,所以这个反应不是中 和反应.
2020/12/6
白色的晶体。
12
化学方程式:
NaOH + HCI = NaCI + H2O 2NaOH + H2SO4 = Na2SO4 + 2H2O
结论:
2、碱能跟酸反应 通式: 碱+ 酸 = 盐 + 水
2020/12/6
13
思考:请你找出下列两个化学方程式的 共同点:
NaOH + HCI = NaCI + H2O 2NaOH + H2SO4 =Leabharlann Na2SO4 + 2H2O
食用碱性食品时会感到涩味,洗澡时不 小心有肥皂泡溅到嘴里也有这种感觉。
2020/12/6
6
一.什么是碱
1.未成熟的柿子中存在碱性物质,家用 的洗涤剂中也存在着碱性物质;常见的物 质中,NaOH、Ca(OH)2等物质都属于碱。
到底什么是碱?
2020/12/6
7
2.碱的电离
NaOH = Na+ + OH– KOH = K + + OH– Ca(OH)2= Ca+ +2OH– Ba(OH)2 =Ba++2OH– 思考:电离产物的共同之处是什么?
2020/12/6
11
2.碱能与酸反应
实验2:氢氧化钠溶液与酸反应
1)、在2支分别盛有少量氢氧化钠稀溶
液的试管里,各滴入1滴酚酞试液,溶液变
( 红色 ),分别向2支试管里逐滴加稀盐
酸和稀硫酸,边滴边振荡,直到(
)
刚好红消色失。
这说明溶液的酸碱性发生了什么变化?
变成中性
2)、用滴管吸取反应后的溶液滴在蒸发皿中, 在小火上烘干,蒸发皿上留下了什么?
2020/12/6
2
2.用化学方程式表示
①用氢氧化铝治疗胃酸过多症,②用盐酸除
铁锈,③用硝酸钡检验硫酸的存在,④用硝 酸银检验盐酸的存在,⑤用稀盐酸除热水瓶 中的水垢(水垢的主要成分是碳酸钙和氢氧 化镁)
Al(OH)3+3HCl=AlCl3+3H2O 6HCl+Fe2O3=2FeCl3+3H2O Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 ACagCNOO3+3+2HCl=ACagCl2↓+H+H2ON+OC3O2↑
2020/12/6
1
1.写出下列化学反应方程式 ①硫酸和铝反应②稀硝酸和氧化镁反应 ③盐酸和氢氧化铁反应④碳酸钠和硝酸反应
2Al+3H2SO4=Al2(SO4)3+3H2↑ MgO+2HNO3=Mg(NO3)2+H2O 3HCl+Fe(OH)3=FeCl3+3H2O Na2CO3+2HNO3=2NaNO3+H2O+CO2↑
阅读教材,回答中和反应工农业生 产上有何用途?
2020/12/6
15
2).中和反应的应用:
农业上用熟石灰[Ca(OH)2]降低土壤的 酸性,达到改良酸性土壤的目的.石油 工业上用氢氧化钠[NaOH]中和过量的硫 酸[H2SO4];医学上用氢氧化铝[Al(OH)3] 中和过多的胃酸.
2020/12/6
