第15讲 配位化学基础(2)
《配位化学基础》PPT课件

性分子,电导为0,分子中的三个Cl-反响性都低。
配位化学简史
———奠基时期
• 1893年,26岁瑞士化学家维尔纳
(Alfred Werner)根据大量的实验事
实,发表了一系列的论文,提出了现
代的配位键、配位数和配位化合物构
造的根本概念,并用立体化学观点成
功地说明了配合物的空间构型和异构
Noble prize in 现象。奠定了配位化学的根底。
配位化学的根本概念
配合物的定义
中国化学会1980年《无机化学 命名原则》狭义定义:具有接 受电子的空位原子或离子(中 心体)与可以给出孤对电子或 多个不定域电子的一定数目的 离子或分子(配体)按一定的 组成和空间构型所形成的物种 称为配位个体,含有配位个体 的化合物称为配合物。
国际纯粹及应用化学联合会无 机化合物命名法广义定义:凡 是由原子B或原子团C与原子A 结合形成的,在某一条件下有 确定组成和区别于原来组分( A、B或C)的物理和化学特性 的物种均可称为配合物。
for centuries, CoordiFnea4t[iFoen(CN)6]3 。〔兽皮或牛血+Na2CO3在
Chemistry chemistry
sisinacebr1a8n9c3铁h. 锅of中煮沸〕。
• 周朝,使用配合物作为染料。?诗经?中记载
“缟衣茹藘〞、“茹藘在阪〞。“茹藘〞就是
茜草,当时用茜草的根〔二羟基蒽醌〕和粘土
• 50年代,分子轨道和晶体场理论的开展; • 60年代以来,二茂铁、环戊二烯、一氧化
碳、烯烃配合物等大量过渡金属有机配合 物和新型配合物的合成及应用
新型配合物的合成和构造 生物化学的崛起
功能配合物材料的开发 构造方法和成键理论的开拓 从配位化学到超分子化学
配位化学(第二章)

有三种水合异构体。 [ Cr Cl (H2O)5 ] Cl2 · H2O
蓝绿色
[ Cr Cl2 (H2O)4 ] Cl · 2H2O
绿色
(6)聚合异构 具有相同的化学式,各个聚合异构体的化学 式是最简式的 n 倍。例如: [ Co(NH3)3(NO2)3 ] n =1 [ Co(NH3)6 ] [ Co(NO2)6 ] n =2 [ Co(NH3)4(NO2)2 ] [ Co(NH3)2(NO2)4 ] n =2 [ Co(NH3)5(NO2) ] [ Co(NH3)2(NO2)4 ] 2 n =3 [ Co(NH3)6 ] [ Co(NH3)2(NO2)4 ] 3 n =4 [ Co(NH3)4(NO2) 2 ] 3 [ Co(NO2)6] [ Co(NH3)5(NO2) ] 3 [ Co(NO2)6] 2 n =4 n =5
可见,多原子配体分别以不同种 配位原子与中心离子键合的现象称为 键合异构。
[ CoBr (NH3)5 ]SO4 → [ CoBr (NH3)5]2+ + SO42暗紫色
[ Co SO4(NH3)5 ] Br → [ Co SO4(NH3)5]+ + Br紫红色
(5)水合异构 凡是化学组成相同,但水分子在内界和外界 分布不同的配合物,互为水合异构。 例如:CrCl3· 6H2O [ Cr(H2O)6 ] Cl3
Co
Cl
H3 N H3 N
NH3
Co
Cl
NH3
面式-三氯· 三氨合钴(Ⅲ) fac-[ Co(NH3)3Cl3
Cl
经式-三氯· 三氨合钴(Ⅲ) mer-[ Co(NH3)3Cl3 ]
2.2.2 旋光异构现象
旋光异构又叫对映异构。 对映异构:组成相同,空间构型相同,互为不 可重叠的镜像关系,就象人的左右手一样,这样的 异构体叫对映异构体。 例如: Ma2b2 c2型八面体配合物有一对对映 异构体。
大一有机化学知识点配位

大一有机化学知识点配位大一有机化学知识点之配位在大一学习有机化学的过程中,我们不可避免地要接触到配位化学。
配位化学是指通过配位键将金属离子和配位体(通常为有机物)结合在一起形成配合物的化学领域。
它是有机化学与无机化学的重要交叉学科,对于理解金属有机化合物的性质以及有机合成的理论基础具有重要意义。
在配位化学中,有一些重要的概念和知识点值得我们深入了解。
首先,我们来看一下配位键的形成。
在配位化学中,金属离子通常通过给体配位基捐出电子对来与配位体形成配位键。
常见的给体配位基包括氮、氧、硫等原子,它们通常以孤立电子对形式与金属离子结合。
在形成配位键的过程中,金属离子通过与配位体的配位键相互作用,形成配位键。
这种相互作用的强弱与金属离子的电子云密度有关。
对于具有较高电子云密度的金属离子,它们通常能够与更多的配位体形成配位键,形成多核配合物。
其次,我们来讨论一下配合物的命名。
在配位化学中,命名配合物是非常重要的。
一般情况下,配合物的命名是由两个部分构成的:中心金属离子的名称和配位体的名称。
对于中心金属离子的名称,我们通常使用常见金属的名称,如铜、铁、锌等。
而对于配位体的命名,根据配位体的性质和结构,有机会出现一些特殊的命名规则。
比如,当配位体为有机物时,根据配位体中的功能基团的命名规则,可以对其进行命名。
此外,还有一些特殊的配位体命名规则,如命名含有吡啶环的配合物时,通常会使用编号来表示其位置。
正确的命名是确保我们准确理解和交流配位化学知识的关键。
接下来,我们来探讨一下配位体的选择和配位理论。
在配位化学中,配位体的选择对于配位化合物的性质具有重要影响。
当配位体中含有多个给体原子时,通常能够与金属离子形成多个配位键,从而形成多核配合物。
此外,配位体的选择还与金属离子的电子云密度、电荷等相关。
在配位理论方面,我们通常会接触到一些重要的理论模型,如配位键理论、晶体场理论等。
这些理论模型帮助我们理解和预测配位化合物的性质,为有机合成和催化反应提供了理论指导。
配位化学知识点总结

配位化学知识点总结一、配位化学的基本概念配位化学是研究金属离子(或原子)与配体之间形成的配位化合物的结构、性质和反应的化学分支。
首先,我们来了解一下什么是配体。
配体是能够提供孤对电子与中心金属离子(或原子)形成配位键的分子或离子。
常见的配体有水分子、氨分子、氯离子等。
而中心金属离子(或原子)则具有空的价电子轨道,可以接受配体提供的孤对电子。
配位键是一种特殊的共价键,由配体提供孤对电子进入中心金属离子(或原子)的空轨道而形成。
配位化合物则是由中心金属离子(或原子)与配体通过配位键结合形成的具有一定空间结构和化学性质的化合物。
二、配位化合物的组成配位化合物通常由内界和外界两部分组成。
内界是配位化合物的核心部分,由中心金属离子(或原子)与配体紧密结合而成。
例如,在Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺就是内界。
外界则是与内界通过离子键结合的其他离子。
在上述例子中,SO₄²⁻就是外界。
中心金属离子(或原子)的化合价与配体的化合价之和等于配位化合物的总化合价。
配位数指的是直接与中心金属离子(或原子)结合的配体的数目。
常见的配位数有 2、4、6 等。
三、配位化合物的结构配位化合物具有特定的空间结构。
常见的配位几何构型有直线型、平面三角形、四面体、八面体等。
例如,配位数为 2 时,通常形成直线型结构;配位数为 4 时,可能是平面正方形或四面体结构;配位数为 6 时,多为八面体结构。
这些结构的形成取决于中心金属离子(或原子)的电子构型和配体的大小、形状等因素。
四、配位化合物的命名配位化合物的命名有一套严格的规则。
先命名外界离子,然后是内界。
内界的命名顺序为:配体名称在前,中心金属离子(或原子)名称在后。
配体的命名顺序遵循先无机配体,后有机配体;先阴离子配体,后中性分子配体。
对于同类配体,按配体中原子个数由少到多的顺序命名。
如果配体中含有多种原子,先列出阴离子配体,再列出中性分子配体。
无机化学课件--第二章 配位化合基础

叫左旋异构体(又叫L-异构体),向右旋转的异构
体叫右旋异构体(又叫D-异构体)。等量左旋异构
体与右旋异构体混合后不具旋光性,这样的混合
物叫外消旋混合物(Racemic mixture)。
从几何异构看,下图中1、2确为同一化合
物. 但它们却互为“镜像”,不存在对称面,不 能重叠,这称为“旋光异构现象”.
N H2
配位数:配位原子数
单基配体中形成体的配位数 = 配位体的数目;
多基配体中形成体的配位数 = 配位体的数目与基数的乘积。
对配位数的影响: 1. 电荷: 形成体电荷增加,配位数增大;配体 电荷增加,配位数减小 Pt2+ [PtCl4]2[Zn(NH3)6]2+ Pt4+ [PtCl6]2-
电离异构:溶液中电离成不同离子。 [CoBr(NH3)5]SO4→[CoBr(NH3)5]2-+SO42- [Co(SO4)(NH3)5]Br→[Co(SO4)(NH3)5]+ +Br-
构型异构:同一配合物有两种或以上的
空间构型(如 四面体型和平面构型)
水合异构:水分子处于内界或外界不同而引起的
别占据八面体的6个顶点,由此产生的静电
键合异构现象
两可配体同不同的配位原子配位
亚硝酸根离子 (NO )是两可配位体。N原子 2 配位时产生硝基络合物,O原子配位时则形成亚
硝基络合物。
三
其他异构
配位异构:配体在配阴离子和配阳离子中心
分布不同
[Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6]
配体异构:由于配体互为异构而使配合物 互为异构
4s
4p
CN CN CN CN dsp2杂化
配位化学基础

配位化学基础9.1 配位化合物的基本特征9.1.1 配位化合物及其命名配位化学是研究中心原子或离子(通常是金属)与其周围的作为配位体的其它离子或分子构成的较复杂的化合物及其性质的学科,它是化学的一个分支。
它所研究的对象称为配位化合物,简称配合物。
早期称为络合物,原词complex compounds是复杂化合物的意思。
配合物及配离子一般表示为:配合物: [M(L)l ],[M(L)l]Xn,或K n [M(L)l]配离子: [M(L)l]m+,[M(L)l]m-其中M为中心原子,通常是金属元素。
它可为带电荷的离子,也可为中性原子(一般应标注其氧化值)。
它们具有空的价轨道,是配合物的形成体。
L是配位体,可为离子(通常是负离子)或中性分子,配位体中的配位原子具有孤对电子对,可提供给M的空价轨道,形成配价键。
l表示配位体的个数或配位数。
[]若带m个电荷者为配离子,它与n个异电荷离子X或K形成中性化合物为配合物;若m=0,即不带电荷者为配合物。
如化学组成为CoCl3·6NH3的配合物表示为:中心离子为Co(Ⅲ),它的价电子构型为3d6 4s0 4p0,具有未充满的空的价轨道,是配离子形成体。
NH3是配位体简称配体,其中氮能向中心离子的空轨道提供孤对电子,形成配价键L:→M,钴-氮共享电子对,直接较紧密地结合,这种结合称为配位。
钴离子周围的六个氨分子皆通过配位原子氮向它配位,形成六个配价键,构成具有一定组成和一定空间构型的配离子。
该配离子带有三个正电荷。
Co(Ⅲ)的配位数为6。
Cl-在外围以静电引力与配离子结合成电中性的配合物,称为氯化六氨合钴(Ⅲ)。
由于配体与金属离子结合得相当牢固而呈现新的物理、化学性质,因此用方括号将其限定起来,常称为配合物的内界。
带异电荷的离子称为外界。
由于内界与外界靠静电结合,因此在极性溶剂中容易解离。
NH3、H2O、卤素负离子(X-)和OH-等具有孤对电子对的小分子或离子是常见的经典的配体。
配位化学基础

配位数 2
4
6
空
间
构
型
直线形 四面体 平面正方形 八面体
杂化类型 sp
sp3
dsp2 d2sp3/sp3d2
例
Ag(NH3
)
+ 2
NiCl24−
Ni(CN)
2− 4
Co(NH3)63+
配位数
空 间 构 型
3 三角形
杂化类型 sp2
例: HgI3−
5
三角双锥 dsp3/sp3d Fe(CO)5
三氯化六氨合钴(III) 六氟合硅 ( IV ) 酸亚铜
2.配位单元
先配体,后中心 配体前面用 二、三、四 … … 表示该配体的个数; 几种不同的配体之间加“ · ”号隔开; 配体与中心之间加“合”字; 中心后面加 ( ),内用罗马数字表示中心的价态。
3.配体的先后顺序
(1)先无机后有机 (2)先阴离子后分子 (3)同类配体中,按配位原子在英文字母表中的次 序。 (4)配位原子相同,配体中原子个数少的在前 (5)配体中原子个数相同,则按和配位原子直接相 连的其它原子英文字母次序。
配位化学基础
Chapter 11
Chemistry of Coordination Compounds
11.1 配位化合物的基本概念 11.2 配位化合物的价键理论 11.3 配位化合物的晶体场理论 11.4 配位化合物的稳定性
11.1 配位化合物的基本概念
11.1.1 配位化合物 11.1.2 配位化合物的命名
螯合物:由双基或者多基 配体形成的配位化合物常 形成环状结构
乙二胺四乙酸(EDTA)
常见的双基和多基配位体
11.1.2 配位化合物的命名
配位化学知识点总结

配位化学知识点总结配位化学是无机化学的一个重要分支,它研究的是金属离子或原子与配体之间通过配位键形成的配合物的结构、性质和反应。
以下是对配位化学知识点的总结。
一、配位化合物的定义与组成配位化合物,简称配合物,是由中心原子(或离子)和围绕它的配体通过配位键结合而成的化合物。
中心原子通常是金属离子或原子,具有空的价电子轨道,能够接受配体提供的电子对。
常见的中心原子有过渡金属离子,如铜离子(Cu²⁺)、铁离子(Fe³⁺)等。
配体是能够提供孤对电子的分子或离子。
配体可以分为单齿配体和多齿配体。
单齿配体只有一个配位原子,如氨(NH₃);多齿配体则有两个或两个以上的配位原子,如乙二胺(H₂NCH₂CH₂NH₂)。
在配合物中,中心原子和配体组成内界,内界通常用方括号括起来。
方括号外的离子则称为外界。
例如,Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺是内界,SO₄²⁻是外界。
二、配位键的形成配位键是一种特殊的共价键,是由配体提供孤对电子进入中心原子的空轨道形成的。
配位键的形成条件是中心原子有空轨道,配体有孤对电子。
例如,在 Cu(NH₃)₄²⁺中,氨分子中的氮原子有一对孤对电子,铜离子的价电子层有空轨道,氮原子的孤对电子进入铜离子的空轨道,形成配位键。
三、配合物的命名配合物的命名遵循一定的规则。
对于内界,先列出中心原子的名称,然后依次列出配体的名称。
配体的命名顺序是先阴离子,后中性分子;先简单配体,后复杂配体。
在配体名称之间用“·”隔开,配体的个数用一、二、三等数字表示。
如果有多种配体,用罗马数字表示其价态。
例如,Co(NH₃)₅ClCl₂命名为氯化一氯·五氨合钴(Ⅲ)。
四、配合物的空间结构配合物的空间结构取决于中心原子的杂化轨道类型和配体的空间排列。
常见的杂化轨道类型有 sp、sp²、sp³、dsp²、d²sp³等。
配位化学基础知识

如: NH3 中的 N 原子 H2O中的 O 原子
配位化学基础知识
(2)能提供 电子的分子.
如: H
C H
H C
H
配位化学基础知识
3. 配体的类型 (1)单齿配位体: 只有 1 个配位原子的配体.
例 : NH3 H2O F -
配位化学基础知识
1. 中心原子(或形成体)
具有接受孤对电子或多个不定域电子的 原子或离子.
特点: 具有空轨道. 常见的中心原子:
(1)金属原子或离子,过渡金属居多. (2) 具有高氧化态的P区非金属元素.
如:[SiF6]2-、[PF6]-、[BF4]-
配位化学基础知识
2. 配位体(配体) (1)具有孤对电子的分子或离子.
Ir
CO
O C Ir
Ir CO
OC
Ir
CO
O C CO CO
Ir4(CO)12的结构 配位化学基础知识
特点?
5. 螯合物
由中心离子与多齿配体形成具有环状 结构的配合物 。五元、六元环最稳定。
NH2
H2N
2+
H2C H2C
CH2 Cu
CH2
NH2
H2N
[Cu(配e位n化)学2基]2础+知的识 结构
H3C CO
配位化学基础知识
第二节 配合物的类型
1. 单一配体配合物
配合物中只含一种配体,[MLn]
例如: [Cu(H2O)4]2+ [Co(py)4]2+
[Cu(NH3)4]2+ [Cu(en)2]2+
配位化学基础知识
配位化学教案

配位化学教案配位化学是现代化学领域的一个重要分支,它研究物质中金属离子与其它化合物或分子之间形成的配合物结构及性质。
配位化学在生物学、医学、材料科学等领域都有着广泛的应用。
本教案将介绍配位化学的基本概念、原理和相关实验方法,帮助学生深入了解这一领域的知识。
一、配位化学基本概念1.1 配位物的定义配位物是指由中心金属离子和配体分子通过配位键结合而成的化合物。
中心金属离子通常是过渡金属元素,而配体则是能够提供一个或多个孤对电子给中心金属离子形成配位键的分子或离子。
1.2 配位键的形成配位键是通过中心金属离子与配体之间的电子对共价或者协同共价键形成的。
配位键的形成可分为硬配位和软配位两种类型,硬配位以强极性金属离子和小的、硬的配体为主,软配位则以较软的金属离子和大的、软的配体为主。
1.3 配位数和配位几何配位数是指配位物中中心金属离子与配体形成的配位键的个数,而配位几何则是指这些配位键在空间中的排布方式。
常见的配位数包括2、4、6等,配位几何则有线性、四方形平面、八面体等形式。
二、配位化学实验方法2.1 合成配位化合物合成配位化合物是配位化学研究的重要实验方法之一。
通过控制金属离子与配体的摩尔比例及反应条件,可以合成出不同种类的配位化合物。
实验中需要注意反应条件的控制以及产物的纯度检测。
2.2 表征配位化合物表征配位化合物是验证合成产物结构及性质的关键步骤。
常用的表征方法包括元素分析、红外光谱、核磁共振等。
通过表征可以确定配位物的组成、配位键结构以及稳定性等信息。
2.3 测定配位物的性质测定配位物的性质是研究配位化学的重要手段。
包括测定配位化合物的磁性、光谱性质、配位键键长等。
这些性质的测定可以进一步揭示配位物的结构和反应机理。
三、配位化学在生物和医学中的应用3.1 金属配合物药物金属配合物药物是一类利用金属离子与配体形成的稳定配合物来治疗疾病的药物。
例如,铂类抗肿瘤药物顺铂、卡铂等就是金属配合物药物的代表。
配位化学基础

配位化学基础配位化学是在无机化学基础上发展起来的一门具有很强交叉性的学科,配位化学旧称络合物化学,其研究对象是配合物的合成、结构、性质和应用。
配位化学的研究范围,除最初的简单无机加和物外,已包括含有金属-碳键的有机金属配位化合物,含有金属-金属键的多核蔟状配位化合物即金属簇合物,还包括有机配体与金属形成的大环配位化合物,以及生物体内的金属酶等生物大分子配位化合物。
一、配合物的基本概念1.配合物的定义及构成依据1980年中国化学会无机化学命名原则,配合物可以定义为:由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(统称为配体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称为中心原子),按一定的组成和空间构型所形成的化合物。
结合以上规定,可以将定义简化为:由中心原子或离子和几个配体分子或离子以配位键相结合而形成的复杂分子或离子,统称为配体单元。
含配体单元(又称配位个体)的化合物称为配位化合物。
配体单元可以是配阳离子,配阴离子和中性配分子,配位阳离子和阴离子统称配离子。
配离子与与之平衡电荷的抗衡阳离子或阴离子结合形成配位化合物,而中性的配位单元即时配位化合物。
但水分子做配体的水合离子也经常不看成配离子。
配位化合物一般分为内界和外界两部分,配体单元为内界,抗衡阳离子或阴离子为外界,而含中性配位单元的配位化合物则无外界。
配合物的内界由中心和配体构成,中心又称为配位化合物的形成体,多为金属,也可以是原子或离子,配体可以是分子、阴离子、阳离子。
2.配位原子和配位数配位原子:配体中给出孤对电子与中心直接形成配位键的原子配位数:配位单元中与中心直接成键的配位原子的个数配位数一般为偶数,以4、6居多,奇数较少配位数的多少和中心的电荷、半径及配体的电荷、半径有关:一般来说,中心的电荷高、半径大有利于形成高配位数的配位单元,如氧化数为+1的中心易形成2配位,氧化数为+2的中心易形成4配位或6配位,氧化数为+3的易形成6配位。
配位化学基础 ppt课件
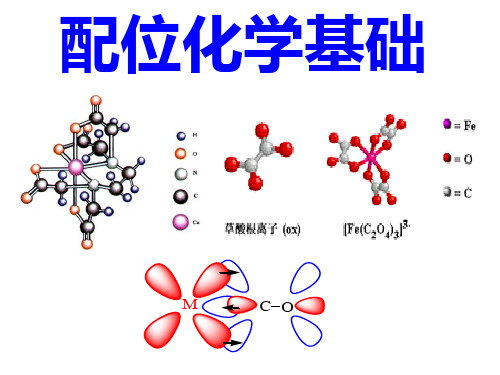
氮配位单齿配体 NH2- (氨基), NH3 (氨) , NO2-(硝基), N3- (氮) CH3NH2(甲胺), NO(亚硝酰), C5H5N(吡啶,Py), NCS- (异硫氰酸根), N2 (双氮) , N3- (叠氮)······
在述配体中,例如 SCN- , NO2- 它们虽然含 有两个不同的配位原子, 但每次只能以单齿方 式配 位,这些配体称为两可配体.
②.多齿配体 /多基配体
在一个配体中有两个或两个以上的配位原 子同时与一个中心原子(或离子)相联结,形成两 个或两个以上的配位键,这类配体称为多齿配体.
乙二胺( en )
配位化学基础
M
CO
内容提要
1 配位化合物的基本概念 2 配位化合物的价键理论 3 配位化合物的晶体场理论 4 配位化合物的稳定性
一、配位化合物Байду номын сангаас基本概念
1. 配位化合物的组成
中心原子
结晶水分子
K3 [Fe (CN)6 ] ·nH2O
抗衡阳离子 配体
中心原子 抗衡阴离子
[Co (NH3 )6 ]Cl3
而配位单元 即内界较稳定,解
离程度小,存在配
外界
内界
位解离平衡.
[ Cu ( NH2CH2COO)2 ]
[Ni(CO)4 ]
内界
中性配合物, 配位单元不带电荷,不存在外界.
配离子与异号配离子结合 [ Co ( NH3 ) 6 ][ Cr( CN ) 6 ]
互为内外界或均为内界
配合物组成确定的方法 元素分析 摩尔电导率 离子交换树脂 凝固点降低 不破坏内界,化学分析 破坏内界,化学分析
化学中的配位化学知识点

化学中的配位化学知识点配位化学是化学中一个重要的分支,它研究的是配位化合物的形成、结构和性质。
配位化合物是由中心金属离子或原子与周围的配体形成的化合物。
在配位化学中,有一些重要的知识点需要我们了解和掌握。
首先,我们需要了解配体的概念。
配体是指能够与中心金属离子或原子形成配位键的分子或离子。
常见的配体有氨、水、氯离子等。
配体通过给予或共享电子对与中心金属离子或原子形成配位键。
其次,我们需要了解配位数的概念。
配位数指的是一个配合物中与中心金属离子或原子形成配位键的配体的个数。
常见的配位数有2、4、6等。
配位数的大小与中心金属离子或原子的电子结构有关。
另外,我们需要了解配位化合物的结构。
配位化合物的结构可以分为简单配位体和配位体离子两种。
简单配位体指的是配体中只有一个配位原子与中心金属离子或原子形成配位键。
而配位体离子则是指配体中有两个或两个以上的配位原子与中心金属离子或原子形成配位键。
此外,还有一些重要的结构类型需要我们了解。
比如,线性结构、四方形结构、八面体结构等。
这些结构类型与配位数和配体的性质有关。
在配位化学中,还有一些重要的概念需要我们了解。
比如,配位键的强度和配合物的稳定性。
配位键的强度取决于配体的性质和中心金属离子或原子的性质。
而配合物的稳定性则取决于配位键的强度和配位数。
此外,还有一些重要的应用需要我们了解。
比如,配位化合物在催化、药物、材料等方面的应用。
配位化合物在催化反应中可以作为催化剂,提高反应速率。
在药物中,配位化合物可以与生物分子形成配位键,发挥药物的作用。
在材料中,配位化合物可以用于制备新型材料,具有特殊的性质和应用价值。
总的来说,配位化学是化学中一个重要的分支,它研究的是配位化合物的形成、结构和性质。
在配位化学中,有一些重要的知识点需要我们了解和掌握,如配体、配位数、配位化合物的结构和配位键的强度等。
同时,配位化学在催化、药物、材料等方面也有着重要的应用。
通过学习和掌握配位化学的知识,我们可以更好地理解和应用化学。
高中化学配位化学知识点归纳总结

高中化学配位化学知识点归纳总结配位化学是化学中一个重要的分支领域,主要研究金属与配体之间的相互作用、配合物的结构、性质和反应机理等内容。
在高中化学课程中,学生通常会接触到与配位化学相关的一些基本概念和理论。
本文将对高中化学配位化学的知识点进行归纳总结,以便学生们更好地理解和应用此部分内容。
一、配位键和配位数配位键是指金属离子与配体之间形成的键。
在配位化合物中,金属离子与配体通过共价键或者均衡键形成配位键。
金属离子和配体之间的配位键数量被称为配位数,常用符号为CN。
常见的配位数有2,4,6等。
二、配体配体是指能够与金属离子形成配位键的小分子或者离子。
配体通常通过给出一对电子与金属离子形成配位键,其中配位键电子对可以是成键电子对、孤立电子对或者共享电子对。
常见的配体包括水分子(H2O)、氨分子(NH3)、硝酸根离子(NO3-)等。
在配合物中,一个或者多个配体与金属离子形成配位键,形成了配合物的结构。
三、配合物的结构配合物的结构受到金属离子和配体之间配位键的类型和数目的影响。
常见的配合物结构有以下几种:1. 线性结构:当金属离子的配位数为2时,配合物的结构呈线性结构。
2. 正方形平面结构:当金属离子的配位数为4时,配合物的结构呈正方形平面结构。
3. 八面体结构:当金属离子的配位数为6时,配合物的结构呈八面体结构。
4. 五边形平面结构:当金属离子的配位数为5时,配合物的结构呈五边形平面结构。
四、配位反应配位反应是指配合物中金属离子与配体之间发生的化学反应。
常见的配位反应有配体置换反应和配合物的还原氧化反应。
在配体置换反应中,一个配体离开配合物,而另一个新的配体进入配合物。
此类反应常用于合成新的配合物或者改变已有配合物的性质。
在配合物的还原氧化反应中,金属离子的氧化态或还原态发生变化,配位键和配位数也可能发生改变。
此类反应常见于电化学反应或催化反应中。
五、配位化学的应用配位化学在生物学、药物学、环境科学等领域具有广泛的应用。
配位化学课件

配位化学课件配位化学课件配位化学是化学中一门重要的学科,它研究的是金属离子与配体之间的相互作用和配位化合物的性质。
在化学课程中,配位化学是一个重要的分支,它不仅涉及到理论知识的学习,还需要进行实验操作和数据处理。
为了更好地教授配位化学知识,许多教师和学者制作了配位化学课件,以帮助学生更好地理解和掌握这门学科。
一、配位化学的基本概念和原理配位化学的基本概念是指金属离子与配体之间的相互作用。
在配位化学中,金属离子通常是正离子,而配体则是带有配位基团的分子或离子。
当金属离子与配体结合形成配位化合物时,它们之间会形成配位键,配位键的形成会导致配位化合物的性质发生变化。
配位化学的原理主要包括配位键的形成和配位化合物的性质。
配位键的形成是指金属离子和配体之间的电子转移过程,通常涉及到配体中的孤对电子和金属离子中的空轨道。
配位化合物的性质则取决于金属离子的性质、配体的性质以及配位键的强度和类型。
二、配位化学课件的设计和使用为了更好地教授配位化学知识,许多教师和学者制作了配位化学课件。
这些课件通常包括理论知识的介绍、实验操作的演示和数据处理的方法。
通过使用配位化学课件,学生可以更直观地了解配位化学的基本概念和原理,提高学习效果。
在配位化学课件的设计中,需要注意以下几个方面。
首先,课件的内容要简洁明了,重点突出,避免冗长和复杂的叙述。
其次,课件的布局要清晰,包括标题、目录、正文和总结等部分,方便学生阅读和理解。
另外,课件中可以加入一些配位化合物的结构示意图和实验操作的演示动画,以增加学生的兴趣和参与度。
配位化学课件的使用可以通过教师讲解和学生自学相结合的方式进行。
教师可以根据课件的内容进行讲解和解答学生的问题,同时可以通过实验操作的演示和数据处理的方法进行实践教学。
学生可以通过阅读课件、观看演示和进行实验操作,加深对配位化学知识的理解和掌握。
三、配位化学课件的优缺点配位化学课件的使用有许多优点。
首先,配位化学课件可以提供直观的图像和动画,帮助学生更好地理解和掌握配位化学的概念和原理。
配位化学基础及解题(2)

分裂能的影响因素—形成体的影响
(1)同种元素中心离子氧化态越高,受配体影 响越大,越大。 (2)中心离子半径越大,d轨道离核越远,受配 体影响越大,越大。 (3)同族金属从上至下分裂能增大。 某些水合离子的分裂能
Cr3+配合物 /kJ/mol Fe(H2O)62+ 124 Fe(H2O)63+ 164 Co(H2O)62+ Co(H2O)63+ 111 223
x
y
x
四面体场
z
平面正方形场
y 37.5O
x 7.5O 22.5O
四方锥场
三角双锥场
表1 在各对称场中d轨道的能级(Dq)
结构 四面体 八面体 平面正方 四方锥 五角双锥
d(Z2) -2.67 6.00 -4.28 0.86 4.93
d(x2-y2) d(xy) d(xz) -2.67 6.00 12.28 9.14 2.82 1.78 -4.00 2.28 -0.86 2.82 1.78 -4.00 -5.14 -4.57 -5.28
其元素分析结果和物理性质如表4a和4b所示。
颜色与波长的关系见表4c。
表1a 元素分析结果
Complex A B Elemental analyses , (wt.%) Fe 5.740, C 37.030, H 3.090 , Cl 10.940, N 8.640 Cr 8.440, C 38.930, H 2.920, Cl 17.250, N 9.080
3、对于配离子[Mn(H2O)6]2+和[Mn(CN)6]2,磁矩为4.9 BM或3.8 BM。 在下图中画出每个配合物的电子排布。 [Mn(H2O)6]2+ [Mn(CN)6]2
大学化学第02章-配位化学基础

2.2.1 几何(立体)异构及几何异构体的命名
多种配体在中心原子(离子)周围所处的相对位置不 同而导致的异构现象称为配合物的几何异构。 具不同配位数、不同配体种类的配合物可有不同数量 的异构体。
20
2.2.1.1 顺-反异构
同种配体处于相邻位 置者称为顺式异构体, 同种配体处于对角位 置者称为反式异构体。
型相结合而成的化合物或离子称为配合物或配离子, 早期称络合物(complex compounds)。
中心离子或原子:配合物中心离子或原子是配合物
的核心,它们必须具有空的低能轨道,通常是金属(尤 其是周期表中的过渡金属) 离子或原子。
配体:含有孤对电子的分子或离子均可作为配体的
配位原子。
中心离子/原子与配体在周期表中的分布
10
2.1.3 配合物的分类
2.1.3.1 按配体种类来分
卤合配合物(以F-、Cl-、Br-、I-为配体)
含氧配合物(如以H2O为配体) 含氮配合物(如以NH3为配体)
含碳配合物(如以CN-、 CO为配体)
其它(含硫、含磷;金属有机化合物等)
2.1.3.2 按配体分子中的配原子数目来分
25
【例2.2】MA2B2C2类型的化合物具有几种几何异构体?
C B A M C A B B A M B C A C A B M A C B C A C M A B C B A A M B C C B
三反式
一反二顺式 M(AABBCC)有5种几何异构体
三顺式
还有其它类型的异构体吗? 三反式;三顺式; 一反二顺式; 一顺二反式?
中心离子相同时,配体的体积越大,配位数越低;
中心离子的电荷数越高,可能的配位数越多。当中心 离子的氧化数分别为+1,+2,+3时,可能的配位数通常 为2, 4或6, 6;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
12.5 配合物的晶体场理论
12.5.1 中心离子d轨道的能级分裂 12.5.2 影响分裂能大小的因素 12.5.3 中心离子d电子的分布 12.5.4 晶体场稳定化能(CFSE) 12.5.5 配离子的电子吸收光谱
无机化学
12.5 配合物的晶体场(crystal filed)理论
¾产生于1950年代,主要是研究过渡金属离子的 d轨道在配体的作用下发生的能级分裂,以及由 此所产生的影响。
¾能级分裂: M的正电荷与L的负电荷相互吸引形 成配合物时, M的5个d轨道电子会受到L电子云的 排斥。在不同方向作用的大小不同,d轨道能量变 化程度不同,出现能级分裂。
无机化学
正八面体场对d轨道的作用
d d x2 − y2
z2
伸展方向正好处于 正八面体的6个顶 点方向,与配体迎 头相遇,能量上升 得更高。
强八面体场中
1、配合物几何构型的影响
zd轨道在不同晶体场中的能级分裂不同:在正四面体场中,配
体占据立方体的4个顶点,配体与d轨道之间不会出现迎头相碰
的作用,所以正四面体的分裂能(△t)低于正八面体的分裂
能(△o),仅相当于正八面体分裂能的4/9。
Z
Z
d(z2)
X Y
Y 正四面体场
无机化学
d(x2-y2)
Δo /cm-1
13000
-
-
18600
[Co(NH3)6]3+ 22900
[Co(en)3]3+ 23300
[Co(CN)6]3-
-
34000
1cm-1=11.96J·mol-1=1.23977×10-4eV
无机化学
¾中心离子的影响
配体相同,中心金属离子相同,但价态不同时,离子价 态越高,分裂能越大。
则:E(eg) = + 6Dq E(t2g)=- 4Dq
¾八面体场中,中心离子的t2g组轨 道 能 量 低 于 平 均 值 4 Dq, 而 eg 组 轨 道能量高出平均值6 Dq。 ¾注意:Dq只是表示能量相对高低 的“份量”。配合物不同,分裂能△0 不无同机,化D学q值也不同。
dz2
dx2-y2 (eg)
轨道(eg orbital),将能量相对较低的一组 (含dxy、dyz、dxz)称t2g轨道(t2g orbital)。
¾分裂能:两组轨道间的能量差称为分裂能 (cleavage energy),以△o表示。注意△o只是 表示能级差的一种符号,对不同的配合物体 系,分裂能不同,△o的值也不同。
无机化学
eg ↑ ↑ t2g ↑↓ ↑ ↑
-4Dq×6 = -24Dq
-4Dq×4+6Dq×2 = -4Dq
CFSE(1)= 24Dq
CFSE(2)= 4Dq
稳定性:Fe2+ - CN- > Fe2+ - NH3 无机化学
讨论: 考虑电子成对能的影响-- CFSE修正值
(a)Fe2+ -CN-强场
(b)Fe2+ -NH3弱场
eg
eg ↑ ↑
t2g ↑↓ ↓↑ ↓↑ t2g ↑↓ ↑ ↑
CFSE(1)= 24Dq-2P 无机化学
CFSE(2)= 4Dq
晶体场稳定化能(CFSE)的计算公式
⎩⎨⎧mm12::八球面形体体场场中中,,
eg
eg ↑ ↑
t2g ↑↓ ↓↑ ↓↑ t2g ↑↓ ↑ ↑
CFSE(1)= 24Dq-3P
CFSE(2)= 4Dq -P
对吗?
无机化学
CFSE定义: 中心离子的d电子从假如未分裂的d轨道 进入分裂后的d轨道所产生的能量下降值。
与分裂前对比 d6自由离子
↑↓ ↑
↑
↑
↑
(a)Fe2+ -CN-强场
(b)Fe2+ -NH3弱场
dxy、dyz、 dxz与正八 面体轴向相 错,作用 小,能量上 升得少些。
无机化学
八面体场中d轨道与配体的相互作用
X
Y
XY平面
d 轨道的 角度分布图
Z
Z轴方向
d轨道与配体 的相互作用
无机化学
XY平面
YZ平面
XZ平面
1
¾分裂组:等价的5个d轨道分裂为2 组,将能
量相对较高的一组(含 d z2 d 、 x2− y2 )称为eg
[Fe(H2O)6]2+ 10400
[CrCl6]3- [MoCl6]313600 19200
无机化学
12.5.3 中心离子d电子的分布
¾排布原则:中心离子d轨道出现能级分裂,电子需 要重新分布。遵守基本原则 “最低能量原理”
同时遵守:“Pauli不相容原理”、 “洪特规则” 同时考虑电子成对能P,即两个电子进入同一轨 道需耗的能量。 强场:Δo > P 弱场:Δo < P
t2g4 eg2
4 5.62 高 外轨型 sp3d2
正八面体场中d 电子在t2g和eg轨道中的分布
z对比价键理论,外轨型配离子对应高自旋,内轨型对应低自旋。对于d7离 子(如Co2+),虽然只能形成外轨型(sp3d2杂化),但仍可以分别形成低 自旋(未成对电子为1)和高自旋配离子(未成对电子为3)两种情况。
dXz 1.14 -3.86 1.78 -5.14 -2.72 -4.57 -4.00
△ 16.56 9.32 4.45 17.42 9.79 13.71 10.00
后面内容将主要讨论正八面体场的情况。 无机化学
(二)晶体场分裂能Δo大小的影响因素 分裂能△o的大小与配体的场强、中心离子的电荷 数及中心离子在周期表中的位置等因素有关。
无机化学
4
12.5.4 晶体场稳定化能(CFSE)
¾晶体场稳定化能:在晶体场中,中心离子的d电子 从假如未分裂的d轨道进入分裂后的d轨道所产生的能 量下降值。
无机化学
2、晶体场稳定化能的计算
例如:Fe2+ --- d6 构型
(a)Fe2+ -CN-强场
eg t2g ↑↓ ↓↑ ↓↑
(b)Fe2+ -NH3弱场
体系总能量:E(a)=3E(t2g)+E(eg) = 4E(t2g)+ △o ¾情况b:d电子集中排在能量低的t2g轨道,避免了 分裂能△o,但出现电子成对排布,需要额外克服电 子成对能P。体系总能量E(b)=4E(t2g)+P ¾两种排列能量差:△E=E(a)-E(b)= △o–P,可见, E(a)与E(b)的大小取决于分裂能△o与电子成对能P的 相对大小。
无机化学
3
12.5.3 中心离子d电子的分布
(1)t2g轨道未满
d1~d3 构 型 , 只 有 一种排列方式,电 子无须动用eg轨道
eg
d1 ↑
t2g
d2
↑↑
eg t2g
无机化学
d3
eg
↑ ↑ ↑ t2g
(2) t2g轨道已满 d8~d10构型, t2g轨 道全部充满,只有一 种排列方式
无机化学
↑ ↑ eg
X 正八面体场
中心离子d轨道在四面体中的能级分裂
dxy、dyz、dxz指向立方体各条棱的中点,而 d z2 d 、 x2 − y2
轨道指向立方体的面心,相对而言,前者受到配体的作用更 强些,所以dxy、dyz、dxz轨道能量高于平均值。
(a)
无机化学
(b)
2
结论:几何构型是影响分裂能大小的主要因素。
[Co(H2O)6]3+ △o=18600 cm-1 [Co(NH3)6]3+ △o= 23000 cm-1
[Co(H2O)6]2+ △o= 9300 cm-1 [Co(NH3)6]2+ △o= 10100 cm-1
配体相同,中心金属离子不同,但为同族元素,且价态
相同时,从上到下分裂能增大。例如:
+ 6Dq
△o
- 4Dq
dxy dxz dyz (t2g)
12.5.2 影响分裂能大小的因素
1、配合物几何构型的影响 2、配体的影响
3、中心离子的影响
dz2 dx2-y2
dz2 dx2-y2 (eg)
影响△大小
Es
的因素是什么?
无机化学
△
△′
dxy dxz dyz 弱八面体场中
dxy dxz dyz (t2g)
d8 ↑↓↑↓ ↑↓ t2g
d9
↑↓ ↑ eg
↑↓↑↓ ↑↓ t2g
d10
↑↓↑↓ eg ↑↓↑↓ ↑↓ t2g
(3)M为d4~d7时,存在两种可能排列,以d4为例
¾情况a:d电子分占不同轨道且自旋平行,此时有 一个电子排在能量较高的eg轨道,使体系的能量升 高△o (因E(eg)=E(t2g)+△o)。
强场 低自旋 Δo > P
dddd4756
eeegggg tttt222g2ggg
↑↑↑↑ ↑↑↑ ↑↑↑↑↓↓↑↑↑↑↓↑↑↑
eegegegg ↑
tt2t2gtg2g2g↑↑↓↑↓↑↓↓↑↑↓↑↓↑↑↑↑↓↓
无机化学
例: [Co(CN)6]3- 与[CoF6]3-性质比较
Δo /J P/J 场
Co3+的价电子构型
¾配体的影响:中心离子相同,配体不同,则由配体的晶体
场分裂能力越强,所产生的晶体场场强越大,分裂能越大。 八面体配合物,用电子光谱法分别测定它们在八面体场 中的分裂能(△o),按由小到大的次序排列,得如下序列 (用“*”号标记的原子表示配位原子):
I-<Br-<*SCN-①~Cl- <NO3-<F-<尿素~OH-~*ONO -~HCOO-<C2O42-<H2O<吡啶~EDTA<*NCS-< *NH2CH2COO*-<NH3<en<*NO2<*CO~*CN-
