电化学原理知识点
电化学原理知识点总结

电化学原理知识点总结电化学原理是一门研究电子和离子在电解溶液中的反应性能,以及电解溶液对电导率、电位等影响的重要学科。
它涉及电解质和电解溶液的电离状态,阳极还原氧化物和阴极氧化物的氧化还原反应,以及参与水质电解的水分解反应和络合反应等多方面。
1、电解质的电离状态:电解质的电离状态可以描述它内部的结构,是电化学反应的基础。
它指的是一种特殊化学物质在给定条件下,其在溶液中产生正负离子的程度,由此反映出它能够承受的电位强度。
2、阴极氧化物与阳极还原物的氧化还原反应:阴极氧化物的氧化反应在电解溶液中的氧化反应是一个重要的分支。
阴极氧化物通常会在氧化过程中吸收电子而产生阳极还原物;阳极还原物则会从溶液中吸收电子以完成还原反应。
3、参与水质电解的水分解反应和络合反应:水分解反应是指电解溶液中水分子由于电场的作用拆解成H+离子和OH-离子;而络合反应指水分子在电场作用下通过H+离子和OH-离子的络合,形成H2O分子,从而稳定电解溶液的PH值,而水分解和络合反应又是电解溶液中的电离平衡反应,它们的平衡常数为水离子均衡常数。
4、电解溶液对电位的影响:电解溶液有很强的稳定性,包括电位稳定性,电导率稳定性和pH稳定性。
电位是指溶液中电子流动的势能,即溶质对另一种溶质的表示,电位可以反映溶液的离子浓度,它是电解溶液中电子移动的最基本参数。
5、电解溶液对电导率的影响:电导率是指溶液中电子流动的速率,它是电解溶液中电子移动的第二个基本参数,它可以反映溶液的分解程度和稳定性。
电导率受溶液的离子浓度、电位、电解质等因素的影响,因此,在研究电解溶液的整体性能时,需要仔细考虑这些因素的相互关系。
总之,电化学原理是一门重要的学科,其原理是电子和离子在电解溶液中的反应性能,以及电解溶液对电导率、电位等影响。
它涉及电解质和电解溶液的电离状态,阳极还原氧化物和阴极氧化物的氧化还原反应,以及参与水质电解的水分解反应和络合反应等,为理解电化学反应提供重要的知识与基础。
电化学原理知识点

电化学原理知识点电化学原理第一章绪论两类导体:第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极原电池(-)电解池(+)阴极:发生还原反应的电极原电池(+)电解池(-)电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型 水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I :离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为:iii x αγ=∑=221i i z m I IA ⋅-=±γlog注:上式当溶液浓度小于0.01mol ·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S ( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。
当量电导(率):在两个相距为单位长度的平行板电极之间,放置含有 1 克当量电解质的溶液时,溶液所具有的电导称为当量电导,单位为Ω-1 ·cm2·eq-1。
电化学知识点总结

电化学知识点总结电化学是研究电能和化学能之间相互转化及转化过程中有关规律的科学。
它是化学学科的一个重要分支,在日常生活、工业生产以及科学研究中都有着广泛的应用。
下面我们来对电化学的一些重要知识点进行总结。
一、原电池原电池是将化学能转化为电能的装置。
1、构成条件(1)两个活泼性不同的电极,其中一个相对较活泼,另一个相对较不活泼。
(2)电解质溶液。
(3)形成闭合回路。
(4)能自发地发生氧化还原反应。
2、工作原理以铜锌原电池为例,在稀硫酸溶液中,锌比铜活泼,锌失去电子成为锌离子进入溶液,电子通过导线流向铜电极,溶液中的氢离子在铜电极上得到电子生成氢气。
在这个过程中,锌电极发生氧化反应,是负极;铜电极发生还原反应,是正极。
负极的电极反应式为:Zn 2e⁻= Zn²⁺;正极的电极反应式为:2H⁺+ 2e⁻= H₂↑。
3、原电池的正负极判断(1)根据电极材料:较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
(2)根据电子流动方向:电子流出的一极为负极,电子流入的一极为正极。
(3)根据电流方向:电流流出的一极为正极,电流流入的一极为负极。
(4)根据离子移动方向:阴离子移向的一极为负极,阳离子移向的一极为正极。
(5)根据电极反应类型:发生氧化反应的一极为负极,发生还原反应的一极为正极。
二、电解池电解池是将电能转化为化学能的装置。
1、构成条件(1)直流电源。
(2)两个电极(惰性电极或活性电极)。
(3)电解质溶液或熔融电解质。
(4)形成闭合回路。
2、工作原理以电解氯化铜溶液为例,连接电源正极的电极称为阳极,发生氧化反应,氯离子在阳极失去电子生成氯气;连接电源负极的电极称为阴极,发生还原反应,铜离子在阴极得到电子生成铜单质。
阳极的电极反应式为:2Cl⁻ 2e⁻= Cl₂↑;阴极的电极反应式为:Cu²⁺+ 2e⁻= Cu。
3、电解池的阴阳极判断(1)与电源正极相连的为阳极,与电源负极相连的为阴极。
第四章电化学基础知识点归纳

第四章电化学基础知识点归纳第四章电化学基础知识点归纳电化学是研究电和化学之间关系的分支学科,主要研究电能和化学变化之间的相互转化规律。
本章主要介绍了电化学基础知识点,包括电化学的基本概念、电池反应、电解反应以及其相关的电解池和电极。
一、电化学的基本概念1. 电化学:研究电和化学之间相互关系的学科。
2. 电解:用电能使电解质溶液或熔融物发生化学变化的过程。
3. 电解质:能在溶液中产生离子的化合物。
4. 电解池:由电解质、电极和电解物质组成的装置。
5. 电极:用来与溶液接触,传递电荷的导体。
二、电池反应1. 电池:将化学能转化为电能的装置。
由正极、负极、电解质和导电体组成。
2. 电池反应:电池工作时在正负极上发生的化学反应。
3. 氧化还原反应:电池反应中常见的反应类型,在正极发生氧化反应,负极发生还原反应。
4. 电池电势:电池正极和负极之间的电位差。
5. 电动势:电池正极和负极之间的最大电势差。
三、电解反应1. 电解:用电流使电解质发生化学变化的过程。
2. 导电质:在电解质中起导电作用的物质。
3. 离子:在溶液中能自由移动的带电粒子。
4. 阳离子:带正电荷的离子。
5. 阴离子:带负电荷的离子。
6. 电解池:由电解质溶液、电解质和电极组成的装置。
7. 电解程度:电解质中离子的溶解程度。
8. 法拉第定律:描述了电解过程中,电流量与电化学当量的关系。
四、电解池和电极1. 电解槽:承载电解液和电极的容器。
2. 阳极:电解池中的电流从电解液流入的电极,发生氧化反应。
3. 阴极:电解池中的电流从电解液流出的电极,发生还原反应。
4. 阳极反应:电解池中阳极上发生的氧化反应。
5. 阴极反应:电解池中阴极上发生的还原反应。
6. 电极反应速度:电极上反应的速度。
7. 电极反应中间体:反应过程中形成的中间物质。
电化学是现代科学和工程领域中的重要分支,广泛应用于电池、电解、蓄电池、电解涂层、电化学合成等领域。
了解电化学的基础知识,有助于我们更好地理解和应用电化学原理。
电化学原理知识点(完整资料).doc

【最新整理,下载后即可编辑】电化学原理第一章 绪论 两类导体: 第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极 原电池(-)电解池(+) 阴极:发生还原反应的电极 原电池(+)电解池(-) 电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型 水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
ii i x αγ=规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I :离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为:注:上式当溶液浓度小于0.01mol ·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S ( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。
当量电导(率):在两个相距为单位长度的平行板电极之间,放置含有1 克当量电解质的溶液时,溶液所具有的电导称为当量电导,单位为Ω-1 ·cm2·eq-1。
电化学的原理

电化学的原理
首先,电解是指利用外加电压使电解质溶液或熔融的电解质发生分解的过程。
在电解过程中,正极吸引阴离子,负极吸引阳离子,使得电解质分解成相应的阴阳离子。
电解的原理可以用法拉第电解定律来描述,即电解质的分解与通过电解质的电荷量成正比。
电解在工业生产中有着广泛的应用,例如电镀、电解制氢、电解制氧等。
其次,电化学反应是指在电化学条件下,化学反应与电流直接相关的反应。
在电化学反应中,电子转移是不可或缺的,它使得化学反应在电化学条件下发生。
电化学反应的原理可以通过纳尔斯特方程来描述,即电化学反应速率与电极上的电势差成正比。
电化学反应在电池、电解池、电化学传感器等领域有着重要的应用。
总的来说,电化学的原理是电与化学之间相互转化的基本规律。
通过对电解和电化学反应的研究,可以更深入地理解电化学的本质,为电化学在能源、环境、材料等方面的应用提供理论基础。
希望本文能够帮助读者更好地理解电化学的原理,促进电化学领域的发展和应用。
电化学知识点完整版
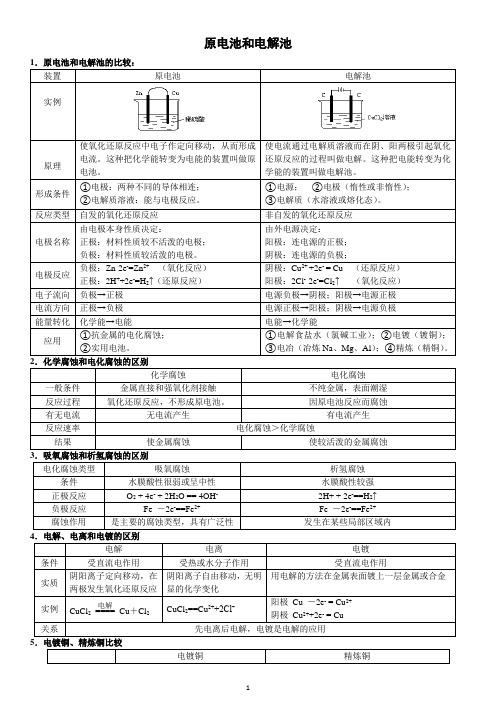
原电池和电解池561.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀:CO 2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
⑵在金属表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法①外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
②牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极3。
常见实用电池的种类和特点⑴干电池(属于一次电池)①结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。
②电极反应负极:Zn-2e-=Zn2+正极:2NH4++2e-=2NH3+H2NH3和H2被Zn2+、MnO2吸收:MnO2+H2=MnO+H2O,Zn2++4NH3=Zn(NH3)42+⑵铅蓄电池(属于二次电池、可充电电池)①结构:铅板、填满PbO2的铅板、稀H2SO4。
②A.放电反应负极:Pb-2e-+ SO42- = PbSO4正极:PbO2 +2e-+4H+ + SO42- = PbSO4 + 2H2OB.充电反应阴极:PbSO4 +2e-= Pb+ SO42-阳极:PbSO4 -2e- + 2H2O = PbO2 +4H+ + SO42-2PbSO4 + 2H2O===总式:Pb + PbO2 + 2H2SO4放电充电注意:放电和充电是完全相反的过程,放电作原电池,充电作电解池。
电化学的基本原理

电化学的基本原理
电化学是一门研究电现象与化学反应之间相互关系的学科。
其基本原理可以归纳为以下几点:
1. 电化学反应:电化学反应是指在电解质溶液中,由于电荷的转移引起的化学反应。
这些反应既可以是氧化还原反应(redox reaction),也可以是非氧化还原反应。
2. 电解质:电解质是指能够在溶液中分解成离子的化合物。
在电解质溶液中,正负离子会在电场的作用下迁移,形成电流。
3. 电极反应:在电解池中,电化学反应发生在电极上。
电极分为阴极和阳极,阴极是电子的还原(还原剂被氧化),阳极是电子的氧化(氧化剂被还原)。
在电解质溶液中,阴极处的电子流向阳极,离子则沿相反的方向迁移。
4. 电势和电动势:电势是指电荷在电场中具有的能力。
电动势是指电池或电解池中的电势差,是推动电荷在电路中流动的力量。
电动势可以通过两个电极之间的差异来测量。
5. 极化和电解过程:在电极表面,由于反应产物的聚积或生成速率不同,可能会导致电解过程受到一定的限制,形成电解质溶液中的电化学极化。
极化会影响电解质溶液的电导率和电化学反应速率。
6. 法拉第电解定律:法拉第电解定律是描述电化学反应中电流与物质的量之间的关系。
根据法拉第电解定律,电流的大小与
电化学反应的速率成正比,与物质的摩尔数之间也存在一定的比例关系。
总之,电化学研究了电解质溶液中的电化学反应以及电荷的转移过程。
了解这些基本原理对于理解电化学现象和应用电化学技术具有重要意义。
电化学高三知识点

电化学高三知识点一、电化学的基本概念电化学是研究电能和化学能相互转化的学科。
它研究化学反应伴随的电荷转移及电流与物质之间的相互关系。
在电化学中,常常涉及两种电极溶液之间的电荷转移过程,即电化学反应。
二、电池电池是将化学能转化为电能的装置。
电池有三大要素:正极、负极和导电电解质。
正极是发生氧化反应的电极,负极是发生还原反应的电极,而导电电解质则负责在两个电极之间传递离子。
电池的工作原理是通过氧化还原反应,使得正负极之间产生电势差,从而驱动电子在外部电路中流动。
三、电解池电解池是利用外加电流使化学反应向一个特定方向进行的装置。
通常,电解池包括一个导电容器(如玻璃或塑料容器)、两个电极(阳极和阴极)以及电解质(溶液或熔融态物质)。
当外加电压过大时,电解质中的离子会发生氧化还原反应,使阳极和阴极上的物质得以电离,并在导电容器中产生电流。
四、电解质溶液电解质溶液是指溶液中含有能够形成离子的物质。
在电解质溶液中,正离子向阴极移动,负离子向阳极移动,以维持电荷平衡。
电解质溶液的离子浓度越高,电导率越大。
五、电解和电镀电解是一种利用电流通过电解质溶液时产生的化学变化。
电解可以使离子化合物分解成离子,也可以使离子在溶液中发生氧化还原反应。
电镀是电解过程中的一种应用,通过电解沉积在阳极上的金属离子,实现对金属表面的镀覆。
六、电位和电动势电位是指电极与电解质接触时产生的电化学现象。
不同物质的电极在与相同电解质接触时,具有不同的电位。
电动势是指电池、电解池等装置产生电流时的推动力或能量转换效果,它与电极的电势和电解质的浓度有关。
七、标准电极电势标准电极电势是指在标准状态下,电极与电解质接触时所产生的电势。
标准电极电势与电极中各物质的浓度无关,只与温度有关。
标准电极电势可以用来判断各种反应的进行方向以及电池的电动势。
八、电解质溶液的电导率电导率是指电解质溶液对电荷传递的能力。
电解质溶液的电导率与溶液中离子的浓度、离子的迁移速率以及离子的电荷数有关。
电化学的基本原理

电化学的基本原理
电化学是研究电与化学之间相互转换关系的学科。
它的基本原理包括以下几个方面:
1. 均匀电场原理:当两个电极之间施加电势差时,存在一个均匀的电场,电势随着距离的增加而线性变化。
2. 电离平衡原理:在电化学过程中,溶液中的物质可以发生电离,形成阳离子和阴离子。
当达到平衡时,离子的生成速率等于离子的消失速率。
3. 傅里叶法则:根据傅里叶法则,任何一个周期性的函数可以表示为若干个不同频率正弦波的叠加。
这个原理在电化学中用来解释频域电化学方法。
4. 动力学原理:根据动力学原理,电化学反应速率与电势差、温度、溶液浓度等因素有关。
动力学原理用来研究电极反应的速率和机理。
5. 线性电化学原理:线性电化学是研究电流与电势之间的线性关系的电化学分析方法。
它基于欧姆定律和法拉第定律,通过测量电流和电势的关系来计算溶液中物质的浓度。
这些基本原理为电化学提供了理论基础,使得我们能够理解和解释电化学现象,并应用于各种实际应用中,如电池、腐蚀、电解等。
高三电化学原理知识点

高三电化学原理知识点电化学原理是高三化学学科中的重要内容之一。
电化学是研究电流与化学反应之间相互关系的学科,对于理解和应用电化学原理知识点,能够帮助我们更好地理解化学反应的本质,提高实验操作和数据处理的技巧。
下面将介绍一些高三电化学原理的知识点。
一、电解质和非电解质电解质和非电解质是电化学反应中重要的概念。
电解质是指在溶液中能够导电的物质,常见的电解质有盐酸、硫酸等。
非电解质则是指在溶液中不能导电的物质,如糖类、酒精等。
电解质在溶液中会形成离子,参与电化学反应,而非电解质不会产生离子。
二、电解池和电解过程电解池是进行电解实验的装置,通常由两个电极和电解质溶液组成。
其中,阴极是电解质溶液中的离子还原的地方,阳极则是电解质溶液中的离子氧化的地方。
在电解过程中,正极吸引阴离子,阴极吸引阳离子,使电解质溶液中的离子发生化学反应。
三、电极电势和电动势电极电势是指电极与溶液中离子达到平衡时所具有的电势差。
电极电势可以通过标准电极电势来表示,标准电极电势是指在标准状态下,电极与溶液中离子达到平衡时所具有的电势差。
电动势则是指电化学电池将化学能转化为电能的能力,是电化学电池的基本特征之一。
四、电化学方程式和电解方程式电化学方程式是描述电化学反应的化学方程式,通常由离子和电子参与。
例如,对于还原反应:Cu2+ + 2e- → Cu,则其电化学方程式可以表示为:Cu2+ + 2e- → Cu。
电解方程式则是指在电解过程中,电解质发生氧化还原反应的方程式。
五、电解质溶液的导电性电解质溶液的导电性是指溶液中能够传导电流的能力。
溶液的导电性与其中的电解质浓度、离子的运动能力等因素密切相关。
一般来说,电解质溶液的导电性随着浓度的增加而增强,而非电解质溶液的导电性很弱。
六、电化学电池电化学电池是将化学能转化为电能的装置。
电化学电池由两个半电池组成,其中包括一个氧化半反应和一个还原半反应。
电化学电池有两种类型:被动型电池和活性型电池。
电化学知识点完整版

电化学知识点完整版电化学作为化学学科的一个重要分支,研究了电化学反应和与电子传递有关的化学过程。
本文将全面介绍电化学的基本概念、原理和应用。
一、电化学的基本概念电化学是研究电子和离子在电解质溶液中的相互作用和转化的学科。
它涉及两种基本类型的反应:即氧化还原反应(简称氧化反应和还原反应)和电解反应。
1. 氧化还原反应氧化还原反应是电化学中最基本的反应类型。
氧化反应是指物质失去电子,还原反应是指物质获得电子。
在氧化还原反应中,电子的转移伴随着离子的迁移和化学键的断裂和形成。
2. 电解反应电解反应是指在电解质溶液中,由于外加电压而引起的非自发反应。
在电解反应中,电子从外部电源进入电解质溶液,物质离子在电解质溶液中发生迁移和转化。
二、电化学的基本原理电化学涉及两个基本的物理现象:电解和电池。
1. 电解电解是指用电流促使电解质溶液中离子发生迁移和转化的过程。
根据电解溶液中离子的迁移方式,电解可以分为两种类型:阳极电解和阴极电解。
在阳极电解过程中,阳离子移向负极,负离子移向阳极;反之,在阴极电解过程中,负离子移向阳极,阳离子移向负极。
2. 电池电池是一种将化学能转化为电能的装置。
它由两个电极(即正极和负极)和介于两者之间的电解质组成。
电池可以分为两类:非可逆电池和可逆电池。
非可逆电池是指只能进行一次反应,反应过程不可逆;可逆电池是指可以进行可逆反应,外加电压可以使电池反应方向发生逆转。
三、电化学的应用电化学在许多领域有着广泛的应用,以下列举其中几个重要的应用领域。
1. 电解和电镀电解和电镀是电化学应用的典型例子。
通过外加电流促使金属离子在电解质溶液中还原为纯净金属,并在电极上形成一层均匀的金属沉积。
2. 燃料电池燃料电池是一种将化学能直接转化为电能的装置。
它通过氧化还原反应将燃料和氧气直接转化为电能,并产生水和二氧化碳等物质。
3. 腐蚀与防腐电化学在材料科学和工程领域中的应用非常重要。
通过研究金属在电解质溶液中的电化学反应,可以预测和防止金属的腐蚀现象,从而在工程中采取有效的防腐措施。
电化学原理知识点

电化学原理知识点 Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT电化学原理第一章绪论两类导体:第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极原电池(-)电解池(+)阴极:发生还原反应的电极原电池(+)电解池(-)电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I : 离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为: 注:上式当溶液浓度小于·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。
当量电导(率):在两个相距为单位长度的平行板电极之间,放置含有1 克当量电解质的溶液时,溶液所具有的电导称为当量电导,单位为Ω-1 ·cm2·eq-1。
电化学工作原理

电化学工作原理
电化学工作原理是指利用电化学反应来实现能量转换、电荷传递和物质转化的原理。
它基于电解质溶液中的离子传递和电子转移过程,利用电化学电位差来推动化学反应进行。
电化学反应涉及两个半反应:氧化半反应和还原半反应。
在电化学电池中,氧化半反应在阳极上进行,还原半反应在阴极上进行。
氧化半反应产生电子,而还原半反应接受电子。
电子在电路中流动,通过外部电源输入或释放电子的方式实现了能量转换。
电化学反应的进行需要满足一定条件,包括溶液中存在可传递电子的物质、电极表面的反应活性、溶液中的离子浓度以及电场强度等。
这些条件相互作用,共同影响着反应速率和电化学效果。
在电化学工作原理中,常见的电化学反应包括氧化还原反应、析氢反应、析氧反应和电解反应等。
这些反应可以应用于电化学电池、电解槽和其他电化学设备中,实现能量储存、金属电镀、废水处理等多种应用。
总之,电化学工作原理是通过利用电化学反应实现能量转换和物质转化的原理。
它基于氧化还原反应,通过电子传递和离子传递来推动化学反应的进行。
通过控制反应条件和电极设计,可以实现多种电化学应用。
电化学原理

电化学原理
电化学原理是研究电化学现象的理论基础,主要包括电化学反应原理、电化学动力学和电化学热力学。
电化学反应原理:电化学反应是指在电场的作用下,电荷转移的化学反应。
电化学反应可分为两类:氧化还原反应和非氧化还原反应。
氧化还原反应是指电子的转移,非氧化还原反应是指离子的转移。
电化学反应的特点是通过在电极上进行电子的转移,实现物质的氧化或还原。
电化学动力学:电化学反应的速率与反应体系中电势差、浓度等因素有关,电化学动力学是研究这些因素对反应速率的影响。
电化学反应速率受到电极表面活化能的影响,而电极表面活化能与电极表面状态有关。
电化学动力学主要研究电化学反应速率的控制因素、速率方程和速率常数等。
电化学热力学:电化学热力学是研究电化学反应的热力学特性,包括反应焓、反应熵和反应自由能等。
根据电化学热力学,可以判断电化学反应是否可逆、反应的方向和反应产物的稳定性等。
1
电化学原理在很多领域中有重要应用,如电池、电解等。
电池是一种将化学能转化为电能的装置,利用电化学反应产生电流。
电解是利用外加电压将化学反应逆向进行,将电能转化为化学能的过程。
2。
电化学知识点

电化学知识点电化学是研究电与化学之间相互作用的科学领域。
它既涉及物理学中的电学,又包括化学学科中的电化学反应。
电化学的研究对于理解和应用电池、电解、腐蚀等过程具有重要意义。
本文将介绍电化学中的一些基本概念和实践应用。
1. 电化学基础电化学中的两个重要概念是电位和电流。
电位是指物体上的电势差,它描述了正电荷和负电荷之间的相对能量差异。
电路中,当电流通过导体时,就像水流动一样,在形成的闭合回路中,电荷会从一个电极流向另一个电极。
这种电流是电化学反应的结果。
2. 电池和蓄电池电池是将化学能转化为电能的装置,它由两个或多个半电池组成。
半电池是一个化学反应产生电流的半截。
蓄电池则是能够重复充放电的电池,它可以在外部电源未连接时储存能量。
蓄电池的工作原理是将化学反应的产物吸附到电极上,然后再通过反向反应释放能量。
3. 电解和电沉积电解是电化学过程中将化学物质分解为离子的过程。
通过将电流通过液体或熔融的盐,可将阴阳离子分离出来。
而电沉积是指通过电流将离子沉积到一个电极上的过程。
这种过程常用于电镀,可以制备出金属薄膜或改变物体的表面性质。
4. 电化学传感器电化学传感器是利用电化学原理来测量、检测化学物质浓度或气体浓度的传感器。
例如,氧气传感器可通过电反应测量氧气浓度,用于监测空气中的氧含量。
另外,pH传感器可以测量溶液中的酸碱度,用于环境监测和实验室分析。
5. 电化学腐蚀电化学腐蚀是金属或合金遭受化学或电化学反应而受到损害的过程。
当金属与电解质接触时,会发生氧化还原反应,导致金属表面的物质流失。
腐蚀不仅使金属失去外观,还可能降低其机械性能和耐用性。
电化学腐蚀的研究有助于开发新的材料和防腐蚀措施。
6. 超级电容器超级电容器是一种能够高效储存电能的装置。
它与传统电池不同,不通过化学反应来储存能量,而是通过电荷在电极表面的吸附和释放来实现。
超级电容器具有高功率密度、长循环寿命和快速充放电等优点,因此被广泛应用于电子设备、电动车等领域。
高三电化学原理知识点汇总

高三电化学原理知识点汇总电化学原理是高中化学中的重要内容,主要研究电流与化学反应之间的关系。
掌握电化学原理的相关知识点对于高三学生来说非常重要。
下面是对于电化学原理的知识点进行的汇总。
一、电解质与非电解质1. 电解质是能在溶液或熔融状态下导电的物质,根据溶液的状态可分为电解质溶液和电解质熔体。
2. 非电解质是不能导电的物质,无论是固体、液体还是气体,都不具备导电性。
二、氧化还原反应1. 氧化还原反应是指物质中的原子失去或获得电子的过程,其中发生氧化的物质称为还原剂,发生还原的物质称为氧化剂。
2. 氧化态和还原态表示了物质在氧化还原反应中电子的失去和获得。
3. 氧化还原反应中,电子的失去和获得必须是同时进行的,被称为一对电子转移反应。
三、电化学电位1. 电化学电位是表示一个半反应中电子的获得或失去能力的物理量,用E表示,单位为伏特(V)。
2. 电化学电位差表示两个半反应之间电子传递的能力差异,称为电动势,用E°表示。
3. 标准电极电位是指在标准状态下,相对于标准氢电极,其他电极的电位差。
标准氢电极的电位差定义为0V。
四、电解池1. 电解池是指在电解过程中,包含有电解质溶液的容器。
其中,正极称为阳极,负极称为阴极。
2. 在电解过程中,阳极发生氧化反应,阴极发生还原反应。
3. 在电解过程中,阳离子在阴极处还原成为物质,阴离子在阳极处氧化成为物质。
五、电解和电镀1. 电解是指利用外加电源的电能将化学能转化为电能的过程,使溶液中的阳离子和阴离子发生还原和氧化反应。
2. 电镀是指利用电解方法在导电物体表面镀上一层金属的过程。
在电镀过程中,被镀物体为阴极,金属离子为阳极。
六、电池1. 电池是指将化学能转化为电能的装置,由正极、负极和电解质组成。
正极和负极之间通过电解质形成电池的电解质界面。
2. 干电池是一种不可充电的电池,内部电解质通常是固体。
3. 燃料电池是一种将燃料直接与氧气反应产生电能的电池,常用于航空航天和汽车等领域。
高中化学《电化学》考点精心汇总!

考点一原电池的工作原理1.概念和反应本质原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。
2.原电池的构成条件(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(2)二看两电极:一般是活泼性不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。
3.工作原理以锌铜原电池为例(1)反应原理(2)盐桥的组成和作用①盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
②盐桥的作用:①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流。
(3)图Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。
图Ⅱ中Zn和CuSO4溶液分别在两个池子中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。
关键点:盐桥原电池中,还原剂在负极区,而氧化剂在正极区。
【深度思考】1.原电池正、负极判断方法说明原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成“活泼电极一定作负极”的思维定势。
2.当氧化剂得电子速率与还原剂失电子速率相等时,可逆反应达到化学平衡状态,电流表指针示数为零;当电流表指针往相反方向偏转,暗示电路中电子流向相反,说明化学平衡移动方向相反。
考点二原电池原理的“四”个基本应用1.用于金属的防护使被保护的金属制品作原电池正极而得到保护。
例如,要保护一个铁质的输水管道或钢铁桥梁等,可用导线将其与一块锌块相连,使锌作原电池的负极。
2.设计制作化学电源(1)首先将氧化还原反应分成两个半反应。
(2)根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
3.比较金属活动性强弱两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
电化学基本原理

现在国际上对电极电位通用的定义表述为:若 任一电极M与标准氢电极组成一特殊原电池, 此电池的电动势(开路电压,无电流通过时)E即 为M电极的电极电位。 规定标准氢电极:(H+/H2) = 0 V
标准氢电极为负极 待= E
标准氢电极为正极 待= –E
相对标准电极电位的测量
所测得的电势为
由图中可以看出,在不同 的电流密度下,析氢过电 位是不同的。由此可以的 得到如下定义:在某一电 流密度下,氢实际析出的 电位EH与氢的平衡电位 EHp的差值,就叫做在该 电流密度下的析氢过电位。 数学表达式:△EH= EHp-EH 实验表明,氢在不同金属上还原时,过电位 是不同的,许多金属上氢的析出过电位与阴极电 流密度的关系服从塔菲尔(Tafel)公式:
对于电极反应来说,若有 a氧化态+ze b还原态 b 则有 RT 还原态
E E0
ln zF 氧化态 a
T—开尔文温度,K; z—电极反应中电子的化学计量数; F—法拉第常数,为96485C· -1 mol 上述方程式称为能斯特方程,它表明氧化还原反应中,溶质 的浓度、气体的压力对电极电势的影响。
△EH=a+blg|Dk|
金属上析氢过电位与电流密度对数值关系
1.0
Pb C
Hg Cu Fe Pt
-η( 伏 )
Au
0.6
0.2 Ni -7 -6 -5 -4 -3 -2 -1 0 1
Lgi(安培/厘米2)
四、金属的电结晶过程
金属的电结晶过程是一个相当复杂的过程
单独研究金属的电结晶过程十分困难
极化度表示了某一电流密 度下电极极化程度变化的 趋势,因而反应了电极过 程进行的难易程度:极化 度越大,电极极化的倾向 也越大,反之,极化度越 小,则电极极化的倾向越 小。
电化学知识归纳总结

电化学知识归纳总结一、电解原理1、电解(1)电解的概念:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫电解。
电解质在电流的作用下发生氧化还原反应,是电能转化为化学能的过程,电解反应是非自发的。
阳极失去电子发生氧化反应,阴极得到电子发生还原反应。
(2)电解池的概念:把电能转变为化学能的装置叫电解池或电解槽。
其中根直流电源或原电池的负极相连的电极是电解池的阴极;反之,跟直流电源或原电池的正极相连的电极是电解池的阳极。
构成电解池的条件是:①直流电源;②两个电极,与电源的正极相连的电极叫阳极,与电源负极相连的电极叫阴极;③电解质溶液或熔融态电解质。
2、电解原理和规律(1)电极分为惰性电极和活泼电极两种。
惰性电极在电解过程中只导电,电极本身不发生任何化学变化,电极材料为石墨、铂、金等;活泼电极是指除石墨、铂、金以外的导电材料做阳极时,金属原子失去电子时发生氧化还原反应的电极。
(2)放电顺序①阳离子在阴极的放电顺序:(H+)、Zn2+、Fe2+、Sn2+、Pb2+、(H+)、Cu2+、Fe3+、Hg2+、Ag+从左到右放电能力依次增强(越排在后面越容易先得电子)注意:a金属离子在阴极放电与否,既跟金属的活泼性有关,又跟离子浓度有关。
例如在一般盐溶液中氢离子浓度很小,放电顺序在Zn2+前,而在相同浓度或浓度相差不大时,放电顺序在Pb2+后。
b Al3+、Mg2+、Na+、Ca2+、K+在水中不放电,只在熔融时放电。
②阴离子在阳极(惰性电极)放电顺序:OH-、Cl-、Br-、I-、S2-放电能力依次增强(越排在后面越容易失去电子)注意:a阳极若为活泼电极,则是活泼电极自身溶解放电,此时不考虑阴离子的放电。
b F-及含氧酸根在水溶液中不放电。
3、电解精炼电解精炼是利用电解原理提纯金属。
如电解精炼铜时,要把粗铜挂在电解槽的阳极,用硫酸铜溶液做电解液,阴极挂纯铜。
电解时阳极发生氧化反应,Cu 失去电子变为Cu2+进入溶液,比铜活泼的金属也失去电子进入溶液;不如铜活泼的金属杂质不能失去电子而变成“阳极泥”被除去。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电化学原理第一章 绪论两类导体: 第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极 原电池(-)电解池(+) 阴极:发生还原反应的电极 原电池(+)电解池(-) 电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型 水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I :离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为: 注:上式当溶液浓度小于0.01mol ·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S ( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。
当量电导(率):在两个相距为单位长度的平行板电极之间,放置含有1 克当量电解质的溶液时,溶液所具有的电导称为当量电导,单位为Ω-1 ·cm2·eq-1。
与 K 的关系:与 的关系:当λ趋于一个极限值时,称为无限稀释溶液当量电导或极限当量电导。
离子独立移动定律:当溶液无限稀释时,可以完全忽略离子间的相互作用,此时离子的运动i i i xαγ=∑=221i i z m I I A ⋅-=±γlog LAG κ=KV =λN c N c k 1000=λ-++=000λλλ是独立的,这时电解质溶液的当量电导等于电解质全部电离后所产生的离子当量电导之和: 同一离子在任何无限稀溶液中极限当量电导值不变!离子淌度:单位场强(V/cm )下的离子迁移速度,又称离子绝对运动速度。
离子迁移数:某种离子迁移的电量在溶液中各种离子迁移的总电量中所占的百分数。
或第二章 电化学热力学相间:两相界面上不同于基体性质的过度层。
相间电位:两相接触时,在两相界面层中存在的电位差。
产生电位差的原因:荷电粒子(含偶极子)的非均匀分布 。
形成相间电位的可能情形:1.剩余电荷层:带电粒子在两相间的转移或利用外电源向界面两侧充电 ;2.吸附双电层:阴、阳离子在界面层中吸附量不同,使界面与相本体中出现等值反号电荷 ;3.偶极子层:极性分子在界面溶液一侧定向排列 ;4.金属表面电位:金属表面因各种 短程力作用而形成的表面电位差。
相间电位的类型:外电位差(伏打电位差): 内电位差(伽尔伐尼电位差): 电化学位差: 电化学位:绝对电位:金属(电子导电相)与溶液(离子导电相)之间的内电位差。
例: 若电极材料不变, 不变;若令 不变,则: 相对(电极)电位:研究电极与参比电极组成的原电池电动势称为该电极的相对(电极)电位 ,用 ψ 表示。
符号规定:研究电极在原电池中发生还原反应 :研究电极在原电池中发生氧化反应:氢标电位:标准氢电极作参比电极时测得的电极相对电位。
如:Pt|H2,H+||Ag2+|Ag E V U ++=E VU --=∑∑==I I i i i Q Q i i t ()∑=1i t ii i ii I i c u z c u z t ∑=A B ψψ-A B φφ-AB ---μμ-Zn Cu Cu S S Zn E φφφ∆+∆+∆=R M φ∆R S φ∆()SM E φ∆∆=∆0>ϕ0<ϕV799.0=ϕ液体接界电位:相互接触的两个组成不同或浓度不同的电解质溶液之间存在的相间电位。
产生的原因:各种离子具有不同的迁移速率而引起。
盐桥:饱和KCl 溶液中加入3%琼脂。
作用:由于K+、Cl-的扩散速度接近,液体接界电位可以保持恒定。
电池进行可逆变化必须具备两个条件:1.电池中的化学变化是可逆的,即物质的变化是可逆的;2.电池中能量的转化是可逆的,即电能或化学能不转变为热能而散失。
原电池电动势:原电池短路时的端电压(即两电极相对电位差)。
注意:只有可逆电池有E ,电池不可逆时只能测到V 。
基本关系式: 注:只适用于可逆电池, 表示可以做的最大有用功(电功)。
Nernst 方程: (标准状态下的电动势)对反应: 的含义:标准状态下的平衡电位电极的分类: 1.可逆电池阳离子(第一类)可逆: 金属在含有该金属离子的可溶性盐溶液中所组成的电极。
阴离子(第二类)可逆:金属插入其难溶盐和与该难溶盐具有相同阴离子的可溶性盐溶液中。
或 氧化还原可逆电极:铂或其它惰性金属插入同一元素的两种不同价态离子溶液中,如:气体电极:气体吸附在铂或其它惰性金属表面与溶液中相应的离子进行氧化还原反应并达到平衡,如: 2.不可逆电极第一类不可逆电极:金属在不含该金属离子的溶液中形成的电极。
如: 第二类不可逆电极:标准单位较正的金属在能生成该金属难溶盐或氧化物的溶液中形成的电极。
如: 第三类不可逆电极:金属浸入含有某种氧化剂的溶液中形成的电极。
如: 不可逆气体电极:一些具有较低氢过电位的金属在水溶液中,尤其在酸中,形成的电极。
如: 影响电极电位的因素:1.电极的本性2.金属表面的状态3.金属的机械变形和内应力4.溶液的PH 值5.溶液中氧化剂的存在6.溶液中络合剂存在7.溶剂的影响第三章 电极/溶液界面的结构与性质理想极化电极:在一定电位范围内,有电量通过时不发生电化学反应的电极体系称为理想极化电极。
比较:理想极化电极是在一定条件下电极上不发生电极反应的电极,通电时电极反应速度跟不上电子运动速度,不存在去极化作用,流入电极的电荷全部在电极表面不断积累,只起到改变电极电位,即改变双电层结构的作用,如滴汞电极。
反之,如果电极反应速度很大,以-+-=ϕϕE nFE G -=∆G ∆-∏∏+=生反ννααln 0nF RT E E K nF RT E ln 0=R ne O ⇔+还原态氧化态ααϕϕln 0nF RT +=0ϕ可溶性盐溶液+n M M ++=n MnFRT αϕϕln 0()-A MAn M ,固n A nF RT --=αϕϕln 0++=n M nF RT αϕϕln ,0nn M M Pt ,1-1ln0-+=n nM M nF RT ααϕϕ()()++H H H P H Pt α22,220ln 2H H P F RT ++=αϕϕ溶液的无能溶解+n M M M NaOHCu 3HNO Fe ()水溶液HCl Fe至于去极化作用于极化作用接近于平衡,有电流通过时电极电位几乎不变化,即电极不出现极化现象,就是理想不极化电极,如电流密度很小时的饱和甘汞电极。
零电荷电位 :电极表面剩余电荷为零时的电极电位 。
与 不同原因:剩余电荷的存在不是形成相间电位的唯一原因。
零标电位:相对于零电荷电位的相对电极电位,以零电荷电位作为零点的电位标度。
吸附:某物质的分子、原子或离子在界面富集(正吸附)或贫乏(负吸附)的现象。
分类:静电吸附; 非特性吸附;特性吸附(物理吸附+化学吸附)。
电毛细现象:界面张力б随电极电位变化的现象。
电毛细曲线:界面张力与电极电位的关系曲线 。
微分电容:引起电位微小变化时所需引入电极表面的电量,也表征了界面在电极电位发生微小变化时所具备的贮存电荷的能力。
电毛细曲线及微分电容曲线研究界面性质和结构的优缺点比较:(仅供参考) (1)电毛细曲线法的主要应用:判断电极表面带电状况(符号);求电极表面剩余电荷密度q ;求离子表面剩余量 。
(2)微分电容曲线的主要应用:利用 判断q 正负;研究界面吸附 ;求q 、 : (3)用微分电容法求q 值比电毛细曲线法更为精确和灵敏,电毛细曲线的直接测量只能在液态金属(汞、镓等)电极上进行,微分电容还可以在固体电极上直接进行。
应用微分电容发往往需要应用电毛细曲线法确定零电荷电位。
斯特恩模型:电极/溶液界面的双电层由紧密层和分散层两部分组成。
电位分布特点:紧密层——线性分布 分散层——曲线分布电位:离子电荷能接近电极表面的最小距离处的平均电位。
紧密层结构对Stern 模型的两点重要修正: 水偶极子定向及对结构的影响(“电极水化”) 短程作用引起的吸附(特性吸附)。
无离子特性吸附 :OHP :距离电极表面为d 的液层,即最接近电极表面的水化阳离子电荷中心所在液层称为外紧密层或外Helmholtz 平面。
有离子特性吸附 :IHP :阴离子电荷中心所在的液层称为内紧密层平面或内Helmholtz 平面。
“电极/溶液”界面模型概要(总结): 由于界面两侧存在剩余电荷(电子及离子电荷)所引起的界面双电层包括紧密层和分散层两部分;分散层是由于离子电荷的热运动引起的,其结构(厚度、 电势分布等)只与温度、电解质浓度(包括价型)及分散层中的剩余电荷密度有关,而与离子的个别特性无关; 紧密层的性质决定于界面层的结构,特别是两相中剩余电荷能相互接近的程度; 能在电极表面“特性吸附”的阴离子往往在电极表面上“超载吸附”。
此时界面结构及其中电势分布具有“三电层”形式。
特性吸附:无机阴离子的特性吸附对 的影响:使界面张力下降;使 负移。
0ϕ0ϕ0=∆ϕi Γ0ϕi C 1ψ()11ψψϕϕϕϕ+-=a a =+分紧ϕσ~()0max ϕσ有机分子的特性吸附对 的影响:使 下降;出现电容峰。
第四章 电极过程概述极化:有电流通过时,电极电位偏离平衡电位的现象过电位:在一定电流密度下,电极电位与平衡电位的差值极化值:有电流通过时的电极电位(极化电位)与静止电位的差值 极化曲线:过电位(或电极电位)随电流密度变化的关系曲线。
极化度:极化曲线上某一点的斜率。
极化图:把表征电极过程特征的阴极极化曲线和阳极极化曲线画在同一个坐标系中,这样组成的曲线图叫极化图。
电极过程的基本历程: 1.液相传质步骤2.前置的表面转化步骤 简称前置转化3.电子转移步骤或称电化学反应步骤4.随后的表面转化步骤简称随后转化5.新相生成步骤或反应后的液相传质步骤速度控制步骤:串连的各反应步骤中反应速度最慢的步骤。
