[推荐学习]2019高考化学一轮基础夯实练(10)(含解析)新人教版
2019高考化学一轮复习基础习练10含解析新人教版.docx

人教化学2019高考一轮基础习练(10)李仕才一、选择题1、己知八、B都为短周期元素,且甲、乙、丙常温下都为气体(如图所示)。
2 mol甲分子反应生成1 mol丙和3 mol乙,下列对此判断不正确的是(D )2总一8 +3乙甲内O表示A原子O表示B原子A.1个乙分子中含有2个A原子B.甲的摩尔质量为17 g • mol-1C.同温同压下,生成丙和乙的体积比为1: 3D.标准状况下,11.2 LAP溶于500汕水中,所得溶液中甲的物质的量浓度为1 mol・17】2、下列各组物质的分类(括号里的是类别)都正确的是(B )A.空气(混合物)、C2H50H(醇)、H2SOH离子化合物)、C02(非电解质)B.液氨(氢化物)、NH心住安盐)、HNO,含氧酸)、NaOH(强电解质)C.HC1 (共价化合物)、C&COOH(竣酸)、NaO(碱性氧化物)、卤代桂)D.曲(酸性氧化物)、CHsCHO(有机物)、CO(有机物)、CMOOCH,酯)解析A项,朋0堤共价化合物,错误;C项,NM)2不属于碱性氧化物,属于过氧化物,错误;D 项,N0?不是酸性氧化物,CO是无机物,错误。
3、在A12(S0d3和MgSOi的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,贝IJ原混合液屮A12(S0I)3-^ MgSO.(的物质的量浓度Z比为(D )A. 6 : 1B. 3 : 1C. 2 : 1D. 1 : 2解析溶解Al(0H)3耗碱10 mL,则生成A1(OH)3耗碱为30 mL,生成Mg(0H)2耗碱(50-30) mL = 20mL,故A严与十浓度之比为1 : 1,则Al2(S04)3与MgSO“的物质的量浓度之比为1 : 2。
4、氯水中存在如下平衡:Cb 2(aq)、C12(aq)+H2++Cr+HC10o下列说法正确的是(A )A.向饱和氯水中通入HC1,有c(H+) =c(Cr)+c(0H") +c(C10_)B.氯气在1 mol -「的NaCl溶液中比在1 mol •「的A1C13溶液中的溶解度小C.光照,氯水的漂白性增强D.若向饱和氯水中通入少量比S, C(H+)/C(C1(F)减小解析 根据电荷守恒,A 项正确;1 mol • L 的NaCl 溶液中的c (Cl )比1 mol • L 1的AlCh 溶液中c(Cr)小,所以NaCl 溶液对氯气溶解的抑制作用更小,即氯气在lmol ・「的NaCl 溶液中的溶解度大,B 项错误;光照时HC1O 分解,氯水的漂白作用减弱,C 项错误;若通入 少量£S,发生反应:C12+H 2S=2HC1+S I ,所以溶液中c(『)增大,Cl 2(aq)消耗使第二个 平衡逆向移动,c(C10-)肯定会减小,所以c(H+)/c(Cl(T )增大,D 项错误。
2019人教版高考化学一轮训导练(10)及答案

2019人教版高考化学一轮训导练(10)及答案2019人教版高考化学一轮训导练(10)及答案一、选择题1.室温时,在由水电离出的c(OH-)=1.0×10-14mol·L-1的溶液中,一定能大量共存的离子组是()A.K+、Na+、HCO-3、Cl-B.K+、MnO-4、Br-、Cl-C.Na+、Cl-、NO-3、SO2-4D.Al3+、NH+4、Cl-、SO2-4解析:由水电离出的c(OH-)=10-14mol·L-1的溶液可能呈强酸性或强碱性。
A选项中的HCO-3在酸性或碱性溶液中都不能大量存在;B选项中的MnO-4在酸性条件下具有强氧化性,而Br-具有较强还原性,两者不能大量共存;D选项中的Al3+、NH+4在碱性溶液中不能大量共存。
答案:C2.常温下,某未知溶液中c H+c OH-=1×1012,且含有大量Al3+和NO-3,检验此溶液中是否大量存在以下6种离子:①SiO2-3、②NH+4、③Fe2+、④K+、⑤HCO-3、⑥SO2-4,其中不必检验就能否定的离子是()A.②③④B.①②⑥C.①③⑤D.④⑤⑥解析:由溶液中c H+c OH-=1×1012可确定该溶液呈酸性,SiO2-3与H+反应生成沉淀而不能大量存在;Fe2+能与H+、NO-3发生氧化还原反应而不能大量存在;HCO-3与H+发生反应生成CO2而不能大量存在,NH+4、K+、SO2-4在该溶液中可以大量存在。
答案:C3.宋代著名法医学家宋慈的《洗冤集录》中有一银针验毒的记载,银针验毒的原理是4Ag+2H2S+O2===2X+2H2O,下列说法不正确的是()A.X的化学式为Ag2SB.银针验毒时,空气中的氧气得到电子C.反应中Ag和H2S均是还原剂(2×56)∶(1×28)=4∶1。
答案:C6.从石英砂制取高纯硅的主要化学反应如下:①SiO 2+2C=====高温Si(粗)+2CO↑②Si(粗)+2Cl 2=====△SiCl 4③SiCl 4+2H 2=====高温Si(纯)+4HCl关于上述反应的叙述不正确的是( )A .①、③是置换反应,②是化合反应B .高温下,焦炭与氢气的还原性均强于硅C .任一反应中,每消耗或生成28 g 硅,均转移4 mol 电子D .高温下在炉子里将石英砂、焦炭、氯气、氢气按比例混合就能得到高纯硅解析:在氧化还原反应中,还原剂的还原性比还原产物的还原性强,B 正确;根据元素化合价的变化,每消耗或生成28 g(1 mol)硅,均转移4 mol 电子,C 正确;题中的三个反应是在三个不同反应器中发生,D 错误。
2019高考化学一轮训练学题含解析新人教版(全套共12份)

人教化学2019高考一轮训练学题(1)李仕才一、选择题1、常温下,在水溶液中发生如下反应①16H++10C-+2XO-4===2X2++5C2+8H2O;②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。
下列说法错误的( )A.反应C2+2A2+===2A3++2Cl-可以进行B.还原性由强到弱的顺序是C->A2+>B->X2+C.氧化性由强到弱的顺序是XO-4>C2>B2>A3+D.反应③是置换反应【参考答案】B答案:C3、电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。
下图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。
下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )解析:HCl 为强电解质,CH 3COOH 为弱电解质,滴加NH 3·H 2O ,先与HCl 反应,生成同样为强电解质的NH 4Cl ,但溶液体积不断增大,溶液稀释,所以电导率下降。
当HCl 被中和完后,继续与CH 3COOH 弱电解质反应,生成CH 3COONH 4,为强电解质,所以电导率增大。
HCl 与CH 3COOH 均反应完后,继续滴加弱电解质NH 3·H 2O ,电导率变化不大,因为溶液被稀释,有下降趋势。
答案:D 固体,3·H 2+4的值都变小倍后,稀释后④溶液中的pH 大=0.001 mol·L -1,一水合氨是弱电解质,·H 2+4+平衡左移,3·H 2+4的值都增大,错误;稀释后③④溶液中5,D 选项正答案:D5、现有下列仪器,①集气瓶;②量筒;③烧杯;④表面皿;⑤蒸发皿;⑥容量瓶;⑦圆底烧瓶。
其中能用酒精灯加热的是( )A .②③⑤B .③⑥⑦C .①③④D .③⑤⑦解析:集气瓶、量筒、表面皿、容量瓶不能加热,烧杯、圆底烧瓶要垫石棉网加热,蒸发皿可直接加热。
2019高考化学一轮复习训练选10含解析新人教版.docx
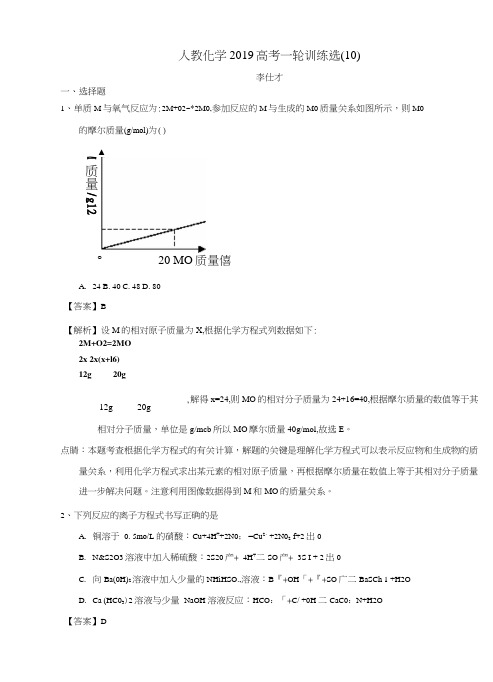
人教化学2019高考一轮训练选(10)李仕才一、选择题1、单质M 与氧气反应为:2M+02~*2M0,参加反应的M 与生成的M0质量关系如图所示,则M0的摩尔质量(g/mol)为()° 20 MO 质量僖A. 24B. 40C. 48D. 80【答案】B【解析】设M 的相对原子质量为X,根据化学方程式列数据如下:2M+O2=2MO2x 2x(x+l6)12g 20g,解得x=24,则MO 的相对分子质量为24+16=40,根据摩尔质量的数值等于其 相对分子质量,单位是g/mcb 所以MO 摩尔质量40g/mol,故选E 。
点睛:本题考查根据化学方程式的有关计算,解题的关键是理解化学方程式可以表示反应物和生成物的质量关系,利用化学方程式求出某元素的相对原子质量,再根据摩尔质量在数值上等于其相对分子质量 进一步解决问题。
注意利用图像数据得到M 和MO 的质量关系。
2、下列反应的离子方程式书写正确的是A. 铜溶于 0. 5mo/L 的硝酸:Cu+4H ++2N0; =Cu 2,+2N02 f+2出0 B. N&S2O3溶液中加入稀硫酸:2S20产+ 4H +二SO 产+ 3S I + 2出0C. 向Ba(0H)2溶液中加入少量的NHiHSO.,溶液:B 『+OH 「+『+SO 广二BaSCh 1 +H2OD. Ca (HC03)2溶液与少量 NaOH 溶液反应:HCO :「+C/ +0H 二CaC0:N+H2O【答案】DM质量/g12 12g 20g ▲【解析】铜濬于0. 5mo/L 的硝酸生成NO,离子方程式是3Cu+8FT+2N8 =3Cu 尹+2NO | +4曲0,故A 错 误;N H 2S 2O3滚'液中加入稀硫酸,+2价S 发生歧化反应2生成S 单质、S6气体,反应离子方程式是 S2O 产+ 2rf=S6 t +S | +H2O,故B 错误;向Ba (OH) 2溶液中加入少量的NHiHSd 溶液,反应离子方程式是 Ba 2>+2OH-+fT+SO42 +NH4-=BaSO41 +股6 NH 3 - H 2O ,故 C 错误:Ca (HCO3) 2 滚滋与少量 NaOH 溶液反应生成碳酸钙、碳酸氢钠、水,反应离子方程式是:HCCWhf 二CaCO 昇+HX ),故D 正确。
2019高考化学一轮复习选习练题含解析新人教版(全套10份)

人教化学2019高考一轮选习练题(1)含答案李仕才一、选择题1、对物质的量的理解正确的是()A.物质的量就是物质的质量的另一种表达方式,单位是g/molB.物质的量就是物质的数量,数值上等于式量,单位是molC.物质的量就是6.02×1023个微粒的质量,单位是gD.物质的量是国际单位制中的一个物理量,表示含有一定数目微粒的集体【答案】D2、下列离子方程式书写正确的是()A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++OH-+Ba2++SO42-=H2O+BaSO4↓B.FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-C.用两个铜电极电解食盐水:2Cl-+2H2O=2OH-+H2↑+Cl2↑D.用三氯化铁溶液腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+【答案】B【解析】A.溶液呈中性的反应为:2H++2OH-+Ba2++SO42-=2H2O+BaSO4↓,A错误;B.Cl比Br 的非金属性强,能将Br-氧化,同时将铁离子氧化,根据电荷守恒和物料守恒,B正确;C.阳极为金属时,将首先失去电子生成Cu2+,负极为H得到电子生成氢气,C错误;D.未配平,2Fe3++Cu=2Fe2++Cu2+,D错误。
故选择B。
3、下列物质的性质和用途描述错误的是A.铜质地漏具有独特的杀菌功能,能较好的抑制细菌生长B.明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用C.铁粉具有还原性,可用作食品袋内的抗氧化剂D.镁燃烧发出耀眼的白光,可以制造照明弹【答案】B【解析】A.细菌是由蛋白质构成的,铜是重金属,可使蛋白质变性,从而杀灭细菌,故A 正确;B.明矾溶于水生成胶状物可吸附悬浮于水中的杂质,不能除掉可溶性杂质和细菌等,不能起到消毒杀菌的作用,故B错误;C.铁粉具有还原性,易与氧气反应,可作食品抗氧化剂,故C正确;D.镁能在空气中燃烧发出耀眼的白光,可以用于制造照明弹,故D正确;故答案选B。
2019高考化学一轮复习选习练题含解析新人教版(全套10份)

人教化学2019高考一轮选习练题(1)含答案李仕才一、选择题1、对物质的量的理解正确的是()A.物质的量就是物质的质量的另一种表达方式,单位是g/molB.物质的量就是物质的数量,数值上等于式量,单位是molC.物质的量就是6.02×1023个微粒的质量,单位是gD.物质的量是国际单位制中的一个物理量,表示含有一定数目微粒的集体【答案】D2、下列离子方程式书写正确的是()A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++OH-+Ba2++SO42-=H2O+BaSO4↓B.FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-C.用两个铜电极电解食盐水:2Cl-+2H2O=2OH-+H2↑+Cl2↑D.用三氯化铁溶液腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+【答案】B【解析】A.溶液呈中性的反应为:2H++2OH-+Ba2++SO42-=2H2O+BaSO4↓,A错误;B.Cl比Br的非金属性强,能将Br-氧化,同时将铁离子氧化,根据电荷守恒和物料守恒,B正确;C.阳极为金属时,将首先失去电子生成Cu2+,负极为H得到电子生成氢气,C错误;D.未配平,2Fe3++Cu=2Fe2++Cu2+,D错误。
故选择B。
3、下列物质的性质和用途描述错误的是A.铜质地漏具有独特的杀菌功能,能较好的抑制细菌生长B.明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用C.铁粉具有还原性,可用作食品袋内的抗氧化剂D.镁燃烧发出耀眼的白光,可以制造照明弹【答案】B【解析】A.细菌是由蛋白质构成的,铜是重金属,可使蛋白质变性,从而杀灭细菌,故A正确;B.明矾溶于水生成胶状物可吸附悬浮于水中的杂质,不能除掉可溶性杂质和细菌等,不能起到消毒杀菌的作用,故B错误;C.铁粉具有还原性,易与氧气反应,可作食品抗氧化剂,故C正确;D.镁能在空气中燃烧发出耀眼的白光,可以用于制造照明弹,故D正确;故答案选B。
2019高考化学一轮训练学题含解析新人教版(全套共12份)

人教化学2019高考一轮训练学题(1)李仕才一、选择题1、常温下,在水溶液中发生如下反应①16H++10C-+2XO-4===2X2++5C2+8H2O;②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。
下列说法错误的( )A.反应C2+2A2+===2A3++2Cl-可以进行B.还原性由强到弱的顺序是C->A2+>B->X2+C.氧化性由强到弱的顺序是XO-4>C2>B2>A3+D.反应③是置换反应3、电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。
下图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。
下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )解析:HCl 为强电解质,CH 3COOH 为弱电解质,滴加NH 3·H 2O ,先与HCl 反应,生成同样为强电解质的NH 4Cl ,但溶液体积不断增大,溶液稀释,所以电导率下降。
当HCl 被中和完后,继续与CH 3COOH 弱电解质反应,生成CH 3COONH 4,为强电解质,所以电导率增大。
HCl 与CH 3COOH 均反应完后,继续滴加弱电解质NH 3·H 2O ,电导率变化不大,因为溶液被稀释,有下降趋势。
固体,3·H 2+4的值都变小倍后,稀释后④溶液中的pH 大=0.001 mol·L -1,一水合氨是弱电解质,·H 2+4平衡左移,3·H 2+4的值都增大,错误;稀释后③④溶液中3、5,D5、现有下列仪器,①集气瓶;②量筒;③烧杯;④表面皿;⑤蒸发皿;⑥容量瓶;⑦圆底烧瓶。
其中能用酒精灯加热的是( ) A .②③⑤ B .③⑥⑦ C .①③④ D .③⑤⑦解析:集气瓶、量筒、表面皿、容量瓶不能加热,烧杯、圆底烧瓶要垫石棉网加热,蒸发皿可直接加热。
人教版2019高考化学一轮复习基础题系列10含解析

2019 高考化学一轮基础题系列(10)1、( 2018 届广东省茂名市五大缔盟学校高三五月联考)设N A为阿伏加德罗常数的值。
下列说法正确的选项是()A. 用惰性电极电解CuSO4溶液一段时间后 , 若加入gCu(OH)2能使溶液复原,则电解过程中转移电子的数目为 1.2N AB. 常温常压下 ,0.5 molO 3与 11.2 LO 2所含的分子数均为0.5N AC. 必然条件下,丁烷催化裂化生成1mol 乙烯时 , 耗资丁烷的数目为 NAD. 25 ℃时, 1LpH=10 的 NaHCO3溶液中含有 H2CO3的数目为 10-4 N A【答案】 A【剖析】 A、若加入 29.4gCu(OH) 2能使溶液复原,则相当于阴极上析出氢气和铜,生成0.3mol 铜转移电子个数 =0.3mol ×2×N,依照原子守恒知,生成水需A A要 0.3mol 氢气,生成 0.3mol 氢气转移电子的个数 =0.3mol ×2×N A/mol=0.6N A,所以电解过程中共转移电子数为 1.2N A,选项 A 正确; B、常温常压下 ,11.2L O 2的物质的量小于0.5mol , 0.5mol O 3和 11.2L O 2的分子数不相等,选项B错误; C、必然条件下,丁烷催化裂化除生成乙烯和乙烷这种均裂外,还会裂解生成甲烷和丙烯,则生成1mol 乙烯时 ,耗资丁烷的数目大于 N A,选项 C错误; D、25℃时, 1LpH=10 的 NaHCO3溶液中含有 H2CO3的数目小于 10-4 N A,选项 D错误。
答案选 A。
2、( 2018 届四川省棠湖中学高三 3 月月考)设N A为阿伏加德罗常数的值,以下说法正确的是在空气中完好焚烧,转移电子数必然为0.2N AB. 标准情况下, 2.24L HF 中所含原子总数必然为0.2N A在稀硝酸中完好溶解,转移电子数必然为0.2N A熔融的 NaHSO中,阳离子的总数必然为4A【答案】 A【剖析】 A、 2.4g 镁的物质的量为0.1mol ,完好反响失去0.2mol 电子,失去的电子数为0.2N A,选项A正确;B.标况下,氟化氢不是气体,题中条件无法计算22.4L 氟化氢的物质的量,选项 B 错误; C、 5.6g 铁的物质的量为 0.1mol ,而铁和硝酸反响后变为 +3 价,故 0.1mol 铁失去 0.3mol 电子即 0.3N A个,选项 C 错误;D、12.0g NaHSO4为 0.1mol ,熔融的硫酸氢钠中含有的阳离子是钠离子,离子数为0.1N A,选项 D 错误。
2019高考化学一轮基础选习题(10)(含解析)新人教版

人教版化学2019高考一轮基础选习题(10)李仕才一、选择题1.古代的很多成语、谚语都蕴含着很多科学知识,下列对成语、谚语的解释正确的是( ) A .“冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 B .“玉不琢不成器”“百炼方能成钢”发生的均为化学变化 C .“甘之如饴”说明糖类均有甜味D .“火树银花”中的焰火实质上是金属元素的焰色反应解析:相同质量的同种物质,固态的能量比液态的低,所以水和冰比较,水的能量高,A 项错误;“玉不琢不成器”是物理变化,“百炼方能成钢”是化学变化,B 项错误;不是所有的糖类都有甜味,如淀粉、纤维素属于糖类,它们均没有甜味,C 项错误。
答案:D2.我国有着悠久的文明历史,其中青铜、陶瓷、造纸及黑火药等与现代化学密切相关。
下列说法中正确的是( )A .青铜的熔点比纯铜和锡都高B .陶瓷的主要成分为硅酸盐C .古代的纸张主要成分为蛋白质D .黑火药爆炸时,氧化剂只有硝酸钾解析:青铜是铜锡合金,合金的熔点一般比组分金属都低,A 项不正确;古代的纸张主要成分是纤维素,C 项不正确;黑火药的主要成分是KNO 3、S 、C ,爆炸时发生如下反应:2KNO 3+3C +S=====点燃K 2S +N 2↑+3CO 2↑,氧化剂是KNO 3和S ,D 项不正确。
答案:B3.部分氧化的Fe -Cu 合金样品(氧化产物为Fe 2O 3、CuO)共5.92 g ,经如下处理:下列说法中正确的是( )①滤液A 中的阳离子为Fe 2+、Fe 3+、H +②样品中氧元素的物质的量为0.03 mol③溶解样品的过程中消耗H 2SO 4的总的物质的量为0.04 mol ④V=224 mL ⑤V=336 mLA .①③④ B.②③④A.粗铜电解精炼时,粗铜作阳极B.生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应C.黄铜矿冶炼铜时,副产物SO2可用于生产硫酸,D.粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法解析:电解精炼铜时,粗铜作阳极,自身可以溶解,故高温、高压催化剂2NH 放电或高温2NO2溶液中加入产生沉淀,再通入.某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定有还原性,B 错误;NO 2与H 2O 反应生成HNO 3,HNO 3具有强氧化性,可以把SO 2-3氧化为SO 2-4,生成BaSO 4沉淀,C 错误。
2019高考化学一轮选练编题(10)(含解析)新人教版

人教化学2019高考一轮选练编题(10)李仕才解析:A 项中四种离子能共存,但通入氯气后,氯气能将HSO 、I 一氧化,故不符合题意;B 项中四种离子能共存,通入二氧化硫,二氧化硫被硝酸根离子氧化而不能共存,故不符合题意; C 项中Fe 3 j CO 「之间反应生成沉淀,所以不能共存,故不符合题意; 通入二氧化碳后也不反应,故符合题意。
答案:D2.下列离子组能大量共存且加入相应试剂后发生反应的离子方程式正确的是H +,则Fe 2 j NQ 、屮发生氧化还原反应, A 选项正确;Fe 3+具有氧化性,I 「具有还原性,二者发生氧化还原反应而不能大量共存, CIO 「也具有氧化性,CIO 「与I 「也不能大量共存,B 选项错 误;C 项,加入NaOH 溶液后,发生反应的离子方程式应为 Ba 2++ HCO + OH===BaCOj + H 2O,C 选项错误;D 项,加入过量浓氨水后,会生成银氨络离子, 答案:A 3.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有或K22颗粒的装置,它的用途是产生氧气。
下列关于N Q Q 的叙述正确的是()1. A. B. C. D.、选择题下列各离子组在溶液中能共存且通入括号中相应气体后,仍能大量存在的是 + 2 + — —Na 、Ba 、HSO 、I (氯气) Ca 、NQ 、Na 、Cl (二氧化硫) Fe 3+、SO 一、CO 一、NQ (氨气)Na +、K +、HCO 、Cl —(二氧化碳)D 项中四种离子能共存,D 选项错误。
NaOA. N&Q中阴、阳离子的个数比为1 :1B. N32Q分别与水及CO反应产生相同量的Q时,需要水和CO的质量相等C. Na2Q分别与水及CO反应产生相同量的Q时,转移电子的物质的量相等D. Na2Q的漂白原理与SQ的漂白原理相同解析:Nc t Q b的电子式为W —」Ml ,故阴、阳离子的个数比为 1 : 2, A项错误;生成相同量的Q2时消耗的水和二氧化碳的物质的量相同,但质量不同,B项错误;由得失电子守恒知二者转移电子的物质的量相同,C项正确;Na^Q因具有强氧化性而有漂白性,SQ易与有色物质化合生成无色不稳定的物质,故二者漂白原理不同,D项错误。
2019高考化学一轮复习基础习练含解析新人教版(全套共11份)

人教化学2019高考一轮基础习练(1)李仕才一、选择题1、应用(1)含答案1.下列两种气体的分子数一定相等的是( A ) A .质量相等、密度不同的N 2和C 2H 4 B .体积相等的CO 和N 2 C .等温、等体积的O 2和N 2D .等压、等体积的N 2和CH 42、我国古代文献资料中记载了大量的化学研究过程与成果。
下列选项不涉及化学变化的是( A )解析 重结晶方法提纯物质利用的是物质的溶解度随温度的变化有明显差异,属于物理变化,A 项符合题意;曾青的主要成分为CuSO 4,Fe 和CuSO 4发生置换反应得到Cu ,属于化学变化,B 项不符合题意;该转化过程为HgS=====△Hg +S 、Hg +S===HgS ,属于化学变化,C 项不符合题意;黏土烧结成陶瓷,有新物质生成,属于化学变化,D 项不符合题意。
3、下列做法不正确的是( B )A .Na 2O 2用作呼吸面具的供氧剂B .NaHCO 3的热稳定性强于Na 2CO 3C .乙醇可与金属钠反应放出H 2D .金属钠着火时,用细沙覆盖灭火解析 NaHCO 3的热稳定性弱于Na 2CO 3。
4、下列关于硅单质及其化合物的说法正确的是( D )①硅酸盐Na 2Fe 2Si 3O 10用氧化物的形式表示为:Na 2O·2FeO·3SiO 2 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④单质硅是将太阳能转变为电能的常用材料 A .②③B .①③C.①④D.④解析从化合价代数和为0可知Na2Fe2Si3O10中铁的化合价是+3价,①错误;水晶的主要成分是SiO2,②错误;光导纤维的主要成分是SiO2,③错误。
5、下列化学用语的表达正确的是( D)A.中子数为22的钙原子:22CaB.S2Cl2的结构式:S—Cl—Cl—SC.可表示CH4或CCl4分子D.氟离子的结构示意图:解析钙原子的质子数为20,中子数为22的钙原子表示为4220Ca,A项错误;根据S2Cl2中S、Cl原子最外层电子数及成键规律可知,其结构式为Cl—S—S—Cl,B项错误;根据比例模型,中间原子半径大,外面四个原子半径小,能表示CH4或CF4分子,不能表示CCl4分子,C 项错误。
2019高考化学一轮复习基础习练含解析新人教版(全套共11份)

人教化学2019高考一轮基础习练(1)李仕才一、选择题1、应用(1)含答案1.下列两种气体的分子数一定相等的是( A ) A .质量相等、密度不同的N 2和C 2H 4 B .体积相等的CO 和N 2 C .等温、等体积的O 2和N 2D .等压、等体积的N 2和CH 42、我国古代文献资料中记载了大量的化学研究过程与成果。
下列选项不涉及化学变化的是( A )化,A 项符合题意;曾青的主要成分为CuSO 4,Fe 和CuSO 4发生置换反应得到Cu ,属于化学变化,B 项不符合题意;该转化过程为HgS=====△Hg +S 、Hg +S===HgS ,属于化学变化,C 项不符合题意;黏土烧结成陶瓷,有新物质生成,属于化学变化,D 项不符合题意。
3、下列做法不正确的是( B )A .Na 2O 2用作呼吸面具的供氧剂B .NaHCO 3的热稳定性强于Na 2CO 3C .乙醇可与金属钠反应放出H 2D .金属钠着火时,用细沙覆盖灭火解析 NaHCO 3的热稳定性弱于Na 2CO 3。
4、下列关于硅单质及其化合物的说法正确的是( D )①硅酸盐Na 2Fe 2Si 3O 10用氧化物的形式表示为:Na 2O·2FeO·3SiO 2 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④单质硅是将太阳能转变为电能的常用材料 A .②③ B .①③ C .①④D .④解析从化合价代数和为0可知Na2Fe2Si3O10中铁的化合价是+3价,①错误;水晶的主要成分是SiO2,②错误;光导纤维的主要成分是SiO2,③错误。
5、下列化学用语的表达正确的是( D)A.中子数为22的钙原子:22CaB.S2Cl2的结构式:S—Cl—Cl—SC.可表示CH4或CCl4分子D.氟离子的结构示意图:解析钙原子的质子数为20,中子数为22的钙原子表示为4220Ca,A项错误;根据S2Cl2中S、Cl原子最外层电子数及成键规律可知,其结构式为Cl—S—S—Cl,B项错误;根据比例模型,中间原子半径大,外面四个原子半径小,能表示CH4或CF4分子,不能表示CCl4分子,C项错误。
2019高考化学一轮复习选习练题含解析新人教版(全套10份)

人教化学2019高考一轮选习练题(1)含答案李仕才一、选择题1、对物质的量的理解正确的是()A.物质的量就是物质的质量的另一种表达方式,单位是g/molB.物质的量就是物质的数量,数值上等于式量,单位是molC.物质的量就是6.02×1023个微粒的质量,单位是gD.物质的量是国际单位制中的一个物理量,表示含有一定数目微粒的集体【答案】D2、下列离子方程式书写正确的是()A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++OH-+Ba2++SO42-=H2O+BaSO4↓B.FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-C.用两个铜电极电解食盐水:2Cl-+2H2O=2OH-+H2↑+Cl2↑D.用三氯化铁溶液腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+【答案】B【解析】A.溶液呈中性的反应为:2H++2OH-+Ba2++SO42-=2H2O+BaSO4↓,A错误;B.Cl比Br 的非金属性强,能将Br-氧化,同时将铁离子氧化,根据电荷守恒和物料守恒,B正确;C.阳极为金属时,将首先失去电子生成Cu2+,负极为H得到电子生成氢气,C错误;D.未配平,2Fe3++Cu=2Fe2++Cu2+,D错误。
故选择B。
3、下列物质的性质和用途描述错误的是A.铜质地漏具有独特的杀菌功能,能较好的抑制细菌生长B.明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用C.铁粉具有还原性,可用作食品袋内的抗氧化剂D.镁燃烧发出耀眼的白光,可以制造照明弹【答案】B【解析】A.细菌是由蛋白质构成的,铜是重金属,可使蛋白质变性,从而杀灭细菌,故A 正确;B.明矾溶于水生成胶状物可吸附悬浮于水中的杂质,不能除掉可溶性杂质和细菌等,不能起到消毒杀菌的作用,故B错误;C.铁粉具有还原性,易与氧气反应,可作食品抗氧化剂,故C正确;D.镁能在空气中燃烧发出耀眼的白光,可以用于制造照明弹,故D正确;故答案选B。
近年高考化学一轮基础夯实练(1)(含解析)新人教版(2021年整理)

2019高考化学一轮基础夯实练(1)(含解析)新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学一轮基础夯实练(1)(含解析)新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学一轮基础夯实练(1)(含解析)新人教版的全部内容。
2019高考化学一轮基础夯实练(1)李仕才一、选择题1、某铁的氧化物(Fe x O)1。
52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化。
x值为( )A.0。
80 B.0.85C.0。
90 D.0。
93A [根据电子守恒可知,Fe x O被氧化为Fe3+转移的电子数和Cl2转移的电子数相等。
标准状况下112 mL Cl2转移电子数为0。
01 mol。
则有错误!×错误!×x =0.01,解得x=0。
80,A项正确.](2017·郑州一模)汽车剧烈碰撞时,安全气囊中发生反应NaN3+KNO3―→K2O 2、+Na2O+N2↑。
对上述反应的描述错误的是()A.NaN3是还原剂,KNO3是氧化剂B.该反应中有两种元素的化合价发生变化C.配平后物质的系数依次为10、2、1、5、16D.若生成8 mol N2,则转移电子的物质的量为5 molB [由题给反应中氮元素的化合价变化可知,NaN3为还原剂,KNO3为氧化剂,A项正确;该反应中只有N元素的化合价发生变化,B项错误;根据得失电子守恒及原子守恒配平化学方程式:10NaN3+2KNO3===K2O+5Na2O+16N2↑,C项正确;由10NaN3+2KNO3===K2O+5Na2O+16N2↑可知,生成16 mol氮气时,转移10 mol电子,则生成8 mol N2时,转移5 mol电子,D项正确。
2019高考化学一轮基础夯实练含解析新人教版(全套10份)

2019高考化学一轮基础夯实练(1)李仕才一、选择题1、某铁的氧化物(Fe x O)1.52 g 溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl 2,恰好将Fe 2+完全氧化。
x 值为( )A .0.80B .0.85C .0.90D .0.93 A [根据电子守恒可知,Fe x O 被氧化为Fe 3+转移的电子数和Cl 2转移的电子数相等。
标准状况下112 mL Cl 2转移电子数为0.01 mol 。
则有 1.5256x +16×⎝ ⎛⎭⎪⎫3-2x ×x=0.01,解得x =0.80,A 项正确。
]2、(2017·郑州一模)汽车剧烈碰撞时,安全气囊中发生反应NaN 3+KNO 3―→K 2O +Na 2O +N 2↑。
对上述反应的描述错误的是( )A .NaN 3是还原剂,KNO 3是氧化剂B .该反应中有两种元素的化合价发生变化C .配平后物质的系数依次为10、2、1、5、16D .若生成8 mol N 2,则转移电子的物质的量为5 molB [由题给反应中氮元素的化合价变化可知,NaN 3为还原剂,KNO 3为氧化剂,A 项正确;该反应中只有N 元素的化合价发生变化,B 项错误;根据得失电子守恒及原子守恒配平化学方程式:10NaN 3+2KNO 3===K 2O +5Na 2O +16N 2↑,C 项正确;由10NaN 3+2KNO 3===K 2O +5Na 2O +16N 2↑可知,生成16 mol 氮气时,转移10 mol 电子,则生成8 mol N 2时,转移5 mol 电子,D 项正确。
]3、(2018·长郡中学临考冲刺)X 、Y 、Z 、W 是原子序数依次增大的短周期元素,且X 、Z 原子序数之和是Y 、W 原子序数之和的1/2。
甲、乙、丙、丁是由这些元素组成的二元化合物,M 是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N 是具有漂白性的气体(常温下)。
推荐2019高考化学一轮基础夯实练(10)(含解析)新人教版

2019高考化学一轮基础夯实练(10)李仕才一、选择题1、下列离子方程式书写正确的是( )A .Na 2SO 3溶液中SO 2-3的水解:SO 2-3+2H 2O===H 2SO 3+2OH -B .用CuCl 2溶液做导电性实验,灯泡发光:CuCl 2=====通电Cu 2++2Cl -C .明矾溶于水产生Al(OH)3胶体:Al 3++3H 2O===Al(OH)3↓+3H +D .向[Ag(NH 3)2]OH 溶液中加入盐酸:[Ag(NH 3)2]++OH -+3H ++Cl- ===AgCl↓+2NH +4+H 2OD [A 项,H 2SO 3为二元弱酸,SO 2-3分步水解,以第一步水解为主,离子方程式为SO 2-3+H 2O HSO -3+OH -,错误;B 项,灯泡发光是因为溶液中存在自由移动的离子,这些离子是由CuCl 2电离出来的,但电离不需要条件,错误;C 项,Al(OH)3胶体不是沉淀,不能用“↓”且应为可逆号,错误;D 项,[Ag(NH 3)2]OH 能完全电离出[Ag(NH 3)2]+和OH -,与Cl -和H +反应,正确。
]2、东晋葛洪《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”。
下列化学操作与“渍”相同或相近的是( )A .洗涤B .浸泡C .萃取D .煮沸B [“渍”为浸泡、浸取,B 正确。
]3、短周期主族元素X 、Y 、Z 在元素周期表中的相对位置如图所示。
下列说法中一定正确的是( )A .最高正化合价:Z>XB .X 、Y 、Z 的单质中,Z 的熔点最高C .若X 为非金属元素,则离子半径:X n ->Y m ->Z m -D .若X 为金属元素,则X 、Y 、Z 的最高价氧化物对应水化物中,Y 的碱性最强C [一般情况下,元素的最高正化合价与其族序数相等,但F 无正价、O 无最高正化合价,Z 为O 或F 时不符合题意,A 项错误;若X 为Si ,则三者的单质中,Si 的熔点最高,B 项错误;若X 为非金属元素,则X n -、Y m -具有相同电子层结构,核电荷数越小,离子半径越大,故离子半径:X n ->Y m -,而Y m -比Z m -多1个电子层,离子半径:Y m ->Z m -,C 项正确;X 、Y 、Z中X 的金属性最强,故X 的最高价氧化物对应水化物的碱性最强,D 项错误。
2019高考化学一轮基础夯实练1含解析新人教版2018090441

2019高考化学一轮基础夯实练(1)一、选择题1、某铁的氧化物(Fe x O)1.52 g 溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl 2,恰好将Fe 2+完全氧化。
x 值为( ) A 、0.80 B 、0.85 C 、0.90D 、0.93A [根据电子守恒可知,Fe x O 被氧化为Fe 3+转移的电子数和Cl 2转移的电子数相等。
标准状况下112 mL Cl 2转移电子数为0.01 mol 。
则有 1.5256x +16×⎝⎛⎭⎪⎫3-2x ×x=0.01,解得x =0.80,A 项正确。
]2、(2017·郑州一模)汽车剧烈碰撞时,安全气囊中发生反应NaN 3+KNO 3―→K 2O +Na 2O +N 2↑。
对上述反应的描述错误的是( ) A 、NaN 3是还原剂,KNO 3是氧化剂B 、该反应中有两种元素的化合价发生变化C 、配平后物质的系数依次为10、2、1、5、16D 、若生成8 mol N 2,则转移电子的物质的量为5 molB [由题给反应中氮元素的化合价变化可知,NaN 3为还原剂,KNO 3为氧化剂,A 项正确;该反应中只有N 元素的化合价发生变化,B 项错误;根据得失电子守恒及原子守恒配平化学方程式:10NaN 3+2KNO 3===K 2O +5Na 2O +16N 2↑,C 项正确;由10NaN 3+2KNO 3===K 2O +5Na 2O +16N 2↑可知,生成16 mol 氮气时,转移10 mol 电子,则生成8 mol N 2时,转移5 mol 电子,D 项正确。
]3、(2018·长郡中学临考冲刺)X 、Y 、Z 、W 是原子序数依次增大的短周期元素,且X 、Z 原子序数之和是Y 、W 原子序数之和的1/2。
甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019高考化学一轮基础夯实练(10)李仕才一、选择题1、下列离子方程式书写正确的是( )A .Na 2SO 3溶液中SO 2-3的水解:SO 2-3+2H 2O===H 2SO 3+2OH -B .用CuCl 2溶液做导电性实验,灯泡发光:CuCl 2=====通电Cu 2++2Cl -C .明矾溶于水产生Al(OH)3胶体:Al 3++3H 2O===Al(OH)3↓+3H +D .向[Ag(NH 3)2]OH 溶液中加入盐酸:[Ag(NH 3)2]++OH -+3H ++Cl- ===AgCl↓+2NH +4+H 2OD [A 项,H 2SO 3为二元弱酸,SO 2-3分步水解,以第一步水解为主,离子方程式为SO 2-3+H 2O HSO -3+OH -,错误;B 项,灯泡发光是因为溶液中存在自由移动的离子,这些离子是由CuCl 2电离出来的,但电离不需要条件,错误;C 项,Al(OH)3胶体不是沉淀,不能用“↓”且应为可逆号,错误;D 项,[Ag(NH 3)2]OH 能完全电离出[Ag(NH 3)2]+和OH -,与Cl -和H +反应,正确。
]2、东晋葛洪《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”。
下列化学操作与“渍”相同或相近的是( )A .洗涤B .浸泡C .萃取D .煮沸B [“渍”为浸泡、浸取,B 正确。
]3、短周期主族元素X 、Y 、Z 在元素周期表中的相对位置如图所示。
下列说法中一定正确的是( )A .最高正化合价:Z>XB .X 、Y 、Z 的单质中,Z 的熔点最高C .若X 为非金属元素,则离子半径:X n ->Y m ->Z m -D .若X 为金属元素,则X 、Y 、Z 的最高价氧化物对应水化物中,Y 的碱性最强C [一般情况下,元素的最高正化合价与其族序数相等,但F 无正价、O 无最高正化合价,Z 为O 或F 时不符合题意,A 项错误;若X 为Si ,则三者的单质中,Si 的熔点最高,B 项错误;若X 为非金属元素,则X n -、Y m -具有相同电子层结构,核电荷数越小,离子半径越大,故离子半径:X n ->Y m -,而Y m -比Z m -多1个电子层,离子半径:Y m ->Z m -,C 项正确;X 、Y 、Z中X 的金属性最强,故X 的最高价氧化物对应水化物的碱性最强,D 项错误。
]4、下左图装置中的电解液是盐酸除去铁锈混合液,下右图是电解4 min 时,混合溶液中金属阳离子的物质的量与转移电子的物质的量变化关系图。
下列说法错误的是( )A.图中②线表示的是Fe2+的变化B.电解4 min时,Fe2+生成速率为v(Fe2+)=0.1 mol·L-1·min-1C.石墨极的电极反应式为Fe3++e-===Fe2+D.反应结束后,要使混合液中金属阳离子恰好完全沉淀,需要280 mL 5.0 mol·L-1NaOH 溶液B [根据混合溶液中金属阳离子的物质的量与转移电子的物质的量变化关系图可知,电解4 min时n(Cu2+)从0→0.2 mol,n(Fe3+)从0.4 mol→0,则图中②线表示的是Fe2+的变化,A 正确;电解前n(Fe3+)=0.4 mol,n(Fe2+)=0.1 mol,当电解4 min时,Fe3+完全反应,生成0.4 mol Fe2+,v(Fe2+)=(0.4 mol÷0.1L)÷4 min=1 mol·L-1·min-1,B错误;电解混合液中Fe3+在阴极放电,C正确;反应结束后,混合液中含0.5 mol Fe2+和0.2 mol Cu2+,需要加入NaOH溶液1.4 mol,则NaOH溶液的体积为1.4 mol÷5 mol·L-1=0.28 L=280 mL,D正确。
]5、(2018·双流中学适应性考试)亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO-2、Cl-等,其中HClO2和ClO2都具有漂白作用。
已知pOH=-lg c(OH-),经测定25 ℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是( )A.HClO2的电离平衡常数的数值K a=10-8B.pOH=11时,ClO-2部分转化成ClO2和Cl-离子的方程式为5ClO-2+2H2O===4ClO2+Cl-+4OH-C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO-2)>c(ClO2)>c(Cl-)D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2) +2c(H+)=c(ClO-2)+2c(OH-)D [HClO 2的电离平衡常数K=-2+c HClO2,观察图像可以看出,当pOH=8时,pH=6,c(ClO-2)=c(HClO2),此时HClO2的电离平衡常数的数值K a=c(H+)=10-6,A错误;pOH=11时,溶液显酸性,不能生成OH-,B错误;根据图知,pH=7时,存在c(HClO2)<c(ClO-2),则微粒浓度大小顺序是c(ClO-2)>c(HClO2)>c(ClO2)>c(Cl-),C错误;根据电荷守恒得出:c(H+)+c(Na+)=c(ClO-2)+c(OH-),依据物料守恒得出:2c(Na+)=c(ClO-2)+c(HClO2),二者消去Na+:c(HClO2)+2c(H+)=c(ClO-2)+2c(OH-),D正确。
]6、(2017·株洲质检)甲、乙、丙、X 是中学化学中常见的4种物质,其转化关系如图,其中甲和X不可能是( )A.甲为C2H5OH、X为O2B.甲为H2S、X为O2C.甲为 HNO3、X为FeD.甲为AlCl3溶液、X为NaOH溶液A[C2H5OH和O2可生成乙醛,乙醛可氧化为乙酸,但乙酸不能与乙醇转化为乙醛, A错误;H2S和O2反应生成S, S和O2生成SO2,SO2和H2S反应生成S, B正确;HNO3和Fe生成Fe(NO3)3,Fe(NO3)3和铁反应生成Fe(NO3)2,Fe(NO3)2可被硝酸氧化为Fe(NO3)3, C正确;AlCl3溶液和NaOH 溶液反应生成Al(OH)3,Al(OH)3与NaOH反应生成NaAlO2,NaAlO2与AlCl3溶液反应生成Al(OH)3,D正确。
]7、在光照下与氯气发生侧链上的一氯取代反应,则生成物有 ( )A.6种B.10种C.12种D.16种C[先写出芳香烃的同分异构体,即—C4H9有四种结构:然后,再判断一氯代物的同分异构体数目。
Ⅰ、Ⅱ、Ⅲ、Ⅳ的侧链上的一氯代物分别有4种、4种、3种、1种,共12种。
]8、(2018·安徽合肥第二次教学质量检测)某种医药中间体X,其结构简式如图。
下列有关该化合物的说法正确的是( )A.X的分子式为C16H11O4B.X分子中有3种不同的官能团C.X分子中3个六元环可能处于同一平面D.既能发生酯化反应,又能发生水解反应D[根据有机物碳原子成键特点,此有机物的分子式为C16H12O4,故A错误;含有的官能团是酯基、羧基,只有2种,故B错误;有机物中有sp3杂化的碳原子,因此3个六元环一定不共面,故C错误;含有羧基,能发生酯化反应,含有酯基,能发生水解反应,故D正确。
]二、非选择题(2018·湖南省考前演练三)亚硝酸钠是一种食品添加剂,具有防腐和抗氧化作用。
某同学对亚硝酸钠进行了相关探究。
(一)查阅资料①亚硝酸钠(NaNO2)为无色、无味的结晶。
②HNO2是一种弱酸,酸性比醋酸略强,性质不稳定,易分解生成NO和NO2;能被常见的强氧化剂氧化;但在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。
③AgNO2是一种微溶于水、易溶于酸的浅黄色固体。
(二)问题讨论(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是___________________________________________________________________________________________________________________________________。
若发生中毒时,你认为下列物质有助于解毒的是________。
A.鸡蛋清B.胃舒平[主要成分是Al(OH)3]C.小苏打D.维生素C(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。
要区别NaNO2和NaCl两种固体,你需用的试剂是________。
(三)实验测定为了测定某样品中NaNO2的含量,某同学进行如下实验:①称取样品a g,加水溶解,配制成100 mL溶液。
②取25.00 mL溶液于锥形瓶中,用0.02 mol/L KMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液V mL。
(3)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________。
(4)在进行滴定操作时,KMnO4溶液盛装在________(填“酸式”或“碱式”)滴定管中。
当滴入最后一滴溶液, ________________________________时达到滴定终点。
(5)滴定过程中发生反应的离子方程式是____________________________;测得该样品中NaNO 2的质量分数为________。
(6)若滴定管未用KMnO 4标准溶液润洗就直接注入,则测定结果________;若滴定过程中刚出现颜色变化就停止滴定,则测定结果________(填“偏大”“偏小”或“无影响”)。
【解析】 (1)由资料可知,误食亚硝酸盐(如NaNO 2)会致使机体组织缺氧,出现青紫而中毒,原因是血红蛋白中Fe 2+被NO -2氧化为Fe 3+,导致血红蛋白失去运氧功能。
若发生中毒时,服用还原性强的物质如维生素C 有助于解毒。
(2)要区别NaNO 2和NaCl 两种固体,可利用氯离子的检验方法,或根据资料利用亚硝酸盐的氧化性或亚硝酸的弱酸性设计出不同的方案,需用的试剂是HNO 3酸化的AgNO 3溶液(检验氯离子)或酚酞试液(亚硝酸根水解显碱性)或淀粉KI 试液和稀硫酸(把I -氧化成I 2,碘遇淀粉变蓝)。
(3)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有烧杯、100 mL 容量瓶。
(4)KMnO 4溶液有强氧化性,所以盛装在酸式滴定管中。
高锰酸钾稀溶液显红色,它被还原的产物几乎是无色的,当滴入最后一滴溶液,锥形瓶中无色溶液变成粉红色,且30 s 内不会褪色。
