细菌内毒素 - 理论
细菌内毒素试验(鲎试验)的全面解析

细菌内毒素试验(鲎试验)的全面解析一般细菌毒素可分为两类,一类为外毒素(Exotoxin);它是一种毒性蛋白质,是细菌在生长过程中分泌到菌体外的毒性物质。
产生外毒素的细菌主要是革兰氏阳性菌。
如白喉杆菌、破伤风杆菌、肉毒杆菌、金黄色葡萄球菌以及少数革兰氏阴性菌。
另一类为内毒素(Endotoxin),是革兰氏阴性菌的细胞壁的产物。
细菌在生活状态时不释放出来,只有当细菌死亡自溶或粘附在其它细胞时,才表现其毒性,内毒素的主要化学成分是脂多糖中的类脂A成分。
和热原的关系热原(pyrogen)系指能引起恒温动物体温异常升高的致热物质。
它包括细菌性热原、内源性高分子热原、内源性低分子热原及化学热原等。
热原是否就是内毒素?细菌内毒素是热原的一种,即细菌性热原。
细菌内毒素被认为是热原的本质,此事在学术上仍有争议,热原不仅是细菌内毒素。
但在药检的范畴,细菌内毒素是主要的热原物质,可以说无内毒素就无热原,控制内毒素就是控制热原。
热原反应:含有热原的注射剂注入人体可引起发热反应,使人体产生发冷、寒战、体温升高、出汗、恶心、呕吐等症状,有时体温可升至40℃,严重者甚至昏迷、虚脱,如不及时抢救,可危及生命。
来源和控制方法1、细菌内毒素的特性2、去除细菌内毒素的方法(1)吸附法此法是利用活性炭对热原的吸附作用达到去除作用的方法。
常用的吸附剂中,活性炭对热原的吸附作用最强,一般用量为总容量的0.1%-0.5% ,将溶液加热到70℃左右保温一定时间效果更好。
使用的活性炭应符合药典规定要求。
(2)蒸馏法此法是利用热原具有不挥发性而达到去除目的。
因此,凡适于蒸馏的药品均可用蒸馏法除去热原。
(3)热破坏法此法是利用热高温能破坏热原质达到去除目的。
因此,凡适用于高温处理的如热原检查试验中接触药液的容器,可用180℃干烤3小时,或250℃干烤30min以上。
(4)强酸强碱处理法此法利用强酸强碱能破坏热原而达到去除的目的。
(5)其他,也可以采用过滤等方法去除热原。
细菌内毒素

细菌内毒素
细菌内毒素是一种由细菌分泌的有毒物质。
它主要由细菌的细胞壁、胞外膜或细胞内产生,并在细菌感染或死亡时释放出来。
细菌内毒素的化学结构和生物活性因细菌种类而异。
它们可以直接伤害宿主细胞,引发免疫反应或导致中毒。
一些细菌内毒素可以穿透宿主细胞膜,并干扰细胞内代谢和信号传导通路,导致细胞功能异常甚至死亡。
细菌内毒素可以引起许多疾病,包括细菌感染引起的疾病如脓毒症、痢疾以及肺炎等。
它们还可能导致食物中毒、肠胃炎和其他细菌相关的疾病。
针对细菌内毒素的治疗方法包括抗生素治疗、中和细菌内毒素的抗体和免疫疗法,以及相关的疫苗预防措施。
需要注意的是,某些细菌内毒素具有非常强的毒性,可能对人类和动物的健康造成严重威胁。
因此,对细菌内毒素的研究和监测非常重要,以便及时采取控制和预防措施。
细菌内毒素ppt

细菌内毒素标准品的稀释
➢ CP2010年版规定内毒素标准品溶解后要在旋涡 混合器上混合15分钟,以后的每一步稀释前要 至少混合30秒,其他国家药典也有类似要求;
➢ 具有两极活性的内毒素分子在水中呈现不均匀 分布
➢ 不按要求进行旋涡混合会使所稀释的内毒素效 价偏低,造成灵敏度标示偏高、阳性对照不凝 等不正确的实验结果
2、将细菌内毒素国家标准品或工作标准品用细菌内毒素 检查用水溶解 ,在旋涡混合器上混匀15分钟 ,然后根据 鲎试剂标示灵敏度(λ),制成 2λ、λ、0.5λ和0.25λ4个 浓度的内毒素标准溶液,每稀释一步均应在旋涡混合器上 混匀30秒钟。
示例 某待复核的鲎试剂的灵敏度标示值为0.25EU/ml, 细菌内毒素工作标准品规格为150EU/ml,将细菌内毒素工 作标准品用1ml检查用水溶解,再稀释制备成浓度为 0.50EU/ml,0.25EU/ml,0.125EU/ml,和0.0625EU/ml的细 菌内毒素标准溶液。
试验中所用的器皿,需要经过处理,除去 可能存在的外源性内毒素。常用的方法是 250℃干烤至少30分钟,达到规定时间后, 关断电源,待烤箱温度自然降至室温,一 般约需6~8 小时。 也可用其他适宜的方法,并应确证不干扰 细菌内毒素的检查。
除去外源性内毒素的玻璃器皿应在规定内 使用,否则须再次除去可能存在的外源性 内毒素。
细菌内毒素检查
主要内容
细菌内毒素检查相关理论及概念
细菌内毒素 实验原理 实验试剂 实验器具
细菌内毒素检查法及注意事项
供试品溶液的制备 内毒素限值的确定 最大有效稀释倍数(MVD)的确定 鲎试剂灵敏度复核 干扰实验 凝胶限度试验
细菌内毒素
➢ 细菌内毒素主要存在于革兰阴性菌细胞壁 的最外层,当细菌死亡、裂解后才释放出 来。
细菌内毒素知识

从示意图我们可 以知道: 细菌内毒素不是 细菌或细菌的代 谢产物,而是细 菌死亡或裂解后 才释放出来的一 种具有生物活性 的物质
1. 细菌内毒素的定义
•1.3 脂多糖的组成
◆脂质A(Lipid A): •糖磷脂。是细菌内毒素生物学活性的主要组分,无种属特 异性。 ◆核心多糖(core polysaccharide):位于脂质A的外层,有种 属特异性。 ◆特异多糖(specific polysaccharide):由数个至数十个低聚 糖重复单位组成的多糖链。具有种属特异性。革兰氏阴性菌 的菌体抗原(O 抗原)
所使用的标准曲线上最低的内毒素浓度; ◆ c 为供试品溶液的浓度,
当L 以EU/ml 表示时,则c 等于1.0ml/ml, 当L以EU/mg 或EU/U 表示时,c 的单位需为mg/ml 或U/ml。 如供试品为注射用无菌粉末或原料药,则MVD 取1,可计算供试
品的最小有效稀释浓度c=λ/L。
谢谢大家!
3. 超滤法 可基于产品的分子量,选择合适的超滤膜进行处理,考虑到内毒素的聚 集的多变性,选用超滤法除蛋白溶液内毒素,并不是很合适的。
5. 细菌内毒素的去除方法
5.2 化学降解法 热原能被强酸、强碱、强氧化剂破坏。玻璃容器及用具、配 液用玻璃器皿、输液瓶等可用重铬酸钾硫酸清洁液或氢氧化 钠(如0.5M NaOH处理30min)处理,破坏热原。
6. 细菌内毒素的检测方法
6.3 确定最大有效稀释倍数(MVD) 最大有效稀释倍数是指在试验中供试品溶液被允许稀释的最大倍数,在不 超过此稀释倍数的浓度下进行内毒素限值的检测。用以下公式来确定:
MVD=cL/λ
式中: ◆ L 为供试品的细菌内毒素限值;
◆ λ为在凝胶法中鲎试剂的标示灵敏度(EU/ml),或是在光度测定法中
细菌内毒素结论

细菌内毒素结论细菌内毒素是一种透过细菌细胞壁释放至外部的有毒分子,它可以引发机体的炎症、凝血和脏器损伤等不良反应。
研究表明,细菌内毒素是引发严重感染(如脓毒症)的主要原因之一,其流感毒素、大肠杆菌毒素、痢疾杆菌毒素等常见病原体毒素已经被广泛研究。
尤其在感染疾病治疗中,对细菌内毒素的研究已成为重要的研究方向之一。
细菌内毒素的结构、生产和释放:细菌内毒素是由革兰氏阴性菌所产生,它主要是由中央毒素结构的脂多糖(LPS)所组成。
LPS是细胞壁中的一个组分,它结合在细菌SC层(荚膜)的表面并形成一个外层膜。
具体来说,LPS由三部分组成:O抗原、中央核心部分和脂肉类A内核外毒素(Endotoxin)。
其中,Endotoxin是LPS的主要成分,它可以释放到体内产生毒性反应。
此外,某些细菌还可以分泌外毒素(Exotoxin),明显产生毒性作用。
Endotoxin经过吸收和分解后,分解产物可以通过胆汁排出体外,引起胆汁淤积和胆石症。
细菌内毒素在感染疾病中的作用:在感染疾病中,细菌内毒素会引起机体严重的炎症反应,进而导致休克、败血症等多种疾病。
实验室研究证明,当Endotoxin作用于大量脐带、侧十二指肠黏膜、靜脉等受体时,会产生严重的内毒素反应。
Endotoxin从受体上提取到细胞内并造成细胞膜的受损,细胞释放出各种炎症介质(如肿瘤坏死因子、白三烯、等等),再引起其他免疫细胞激活,形成一个恶性循环的作用机制。
研究表明,内毒素在肠道中可以改变肠道黏膜的通透性,促进肠道细菌的侵袭,增加肠胃道的感染、内毒素血症、出血、萎缩性肠炎等并发症的风险。
检测细菌内毒素的方法包括:1. LAL法,这是目前常用的检测B类内毒素(Endotoxin)的方法。
2.组织培养,此法通过培养体液或患者组织标本中的细菌来检测Endotoxin,但是它存在收到感染病灶影响的局限性。
3.免疫学检测,其原理是通过检测人体免疫系统对Endotoxin的抗体来确定是否存在内毒素反应等。
细菌内毒素检查法讲义

鲎试剂灵敏度复核试验
内毒素浓度 2λ
● ● 鲎试剂 平行管 ●
λ
0.5λ 0.25λ
阴性对 照
终点
●○ ○
○
λ
●○ ○
○
λ
●● ○
0.5λ
●●● ○
0.5λ
λc=lg-1[(lgλ+lgλ+lg0.5λ+lg0.5λ)/4]=0.707λ
如果供试品为注射用无菌粉末或原料药,则MVD 取1,计算供试品的最小有效稀释浓度c=λ/L ;
适用于供试品为固体的情况。计算得到的最小有 效稀释浓度即为MVD下的该供试品的浓度。
例:注射用阿莫西林钠 计算限值为0.15EU/mg,使用灵敏度为0.125EU/ml
的鲎试剂进行检验。 最小有效稀释浓度 c =0.125 EU/ml÷0.15EU/mg=0.833mg/ml
菌、抗体-抗原复合物、细胞分裂素)
热原和内毒素的关系:
热原是否就是内毒素? 在学术上仍有争议,热原不仅是细菌内
毒素。但在药检的范畴,细菌内毒素是 主要的热原物质,可以说无内毒素就无 热原,控制内毒素就是控制热原。
三、鲎
鲎(horseshoe crab)是一类与三叶虫 (现在 只有化石)一样古老的动物。鲎的祖先出 现在地质历史时期古生代的泥盆纪,当 时恐龙尚未崛起,原始鱼类刚刚问世, 随着时间的推移,与它同时代的动物或 者进化、或者灭绝,而惟独只有鲎从4 亿 多年前问世至今仍保留其原始而古老的 相貌,所以鲎有“活化石”之称。又具 有很高的药用价值。
进行检验。 需先称取一定重量的注射用阿莫西林钠,在已除去外源性
内毒素

旋涡混合器上混合15分钟,以后的每一步稀 释前要至少混合30秒,其他国家药典也有类 似要求; 具有两极活性的内毒素分子在水中呈现不均 匀分布 不按要求进行旋涡混合会使所稀释的内毒 素效价偏低,造成灵敏度标示偏高、阳性对 照不凝等不正确的实验结果
世界上现存鲎的种类
鲎是一种海洋无脊椎动物,蓝色的血液。
2 、本试验操作过程应 试验操作过程应防止微 防止微生物和内毒素的 生物的污染 污染
2010版
3 、1EU与1个内毒素国际单 位(IU)相当
2005年版
----
4、常用干热灭菌法(250℃、 常用的方法是在250 ℃干烤至少 30分钟以上)去除 60分钟 5、删除 对于过酸、过碱或本身有缓冲能 力的供试品,需调节被测溶液 (或其稀释液)的pH 值,可 使用酸、碱溶液或鲎试剂生产厂 家推荐的适宜的缓冲液调节pH 值。
实验基本流程图
供试品 限值确定
最大有效稀释 倍数确定
正式实验
供试品干扰实验
结果判断
2. 试剂、仪器设备等
细菌内毒素检查法所应用的 试剂,主要包括:鲎试剂、细菌 内毒素检查用水、细菌内毒素工 作标准品等。
国内鲎试剂的生产情况
安度斯生物技术有限公司 湛江海洋生物制品厂 福州新北鲎试剂厂 厦门鲎试剂厂 福州东方鲎试剂厂 福州平潭东方鲎试剂厂 广西北海鲎试剂厂
细菌内毒素工作标准品(CSE)
细菌内毒素工作标准品系以细菌内 毒素国家标准品为基准标定其效价, 用于试验中鲎试剂灵敏度复核、干 扰试验及各种阳性对照。
仪器设备与实验器具
分析天平 超净工作台 细菌内毒素检查专用干式恒温器 电热恒温干燥箱 旋涡混合器
《细菌内毒素的简介》课件

分泌机制
01
02
03
分泌方式
细菌内毒素通常通过细菌 细胞膜上的通道或出芽方 式分泌到细胞外。
分泌调控
细菌内毒素的分泌受到多 种因素的影响,包括细胞 内的pH值、离子浓度、能 量供应等。
分泌过程
细菌内毒素的分泌过程需 要经过多个步骤,包括内 毒素在细胞内的合成、转 运和分泌到细胞外等。
影响因子与调控方式
制。
03
细菌内毒素的生物合成与分泌 机制
生物合成机制
合成原料
细菌内毒素的生物合成需要特定 的氨基酸和脂质作为原料。
合成酶系
细菌内毒素的合成涉及一系列酶促 反应,这些酶由细菌基因编码。
合成过程
细菌内毒素的生物合成过程包括初 级代谢和次级代谢,其中初级代谢 涉及细胞生长和繁殖,次级代谢则 与内毒素的合成有关。
抑制抗原提呈
内毒素能够抑制抗原提呈细胞对细菌抗原的提呈 ,降低抗原刺激T细胞的效率。
3
诱导免疫抑制细胞因子
内毒素能够诱导免疫抑制细胞因子的产生,如转 化生长因子、白细胞介素10等,从而抑制免疫细 胞的活化和功能。
05
细菌内毒素的检测与防治
检测方法与标准
检测方法
目前常用的细菌内毒素检测方法有鲎试剂法、免疫学检测法 和生物芯片技术等。这些方法具有灵敏度高、特异性强的特 点,能够快速准确地检测出细菌内毒素的含量。
细菌内毒素广泛分布于自然界,主要存在于革兰氏阴性细菌中,如大肠杆菌、 沙门氏菌、志贺氏菌等。
应用领域
细菌内毒素在医学、生物工程、制药等领域具有广泛的应用价值,如用于制备 诊断试剂、疫苗和药物等。
02
细菌内毒素的结构与性质
化学结构
细菌内毒素的化学结构是由多个糖链组成的脂多糖,具有特定的化学组成和排列顺 序。
细菌内毒素的概念
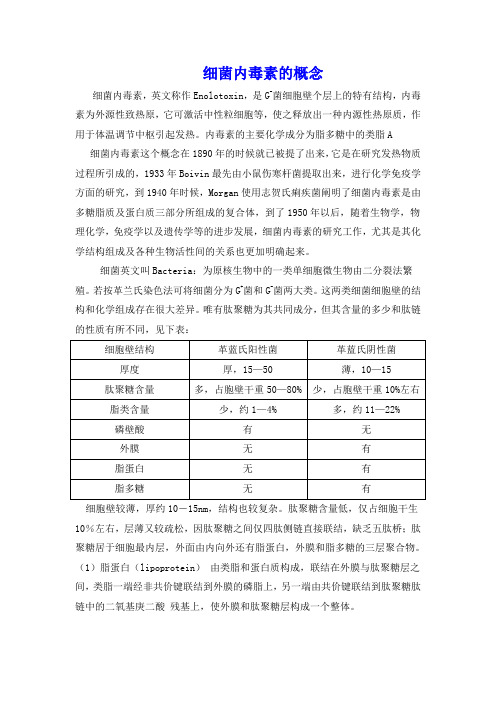
细菌内毒素的概念细菌内毒素,英文称作Enolotoxin,是G-菌细胞壁个层上的特有结构,内毒素为外源性致热原,它可激活中性粒细胞等,使之释放出一种内源性热原质,作用于体温调节中枢引起发热。
内毒素的主要化学成分为脂多糖中的类脂A细菌内毒素这个概念在1890年的时候就已被提了出来,它是在研究发热物质过程所引成的,1933年Boivin最先由小鼠伤寒杆菌提取出来,进行化学免疫学方面的研究,到1940年时候,Morgan使用志贺氏痢疾菌阐明了细菌内毒素是由多糖脂质及蛋白质三部分所组成的复合体,到了1950年以后,随着生物学,物理化学,免疫学以及遗传学等的进步发展,细菌内毒素的研究工作,尤其是其化学结构组成及各种生物活性间的关系也更加明确起来。
细菌英文叫Bacteria:为原核生物中的一类单细胞微生物由二分裂法繁殖。
若按革兰氏染色法可将细菌分为G+菌和G-菌两大类。
这两类细菌细胞壁的结构和化学组成存在很大差异。
唯有肽聚糖为其共同成分,但其含量的多少和肽链的性质有所不同,见下表:细胞壁较薄,厚约10-15nm,结构也较复杂。
肽聚糖含量低,仅占细胞干生10%左右,层薄又较疏松,因肽聚糖之间仅四肽侧链直接联结,缺乏五肽桥;肽聚糖居于细胞最内层,外面由内向外还有脂蛋白,外膜和脂多糖的三层聚合物。
(1)脂蛋白(lipoprotein)由类脂和蛋白质构成,联结在外膜与肽聚糖层之间,类脂一端经非共价键联结到外膜的磷脂上,另一端由共价键联结到肽聚糖肽链中的二氧基庚二酸残基上,使外膜和肽聚糖层构成一个整体。
(2)外膜(outer membrane)是革兰氏阴性菌细胞壁的重要结构,位于肽聚糖的外侧,其结构类似细胞膜,为液态的磷脂双层,其中镶嵌一些特异蛋白质,穿透外膜的内外双层,呈液态镶嵌体。
外膜中间有微小孔道,容许水溶性的小分子通过,以进行细胞内外的物质运输和交换。
除此之外,外膜还能防止胰蛋白酶和溶菌酶等进入,起到保护性屏障作用。
细菌内毒素名词解释

细菌内毒素名词解释
细菌内毒素是指由细菌产生的一类具有毒性的分子物质。
细菌内毒素主要存在于细菌的细胞壁、细胞膜或细胞质中。
当细菌感染机体时,它们可以释放内毒素进入周围环境或机体内部,从而引起疾病的发展和病情恶化。
细菌内毒素可以激活机体免疫系统,引起炎症反应。
一旦细菌内毒素进入机体,它们可以与免疫细胞、炎症介质和细胞受体等相互作用,导致一系列炎症反应和病理变化。
如持续的内毒素刺激会使炎症反应过度放大,导致休克、多器官功能衰竭等严重疾病。
细菌内毒素对机体的毒性可以因细菌种类、产生量和机体对毒素的敏感程度而异。
某些细菌内毒素可以引起中毒性休克、败血症、食物中毒等急性疾病,甚至危及生命。
而其他细菌内毒素则能导致慢性炎症反应、免疫异常和器官损伤等长期疾病发展。
研究细菌内毒素对于理解和控制细菌感染的病理机制具有重要意义。
许多致病细菌的内毒素已成为疫苗和药物研发的靶点,以预防和治疗与细菌感染相关的疾病。
细菌内毒素介绍

细菌内毒素介绍细菌内毒素你了解多少?1.热点引导细菌内毒素,英文称作Endotoxin,是G-菌细胞壁个层上的特有结构,内毒素为外源性致热原,它可激活中性粒细胞等,使之释放出一种内源性热原质,作用于体温调节中枢引起发热,细菌内毒素的主要化学成分为脂多糖。
革兰氏阴性菌感染的危害性主要源自其释放的内毒素。
动物传染病多种细菌皆可产生内毒素,如大肠杆菌、沙门氏菌、巴氏杆菌、胸膜肺炎放线杆菌等,它们通过外源性感染和肠道系统内源性转位两种途径进入血液循环导致内毒素血症,是机体致病的重要毒力因子。
很多严重疾病(如损伤、烧伤、心、肾、消化系统、呼吸系统、肿瘤、自动免疫等方面的疾病)都直接或间接与革兰阴性菌感染及其释放的内毒素有关。
内毒素血症、休克和弥漫性血管内凝血等,LPS进入机体后可先后诱导细胞因子和黏附分子等炎性介质产生和释放,引起内皮细胞的损伤和屏障功能的改变,导致全身性炎症反应综合征和脓毒症,严重者可导致低血压、中毒性休克、弥漫性血管内凝血(DIC)、急性呼吸窘迫综合征(ARDS)、多器官功能衰竭(MOF),甚至死亡。
白细胞数目改变,LPS初期可使血液中白细胞数目急剧下降,数小时后骨髓粒细胞又大量释放入血引发白细胞增多症。
该过程会导致动物免疫系统紊乱,增加病原体感染几率。
此外,内毒素还能导致怀孕动物流产、早产或死胎;抑制红细胞生成;具有致敏和抗敏作用等。
2.保健误区生产实践中许多人认为细菌病可用抗菌素治疗,只要通过药敏试验筛选出敏感药物,即可产生理想疗效,其实并非如此。
因为多种因素会导致药敏结果与实际效果不一致,如药物剂量、用法、血清型等。
细菌内毒素在人医上研究较多,但在兽医临床很少有人去考虑抗生素诱导细菌释放内毒素,以及某些革兰氏阴性菌会产生内毒素的问题,以致治疗效果差。
虽然现在防治内毒素损伤的方法和途径多种多样,如LPS抗体、细菌通透性增加蛋白、细胞因子拮抗剂、抗内毒素蛋白等,但尚无一种非常有效的手段。
内毒素知识介绍

内毒素知识介绍(2010-01-16 10:00:17)转载分类:精彩推荐展示标签:抗体细胞因子蛋白酶试剂盒信号转导凋亡生化试剂干细胞生物ips细菌内毒素,英文称作Enolotoxin,是G-菌细胞壁个层上的特有结构,内毒素为外源性致热原,它可激活中性粒细胞等,使之释放出一种内源性热原质,作用于体温调节中枢引起发热。
内毒素的主要化学成分为脂多糖中的类脂A细菌内毒素这个概念在1890年的时候就已被提了出来,它是在研究发热物质过程所引成的,1933年Boivin 最先由小鼠伤寒杆菌提取出来,进行化学免疫学方面的研究,到1940年时候,Morgan使用志贺氏痢疾菌阐明了细菌内毒素是由多糖脂质及蛋白质三部分所组成的复合体,到了1950年以后,随着生物学,物理化学,免疫学以及遗传学等的进步发展,细菌内毒素的研究工作,尤其是其化学结构组成及各种生物活性间的关系也更加明确起来。
细菌英文叫Bacteria :为原核生物中的一类单细胞微生物由二分裂法繁殖。
若按革兰氏染色法可将细菌分为G+菌和G-菌两大类。
这两类细菌细胞壁的结构和化学组成存在很大差异。
唯有肽聚糖为其共同成分,但其含量的多少和肽链的性质有所不同,见下表:关于细菌细胞壁结构,尤其G+/G-菌不同之处见下图所示:由以上结构模式图可以发现,G+菌与G-菌有不同之处,其中对于G-菌来说:细胞壁较薄,厚约10-15nm,结构也较复杂。
肽聚糖含量低,仅占细胞干生10%左右,层薄又较疏松,因肽聚糖之间仅四肽侧链直接联结,缺乏五肽桥;肽聚糖居于细胞最内层,外面由内向外还有脂蛋白,外膜和脂多糖的三层聚合物。
(1)脂蛋白(lipoprotein)由类脂和蛋白质构成,联结在外膜与肽聚糖层之间,类脂一端经非共价键联结到外膜的磷脂上,另一端由共价键联结到肽聚糖肽链中的二氧基庚二酸残基上,使外膜和肽聚糖层构成一个整体。
(2)外膜(outer membrane)是革兰氏阴性菌细胞壁的重要结构,位于肽聚糖的外侧,其结构类似细胞膜,为液态的磷脂双层,其中镶嵌一些特异蛋白质,穿透外膜的内外双层,呈液态镶嵌体。
欧洲药典EP6.0细菌内毒素-(中文)

2.6.14 细菌内毒素本法利用鲎试剂(从鲎——Limuluspolyhemus或 Tachypleus tridentatus——血细胞提取物(amoebocyte lysate)制备而来)检测由革兰氏阴性菌产生的细菌内毒素或对内毒素进行定量。
该检查包括三种方法:一为凝胶法,系利用鲎试剂与内毒素产生凝集反应的原理;第二种为浊度法(基于内源性底物断裂后,产生的浊度变化);最后一种为显色法(得到的肽-呈色基团复合物断裂后,检测反应混合物的色度)。
这一章阐述了下面6种方法:方法A:凝胶法:限度试验方法B:凝胶法:半定量试验方法C:动态浊度试验方法D:动态显色法方法E:终点显色法方法F:终点浊度法检测时,可用6种方法的任一种进行试验。
当测定结果可疑或有争议时,除非另有规定,以专论中的方法A的测定结果为准。
试验操作过程应防止内毒素的污染。
仪器所有的玻璃器皿及由其他耐热材料制成的器皿需用已验证的工艺在热烘箱内进行去热原处理。
去热原时,常用的最小时间和温度设置分别为30分钟和250℃。
若使用塑料器械,如微孔板和微量进样器配套的吸头等,它们必须标明无内毒素并确对试验无干扰。
注:这一章中,“管”的意思包括其他任何反应容器,如微孔板中的孔。
内毒素储备标准溶液的制备用内毒素标准品制备内毒素储备标准溶液;所用的内毒素标准品必须先用国际标准品校准,如内毒素标准BRP。
内毒素以国际单位(IU)表示。
IU的换算见国际卫生组织公布的国际标准。
注:一国际单位(IU)内毒素相当于一个内毒素单位(E.U.)。
根据包装说明书上的标准和内毒素储备标准溶液的标签上关于制备和贮存的说明。
内毒素标准溶液的制备充分混合内毒素储备标准溶液后,用细菌内毒素试验检查用水(BET检查用水)稀释,制成适当的系列稀释液,即得BET检查用内毒素标准溶液。
得到的稀释液应尽快使用,以免因吸附而导致活性损失。
供试品溶液的制备除非另有说明,以BET检查用水溶解或稀释活性成分或药品来制备供试品溶液。
细菌内毒素原理

细菌内毒素原理细菌内毒素是革兰氏阴性菌细胞壁中的特有结构,其原理涉及多个方面,下面将详细介绍:1.化学成分与结构:1.细菌内毒素的主要化学成分为脂多糖(LPS),这是革兰氏阴性菌细胞壁上的特有结构。
2.LPS由类脂A、核心多糖和O-特异侧链三部分组成,其中类脂A是内毒素毒性的主要成分。
2.毒性机制:1.内毒素是一种外源性致热原,能够激活中性粒细胞等免疫细胞,使它们释放出内源性热原质,这些物质作用于体温调节中枢,引起机体发热。
2.内毒素还可以诱导细胞因子的产生,如肿瘤坏死因子(TNF)、白细胞介素(ILs)等,这些细胞因子在炎症和免疫反应中起重要作用。
3.通过激活补体替代途径、诱导黏附分子的表达和促进自由基的生成等多种机制,内毒素对宿主产生毒性作用,可能导致微循环障碍、内毒素休克及播散性血管内凝血等严重后果。
3.释放与作用时机:1.细菌内毒素在细菌生活状态时不释放出来,只有当细菌死亡自溶或用人工方法破坏菌细胞时,才表现出其毒性。
2.进入宿主体内后,内毒素与靶细胞结合,通过信号转导机制引发细胞反应,从而产生一系列生物活性效应。
4.稳定性与灭活:1.内毒素不是蛋白质,因此非常耐热,在100℃的高温下加热1小时也不会被破坏。
通常需要在更高温度或强酸、强碱条件下才能破坏其生物活性。
2.虽然内毒素可以刺激机体产生一定量的特异性抗体(抗毒素),但这种抗体中和内毒素的作用相对较弱。
总结来说,细菌内毒素的原理涉及其化学成分与结构、毒性机制、释放与作用时机以及稳定性与灭活等方面。
这些原理共同解释了内毒素如何对宿主产生毒性作用,并在感染过程中发挥重要作用。
细菌内毒素工作原理

细菌内毒素工作原理英文回答:Bacterial Endotoxins: Mechanism of Action.Bacterial endotoxins, also known as lipopolysaccharides (LPS), are potent molecules that play a crucial role in the pathogenesis of Gram-negative bacterial infections. They are essential components of the bacterial outer membrane and are released during bacterial lysis or shedding of outer membrane vesicles.The mechanism of action of bacterial endotoxins involves a complex cascade of events that lead to the activation of the innate immune system and the production of pro-inflammatory cytokines. Here is an overview of the key steps:1. Binding to Toll-like receptor 4 (TLR4): Endotoxins bind to TLR4, a pattern recognition receptor that isexpressed on immune cells such as macrophages and dendritic cells. TLR4 recognizes the lipid A moiety of LPS, which is responsible for the endotoxic activity.2. Recruitment of adaptor proteins: Upon binding to TLR4, endotoxins trigger the recruitment of adaptor proteins such as MyD88 and TRIF. These adaptor proteins bridge the interaction between TLR4 and downstreamsignaling molecules.3. Activation of the MAPK and NF-κB pathways: The binding of endotoxins to TLR4 leads to the activation of the mitogen-activated protein kinase (MAPK) and nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB) pathways. MAPKs regulate the expression of pro-inflammatory cytokines, while NF-κB controls the transcription of genes involved in inflammation and immunity.4. Production of pro-inflammatory cytokines: The activation of the MAPK and NF-κB path ways results in the production of pro-inflammatory cytokines such as tumornecrosis factor-alpha (TNF-α), interleukin-1β (IL-1β), and interleukin-6 (IL-6). These cytokines promote inflammation, fever, and the recruitment of immune cells to the site of infection.5. Endothelial dysfunction and shock: Excessive production of pro-inflammatory cytokines can lead to endothelial dysfunction and shock. Endotoxins can directly activate endothelial cells, causing the release of vasodilators and the disruption of the endothelial barrier. This can lead to hypotension, tissue edema, and organ failure.6. Sepsis: In severe cases, the systemic release of endotoxins can trigger sepsis, a life-threatening condition characterized by uncontrolled inflammation and organ dysfunction. Sepsis is a major cause of morbidity and mortality in critically ill patients.中文回答:细菌内毒素,作用机理。
细菌内毒素检查基础理论

内毒素检查方法的合法性
根据《中国药典》细菌内毒素检查法,细菌内 毒素检查方法可分为
凝胶法限度试验凝胶半定量试验 动态浊度法终点浊度法 动态显示法终点显示法
供试品检测时,可使用其中任何一种方法进行 试验。
19
什么是争议情况?
争议的情况是指:检测同一样品出现不 同结果的情况。
鲎反应性
能与鲎试剂发生多级酶促反应,形成凝胶
除上述性质外,LPS还有许多其它的生物活性 10
• 细菌内毒素的量值
细菌内毒素
80年代以前,
ChP,EU,
不相
重量单位 mg/ng/pg20来自0年 1EU=1IU同同
︐其
重 量
生的
物内
活毒
性素
不 同
︐菌
1982年
︒
种 来
USPΧΧ,
源
EU
细菌内毒素国际单位:IU; 中国药典细菌内毒素的效价单位:EU; 中国药典2010年版第一次明确提出:1EU=1IU
外源性热原
细菌、病毒、真菌、 螺旋体和疟原虫等
内源性热原 白细胞介素-1、白细 胞介素-6、肿瘤坏死 因子和干扰素等
3
(一)热原
• 热原反应
–临床上在进行静脉滴注大量输液时,由 于药液中含有热原,病人在短时间内出现 发热、寒颤、恶心、呕吐、头痛等症状, 严重者甚至可休克,危及生命。这种现象 称为热原反应。
4
(一)热原
• 热原检查法—家兔法
• 定义:系将一定剂量的供试 品,静脉注入家兔体内,在 规定时间内,观察家兔体温
升高的情况,以判定供试品 中所含热原限度是否符合规 定。
5
(一)热原
• 热原检查法—家兔法
• 优点:能直观地反映各种热原致热程度 • 缺点:不能定量反映热原含量,不易标准
细菌内毒素 - 理论

细菌内毒素测定1:试验用的试剂为1.1内毒素工作品,1.3鲎试剂灵敏度:λ1.4细菌内毒素检查用水1.5 无热源原安剖瓶 5ml/支2:内毒素限值的确定:3:样品最大稀释倍数确定注射液MVD=λCL =鲎试剂灵敏度内毒素限值样品浓度⨯ (样品浓度按样品规格计算,单位换算为mg/ml )大输液MVD=鲎试剂灵敏度内毒素限值⨯=1λCL (大输液的浓度都按1mg/ml 计算)粉针样品稀释最大有限浓度=内毒素限值鲎试剂灵敏度=L λ(然后根据样品规格计算出应该稀释的倍数)4:溶液稀释4.1样品稀释样品稀释为比最大稀释倍数的小一倍的样品溶液为T 0和最大稀释倍数的样品溶液为T 14.2内毒素工作品稀释:内毒素工作品根据鲎试剂的灵敏度稀释S 0=4λ,S 1=2λ。
4.3样品阳性对照0.5mlS 0+0.5mlT 0混匀5:操作步骤5.1取鲎试剂8支(如有一批样品),分别加入100ul 的检查用水,复溶。
5.2 对照品和供试品5.2.1阴性对照加入100ul 检查用水5.2.2阳性对照加入100ulS 0溶液5.2.3样品加入100ulT 1溶液5.2.4样品阳性对照加入100ul 样品阳性对照溶液每个管平行做2支。
6:培养放入试管恒温仪中37℃,培养60min。
阴性对照、样品应无凝固。
阳性对照、样品阳性对照应凝固,轻轻倒立180°无滑脱。
注:1、安剖瓶用酒精棉将曲颈擦拭消毒后,沿易折点折断。
2、试验完成后,用酒精棉球擦拭工作台面。
3、培养过程中注意防止震动,以免出现假阴性。
4、S1=2λ、S0=4λ。
5、如果同时做几批样品,可以只做2个阳性对照,2个阴性对照。
6、空安剖瓶的最大容积为5ml,在稀释过程中要注意不能使稀释体积过大。
另外还要注意移液器的量程,尽量减少稀释次数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细菌内毒素测定
1:试验用的试剂为
1.1内毒素工作品,
1.3鲎试剂灵敏度:λ
1.4细菌内毒素检查用水
1.5 无热源原安剖瓶 5ml/支
2:内毒素限值的确定:
3:样品最大稀释倍数确定
注射液MVD=λCL =鲎试剂灵敏度
内毒素限值样品浓度⨯ (样品浓度按样品规格计算,单位换算为mg/ml )
大输液MVD=鲎试剂灵敏度内毒素限值⨯=1λ
CL (大输液的浓度都按1mg/ml 计算)
粉针样品稀释最大有限浓度=内毒素限值
鲎试剂灵敏度=L λ
(然后根据样品规格计算出应该稀释的倍数)
4:溶液稀释
4.1样品稀释
样品稀释为比最大稀释倍数的小一倍的样品溶液为T 0和最大稀释倍数的样品溶液为T 1
4.2内毒素工作品稀释:
内毒素工作品根据鲎试剂的灵敏度稀释S 0=4λ,S 1=2λ。
4.3样品阳性对照0.5mlS 0+0.5mlT 0混匀
5:操作步骤
5.1取鲎试剂8支(如有一批样品),分别加入100ul 的检查用水,复溶。
5.2 对照品和供试品
5.2.1阴性对照加入100ul 检查用水
5.2.2阳性对照加入100ulS 0溶液
5.2.3样品加入100ulT 1溶液
5.2.4样品阳性对照加入100ul 样品阳性对照溶液
每个管平行做2支。
6:培养
放入试管恒温仪中37℃,培养60min。
阴性对照、样品应无凝固。
阳性对照、样品阳性对照应凝固,轻轻倒立180°无滑脱。
注:1、安剖瓶用酒精棉将曲颈擦拭消毒后,沿易折点折断。
2、试验完成后,用酒精棉球擦拭工作台面。
3、培养过程中注意防止震动,以免出现假阴性。
4、S1=2λ、S0=4λ。
5、如果同时做几批样品,可以只做2个阳性对照,2个阴性对照。
6、空安剖瓶的最大容积为5ml,在稀释过程中要注意不能使稀释体积过大。
另外还要注意移液器的量程,尽量减少稀释次数。
