氯及其化合物的转化关系(王盛自编)
氯及其重要化合物的化学方程式总结

氯及其重要化合物的化学方程式总结氯元素是第17组中的第一位元素,化学符号为Cl。
它是气态二原子分子,是一种非金属元素。
氯是地壳中含量第21多的元素,主要以盐的形式存在。
氯在化学反应中可以形成两种氧化态:-1和+1、氯以负一价形式存在于大多数氯化物中,如氯化钠(NaCl),氯化银(AgCl)和氯化钙(CaCl2)。
氯以正一价形式存在于几种阳离子中,例如亚氯酸盐(ClO-),氯酸盐(ClO2-)和高氯酸盐(ClO4-)。
氯与氢气反应可以生成氯化氢,化学方程式如下:Cl2(g)+H2(g)->2HCl(g)氯气可以与水反应生成一氯化酸:Cl2(g) + H2O(l) -> HOCl(aq) + HCl(aq)氯气也可与碱反应生成亚氯酸盐:Cl2(g) + 2NaOH(aq) -> NaCl(aq) + NaClO(aq) + H2O(l)氯气还可以与亚硫酸盐反应生成氯化物和硫酸:Cl2(g) + SO32-(aq) -> Cl-(aq) + SO42-(aq)氯气可以与硫化氢反应生成硫磺和氯化氢气:Cl2(g)+H2S(g)->S(s)+2HCl(g)除了与其他元素和化合物发生反应外,氯化氢和亚氯酸盐等氯的重要化合物也有一些重要的反应。
例如氯化氢可以与氨气反应生成氯化铵:HCl(g)+NH3(g)->NH4Cl(s)亚氯酸盐可以与硝酸银反应生成氯化银:2AgNO3(aq) + 2ClO-(aq) + 2H2O(l) -> 2AgCl(s) + 2HNO3(aq) + ClO2(g)氯气还参与了许多工业过程,例如氯气在生产聚氯乙烯(PVC)时与乙烯反应生成PVC:C2H4(g)+Cl2(g)->-(-CH2-CHCl-)n-此外,氯也被广泛用于净化水、消毒和漂白剂。
氯和污染物中的有机物反应可以生成臭氧消耗物,这是一个引起全球性环境问题的重要化学反应。
总的来说,氯及其重要化合物的化学方程式涵盖了氯与其他元素和化合物发生的多种反应。
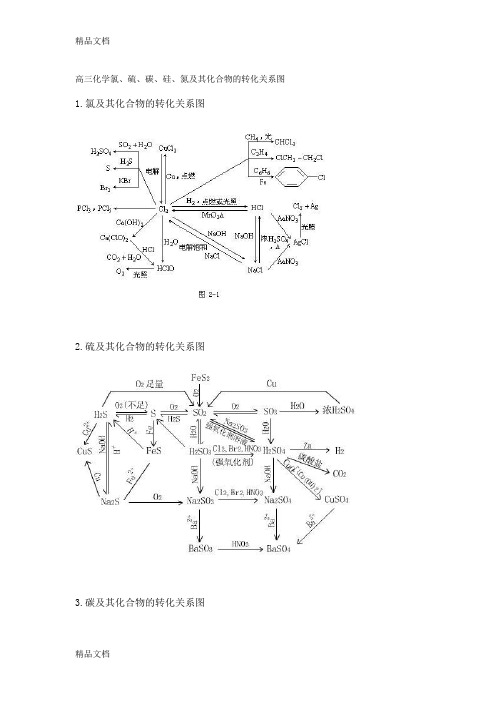
高三化学氯、硫、碳、硅、氮及其化合物的转化关系图教案资料
5.磷及其化合物的转化关系图
2、传统文化对大学生饰品消费的影响
据调查统计在对大学生进行店铺经营风格所考虑的因素问题调查中,发现有50%人选择了价格便宜些,有28%人选择服务热情些,有30%人选择店面装潢有个性,只有14%人选择新颖多样。如图(1-5)所示1.www。cer。net/artide/2004021313098897。shtml。6.铁及其化合物的转化关系图
我们认为:创业是一个整合的过程,它需要合作、互助。大学生创业“独木难支”。在知识经济时代,事业的成功来自于合作,团队精神。创业更能培养了我们的团队精神。我们一个集体的智慧、力量一定能够展示我们当代大学生的耐心.勇气和坚强的毅力。能够努力克服自身的弱点,取得创业的成功。“碧芝”的成功归于他的唯一,这独一无二的物品就吸引了各种女性的眼光。
(二)对“碧芝”自制饰品店的分析高三化学氯、硫、碳、硅、氮及其化合ห้องสมุดไป่ตู้的转化关系图
1.氯及其化合物的转化关系图
“碧芝”的成功归于他的唯一,这独一无二的物品就吸引了各种女性的眼光。2.硫及其化合物的转化关系图
(2)缺乏经营经验3.碳及其化合物的转化关系图
我们大学生没有固定的经济来源,但我们也不乏缺少潮流时尚的理念,没有哪个女生是不喜欢琳琅满目的小饰品,珠光宝气、穿金戴银便是时尚的时代早已被推出轨道,简洁、个性化的饰品成为现代时尚女性的钟爱。因此饰品这一行总是吸引很多投资者的目光。然而我们女生更注重的是感性消费,我们的消费欲望往往建立在潮流、时尚和产品的新颖性上,所以要想在饰品行业有立足之地,又尚未具备雄厚的资金条件的话,就有必要与传统首饰区别开来,自制饰品就是近一两年来沿海城市最新流行的一种。4.氮及其化合物的转化关系图
7.镁及其化合物的转化关系图
氯其化合物转化关系

氯及其化合物的转化关系2、氯气的性质H2+Cl22HCl;H2+Cl22HCl综合能力测试卷一.选择题(共28小题)1.将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是()A.与NaOH反应的氯气一定为0.3 molB.n(Na+):n(Cl﹣)可能为7:3C.若反应中转移的电子为n mol,则0.15<n<0.25D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:12.向仅含Fe2+、I﹣、Br﹣的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是()A.线段Ⅲ代表Fe2+的变化情况B.线段Ⅰ代表Br﹣的变化情况C.a数值等于6D.原混合溶液中n(FeBr2)=4 mol3.下列说法正确的是()①新制氯水的氧化性强于久置氯水;②氯气的性质活泼,它与氢气混合后立即发生爆炸;③实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收④检验Cl2中是否混有HCl气体,方法是将气体通入硝酸银溶液中⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水⑥干燥的Cl2能使湿润的有色布条褪色,说明干燥的Cl2有漂白性.A.①②③④⑤⑥ B.②③⑤ C.①②④⑤D.①③⑤4.时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域.测定含I﹣浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是①在中性溶液中,用溴将试样中I﹣氧化成IO3﹣,将过量的溴除去②再加入过量的碘化钾,在酸性条件下,使IO3﹣完全转化成I2③将②中生成的碘完全萃取后,用肼将其还原成I﹣,方程式为H2N﹣NH2+2I2→4I﹣+N2↑+4H+④将生成的I﹣萃取到水层后用①法处理.⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化.⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2→Na2S4O6+2NaI经过上述放大后,则溶液中I﹣浓度放大为原溶液中I﹣浓度的(设放大前后溶液体积相等)()A.2倍B.4倍C.6倍D.36倍5.化合物BrF x能够与水反应,产物有溴酸、氢氟酸、单质溴和氧气,则下列关于该反应的说法正确的是()A.BrF x是还原剂,HF是氧化产物B.水是氧化剂,O2是还原产物C.若x=3,则BrF x与水的系数比为3:5D.x为奇数,分别可以取1、3、5、7、9等值6.在同温同压下,将由H2和Cl2组成的混和气体200mL引发化学反应,反应后的气体体积仍为200mL.下列对化学反应状况的判断中正确的是()A.若反应后的气体有刺激性气味,则一定是Cl2没有完全反应B.若反应后的气体没有颜色,则一定是H2,Cl2都已完全反应C.若反应后的气体略带黄绿色,则一定是H2已完全反应D.若反应后的气体遇水显漂白性,则一定是Cl2未完全反应7.反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是()A.I2在反应①中是还原产物,在反应②中是氧化产物B.两个反应中生成等量的I2时转移的电子数相等C.NaI和NaIO3在一定条件下能反应生成I2D.NaIO3在化学反应中只能做氧化剂不能做还原剂8.实验:①向2mL 1mol•L﹣1 NaBr溶液中通入少量氯气,溶液变为黄色;②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;③向①所得溶液继续通入氯气,溶液由黄色变成橙色.下列分析不正确的是()A.仅根据实验①能说明还原性:Br﹣>Cl﹣B.仅根据实验②能说明氧化性:Br2>I2C.上述实验验证了Cl2、Br2、I2的氧化性相对强弱D.向实验③所得溶液中加CCl4,充分振荡,下层为橙红色9.制备食用碘盐(KIO3)原理之一为:I2+2KClO3Cl2+2KIO3,下列正确的是()A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀B.反应过程中I2置换出Cl2,由此可推断非金属性I>ClC.KClO3和KIO3均属于离子化合物,都只含有离子键D.制备KIO3的反应中氯元素被还原10.已知H2SO3+I2+H2O→2HI+H2SO4.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气,将溶液蒸干并充分燃烧,得到固体剩余物质的组成可能是()A.NaCl、Na2SO4B.NaCl、NaBr、Na2SO4C.NaCl、Na2SO4、I2 D.NaCl、NaI、Na2SO411.自来水可用氯气消毒,某学生用自来水配制下列物质的溶液,会引起药品变质是()①AgNO3②FeBr2③烧碱④Na2CO3⑤Na2SO3⑥CaCl2.A.除②⑤③外 B.④⑤⑥ C.①②③⑥D.除⑥外12.已知:常温时;2NaOH+Cl2═NaCl+NaClO+H2O;加热时:6NaOH+3Cl2═5NaCl+NaClO3+3H2O,将Cl2通入amol NaOH溶液恰好完全反应,下列有关说法错误的是()A.参加反应的氯气的物质的量等于0.5a mo1B.若某温度下,反应后=K,若溶液中=C.控制温度,反应中转移电子的物质的量最大值是a molD.控制温度,产物中NaCl的物质的量的范围 a mol≤n(NaCl)≤ a mol13.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能还有杂质气体()①CO2②HCl ③H2O ④O2.A.①②③④B.②③④ C.②③D.①④14.某溶液中含有SO32﹣、Br﹣、SiO32﹣、CO32﹣、Na+,向该溶液中通入过量的Cl2,下列判断正确的是()①反应前后,溶液中离子浓度基本保持不变的只有Na+②有胶状沉淀物质生成③有气体产生④溶液颜色发生变化⑤共发生了2个氧化还原反应.A.①②③④⑤B.①②③④C.①③⑤ D.②④⑤15.在淀粉碘化钾溶液中加入少量次氯酸钠溶液,振荡后溶液变蓝,再加入足量的亚硫酸钠溶液,蓝色逐渐消失.下列判断错误的是()A.氧化性:ClO﹣>SO42﹣>I2B.漂粉精溶液可使淀粉碘化钾试纸变蓝C.ClO﹣与I﹣在碱性条件可以发生氧化还原反应D.向新制氯水中加入足量亚硫酸钠溶液,氯水褪色16.某溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl﹣、﹣﹣C.15:30:8 D.条件不足,无法计算17.相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是()A.1:1:2 B.2:1:3 C.6:3:2 D.3:2:118.已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体.②向NaI溶液中通入少量实验①产生的气体,溶液变黄色.③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是()A.实验①证明Cl﹣具有还原性B.实验②中氧化剂与还原剂的物质的量之比为2:1C.实验③说明KI被氧化D.上述实验证明氧化性:ClO3﹣>Cl2>I219.溶液中含有NH4+、F﹣、HSO3﹣、K+等离子.向其中加入少量NaClO后,溶液中离子数目肯定增加的是()A.F﹣B.ClO﹣C.HSO3﹣D.NH4+20.有一混合溶液,其中只含有Fe2+、Cl﹣、Br﹣、I﹣(忽略水的电离),Cl﹣、Br﹣、I﹣的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl﹣和Br﹣的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为()A.7:4 B.7:3 C.7:2 D.7:121.已知在热的碱性溶液中,Cl2发生如下反应:Cl2+NaOH→NaCl+NaClO3+H2O(未配平).请推测NaClO2在热的碱性溶液中发生反应的最终产物是()A.NaCl、NaClO B.NaCl、NaClO3C.NaClO、NaClO3D.NaClO3、NaClO422.已知:2Fe2++Br2═2Fe3++2Br﹣,2Fe3++2I﹣═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是()A.还原性:I﹣>Fe2+>Br﹣B.原混合溶液中FeBr2的物质的量为6 molC.当通入2 mol Cl2时,发生的离子反应可表示为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣D.原溶液中:n(Fe2+):n(I﹣):n(Br﹣)=2:1:323.某混合溶液中含有NaI、NaBr、Na2SO3三种溶质,其物质的量均为l mol,向混合溶液中通入一定量的氯气.下列说法正确的是()A.将溶液蒸干最多可以得到4 mol NaClB.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4C.向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量D.若通入氯气的体积为11.2 L(标准状况),反应的离子方程式为:2I﹣+Cl2=I2+2C1﹣24.下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终可能得到纯净物的是()A.向FeSO4溶液中通入Cl2B.向KI和NaBr混合溶液中通入Cl2C.向NaAlO2溶液中加入HCl溶液D.向NaHCO3溶液中加入Na2O2粉末25.往含Br﹣和Cl﹣的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则原溶液中c(Br﹣)/c(Cl﹣)的比值约为()A.(V2﹣V1)/V1 B.V1/V2C.V1/(V2﹣V1)D.V2/V126.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是()A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl﹣存在D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在27.下列氯化物,不能用单质直接反应制得的是()A.CuCl2B.FeCl2C.NaCl D.HCl28.某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O),经测定ClO﹣与ClO3﹣的物质的量之比为1:3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为()A.21:5 B.11:3 C.3:1 D.4:1二.填空题(共2小题)29.Cl2O为国际公认高效安全灭菌消毒剂之一,它是棕黄色强刺激性气体,沸点3.8℃熔点﹣116℃.实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,装置如下(图Ⅰ):回答下列问题:(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2.请模仿“图Ⅱ”在“图Ⅰ”A处补画出正确的装置图,并作必要的标注.(2)B中试剂a应选用(填下列序号字母):a.CCl4b.饱和NaCl溶液c.浓H2SO4 d.饱和NaHCO3溶液(3)通入适量的氯气,在C中生成黄绿色的物质Cl2O,该物质常温为气体,方程式为:Cl2+Na2CO3+═NaHCO3+NaCl+Cl2O(4)对C中反应后的固体成分进行检验,请写出实验步骤以及预期的现象和结论.限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、澄30.禽流感病毒是一种没有超常抵抗力的病毒.研究证明,许多常用消毒药物如漂粉精、漂白粉、高锰酸钾等,可以将禽流感病毒杀灭.氯气与氢氧化钙充分反应,得到漂粉精,其稳定性比漂白粉高.(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂粉精,化学反应方程式为:.(2)漂粉精的有效成分是(填化学式).(3)漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的物质,化学反应方程式为.(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号).(5)将漂粉精溶于适量水中,呈白色浊状物,静置沉降.取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为.另取少许上层清液,先滴加适量的(填化学式)酸化,再滴加(填化学式)溶液即可检验Cl﹣的存在,发生反应的离子方程式为.再取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈性并具有性.氯及其化合物参考答案与试题解析一.选择题(共28小题)1.(2015•上饶模拟)将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是()A.与NaOH反应的氯气一定为0.3 molB.n(Na+):n(Cl﹣)可能为7:3C.若反应中转移的电子为n mol,则0.15<n<0.25D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1【解答】解:A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气n(Cl2)=0.15mol,故A错误;B、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时,n(Na+):n(Cl﹣)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl﹣)最小为6:5,故6:5<n(Na+):n(Cl﹣)<2:1,7:3>2:1,故B错误;C、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时,转移电子数最少,为0.3mol××1=0.15mol,氧化产物只有NaClO3时,转移电子数最多,为0.3mol××1=0.25mol,故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;故选C.2.(2014•黄梅县校级模拟)向仅含Fe2+、I﹣、Br﹣的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是()A.线段Ⅲ代表Fe2+的变化情况 B.线段Ⅰ代表Br﹣的变化情况C.a数值等于6 D.原混合溶液中n(FeBr2)=4 mol【解答】解:向仅含Fe2+、I﹣、Br﹣的溶液中通入适量氯气,根据还原性:I﹣>Fe2+>Br﹣,首先发生反应:2I﹣+Cl2=I2+2Cl﹣,I﹣反应完毕,再发生反应:2Fe2++Cl2=2Fe3++2Cl﹣,Fe2+反应完毕,最后发生反应:2Br﹣+Cl2=Br2+2Cl﹣,故线段Ⅰ代表I﹣的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br﹣的变化情况;由通入氯气可知,根据反应离子方程式可知溶液中n(I﹣)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol﹣1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I﹣)+n(Br﹣)=2n(Fe2+),故n(Br﹣)=2n(Fe2+)﹣n(I﹣)=2×4mol﹣2mol=6mol,A、由上述分析可知,线段Ⅲ代表Br﹣的变化情况,故A错误;B、由上述分析可知,线段I代表I﹣的变化情况,故B错误;C、由上述分析可知,溶液中n(Br﹣)=2n(Fe2+)﹣n(I﹣)=2×4mol﹣2mol=6mol,根据2Br﹣+Cl2═Br2+2Cl﹣可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,故C 正确;D、溶液中n(Br﹣)=6mol,所以原混合溶液中n(FeBr2)=3mol,故D错误;故选:C.3.(2015•江西模拟)下列说法正确的是()①新制氯水的氧化性强于久置氯水;②氯气的性质活泼,它与氢气混合后立即发生爆炸;③实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收④检验Cl2中是否混有HCl气体,方法是将气体通入硝酸银溶液中⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水⑥干燥的Cl2能使湿润的有色布条褪色,说明干燥的Cl2有漂白性.A.①②③④⑤⑥ B.②③⑤ C.①②④⑤D.①③⑤【解答】解:①新制氯水中含有大量氯气和次氯酸,久置氯水相当于盐酸溶液,氯水和次氯酸有强氧化性、盐酸具有弱氧化性,所以新制氯水氧化性大于久置氯水,故正确;②氯气的性质活泼,它与氢气混合后干燥条件下发生爆炸,常温下不反应,故错误;③氯气有毒不能直接排空,氯气和水反应生成酸,所以氯气能和碱反应生成盐,实验室用NaOH溶液吸收氯气尾气,故正确;④氯气、HCl都可以和硝酸银反应生成白色沉淀,所以不能用硝酸银溶液检验,故错误;⑤HCl极易溶于水,饱和食盐水抑制氯气溶解,所以可以用饱和食盐水除去氯气中的HCl,故正确;⑥氯气没有漂白性,次氯酸有漂白性,干燥的氯气能使湿润的有色布条褪色,实际上是氯气和水反应生成的HClO体现的漂白性,故错误;故选D.4.(2014•扶沟县校级模拟)时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域.测定含I﹣浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是①在中性溶液中,用溴将试样中I﹣氧化成IO3﹣,将过量的溴除去②再加入过量的碘化钾,在酸性条件下,使IO3﹣完全转化成I2③将②中生成的碘完全萃取后,用肼将其还原成I﹣,方程式为H2N﹣NH2+2I2→4I﹣+N2↑+4H+④将生成的I﹣萃取到水层后用①法处理.⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化.⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2→Na2S4O6+2NaI经过上述放大后,则溶液中I﹣浓度放大为原溶液中I﹣浓度的(设放大前后溶液体积相等)()A.2倍B.4倍C.6倍D.36倍【解答】解:①从方程式可看出,I﹣浓度不变;②从方程式可看出,1个IO3﹣生成3个I2,从第三步反应看出,I﹣浓度放大了6倍;③从方程式可看出,1个I2生成2个I﹣;④从方程式可看出,I﹣浓度不变;⑤从方程式可看出,1个IO3﹣生成3个I2,从第三步反应看出,I﹣浓度放大了6倍;⑥从方程式可看出,1个I2生成2个I﹣;因此从以上方程式和分析可得关系式:I~IO3﹣~3I2~6I﹣~6IO3﹣~18I2~36S2SO32﹣~36I﹣,1 3 6 6 18 36总计放大倍数为:6×6=36倍.故选D.5.(2011•北京模拟)化合物BrF x能够与水反应,产物有溴酸、氢氟酸、单质溴和氧气,则下列关于该反应的说法正确的是()A.BrF x是还原剂,HF是氧化产物B.水是氧化剂,O2是还原产物C.若x=3,则BrF x与水的系数比为3:5D.x为奇数,分别可以取1、3、5、7、9等值【解答】解:A.F的非金属性非常强,其它氧化剂难以氧化F,反应前后F元素的化合价不变,故A错误;B.反应中O元素的化合价升高,水被氧化生成氧气,则水为还原剂,O2是氧化产物,故B 错误;C.若x=3,则BrF3与水发生:3BrF3+5H2O=HBrO3+9HF+O2+Br2,BrF x与水的系数比为3:5,故C正确;D.Br的最外层电子数为7,最高化合价为+7价,x不可能为9,故D错误.故选C.6.在同温同压下,将由H2和Cl2组成的混和气体200mL引发化学反应,反应后的气体体积仍为200mL.下列对化学反应状况的判断中正确的是()A.若反应后的气体有刺激性气味,则一定是Cl2没有完全反应B.若反应后的气体没有颜色,则一定是H2,Cl2都已完全反应C.若反应后的气体略带黄绿色,则一定是H2已完全反应D.若反应后的气体遇水显漂白性,则一定是Cl2未完全反应【解答】A、反应后的气体有刺激性气味,可以是生成的氯化氢气体,也可以是剩余氯气,故A错误;B、反应后的气体没有颜色,可以是恰好完全反应,也可以是氢气剩余,故B错误;C、反应后的气体略带黄绿色,说明一定剩余氯气,故C正确;D、反应后的气体遇水显漂白性,是剩余氯气与水反应生成的次氯酸的作用,故一定剩余氯气,故D正确;故选CD.7.(2009•龙海市校级模拟)反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是()A.I2在反应①中是还原产物,在反应②中是氧化产物B.两个反应中生成等量的I2时转移的电子数相等C.NaI和NaIO3在一定条件下能反应生成I2D.NaIO3在化学反应中只能做氧化剂不能做还原剂【解答】解:A.反应①中氧化剂是MnO2,还原剂是NaI,MnSO4是还原产物,I2是氧化产物;反应②中I2是还原产物,故A错误;B.生成1mol I2时,反应①转移2mol电子,反应②转移电子10mol,两者在生成等量I2时转移电子数不相等,故B错误;C.NaI中碘元素化合价是﹣1,而NaIO3中的碘元素化合价是+5,I2中碘元素化合价是0,故NaI与NaIO3在一定条件下可以发生氧化还原反应生成I2,故C正确;D.NaIO3中氧元素是最低价,可以作还原剂,故D错误.故选C.8.实验:①向2mL 1mol•L﹣1 NaBr溶液中通入少量氯气,溶液变为黄色;②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;③向①所得溶液继续通入氯气,溶液由黄色变成橙色.下列分析不正确的是()A.仅根据实验①能说明还原性:Br﹣>Cl﹣B.仅根据实验②能说明氧化性:Br2>I2C.上述实验验证了Cl2、Br2、I2的氧化性相对强弱D.向实验③所得溶液中加CCl4,充分振荡,下层为橙红色【解答】解:A.Cl2+2NaBr=Br2+2NaCl,说明还原性:Br﹣>Cl﹣,故A正确;B.①所得溶液可能含有氯气,氯气能氧化碘离子得到I2,不能说明氧化性:Br2>I2,故B 错误;C.根据③指知①中氯气不足,与碘离子反应的是溴单质,能说明氧化性:Br2>I2,结合Cl2+2NaBr=Br2+2NaCl可以得出:Cl2>Br2>I2,故C正确;D.CCl4密度比水大,下层为橙红色是被氧化出来的溴单质溶于CCl4,故D正确.故选B.9.(2014•临沂一模)制备食用碘盐(KIO3)原理之一为:I2+2KClO3Cl2+2KIO3,下列说法正确的是()A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀B.反应过程中I2置换出Cl2,由此可推断非金属性I>ClC.KClO3和KIO3均属于离子化合物,都只含有离子键D.制备KIO3的反应中氯元素被还原【解答】解:A.KClO3不能电离出Cl﹣,则不能与AgNO3溶液反应生成白色AgCl沉淀,故A错误;B.I2+2KClO3Cl2+2KIO3中,I元素的化合价升高,Cl元素的化合价降低,则非金属性Cl>I,故B错误;C.KClO3和KIO3均含离子键、共价键,均为离子化合物,故C错误;D.制备KIO3的反应中,Cl元素的化合价由+5价降低为0,得到电子被还原,故D正确;故选D.10.已知H2SO3+I2+H2O→2HI+H2SO4.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气,将溶液蒸干并充分燃烧,得到固体剩余物质的组成可能是()A.NaCl、Na2SO4B.NaCl、NaBr、Na2SO4C.NaCl、Na2SO4、I2 D.NaCl、NaI、Na2SO4【解答】解:通入Cl2后将按顺序发生以下三个反应:①Na2SO3+Cl2+H2O=Na2SO4+2HCl,②2NaI+Cl2=2NaCl+I2,③2NaBr+Cl2=2NaCl+Br2.当Cl2过量时,蒸干灼烧,HCl、Br2会挥发,I2会升华,将得到Na2SO4和NaCl的混合物,如Cl2不足时,将得到NaCl、NaBr、Na2SO4,故选AB.11.自来水可用氯气消毒,某学生用自来水配制下列物质的溶液,会引起药品变质是()①AgNO3②FeBr2③烧碱④Na2CO3⑤Na2SO3⑥CaCl2.A.除②⑤③外 B.④⑤⑥ C.①②③⑥D.除⑥外【解答】解:①氯水中含有Cl﹣,加入硝酸银生成氯化银沉淀,不能用于配制AgNO3溶液,故①选;②Cl2、HClO具有强氧化性,可与FeBr2发生氧化还原反应,不能用于配制FeBr2溶液,②选;③氯气与烧碱溶液反应,不能配制烧碱溶液,故③选④H+都能与Na2CO3溶液反应,不能配制Na2CO3溶液,故④选;⑤Cl2、HClO具有强氧化性,可与Na2SO3发生氧化还原反应,不能用于配制溶液Na2SO3,故⑤选;⑥氯水中各粒子与CaCl2都不反应,可用于配制CaCl2溶液,故⑥不选;故选D.12.已知:常温时;2NaOH+Cl2═NaCl+NaClO+H2O;加热时:6NaOH+3Cl2═5NaCl+NaClO3+3H2O,将Cl2通入amol NaOH溶液恰好完全反应,下列有关说法错误的是()A.参加反应的氯气的物质的量等于0.5a mo1B.若某温度下,反应后=K,若溶液中=C.控制温度,反应中转移电子的物质的量最大值是a molD.控制温度,产物中NaCl的物质的量的范围 a mol≤n(NaCl)≤ a mol【解答】解:A.常温时;2NaOH+Cl2═NaCl+NaClO+H2O,反应2mol氢氧化钠,消耗1mol 氯气,所以Cl2通入amol NaOH溶液恰好完全反应,则参加反应的氯气的物质的量等于0.5a mo1,故A正确;B.反应中氯气一部分化合价升高生成次氯酸钠、氯酸钠,一部分化合价降低生成氯化钠,依据得失电子守恒可知:C(ClO﹣)×1+5×C(ClO3﹣)=C(Cl﹣)×1,若=K,则C(ClO3﹣)=,代入C(ClO﹣)×1+5×C(ClO3﹣)=C(Cl﹣)×1中化简得:=,故B正确;C.当只发生6NaOH+3Cl2═5NaCl+NaClO3+3H2O,转移电子数最多,依据方程式6mol氢氧化钠反应转移5mol电子,所以amol氢氧化钠反应,最多转移mol电子,故C错误;D.若只发生反应:2NaOH+Cl2═NaCl+NaClO+H2O,则amol NaOH溶液能生成amol氯化钠,若只发生反应:6NaOH+3Cl2═5NaCl+NaClO3+3H2O,则能生成mol氯化钠,若两个反应都发生,生成氯化钠的物质的量介于amol和mol之间,故D正确;故选:C.13.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能还有杂质气体()①CO2②HCl ③H2O ④O2.A.①②③④B.②③④ C.②③D.①④【解答】解:次氯酸钙能够与空气中的二氧化碳、水反应生成碳酸钙和次氯酸,次氯酸分解生成氯化氢和氧气,贮存很久的漂白粉可能存在碳酸钙,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O、CaCO3+2HCl=CaCl2+CO2↑+H2O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO2、HCl、H2O(气)、O2,故选:A.14.(2014•安徽模拟)某溶液中含有SO32﹣、Br﹣、SiO32﹣、CO32﹣、Na+,向该溶液中通入过量的Cl2,下列判断正确的是()①反应前后,溶液中离子浓度基本保持不变的只有Na+②有胶状沉淀物质生成③有气体产生④溶液颜色发生变化⑤共发生了2个氧化还原反应.A.①②③④⑤B.①②③④C.①③⑤ D.②④⑤【解答】解:某溶液中含有SO32﹣、SiO32﹣、Br﹣、CO32﹣、Na+,向该溶液中通入过量的Cl2,SO32﹣可以被氯气氧化为硫酸根离子;SiO32﹣和氯水中的盐酸反应生成硅酸沉淀;Br﹣被氯气氧化为溴单质;CO32﹣和氯水中的盐酸反应生成二氧化碳气体;①钠离子不参加反应,反应前后,溶液中离子浓度基本保持不变的有Na+,故①正确;②SiO32﹣和氯水中的盐酸反应生成硅酸沉淀,有胶状物质硅酸生成,故②正确;③CO32﹣和氯水中的盐酸反应生成二氧化碳气体,故③正确;④氯气氧化溴离子为溴单质,溶液颜色发生变化有无色变化为橙红色,故④正确;⑤共发生了氯气与水反应、氧化SO32﹣、Br﹣3个氧化还原反应.故⑤错误;故选B.15.(2014•金山区一模)在淀粉碘化钾溶液中加入少量次氯酸钠溶液,振荡后溶液变蓝,再加入足量的亚硫酸钠溶液,蓝色逐渐消失.下列判断错误的是()A.氧化性:ClO﹣>SO42﹣>I2B.漂粉精溶液可使淀粉碘化钾试纸变蓝C.ClO﹣与I﹣在碱性条件可以发生氧化还原反应D.向新制氯水中加入足量亚硫酸钠溶液,氯水褪色【解答】解:A.根据向淀粉碘化钾溶液中加入少量的次氯酸钠溶液,溶液变蓝色知,次氯酸根离子将碘离子氧化成了碘单质,碘遇淀粉变蓝色,根据氧化剂的氧化性大于氧化产物的氧化性,次氯酸根离子是氧化剂,碘单质是氧化产物,氧化性为:ClO﹣>I2,再加入足量的亚硫酸钠溶液蓝色又逐渐消失,说明碘单质又将亚硫酸根离子氧化了,得到硫酸根离子,碘单质是氧化剂,硫酸根离子是氧化产物,故氧化性SO42﹣<I2.因此得出氧化性的强弱为:ClO﹣>I2>SO42﹣.故A错误;B.漂白精的成分中有次氯酸钠,根据对A的分析,次氯酸钠能将淀粉碘化钾中的碘离子氧化成碘单质.故B正确;C.次氯酸根离子无论在碱性条件下还是在酸性条件下、中性条件下均有氧化性.因此ClO ﹣与I﹣在碱性条件下可以发生氧化还原反应.故C正确;D.新制的氯水中主要是氯气,因此新制的氯水是黄绿色的,由于氯气的氧化性比亚硫酸根离子的氧化性强,故能发生氧化还原反应,氯气被还原而使氯水退色,故D正确.故选A.16.(2014•奉贤区二模)某溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表﹣﹣﹣C.15:30:8 D.条件不足,无法计算【解答】解:还原性:I﹣>Br﹣,加入氯气5.6L时溶液中I﹣为xmol,则说明通入5.6L Cl2只发生:Cl2+2I﹣═I2+2Cl﹣,由表中数据可知原溶液中溴离子为3mol,通入11.2L氯气,其物质的量为=0.5mol,I﹣为0mol,碘离子完全反应,同时氧化0.2mol溴离子,发生反应:Cl2 +2Br﹣═Br2+2Cl﹣,Cl2+2I﹣═I2+2Cl﹣,氯气反应生成的氯离子为0.5mol×2=1mol,故原溶液中氯离子为2mol﹣1mol=1mol,由方程式可知溶液中阴离子总的物质的量不变(不含氢氧根离子),故原溶液中碘离子的物质的量为2mol+2.8mol﹣1mol﹣3mol=0.8mol,故原溶液中Cl﹣、Br﹣、I﹣物质的量之比为1mol:3mol:0.8mol=5:15:4,故选:A.17.(2013•河南一模)相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是()A.1:1:2 B.2:1:3 C.6:3:2 D.3:2:1【解答】解:首先,写出相关化学方程式2KI+Cl2═2KCl+I2 Na2S+Cl2═2NaCl+S↓2FeBr2+3Cl2═2FeCl3+2Br22n n n n n n可知在Cl2相等的情况下,KI、Na2S、FeBr2的物质的量之比为2n:n:n=6:3:2,在三种溶液体积相等的前提下,物质的量浓度之比就等于物质的量之比.故选:C.18.(2015•宝山区一模)已知:。
非金属元素及其重要化合物之间的相互转化关系

-2-2-2-22Cl Br 2Br Cl 2Cl I 2I Cl )1(+→++→+O8H 5Cl 2KCl 2MnCl 16HCl 2KMnO O2H Cl MnCl )4HCl(Conc.MnO2 (2)2224222Δ+↑++→++↑+−→−+O2H CaCl Ca(ClO)2Ca(OH)2Cl OH NaClO NaCl 2NaOH Cl (3)222222Cold 2++→+++−−→−+O 3H 5KCl KClO KOH 63Cl )4(23Δ2++−→−+2KCl KClO KClO 3 )5(3OH Δ,-+−−→−O 2H CaCl 2Cl 4HCl Ca(ClO) )6(2222++→+ 2KCl KClO KClO 3 )7(3OHΔ,-+−−→− KCl 3KClO KClO 4 )8(43+→溴及其重要化合物之间的相互转化关系:2Br I 2I Br )1(-2-2+→+ -22-2Cl Br Cl Br 2 (2)+→+O 2H Br S O 2NaHS O (Conc.)S O 3H 2NaBr 2224Δ42+++−→−+ O H NaBrO KBr 2KOH Br (3)2Cold 2++−−→−+O 3H 5KBr KBrO KOH 63Br )4(23Δ2++−→−+2KBr KBrO KBrO 3 )5(3OH Δ,-+−−→−O H 2KCl Br 2HCl KBr KBrO )6(22++→++ 2KBr KBrO KBrO 3 )7(3OHΔ,-+−−→−Xe2HF BrO O H XeF BrO OH 2F BrO 2OH F BrO (8)--2--4-2-3++→++++→++2Br I 2I Br 2Cl I 2I Cl )1(-2-2-2-2+→++→+2NaI O S Na O S 2Na I (2)6423222+→+HIO HI O H I (3)-O HCold,22+−−−→−+O 3H 5KBr KIO KOH 63I )4(23Δ2++−→−+O3H 3I 6H 5I IO OH 3H 5SO I 5HSO 2IO )5(22--3224233+→+++++→+++--- O 3H 2Cl IO Cl 6OH IO )6(2562--3++→++--O 7H 5IO 2MnO 14H 5IO Mn 2 (7)2-3-4-562++→++++↑+−−−−→−O 4H 2HIO IO H 2 (8)24373Kvacuum,65↑+↑−→−++↑−→−+HCl NH Cl NH OH NaCl NH NaOH Cl (1)NH 3Δ423Δ4 3HClO NH O 3H NCl (2)323+↑=+3773K ~673 atalyst,c 700atm,~300222NH 3H N (3)−−−−−−−−→−+ O6H 2N 3O 4NH O3H N 3Cu 3CuO 2NH (4)2223223+=+++=+O 6H 4NO 5O 4NH (5)2800KPt,23+−−→−+↑+−→−++↑+−→−+5NO PO 3H O 2H 5HNO 3P 2NO SO H 2HNO S (6)43boil2342boil 3 22NO 2O 2NO (7)=+O2H O 4NO 4HNO O2H 2NO )Cu(NO Cu 4HNO (8)222322233+↑+↑−→−+↑+=+∆O 5H O N )4Zn(NO 4Zn (dilute)10HNO (9)22233+↑+=+↑+−→−22Δ3O 2NaNO 2NaNO (10) O 3H 5NO 2Mn 6H 5NO 2MnO (11)2322-4++=++-++- O 2H I 2NO 4H 2I 2NO (12)222++↑=+++-- O H NaCl H N NaOCl 2NH (13)2423++=+ O H NaNO NaOH HNO (14)233+=+↑+−→−+342Δ4232HNO S O Na S O H 2NaNO (15) 3433NO NH (aq)NH HNO (16)=+ O 2H O N NO NH (17)22Δ34+↑−→−↑+=+++S H Fe 2H FeS (1)22S H S H (2)2Δ2−→−+S2HI I S H 2SO 2H O S H 2 (3)22222+=++=+2773K铝矾土,22CO S 2CO S O (4)+−−−−→−+22SO O S (5)=+3O V 222S O O 2S O (6)52−−→−+5223O P 5S O 2P 5S O (7)+=+ O H S O Na 2NaOH S O (8)2423+=+ 2NaCl S H 2HCl S Na (9)22+↑=+x x S Na S )1(S Na (10)2Boil 2−→−-+ 3222S nS Na S nS S Na (11)=+O 3H 3S 6H 2S S O (12)22-23+↓=+++-62SF 3F S (13)=+O 2H S 3SO 4H O 2S (14)22-242+↓+↑=++3222S O H O H S O (16)=+O H NaHS O NaOH S O H (17)2332+=+2422Δ3Zn(OH)O S Na Zn 2NaHS O (18)+−→−+ O H S O 2H S O (19)22-23+↑=++O H S O Na 2NaOH S O (20)2322+=+ 2Hg O S Na 2SO 2Na[Hg] (21)4222+=+322Boil 32O S Na S S O Na (22)−→−+NaX ])O [Ag(S Na AgX O S 2Na (23)2323322+=+ NaI 2O S Na I O S 2Na (24)6422322+=+O 2H 2S O CO C (conc.)S O 2H (25)22242+↑+↑=+ 8HBr SO H O 4H 4Br S H (26)42222+=++O 4H 4I S H 8KHS O 8KI (conc.)S O 9H (27)222442+↓+↑+=+ 4223S O H O H S O (28)=+722423O S H (Conc.)S O H S O (29)=+ 422722SO 2H O H O S H (30)=+O H NaHSO NaOH SO H (31)2442+=+ 4442424HSO NH 2SO H SO )(NH (32)=+↑++−−→−+-++22824电解-44H O S 2NH 2HS O 2NH (33) 2242Cold 25242522282O H SO H O H SO H SO H SO H O H 2H O (34)S +−−→−++=+++-O H SO Na NaOH (35)NaHSO 2424+=+2HClSO Na O H Cl SO Na SO 2Na O SO (36)2Na 42223242232+=++=+6HCl 2NaCl SO 2H O 5H 4Cl O S (37)Na 4222322++=++64点燃24O P )不足(O 3P (1)−−→−+ 104点燃24O P )充足(O 5P (2)−−→−+22324PO 3KH PH O 3H 3KOH P (3)+↑=++3点燃244PCl )不足(Cl 6P (4)−−→−+5点燃24PCl 4)充足(Cl 10P (5)−−→−+ 3HCl PO H O 3H PCl (6)3323+=+ 33264PO 4H O 6H O P (7)=+ 321044HPO O 2H O P (8)=+ 72423O P H O H 2HPO (9)=+ O H 2HPO O P H (10)23724+= 432724PO 2H O H O P H (11)=+ O H O P H PO 2H (12)272443+= 5HCl PO H O 4H PCl (13)4325+=+2S CCl 2Cl CS (1)4FeS340K ,22+−−−→−+21170K CS 2S C (2)−−→−+2CO O 2C (3)不完全燃烧2−−−→−+O H Cu(CO)Cl O H CuCl CO (4)2盐酸溶液2⋅−−−→−++ CO CaC CaO 3C (5)22273K +−−→−+4高压Ni(CO))粉Ni(4CO (6)−−→−+ Ni 4CO Ni(CO) (7)593K ~5134+↑−−−→−C 2MgO 2Mg CO (8)点燃2+−−→−+2完全燃烧2CO O C (9)−−−→−+2CO C CO (10)高温2−−→−+ 2点燃22CO O 2CO (11)−−→−+O H CO CaCO )Ca(HCO (12)223Δ23+↑+↓−→−23223)Ca(HCO O H CO CaCO (13)=++2煅烧3CO CaO CaCO (14)+−−→− O H CaCO Ca(OH)CO (15)2322+↓=+ 32NaHCO NaOH CO (16)=+O H CO CO Na NaHCO 2 (17)2232Δ3+↑+−→−↑+=++23222H S iO Na O H 2NaOH S i (1)4773K~7232S iCl 2Cl S i (2)−−−→−+↑+−−−→−+4HCl )纯S i(2H S iCl (3)1453K ~137324O 8H 4NO S iF 3H 18HF 4HNO S i (4)2623+↑+=++ 624424S iF 2H S iO H O H 43S iF (5)+=+3444AlCl LiCl S iH LiAlH S iCl (6)+↑+=+ ↑+−−→−+2CO S i 2C S iO (7)3273228732SiO O Si (8)−→−+O 2H S iF H 6HF(aq)S iO (9)2622+=+ O 2H S iF 4HF S iO (10)242+↑=+O H S iO Na )浓2NaOH(S iO (11)232Δ2+−→−+322348HNO S iO 8Ag O 2H 8AgNO S iH (12)+↓+↓=++ 2NaCl 2NH S iO H Cl 2NH SiO (13)Na 332432+↑+↓=+ O H S iO S iO (14)H 2232+−→−∆ 2MgO S i Mg 4Mg (15)S iO 2灼烧2+−−→−+32973K 2O 2B 3O (1)4B −−→−+3MgO 2B 3Mg O (2)B 32+−→−+∆ 33232BO 2H O(l)3H O (3)B =+O 3H O B BO (4)2H 23233+−→−∆O 7H O B Na 9)2NaOH(pHBO (5)4H 274233+=<+ 2NaCl BO 4H O 5H 2HCl O B (6)Na 332742+=++(7) H 3BO 3+ 2 HCOH = HCCOH H 2COHH 2OCOH H 2C H 2BOO O CH 2CH 2OH -+ H + + 3H 2O+-+=+H B(OH)O H BO (8)4H 4233O 3H B(OR)3ROH BO (9)H 23S O 浓H 3342+−−−→−+3573K 22BCl 3Cl (10)2B −−→−+3CO 2BCl 3C 3Cl O (11)B 3773K 232+−−→−++> O 3H 3CaS O 2BF S O 3H 3CaF O (12)B 24342232++−→−++∆ O(g)3H O B 3O H (13)B 232262+=+ 433233HBF BO H O 3H (14)4BF +=+ 6243H B 6LiBF 6LiH (15)8BF +=+ 2332626H BO 2H O 6H H (16)B +=+ 3HCl BO H O 3H (17)BCl 3323+=+ O 3H )Co(BO CoO BO (18)2H 22233+=+ 2227422NaBO )Co(BO CoO O B (19)Na ⋅=+ 6HCl (l)2BCl 6Cl H (20)B 3262+=+-4232362BH ])(NH [BH 2NH H (21)B +⋅=+。
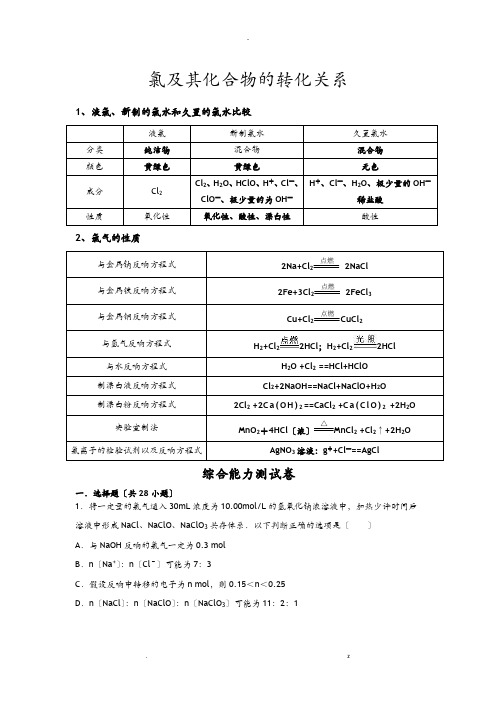
氯及其化合物的转化关系

氯及其化合物的转化关系Company number:【0089WT-8898YT-W8CCB-BUUT-202108】氯及其化合物的转化关系1、液氯、新制的氯水和久置的氯水比较液氯新制氯水久置氯水分类纯净物混合物混合物颜色黄绿色黄绿色无色成分Cl2Cl2、H2O、HClO、H+、Cl―、ClO―、极少量的为OH―H+、Cl―、H2O、极少量的OH―稀盐酸性质氧化性氧化性、酸性、漂白性酸性2、氯气的性质与金属钠反应方程式2Na+Cl2点燃 2NaCl与金属铁反应方程式2Fe+3Cl2点燃 2FeCl3与金属铜反应方程式Cu+Cl2点燃CuCl2与氢气反应方程式H2+Cl22HCl;H2+Cl22HCl与水反应方程式H2O +Cl2==HCl+HClO制漂白液反应方程式Cl2+2NaOH==NaCl+NaClO+H2O制漂白粉反应方程式2Cl2 +2C a(O H)2==CaCl2+C a(C l O)2+2H2O实验室制法MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O氯离子的检验试剂以及反应方程式AgNO3溶液:g++Cl―==AgCl 综合能力测试卷一.选择题(共28小题)1.将一定量的氯气通入30mL浓度为L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是()A.与NaOH反应的氯气一定为 molB.n(Na+):n(Cl﹣)可能为7:3C.若反应中转移的电子为n mol,则<n<D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:12.向仅含Fe2+、I﹣、Br﹣的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是()A.线段Ⅲ代表Fe2+的变化情况B.线段Ⅰ代表Br﹣的变化情况C.a数值等于6D.原混合溶液中n(FeBr2)=4 mol3.下列说法正确的是()①新制氯水的氧化性强于久置氯水;②氯气的性质活泼,它与氢气混合后立即发生爆炸;③实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收④检验Cl2中是否混有HCl气体,方法是将气体通入硝酸银溶液中⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水⑥干燥的Cl2能使湿润的有色布条褪色,说明干燥的Cl2有漂白性.A.①②③④⑤⑥B.②③⑤C.①②④⑤D.①③⑤4.时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域.测定含I﹣浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是①在中性溶液中,用溴将试样中I﹣氧化成IO3﹣,将过量的溴除去②再加入过量的碘化钾,在酸性条件下,使IO3﹣完全转化成I2③将②中生成的碘完全萃取后,用肼将其还原成I﹣,方程式为H2N﹣NH2+2I2→4I﹣+N2↑+4H+④将生成的I﹣萃取到水层后用①法处理.⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化.⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2→Na2S4O6+2NaI经过上述放大后,则溶液中I﹣浓度放大为原溶液中I﹣浓度的(设放大前后溶液体积相等)()A.2倍B.4倍C.6倍D.36倍5.化合物BrF x能够与水反应,产物有溴酸、氢氟酸、单质溴和氧气,则下列关于该反应的说法正确的是()A.BrF x是还原剂,HF是氧化产物B.水是氧化剂,O2是还原产物C.若x=3,则BrF x与水的系数比为3:5D.x为奇数,分别可以取1、3、5、7、9等值6.在同温同压下,将由H2和Cl2组成的混和气体 200mL引发化学反应,反应后的气体体积仍为200mL.下列对化学反应状况的判断中正确的是()A.若反应后的气体有刺激性气味,则一定是Cl2没有完全反应B.若反应后的气体没有颜色,则一定是H2,Cl2都已完全反应C.若反应后的气体略带黄绿色,则一定是H2已完全反应D.若反应后的气体遇水显漂白性,则一定是Cl2未完全反应7.反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是()A.I2在反应①中是还原产物,在反应②中是氧化产物B.两个反应中生成等量的I2时转移的电子数相等C.NaI和NaIO3在一定条件下能反应生成I2D.NaIO3在化学反应中只能做氧化剂不能做还原剂8.实验:①向2mL 1molL﹣1 NaBr溶液中通入少量氯气,溶液变为黄色;②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;③向①所得溶液继续通入氯气,溶液由黄色变成橙色.下列分析不正确的是()A.仅根据实验①能说明还原性:Br﹣>Cl﹣B.仅根据实验②能说明氧化性:Br2>I2C.上述实验验证了Cl2、Br2、I2的氧化性相对强弱D.向实验③所得溶液中加CCl4,充分振荡,下层为橙红色9.制备食用碘盐(KIO3)原理之一为:I2+2KClO3Cl2+2KIO3,下列正确的是()A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀B.反应过程中I2置换出Cl2,由此可推断非金属性I>ClC.KClO3和KIO3均属于离子化合物,都只含有离子键D.制备KIO3的反应中氯元素被还原10.已知H2SO3+I2+H2O→2HI+H2SO4.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气,将溶液蒸干并充分燃烧,得到固体剩余物质的组成可能是()A.NaCl、Na2SO4B.NaCl、NaBr、Na2SO4C.NaCl、Na2SO4、I2D.NaCl、NaI、Na2SO411.自来水可用氯气消毒,某学生用自来水配制下列物质的溶液,会引起药品变质是()①AgNO3②FeBr2③烧碱④Na2CO3⑤Na2SO3⑥CaCl2.A.除②⑤③外B.④⑤⑥C.①②③⑥D.除⑥外12.已知:常温时;2NaOH+Cl2═NaCl+NaClO+H2O;加热时:6NaOH+3Cl2═5NaCl+NaClO3+3H2O,将Cl2通入amol NaOH溶液恰好完全反应,下列有关说法错误的是()A.参加反应的氯气的物质的量等于 mo1B.若某温度下,反应后=K,若溶液中=C.控制温度,反应中转移电子的物质的量最大值是a molD.控制温度,产物中NaCl的物质的量的范围 a mol≤n(NaCl)≤ a mol13.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能还有杂质气体()①CO2②HCl ③H2O ④O2.A.①②③④B.②③④C.②③D.①④14.某溶液中含有SO32﹣、Br﹣、SiO32﹣、CO32﹣、Na+,向该溶液中通入过量的Cl2,下列判断正确的是()①反应前后,溶液中离子浓度基本保持不变的只有Na+②有胶状沉淀物质生成③有气体产生④溶液颜色发生变化⑤共发生了2个氧化还原反应.A.①②③④⑤B.①②③④C.①③⑤D.②④⑤15.在淀粉碘化钾溶液中加入少量次氯酸钠溶液,振荡后溶液变蓝,再加入足量的亚硫酸钠溶液,蓝色逐渐消失.下列判断错误的是()A.氧化性:ClO﹣>SO42﹣>I2B.漂粉精溶液可使淀粉碘化钾试纸变蓝C.ClO﹣与I﹣在碱性条件可以发生氧化还原反应D.向新制氯水中加入足量亚硫酸钠溶液,氯水褪色16.某溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br ﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为()Cl2的体积(标准状况)n(Cl﹣)/moln(Br﹣)/moln(I﹣)/mol x(x>0)0 0A.5:15:4 B.5:12:4C.15:30:8 D.条件不足,无法计算17.相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是()A.1:1:2 B.2:1:3 C.6:3:2 D.3:2:118.已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体.②向NaI溶液中通入少量实验①产生的气体,溶液变黄色.③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是()A.实验①证明Cl﹣具有还原性B.实验②中氧化剂与还原剂的物质的量之比为2:1C.实验③说明KI被氧化D.上述实验证明氧化性:ClO3﹣>Cl2>I219.溶液中含有NH4+、F﹣、HSO3﹣、K+等离子.向其中加入少量NaClO后,溶液中离子数目肯定增加的是()A.F﹣B.ClO﹣C.HSO3﹣D.NH4+20.有一混合溶液,其中只含有Fe2+、Cl﹣、Br﹣、I﹣(忽略水的电离),Cl﹣、Br﹣、I﹣的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl﹣和Br﹣的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为()A.7:4 B.7:3 C.7:2 D.7:121.已知在热的碱性溶液中,Cl2发生如下反应:Cl2+NaOH→NaCl+NaClO3+H2O(未配平).请推测NaClO2在热的碱性溶液中发生反应的最终产物是()A.NaCl、NaClO B.NaCl、NaClO3C.NaClO、NaClO3D.NaClO3、NaClO422.已知:2Fe2++Br2═2Fe3++2Br﹣,2Fe3++2I﹣═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是()A.还原性:I﹣>Fe2+>Br﹣B.原混合溶液中FeBr2的物质的量为6 molC.当通入2 mol Cl2时,发生的离子反应可表示为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣D.原溶液中:n(Fe2+):n(I﹣):n(Br﹣)=2:1:323.某混合溶液中含有NaI、NaBr、Na2SO3三种溶质,其物质的量均为l mol,向混合溶液中通入一定量的氯气.下列说法正确的是()A.将溶液蒸干最多可以得到4 mol NaClB.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4C.向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量D.若通入氯气的体积为 L(标准状况),反应的离子方程式为:2I﹣+Cl2=I2+2C1﹣24.下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终可能得到纯净物的是()A.向FeSO4溶液中通入Cl2B.向KI和NaBr混合溶液中通入Cl2C.向NaAlO2溶液中加入HCl溶液D.向NaHCO3溶液中加入Na2O2粉末25.往含Br﹣和Cl﹣的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则原溶液中c(Br﹣)/c(Cl﹣)的比值约为()A.(V2﹣V1)/V1 B.V1/V2 C.V1/(V2﹣V1) D.V2/V126.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是()A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl﹣存在D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在27.下列氯化物,不能用单质直接反应制得的是()A.CuCl2 B.FeCl2 C.NaCl D.HCl28.某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O),经测定ClO﹣与ClO3﹣的物质的量之比为1:3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为()A.21:5 B.11:3 C.3:1 D.4:1二.填空题(共2小题)29.Cl2O为国际公认高效安全灭菌消毒剂之一,它是棕黄色强刺激性气体,沸点℃熔点﹣116℃.实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,装置如下(图Ⅰ):回答下列问题:(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2.请模仿“图Ⅱ”在“图Ⅰ”A处补画出正确的装置图,并作必要的标注.(2)B中试剂a应选用(填下列序号字母):a.CCl4 b.饱和NaCl溶液 c.浓H2SO4 d.饱和NaHCO3溶液(3)通入适量的氯气,在C中生成黄绿色的物质Cl2O,该物质常温为气体,方程式为:Cl2+Na2CO3+═NaHCO3+NaCl+ Cl2O(4)对C中反应后的固体成分进行检验,请写出实验步骤以及预期的现象和结论.限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、澄清石灰水、试管、小烧杯、带导管的橡皮塞、过滤装置.实验步骤现象和结论步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中.步骤二:向a试管中滴加BaCl2溶液,静置.无明显现象,证明固体中不含Na2CO3步骤三:步骤四:则证明固体中含有NaCl.30.禽流感病毒是一种没有超常抵抗力的病毒.研究证明,许多常用消毒药物如漂粉精、漂白粉、高锰酸钾等,可以将禽流感病毒杀灭.氯气与氢氧化钙充分反应,得到漂粉精,其稳定性比漂白粉高.(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂粉精,化学反应方程式为:.(2)漂粉精的有效成分是(填化学式).(3)漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的物质,化学反应方程式为.(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号).(5)将漂粉精溶于适量水中,呈白色浊状物,静置沉降.取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为.另取少许上层清液,先滴加适量的(填化学式)酸化,再滴加(填化学式)溶液即可检验Cl﹣的存在,发生反应的离子方程式为.再取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈性并具有性.氯及其化合物参考答案与试题解析一.选择题(共28小题)1.(2015上饶模拟)将一定量的氯气通入30mL浓度为L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是()A.与NaOH反应的氯气一定为 molB.n(Na+):n(Cl﹣)可能为7:3C.若反应中转移的电子为n mol,则<n<D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1【解答】解:A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=×10mol/L=,根据氯原子守恒有2n(Cl2)=n(NaCl)+n (NaClO)+n(NaClO3)=,故参加反应的氯气n(Cl2)=,故A错误;B、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时,n(Na+):n(Cl﹣)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl ﹣)最小为6:5,故6:5<n(Na+):n(Cl﹣)<2:1,7:3>2:1,故B错误;C、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时,转移电子数最少,为××1=,氧化产物只有NaClO3时,转移电子数最多,为××1=,故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D 错误;故选C.2.(2014黄梅县校级模拟)向仅含Fe2+、I﹣、Br﹣的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是()A.线段Ⅲ代表Fe2+的变化情况B.线段Ⅰ代表Br﹣的变化情况C.a数值等于6 D.原混合溶液中n(FeBr2)=4 mol【解答】解:向仅含Fe2+、I﹣、Br﹣的溶液中通入适量氯气,根据还原性:I﹣>Fe2+>Br﹣,首先发生反应:2I﹣+Cl2=I2+2Cl﹣,I﹣反应完毕,再发生反应:2Fe2++Cl2=2Fe3++2Cl﹣,Fe2+反应完毕,最后发生反应:2Br﹣+Cl2=Br2+2Cl﹣,故线段Ⅰ代表I﹣的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br﹣的变化情况;由通入氯气可知,根据反应离子方程式可知溶液中n(I﹣)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n (Cl2)=2×(3mol﹣1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I﹣)+n(Br﹣)=2n(Fe2+),故n(Br﹣)=2n(Fe2+)﹣n(I﹣)=2×4mol﹣2mol=6mol,A、由上述分析可知,线段Ⅲ代表Br﹣的变化情况,故A错误;B、由上述分析可知,线段I代表I﹣的变化情况,故B错误;C、由上述分析可知,溶液中n(Br﹣)=2n(Fe2+)﹣n(I﹣)=2×4mol﹣2mol=6mol,根据2Br﹣+Cl2═Br2+2Cl﹣可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,故C正确;D、溶液中n(Br﹣)=6mol,所以原混合溶液中n(FeBr2)=3mol,故D错误;故选:C.3.(2015江西模拟)下列说法正确的是()①新制氯水的氧化性强于久置氯水;②氯气的性质活泼,它与氢气混合后立即发生爆炸;③实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收④检验Cl2中是否混有HCl气体,方法是将气体通入硝酸银溶液中⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水⑥干燥的Cl2能使湿润的有色布条褪色,说明干燥的Cl2有漂白性.A.①②③④⑤⑥B.②③⑤C.①②④⑤D.①③⑤【解答】解:①新制氯水中含有大量氯气和次氯酸,久置氯水相当于盐酸溶液,氯水和次氯酸有强氧化性、盐酸具有弱氧化性,所以新制氯水氧化性大于久置氯水,故正确;②氯气的性质活泼,它与氢气混合后干燥条件下发生爆炸,常温下不反应,故错误;③氯气有毒不能直接排空,氯气和水反应生成酸,所以氯气能和碱反应生成盐,实验室用NaOH溶液吸收氯气尾气,故正确;④氯气、HCl都可以和硝酸银反应生成白色沉淀,所以不能用硝酸银溶液检验,故错误;⑤HCl极易溶于水,饱和食盐水抑制氯气溶解,所以可以用饱和食盐水除去氯气中的HCl,故正确;⑥氯气没有漂白性,次氯酸有漂白性,干燥的氯气能使湿润的有色布条褪色,实际上是氯气和水反应生成的HClO体现的漂白性,故错误;故选D.4.(2014扶沟县校级模拟)时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域.测定含I﹣浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是①在中性溶液中,用溴将试样中I﹣氧化成IO3﹣,将过量的溴除去②再加入过量的碘化钾,在酸性条件下,使IO3﹣完全转化成I2③将②中生成的碘完全萃取后,用肼将其还原成I﹣,方程式为H2N﹣NH2+2I2→4I﹣+N2↑+4H+④将生成的I﹣萃取到水层后用①法处理.⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化.⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2→Na2S4O6+2NaI经过上述放大后,则溶液中I﹣浓度放大为原溶液中I﹣浓度的(设放大前后溶液体积相等)()A.2倍B.4倍C.6倍D.36倍【解答】解:①从方程式可看出,I﹣浓度不变;②从方程式可看出,1个IO3﹣生成3个I2,从第三步反应看出,I﹣浓度放大了6倍;③从方程式可看出,1个I2生成2个I﹣;④从方程式可看出,I﹣浓度不变;⑤从方程式可看出,1个IO3﹣生成3个I2,从第三步反应看出,I﹣浓度放大了6倍;⑥从方程式可看出,1个I2生成2个I﹣;因此从以上方程式和分析可得关系式:I~IO3﹣~3I2~6I﹣~6IO3﹣~18I2~36S2SO32﹣~36I﹣,1 3 6 6 18 36总计放大倍数为:6×6=36倍.故选D.5.(2011北京模拟)化合物BrF x能够与水反应,产物有溴酸、氢氟酸、单质溴和氧气,则下列关于该反应的说法正确的是()A.BrF x是还原剂,HF是氧化产物B.水是氧化剂,O2是还原产物C.若x=3,则BrF x与水的系数比为3:5D.x为奇数,分别可以取1、3、5、7、9等值【解答】解:A.F的非金属性非常强,其它氧化剂难以氧化F,反应前后F元素的化合价不变,故A错误;B.反应中O元素的化合价升高,水被氧化生成氧气,则水为还原剂,O2是氧化产物,故B错误;C.若x=3,则BrF3与水发生:3BrF3+5H2O=HBrO3+9HF+O2+Br2,BrF x与水的系数比为3:5,故C正确;D.Br的最外层电子数为7,最高化合价为+7价,x不可能为9,故D错误.故选C.6.在同温同压下,将由H2和Cl2组成的混和气体 200mL引发化学反应,反应后的气体体积仍为200mL.下列对化学反应状况的判断中正确的是()A.若反应后的气体有刺激性气味,则一定是Cl2没有完全反应B.若反应后的气体没有颜色,则一定是H2,Cl2都已完全反应C.若反应后的气体略带黄绿色,则一定是H2已完全反应D.若反应后的气体遇水显漂白性,则一定是Cl2未完全反应【解答】A、反应后的气体有刺激性气味,可以是生成的氯化氢气体,也可以是剩余氯气,故A错误;B、反应后的气体没有颜色,可以是恰好完全反应,也可以是氢气剩余,故B错误;C、反应后的气体略带黄绿色,说明一定剩余氯气,故C正确;D、反应后的气体遇水显漂白性,是剩余氯气与水反应生成的次氯酸的作用,故一定剩余氯气,故D 正确;故选CD.7.(2009龙海市校级模拟)反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是()A.I2在反应①中是还原产物,在反应②中是氧化产物B.两个反应中生成等量的I2时转移的电子数相等C.NaI和NaIO3在一定条件下能反应生成I2D.NaIO3在化学反应中只能做氧化剂不能做还原剂【解答】解:A.反应①中氧化剂是 MnO2,还原剂是NaI,MnSO4是还原产物,I2是氧化产物;反应②中I2是还原产物,故A错误;B.生成 1mol I2时,反应①转移2mol电子,反应②转移电子10mol,两者在生成等量I2时转移电子数不相等,故B错误;C.NaI中碘元素化合价是﹣1,而NaIO3中的碘元素化合价是+5,I2中碘元素化合价是0,故NaI与NaIO3在一定条件下可以发生氧化还原反应生成I2,故C正确;D.NaIO3中氧元素是最低价,可以作还原剂,故D错误.故选C.8.实验:①向2mL 1molL﹣1 NaBr溶液中通入少量氯气,溶液变为黄色;②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;③向①所得溶液继续通入氯气,溶液由黄色变成橙色.下列分析不正确的是()A.仅根据实验①能说明还原性:Br﹣>Cl﹣B.仅根据实验②能说明氧化性:Br2>I2C.上述实验验证了Cl2、Br2、I2的氧化性相对强弱D.向实验③所得溶液中加CCl4,充分振荡,下层为橙红色【解答】解:A.Cl2+2NaBr=Br2+2NaCl,说明还原性:Br﹣>Cl﹣,故A正确;B.①所得溶液可能含有氯气,氯气能氧化碘离子得到I2,不能说明氧化性:Br2>I2,故B错误;C.根据③指知①中氯气不足,与碘离子反应的是溴单质,能说明氧化性:Br2>I2,结合Cl2+2NaBr=Br2+2NaCl可以得出:Cl2>Br2>I2,故C正确;D.CCl4密度比水大,下层为橙红色是被氧化出来的溴单质溶于CCl4,故D正确.故选B.9.(2014临沂一模)制备食用碘盐(KIO3)原理之一为:I2+2KClO3Cl2+2KIO3,下列说法正确的是()A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀B.反应过程中I2置换出Cl2,由此可推断非金属性I>ClC.KClO3和KIO3均属于离子化合物,都只含有离子键D.制备KIO3的反应中氯元素被还原【解答】解:A.KClO3不能电离出Cl﹣,则不能与AgNO3溶液反应生成白色AgCl沉淀,故A错误;B.I2+2KClO3Cl2+2KIO3中,I元素的化合价升高,Cl元素的化合价降低,则非金属性Cl>I,故B错误;C.KClO3和KIO3均含离子键、共价键,均为离子化合物,故C错误;D.制备KIO3的反应中,Cl元素的化合价由+5价降低为0,得到电子被还原,故D正确;故选D.10.已知H2SO3+I2+H2O→2HI+H2SO4.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气,将溶液蒸干并充分燃烧,得到固体剩余物质的组成可能是()A.NaCl、Na2SO4B.NaCl、NaBr、Na2SO4C.NaCl、Na2SO4、I2D.NaCl、NaI、Na2SO4【解答】解:通入Cl2后将按顺序发生以下三个反应:①Na2SO3+Cl2+H2O=Na2SO4+2HCl,②2NaI+Cl2=2NaCl+I2,③2NaBr+Cl2=2NaCl+Br2.当Cl2过量时,蒸干灼烧,HCl、Br2会挥发,I2会升华,将得到Na2SO4和NaCl的混合物,如Cl2不足时,将得到NaCl、NaBr、Na2SO4,故选AB.11.自来水可用氯气消毒,某学生用自来水配制下列物质的溶液,会引起药品变质是()①AgNO3②FeBr2③烧碱④Na2CO3⑤Na2SO3⑥CaCl2.A.除②⑤③外B.④⑤⑥C.①②③⑥D.除⑥外【解答】解:①氯水中含有Cl﹣,加入硝酸银生成氯化银沉淀,不能用于配制AgNO3溶液,故①选;②Cl2、HClO具有强氧化性,可与FeBr2发生氧化还原反应,不能用于配制FeBr2溶液,②选;③氯气与烧碱溶液反应,不能配制烧碱溶液,故③选④H+都能与Na2CO3溶液反应,不能配制Na2CO3溶液,故④选;⑤Cl2、HClO具有强氧化性,可与Na2SO3发生氧化还原反应,不能用于配制溶液Na2SO3,故⑤选;⑥氯水中各粒子与CaCl2都不反应,可用于配制CaCl2溶液,故⑥不选;故选D.12.已知:常温时;2NaOH+Cl2═NaCl+NaClO+H2O;加热时:6NaOH+3Cl2═5NaCl+NaClO3+3H2O,将Cl2通入amol NaOH溶液恰好完全反应,下列有关说法错误的是()A.参加反应的氯气的物质的量等于 mo1B.若某温度下,反应后=K,若溶液中=C.控制温度,反应中转移电子的物质的量最大值是a molD.控制温度,产物中NaCl的物质的量的范围 a mol≤n(NaCl)≤ a mol【解答】解:A.常温时;2NaOH+Cl2═NaCl+NaClO+H2O,反应2mol氢氧化钠,消耗1mol氯气,所以Cl2通入amol NaOH溶液恰好完全反应,则参加反应的氯气的物质的量等于 mo1,故A正确;B.反应中氯气一部分化合价升高生成次氯酸钠、氯酸钠,一部分化合价降低生成氯化钠,依据得失电子守恒可知:C(ClO﹣)×1+5×C(ClO3﹣)=C(Cl﹣)×1,若=K,则C(ClO3﹣)=,代入C(ClO﹣)×1+5×C(ClO3﹣)=C(Cl﹣)×1中化简得:=,故B正确;C.当只发生6NaOH+3Cl2═5NaCl+NaClO3+3H2O,转移电子数最多,依据方程式6mol氢氧化钠反应转移5mol电子,所以amol氢氧化钠反应,最多转移mol电子,故C错误;D.若只发生反应:2NaOH+Cl2═NaCl+NaClO+H2O,则amol NaOH溶液能生成amol氯化钠,若只发生反应:6NaOH+3Cl2═5NaCl+NaClO3+3H2O,则能生成mol氯化钠,若两个反应都发生,生成氯化钠的物质的量介于amol和mol之间,故D正确;故选:C.13.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能还有杂质气体()①CO2②HCl ③H2O ④O2.A.①②③④B.②③④C.②③D.①④【解答】解:次氯酸钙能够与空气中的二氧化碳、水反应生成碳酸钙和次氯酸,次氯酸分解生成氯化氢和氧气,贮存很久的漂白粉可能存在碳酸钙,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O、CaCO3+2HCl=CaCl2+CO2↑+H2O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO2、HCl、H2O(气)、O2,故选:A.14.(2014安徽模拟)某溶液中含有SO32﹣、Br﹣、SiO32﹣、CO32﹣、Na+,向该溶液中通入过量的Cl2,下列判断正确的是()①反应前后,溶液中离子浓度基本保持不变的只有Na+②有胶状沉淀物质生成③有气体产生④溶液颜色发生变化⑤共发生了2个氧化还原反应.A.①②③④⑤B.①②③④C.①③⑤D.②④⑤【解答】解:某溶液中含有SO32﹣、SiO32﹣、Br﹣、CO32﹣、Na+,向该溶液中通入过量的Cl2,SO32﹣可以被氯气氧化为硫酸根离子;SiO32﹣和氯水中的盐酸反应生成硅酸沉淀;Br﹣被氯气氧化为溴单质;CO32﹣和氯水中的盐酸反应生成二氧化碳气体;①钠离子不参加反应,反应前后,溶液中离子浓度基本保持不变的有Na+,故①正确;②SiO32﹣和氯水中的盐酸反应生成硅酸沉淀,有胶状物质硅酸生成,故②正确;③CO32﹣和氯水中的盐酸反应生成二氧化碳气体,故③正确;④氯气氧化溴离子为溴单质,溶液颜色发生变化有无色变化为橙红色,故④正确;⑤共发生了氯气与水反应、氧化SO32﹣、Br﹣3个氧化还原反应.故⑤错误;故选B.15.(2014金山区一模)在淀粉碘化钾溶液中加入少量次氯酸钠溶液,振荡后溶液变蓝,再加入足量的亚硫酸钠溶液,蓝色逐渐消失.下列判断错误的是()A.氧化性:ClO﹣>SO42﹣>I2B.漂粉精溶液可使淀粉碘化钾试纸变蓝C.ClO﹣与I﹣在碱性条件可以发生氧化还原反应D.向新制氯水中加入足量亚硫酸钠溶液,氯水褪色【解答】解:A.根据向淀粉碘化钾溶液中加入少量的次氯酸钠溶液,溶液变蓝色知,次氯酸根离子将碘离子氧化成了碘单质,碘遇淀粉变蓝色,根据氧化剂的氧化性大于氧化产物的氧化性,次氯酸根离子是氧化剂,碘单质是氧化产物,氧化性为:ClO﹣>I2,再加入足量的亚硫酸钠溶液蓝色又逐渐消失,说明碘单质又将亚硫酸根离子氧化了,得到硫酸根离子,碘单质是氧化剂,硫酸根离子是氧化产物,故氧化性SO42﹣<I2.因此得出氧化性的强弱为:ClO﹣>I2>SO42﹣.故A错误;B.漂白精的成分中有次氯酸钠,根据对A的分析,次氯酸钠能将淀粉碘化钾中的碘离子氧化成碘单质.故B正确;C.次氯酸根离子无论在碱性条件下还是在酸性条件下、中性条件下均有氧化性.因此ClO﹣与I﹣在碱性条件下可以发生氧化还原反应.故C正确;D.新制的氯水中主要是氯气,因此新制的氯水是黄绿色的,由于氯气的氧化性比亚硫酸根离子的氧化性强,故能发生氧化还原反应,氯气被还原而使氯水退色,故D正确.故选A.16.(2014奉贤区二模)某溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为()Cl2的体积(标准状况)n(Cl﹣)/moln(Br﹣)/moln(I﹣)/mol x(x>0)0 0A.5:15:4 B.5:12:4C.15:30:8 D.条件不足,无法计算【解答】解:还原性:I﹣>Br﹣,加入氯气时溶液中I﹣为xmol,则说明通入 Cl2只发生:Cl2+2I﹣═I2+2Cl﹣,由表中数据可知原溶液中溴离子为3mol,通入氯气,其物质的量为=,I﹣为0mol,碘离子完全反应,同时氧化溴离子,发生反应:Cl2 +2Br﹣═Br2+2Cl﹣,Cl2+2I﹣═I2+2Cl﹣,氯气反应生成的氯离子为×2=1mol,故原溶液中氯离子为2mol﹣1mol=1mol,由方程式可知溶液中阴离子总的物质的量不变(不含氢氧根离子),故原溶液中碘离子的物质的量为2mol+﹣1mol﹣3mol=,。
2025年新人教版高考化学一轮复习讲义 第五章 第17讲 氯及其重要化合物的转化关系

拓展 综合应用
碱石灰能吸收二氧化碳,但二氧化碳对 反应没有影响,故B不符合; 即使有O2进入,O2能氧化丁中生成的副 产物SnCl2,但不会氧化戊装置试管中的 产物SnCl4,故D不符合。
拓展 综合应用
(5)某同学认为丁装置中的反应可能产生SnCl2 杂质,下列试剂中可用于检测是否产生SnCl2 的有_B_D__。 A.H2O2溶液 B.FeCl3溶液(滴有KSCN) C.AgNO3溶液 D.溴水
拓展 综合应用
整个装置中充满氯气,即丁装置充满黄 绿色气体时,再加热熔化锡粒生成SnCl4, 继续加热丁装置,促进氯气与锡反应, 使生成的SnCl4汽化,有利于从混合物中 分离出来,便于在戊装置处冷却收集。
拓展 综合应用
(4)如果缺少乙装置,可能发生的副反应的 化学方程式为_S_n_+__2_H_C__l=_=_=__S_n_C_l_2+__H__2↑__; 己装置的作用是_A__C_(填字母,下同)。 A.除去未反应的氯气,防止污染空气 B.防止空气中CO2气体进入戊装置 C.防止水蒸气进入戊装置的试管中使产物水解 D.防止空气中O2进入戊装置的试管中使产物氧化
1 2 3 4 5 6 7 8 9 10 11 12 13 14
2.(2023·广东惠州模拟)部分含氯物质的分类与相应化合价关系如图所示。下列推断 不合理的是
√A.常温下,a、d水溶液的pH:a<d
B.b既具有氧化性,又具有还原性 C.c可用于自来水消毒 D.e或f分别与a的浓溶液反应均可制得b
1 2 3 4 5 6 7 8 9 10 11 12 13 14
2025年新人教版高考化学一轮复习讲义 第17讲
氯及其重要化合物的转化关系
复
习 目
掌握氯及其化合物的转化关系及条件。
【2025人教版化学复习讲义】大单元二 第五章 第17讲 氯及其重要化合物的转化关系

拓展 综合应用
由题干信息及装置图分析各装置的作 用,a装置用于除杂,b装置用于制备 氯酸钾,c装置用于制备次氯酸钠,d 装置用于尾气处理。b装置的加热方式 为水浴加热。c装置中氯气与氢氧化钠 发生反应的离子方程式为Cl2+2OH-===ClO-+Cl-+H2O。根据b、c装置水 浴温度的不同推知,生成氯酸盐时需要酒精灯加热,生成次氯酸盐时需要冰水 冷却,所以c中冰水浴的目的是避免氯酸钠的生成。
拓展 综合应用
(2)b中采用的加热方式是__水__浴__加__热__,c中 化学反应的离子方程式是_C_l_2+__2_O__H_-_=__=_=_ _C_l_O_-__+__C_l_-_+__H_2_O__ , 采 用 冰 水 浴 冷 却 的 目的是_避__免__生__成__N__aC__lO__3_。
拓展 综合应用
(3)d 的 作 用 是 _吸__收__尾__气__(_C_l_2)_ , 可 选 用 试 剂_A_C__(填标号)。
A.Na2S C.Ca(OH)2
B.NaCl D.H2SO4
d是尾气处理装置,吸收氯气可以用硫化钠溶液或氢氧化钙浊液。
拓展 综合应用
(4)反应结束后,取出b中试管,经冷却结 晶,_过__滤___,_少__量__(_冷__)水__洗__涤__,干燥,得 到KClO3晶体。
SO2的物质的量之比为2∶1 B.若反应①通过原电池来实现,则ClO2是正极产物
√C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于 H2O2
拓展 综合应用
根据流程知,反应①中氧化剂是 NaClO3,还原剂是SO2,还原产 物是ClO2,氧化产物是NaHSO4, 根据化合价升降相等可得参加反 应的NaClO3和SO2的物质的量之比为2∶1,A项正确; 由反应①化合价变化情况,再根据原电池正极发生还原反应,所以ClO2是正极产物, B项正确; 据反应②,在ClO2与H2O2的反应中,ClO2转化为NaClO2,氯元素的化合价降低,作 氧化剂,H2O2只能作还原剂,氧元素的化合价升高,不能用NaClO4代替H2O2,且可 以推出ClO2的氧化性大于H2O2,C项错误,D项正确。
氯及其化合物方程式

1.钠在氯气中燃烧:2.铜在氯气中燃烧:3.铁在氯气中燃烧:4.工业制盐酸:5.氯气溶解于水:离子反应:6.次氯酸溶液见光:7.氯气使湿润的碘化钾淀粉试纸变蓝:8.工业制漂白粉:离子方程式:9.漂白粉使用原理:10.漂白粉固体久置变质:①;②11.实验室制氯气:离子反应:12.实验室制氯气时尾气吸收(制84消毒液):离子方程式:13.氯离子检验:14.碳酸钠与硝酸银离子反应:15.碳酸银溶于稀硝酸:1.钠在氯气中燃烧:2Na + Cl 2点燃 2NaCl (白烟) 2.铜在氯气中燃烧:Cu + Cl 2 点燃CuCl 2 (棕黄色烟)3.铁在氯气中燃烧:2Fe + 3Cl 2点燃 2FeCl 3 (棕褐色烟) 4.工业制盐酸:H 2 + Cl 2 点燃2HCl (光照爆炸)5.氯气溶解于水:Cl 2 + H 2OHCl + HClO 离子反应:Cl 2 + H 2O H + + Cl -+ HClO6.次氯酸溶液见光:2HClO 2HCl + O 2↑7.氯气使湿润的碘化钾淀粉试纸变蓝:Cl 2 + 2KI = 2KCl + I 28.工业制漂白粉:2Ca(OH)2 + 2Cl 2 = CaCl 2 + Ca(ClO)2 + 2H 2O 离子方程式:Ca(OH)2 + Cl 2 = Ca 2+ + Cl - + ClO - + H 2O9.漂白粉使用原理:Ca(ClO)2 + CO 2 + H 2O = CaCO 3↓ + 2HClO10.漂白粉固体久置变质:①Ca(ClO)2 + CO 2 + H 2O = CaCO 3 + 2HClO ;②2HClO 2HCl + O 2↑11.实验室制氯气:4HCl(浓) + MnO 2△ MnCl 2 + Cl 2↑ + 2H 2O 离子反应: 4H ++2Cl - + MnO 2 △ 2+ + Cl 2↑ + 2H 2O12.实验室制氯气时尾气吸收(制84消毒液):Cl 2 + 2NaOH = NaCl + NaClO + H 2O离子反应方程:Cl 2 + 2OH - = Cl - + ClO - + H 2O13.氯离子检验:Cl - +Ag + = AgCl ↓ (白色沉淀不溶于硝酸)14.碳酸钠与硝酸银离子反应:CO 32-+2Ag + = Ag 2CO 3↓光照 光照15.碳酸银溶于稀硝酸:Ag2CO3 + 2H+ = 2Ag+ + CO2↑ + H2O。
Cl及其化合物(兼顾卤素)(一)

说明: Si不再专门讲解,配合课后习题训练即可。
Cl及其化合物转化的一般规律
一、Cl2单质 1. Cl2的强氧化性 (1)Cl2与金属的反应
(2) Cl2与非金属的反应
Cl2强氧化性规律总结
2.Cl2的歧化反应 Cl2与水的反应
Cl2与碱反应
(1)非金属单质与水、碱反应的一般规律
1
Hale Waihona Puke 兼谈逆向反应的一般规律 (2) Cl2歧化的一般规律
(3) Cl2通入NaOH(aq)是先于水反应生成酸,还是直接与 NaOH反应?
(4) Cl2制备84消毒液和漂白粉、漂白精:酸和盐的稳定性问 题
(5) Cl2通入加有酚酞的NaOH(aq),发生褪色现象。是酸碱中 和反应还是漂白?
2
氯及其化合物转化关系
氯及其化合物的转化关系1、液氯、新制的氯水和久置的氯水比较 液氯 新制氯水 久置氯水 分类纯洁物 混合物 混合物 颜色黄绿色 黄绿色 无色 成分Cl 2 Cl 2、H 2O 、HClO 、H +、Cl ―、ClO ―、极少量的为OH ― H +、Cl ―、H 2O 、极少量的OH ― 稀盐酸 性质 氧化性 氧化性、酸性、漂白性 酸性2、氯气的性质与金属钠反响方程式2Na+Cl 2 点燃 2NaCl 与金属铁反响方程式2Fe+3Cl 2 点燃 2FeCl 3 与金属铜反响方程式Cu+Cl 2 点燃 CuCl 2 与氢气反响方程式H 2+Cl 22HCl ;H 2+Cl 22HCl 与水反响方程式H 2O +Cl 2 ==HCl+HClO 制漂白液反响方程式Cl 2+2NaOH==NaCl+NaClO+H 2O 制漂白粉反响方程式2Cl 2 +2C a (O H )2==CaCl 2 +C a (C l O )2 +2H 2O 实验室制法MnO 2+4HCl 〔浓〕 △ MnCl 2 +Cl 2↑+2H 2O 氯离子的检验试剂以及反响方程式 AgNO 3溶液:g ++Cl ―==AgCl综合能力测试卷一.选择题〔共28小题〕1.将一定量的氯气通入30mL 浓度为10.00mol/L 的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl 、NaClO 、NaClO 3共存体系.以下判断正确的选项是〔 〕A .与NaOH 反响的氯气一定为0.3 molB .n 〔Na +〕:n 〔Cl ﹣〕可能为7:3C .假设反响中转移的电子为n mol ,则0.15<n <0.25D .n 〔NaCl 〕:n 〔NaClO 〕:n 〔NaClO 3〕可能为11:2:12.向仅含Fe2+、I﹣、Br﹣的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如下列图.以下说法中正确的选项是〔〕A.线段Ⅲ代表Fe2+的变化情况B.线段Ⅰ代表Br﹣的变化情况C.a数值等于6D.原混合溶液中n〔FeBr2〕=4 mol3.以下说法正确的选项是〔〕①新制氯水的氧化性强于久置氯水;②氯气的性质活泼,它与氢气混合后立即发生爆炸;③实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收④检验Cl2中是否混有HCl气体,方法是将气体通入硝酸银溶液中⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水⑥枯燥的Cl2能使湿润的有色布条褪色,说明枯燥的Cl2有漂白性.A.①②③④⑤⑥ B.②③⑤C.①②④⑤ D.①③⑤4.时钟反响或振荡反响提供了迷人课堂演示实验,也是一个活泼的研究领域.测定含I﹣浓度很小的碘化物溶液时,利用振荡反响进展化学放大,以求出原溶液中碘离子的浓度.主要步骤是①在中性溶液中,用溴将试样中I﹣氧化成IO3﹣,将过量的溴除去②再参加过量的碘化钾,在酸性条件下,使IO3﹣完全转化成I2③将②中生成的碘完全萃取后,用肼将其复原成I﹣,方程式为H2N﹣NH2+2I2→4I﹣+N2↑+4H+④将生成的I﹣萃取到水层后用①法处理.⑤将④得到的溶液参加适量的KI溶液,并用硫酸酸化.⑥将⑤反响后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2→Na2S4O6+2NaI经过上述放大后,则溶液中I﹣浓度放大为原溶液中I﹣浓度的〔设放大前后溶液体积相等〕〔〕A.2倍B.4倍C.6倍D.36倍5.化合物BrF*能够与水反响,产物有溴酸、氢氟酸、单质溴和氧气,则以下关于该反响的说法正确的选项是〔〕A.BrF*是复原剂,HF是氧化产物B.水是氧化剂,O2是复原产物C.假设*=3,则BrF*与水的系数比为3:5D.*为奇数,分别可以取1、3、5、7、9等值6.在同温同压下,将由H2和Cl2组成的混和气体200mL引发化学反响,反响后的气体体积仍为200mL.以下对化学反响状况的判断中正确的选项是〔〕A.假设反响后的气体有刺激性气味,则一定是Cl2没有完全反响B.假设反响后的气体没有颜色,则一定是H2,Cl2都已完全反响C.假设反响后的气体略带黄绿色,则一定是H2已完全反响D.假设反响后的气体遇水显漂白性,则一定是Cl2未完全反响7.反响①是自海藻灰中提取碘的主要反响,反响②是自智利硝石中提取碘的主要反响:①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2NaIO3的氧化性与MnO2相近,以下有关说法正确的选项是〔〕A.I2在反响①中是复原产物,在反响②中是氧化产物B.两个反响中生成等量的I2时转移的电子数相等C.NaI和NaIO3在一定条件下能反响生成I2D.NaIO3在化学反响中只能做氧化剂不能做复原剂8.实验:①向2mL 1mol•L﹣1 NaBr溶液中通入少量氯气,溶液变为黄色;②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;③向①所得溶液继续通入氯气,溶液由黄色变成橙色.以下分析不正确的选项是〔〕A.仅根据实验①能说明复原性:Br﹣>Cl﹣B.仅根据实验②能说明氧化性:Br2>I2C.上述实验验证了Cl2、Br2、I2的氧化性相对强弱D.向实验③所得溶液中加CCl4,充分振荡,下层为橙红色9.制备食用碘盐〔KIO3〕原理之一为:I2+2KClO3Cl2+2KIO3,以下正确的选项是〔〕A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀B.反响过程中I2置换出Cl2,由此可推断非金属性I>ClC.KClO3和KIO3均属于离子化合物,都只含有离子键D.制备KIO3的反响中氯元素被复原10.H2SO3+I2+H2O→2HI+H2SO4.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气,将溶液蒸干并充分燃烧,得到固体剩余物质的组成可能是〔〕A.NaCl、Na2SO4 B.NaCl、NaBr、Na2SO4C.NaCl、Na2SO4、I2D.NaCl、NaI、Na2SO411.自来水可用氯气消毒,*学生用自来水配制以下物质的溶液,会引起药品变质是〔〕①AgNO3②FeBr2③烧碱④Na2CO3⑤Na2SO3⑥CaCl2.A.除②⑤③外B.④⑤⑥C.①②③⑥ D.除⑥外12.:常温时;2NaOH+Cl2═NaCl+NaClO+H2O;加热时:6NaOH+3Cl2═5NaCl+NaClO3+3H2O,将Cl2通入amol NaOH溶液恰好完全反响,以下有关说法错误的选项是〔〕A.参加反响的氯气的物质的量等于0.5a mo1B.假设*温度下,反响后=K,假设溶液中=C.控制温度,反响中转移电子的物质的量最大值是a molD.控制温度,产物中NaCl的物质的量的*围 a mol≤n〔NaCl〕≤ a mol13.用贮存很久的漂白粉与浓盐酸反响制得的氯气中,可能还有杂质气体〔〕①CO2②HCl ③H2O ④O2.A.①②③④ B.②③④C.②③ D.①④14.*溶液中含有SO32﹣、Br﹣、SiO32﹣、CO32﹣、Na+,向该溶液中通入过量的Cl2,以下判断正确的选项是〔〕①反响前后,溶液中离子浓度根本保持不变的只有Na+②有胶状沉淀物质生成③有气体产生④溶液颜色发生变化⑤共发生了2个氧化复原反响.A.①②③④⑤B.①②③④C.①③⑤D.②④⑤15.在淀粉碘化钾溶液中参加少量次氯酸钠溶液,振荡后溶液变蓝,再参加足量的亚硫酸钠溶液,蓝色逐渐消失.以下判断错误的选项是〔〕A.氧化性:ClO﹣>SO42﹣>I2B.漂粉精溶液可使淀粉碘化钾试纸变蓝C.ClO﹣与I﹣在碱性条件可以发生氧化复原反响D.向新制氯水中参加足量亚硫酸钠溶液,氯水褪色16.*溶液中含有大量的Cl﹣、Br﹣、I﹣,假设向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积〔标准状况〕的关系如下表所示,原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为〔〕C.15:30:8 D.条件缺乏,无法计算17.一样体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反响恰好完成时,消耗Cl2的体积一样〔同温、同压条件下〕,则KI、Na2S、FeBr2溶液的物质的量浓度之比是〔〕A.1:1:2 B.2:1:3 C.6:3:2 D.3:2:118.:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体.②向NaI溶液中通入少量实验①产生的气体,溶液变黄色.③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.以下判断正确的选项是〔〕A.实验①证明Cl﹣具有复原性B.实验②中氧化剂与复原剂的物质的量之比为2:1C.实验③说明KI被氧化D.上述实验证明氧化性:ClO3﹣>Cl2>I219.溶液中含有NH4+、F﹣、HSO3﹣、K+等离子.向其中参加少量NaClO后,溶液中离子数目肯定增加的是〔〕A.F﹣B.ClO﹣ C.HSO3﹣D.NH4+20.有一混合溶液,其中只含有Fe2+、Cl﹣、Br﹣、I﹣〔忽略水的电离〕,Cl﹣、Br﹣、I﹣的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl﹣和Br﹣的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为〔〕A.7:4 B.7:3 C.7:2 D.7:121.在热的碱性溶液中,Cl2发生如下反响:Cl2+NaOH→NaCl+NaClO3+H2O〔未配平〕.请推测NaClO2在热的碱性溶液中发生反响的最终产物是〔〕A.NaCl、NaClO B.NaCl、NaClO3C.NaClO、NaClO3D.NaClO3、NaClO422.:2Fe2++Br2═2Fe3++2Br﹣,2Fe3++2I﹣═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中*些离子的物质的量变化如下列图.以下有关说法中,不正确的选项是〔〕A.复原性:I﹣>Fe2+>Br﹣B.原混合溶液中FeBr2的物质的量为6 molC.当通入2 mol Cl2时,发生的离子反响可表示为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣D.原溶液中:n〔Fe2+〕:n〔I﹣〕:n〔Br﹣〕=2:1:323.*混合溶液中含有NaI、NaBr、Na2SO3三种溶质,其物质的量均为l mol,向混合溶液中通入一定量的氯气.以下说法正确的选项是〔〕A.将溶液蒸干最多可以得到4 mol NaClB.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4C.向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量D.假设通入氯气的体积为11.2 L〔标准状况〕,反响的离子方程式为:2I﹣+Cl2=I2+2C1﹣24.以下各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终可能得到纯洁物的是〔〕A.向FeSO4溶液中通入Cl2B.向KI和NaBr混合溶液中通入Cl2C.向NaAlO2溶液中参加HCl溶液D.向NaHCO3溶液中参加Na2O2粉末25.往含Br﹣和Cl﹣的稀溶液中滴入AgNO3溶液,沉淀的质量与参加AgNO3溶液体积的关系如下列图.则原溶液中c〔Br﹣〕/c〔Cl﹣〕的比值约为〔〕A.〔V2﹣V1〕/V1 B.V1/V2C.V1/〔V2﹣V1〕D.V2/V126.在氯水中存在多种分子和离子,它们在不同的反响中表现各自的性质.以下实验现象和结论一致且正确的选项是〔〕A.参加有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在C.先参加盐酸酸化,再参加AgNO3溶液产生白色沉淀,说明有Cl﹣存在D.参加NaOH溶液,氯水黄绿色消失,说明有HClO分子存在27.以下氯化物,不能用单质直接反响制得的是〔〕A.CuCl2B.FeCl2C.NaCl D.HCl28.*温度下,将氯气通入NaOH溶液中,反响得到NaCl、NaClO、NaClO3的混合溶液〔氯气和NaOH在一定温度下能发生反响:3Cl2+6NaOH=5NaCl+NaClO3+3H2O〕,经测定ClO﹣与ClO3﹣的物质的量之比为1:3,则氯气与氢氧化钠反响时,被复原的氯元素和被氧化的氯元素的物质的量之比为〔〕A.21:5 B.11:3 C.3:1 D.4:1二.填空题〔共2小题〕29.Cl2O为国际公认高效平安灭菌消毒剂之一,它是棕黄色强刺激性气体,沸点3.8℃熔点﹣116℃.实验室可用潮湿的Cl2与Na2CO3反响制取少量Cl2O,装置如下〔图Ⅰ〕:答复以下问题:〔1〕把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2.请模仿“图Ⅱ〞在“图Ⅰ〞A处补画出正确的装置图,并作必要的标注.〔2〕B中试剂a应选用〔填以下序号字母〕:a.CCl4b.饱和NaCl溶液c.浓H2SO4 d.饱和NaHCO3溶液〔3〕通入适量的氯气,在C中生成黄绿色的物质Cl2O,该物质常温为气体,方程式为:Cl2+Na2CO3+═NaHCO3+NaCl+Cl2O〔4〕对C中反响后的固体成分进展检验,请写出实验步骤以及预期的现象和结论.限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、Ba〔OH〕2溶液、AgNO3溶液、澄清石灰水、试管、小烧杯、带导管的橡皮塞、过滤装置.实验步骤现象和结论步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中.步骤二:向a试管中滴加BaCl2溶液,静置.无明显现象,证明固体中不含Na2CO3步骤三:步骤四:则证明固体中含有NaCl.白粉、高锰酸钾等,可以将禽流感病毒杀灭.氯气与氢氧化钙充分反响,得到漂粉精,其稳定性比漂白粉高.〔1〕工业上将氯气通入石灰乳[Ca〔OH〕2]制取漂粉精,化学反响方程式为:.〔2〕漂粉精的有效成分是〔填化学式〕.〔3〕漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的物质,化学反响方程式为.〔4〕反响〔1〕和反响〔3〕中,属于氧化复原反响的是〔填编号〕.〔5〕将漂粉精溶于适量水中,呈白色浊状物,静置沉降.取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反响的离子方程式为.另取少许上层清液,先滴加适量的〔填化学式〕酸化,再滴加〔填化学式〕溶液即可检验Cl﹣的存在,发生反响的离子方程式为.再取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈性并具有性.氯及其化合物参考答案与试题解析一.选择题〔共28小题〕1.〔2021 •**模拟〕将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.以下判断正确的选项是〔〕A.与NaOH反响的氯气一定为0.3 molB.n〔Na+〕:n〔Cl﹣〕可能为7:3C.假设反响中转移的电子为n mol,则0.15<n<0.25D.n〔NaCl〕:n〔NaClO〕:n〔NaClO3〕可能为11:2:1【解答】解:A、由于反响后体系中没有NaOH,故氢氧化钠反响完,根据钠元素守恒n〔NaOH〕=n〔NaCl〕+n〔NaClO〕+n〔NaClO3〕=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n〔Cl2〕=n〔NaCl〕+n〔NaClO〕+n〔NaClO3〕=0.3mol,故参加反响的氯气n〔Cl2〕=0.15mol,故A错误;B、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时,n〔Na+〕:n〔Cl﹣〕最大为2:1,当氧化产物为NaClO3时,n〔Na+〕:n〔Cl﹣〕最小为6:5,故6:5<n〔Na+〕:n〔Cl﹣〕<2:1,7:3>2:1,故B错误;C、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时,转移电子数最少,为0.3mol××1=0.15mol,氧化产物只有NaClO3时,转移电子数最多,为0.3mol××1=0.25mol,故C正确;D、令n〔NaCl〕=11mol,n〔NaClO〕=2mol,n〔NaClO3〕=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;应选C.2.〔2021•黄梅县校级模拟〕向仅含Fe2+、I﹣、Br﹣的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如下列图.以下说法中正确的选项是〔〕A.线段Ⅲ代表Fe2+的变化情况 B.线段Ⅰ代表Br﹣的变化情况C.a数值等于6 D.原混合溶液中n〔FeBr2〕=4 mol【解答】解:向仅含Fe2+、I﹣、Br﹣的溶液中通入适量氯气,根据复原性:I﹣>Fe2+>Br﹣,首先发生反响:2I﹣+Cl2=I2+2Cl﹣,I﹣反响完毕,再发生反响:2Fe2++Cl2=2Fe3++2Cl﹣,Fe2+反响完毕,最后发生反响:2Br﹣+Cl2=Br2+2Cl﹣,故线段Ⅰ代表I﹣的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br﹣的变化情况;由通入氯气可知,根据反响离子方程式可知溶液中n〔I﹣〕=2n〔Cl2〕=2mol,溶液中n〔Fe2+〕=2n〔Cl2〕=2×〔3mol﹣1mol〕=4mol,Fe2+反响完毕,根据电荷守恒可知n〔I﹣〕+n〔Br﹣〕=2n〔Fe2+〕,故n〔Br﹣〕=2n〔Fe2+〕﹣n〔I﹣〕=2×4mol﹣2mol=6mol,A、由上述分析可知,线段Ⅲ代表Br﹣的变化情况,故A错误;B、由上述分析可知,线段I代表I﹣的变化情况,故B错误;C、由上述分析可知,溶液中n〔Br﹣〕=2n〔Fe2+〕﹣n〔I﹣〕=2×4mol﹣2mol=6mol,根据2Br﹣+Cl2═Br2+2Cl﹣可知,溴离子反响需要的氯气的物质的量为3mol,故a=3+3=6,故C 正确;D、溶液中n〔Br﹣〕=6mol,所以原混合溶液中n〔FeBr2〕=3mol,故D错误;应选:C.3.〔2021 •**模拟〕以下说法正确的选项是〔〕①新制氯水的氧化性强于久置氯水;②氯气的性质活泼,它与氢气混合后立即发生爆炸;③实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收④检验Cl2中是否混有HCl气体,方法是将气体通入硝酸银溶液中⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水⑥枯燥的Cl2能使湿润的有色布条褪色,说明枯燥的Cl2有漂白性.A.①②③④⑤⑥ B.②③⑤C.①②④⑤ D.①③⑤【解答】解:①新制氯水中含有大量氯气和次氯酸,久置氯水相当于盐酸溶液,氯水和次氯酸有强氧化性、盐酸具有弱氧化性,所以新制氯水氧化性大于久置氯水,故正确;②氯气的性质活泼,它与氢气混合后枯燥条件下发生爆炸,常温下不反响,故错误;③氯气有毒不能直接排空,氯气和水反响生成酸,所以氯气能和碱反响生成盐,实验室用NaOH溶液吸收氯气尾气,故正确;④氯气、HCl都可以和硝酸银反响生成白色沉淀,所以不能用硝酸银溶液检验,故错误;⑤HCl极易溶于水,饱和食盐水抑制氯气溶解,所以可以用饱和食盐水除去氯气中的HCl,故正确;⑥氯气没有漂白性,次氯酸有漂白性,枯燥的氯气能使湿润的有色布条褪色,实际上是氯气和水反响生成的HClO表达的漂白性,故错误;应选D.4.〔2021•扶沟县校级模拟〕时钟反响或振荡反响提供了迷人课堂演示实验,也是一个活泼的研究领域.测定含I﹣浓度很小的碘化物溶液时,利用振荡反响进展化学放大,以求出原溶液中碘离子的浓度.主要步骤是①在中性溶液中,用溴将试样中I﹣氧化成IO3﹣,将过量的溴除去②再参加过量的碘化钾,在酸性条件下,使IO3﹣完全转化成I2③将②中生成的碘完全萃取后,用肼将其复原成I﹣,方程式为H2N﹣NH2+2I2→4I﹣+N2↑+4H+④将生成的I﹣萃取到水层后用①法处理.⑤将④得到的溶液参加适量的KI溶液,并用硫酸酸化.⑥将⑤反响后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:2Na2S2O3+I2→Na2S4O6+2NaI经过上述放大后,则溶液中I﹣浓度放大为原溶液中I﹣浓度的〔设放大前后溶液体积相等〕〔〕A.2倍B.4倍C.6倍D.36倍【解答】解:①从方程式可看出,I﹣浓度不变;②从方程式可看出,1个IO3﹣生成3个I2,从第三步反响看出,I﹣浓度放大了6倍;③从方程式可看出,1个I2生成2个I﹣;④从方程式可看出,I﹣浓度不变;⑤从方程式可看出,1个IO3﹣生成3个I2,从第三步反响看出,I﹣浓度放大了6倍;⑥从方程式可看出,1个I2生成2个I﹣;因此从以上方程式和分析可得关系式:I~IO3﹣~3I2~6I﹣~6IO3﹣~18I2~36S2SO32﹣~36I ﹣,1 3 6 6 18 36 总计放大倍数为:6×6=36倍.应选D.5.〔2021•模拟〕化合物BrF*能够与水反响,产物有溴酸、氢氟酸、单质溴和氧气,则以下关于该反响的说法正确的选项是〔〕A.BrF*是复原剂,HF是氧化产物B.水是氧化剂,O2是复原产物C.假设*=3,则BrF*与水的系数比为3:5D.*为奇数,分别可以取1、3、5、7、9等值【解答】解:A.F的非金属性非常强,其它氧化剂难以氧化F,反响前后F元素的化合价不变,故A错误;B.反响中O元素的化合价升高,水被氧化生成氧气,则水为复原剂,O2是氧化产物,故B 错误;C.假设*=3,则BrF3与水发生:3BrF3+5H2O=HBrO3+9HF+O2+Br2,BrF*与水的系数比为3:5,故C正确;D.Br的最外层电子数为7,最高化合价为+7价,*不可能为9,故D错误.应选C.6.在同温同压下,将由H2和Cl2组成的混和气体200mL引发化学反响,反响后的气体体积仍为200mL.以下对化学反响状况的判断中正确的选项是〔〕A.假设反响后的气体有刺激性气味,则一定是Cl2没有完全反响B.假设反响后的气体没有颜色,则一定是H2,Cl2都已完全反响C.假设反响后的气体略带黄绿色,则一定是H2已完全反响D.假设反响后的气体遇水显漂白性,则一定是Cl2未完全反响【解答】A、反响后的气体有刺激性气味,可以是生成的氯化氢气体,也可以是剩余氯气,故A错误;B、反响后的气体没有颜色,可以是恰好完全反响,也可以是氢气剩余,故B错误;C、反响后的气体略带黄绿色,说明一定剩余氯气,故C正确;D、反响后的气体遇水显漂白性,是剩余氯气与水反响生成的次氯酸的作用,故一定剩余氯气,故D正确;应选CD.7.〔2021•龙海市校级模拟〕反响①是自海藻灰中提取碘的主要反响,反响②是自智利硝石中提取碘的主要反响:①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2NaIO3的氧化性与MnO2相近,以下有关说法正确的选项是〔〕A.I2在反响①中是复原产物,在反响②中是氧化产物B.两个反响中生成等量的I2时转移的电子数相等C.NaI和NaIO3在一定条件下能反响生成I2D.NaIO3在化学反响中只能做氧化剂不能做复原剂【解答】解:A.反响①中氧化剂是MnO2,复原剂是NaI,MnSO4是复原产物,I2是氧化产物;反响②中I2是复原产物,故A错误;B.生成1mol I2时,反响①转移2mol电子,反响②转移电子10mol,两者在生成等量I2时转移电子数不相等,故B错误;C.NaI中碘元素化合价是﹣1,而NaIO3中的碘元素化合价是+5,I2中碘元素化合价是0,故NaI与NaIO3在一定条件下可以发生氧化复原反响生成I2,故C正确;D.NaIO3中氧元素是最低价,可以作复原剂,故D错误.应选C.8.实验:①向2mL 1mol•L﹣1 NaBr溶液中通入少量氯气,溶液变为黄色;②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;③向①所得溶液继续通入氯气,溶液由黄色变成橙色.以下分析不正确的选项是〔〕A.仅根据实验①能说明复原性:Br﹣>Cl﹣B.仅根据实验②能说明氧化性:Br2>I2C.上述实验验证了Cl2、Br2、I2的氧化性相对强弱D.向实验③所得溶液中加CCl4,充分振荡,下层为橙红色【解答】解:A.Cl2+2NaBr=Br2+2NaCl,说明复原性:Br﹣>Cl﹣,故A正确;B.①所得溶液可能含有氯气,氯气能氧化碘离子得到I2,不能说明氧化性:Br2>I2,故B 错误;C.根据③指知①中氯气缺乏,与碘离子反响的是溴单质,能说明氧化性:Br2>I2,结合Cl2+2NaBr=Br2+2NaCl可以得出:Cl2>Br2>I2,故C正确;D.CCl4密度比水大,下层为橙红色是被氧化出来的溴单质溶于CCl4,故D正确.应选B.9.〔2021•**一模〕制备食用碘盐〔KIO3〕原理之一为:I2+2KClO3Cl2+2KIO3,以下说法正确的选项是〔〕A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀B.反响过程中I2置换出Cl2,由此可推断非金属性I>ClC.KClO3和KIO3均属于离子化合物,都只含有离子键D.制备KIO3的反响中氯元素被复原【解答】解:A.KClO3不能电离出Cl﹣,则不能与AgNO3溶液反响生成白色AgCl沉淀,故A错误;B.I2+2KClO3Cl2+2KIO3中,I元素的化合价升高,Cl元素的化合价降低,则非金属性Cl>I,故B错误;C.KClO3和KIO3均含离子键、共价键,均为离子化合物,故C错误;D.制备KIO3的反响中,Cl元素的化合价由+5价降低为0,得到电子被复原,故D正确;应选D.10.H2SO3+I2+H2O→2HI+H2SO4.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气,将溶液蒸干并充分燃烧,得到固体剩余物质的组成可能是〔〕A.NaCl、Na2SO4 B.NaCl、NaBr、Na2SO4C.NaCl、Na2SO4、I2D.NaCl、NaI、Na2SO4【解答】解:通入Cl2后将按顺序发生以下三个反响:①Na2SO3+Cl2+H2O=Na2SO4+2HCl,②2NaI+Cl2=2NaCl+I2,③2NaBr+Cl2=2NaCl+Br2.当Cl2过量时,蒸干灼烧,HCl、Br2会挥发,I2会升华,将得到Na2SO4和NaCl的混合物,如Cl2缺乏时,将得到NaCl、NaBr、Na2SO4,应选AB.11.自来水可用氯气消毒,*学生用自来水配制以下物质的溶液,会引起药品变质是〔〕①AgNO3②FeBr2③烧碱④Na2CO3⑤Na2SO3⑥CaCl2.A.除②⑤③外B.④⑤⑥C.①②③⑥ D.除⑥外【解答】解:①氯水中含有Cl﹣,参加硝酸银生成氯化银沉淀,不能用于配制AgNO3溶液,故①选;②Cl2、HClO具有强氧化性,可与FeBr2发生氧化复原反响,不能用于配制FeBr2溶液,②选;③氯气与烧碱溶液反响,不能配制烧碱溶液,故③选④H+都能与Na2CO3溶液反响,不能配制Na2CO3溶液,故④选;⑤Cl2、HClO具有强氧化性,可与Na2SO3发生氧化复原反响,不能用于配制溶液Na2SO3,故⑤选;⑥氯水中各粒子与CaCl2都不反响,可用于配制CaCl2溶液,故⑥不选;应选D.12.:常温时;2NaOH+Cl2═NaCl+NaClO+H2O;加热时:6NaOH+3Cl2═5NaCl+NaClO3+3H2O,将Cl2通入amol NaOH溶液恰好完全反响,以下有关说法错误的选项是〔〕A.参加反响的氯气的物质的量等于0.5a mo1B.假设*温度下,反响后=K,假设溶液中=C.控制温度,反响中转移电子的物质的量最大值是a molD.控制温度,产物中NaCl的物质的量的*围 a mol≤n〔NaCl〕≤ a mol【解答】解:A.常温时;2NaOH+Cl2═NaCl+NaClO+H2O,反响2mol氢氧化钠,消耗1mol 氯气,所以Cl2通入amol NaOH溶液恰好完全反响,则参加反响的氯气的物质的量等于0.5amo1,故A正确;B.反响中氯气一局部化合价升高生成次氯酸钠、氯酸钠,一局部化合价降低生成氯化钠,依据得失电子守恒可知:C〔ClO﹣〕×1+5×C〔ClO3﹣〕=C〔Cl﹣〕×1,假设=K,则C〔ClO3﹣〕=,代入C〔ClO﹣〕×1+5×C〔ClO3﹣〕=C〔Cl﹣〕×1中化简得:=,故B正确;C.当只发生6NaOH+3Cl2═5NaCl+NaClO3+3H2O,转移电子数最多,依据方程式6mol氢氧化钠反响转移5mol电子,所以amol氢氧化钠反响,最多转移mol电子,故C错误;D.假设只发生反响:2NaOH+Cl2═NaCl+NaClO+H2O,则amol NaOH溶液能生成amol氯化钠,假设只发生反响:6NaOH+3Cl2═5NaCl+NaClO3+3H2O,则能生成mol氯化钠,假设两个反响都发生,生成氯化钠的物质的量介于amol和mol之间,故D正确;应选:C.13.用贮存很久的漂白粉与浓盐酸反响制得的氯气中,可能还有杂质气体〔〕①CO2②HCl ③H2O ④O2.A.①②③④ B.②③④C.②③ D.①④【解答】解:次氯酸钙能够与空气中的二氧化碳、水反响生成碳酸钙和次氯酸,次氯酸分解生成氯化氢和氧气,贮存很久的漂白粉可能存在碳酸钙,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生Ca〔ClO〕2+4HCl〔浓〕=CaCl2+2Cl2↑+2H2O、CaCO3+2HCl=CaCl2+CO2↑+H2O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO2、HCl、H2O〔气〕、O2,应选:A.14.〔2021•**模拟〕*溶液中含有SO32﹣、Br﹣、SiO32﹣、CO32﹣、Na+,向该溶液中通入过量的Cl2,以下判断正确的选项是〔〕①反响前后,溶液中离子浓度根本保持不变的只有Na+②有胶状沉淀物质生成③有气体产生④溶液颜色发生变化⑤共发生了2个氧化复原反响.A.①②③④⑤B.①②③④C.①③⑤D.②④⑤【解答】解:*溶液中含有SO32﹣、SiO32﹣、Br﹣、CO32﹣、Na+,向该溶液中通入过量的Cl2,SO32﹣可以被氯气氧化为硫酸根离子;SiO32﹣和氯水中的盐酸反响生成硅酸沉淀;Br﹣被氯气氧化为溴单质;CO32﹣和氯水中的盐酸反响生成二氧化碳气体;①钠离子不参加反响,反响前后,溶液中离子浓度根本保持不变的有Na+,故①正确;②SiO32﹣和氯水中的盐酸反响生成硅酸沉淀,有胶状物质硅酸生成,故②正确;③CO32﹣和氯水中的盐酸反响生成二氧化碳气体,故③正确;④氯气氧化溴离子为溴单质,溶液颜色发生变化有无色变化为橙红色,故④正确;⑤共发生了氯气与水反响、氧化SO32﹣、Br﹣3个氧化复原反响.故⑤错误;应选B.15.〔2021•金山区一模〕在淀粉碘化钾溶液中参加少量次氯酸钠溶液,振荡后溶液变蓝,再参加足量的亚硫酸钠溶液,蓝色逐渐消失.以下判断错误的选项是〔〕A.氧化性:ClO﹣>SO42﹣>I2B.漂粉精溶液可使淀粉碘化钾试纸变蓝C.ClO﹣与I﹣在碱性条件可以发生氧化复原反响D.向新制氯水中参加足量亚硫酸钠溶液,氯水褪色【解答】解:A.根据向淀粉碘化钾溶液中参加少量的次氯酸钠溶液,溶液变蓝色知,次氯酸根离子将碘离子氧化成了碘单质,碘遇淀粉变蓝色,根据氧化剂的氧化性大于氧化产物的氧化性,次氯酸根离子是氧化剂,碘单质是氧化产物,氧化性为:ClO﹣>I2,再参加足量的亚硫酸钠溶液蓝色又逐渐消失,说明碘单质又将亚硫酸根离子氧化了,得到硫酸根离子,碘单质是氧化剂,硫酸根离子是氧化产物,故氧化性SO42﹣<I2.因此得出氧化性的强弱为:ClO﹣>I2>SO42﹣.故A错误;B.漂白精的成分中有次氯酸钠,根据对A的分析,次氯酸钠能将淀粉碘化钾中的碘离子氧化成碘单质.故B正确;C.次氯酸根离子无论在碱性条件下还是在酸性条件下、中性条件下均有氧化性.因此ClO ﹣与I﹣在碱性条件下可以发生氧化复原反响.故C正确;。
