元素及其化合物之间转化关系
元素化合物知识

1.氯气及其化合物相互转化关系(1)铁与氯气:H:3Cl2+2Fe 2FeCl3 (固体是红棕色,溶液为黄色)(2)氯气通入水中:L:Cl2+H2O==H++Cl–+ HClO(3)氯气尾气吸收:L:Cl2+2OH–=Cl–+ClO–+H2O(4)氯气通入溴化亚铁溶液中:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-;(足量氯气)2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl- (1:1)(5)氯气通入碘化亚铁溶液中:2I-+Cl2===I2+2Cl-(少量氯气);2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-(足量氯气)(6)实验室制氯气:L:4H++2Cl–+MnO2 Mn2++Cl2↑+2H2O2.硫及其化合物相互转化关系(1)铁与硫:H:S+Fe FeS (2)铜与硫:H:S+2Cu Cu2S(3)硫与氧气:H:S+O2 SO2 (4)SO2与O2:H:2SO2+O2 2SO3 (5)SO2与H2S混合:H:2H2S+SO2===3S↓+2H2O(6)SO2通入到卤水中:H:X2+SO2+2H2O===H2SO4+2HX (X2=Cl2、Br2、I2)(7)卤素单质加入到亚硫酸钠溶液中:L:SO32-+X2+H2O=2H++SO42-+2X–(X2=Cl2、Br2、I2)(8)铜与浓硫酸:H:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O(浓硫酸表现强氧化性和酸性)(9)碳与浓硫酸:H:2H2SO4(浓)+C CO2↑+2SO2↑+2H2O (浓硫酸仅表现强氧化性)3.氮及其化合物相互转化关系(1)工业合成氨:H:N2+3H2 2NH3(2)实验室制氨气:H:Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O(3)氨与氯化氢:H:NH3+HCl===NH4Cl (沾有浓盐酸与沾有浓氨水的玻璃棒靠近产生“白烟”)(4)氨的催化氧化:H:4NH3+5O2 4NO+6H2O(5)氯化铵分解:H:NH4Cl NH3+HCl (6)铵根离子的检验:L:NH4++OH- NH3+H2O (7)硝酸分解:H:4HNO3 4NO2↑+O2↑+2H2O (保存在棕色瓶中)(8)铜与浓硝酸:H:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(9)铜与稀硝酸:L: 3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O(10)碳与浓硝酸:H:4HNO3(浓)+C CO2↑+4NO2↑+2H2O(11)铁与稀硝酸:L:(铁不足)4H++NO3-+Fe=Fe3++NO↑+2H2O;(铁过量)3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O4.硅及其化合物之间的相互转化关系(1)硅与氧气:H:Si(粉)+O2 SiO2 (2)工业制粗硅:H:2C+SiO2 Si+2CO(制得粗硅) (3)二氧化硅与氢氧化钠:H:SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃) (4)二氧化硅与氢氟酸:H:4HF+SiO2===SiF4+2H2O(5)制玻璃:H:SiO2+Na2CO3 Na2SiO3+CO2 ;SiO2+CaCO3 CaSiO3+CO25.钠的转化关系(1)钠投入水中:L:2Na+2H2O==2Na++2OH-+H2↑。
氮元素之间的转化关系

氮元素之间的转化关系氮元素在自然界中存在多种形式,通过不同的化学反应和生物过程,这些形式之间会不断地转化。
氮元素的转化关系对于生物圈的氮循环和生态系统的平衡起着至关重要的作用。
本文将探讨氮元素在大气、土壤和生物体中的转化关系,以及这些转化对环境和生物的影响。
氮元素在大气中主要以氮气(N2)的形式存在,占据了大气中约78%的成分。
氮气通过闪电、紫外线辐射等自然过程发生固氮,将氮气转化为氧化态氮(NOx)和氨(NH3)。
这些氮化合物在大气中与水蒸气和氧气发生反应,形成硝酸雨,对环境造成污染。
氮元素在土壤中的转化过程也非常复杂。
土壤中的氨氮、硝态氮和有机氮是主要的形式。
氨氮主要来自有机物的分解和固氮细菌的作用,可以通过硝化作用转化为硝态氮,再被植物吸收利用。
有机氮则需要通过微生物的分解作用才能转化为植物可利用的氮源。
土壤中的氮元素不仅影响着作物的生长发育,还会对地下水质和生态系统健康产生影响。
氮元素在生物体内的转化关系也非常重要。
植物通过根系吸收土壤中的氮素,将其转化为蛋白质等有机化合物,供自身生长和发育所需。
动物通过摄食植物或其他动物获取氮素,将其转化为蛋白质和氨基酸等营养物质。
微生物在土壤中或生物体内参与氮素的分解和转化过程,促进有机物的降解和循环利用。
总的来说,氮元素之间的转化关系在自然界中起着至关重要的作用。
这种转化关系不仅影响着大气、土壤和生物体中氮素的分布和循环,还直接影响着生态系统的平衡和稳定。
因此,我们需要更加深入地研究氮元素的转化机理,为保护环境和维护生态平衡提供科学依据。
希望通过本文的探讨,读者能对氮元素的转化关系有更深入的了解,为环境保护和可持续发展贡献自己的力量。
碳硅及其重要化合物间的转化关系

碳硅及其重要化合物间的转化关系全文共四篇示例,供读者参考第一篇示例:碳硅是一种重要的元素,它们在自然界中广泛存在并且具有许多重要的化合物。
碳和硅是两种非金属元素,它们在化学性质上有一些相似之处,因此在一些化学反应中可以相互转化。
在本文中,我们将探讨碳硅及其重要化合物之间的转化关系。
让我们来看一下碳的化合物。
碳是一种非金属元素,它在自然界中存在于多种形式中,如石墨、金刚石和全新炭等。
碳在化学反应中通常以四价的形式存在,它可以与氧、氢、氮等元素形成许多不同的化合物。
碳酸盐是碳循环中的一个重要环节,它在地壳中有着广泛的存在,并且可以通过各种化学反应转化为其他碳化合物,如石灰石、煤炭等。
硅是一种具有金属性质的元素,它在自然界中存在于硅石、石英和硅酸盐等形式中。
硅与氧形成的硅酸盐是地壳中的主要组成,它们可以通过地球内部的热液作用、熔融作用等过程来形成。
硅也可以与其他元素形成许多重要化合物,如硅烷、硅酸等。
碳硅在化学性质上有一些相似之处,因此它们在一些化学反应中可以相互转化。
碳可以与硅直接反应,生成碳硅化合物,如碳化硅。
碳化硅是一种重要的半导体材料,它具有优良的导电性能和热导率,被广泛应用于电子器件、太阳能电池等领域。
碳硅材料还可以通过不同的方法制备,如化学气相沉积、烧结等。
碳硅及其重要化合物之间存在着多种转化关系,它们在材料科学、化工等领域中有着广泛的应用前景。
通过深入研究碳硅化学性质及其相互转化关系,我们可以更好地利用这些重要元素和化合物,推动科学技术的发展,实现材料的创新和应用。
希望本文能够帮助读者更深入地了解碳硅及其重要化合物之间的转化关系,激发对这一领域的兴趣和热情。
希望碳硅化学的研究能够为人类社会的可持续发展做出更大的贡献。
【2000字】。
第二篇示例:碳硅是一种重要的元素,其在自然界中的存在形式有许多,包括石墨、金刚石等,而碳硅也是一种重要的金属loid,其在化学反应中具有独特的性质和作用。
碳硅及其重要化合物间的转化关系,既包括碳硅之间的相互转化,也包括碳硅与其他元素形成的化合物之间的转化关系。
元素化合物的转化关系网络图

元素化合物的转化关系、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。
1、钠及其重要化合物间的转化关系。
(WH 或 AHCIHC1写出图中标号反应的化学方程式或离子方程式。
① 2Na + 02,Na 2O 2 (淡黄色)② 2Na 2O 2 + 2H 2O = 4NaOH + 0 2? 2Na + 2H 2O = 2Na ++ 20H - + H z f③ 2Na 2O 2 + 2H 2O = 4NaOH + O 2?2血2。
2 + 2H 2O = 4Na ++ 4OH -+ O 2 ?④ 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2⑤ 2NaCl +2 H 2O 通电 2NaOH + H 2 ? + CI 2 ?(氯碱工业) 2C 「+2 H 2O 通电 2OH - + H 2 ? + CI 2 ? ⑥ Na 2CO 3 + H 2O +CO 2 = 2NaHCO 3CO 3 + H 2O +CO 2 = 2HCO 3⑦ 2 NaCIO + H 2O +CO 2 = Na 2CO 3+ HCIO 2、铝及其重要化合物间的转化关系。
HC1 出, 通暫熔融陋'NaOHAJ 7冷浓HNOj或浓HjSO, NaOH②钝化④HC1△NaA10a — 或 ⑦NaOH写出图中标号反应的化学方程式或离子方程式。
- 点燃 ① 4AI + 3O 2 2AI 2O 3 ② 2AI + 2NaOH + 2H 2O = 2NaAIO 2 + 3H 2 ? ③ 2AI 2O 3 通电 4AI+3O 2 ? ④ AI 2O 3+6HCI = 2AICI 3+3H 2O⑤ AI 2O 3 + 2NaOH = 2NaAIO 2 +H 2O咼温2AI + Fe 2O 3 2Fe + AI 2O 32AI +2OH - +2H 2O = 2AIO 2 +3H 2 ?+3+AI 2O 3 + 6H = 2AI 3+ 3H 2O AI 2O 3 + 2OH - = 2AIO 2- + H 2O点燃* N«CK>CO Z . H 屮⑥NaCl 工C 2H 5OHC ?H 5ONaC»(OH )2 HCIAICI 3+3NH 3 H 2O = AI(OH) 3 J + 3NH 4CI AICI3 +3NaOH = AI(OH) 3J + 3NaCI AI(OH) 3 +NaOH =NaAIO 2 +2 H 2O AI 3+ +3 AIO 2- +6H 2O = 4AI(OH) 铁及其重要化合物间的转化关系。
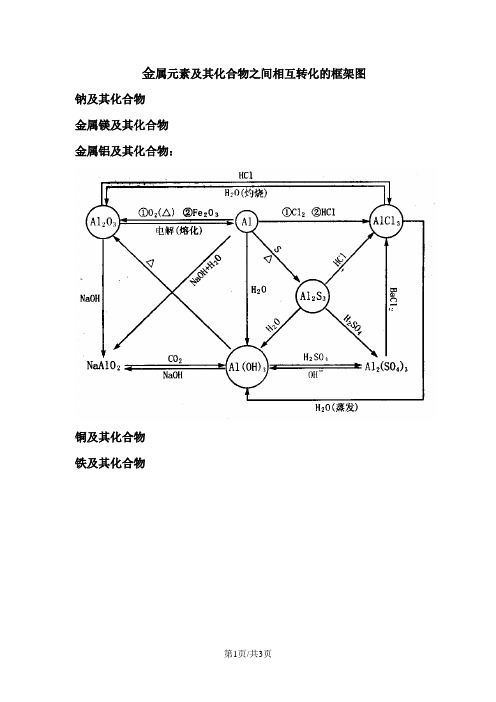
人教高中化学 必修一 第 3章 金属元素及其化合物之间相互转化的框架图
高考化学一轮复习讲义—氮及其化合物的转化关系

高考化学一轮复习讲义—氮及其化合物的转化关系[复习目标]1、能从物质类别、氮的化合价变化理解氮及其化合物的转化关系;2、能从含氮物质的性质和转化的视角解释生产、生活中的相关现象。
1.氮元素的“价—类”二维图氮元素有多种可变化合价,物质的种类较多,在复习时要从物质类别和价态变化理解这些物质之间的转化关系。
2.含氮元素物质之间的转化关系典型物质间转化方程式再落实。
(1)工业合成氨:N 2+3H 2高温、高压催化剂2NH 3;(2)实验室用NH 4Cl 固体制NH 3:2NH 4Cl +Ca(OH)2=====△2NH 3↑+2H 2O +CaCl 2;(3)NH 3的催化氧化:4NH 3+5O 2=====催化剂△4NO +6H 2O ;(4)NO 2溶于水:3NO 2+H 2O===2HNO 3+NO ;(5)Cu 溶于稀HNO 3:3Cu +8H ++2NO -3===3Cu 2++2NO↑+4H 2O ;(6)Cu 溶于浓HNO 3:Cu +4H ++2NO -3===Cu 2++2NO 2↑+2H 2O ;(7)炽热的炭在浓硝酸中燃烧:C +4HNO 3(浓)=====△CO 2↑+4NO 2↑+2H 2O ;(8)浓硝酸见光分解:4HNO 3=====光照4NO 2↑+O 2↑+2H 2O 。
一、氮在自然界中的循环1.自然界中氮的循环如图所示。
下列说法不正确的是()A .工业合成氨属于人工固氮B .雷电作用下N 2与O 2发生了化学反应C .在氮的循环中不涉及氧化还原反应D .含氮无机物与含氮有机化合物可相互转化答案C 解析工业合成氨是氮气和氢气在高温、高压和催化剂条件下生成氨气,属于人工固氮,故A正确;雷电作用下N2与O2发生反应生成NO,故B正确;在氮的循环中,工业合成氨、雷电作用过程中N元素化合价改变,涉及氧化还原反应,故C错误;含氮无机物与含氮有机化合物可相互转化,如氨气可合成尿素,故D 正确。
高中化学第7讲 常见元素及其化合物的性质及转化(教案)

第7课时 核心价值——常见元素及其化合物的性质及转化(学科本质价值)常见元素及其化合物的性质及转化是高考命题的热点,该类试题体现《化学课程标准》对“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”等学科核素素养的要求,要求考生能从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“性质决定性质”的观念,能从宏观和微观相结合的视角分析与解决实际问题。
1.直线型转化关系A ――→XB ――→XC (1)X 为O 2Na ―→Na 2O ―→Na 2O 2N 2―→NO ―→NO 2或NH 3―→NO ―→NO 2 S ―→SO 2―→SO 3或H 2S ―→SO 2―→SO 3 C ―→CO ―→CO 2或CH 4―→CO ―→CO 2 醇―→醛―→羧酸 (2)X 为CO 2NaOH ――→CO 2Na 2CO 3――→CO 2NaHCO 3 (3)X 为强酸,如HClNaAlO 2――→HCl Al(OH)3――→HCl AlCl 3Na 2CO 3――→HClNaHCO 3――→HClCO 2 (4)X 为强碱,如NaOHAlCl 3――→NaOHAl(OH)3――→NaOHNaAlO 2 2.交叉型转化3.三角型转化4.注意反应形式与物质的关系,特别是置换反应 (1)金属―→金属:金属+盐―→盐+金属,铝热反应。
(2)金属―→非金属:活泼金属+H 2O(或H +)―→H 2,2Mg +CO 2=====点燃2MgO +C 。
(3)非金属―→非金属:2F 2+2H 2O===4HF +O 2,2C +SiO 2=====高温Si +2CO ↑,C +H 2O(g)=====高温CO +H 2,X 2+H 2S===2HX +S ↓。
(4)非金属―→金属:用H 2、C 冶炼金属。
(2020·江苏卷)下列选项所示的物质间转化均能实现的是( )A .NaCl(aq)――→电解Cl 2(g)――→石灰水漂白粉(s)B .NaCl(aq)――→CO 2(g )NaHCO 3(s)――→加热Na 2CO 3(s)C .NaBr(aq)――→Cl 2(g )Br 2(aq)――→NaI (aq )I 2(aq)D .Mg(OH)2(s)――→HCl (aq )MgCl 2(aq)――→电解Mg(s)C [由Cl 2制备漂白粉应通入石灰乳而不是石灰水中,A 项错误。
元素化合物的转化关系网络图
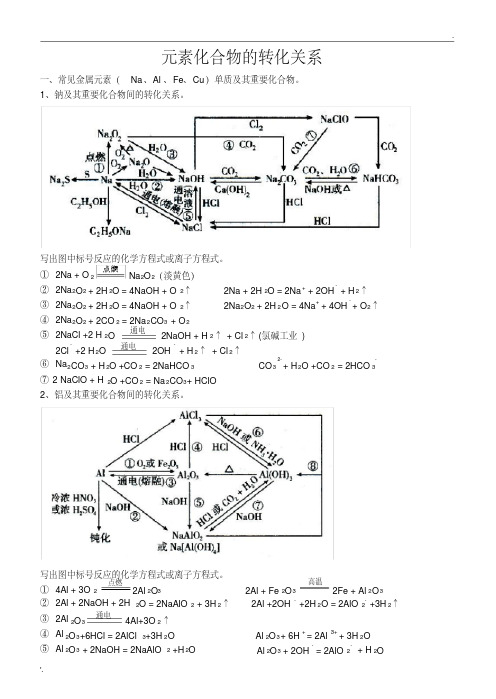
元素化合物的转化关系
一、常见金属元素( Na 、Al 、 Fe、 Cu )单质及其重要化合物。 1、钠及其重要化合物间的转化关系。
写出图中标号反应的化学方程式或离子方程式。
① 2Na + O 2
Na 2O 2(淡黄色)
② 2Na2O2 + 2H 2O = 4NaOH + O 2↑
③ 2Na2O2 + 2H 2O = 4NaOH + O 2↑
2Na
+
2H
2O
=
2Na +
+
-
2OH
+
H 2↑
2Na2O2 + 2H 2 O = 4Na+ + 4OH - + O2↑
④ 2Na2O2 + 2CO 2 = 2Na 2CO3 + O2
⑤ 2NaCl +2 H 2O 通电 2NaOH + H 2↑ + Cl 2↑ (氯碱工业 )
-
2Cl +2 H 2O
2Fe3+ + Cu = 2Fe 2+ +Cu2+
2 Fe2+ + Cl 2 = 2 Fe3+ + 2Cl -
△
⑥ 2 Fe(OH) 3
Fe2O3 + 3H 2O
⑧ FeCl3 +3NH 3·H2O = Fe (OH) 3 ↓+ 3NH 4Cl
Fe
3+
+
3
NH
3·H 2O
=
Fe
(Oห้องสมุดไป่ตู้)
3↓+
3NH
元素化合物转化关系图(高中)
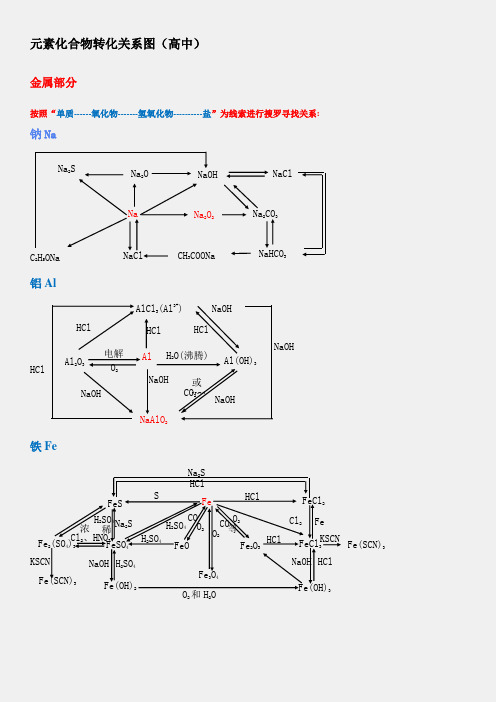
元素化合物转化关系图(高中)金属部分按照“单质------氧化物-------氢氧化物----------盐”为线索进行搜罗寻找关系:钠Na铝Al铁FeNa 2SNa 2ONaOHNaClNa 2CO 3Na 2O 2NaC 2H 5ONaNaCl CH 3COONaNaHCO 3Al 2O 3Al Al(OH)3NaAlO 2AlCl 3(Al 3+)H 2O(沸腾) 电解 O 2HCl NaOHNaOHCO 2或HCl NaOHNaOH HClHClHClNaOH稀 FeFeO FeCl 3 Fe(OH)2FeSFe 2O 3 Fe 3O 4FeCl 2Fe(OH)3 FeSO 4 Fe 2(SO 4)3 Fe(SCN)3 Fe(SCN)3SHClH 2SO 4 O 2 CO 等HCl Cl 2 Fe KSCN KSCN Na 2S H 2SO 4 Cl 2、HNO 3 浓 O 2和H 2ONaOH HClNaOH H 2SO 4H 2SO 4 CO O 2O 2 Na 2S HCl镁Mg铜Cu钙CaMg 3N 2MgOMg(OH)2MgX 2Cl 2CO 2H 2OX 2Mg MgO Mg(OH)2 MgCO 3△ MgCl 2 H 2OH 2ON 2HCl NaOH HCl 电解Mg(HCO 3)2 煅烧O 2HClH 2O CO 2 △或 OH -HCl CuCuO Cu(OH)2Cu 2+(NO 3-、SO42-)Cu 2SNH 3•H 2O[Cu(NH 3)4]2+CuSCu 2ONa 2S SH + HNO 3或H 2SO 4(浓)NaOH O 2 CO 、Al 、H△H +Ca(OH)2HClHCl H 2OHClNa 2CO 3CO 2+H 2OCaCaO CaHPO 4△CaCl 2CaCO 3 CaC 2 C(电炉)Ca(HCO 3)2O 2 H 2OH 3PO 4HClCO 2Ca(ClO)2H 2OCl 2或 CO 2非金属部分按照“化合价”寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐:氯Cl硫SCl2HCl CH3ClCa(ClO)FeCl3CuCl2PCl3、PCl5NaClOHClOCH2ClCH2ClO 2FeCl2CO2NaClCuCl2H2CH2=CHClHBr NaBrAgBrHI NaIAgIBr2I2ClFeS2S H2S Na2SSO2Na2SO3FeSSO3 Na2SO4BaSO4PbSCuSBaSO3 H2SO3H2SO4氮N碳与硅 C 、SiMg 3N 2N 2NONO 2N 2O 4NH 4Cl NH 3 NaNO3 HNO 3 Cu(NO 3)2[Ag (NH 3)2]+NH 3·H 2O(C 6H 7O 2) NO 2NO 2NO 2 n或 NO 2 Si C SiO 2H 2SiO 3CaSiO3H 4SiO 4Na 2SiO 3 SiH 4 SiF 4 SiCl 4CO 2 CO H 2CO 3 Ca(HCO 3) 2CaCO 3CaC 2CaOCa(OH)2磷P\氢与氧 H 、OPP 2O 5PCl 3PCl 5HPO 3H 3PO 4Na 3PO 4Ca 3(PO 4)2Ca (H 2PO 4)2CaHPO 4 H 2 H 2OO 2CH 3COOHCH 3CH 2OHKMnO 4HgOKClO 3 Na 2O 2H 2SO 4 CH 4ZnNH 4ClNH 3Cu Ca(OH)2Fe 3O 4 SO 2 CO 2+H 2O。
化学化学元素与化学物质的关联

化学化学元素与化学物质的关联化学:元素与化学物质的关联化学是一门研究物质的组成、结构、性质以及变化规律的基础自然科学。
在化学领域,元素和化学物质是两个核心概念,它们之间存在着紧密的关联。
本文将从元素的概念、化学物质的定义以及它们之间的相互关系等方面进行详细探讨。
元素的概念元素是构成物质的基本单元,由一种类型的原子组成。
具有相同原子序数的原子被称为同种元素。
元素在化学反应中不能再通过化学手段分解为其他物质,但可以通过核反应进行转化。
目前已知的元素有118种,包括自然界中的天然元素和人工合成的超重元素。
化学物质的定义化学物质是指由两种或两种上面所述不同元素按照一定的比例结合而成的物质。
化学物质的性质和组成决定了它的用途和影响。
化学物质可以是自然界中存在的,也可以是人工合成的。
它们广泛应用于各个领域,如工业生产、医药、食品、农业等。
元素与化学物质的相互关系元素和化学物质之间存在着密切的相互关系。
化学物质是由不同元素组成的,而元素是构成化学物质的基本单元。
以下是它们之间关系的具体表现:1.元素组成化学物质:化学物质是由两种或两种上面所述元素通过化学键结合而成的。
例如,水(H₂O)由氢元素和氧元素组成;二氧化碳(CO₂)由碳元素和氧元素组成。
2.元素性质影响化学物质性质:元素的电子排布、原子半径、电负性等性质决定了它与其他元素形成化学键的方式和化学物质的性质。
例如,氧元素具有较高的电负性,使得它与其他元素形成的化合物通常具有氧化性质。
3.元素活性与化学物质稳定性:元素的活性决定了它与其他元素形成化学物质的能力。
活性较高的元素容易与其他元素发生化学反应,形成稳定的化学物质。
例如,氟元素具有很高的活性,与许多元素形成的化合物都具有较高的稳定性。
4.元素周期律与化学物质性质:元素周期律是元素性质随原子序数变化的规律。
根据元素周期律,我们可以预测化学物质的一些性质,如熔点、沸点、溶解度等。
元素和化学物质是化学领域的两个核心概念。
非金属元素及其重要化合物之间的相互转化关系

-2-2-2-22Cl Br 2Br Cl 2Cl I 2I Cl )1(+→++→+O8H 5Cl 2KCl 2MnCl 16HCl 2KMnO O2H Cl MnCl )4HCl(Conc.MnO2 (2)2224222Δ+↑++→++↑+−→−+O2H CaCl Ca(ClO)2Ca(OH)2Cl OH NaClO NaCl 2NaOH Cl (3)222222Cold 2++→+++−−→−+O 3H 5KCl KClO KOH 63Cl )4(23Δ2++−→−+2KCl KClO KClO 3 )5(3OH Δ,-+−−→−O 2H CaCl 2Cl 4HCl Ca(ClO) )6(2222++→+ 2KCl KClO KClO 3 )7(3OHΔ,-+−−→− KCl 3KClO KClO 4 )8(43+→溴及其重要化合物之间的相互转化关系:2Br I 2I Br )1(-2-2+→+ -22-2Cl Br Cl Br 2 (2)+→+O 2H Br S O 2NaHS O (Conc.)S O 3H 2NaBr 2224Δ42+++−→−+ O H NaBrO KBr 2KOH Br (3)2Cold 2++−−→−+O 3H 5KBr KBrO KOH 63Br )4(23Δ2++−→−+2KBr KBrO KBrO 3 )5(3OH Δ,-+−−→−O H 2KCl Br 2HCl KBr KBrO )6(22++→++ 2KBr KBrO KBrO 3 )7(3OHΔ,-+−−→−Xe2HF BrO O H XeF BrO OH 2F BrO 2OH F BrO (8)--2--4-2-3++→++++→++2Br I 2I Br 2Cl I 2I Cl )1(-2-2-2-2+→++→+2NaI O S Na O S 2Na I (2)6423222+→+HIO HI O H I (3)-O HCold,22+−−−→−+O 3H 5KBr KIO KOH 63I )4(23Δ2++−→−+O3H 3I 6H 5I IO OH 3H 5SO I 5HSO 2IO )5(22--3224233+→+++++→+++--- O 3H 2Cl IO Cl 6OH IO )6(2562--3++→++--O 7H 5IO 2MnO 14H 5IO Mn 2 (7)2-3-4-562++→++++↑+−−−−→−O 4H 2HIO IO H 2 (8)24373Kvacuum,65↑+↑−→−++↑−→−+HCl NH Cl NH OH NaCl NH NaOH Cl (1)NH 3Δ423Δ4 3HClO NH O 3H NCl (2)323+↑=+3773K ~673 atalyst,c 700atm,~300222NH 3H N (3)−−−−−−−−→−+ O6H 2N 3O 4NH O3H N 3Cu 3CuO 2NH (4)2223223+=+++=+O 6H 4NO 5O 4NH (5)2800KPt,23+−−→−+↑+−→−++↑+−→−+5NO PO 3H O 2H 5HNO 3P 2NO SO H 2HNO S (6)43boil2342boil 3 22NO 2O 2NO (7)=+O2H O 4NO 4HNO O2H 2NO )Cu(NO Cu 4HNO (8)222322233+↑+↑−→−+↑+=+∆O 5H O N )4Zn(NO 4Zn (dilute)10HNO (9)22233+↑+=+↑+−→−22Δ3O 2NaNO 2NaNO (10) O 3H 5NO 2Mn 6H 5NO 2MnO (11)2322-4++=++-++- O 2H I 2NO 4H 2I 2NO (12)222++↑=+++-- O H NaCl H N NaOCl 2NH (13)2423++=+ O H NaNO NaOH HNO (14)233+=+↑+−→−+342Δ4232HNO S O Na S O H 2NaNO (15) 3433NO NH (aq)NH HNO (16)=+ O 2H O N NO NH (17)22Δ34+↑−→−↑+=+++S H Fe 2H FeS (1)22S H S H (2)2Δ2−→−+S2HI I S H 2SO 2H O S H 2 (3)22222+=++=+2773K铝矾土,22CO S 2CO S O (4)+−−−−→−+22SO O S (5)=+3O V 222S O O 2S O (6)52−−→−+5223O P 5S O 2P 5S O (7)+=+ O H S O Na 2NaOH S O (8)2423+=+ 2NaCl S H 2HCl S Na (9)22+↑=+x x S Na S )1(S Na (10)2Boil 2−→−-+ 3222S nS Na S nS S Na (11)=+O 3H 3S 6H 2S S O (12)22-23+↓=+++-62SF 3F S (13)=+O 2H S 3SO 4H O 2S (14)22-242+↓+↑=++3222S O H O H S O (16)=+O H NaHS O NaOH S O H (17)2332+=+2422Δ3Zn(OH)O S Na Zn 2NaHS O (18)+−→−+ O H S O 2H S O (19)22-23+↑=++O H S O Na 2NaOH S O (20)2322+=+ 2Hg O S Na 2SO 2Na[Hg] (21)4222+=+322Boil 32O S Na S S O Na (22)−→−+NaX ])O [Ag(S Na AgX O S 2Na (23)2323322+=+ NaI 2O S Na I O S 2Na (24)6422322+=+O 2H 2S O CO C (conc.)S O 2H (25)22242+↑+↑=+ 8HBr SO H O 4H 4Br S H (26)42222+=++O 4H 4I S H 8KHS O 8KI (conc.)S O 9H (27)222442+↓+↑+=+ 4223S O H O H S O (28)=+722423O S H (Conc.)S O H S O (29)=+ 422722SO 2H O H O S H (30)=+O H NaHSO NaOH SO H (31)2442+=+ 4442424HSO NH 2SO H SO )(NH (32)=+↑++−−→−+-++22824电解-44H O S 2NH 2HS O 2NH (33) 2242Cold 25242522282O H SO H O H SO H SO H SO H O H 2H O (34)S +−−→−++=+++-O H SO Na NaOH (35)NaHSO 2424+=+2HClSO Na O H Cl SO Na SO 2Na O SO (36)2Na 42223242232+=++=+6HCl 2NaCl SO 2H O 5H 4Cl O S (37)Na 4222322++=++64点燃24O P )不足(O 3P (1)−−→−+ 104点燃24O P )充足(O 5P (2)−−→−+22324PO 3KH PH O 3H 3KOH P (3)+↑=++3点燃244PCl )不足(Cl 6P (4)−−→−+5点燃24PCl 4)充足(Cl 10P (5)−−→−+ 3HCl PO H O 3H PCl (6)3323+=+ 33264PO 4H O 6H O P (7)=+ 321044HPO O 2H O P (8)=+ 72423O P H O H 2HPO (9)=+ O H 2HPO O P H (10)23724+= 432724PO 2H O H O P H (11)=+ O H O P H PO 2H (12)272443+= 5HCl PO H O 4H PCl (13)4325+=+2S CCl 2Cl CS (1)4FeS340K ,22+−−−→−+21170K CS 2S C (2)−−→−+2CO O 2C (3)不完全燃烧2−−−→−+O H Cu(CO)Cl O H CuCl CO (4)2盐酸溶液2⋅−−−→−++ CO CaC CaO 3C (5)22273K +−−→−+4高压Ni(CO))粉Ni(4CO (6)−−→−+ Ni 4CO Ni(CO) (7)593K ~5134+↑−−−→−C 2MgO 2Mg CO (8)点燃2+−−→−+2完全燃烧2CO O C (9)−−−→−+2CO C CO (10)高温2−−→−+ 2点燃22CO O 2CO (11)−−→−+O H CO CaCO )Ca(HCO (12)223Δ23+↑+↓−→−23223)Ca(HCO O H CO CaCO (13)=++2煅烧3CO CaO CaCO (14)+−−→− O H CaCO Ca(OH)CO (15)2322+↓=+ 32NaHCO NaOH CO (16)=+O H CO CO Na NaHCO 2 (17)2232Δ3+↑+−→−↑+=++23222H S iO Na O H 2NaOH S i (1)4773K~7232S iCl 2Cl S i (2)−−−→−+↑+−−−→−+4HCl )纯S i(2H S iCl (3)1453K ~137324O 8H 4NO S iF 3H 18HF 4HNO S i (4)2623+↑+=++ 624424S iF 2H S iO H O H 43S iF (5)+=+3444AlCl LiCl S iH LiAlH S iCl (6)+↑+=+ ↑+−−→−+2CO S i 2C S iO (7)3273228732SiO O Si (8)−→−+O 2H S iF H 6HF(aq)S iO (9)2622+=+ O 2H S iF 4HF S iO (10)242+↑=+O H S iO Na )浓2NaOH(S iO (11)232Δ2+−→−+322348HNO S iO 8Ag O 2H 8AgNO S iH (12)+↓+↓=++ 2NaCl 2NH S iO H Cl 2NH SiO (13)Na 332432+↑+↓=+ O H S iO S iO (14)H 2232+−→−∆ 2MgO S i Mg 4Mg (15)S iO 2灼烧2+−−→−+32973K 2O 2B 3O (1)4B −−→−+3MgO 2B 3Mg O (2)B 32+−→−+∆ 33232BO 2H O(l)3H O (3)B =+O 3H O B BO (4)2H 23233+−→−∆O 7H O B Na 9)2NaOH(pHBO (5)4H 274233+=<+ 2NaCl BO 4H O 5H 2HCl O B (6)Na 332742+=++(7) H 3BO 3+ 2 HCOH = HCCOH H 2COHH 2OCOH H 2C H 2BOO O CH 2CH 2OH -+ H + + 3H 2O+-+=+H B(OH)O H BO (8)4H 4233O 3H B(OR)3ROH BO (9)H 23S O 浓H 3342+−−−→−+3573K 22BCl 3Cl (10)2B −−→−+3CO 2BCl 3C 3Cl O (11)B 3773K 232+−−→−++> O 3H 3CaS O 2BF S O 3H 3CaF O (12)B 24342232++−→−++∆ O(g)3H O B 3O H (13)B 232262+=+ 433233HBF BO H O 3H (14)4BF +=+ 6243H B 6LiBF 6LiH (15)8BF +=+ 2332626H BO 2H O 6H H (16)B +=+ 3HCl BO H O 3H (17)BCl 3323+=+ O 3H )Co(BO CoO BO (18)2H 22233+=+ 2227422NaBO )Co(BO CoO O B (19)Na ⋅=+ 6HCl (l)2BCl 6Cl H (20)B 3262+=+-4232362BH ])(NH [BH 2NH H (21)B +⋅=+。
化学必修一元素转换关系图

高中化学必修一元素转换关系图1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 2、铝及其化合物的转化关系NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④ Al Al 2O 3 A l (O H )3 KAl(SO 4)2 NaAlO 2AlCl 3① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾⑿①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2△2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 3、铁及其化合物的转化关系①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀①Si +O 2△SiO 2②SiO 2+2C 高温 Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO高温CaSiO 3※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △ Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClONa 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ①②③ ④ ⑤⑥ ⑦ ⑧⑨ CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
知识总结物质间的相互转化
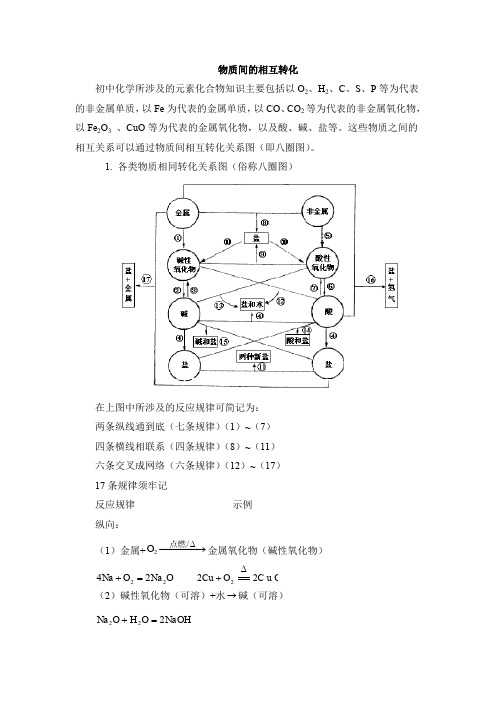
物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为:两条纵线通到底(七条规律)(1)~(7)四条横线相联系(四条规律)(8)~(11)六条交叉成网络(六条规律)(12)~(17)17条规律须牢记反应规律示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ C u O O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水 O H PO Na PO H NaOH 2434333+=+O H C u S O SO H OH Cu 244222)(+=+ (5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+ (6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232S i O O H S i O H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐 32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H(15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用:(1)可知某物质的性质。
铁及其化合物的转化关系

联想·质疑
3.亚铁盐、铁盐的检验
(1)特性法: ①现象:加入KSCN溶液,溶液变为红色 ②反应:Fe3++3SCN-=== Fe(SCN)3(红色)
(2)氧化剂法: ①现象:加入KSCN溶液无明显现象,再滴入氯水变成红色溶液 ②反应:2Fe2++Cl2 === 2Fe3++2Cl-; Fe3++3SCN- === Fe(SCN)3(红色)
√B.用浓盐酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
测 当堂测试 测试2
2.《神农本草经》记载:“神农尝百草,日遇七十二毒,得茶而解。”茶叶中铁 元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是 ()
C.过滤得到滤液,选用④、⑤和⑦
测 当堂测试 测试2
2.《神农本草经》记载:“神农尝百草,日遇七十二毒,得茶而解。”茶叶中铁 元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是 ()
活动·探究
为了提高皮革的耐曲折强度以及耐化学药剂和微生物的作用,常常使用绿矾作为鞣 革剂。绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化 而变质。为探究绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案。 可供选择的试剂:硫氰化钾溶液、酸性高锰酸钾溶液、氯水、氢氧化钠溶液、氯 化钡溶液,请完成方案设计。 实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。 (1)如何证明绿矾已经被氧化? (2) 如何证明绿矾已经被完全氧化? (3)在使用硫酸亚铁时,如何防止Fe3+的干扰?
Fe(OH)3
+2
FeO
酸
Fe2+
碱
Fe(OH)2
酸
0
Fe
单质
氧化物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C CO 2 CO O 2 CaCO 3 O 2 △或H +
Ca(OH)2 C CuO
Fe 2O 3 H 2O △ △ Cu Fe H 2CO 3 Ca(HCO 3)2
CO 2
H 2O
元素及其化合物之间转化关系
1.钠及其重要化合物之间转化关系
完成下列化学方程式
(注明反应条件)
①Na+O
2:___________________________ ②
Na+H 2O :__________________________ ③Na 2O 2+H 2O :_______________________ ④Na 2O 2+CO 2:_______________________ ⑤NaOH+CO 2:_______________________ 2.铝及其化合物之间的转化关系
完成下列反应的离子方程式:
①Al+HCl :____________________________ ②Al+NaOH+H 2O :__________________________ ③Al 2O 3+HCl :_________________________ ④Al 2O 3+NaOH :___________________________ ⑤Al(OH)3+HCl :______________________ ⑥Al(OH)3+NaOH :_________________________ ⑦AlCl 3+NH 3·H 2O :_____________________ ⑧NaAlO 2+CO 2+H 2O :______________________ 3
Fe + HCl ①:___________________________ Fe ② + CuSO 4:_________________________ FeCl ③ 2 + Cl 2:__________________________ FeCl ④ 3 + Fe :__________________________ ⑤Fe + Cl 2: ___________________________ Fe ⑥3O 4 + CO :_________________________ ⑦Fe 3O 4 + Al :_________________________ 4.碳及其化合物转化关系
写出下列反应的方程式(①—③写离子方程式,④—⑥写化学方程式)
①CO 2+C a (O H )2:________________________ ②CaCO 3+HCl :_____________________________ ③Ca(HCO 3)2+HCl :________________________ ④CaCO 3高温分解:________________________ ⑤C+CuO :________________________________ ⑥CO+Fe 2O 3:______________________________
H 2O NaOH HCl
或HCl
Fe 2+
Fe
Fe 3+
I 2、S 、H +
、Cu 2+
、Fe 3+
Zn 、CO H 2、CO 、Al Cl 2、Br 2、O 2、HNO 3、KMnO 4
Cl 2、Br 2、O 2、HNO 3 Cu 、Fe 、I -
5.硅及其化合物转化关系
写出下列反应的方程式(①②写离子方程式,③④写化学方程式,并注明条件)
①SiO 2+NaOH :____________________________ ②Na 2SiO 3+CO 2+H 2O :_______________________ ③Na 2CO 3+SiO 2:___________________________ ④CaCO 3+SiO 2:____________________________ ⑤SiO 2+C :________________________________ ⑥H 2SiO 3→ 6.氯及其重要化合物间的转化关系
写出下列反应的方程式(④⑤写离子方程式,其余写化学方程式)
①Cl 2+H 2:____________________________ ②Cl 2+Cu :_____________________________ ③Cl 2+Fe :____________________________ ④Cl 2+H 2O :___________________________ ⑤Cl 2+NaOH :_________________________ ⑥Cl 2+Ca(OH)2:______________________
⑦HClO 见光:________________________ ⑧Ca(ClO)2+CO 2+H 2O :__________________________ 7.
写出下列反应的方程式,要注明反应条件。
①S+H 2:______________________________ ②S+Cu :______________________________ ③S+Fe :______________________________ ④S+O 2:______________________________ ⑤SO 2+O 2:____________________________ ⑥Cu+H 2SO 4(浓):______________________ ⑦BaCl 2+H 2SO 4:_______________________ ⑧H 2SO 3+O 2:__________________________ 8.氮气及氮的化合物之间的转化
完成下列化学方程式(注明反应条件)
①N 2+O 2:_____________________________ ②N 2+H 2:_____________________________ ③NO+O 2:____________________________ ④NO 2+H 2O :__________________________ ⑤HNO 3(浓,见光):____________________ ⑥Cu+HNO 3(浓
):________________________ ⑦Cu+HNO 3(稀):_______________________ ⑧NH 4Cl+Ca(OH)2:_____________________
HCl NaClO Ca(ClO)2 Cl 2 HClO O 2 Ag CuCl 2 FeCl 3 AgCl Br 2
SiF。
