结晶水合物中结晶水测定-习题
高二化学结晶水合物中结晶水含量的测定

内。
(3)在靠近坩埚的沙浴中插入一支温度计
(300℃),其末端应与坩埚底部大致处于同
一水平。
(4)加热沙浴至约210 ℃,再慢慢升温至280 ℃
左右,控制沙浴温度在260~280 ℃之间。 (5)当粉末由蓝色全部变为白色时停止加热(约
需15~20min)。 (6)移入干燥器,冷至室温,在天平上称量。记 下数据。 (7)重复以上操作,直到“恒重”(本实验要求
结晶水合物中结晶水的测定
【实验目的】
(1)了解结晶水合物重结晶水含量的测定原理和
方法。
(2)学习研钵、干燥器等仪器的使用和沙浴加
热、恒重等基本操作。
【实验原理】 利用结晶水受热到一定温度时可以脱去结晶水的 一部分或全部的方法。 CuSO4· 5H2O晶体在不同温度下的逐步脱水:
CuSO4· 5H2O CuSO4· 3H2O CuSO4· H2O
至略高于室温。
(2)移入干燥器中,冷却至室温(注意:热坩埚
放入干燥器后,一定要在短时间内将干燥器 盖子打开1~2次,以免内部压力降低,难以 打开)。
(3)取出,用天平称量。重复加热至脱水温度以 上、冷却、称量,直至恒重。
2、水合硫酸铜脱水
(1)在已恒重的坩埚中加入1.0~1.2g研细的水
合硫酸铜晶体,铺成均匀,再用天平称 量。 (2)将已称量的、内装有水合硫酸铜晶体的坩埚 置于沙浴盘中,将其四分之三体积埋入沙
无水硫酸铜的质量/159.6g· mol-1 _________
结晶水的质量m3——————
结晶水的物质的量=m3/18.0 g· mol-1_________
每物质的量的CuSO4的结合水——————
水合硫酸铜的化学式——————
了解结晶水合物中结水含量的测定原理和方法。进一步熟悉分

实验内容
一、恒重坩埚
将一洗净的坩埚及坩埚盖置于泥三角上。小火烘 干后,用氧化焰灼烧至红热。将坩埚冷却至略高 于室温,再用干净的坩埚钳将其移入干燥器中, 冷却至室温(注意:热坩埚放入干燥器后,一定 要在短时间内将干燥器盖子打开1~2次,以免内部 压力降低,难以打开)。取出,用电光天平称量。 重复加热至脱水温度以上、冷却、称量,直至恒 重。
实验注意事项
CuSO4 .5H2O 的,
不能是浅蓝色。 注意恒重 注意控制脱水温度
准备干燥器时要用干的抹布将内壁和磁板擦抹干净,一般 不用水洗,以免不能很快干燥。放放干燥剂时,干燥剂不要 放得太满,装至干燥器下室的一半就够了,太多容易玷污坩 埚。
开启干燥器时,应左手按住干燥器的下部有右手握住盖的 圆顶,向前小心推开器盖。盖取下时,将盖倒置在安全处。 放入物体后,应及时加盖。加盖时也应该拿住盖上的圆顶推 盖严。当放入温热的坩埚时,应将盖留一缝隙,稍等几分钟 再盖严;也可以前后推动器盖稍稍打开2~3次。搬动干燥器 时,应用两手的拇指按住盖子,以防盖子滑落打碎。
思考题
在水合硫酸铜结晶水的测定中,为什么沙浴加热 并控制温度在280℃左右?
加热后的坩埚能否未冷却至室温就去称量?加热 后的热坩埚为什么要放在干燥器内冷却?
在高温灼烧过程中,为什么必须用煤气灯氧化焰 而不能用还原焰中热坩埚?
为什么要进行重复的灼烧操作?为什么叫恒重? 其作用是什么?
分析天平的使用 沙浴加热 研钵的使用方法 干燥器的准备和使用
由于空气中总含有一定量的水汽,因此灼烧后坩埚和沉淀等, 不能置于空气中,必须放在干燥器中冷却以防吸收空气中的 水分。
干燥器是一种具有磨口盖子的厚质玻璃器皿,磨口上涂着 一薄层凡士林,使其更好地密合,底部放适当的干燥剂,其 上架有洁净的的带孔瓷板,以便放置坩埚和称量瓶等。
五水合硫酸铜结晶水的测定

实验六 五水合硫酸铜结晶水的测定[课时安排] 4学时[实验目的]1、了解结晶水合物中结晶水含量的测定原理和方法。
2、学习研钵、干燥器等仪器的使用和沙浴加热、恒重等基本操作。
[实验原理介绍]很多离子型的盐类从水溶液中析出时,常含有一定量的结晶水(或称水合水)。
结晶水与盐类结合的比较牢固,但受热到一定温度时,可以脱去结晶水分一部分或全部。
CuSO 4·5H 2O 晶体在不同温度下按下列反应逐步脱水:CuSO 4·5H 2O −−→−℃48 CuSO 4·3H 2O +2 H 2OCuSO 4·3H 2O −−→−℃99 CuSO 4·H 2O +2 H 2OCuSO 4·H 2O −−→−℃218 CuSO 4+H 2O 因此对于经过加热能脱去结晶水,又不会发生分解的结晶水合物中结晶水的测定,通常把一定量的结晶水合物(不含吸附水)置于已灼烧至恒重的坩埚中,加热至较高温度(以不超过被测定物质的分解温度为限)脱水,然后把坩埚移入干燥器中,冷却至室温,再取出用电子天平称量。
由结晶水合物经高温加热后的失重值可算出该结晶水合物所含结晶水的质量分数,以及每物质的量的该盐所含结晶水的物质的量,从而可确定结晶水合物的化学式。
由于压力不同、粒度不同、升温速率不同,有时可以得到不同的脱水温度及脱水过程。
[基本操作与仪器介绍]1、沙浴加热,参见第三章三。
2、研钵的使用方法参见附录1。
3、干燥器的准备和使用。
由于空气中总含有一定量的水汽,因此灼烧后的坩埚和沉淀等,不能置于空气中,必须放在干燥器中冷却以防吸收空气中的水份。
干燥器是一种具有磨口盖子的厚质玻璃器皿,磨口上涂有一薄层凡士林,使其更好地密合。
底部放适当的干燥剂,其上架有洁净的带孔瓷板,以便放置坩埚和称量瓶等。
准备干燥器时要用干的抹布将内壁和瓷板擦抹干净,一般不用水洗,以免不能很快干燥。
放入干燥剂的量不能太多,干燥剂不要放得太满,太多容易玷污坩埚。
胆矾结晶水的测定

③加热脱结晶水。加热坩埚, 不用盖盖子,用玻璃棒不断 搅拌,加热到硫酸铜晶体变白 (不要变灰,变灰就是氧化铜了)。 用到的仪器有____________________________
④干燥器内冷却:把装有样品的坩埚马上放到 干燥器中干燥,不盖盖子(切忌不能放在空气 中干燥),干燥好了盖上坩埚盖子。为什么不 能放在空气中干燥_____________________
实验目的:结晶水合物中结晶水含量的测定
实验原理:CuSO4·XH2O △ CuSO4+XH2O 实验流程:
①研磨 ②称量:准确称量一干燥洁净的瓷坩锅质量(m0)。 再称:称量瓷坩埚+硫酸铜晶体的质量(m1) ③加热脱结晶水 ④干燥器内冷却 ⑤再称:在干燥器内冷却后,称量瓷坩埚+硫酸铜粉 末的质量(m2) ⑥重复③~⑤至恒重[再加热脱结晶水→干燥器内再冷 却→再称重] ⑦计算
主要步骤: ①研磨:将颗粒较大的固体研磨成颗粒较小的 固体,方便加热时快速失水。用到的仪器有 _____________
②称重[样品(m1-m0)克]:天平调零后先称干燥 的坩埚包括盖子的质量,记录读数m0,然后在坩 埚中加入硫酸铜晶体盖上盖子,再称量,记录读 数m1。用到的仪器有 ___________量瓷坩埚+硫酸 铜粉末的质量(m2)。 ⑥重复③~⑤至恒重。(恒重:托盘天平,前后 两次重量不相差0.1克可视为恒重。)
⑦计算:根据实验数据计算硫酸 铜晶体中结晶水的质量分数和化学 式中的X值。一般情况,定量实验要 多测几次,求平均值,以减少误差。
【练一练】根据实验室中测定硫酸铜晶体结晶水含量 的实验,填写下列空白。 (1)从下列仪器选出所需仪器________________ (用标 号字母填写)。 (A)托盘天平(带砝码) (B)研钵 (C)试管夹 (D)酒 精灯 (E)蒸发皿 (F)玻璃棒 (G)坩埚 (H)干燥器 (I)石棉网 (J)三脚架 除上述仪器外,还需要的仪器是__________________.
2017年全国卷3-化学大题及解析
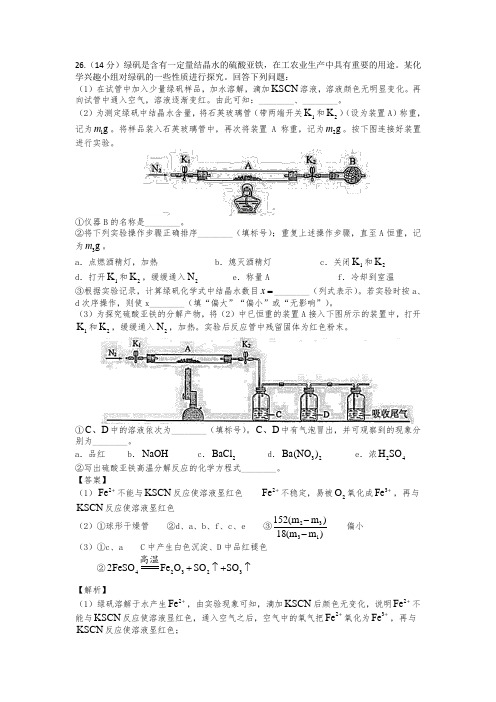
26.(14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。
某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN 溶液,溶液颜色无明显变化。
再向试管中通入空气,溶液逐渐变红。
由此可知:________、________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关1K 和2K )(设为装置A )称重,记为1g m 。
将样品装入石英玻璃管中,再次将装置A 称重,记为2g m 。
按下图连接好装置进行实验。
①仪器B 的名称是________。
②将下列实验操作步骤正确排序________(填标号);重复上述操作步骤,直至A 恒重,记为3g m 。
a .点燃酒精灯,加热b .熄灭酒精灯c .关闭1K 和2Kd .打开1K 和2K ,缓缓通入2Ne .称量Af .冷却到室温③根据实验记录,计算绿矾化学式中结晶水数目x =________(列式表示)。
若实验时按a 、d 次序操作,则使x________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A 接入下图所示的装置中,打开1K 和2K ,缓缓通入2N ,加热。
实验后反应管中残留固体为红色粉末。
①C D 、中的溶液依次为________(填标号)。
C D 、中有气泡冒出,并可观察到的现象分别为________。
a .品红b .NaOHc .2BaCld .32Ba(NO )e .浓24H SO ②写出硫酸亚铁高温分解反应的化学方程式________。
【答案】(1)2Fe +不能与KSCN 反应使溶液显红色 2Fe +不稳定,易被2O 氧化成3Fe +,再与KSCN 反应使溶液显红色(2)①球形干燥管 ②d 、a 、b 、f 、c 、e ③2331152(m m )18(m m )-- 偏小(3)①c 、a C 中产生白色沉淀、D 中品红褪色 ②423232FeSO Fe O SO SO +↑+↑高温【解析】(1)绿矾溶解于水产生2Fe +,由实验现象可知,滴加KSCN 后颜色无变化,说明2Fe +不能与KSCN 反应使溶液显红色,通入空气之后,空气中的氧气把2Fe +氧化为3Fe +,再与KSCN 反应使溶液显红色;(2)①由装置图可知,仪器B的名称是球形干燥管;②实验先打开K1和K2,缓慢通入2N,防止空气中的氧气将绿矾中的2Fe+氧化为3Fe+,一段时间后点燃酒精灯,使绿矾中的结晶水变为水蒸气,熄灭酒精灯,将石英玻璃管冷却至室温后关闭K1和K2,防止空气进入石英玻璃管中,冷却之后称量A,再进行计算得出结论;③由题意可知4FeSO的物质的量为31m m152-mol,水的物质的量为23m m18-mol,由此可以得到绿矾中结晶水的数量2331152(m m)x18(m m)-=-,若先点燃酒精灯再通2N,硬质玻璃管中原有的空气会将绿矾中的2Fe+氧化,造成最终剩余的固体质量偏高,则计算得到的结晶水的数目会偏小;(3)①实验后残留的红色粉末为23Fe O,根据得失电子守恒可知必然有2SO产生,故分解的产物气体中有2SO和3SO,则检验的试剂应选择品红溶液和2BaCl溶液,不能选择32Ba(NO),因为2SO也会与32Ba(NO)产生白色沉淀,由于3SO可溶于品红溶液中,故应先检验3SO,再利用2SO能使品红褪色的原理检验2SO;②由题意可以得到硫酸亚铁分解的方程式为423232FeSO Fe O SO SO+↑+↑高温。
《10.2结晶水合物中结晶水含量的测定(第一课时)》教案

《10.2结晶水合物中结晶水含量的测定(第一课时)》教案松江四中李婉一、设计思路1.教材分析本节课是沪科版《化学》高二年级第一学期第十章“学习几种定量测定方法”第二节“结晶水合物中结晶水含量的测定”第一课时内容。
第十章共有三个定量实验:“测定1mol气体的体积”“结晶水合物中结晶水含量的测定”“酸碱滴定”,其中“测定1mol气体的体积”是拓展型课程内容,因此“结晶水合物中结晶水含量的测定”就成为本章的第一个定量实验,是学生学习定量测定方法的第一课,也是学生学习的第一种定量测定方法——重量法。
因此,本节课设计思路:既然是第一课,那么本节课的任务是带领学生进入定量测定实验的殿堂,在完成本节课后对定量实验的核心——“精准性”留下深刻的印象。
教学设计让学生在测定物质组成的过程中,始终围绕着“精准性”徐徐展开内容,感受“精准性”在定量测定中的意义和价值,为后面学习“中和滴定”和拓展型课程中的“气体摩尔体积的测定”、“小苏打中碳酸氢钠的含量测定”打好基础。
2.教学基本要求分析《上海市高中化学学科教学基本要求》中指出:高中阶段共学习5个定量实验,按基础性课程和拓展型课程的顺序,分别是“配制一定物质的量浓度的溶液”、“结晶水合物中结晶水含量的测定”、“中和滴定”、“气体摩尔体积的测定❃”、“小苏打中碳酸氢钠的含量测定❃”。
其中对“结晶水合物中结晶水含量的测定”的学习水平要求:知识水平C级,技能水平C级;即知识达到运用层面,能将所学内容应用到新的情境中,并用于解决简单的问题;技能达到设计层面,能根据具体情境的需要,选择、组合相关实验操作,解决问题。
虽然,在高一年级学习“配制一定物质的量浓度的溶液”时初次接触了定量实验,但对定量实验的“精准性”核心只有一个模糊的印象,技能水平也只要求达到B级:能规范、熟练地完成某种操作的水平。
而本节课要在其基础上,技能水平有所提高,要求达到C级设计水平;但是在具体要求一栏的描述中,并没有出现设计方案四个字,而是解释实验原理、复述恒重操作要点的概念和操作要点、描述实验步骤、归纳仪器使用要点。
结晶水合物中结晶水含量的测定

三.实验步骤
(1)研磨:在研钵中将硫酸铜晶体研碎
(2)称量:准确称量一干燥洁净的瓷坩锅质量(m0) (3)再称:称量瓷坩埚+硫酸铜晶体的质量(m1)
(4)加热灼烧:加热瓷坩埚(边加热边搅拌)至蓝色晶体 全部变为白色粉末 (5)干燥冷却:并放入干燥器中冷却 (6)称量并进行恒重操作:再加热,再冷却,再称重,直到 两次称量误差不得超过0.001g(结晶水已经完全分解), 称量瓷坩埚+硫酸铜粉末的质量(m2)
X —— 实际的测定值
实验误差分析:
m(CuSO4) m( H 2O) ∶ 1 x ∶ M (CuSO4) M ( H 2O)
1、加热温度过高或时间过长,固体部分变为黑色
偏大
2、加热时搅拌不当使晶体溅出坩燥
偏大
4、晶体试样受潮
偏大
5、加热温度过低固体未完全变白
二.实验仪器、药品
研钵、电子天平、坩埚、坩埚钳、药匙、
泥三角、酒精灯、玻璃棒、 干燥器(共用)、 三脚架(或带铁圈的铁架台)
四.数据处理及误差分析
160(m1-m2) X= 18(m2-m0)
m1-m2—表示失去的水的质量 m2-m0 —表示无水硫酸铜质量
5—x 相对误差= 5 绝对误差=5 — x ×100%
CuSO4· 2O在受热时逐步发生的反应: 5H
CuSO4
白色
650℃ -SO2
CuO
黑色
在室温时:
CuSO4 + 5H2O → CuSO4· 2O 5H
一.实验原理
m(CuSO4)
=
m(H2O)
=1︰X
M(CuSO4) M(H2O)
【思考】
1.加热晶体前为什么要研细晶体? 2.加热过后就直接放到电子天平上称量吗? 3.冷却时要注意什么,结合之前给出的信息 回答? 4.实验过程中至少需要称量几次?为什么? 为什么要恒重操作?如何进行恒重操作?
高二化学第十章结晶水合物中结晶水的测定教师版

加热时间过长,部分变黑
减小
偏小
加热后在空气中冷却称量
减小
偏小
加热过程中有少量晶体溅出
减小
偏大
两次称量相差0.2 g
减小
偏小
二、真题解析Байду номын сангаас
【例1】下列关于“硫酸铜晶体中结晶水含量的测定”操作中,肯定使测定结果偏大的是( )
(A)加热时硫酸铜晶体未完全变白(B)加热时硫酸铜晶体有爆溅现象
(C)加热后硫酸铜晶体放在空气中冷却(D)未作恒重操作
三、课堂练习
1.下列关于硫酸铜晶体中结晶水含量的测定中,可能使结果偏大的是( )
(A)加热温度过高,有黑色固体生成(B)未作恒重操作
(C)晶体溅出(D)加热后,晶体没有在干燥器中冷却
2.某学生进行硫酸铜晶体中结晶水含量测定实验,得到实验数据如下:
次序
瓷坩埚质量(g)
瓷坩埚和硫酸铜晶体质量(g)
瓷坩埚和硫酸铜质量(g)
③从下列分析中得知该学生产生误差的原因可能是________。
(A)加热前称量时,容器未完全干燥
(B)最后两次加热后的质量相差较大(大于0.1 g)
(C)加热后,容器未放入干燥器中冷却
(D)加热过程中晶体有少量溅失
8.下列使用托盘天平的操作中,错误的是( )
(A)称量时,左盘放被称物质,右盘放砝码
(B)托盘天平可称至0.01 g
a.__________________________________________________________________
b.验证CuO的化学性质没有改变。
6.无水氯化铝是白色晶体,易吸收水分,在178℃升华。装有无水氯化铝的试剂瓶久置潮湿空气中,会自动爆炸并产生大量白雾。氯化铝常作为有机合成和石油工业的催化剂。并用于处理润滑油等。工业上由金属铝和氯气作用或由无水氯化氢气体与熔融金属铝作用而制得。
三大实验--结晶水合物中结晶水含量的测定解读

1.550
2.334
0.950
1.354
用表格数据计算X值;第一次: 5.45 ,第二次: 5.16 ,平均值: 5.31
实验误差=
= 6.1%
尽可能多的找出实验误差的原因
(1)加热要充分但不“过头”(加热不充分,硫酸铜晶体没有完 全分解;加热温度过高CuSO4也分解)要进行恒重操作
(2)称量读数要正确 (3)加热时搅拌不当使晶体溅出坩埚外或被玻璃棒少量带走 (4)硫酸铜晶体研碎 (5)晶体加热后一定要将坩埚放在干燥器中冷却
加热坩埚需要垫石棉网吗?
✓ 不需要,坩埚可直接加热,但要放在泥三角上加热
加热时为什么要不断搅拌?
✓ 防止局部过热造成晶体飞溅,实验结果偏大.搅拌时需 用坩埚钳夹住坩埚,防止跌落
四、实验步骤
❖ 学生讨论
加热到何时可以停止加热?
加热结束后为什么要冷却后称量?为什么 要放在干燥器中冷却?
✓ 温度较高时称量会损坏天平;在空气中冷却会又吸 收空气中的水蒸气,影响测定结果.
准确称量瓷坩埚+无水硫酸铜的质量
(5)恒重操作:再加热,再冷却,再称重,直到
两次称量误差不得超过0.001g,
称量瓷坩埚+硫酸铜粉末的质量(m2)
(6)计算:根据实验测得的结果 计算硫酸铜晶体中结晶水X。
x
m1 m2 m2 m0
160 18
实验步骤
1.研磨 在研钵中将硫酸铜晶体研碎。 注意事项:加热前,一定要把硫酸铜晶体
CuSO4·xH 2O ol
加热晶体至晶体完全失去结晶水,固体前后质量差就
是结晶水的质量。计算公式:
m H2O x nH 2O 18 160mH2O
nCuSO4 mCuSO4 18mCuSO4 160
高二化学第十章结晶水合物中结晶水的测定教师版(DOC)

学科教师辅导讲义年 级:高二 辅导科目:化学 课时数:3 课 题结晶水合物中结晶水的测定教学目的1、 理解结晶水含量测定的原理。
2、 掌握恒重操作。
3、 理解测定值与理论值有偏差的原因。
教学内容一、 知识梳理 (一)实验原理1.原理:称取一定质量的硫酸铜晶体,将其加热失去全部结晶水后再进行称量,可知道硫酸铜晶体中硫酸铜的质量和水的质量,然后根据硫酸铜和水的摩尔质量计算1 mol 硫酸铜晶体中含多少摩尔结晶水:即4242()():1:()()m CuSO m H O x M CuSO M H O =2.CuSO 4·5H 2O 受热时逐步失去结晶水的过程可表示如下:42CuSO 5 H O • 蓝色21022H O -−−−→℃CuSO 4·3H 2O 21132H O-−−−→℃42CuSO H O • 蓝白色2250H O-−−−→℃4CuSO 白色在250℃以下,CuSO 4·5H 2O 失掉的结晶水是全量的4/5,剩下的1个水分子需要在较高的温度下才能失去。
(二)实验仪器和装置1.瓷坩埚、坩埚钳、泥三角。
瓷坩埚(图(A))用于加热或灼烧固体物质,加热、灼烧时应放在泥三角(图(B))上进行,如图(D)所示。
热的瓷坩埚及坩埚盖取放时要用坩埚钳(图(C))。
2.干燥器。
干燥器(图(E))用于保存干燥的物质。
由普通厚玻璃制成,内有带孔瓷板,玻璃盖与容器应与 磨砂面保持吻合。
容器内下部装有干燥剂(如无水氯化钙、碱石灰、浓硫酸等)。
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号) 。
(A)被测样品中含有加热不挥发的杂质(B)被测样品中含有加热易挥发的杂质(C)实验前被测样品已有部分失水(D)加热前所用的坩埚未完全干燥5.某化学实验小组欲制取氧化铜并验证氧化铜能加快氯酸钾的分解,进行了如下实验:(1)制取氧化铜a.称取2 g CuSO4·5H2O在(填仪器)中研细后倒入烧杯,加10mL蒸馏水溶解。
10.2结晶水合物中结晶水含量的测定

(3)加热
将盛有硫酸铜晶体的坩埚放在三脚架上的泥三角上, 用酒精灯缓慢加热,同时用玻璃棒轻轻搅拌硫酸铜晶 体,直到蓝色硫酸铜晶体完全变成白色粉末,且不再 有水蒸气逸出。 C 温度不能过高。CuSO650 CuO+SO3 4 酒精灯外焰400—500C 玻璃棒搅拌,防止晶体飞溅(局部过热,晶体飞溅)
脱水后的硫酸铜粉末具有很强的吸水性,为了防止其 吸收空气中的水蒸气,应放在干燥器中冷却。 干燥器是一种具有磨口盖子的厚质玻璃器皿, 磨口上涂着一薄层凡士林,使其更好地密合,底 部放适当的干燥剂硅胶(蓝色,吸水后变成红色), 其上架有洁净的带孔瓷板,以便放置坩埚等。
(4)冷却 —干燥器中
(5)再称量
测定物质的组成,确定其化学式是定量实验的 重要内容之一。硫酸铜的化学式是CuSO4, 硫酸铜晶体中带有结晶水,本节将通过实验确 定其化学式为CuSO45H2O,体验化学是怎样 探求物质组成的奥秘。
10.2结晶水合物中结晶水含量的测定
1.实验目的 测定结晶水含量 2.实验原理 CuSO4xH2OCuSO4+xH2O 1mol xmol
称取一定质量的硫酸铜晶体,将其加热失去全部结晶水 后再进行称量,就可以得到硫酸铜的质量和结晶水的质 量。再根据各自的摩尔质量,就可以求出物质的量。 1mol xmol m(CuSO4) m(H2O) M(CuSO4) M(H2O) M(CuSO4)m(H2O) x= M(H O)m(CuSO ) 2 4
3.仪器、药品
电子天平、研钵、酒精灯、坩埚、坩埚钳、泥三角、 玻璃棒、干燥器。 硫酸铜晶体(CuSO4•xH2O)。
4.实验步骤 (1)研磨 加热前,先把硫酸铜晶体在研钵中研碎,使晶体受 热均匀,防止飞溅(防止加热时局部过热导致晶 体飞溅) (2)称量 (精确到0.001g) 称量坩埚(m0)的质量。 称取2.000g已经研碎的硫酸铜晶体, 记下坩埚+CuSO4•xH2O(m1)的总质量。
文档:结晶水的测定

结晶水合物中结晶水含量的测定[考纲要求]1. 结晶水合物中结水含量的测定原理;2.瓷坩埚、研钵、干燥器等仪器的正确使用;3.恒重等基本操作技能;4.按操作程序分析操作不当引起实验误差的技能。
分点清理查漏补缺考点一:结晶水合物中结晶水含量的测定【基础再现】一、硫酸铜晶体的组成、性质及用途五水硫酸铜俗称胆矾、蓝矾。
是一种结晶水和物其化学式为:CuSO4·5H2O,是一种蓝色固体,其水溶液为蓝色,固体受热时变为白色粉末,硫酸铜水溶液能杀菌消毒,游泳池里水变蓝是放了硫酸铜的缘故。
用作纺织品媒染剂、农业杀虫剂、水的杀菌剂,饲料添加剂,并用于镀铜。
我国劳动人民很早就认识了铜盐,在汉代许多著作里有记载“石胆能化铁为铜”,晋葛洪《抱朴子内篇·黄白》中也有“以曾青涂铁,铁赤色如铜”的记载。
这是我国劳动人民发明的水法炼铜,即用铁把铜盐溶液里的铜置换出来,它成为湿法冶金术的先驱,在世界化学史上占有光辉的一页。
在欧洲,湿法炼铜出现比较晚。
15世纪50年代,欧洲人把铁片浸入硫酸铜溶液,偶尔看出铜出现在铁表面,感到十分惊讶,更谈不上应用这个原理来炼铜了。
二、结晶水含量测定的原理化学反应CuSO4· xH2O CuSO4 + xH2O所测数据:硫酸铜晶体质量m1,无水硫酸铜质量m2CuSO4·xH2OCuSO4+xH2O160+18x 160 18xm 1g m2g (m1-m2)g(160+18x) :160 = m1 :m2或 160 :18x = m2:( m1-m2)计算公式三、测定硫酸铜结晶水含量的实验方案设计请完成下列设计:1.实验设计思路测定目标——求x值化学反应——与x有关确定测量值确定实验操作计算公式实验仪器实验步骤注意事项2.实验步骤(1)研磨:在研钵中将硫酸铜晶体研碎。
(2)称量:准确称量一干燥洁净的瓷坩锅质量(m1)。
(3)再称:称量瓷坩埚+硫酸铜晶体的质量(m2)。
10.2-1结晶水含量测定的原理及恒重操作报告

目标与要求 准备与导入 探究与深化
练习与评价 回顾与小结 作业与拓展 资源与链接
10.2-1结晶水含量测定的原理 及恒重操作
目标与要求 准备与导入 探究与深化
练习与评价 回顾与小结 作业与拓展 资源与链接
教学目标
学习要求
目标与要求 准备与导入 探究与深化
练习与评价 回顾与小结 作业与拓展 资源与链接
160(m1-m2) X= 18m2
探究一 探究二 探究三 探究四
目标与要求 准备与导入 探究与深化
练习与评价 回顾与小结 作业与拓展 资源与链接
〔探究与深化一〕
(5-4)
一、结晶水含量测定的原理
n(CuSO4) = n(H2O) m(CuSO4)/M(CuSO4) m(H2O)/究一
探究二
探究三
探究四
目标与要求 准备与导入 探究与深化
练习与评价 回顾与小结 作业与拓展 资源与链接
〔探究与深化一〕
(5-3)
讨论
依据以上原理,请你初步设计一个确定硫酸 铜晶体化学式的实验步骤。
1、称量CuSO4· xH2O (m1g) 2、在坩埚中加热分解 3、冷却 4、称量CuSO4 (m2 g) 5、计算 m2 160 m(H2O)=(m1-m2)g (m -m ) : 1 2 =1:x 18
情感态度与价值观
通过实验方案的讨论,体验实事求是、严肃认真、一丝不苟 的科学态度在定量测定实验中的意义。
教学目标
目标与要求 准备与导入 探究与深化
学习要求
练习与评价 回顾与小结 作业与拓展 资源与链接
〔学习要求 〕
1.掌握结晶水合物中结晶水含量的测定原理,学 会测定硫酸铜晶体中结晶水含量的方法。 2.初步学会瓷坩埚、研钵、干燥器等仪器的使用, 学会使用瓷坩埚的灼烧技能。 3.理解和学会恒重等基本操作技能。
结晶水含量测定

四、实验步骤
4.冷却:将坩埚放在干燥器里冷却。 4.冷却:将坩埚放在干燥器里冷却。 冷却 5.称量 坩埚+无水硫酸铜的质量( 5.称量:坩埚+无水硫酸铜的质量(m3)。 称量: 6.恒重: 6.恒重:m4。 恒重 7.计算 化学式中n的实验值。 7.计算:化学式中n的实验值。 计算:
“四称”、“两热” 四称” 四称 两热”
需测定的量 m(CuSO4) M(CuSO4) ∶ m(H2O) M(H2O) = 1∶n ∶ 固定值
怎样测定水的质量? 怎样测定水的质量?
用浓硫 酸吸水
用碱石 灰吸水
将水冷凝 将水冷凝
实际实验中水的质量是间接计算出来的。 实际实验中水的质量是间接计算出来的。 CuSO4·nH2O的质量 的质量 CuSO4的质量
怎样知道硫酸铜晶体中的水已全部被加热失去呢? 怎样知道硫酸铜晶体中的水已全部被加热失去呢? 恒重操作(两次加热,两次称重, 恒重操作(两次加热,两次称重,两次称重 的结果相差不超过0.001g) 的结果相差不超过 )
如某次实验,两次称重的结果如下: 如某次实验,两次称重的结果如下: 第一次: 第一次:25.678 g 第二次: 第二次:25.432 g 用哪次称重结果作为计算依据? 用哪次称重结果作为计算依据? 强调:一定要最后两次的称重结果相差不超过 强调: 0.001 g。 。
102结晶水合物中结晶水含量的测定硫酸铜晶体结晶水含量的测定定量实验方法重量法?现有某硫酸铜晶体cuso4nh2o如果要求出该晶体中结晶水如果要求出该晶体中结晶水n的值应根据什么原理来进行测定呢
定量实验方法——重量法 重量法 定量实验方法
10.2结晶水合物中结晶水含量的测定 结晶水合物中结晶水含量的测定 ——硫酸铜晶体结晶水含量的测定
三大实验--结晶水合物中结晶水含量的测定

⒌恒重操作:在干燥器内冷却后,称量瓷坩埚+硫酸 铜粉末的质量(m2),直至连续两次称量结果相差不 超过0.001 g ;
⒍另取硫酸铜晶体,再作一次测定;
⒎数据处理、误差分析、完成实验报告。
测定值与理论值有偏差的原因:
阅读:P55/测定值与理论值有偏差的原因
思考:
/P55
② 在坩埚中加入一定量的硫酸铜晶体试样,称重,将称量的试样放入研
钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。
重复本操作,直至连续两次称量的质量差不超过0.1g为止;
硫酸铜晶体的质量(m1—m0) 无水硫酸铜粉末的质量(m2—m0)
结晶水的质量(m1—m2)
质量(g)
第一次
第二次
44.520 44.670
47.020 48.358
46.070 47.004
2.500
3.688
1.550
2.334
0.950
1.354
用表格数据计算X值;第一次: 5.45 ,第二次: 5.16 ,平均值: 5.31
:①研磨;②称量空坩埚和装有试样的坩埚质量;③加
热;④冷却;⑤称量;⑥重复③~⑤的操作,直至连续
两次称量的质量差不超过0.001 g为止;⑦根据实验数据
计算硫酸铜晶体中结晶水的含量。请回答下列问题:
⑴现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥
器、药匙等实验用品,进行该实验时,缺少的实验用品
三大实验--结晶水合物中结晶水含 量的测定
【doc】例析有关结晶水合物的计算

例析有关结晶水合物的计算理科考试研究?综合版,2003年11月1日其大小为0.58×10-3l【g×9.8N/l【g.因同一气球在相同条件下充满不同气体所受的浮力是相等的,故充满某气体后连同气球的实际质量应为35.53g+0.58g=36.11g气球中某气体的质量为36.1lg一35.23g=0.88g0.64g:—3—20.88gMMr=44正确答案为(B)和(C).例2已知NI寸与HCHO在水溶液中发生的反应为4寸+6HCHO一(Q乇)6N4+4H+6H2O现有一失去标签的铵盐,为测定其含氮量,称取2g样品溶于水,加入足量的HCHO溶液,配成100mL溶液,再从中取出10mL,滴入酚酞后再逐滴加入0.1mol/LNaOH溶液,当滴到25mL时溶液呈粉红色,且半分钟内未褪去.求该铵盐中氮的质量分数.解析某杂志上对该题的解答为:设该铵盐中氮元素的质量为,则依关系式OH一~H~Ⅲ~Nlmol14g0.1×0.025×10tool可解得=0.35g.该铵盐中氮的质量分数为(N):×100%:17.5%二稍加思考后不难发现,所有常见铵盐中均没有氮的质量分数为17.5%的.错在哪里呢? 错在该解法没有挖掘出题中的隐含信息,即铵盐中除氨根中含有氮外,酸根中也可能含有氮,随之可想到常见铵盐中的NH,NCh,其中训(N)=17.5%×2=35%综上所述,隐含信息有着令人瞩目的解题功能.若能及时挖掘出题中的隐含信息,则对活化思维,提高解题技巧,培养思维品质都将大有裨益.例析有关结晶水合.物的计算湖南省长沙市二十一中(410007)邵国光一,计算晶体中的结晶水或失去的结晶水例1某学生用加热的方法测定磷酸二氢钙结晶水合物中的结晶水.他称出口g结晶水合物置于坩埚中加热,加热时因温度偏高而导致磷酸二氢钙分解,结果得到了6g无水偏磷酸钙.他经过一番思考后,没有重做实验就算出了结晶水的分子数,而且得到了老师的肯定.该结晶水分子数,z的正确计算式是() (A)(B)(cl19a-234b(D)解析Ca(H2Po4)2?H2O分解的化学方程式和相关数据为ACa(H2PO4)2-,lH2O—Ca(P)2+(,z+2)I-I2O19818(,l+2)ba—b'198:b=18(,l+2):(口一b)解之,:.U例2在170"(3,生石膏可以失去部分结晶水而生成熟石膏,当生成1.5tool熟石膏时生成的水为()(A)1.5tool(B)2.25mot(C)3mol(D)4.5mol解析根据化学方程式2003年11月1日理科考试研究?综合版2(Ca,.qD4.2H2o)2.H2o+3H2o可知,生成1tool熟石膏时可得3tool水,生成1.5tool熟石膏时应生成4.5mo1.二,计算所需溶剂水的量例t'C时CA.ISO4在水中的溶解度为25g.将32gC_,uSO4白色粉末加入mg水中形成饱和CI.1SO4溶液时有CKISO4?5H2O晶体析出.m的取值范围是()(A)18gK-m≤128g(B)36g<<180g(C)18g<m<128g(D)36g~m≤180g解析£℃时若32gC,uSO4恰好形成饱和溶液时,需水的质量为m,则=,m=128g.若32gC_,uSO4恰好全部形成CaSO4?5H2O,则需水.18g.答案为(C).三,计算从饱和溶液中析出无水物的质量例某温度下某盐饱和溶液的质量分数为a%.取一定量的此饱和溶液,向其中加入wg该无水盐,在温度不变的情况下析出mg 含一定结晶水的该盐晶体.从饱和盐溶液中析出的溶质的质量为——g.解析温度一定时向该盐的饱和溶液中加wg该无水盐,不溶解,该盐必以结晶水合物从溶液中析出,析出后的溶液还是饱和溶液, 被减少的饱和溶液的质量为(m一伽)g,从饱和溶液中析出的溶质的质量为(一)口%g.四,计算析出的结晶水合物的质量例1(1994年全国高考题)在一定温度下,向足量的Na2033饱和溶液中加入1.06g 无水Na2CO3,搅拌后静置,最终所得晶体(Na2CO3?10H2O)的质量为()(A)10.6g(B)2.46g(C)2.86g(D)大于2.86g解析向Na2CO3饱和溶液中加入1.06g无水Na2CO3,会析出晶体(Na2CO3?10H2O): Na2CO3+10H2O—Na2O0'10H2O1061.06g28.6g从饱和溶液中析出晶体,必使原溶液中的水量减少,从而又使晶体析出,导致析出的晶体大于2.86g.选(D).例2已知20℃时CLISO4的溶解度为21g.在20*(2时取无水Ca.k.~4粉末,与水以等质量相混合,此时产生的现象是——.若容器中还有未溶固体,则该固体与所加无水C-A.K~4 粉末的质量比为——.懈析设无水CuSO4粉末与水的质量均为mg,析出的CuSO4?5H2O为xg,则根据溶解度的计算公式得21:100:(优一优一)解之,.7g:m:7:5,产生的现象是得到了蓝色溶液和蓝色晶体.五,计算加入的无水物的质量例15℃时,MgSO4饱和溶液中溶剂和溶质的质量比为3:1.在温度不变的条件下,要从足量的此饱和溶液中析出2.46gMgSO4?7H2O,需向溶液中加入——g无水MgSO4.解析设需加入口g无水~4gSO4,则被减少的饱和溶液的质量为(2.46一a)g.利用2.46gMgSO4?7H2O中MgSO4的质量等于被减少的饱和溶液中MgSO4的质量与加入的无水MgSO4的质量之和得口+(2.46_口)×1-2.46×解之,a=0.78(g).六,计算无水物的溶解度或质量分数例1某温度下,向一未饱和的Na~SO3溶液中加入20g无水Na2S03或加入50gNa2SO37H2O晶体,都恰好使溶液达到饱和.N~SO3在此温度下的溶解度为——.解析本题宜采用?隔离法求解.因在50gNa2003?7H2O中N~SO3的质量为50×126=25(g)60?理科考试研究?综合版2003年11月1日.的质量为50×=25(g)从25gNa2SO3中取20g溶于未饱和溶液中可达到饱和,故剩下的5gN2SCh溶于25g水中也得饱和溶液.设该温度下Na2so3的溶解度为S,则S:100=5:25,解之,S=20g.例2在25℃时,将两个铜电极插入一定量的Na2SO4饱和溶液中进行电解,通电一段时间后阴极上析出了atool气体,同时有wgNa2SO4?10I-I2O晶体析出.若温度不变,则剩余溶液中溶质的质量分数为——.若上述数据不变,将铜电极换成铂(Pt)电极,则剩余溶液中溶质的质量分数为——.解析电解时阳极的反应为Cu一2eCu2阴极的反应为2H+2eH2十电解的总化学方程式为Cu+2H2oCu(oH)2J,+H2十因阴极上析出了amolH2时水被电解了2atool,故剩余溶液中溶质的质量分数为.1....4....2.....w—.322×100%=%若将铜电极换成铂电极,则阳极反应为4OH一一4e~2H2o+02十阴极反应为2H+2eI42十电解的总化学方程式为2H20~ggg2H2十+o2十阴极上析出amolH2时水被电解了amol,同理可求得剩余溶液中溶质的质量分数为7100硼,丙'例3某温度下,Na2Co饱和溶液的质量分数为a%,向其中加入mmoLNa2(]03?5H2O 或nmolNa2CO3时都可析出相同质量的Na~O33?10O.下列叙述中正确的是()(A)a%可能为40%,m一定大于gt(B)口%可能为40%,m可有大于,等于,小于gt(C)a%可能为30%,m一定大于gt(D)a%可能为30%,优可能大于,等于,小于gt解析由题意可知m>gt.因在晶体Na2CO3?10I-I2O中N~CO3的质量分数为106x100%<40%故在Na203饱和溶液中%不可能为._3.a40%应选(C).七,判断加入无水物后溶液的变化情况例向某CuSO4饱和溶液中加入xg含坞.的无水CAk.,qO4粉末,如果保持温度不变,则其结果是()(A)无水CuSO4不再溶解,xg粉末不变03)溶液中含有坞.的S一,且白色粉末变为蓝色晶体,其质量大于xg(c)溶液中含有坞.的s一,且白色粉末变为蓝色晶体,其质量等于xg(D)溶解平衡被破坏,达到平衡时有部分含坞.的s一进入溶液,固体粉末的质量小于xg解析因溶解平衡是动态平衡,故溶液中含有坞.的s一,加入的xg无水CAISO4粉末会以CuSO4?5I-I2O晶体析出,白色粉末变为蓝色晶体,其质量大于xg.答案为(B).八,判断差量的意义例向t*C的饱和r%co~溶液中加入ag无水Na2CO3,可析出6g晶体(Na2∞?1OH2o).(b—a)的值表示的意义是——.解析Na2033将不再溶解.析出bgNa2CO3?10H2O晶体后剩余的溶液还是饱和溶液.(b—a)g为减少的饱和溶液的质量.九,判断溶液是否饱和例在一定温度下,向一定量的ClaSO4溶液中加入25g无水CuSO4时从溶液中析出了.2003年l1月1日理科考试研究?综合版25gCu,-qO4?5H2O晶体.(1)原溶液是否饱和?(2)在该温度下,要使原溶液成为饱和溶液,应蒸发掉——g水,同时还应加入——g无水CAl,~4(若原溶液饱和,此问可不答).解析(1)析出的25gCuSO4?5H2O中CAJ~4的质量为25×=16gH2o的质量为25X90=9g,即溶解的无水CAISO4的质量为25g一9g=16g,从溶液中减少的水的质量为9g,可见,原溶液是不饱和溶液. (2)由前面的计算可知,要使原溶液成为饱和溶液,应蒸发掉9g水,同时应加入16g无水CAJ~4.十,根据图像计算例下图是无水NaESO4的溶解度曲线,曲线在变化过程中有转折点A,A点表示在32.4"C以下饱和溶液与未溶的Na2504?10H2O 处于平衡状态,而在这个温度以上时则为无水Na2SO4的溶解度曲线.试通过计算回答下列问题:(℃)(1)取322gNaESO4?10H2O,放入烧杯中用水浴加热,在32.4"C时Na2SO4?10H2O变成无水Na2SO4和水,进一步升高温度,保持在80℃时在未溶解物中无水盐的质量为——g.(2)取143g80"C的Na2504饱和溶液,冷却到20"C时能析出Na2504?10H2O晶体——g.解析(1)322gNa2SO4'10H2O中Na2SO4的质量为142g,H2O的质量为180g. 设80"(3时未溶解的Na2SO4为g,则由溶解度曲线可得100:43=180:(142一SC)解之,SC=64.6(g).(2)在32.4"C以下,饱和溶液与未溶的Na2SO4?10H2O处于平衡状态.设冷却到20"C 时能析出Na2SO4?10H2O晶体Yg,则根据溶解度曲线得(100+19):19=(143:(43一)解之,Y=71.6(g).十一,确定结晶水合物中金属的原子量例将某二价金属R投入200mLffmot?LI1的稀H2SO4中,放出H2并生成RSO4.充分反应后,滤去未反应的金属,然后将溶液蒸发浓缩.当蒸发到留下140g溶液时保持温度为t*C.开始析出RSO4?7H2O晶体.当析出的晶体为20.5g时还留下溶液105g.求:(1)金属R的原子量;(2)t时无水RSO4的溶解度.解析(1)因硫酸完全反应,故生成的RSO4的物质的量等于硫酸的物质的量,即n(RSO4)=n(H2SO4)=0.2L~tool?LI1=由题意得105g饱和溶液中含RSO4号×=0.25(mo1)析出的RSO4?7H2O为{mol一0.25mol=molj上设R的原子量为A,则有(A+96+126)X壶20?5解之,A=24.(2)设t*C时RSO4的溶解度为S,则有s:(100+S)=(120X÷):140解之.S=40(g).。
结晶水合物

有关结晶水合物的计算1、在30℃时,43.07克水里达到饱和时能溶解19.6克胆矾,求在30℃时硫酸铜的溶解度?2、60℃时硫酸铜的溶解度为40克。
60℃时配制420克饱和硫酸铜溶液,应称取多少克胆矾,加多少克水?3、在足量的20℃硫酸铜饱和溶液中,加入2克无水硫酸铜,应有多少克晶体析出?(20℃时,硫酸铜溶解度为20克)4、将20℃时一定量的饱和硫酸铜溶液,加热蒸发,再冷却到20℃,称其质量发现少了30克。
问此时有多少克晶体析出?(20℃时,硫酸铜溶解度为20克)5、20.0克CuO溶于123.5克温热的20%硫酸溶液,冷却到20℃时能从溶液中析出多少克晶体?(20℃时,硫酸铜溶解度为20.7克)有关温度差时溶液的计算:6、将100℃的硫酸铜饱和溶液200克加热蒸发掉50克水后,再冷却到0℃,问能析出多少克胆矾晶体?(100℃时,硫酸铜溶解度为75.4克;0℃时,硫酸铜溶解度为14.3克)7、把60℃时硝酸钾的饱和溶液84克冷却到20℃,有多少克晶体析出?(60℃时,KNO3溶解度为110克;20℃,KNO3溶解度为30克)8、把60℃时硝酸钾的饱和溶液84克加热蒸发20克水后,再冷却到20℃,有多少克晶体析出?(60℃时,KNO3溶解度为110克;20℃,KNO3溶解度为30克)9、使Wg某结晶水合物A· nH2O受热失去全部结晶水后,质量变为Mg,由此可以得知该结晶水合物的分子量结晶水合物的析出●难点磁场请试做下列题目,然后自我界定学习本篇是否需要。
t℃时向a g饱和Na2CO3(aq)中加入1.06 g无水Na2CO3,搅拌后静置,冷却到原温度,结果溶液全部变为晶体(Na2CO3·10H2O)。
求:(1)S(Na2CO3)与a的关系式,S=_____________(S代表溶解度)。
(2)a的取值范围。
●案例探究[例题]已知某温度下,无水Na2CO3的溶解度是10.0 g/(100 g水)。
【精品】结晶水含量的测定

Evaluation only. ted with Aspose.Slides for .NET 3.5 Client Profile 5.2 Copyright 2004-2011 Aspose Pty Ltd.
实验步骤
所需仪器
注意
研钵 实 1. 研磨 坩埚 电子天平 ⒉ 称量晶体 验 酒精灯、铁架 步 Evaluation only. ⒊加热 ted骤 with Aspose.Slides for 台、铁圈、泥 .NET 3.5 Client Profile 5.2 三角、玻璃棒 Copyright 2004-2011 Aspose Pty Ltd. 设 干燥器 ⒋冷却 计
思考二:没有坩埚可用什么仪器 代替?实验步骤如何?
可用试管和试管夹代替来做,步骤如下:
①用天平准确称量出干燥试管与 CuS04· xH20 Evaluation only. 的质量 ted with Aspose.Slides for .NET 3.5 Client Profile 5.2 ②用酒精灯缓慢加热至晶体完全变白 Copyright 2004-2011 Aspose Pty Ltd. ③待试管冷却后,在天平上迅速称出试管和 CuS04的质量。 ④加热,再称量,至两次称量误差不超过 0.001g为止。
尽可能多的找出实验误差的原因
80 m(H2O) x= 9 m(CuSO4)
用电子天平称量读数至0.01g 无法判断 坩埚水洗后未干燥 偏高 加热至白色出现即停止 偏低 Evaluation only. 加热至仍有淡蓝色即停止 偏低 ted加热至灰黑色出现 with Aspose.Slides for .NET 3.5 Client偏高 Profile 5.2 Copyright 2004-2011 Aspose Pty Ltd. 加热时有晶体溅出 偏高 偏高 加热时温度过高 晶体在空气中冷却 偏低 偏低 晶体中含受热不分解的杂质 晶体中含受热完全分解为气体的杂质 偏高
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
10.3结晶水合物中结晶水的测定习题
知识回顾
1为了保证硫酸铜晶体加热后,全部结晶水都失去,必需做恒重操作,即在完成第一次 、 、 后,再进行第二次 、 、 ,如果第二次的质量在减小,还要做第三次,直到 为止。
2加热后的硫酸铜晶体必须放在 中冷却到 ,否则在冷却过程中又会吸收空气中的水蒸气,影响测量结果。
习题检测
1.胆矾中结晶水含量测定的实验,不必使用的仪器是 ( )
(A)坩埚 (B)天平 (C)干燥器 (D)量筒
2.以下关于坩埚的使用,错误的是 ( )
(A)加热时,应把坩埚放在泥三角上 (B)取放、移动坩埚时应使用坩埚钳
(C)坩埚加热时,要盖住坩埚盖不留空隙 (D)热的坩埚放在桌面上应垫有石棉网
3.在胆矾晶体中结晶水含量测定中,必须用天平测定的质量是 ( )
①胆矾的质量 ②无水CuSO 4的质量 ③瓷坩埚的质量 ④结晶水的质量 ⑤瓷坩埚 + 胆矾的质量 ⑥瓷坩埚+无水CuSO 4的质量
(A)①和② (B)①和④ (C)③、⑤和⑥ (D)①、⑤和⑥
4.取某结晶水合物(A ·nH 2O)p g ,加热使结晶水全部失去后,质量变为q g ,由此可以得知该结晶水合物的相对分子质量为 (
)
5.实验室里需要480 mL ,0.1 mol/L 的硫酸铜溶液,现选取500 ml 。
容量瓶进行配制,以下叙述正确的是 ( )
(A)称取7.68 g 无水硫酸铜,加入500 mL 水
(B)称取12.0 g 胆矾配成500 mL 溶液
(C)称取8.0 g 无水硫酸铜,加入500 mL 水
(D)称取12.5 g 胆矾配成500 mL 溶液
6.在质量为G g 的瓷坩埚里,加入BaCl 2·nH 2O 晶体后,称得质量为W 1 g ,加热使结晶水全部失去,冷却后为W 2 g 。
则n 值为 ( ) (A)122208()18()W W W G -- (B) 212208()18()
W W W G -- (C)
21218()208()W G W W -- (D) 212208()18()W G W W --
·5H
试计算:第一次实验x_________(取小数点后1位,F同);
第二次实验x____________;
两次实验平均值x__________;
本次实验误差___________。
8.某学生做测定硫酸铜晶体中结晶水含量的实验,试回答下列问题。
(1)从下列仪器中选出所需仪器:_________________。
(A)天平(B)研钵(C)试管夹(D)酒精灯(E)蒸发皿(F)玻璃棒(G)瓷坩埚(H)干燥器(I)石棉网(J)三脚架
除上述所选仪器外,还需要的仪器是_________________________________。
①写出结晶水含量z%的计算公式(用W1,、W2、W3表示):x%=_________。
②测出结果:第(1)次x%________,第(2)次x%________,平均值x%______。
理论值为________,测得结果________(填“偏大”或“偏小”)。
‘
③从下列分析中得知该学生产生误差的原因可能是________。
(A)加热前称量时,容器未完全干燥
(B)最后两次加热后的质量相差较大(大于0.1 g)
(C)加热后,容器未放入干燥器中冷却
(D)加热过程中晶体有少量溅失
9.写出下列仪器的名称。
