食品中阪崎肠杆菌原始记录
食品微生物之检验方法-阪崎肠杆菌之检验

附件食品微生物之檢驗方法-阪崎腸桿菌之檢驗1 適用範圍〆本方法適用於一般食品及奶粉中阪崎腸桿菌之檢驗。
2 檢驗方法〆2.1 工作環境〆工作平台須寬敞、潔淨、光線良好,操作平台光度為100呎燭光以上,密閉室內換氣良好,儘可能沒有灰塵及流動空氣。
每15分鐘落菌數不得超過15 CFU/培養皿。
2.2 器具及材料〆2.2.1 乾熱滅菌器。
2.2.2 高壓滅菌釜。
2.2.3 攪拌均質器(Blender)或鐵胃(Stomacher)〆適用於無菌操作者。
2.2.4 天平〆可稱量到2000 g者,靈敏度為0.1 g々可稱量到120 g者,靈敏度為1 mg。
2.2.5 冰箱〆能維持5 ±3℃者。
2.2.6 吸管或吸管尖〆已滅菌,1 mL吸管應有0.01 mL之刻度々5 mL及10 mL吸管應有0.1 mL之刻度。
2.2.7 吸管輔助器(Pipette aid)或微量分注器。
2.2.8 稀釋瓶〆160 mL,玻璃、聚乙烯(polyethylene)、鐵弗龍(Teflon)或其他能耐121℃濕熱滅菌20分鐘以上之塑膠材質,附螺旋蓋。
2.2.9 培養皿〆已滅菌,內徑約9 cm,深度約15 mm,底皿之內外面應平坦,無氣泡、刮傷或其他缺點。
2.2.10 增菌用容器〆附螺旋蓋之125 mL、250 mL、2 L三角錐瓶或廣口瓶々玻璃、聚乙烯、鐵弗龍或其他能耐121℃濕熱滅菌20分鐘以上之塑膠材質。
2.2.11 pH測定儀。
2.2.12 培養箱〆能維持內部溫度在±1℃以內者。
2.2.13 溫度計〆量測溫度範圍1~55℃,最小刻度0.1℃。
2.2.14 水浴〆加蓋,具水流循環系統,能維持水溫溫差在±0.2℃以內者。
2.2.15 接種針及接種環(直徑約3 mm)〆鎳鉻合金、鉑銥或鉻線材質,或可拋棄式者。
2.2.16 曲玻棒〆可滅菌者,直徑3~4 mm,塗抹區域45~55 mm。
2.2.17 試管〆10 ×100 mm,13 ×100 mm,13 ×120 mm,15 ×150 mm,16 ×150 mm試管,或其他適用者。
食品克罗诺杆菌属(阪崎肠杆菌)检验原始记录
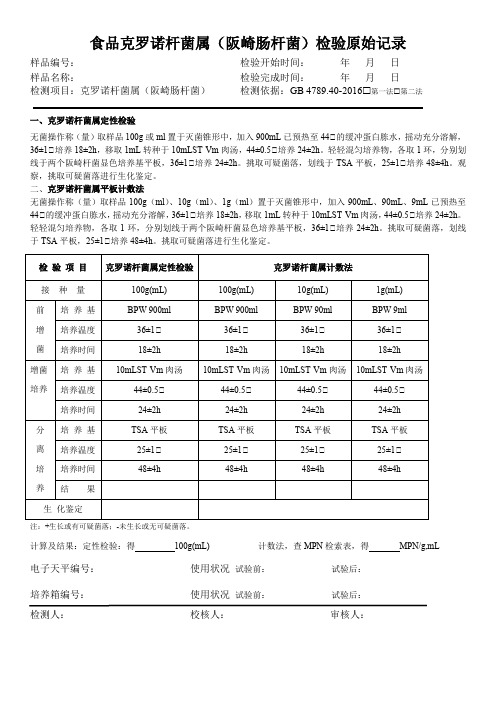
食品克罗诺杆菌属(阪崎肠杆菌)检验原始记录样品编号:检验开始时间:年月日样品名称:检验完成时间:年月日检测项目:克罗诺杆菌属(阪崎肠杆菌)检测依据:GB 4789.40-2016 第一法 第二法一、克罗诺杆菌属定性检验无菌操作称(量)取样品100g或ml置于灭菌锥形中,加入900mL已预热至44℃的缓冲蛋白胨水,摇动充分溶解,36±1℃培养18±2h,移取1mL转种于10mLST-Vm肉汤,44±0.5℃培养24±2h。
轻轻混匀培养物,各取1环,分别划线于两个阪崎杆菌显色培养基平板,36±1℃培养24±2h。
挑取可疑菌落,划线于TSA平板,25±1℃培养48±4h。
观察,挑取可疑菌落进行生化鉴定。
二、克罗诺杆菌属平板计数法无菌操作称(量)取样品100g(ml)、10g(ml)、1g(ml)置于灭菌锥形中,加入900mL、90mL、9mL已预热至44℃的缓冲蛋白胨水,摇动充分溶解,36±1℃培养18±2h,移取1mL转种于10mLST-Vm肉汤,44±0.5℃培养24±2h。
轻轻混匀培养物,各取1环,分别划线于两个阪崎杆菌显色培养基平板,36±1℃培养24±2h。
挑取可疑菌落,划线于TSA平板,25±1℃培养48±4h。
挑取可疑菌落进行生化鉴定。
注:+生长或有可疑菌落;-未生长或无可疑菌落。
计算及结果:定性检验:得100g(mL) 计数法,查MPN检索表,得MPN/g,mL电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:。
阪崎肠杆菌污染途径

• 检验流程: ①接种缓冲蛋白胨水 : • ②mLST增菌24h • ③接种DFI培养基,37℃,培养 24h • ④接种API20NE
1.3 分离方法 DFI显色培养基上阪崎肠杆菌的菌落特征 显色培养基上阪崎肠杆菌的菌落特征 显色培养基上
蓝绿色菌落
1.3 分离方法
E. sakazakii 的API 20E结果 结果
• 样品修复培养(前增菌): 样品修复培养(前增菌):无菌称取100g乳粉加 ): 入500ml预热45℃BP中,混匀,经36℃±1℃培 养18-24h。 • 样品肠道增菌培养 样品肠道增菌培养:移取10ml 加入90mlEE肉 汤中,于36℃±1℃培养18-24h。 • 样品分离培养:取EE增菌肉汤培养物1环,分别 样品分离培养: 划线接种EMB、MacConKey、 SorbitolMacConKey琼脂平板各1块,置 36℃±1℃培养18-24h。观察3种平板上的菌落 形态及不同的生物学特性反应及其差异比较。
DFI培养基存在的问题 培养基存在的问题
更快的检测方法? 更快的检测方法
• PCR • Q-PCR
DFI培养基存在的问题 培养基存在的问题
荧光PCR结果 结果 荧光
1.4其他肠杆菌属的检验 其他肠杆菌属的检验
• E-M-S法 • 所需培养基: • EMB • MacConKey • SorbitolMacConKey
1.3 分离方法 美国FDA 法 – 2002年 美国 年
• 对加拿大法进行了修改:
– 从10毫升接种到 毫升肠杆菌增菌肉汤(EE)。 毫升接种到90毫升肠杆菌增菌肉汤 毫升接种到 毫升肠杆菌增菌肉汤( )。 孵育过夜而不是直接涂布 平板. 在36oC孵育过夜而不是直接涂布 VRBG 平板 孵育过夜 – 可疑菌落接种 可疑菌落接种TSA 并在 oC 培养 48-72 hours. 并在25 – 只有产黄色色素的菌落进行 API 20E system实验 实验. 实验
关于婴幼儿奶粉中检出阪崎肠杆菌

关于婴幼儿奶粉中检出阪崎肠杆菌摘要】目的:对本市某品牌的婴幼儿配方奶粉进行阪崎肠杆菌检验,从而发现婴幼儿奶粉中所含的阪崎肠杆菌含量。
方法:选自2011年-2013年间,从我市各级市场购买的某品牌国产婴幼儿配方奶粉15份,对采集的15份市售婴幼儿配方奶粉进行菌落总数、大肠菌群及阪崎肠杆菌的检测。
结果:发现所选取的15份奶粉中,检验出5株阪崎肠杆菌。
结论:通过主要检验手段发现,检验的标准对建立降低婴幼儿配方奶粉的风险具有十分重要的意义。
【关键词】婴幼儿配方奶粉阪崎肠杆菌【中图分类号】R155.5 【文献标识码】A 【文章编号】1672-5085(2014)07-0031-02【Abstract】Objective: On a certain brand of infant formula milk powder in the city of Enterobacter sakazakii inspection,Enterobacter sakazakii and found that the content of infant milk powder,Method:From the 2011 -2013 years A domestic brand of infant formula milk powder 15 parts purchased from my suburban supermarket,The acquisition of the 15 commercial infant formula Detection of milk powder for aerobic bacterial count, coliform and Enterobacter sakazakii。
Bear fruit:15 samples of milk powder found in the selected,Test of 5 strains of Enterobacter sakazakii,Conclusion:The main test method,Very important to have the risk of infant formula milk powder was reduced inspection standard significance。
食品中阪崎肠杆菌原始记录
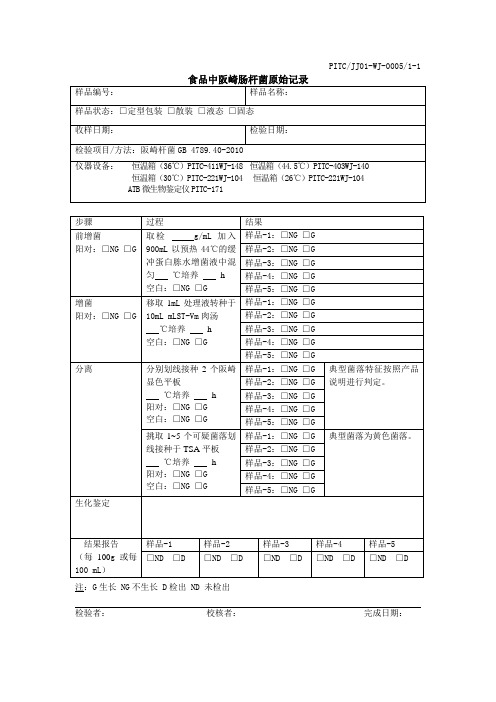
PITC/JJ01-WJ-0005/1-1食品中阪崎肠杆菌原始记录样品编号:样品名称:样品状态:□定型包装□散装□液态□固态收样日期:检验日期:检验项目/方法:阪崎杆菌GB 4789.40-2010仪器设备:恒温箱(36℃)PITC-411WJ-148 恒温箱(44.5℃)PITC-403WJ-140恒温箱(30℃)PITC-221WJ-104 恒温箱(26℃)PITC-221WJ-104 ATB微生物鉴定仪PITC-171步骤过程结果前增菌阳对:□NG □G 取检g/mL加入900mL以预热44℃的缓冲蛋白胨水增菌液中混匀℃培养h空白:□NG □G样品-1:□NG □G样品-2:□NG □G样品-3:□NG □G样品-4:□NG □G样品-5:□NG □G增菌阳对:□NG □G 移取1mL处理液转种于10mL mLST-Vm肉汤℃培养h空白:□NG □G样品-1:□NG □G样品-2:□NG □G样品-3:□NG □G样品-4:□NG □G样品-5:□NG □G分离分别划线接种2个阪崎显色平板℃培养h阳对:□NG □G空白:□NG □G 样品-1:□NG □G典型菌落特征按照产品说明进行判定。
样品-2:□NG □G样品-3:□NG □G样品-4:□NG □G样品-5:□NG □G挑取1~5个可疑菌落划线接种于TSA平板℃培养h阳对:□NG □G空白:□NG □G 样品-1:□NG □G典型菌落为黄色菌落。
样品-2:□NG □G样品-3:□NG □G样品-4:□NG □G样品-5:□NG □G生化鉴定结果报告(每100g或每100 mL)样品-1样品-2样品-3样品-4样品-5□ND □D□ND □D□ND □D□ND □D□ND □D注:G生长 NG不生长 D检出 ND 未检出检验者:校核者:完成日期:。
阪崎肠杆菌微生物检测原始记录表-
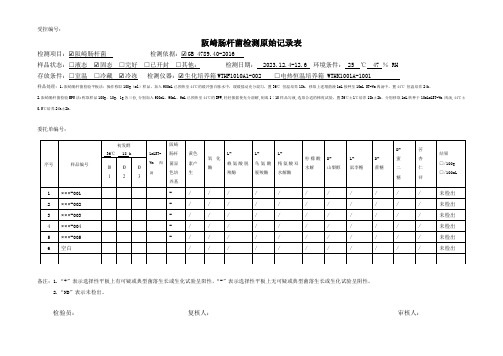
受控编号:
阪崎肠杆菌检测原始记录表
检测项目:☑阪崎肠杆菌检测依据:☑GB 4789.40-2016
样品状态:□液态☑固态□完好□已开封□其他:检测日期: 2023.12.4-12.6 环境条件: 25 ℃ 47 % RH
存放条件:□室温□冷藏☑冷冻检测仪器:☑生化培养箱WTHF1010A1-002 □电热恒温培养箱 WTHK1001A-1001
样品处理:1.阪崎肠杆菌检验平板法:操作称取100g(ml)样品,加入900mL已预热至44℃的缓冲蛋白胨水中,缓缓摇动充分混匀,置36℃恒温培养18h,移取上述增菌液1mL接种至10mL ST-Vm肉汤中,置44℃恒温培养24h。
2.阪崎肠杆菌检验MPN法:称取样品100g、10g、1g各三份,分别加入900mL、90mL、9mL已预热至44℃的BPW,轻轻振摇使充分溶解,制成1∶10样品匀液,选取合适的梯度试验,置36℃±1℃培养18h±2h。
分别移取1mL转种于10mLmLST-Vm 肉汤,44℃±0.5℃培养24h±2h。
委托单编号:
备注:1.“+”表示选择性平板上有可疑或典型菌落生长或生化试验呈阳性,“-”表示选择性平板上无可疑或典型菌落生长或生化试验呈阴性。
2.“ND”表示未检出。
检验员:复核人:审核人:。
GB478940坂崎肠杆菌检验

TSA 25℃±1℃,48h±4h
挑取黄色菌落 生化鉴定 报告
生化鉴定
5.1 前增菌和增菌
加样入已预 热到44℃的
BP中左图:Leabharlann 混合; 右图:混合后。25
5.2 分离
DFI 36℃±1℃ 24 h±2h
26
黄色素
TSA: 25 ℃培养后 典型ES:黄色
阴性对照E. coli ATCC 25922:白色菌落
• 营养要求不高: VRBGA、TSA、NA、MAC、EMB、其他
与其他常见肠杆菌相似
7
三、生化反应
生化反应 D-山梨醇 产生吐温80脂酶 细胞外Dnase 氧化酶试验 黄色菌落 α-葡萄糖苷酶
结果 + + + +
8
ES及亲缘关系较近的肠杆菌生化反应比较
生化反应1
试验
阪崎 肠杆菌
阴沟 肠杆菌
产气 肠杆菌
Germany),NA+ -MUG
14
显色培养基的特点
-葡萄糖苷酶活性
指示剂:
1. 5-溴-4-氯-3-吲哚-,D-吡喃葡糖甙(XGlc) 2. 4-甲基伞形酮--D-葡糖苷(-MUG) 3. 4-邻硝基苯--D-吡喃葡糖甙
15
16
选择性培养基的选择
1. FDA方法使用VRBGA,ISO 方法中使用ESIA, 本方法中我们选用DFI。
2. 美国FDA 2002年颁布的“婴儿配方粉中阪崎肠杆菌的分离和 计数”(Isolation and Enumeration of Enterobacter sakazakii from Dehydrated Powdered Infant Formula)方法;
奶粉中阪崎肠杆菌分离鉴别方法研究

*基金项目:国家质量监督检疫总局科研项目(2004IK097)作者单位:中国检验检疫科学研究院食品安全研究所,北京100025作者简介:赵贵明(1963-),男,山西人,研究员,学士,研究方向:食品微生物检验技术研究。
文章编号:1001-0580(2006)02-0207-02 中图分类号:R 378.2 文献标识码:B=实验研究>奶粉中阪崎肠杆菌分离鉴别方法研究*赵贵明,袁飞,陈颖,黄文胜,刘沛,张旭阪崎肠杆菌(Enter obacter sakaz akii )可引发婴儿、早产儿脑膜炎、败血症及坏死性结肠炎,散发和暴发病例在全球范围均有报道11~32。
国际相关组织认为,奶粉中的阪崎肠杆菌与沙门菌一样,是导致幼儿感染、死亡的主要原因,已有报道从婴幼儿配方奶粉中检出阪崎肠杆菌13,42。
因此,有效地从奶粉中分离阪崎肠杆菌,准确鉴别尤为重要,本文根据所有阪崎肠杆菌菌株均产生A -葡萄苷酶的原理152,在营养琼脂中添加5-溴-4-氯-3-吲哚-A -葡萄苷作为底物,月桂基硫酸盐作为抑制剂,制成改良显色培养基,检测80份市售奶粉,同时使用肠杆菌科细菌生化鉴定试剂(AP I20E),对可疑菌株进行鉴别并分析遇到的问题。
现报告如下。
1 材料与方法111 材料 (1)标准菌珠:大肠埃希菌44104,产气肠杆菌45103,阴沟肠杆菌45301,奇异变形杆菌49005,普通变形杆菌49027,鼠伤寒沙门氏菌51315,弗氏柠檬酸杆菌11732,肺炎克雷伯菌46114以及金黄色葡萄球菌6株,表皮葡萄球菌9株,均由中国药品生物制品检定所提供;阪崎肠杆菌AT CC 29544;阪崎肠杆菌样品分离株1~4,分离自奶粉样品中。
(2)试剂与培养:肠杆菌增菌肉汤,结晶紫中性红胆盐葡萄糖琼脂(VRBGA,由北京陆桥公司生产);阪崎肠杆菌显色培养基,胰酪胨大豆胨琼脂(T SA ),由本实验室配制;A PI20E(梅里埃公司)。
食源性阪崎肠杆菌检测方法研究进展

食源性阪崎肠杆菌检测方法研究进展邓丽萍1,2,3,邓访萍4,张 琴1,2,3(1.广东省食品质量监督检验站,广东广州 511442;2.广东省食品工业研究所有限公司,广东广州 511442;3.广东省食品工业公共实验室,广东广州 511442;4.广东药科大学附属第一医院,广东广州 510080)摘 要:阪崎肠杆菌可感染婴幼儿,引发脑膜炎、菌血症和坏死性小肠结肠炎。
因此,探究出快速、灵敏、高效的阪崎肠杆菌检测方法对于保障食品质量安全至关重要。
目前,阪崎肠杆菌的检测方法中比较常见的是分离鉴定法、分子生物学检测技术和免疫学检测法。
分离鉴定法易于操作、成本低,但检测周期长,无法满足对目标食品快速检测的需求;分子生物学检测技术是一种高灵敏度和特异性的检测手段,但是由于其对检测人员要求高,所需设备和试剂价格昂贵,目前多在实验室进行,不适用于现场检测;免疫学检测方法简单快捷,适用于现场快速检验,但容易受到其他杂菌的影响,敏感性较低。
本文综述了分离鉴定法、分子生物学检测技术、免疫学检测技术等多种阪崎肠杆菌的检测方法,结合参考文献就检测研究进展予以分析,以期为食品中阪崎肠杆菌的快速检测方法研究提供参考。
关键词:阪崎肠杆菌;检测方法;研究进展Research Progress in Detection Methods for FoodborneEnterobacter sakazakiiDENG Liping1,2,3, DENG Fangping4, ZHANG Qin1,2,3(1.Guangdong Food Quality Supervision and Inspection Station, Guangzhou 511442, China;2.Guangdong Food Industry Institute Limited Company, Guangzhou 511442, China;3.Guangdong Provincial Food Industry Public Laboratory, Guangzhou 511442, China;4.The First Hospital of Guangdong Pharmaceutical University, Guangzhou 510080, China)Abstract: Trace amounts of E. sakazakii can infect newborns and young children, causing meningitis, septicaemia and necrotising small bowel colitis, among others. Therefore, exploring a rapid, sensitive and efficient detection method for E. sakazakii is essential for ensuring food quality and safety. At present, conventional isolation and identification, molecular biology and immunological detection methods for E. sakazakii are more common. The separation and identification method is easy to operate and low cost, but the detection cycle is long, which can not meet the demand for rapid detection of target food. Molecular biotechnology is a highly sensitive and specific means of detection, but due to its high demand for test technicians, the required equipment and reagents are expensive, and is currently mostly carried out in the laboratory, is not suitable for on-site testing. The method of immunological determination is simple and fast, which is suitable for field rapid detection, but it is easy to be interfered with other miscellaneous bacteria and its sensitivity is not high enough. In this paper, separation and identification method, molecular biological detection techniques, immunological detection techniques and other detection methods of E. sakazakii were reviewed, and the research progress of detection was analyzed in combination with references, in order to provide reference for the rapid detection of E. sakazakii in food.Keywords:Enterobacter sakazakii; detection method; research progress阪崎肠杆菌(又称阪崎氏肠杆菌)是一种寄生于人和动物肠道内的条件致病菌,在自然界中分布广泛,具有一定的耐热性、耐干燥性、耐高渗环境性,可抵抗超高温瞬时灭菌。
牛奶中阪崎肠杆菌的检测方法

牛奶中阪崎肠杆菌的检测方法引言:阪崎肠杆菌(又称阪崎氏肠杆菌)是一种周身无鞭毛,能运动,无芽孢的兼性厌氧菌,革兰氏阴性杆菌。
1980年由黄色阴沟肠杆菌更名为阪崎肠杆菌。
阪崎肠杆菌能引起严峻的新生儿脑膜炎、小肠结肠炎和菌血症,致死率可达40%~80%,自1961年首次由阪崎肠杆菌引起的新生儿脑膜炎之后,全球范围间续消失感染大事,丹麦、希腊、英国、荷兰、冰岛等国均有报道。
其严峻性已引起世界多国相关部门的重视,阪崎肠杆菌已被世界卫生组织和很多国家确定为引起婴儿死亡的重要条件致病菌。
我国也于2021年5月20日通过了《奶粉中阪崎肠杆菌检测方法》行业标准,并于同年10月实施,我国《婴儿配方食品》和《幼儿配方食品》相关标准规定婴幼儿配方奶粉、食品中禁止检出阪崎肠杆菌等致病菌。
一、阪崎杆菌的生物学特性1 形态染色阪崎肠杆菌属肠杆菌科肠杆菌属, 因此本菌具备肠杆菌基本形态特征: 革兰阴性粗短杆菌,有周身菌毛, 无芽胞, 有动力[1] 。
2 培育特性能在一般养分琼脂、血平板、麦康凯(MAC) 琼脂、伊红美兰(EMB) 琼脂、脱氧胆酸琼脂等多种培育基上生长繁殖。
培育最佳温度25 ~36 ℃ , 在6~45 ℃下都能生长, 某些菌株可在47 ℃下生长[8] 。
在胰蛋白胨琼脂(TSA) 、脑心浸液琼脂(BH I) 及血平板上经25 ~36 ℃培育24 h 后, 形成1. 5 ~2. 5mm, 黄色菌落。
在结晶紫中性红胆盐葡萄糖琼脂(VRBG) 能产生紫红色菌落[2]。
二、阪崎杆菌的传统检测方法阪崎肠杆菌检验程序见图1。
1 基本步骤如下:取检样100g(mL)加入已预热至44℃装有900mL缓冲蛋白胨水的锥形瓶中,用手缓缓地摇动至充分溶解,36℃1℃培育18 h2h。
移取1mL 转种于10mL mLST-Vm肉汤,44℃0.5 ℃培育24 h2h。
轻轻混匀mLST-Vm 肉汤培育物,各取增菌培育物1环,分别划线接种于两个阪崎肠杆菌显色培育基平板,36℃1℃培育18 h2 h。
辣椒粉中检出阪崎肠杆菌

辣椒粉中检出阪崎肠杆菌
张敏爱;张建军;李卫华;罗秀珍
【期刊名称】《中国调味品》
【年(卷),期】2011(036)011
【摘要】目的—验证辣椒粉中阪崎肠杆菌存在状况.方法—采用国家标准GB 4789.40-2010,应用VITEK 32全自动微生物鉴定及药敏系统进行检验.结果—从辣椒粉中检出阪崎肠杆菌.结论—阪崎肠杆菌存在于辣椒粉调味品中,存在较大的安全隐患.
【总页数】2页(P79-80)
【作者】张敏爱;张建军;李卫华;罗秀珍
【作者单位】山西出入境检验检疫局技术中心,太原030024;山西出入境检验检疫局技术中心,太原030024;山西出入境检验检疫局技术中心,太原030024;山西出入境检验检疫局技术中心,太原030024
【正文语种】中文
【中图分类】TS207.4
【相关文献】
1.提高食品中阪崎肠杆菌的阳性检出率 [J], 房玉国;卢雁;王淼;王旻;王宇;赵长利
2.提高奶粉中阪崎肠杆菌检出率方法探讨 [J], 陈冠武;马少玲;许如苏;
3.从酱腌菜中检出一株阪崎肠杆菌 [J], 李萍;邢丽萍;王文
4.某国产婴幼儿配方奶粉中检出阪崎肠杆菌 [J], 黎明;黄剑屏;黄薇;黄葵
5.从进口饼干、巧克力和方便面中检出阪崎肠杆菌 [J], 黄忠梅;王翀;田延河
因版权原因,仅展示原文概要,查看原文内容请购买。
1534微生物检测原始记录阪崎杆菌
检测者:复核者:
微生物检测原始记录
XCXCDC/JY11550共页第页
样品名称
性状
样品编号
样品来源
批号
商标
生产厂家
Hale Waihona Puke 温度0C相对温度检测依据
检测日期
报告时间
检测项目
阪崎肠杆菌
主要仪器
恒温培养箱、恒温水浴箱、均质器、PH计
1、增菌培养:无菌操作取检样100g(ml)+ 900mlBPW中360C±10C,18+2h移取1ml+10ml mLST-Vm肉汤中440C±0.50C,24+2h培养。
2、分离培养:取培养物一环,分别划线接种于两个阪崎肠杆菌显色培养基平板,置360C±10C培养24±2h,观察菌落。挑取1-5个可疑菌落,划线接种于TSA平板,形态染色250C±10C培养48±4h。
3、生化试验:黄色素产生、氧化酶、L-赖氨酸脱羟酶、L-鸟氨酸脱羟酶、L-精氨酸脱羟酶、
柠檬酸水解、D-山梨醇、L-鼠李糖、D-蔗糖、D-蜜二糖、苦杏仁苷
含乳冷饮中阪崎肠杆菌和其它肠杆菌的污染状况

[作者简介] 戴岚(1964-),女,高级工程师,主要从事食品、化妆品微生物检验工作。
【微生物检测方法】含乳冷饮中阪崎肠杆菌和其它肠杆菌的污染状况戴岚,宋白薇(苏州出入境检验检疫局,江苏苏州 215021)[摘要] 目的:了解含乳冷饮中阪崎肠杆菌和其它肠杆菌的污染状况。
方法:S N/T163211-2005《奶粉中阪崎肠杆菌检验方法》第一部分:分离与计数方法。
结果:在31份样品中有4份样品分离到阪崎肠杆菌,占1219%;有24份样品分离到肠杆菌,占7714%。
结论:本次检测结果表明应加强对市售含乳冷饮的卫生预防和控制。
[关键词] 阪崎肠杆菌;肠杆菌;含乳冷饮;V I TEK2微生物分析鉴定[中图分类号] R37812 [文献标识码] A [文章编号] 1004-8685(2009)02-0337-02Con t am i n a ti on of En terobacter sakazak ii and other en terobacter i a ceae i n da i ry frozen dr i n ksDA I L an,SON G B ai2w ei(Suzhou Entry-Exit I ns pecti on and Quarantine Bureau,Suzhou215021,China)[Abstract] O bjecti ve:To study the conta m inati on of Enterobacter sakazakii and other Enter obacteriaceae in the dairy fr ozen drinks1M ethods:S N/T163211-2005Detecti on of Enterobacter sakazakii fr om dehydrated powdered m ilk-Part1:Is olati on and enu merati on1Results:Enterobacter sakazakii were is olated fr om4dairy fr ozen drinks and Enter obacteriaceae were is olated fr om24 dairy fr ozen drinks,which showed1219%and7714%positive rati o,res pectively1Conclusi on:The results in this study are valua2 ble t o support the hygienic p recauti on and contr ol of the retail dairy fr ozen drinks1[Key words] Enterobacter sakazakii;Enter obacteriaceae;The dairy fr ozen drinks;V I TEK m icr obial analytical syste m 阪崎肠杆菌(Enterobacter sakazakii)属肠杆菌科肠杆菌属,是近年来引起国际社会广泛关注的一种条件致病菌。
阪崎肠杆菌的测定.pptx

阪崎肠杆菌的分布
1.环境 原油、切削液、苍蝇、食品加工厂(奶制品、谷类、
巧克力、马铃薯粉),医院(空气、听诊器、临床 食品)、家庭、温泉、鼠、沉积物、沼泽地、土壤 2.食品及相关用品 啤酒杯、干酪、婴儿配方奶粉和豆粉、婴儿配方粉 冲调用品(搅拌器、勺子、甁刷),普通奶粉、碎 牛肉、肉类、香肠、发酵面包、豆腐、蔬菜、水 (管道、生物膜)、调味品
冷藏条件下可以生长 5、在TSA培养基上产生黄色色素 6、产生α-葡萄糖苷酶,其它肠杆菌均不产生; 7、较强的耐干燥性,耐高渗透压, “干燥逆境抗
性”比其他,大多数乳品中分离得到的肠杆菌更 加耐热,但标准的高温短时巴氏杀菌可消灭
5
易感人群
• 阪崎肠杆菌可引起各年龄段的感染,但从 报道病例的年龄分布来看,高危人群主要是 婴儿(即<1岁的儿童),新生儿(≤28天)、 尤其是早产儿、低出生体重或免疫力下的婴 儿,发生严重感染的危险性最高。
• 母亲HIV阳性的婴儿
6
主要感染渠道
虽然现在还不能确定阪 崎肠杆菌的宿主和传播 模型,但在多起新生儿 阪崎肠杆菌感染事件的 调查中发现婴幼儿配方 粉是主要的感染渠道
7
阪
崎
检
1前增菌 2选择性增菌
测 3平板分离
பைடு நூலகம்
步
4平板确认 5 生化鉴定
骤
8
阪崎肠杆菌检验——前增菌
操作:100g样品+900mL增菌液,培养18h±2h GB使用的增菌液为BPW 主要作用:营养丰富,更利于食品检验具有缓冲体系
10
阪崎肠杆菌检验——平板分离
操作:各取培养物一环,接种显色平板,培养24h±2h 培养基作用 显色培养基 •显色培养基利用阪崎特异性α-葡萄糖苷酶原理,分解底物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PITC/JJ01-WJ-0005/1-1
食品中阪崎肠杆菌原始记录
样品编号:样品名称:
样品状态:□定型包装□散装□液态□固态
收样日期:检验日期:
检验项目/方法:阪崎杆菌GB 4789.40-2010
仪器设备:恒温箱(36℃)PITC-411WJ-148 恒温箱(44.5℃)PITC-403WJ-140
恒温箱(30℃)PITC-221WJ-104 恒温箱(26℃)PITC-221WJ-104 ATB微生物鉴定仪PITC-171
步骤过程结果
前增菌
阳对:□NG □G 取检g/mL加入
900mL以预热44℃的缓
冲蛋白胨水增菌液中混
匀℃培养h
空白:□NG □G
样品-1:□NG □G
样品-2:□NG □G
样品-3:□NG □G
样品-4:□NG □G
样品-5:□NG □G
增菌
阳对:□NG □G 移取1mL处理液转种于
10mL mLST-Vm肉汤
℃培养h
空白:□NG □G
样品-1:□NG □G
样品-2:□NG □G
样品-3:□NG □G
样品-4:□NG □G
样品-5:□NG □G
分离分别划线接种2个阪崎
显色平板
℃培养h
阳对:□NG □G
空白:□NG □G 样品-1:□NG □G典型菌落特征按照产品
说明进行判定。
样品-2:□NG □G
样品-3:□NG □G
样品-4:□NG □G
样品-5:□NG □G
挑取1~5个可疑菌落划线接种于TSA平板
℃培养h
阳对:□NG □G
空白:□NG □G 样品-1:□NG □G典型菌落为黄色菌落。
样品-2:□NG □G
样品-3:□NG □G
样品-4:□NG □G
样品-5:□NG □G
生化鉴定
结果报告(每100g或每100 mL)样品-1样品-2样品-3样品-4样品-5
□ND □D□ND □D□ND □D□ND □D□ND □D
注:G生长 NG不生长 D检出 ND 未检出
检验者:校核者:完成日期:。
