常见九种典型的晶体结构PPT课件
合集下载
典型晶体结构ppt课件

[思考]:
在每个Na+周围最近且等距离的Cl-有 6 个, 在每个Cl-周围最近的等距离的Na+有 6 个,
每个Na+周围最近的等距离的Na+有 12 个, 在每个Cl-周围最近且等距离的Cl-有 12 个 该氯化钠晶胞相当于 4 个“NaCl”分子。3
在氯化钠晶体中, 每个Na+周围与 之最接近且距离 相等的Cl-共有 个;6 这几个Cl-在 空间构成的几何 构型 为 正八面体 。
该晶胞相当于 4 个“CsCl”分子。
6
(3)二氧化碳晶体 干冰晶体是一个立方面心结构,每8个CO2分
子构成立方体且再在6个面的中心又各占1个 CO2。 (见图已)。
7
(3)二氧化碳晶体
[思考];在每个CO2周围最近且等距离的CO2有 12 个
该晶胞相当于有 4 个CO2分子。
8
(4)金刚石晶体 每个C原子与4个C原子紧邻。由5个碳原子
个O形成4个共价键,前者位于正四面体的中 心.后者位于正四面体的顶点;每个Si周围又 有4个O,每个O的周围有2个Si,实际上SiO2晶 体是由Si原子和O原子按1:2的比例组成的原子 晶体(见图丁)。
12
二氧化硅晶体
[思考]: 1.由共价键构成最
小环状结构中有 12个原子; 2.晶体中每个硅原子被12个
晶体之所以具有规则的几何外形,是因其内部的 质点作规则的排列,实际上是晶体中最基本的结 构单元重复出现的结果。
我们把晶体中重复出现的最基本的结
构单元叫晶体的基本单位—— 晶胞
晶胞对组成晶胞的各质点(晶格点)的占 有率如何呢(以立方体形晶胞为例)?如果 是六棱柱形晶胞又如何?
15
晶胞对组成晶胞的各质点的占有率
在每个Na+周围最近且等距离的Cl-有 6 个, 在每个Cl-周围最近的等距离的Na+有 6 个,
每个Na+周围最近的等距离的Na+有 12 个, 在每个Cl-周围最近且等距离的Cl-有 12 个 该氯化钠晶胞相当于 4 个“NaCl”分子。3
在氯化钠晶体中, 每个Na+周围与 之最接近且距离 相等的Cl-共有 个;6 这几个Cl-在 空间构成的几何 构型 为 正八面体 。
该晶胞相当于 4 个“CsCl”分子。
6
(3)二氧化碳晶体 干冰晶体是一个立方面心结构,每8个CO2分
子构成立方体且再在6个面的中心又各占1个 CO2。 (见图已)。
7
(3)二氧化碳晶体
[思考];在每个CO2周围最近且等距离的CO2有 12 个
该晶胞相当于有 4 个CO2分子。
8
(4)金刚石晶体 每个C原子与4个C原子紧邻。由5个碳原子
个O形成4个共价键,前者位于正四面体的中 心.后者位于正四面体的顶点;每个Si周围又 有4个O,每个O的周围有2个Si,实际上SiO2晶 体是由Si原子和O原子按1:2的比例组成的原子 晶体(见图丁)。
12
二氧化硅晶体
[思考]: 1.由共价键构成最
小环状结构中有 12个原子; 2.晶体中每个硅原子被12个
晶体之所以具有规则的几何外形,是因其内部的 质点作规则的排列,实际上是晶体中最基本的结 构单元重复出现的结果。
我们把晶体中重复出现的最基本的结
构单元叫晶体的基本单位—— 晶胞
晶胞对组成晶胞的各质点(晶格点)的占 有率如何呢(以立方体形晶胞为例)?如果 是六棱柱形晶胞又如何?
15
晶胞对组成晶胞的各质点的占有率
常见的晶体结构PPT幻灯片课件

离子半径、电中性、阴离子多面体之间的连接 18
1、NaCl型结构
——立方晶系
(1)密堆积情况: Cl- 离子面心立方堆积; Na+离子填充八面体空隙; 晶胞分子数:Z=4; 晶胞中:4个八面体空隙 8个四面体空隙; Na+离子填充全部八面体空隙
19
(2)质点坐标:
Cl : 000, 1 1 0, 1 0 1 ,0 1 1 22 2 2 22
Cl : 000
Cl : 1 1 1
或
222
Cs : 1 1 1
Cs : 000
222
(3)配位数与配位多面体:
r 0.174 nm 0.96 0.732 r 0.181nm
CN 8,立方体配位
CsCl型:CsBr、CsI、TlCl、NH4Cl……
23
3、闪锌矿型结构(-ZnS) ——立方晶系
晶胞的3个棱边长度(a、b、c)与原子半径r 之间的关系,可由简单的几何知识求出。
面心立方结构(a=b=c):
a2 a2 2r 2r2
a 2 2r
4
(6)配位数:
CN=12
(7)致密度(堆垛密度): K=0.74
(8)密度:
密度
=
原子数 晶胞原子量 晶胞体积 阿佛加德罗常数
a4 3r 3
9
(6)配位数: CN=8
(7)致密度(堆垛密度): 致密度:K=0.68
A2型结构:-Fe、铬、钨、结构(A3型)
(1)密堆积情况: 原子以ABAB……的方式堆积,
六方紧密堆积, (0001)面为密排面。
(2)原子分布:
12个原子分布在六方晶胞的 顶点、2个原子处于上下底心、3 个原子在六方晶胞体内。
1、NaCl型结构
——立方晶系
(1)密堆积情况: Cl- 离子面心立方堆积; Na+离子填充八面体空隙; 晶胞分子数:Z=4; 晶胞中:4个八面体空隙 8个四面体空隙; Na+离子填充全部八面体空隙
19
(2)质点坐标:
Cl : 000, 1 1 0, 1 0 1 ,0 1 1 22 2 2 22
Cl : 000
Cl : 1 1 1
或
222
Cs : 1 1 1
Cs : 000
222
(3)配位数与配位多面体:
r 0.174 nm 0.96 0.732 r 0.181nm
CN 8,立方体配位
CsCl型:CsBr、CsI、TlCl、NH4Cl……
23
3、闪锌矿型结构(-ZnS) ——立方晶系
晶胞的3个棱边长度(a、b、c)与原子半径r 之间的关系,可由简单的几何知识求出。
面心立方结构(a=b=c):
a2 a2 2r 2r2
a 2 2r
4
(6)配位数:
CN=12
(7)致密度(堆垛密度): K=0.74
(8)密度:
密度
=
原子数 晶胞原子量 晶胞体积 阿佛加德罗常数
a4 3r 3
9
(6)配位数: CN=8
(7)致密度(堆垛密度): 致密度:K=0.68
A2型结构:-Fe、铬、钨、结构(A3型)
(1)密堆积情况: 原子以ABAB……的方式堆积,
六方紧密堆积, (0001)面为密排面。
(2)原子分布:
12个原子分布在六方晶胞的 顶点、2个原子处于上下底心、3 个原子在六方晶胞体内。
常见九种典型的晶体结构
反萤石型结构
球键图
阳离子四面体配位 阴离子立方体配位
反萤石型结构可看作:阴离子做立方最紧密堆积,阳离 子充填在全部的四面体空隙中。
结构类型 物质名称 萤石(CaF2)
萤石型结 氯化锶(SrCl2)
构
氯化钡(BaCl2)
氟化铅(PbF2)
氧化钾(K2O)
反萤石型 结构
氧化钠(Na2O)
氧化锂(Li2O)
闪锌矿的晶体结构:球键图(左)、配位多面体连接图(右)
结构中,S2- 和Zn2+配位数都是4,配位多面体都 是四面体。四面体共角顶相联。
从图可看出,[SZn4] 四面体([ZnS4] 四面体 也是一样)共角顶联成的 四面体基元层与[111]方 向垂直。
由于S2-和Zn2+都呈配位四面体,所以闪锌矿只用一种配位 多面体结构形式表达(S和Zn互换是一样的)。
(Fe3+(Fe2+Fe3+)2O4)。
当结构中四、八面体孔隙被A2+和B3+无序占据时, 叫混合尖晶石结构,代表晶相是镁铁矿(Fe, Mg)3O4。
具有尖晶石型结构的部分物质
Fe3O4 VMn2O4 NiAl2O4 NiGa2O4 Co3S4 TiZn2O4 γ-Fe2O3 LiTi2O4 CoAl2O4 MgGa2O4 NiCo2S4 VZn2O4 MnFe2O4 MnTi2O4 ZnAl2O4 MnGa2O4 Fe2SiO4 SnMg2O4 MgFe2O4 ZnCr2O4 Co3O4 ZnIn2S4 Ni2SiO4 TiMg2O4 Ti Fe2O4 CoCr2O4 GeCo2O4 MgIn2O4 Co2SiO4 WNa2O4 LiMn2O4 CuMn2O4 VCo2O4 CuV2S4 Mg2SiO4 CdIn2O4
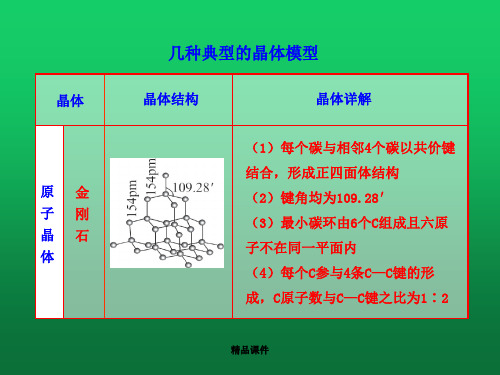
几种典型的晶体模型ppt课件
典型代表Cu、Ag、Au,空间利用率74%, 配位数为12
精品课件
晶体
原金 子刚 晶石 体
几种典型的晶体模型
晶体结构
晶体详解
(1)每个碳与相邻4个碳以共价键 结合,形成正四面体结构 (2)键角均为109.28′ (3)最小碳环由6个C组成且六原 子不在同一平面内 (4)每个C参与4条C—C键的形 成,C原子数与C—C键之比为1∶2
精品课件
晶体
晶体结构
原
子 晶
SiO2
精品课件
晶体
晶体结构
晶体详解
离 子 NaCl 晶型 体
(1)每个Na+(Cl-)周围等距且紧 邻的Cl-(Na+)有6个。每个Na+周 围等距且紧邻的Na+有12个 (2)每个晶胞中含4个Na+和4个Cl-
精品课件
晶体
晶体结构
晶体详解
离 子 CsCl 晶型 体
(1)每个Cs+周围等距且紧邻的Cl有8个,每个Cs+(Cl-)周围等距且 紧邻的Cs+(Cl-)有8个 (2)如图为8个晶胞,每个晶胞中 含1个Cs+、1个Cl-
体
晶体详解
(1)每个Si与4个O以共价键结 合,形成正四面体结构 (2)每个正四面体占有1个Si,4 个“ 1 O”最小环上有12个原子,即6个 O,6个Si
精品课件
晶体
晶体结构
分 子干 晶冰 体
晶体详解
(1)8个CO2分子构成立方体且在6 个面心又各占据1个CO2分子 (2)每个CO2分子周围等距紧邻的 CO2分子有12个
精品课件
晶体
简单 金 立方 属 堆积 晶 体 体心
立方 堆积
晶体结构
精品课件
晶体
原金 子刚 晶石 体
几种典型的晶体模型
晶体结构
晶体详解
(1)每个碳与相邻4个碳以共价键 结合,形成正四面体结构 (2)键角均为109.28′ (3)最小碳环由6个C组成且六原 子不在同一平面内 (4)每个C参与4条C—C键的形 成,C原子数与C—C键之比为1∶2
精品课件
晶体
晶体结构
原
子 晶
SiO2
精品课件
晶体
晶体结构
晶体详解
离 子 NaCl 晶型 体
(1)每个Na+(Cl-)周围等距且紧 邻的Cl-(Na+)有6个。每个Na+周 围等距且紧邻的Na+有12个 (2)每个晶胞中含4个Na+和4个Cl-
精品课件
晶体
晶体结构
晶体详解
离 子 CsCl 晶型 体
(1)每个Cs+周围等距且紧邻的Cl有8个,每个Cs+(Cl-)周围等距且 紧邻的Cs+(Cl-)有8个 (2)如图为8个晶胞,每个晶胞中 含1个Cs+、1个Cl-
体
晶体详解
(1)每个Si与4个O以共价键结 合,形成正四面体结构 (2)每个正四面体占有1个Si,4 个“ 1 O”最小环上有12个原子,即6个 O,6个Si
精品课件
晶体
晶体结构
分 子干 晶冰 体
晶体详解
(1)8个CO2分子构成立方体且在6 个面心又各占据1个CO2分子 (2)每个CO2分子周围等距紧邻的 CO2分子有12个
精品课件
晶体
简单 金 立方 属 堆积 晶 体 体心
立方 堆积
晶体结构
常见晶体结构.ppt

Hcp的堆垛方式为AB,AB,…… 密排面(0001)垂直于C轴。 Fcc的堆垛方式为ABC,ABC,…… 密排面{111}垂直于体对角线。
总结
绪论 ——大家自己看 晶体学基础: 一、空间点阵 阵点: 理想晶体、几何点、周围环境相同 空间点阵:阵点规则、周期、有规律的排列,三维空间 晶胞:具有代表性的 、最小单元、先满足对称性、六个点阵常数(晶格常数) 晶系和空间点阵类型:7各晶系 14个空间点阵 晶体结构和空间点阵的区别 二、晶面指数和晶向指数的标定 步骤: 晶面族和晶向族:位向不同、原子排列相同、晶体学上性质等价 晶带:平行或相交晶带轴晶面的全体 三、常见晶体结构 配位数: 12 8 12 个数 : 4 2 6 堆垛密度:0.74 0.68 0.74 间隙:见表1-3 堆垛方式:FCC ABCABCA………………….
(2)FCC、HCP的八面体间隙大于四面体间隙,因此这些金属中的间 隙原子主要位于八面体间隙中。
(3)BCC中,四面体间隙大于八面体间隙,间隙原子主要占据四面体 间隙中。八面体间隙是不对称的,主要引起据间隙原子为a/2的两个 原子显著的偏离原始位置,其余不发生明显的改变,整个点阵畸变不 大。
(4)FCC、HCP的八面体间隙远大于BCC的八面体间隙和四面体间隙, 所以间隙原子在FCC和HCP中的固溶度比在BCC大得多。
A C B A
C B A
三、常见晶体结构及其几何ቤተ መጻሕፍቲ ባይዱ征
4 常见晶体的堆垛方式
4.2 HCP结构 (0001)面为密排面
第二层放在“下箭头” 的位置,(也可以放在“上箭头”的位置) 第三层的位置与第一层重合。
三、常见晶体结构及其几何特征
4 常见晶体的堆垛方式 4.3 FCC和HCP的比较 (1)只看一层原子时,密排面是一样的 (2)看相邻的两层原子时,堆垛是一样的 (3)看相邻的三层原子时,堆垛是不同的
总结
绪论 ——大家自己看 晶体学基础: 一、空间点阵 阵点: 理想晶体、几何点、周围环境相同 空间点阵:阵点规则、周期、有规律的排列,三维空间 晶胞:具有代表性的 、最小单元、先满足对称性、六个点阵常数(晶格常数) 晶系和空间点阵类型:7各晶系 14个空间点阵 晶体结构和空间点阵的区别 二、晶面指数和晶向指数的标定 步骤: 晶面族和晶向族:位向不同、原子排列相同、晶体学上性质等价 晶带:平行或相交晶带轴晶面的全体 三、常见晶体结构 配位数: 12 8 12 个数 : 4 2 6 堆垛密度:0.74 0.68 0.74 间隙:见表1-3 堆垛方式:FCC ABCABCA………………….
(2)FCC、HCP的八面体间隙大于四面体间隙,因此这些金属中的间 隙原子主要位于八面体间隙中。
(3)BCC中,四面体间隙大于八面体间隙,间隙原子主要占据四面体 间隙中。八面体间隙是不对称的,主要引起据间隙原子为a/2的两个 原子显著的偏离原始位置,其余不发生明显的改变,整个点阵畸变不 大。
(4)FCC、HCP的八面体间隙远大于BCC的八面体间隙和四面体间隙, 所以间隙原子在FCC和HCP中的固溶度比在BCC大得多。
A C B A
C B A
三、常见晶体结构及其几何ቤተ መጻሕፍቲ ባይዱ征
4 常见晶体的堆垛方式
4.2 HCP结构 (0001)面为密排面
第二层放在“下箭头” 的位置,(也可以放在“上箭头”的位置) 第三层的位置与第一层重合。
三、常见晶体结构及其几何特征
4 常见晶体的堆垛方式 4.3 FCC和HCP的比较 (1)只看一层原子时,密排面是一样的 (2)看相邻的两层原子时,堆垛是一样的 (3)看相邻的三层原子时,堆垛是不同的
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见九种典型的晶体结构
1 金属单质结构 2 氯化铯结构 3 CaI2结构 4 萤石结构 5 食盐结构
6 闪锌矿结构 7 金刚石结构 8 钙钛矿结构 9 层202状1 硅酸盐结构
1 金属单质结构
(1) 立方面心结构:空间群:Fm3m, 相当于等大 球立方最紧密堆积。
▪ 属于该结构的物质主要有:铝、铜、金、银、铂、 铅等单质。 2021
2021
金刚石的晶体结构可以看成是半数的C作立方最紧密堆积(蓝 球),另外一半C相间地充填在其中的四面体孔隙中(红球)而构 成的。
2021
2021
2 氯化铯(CsCl)结构
空间群:Pm3m,立方原始格子。
2021
▪ 阴离子分布在晶胞的8个角顶,阳离子充填 在其所形成的立方体空隙中。立方体共面连 接。
2021
▪ 具有该结构的物质主要有:KCl, NaCl, TiCl, RbF, CsN, NbN, NbO, AgI, TiTh等物质。
2021
具有该种结构的物质主要有: VCl2, PbI2, GeI2, PtO2, ToBr2, RhTe2, TiS2, TiSe2, TiTe2, SnS2, MnI2, NiTe2, PdTe2, PtS2, CdI2, MgI2, CaI2, CoBr2, FeBr2, FeI2, ZrS2, ZrSe2, MnBr2等。
2021
2021
3 CaI2结构
空间群:P-3m,三方原始格子。
2021
在单位晶胞中,阳离子分布在8个角顶,阴离子分 布中由上下各3个阳离子构成的正三方柱中,并间 隔地在上半部的中心和下半部的中心。
2021
2021
2021
2021
因此,该结构也可以理解为:阴离子做六方最紧密 堆积,阳离子填充在间隔一层的全部八面体空隙中。
2021
2021
(111)
(200)
(220)
2021
6 闪锌矿结构
空间群 F-43m,立方面心格子。 Zn分布于晶胞的角顶及面心。如果把晶胞8等分,S分 布于间隔的小立方体的中心。
2021
闪锌矿的晶体结构:球键图(左)、配位多面体连接图(右)
2021
结构中,S2- 和Zn2+配位数都是4,配位多面体都 是四面体。四面体共角顶相联。
物质名称
氮化镓(Ga) 磷化硼(BP) 磷化铟(InP) 硫化锡(SnS)
氧化钴(CoO) 砷化铟(InAs) 硒化锰(MnSe) 蹄化铟(InSb)
2021
7 金刚石结构
等轴晶系,空间群Fd3m。立方面心结构。
金刚石的晶体结构中,碳原子分布在角顶和面心,以及把晶胞 八等分之后,半数交替的小立方体中心。
氧化钠(Na2O)
氧化锂(Li2O)
2021
2021
2021
5 石盐结构
空间群:Fm3m,立方面心格子。
2021
具有NaCl型结构的部分物质。
氯化物 碳化物
氯化钾
(KCl)
氯化铷
(RbCl)
碳化钛
(TiC)
碳化钒
(VC)
碳化锆
(ZrC)
氮化物
氮化钒
(VN)
氮化钛
(TiN)
氮化锆
(ZrN)
氮化钪
具有反CaI2结构的物质有: Ag2F,B2O, Ni2C
2021
2021
4 萤石结构
空间群:Fm3m,立方面心结构。 Ca分布于晶胞的角顶及面心;F分布在晶胞8等分 之后每个小立方体的中心。
2021
萤石结构可以理 解为:Ca2+ 做立 方最紧密堆积,F充填在其中全部的 四面体孔隙中。N 个球最紧密堆积有 2N个四面体空隙, 所以Ca:F= 1:2, 故得其分子式为 CaF2。
2021
具有闪锌矿型结构的物质
物质类型 氯化物 碳化物 氮化物
磷化物
硫化物
氧化物 砷化物 硒化物 蹄化物
物质名称
氯化铜(CuCl) 碳化硅 (SiC) 氮化硼(BN) 磷化硅(SiP) 磷化铝(AlP) 硫化镉(CdS) 毒砂 (HgS) 氧化镉(CdO) 砷化镓(GaAs) 硒化汞(HgSe) 蹄化铝(AlS202b1)
(ScN)
氮化铕
(EuN)
氧化物
氧化镁
(MgO)
氧化钴
(CoO)
氧化镍
(NiO)
氧化锰
(MnO)
氟化物 溴化物
氟化锂 溴化钠
(LiF) (NaBr)
氟化银 溴化钾 表9.4 与石盐等结构的物质
(AgF) (KBr)
溴化铷
(RbBr)
硫化物
硫化锰
(MnS)
方铅矿
(PbS)
2021
2021
2021
2021
2021
2021
反萤石型结构
球键图
阳离子四面体配位 阴离子立方体配位
2021
反萤石型结构可看作:阴离子做立方最紧密堆积,阳离 子充填在全部的四面体空隙中。
2021
结构类型 物质名称 萤石(CaF2)
萤石型结 氯化锶(SrCl2)
构
氯化钡(BaCl2)
氟化铅(PbF2)
氧化钾(K2O)
反萤石型 结构
Mg等单质。
Hale Waihona Puke 2021▪ 值得指出的是,部分元素的单质可以在不同条件下 形成不同的结构,或者可以有不同的结构状态共存。
▪ 如单质铁: ▪ α-铁(Iron-alpha) ---(奥氏体) --立方体心 ▪ γ-铁(Iron-gama) --(马氏体)--立方面心 ▪ ε-铁(Iron- Epsilon) --六方结构
(2) 六方结构:空间群:P63/mmc,相当于等大球 六方最紧密堆积。
▪ 属于该结构的物质主要有:Os、Ru、Re、 Zn等单质。 2021
(3) 立方体心结构:空间群:Im3m,为非最紧密 堆积方式。
▪ 属于该结构的物质主要有:T、V、W、La、Ce、
Pr、Nd、Yb、Eu、Ti、U、Ba、Sr、K、Na、Ca、
2021
萤石晶胞中存在平行于 (111)面的离子堆积层, 因此,萤石具有{111}完全 解理。
2021
阳离子配位四面体的连接:共棱联结形成的萤石结构。 晶胞中由8个 [FCa4]共棱连接而成,而且四面体的每根 棱都被共用了。
2021
阴离子配位立方体:全部共棱形成萤石结构。 [CaF8] 配位立方体沿3维方向相间排列而成。
2021
从图可看出,[SZn4] 四面体([ZnS4] 四面体 也是一样)共角顶联成的 四面体基元层与[111]方 向垂直。
由于S2-和Zn2+都呈配位四面体,所以闪锌矿只用一种配位 多面体结构形式表达(S和Zn互换是一样的)。
如果将闪锌矿结构中的Zn和S都变成C,则结构变成金刚
石结构(Fd3m)。
1 金属单质结构 2 氯化铯结构 3 CaI2结构 4 萤石结构 5 食盐结构
6 闪锌矿结构 7 金刚石结构 8 钙钛矿结构 9 层202状1 硅酸盐结构
1 金属单质结构
(1) 立方面心结构:空间群:Fm3m, 相当于等大 球立方最紧密堆积。
▪ 属于该结构的物质主要有:铝、铜、金、银、铂、 铅等单质。 2021
2021
金刚石的晶体结构可以看成是半数的C作立方最紧密堆积(蓝 球),另外一半C相间地充填在其中的四面体孔隙中(红球)而构 成的。
2021
2021
2 氯化铯(CsCl)结构
空间群:Pm3m,立方原始格子。
2021
▪ 阴离子分布在晶胞的8个角顶,阳离子充填 在其所形成的立方体空隙中。立方体共面连 接。
2021
▪ 具有该结构的物质主要有:KCl, NaCl, TiCl, RbF, CsN, NbN, NbO, AgI, TiTh等物质。
2021
具有该种结构的物质主要有: VCl2, PbI2, GeI2, PtO2, ToBr2, RhTe2, TiS2, TiSe2, TiTe2, SnS2, MnI2, NiTe2, PdTe2, PtS2, CdI2, MgI2, CaI2, CoBr2, FeBr2, FeI2, ZrS2, ZrSe2, MnBr2等。
2021
2021
3 CaI2结构
空间群:P-3m,三方原始格子。
2021
在单位晶胞中,阳离子分布在8个角顶,阴离子分 布中由上下各3个阳离子构成的正三方柱中,并间 隔地在上半部的中心和下半部的中心。
2021
2021
2021
2021
因此,该结构也可以理解为:阴离子做六方最紧密 堆积,阳离子填充在间隔一层的全部八面体空隙中。
2021
2021
(111)
(200)
(220)
2021
6 闪锌矿结构
空间群 F-43m,立方面心格子。 Zn分布于晶胞的角顶及面心。如果把晶胞8等分,S分 布于间隔的小立方体的中心。
2021
闪锌矿的晶体结构:球键图(左)、配位多面体连接图(右)
2021
结构中,S2- 和Zn2+配位数都是4,配位多面体都 是四面体。四面体共角顶相联。
物质名称
氮化镓(Ga) 磷化硼(BP) 磷化铟(InP) 硫化锡(SnS)
氧化钴(CoO) 砷化铟(InAs) 硒化锰(MnSe) 蹄化铟(InSb)
2021
7 金刚石结构
等轴晶系,空间群Fd3m。立方面心结构。
金刚石的晶体结构中,碳原子分布在角顶和面心,以及把晶胞 八等分之后,半数交替的小立方体中心。
氧化钠(Na2O)
氧化锂(Li2O)
2021
2021
2021
5 石盐结构
空间群:Fm3m,立方面心格子。
2021
具有NaCl型结构的部分物质。
氯化物 碳化物
氯化钾
(KCl)
氯化铷
(RbCl)
碳化钛
(TiC)
碳化钒
(VC)
碳化锆
(ZrC)
氮化物
氮化钒
(VN)
氮化钛
(TiN)
氮化锆
(ZrN)
氮化钪
具有反CaI2结构的物质有: Ag2F,B2O, Ni2C
2021
2021
4 萤石结构
空间群:Fm3m,立方面心结构。 Ca分布于晶胞的角顶及面心;F分布在晶胞8等分 之后每个小立方体的中心。
2021
萤石结构可以理 解为:Ca2+ 做立 方最紧密堆积,F充填在其中全部的 四面体孔隙中。N 个球最紧密堆积有 2N个四面体空隙, 所以Ca:F= 1:2, 故得其分子式为 CaF2。
2021
具有闪锌矿型结构的物质
物质类型 氯化物 碳化物 氮化物
磷化物
硫化物
氧化物 砷化物 硒化物 蹄化物
物质名称
氯化铜(CuCl) 碳化硅 (SiC) 氮化硼(BN) 磷化硅(SiP) 磷化铝(AlP) 硫化镉(CdS) 毒砂 (HgS) 氧化镉(CdO) 砷化镓(GaAs) 硒化汞(HgSe) 蹄化铝(AlS202b1)
(ScN)
氮化铕
(EuN)
氧化物
氧化镁
(MgO)
氧化钴
(CoO)
氧化镍
(NiO)
氧化锰
(MnO)
氟化物 溴化物
氟化锂 溴化钠
(LiF) (NaBr)
氟化银 溴化钾 表9.4 与石盐等结构的物质
(AgF) (KBr)
溴化铷
(RbBr)
硫化物
硫化锰
(MnS)
方铅矿
(PbS)
2021
2021
2021
2021
2021
2021
反萤石型结构
球键图
阳离子四面体配位 阴离子立方体配位
2021
反萤石型结构可看作:阴离子做立方最紧密堆积,阳离 子充填在全部的四面体空隙中。
2021
结构类型 物质名称 萤石(CaF2)
萤石型结 氯化锶(SrCl2)
构
氯化钡(BaCl2)
氟化铅(PbF2)
氧化钾(K2O)
反萤石型 结构
Mg等单质。
Hale Waihona Puke 2021▪ 值得指出的是,部分元素的单质可以在不同条件下 形成不同的结构,或者可以有不同的结构状态共存。
▪ 如单质铁: ▪ α-铁(Iron-alpha) ---(奥氏体) --立方体心 ▪ γ-铁(Iron-gama) --(马氏体)--立方面心 ▪ ε-铁(Iron- Epsilon) --六方结构
(2) 六方结构:空间群:P63/mmc,相当于等大球 六方最紧密堆积。
▪ 属于该结构的物质主要有:Os、Ru、Re、 Zn等单质。 2021
(3) 立方体心结构:空间群:Im3m,为非最紧密 堆积方式。
▪ 属于该结构的物质主要有:T、V、W、La、Ce、
Pr、Nd、Yb、Eu、Ti、U、Ba、Sr、K、Na、Ca、
2021
萤石晶胞中存在平行于 (111)面的离子堆积层, 因此,萤石具有{111}完全 解理。
2021
阳离子配位四面体的连接:共棱联结形成的萤石结构。 晶胞中由8个 [FCa4]共棱连接而成,而且四面体的每根 棱都被共用了。
2021
阴离子配位立方体:全部共棱形成萤石结构。 [CaF8] 配位立方体沿3维方向相间排列而成。
2021
从图可看出,[SZn4] 四面体([ZnS4] 四面体 也是一样)共角顶联成的 四面体基元层与[111]方 向垂直。
由于S2-和Zn2+都呈配位四面体,所以闪锌矿只用一种配位 多面体结构形式表达(S和Zn互换是一样的)。
如果将闪锌矿结构中的Zn和S都变成C,则结构变成金刚
石结构(Fd3m)。
