有机反应Chapter 1
湖南大学【无机化学】有机化学
sp2杂化态
三、 有机化合物的结构 (难点)
三、 有机化合物的结构 (难点)
3) sp杂化——CH≡CH
2p 能 量 2s
1s
基态
2p 激发
2s
1s
杂化 激发态
sp杂化态
三、 有机化合物的结构 (难点)
三、 有机化合物的结构 (难点)
3. 碳原子三种杂化态特性
杂化轨 道类型
sp
sp2
sp3
s成分 1/2 1/3 1/4
(1936—?) 美国人 (1927—?) 美国人 (1936—?) 日本人
2000年获奖
2000年获奖
2000年获奖
导电高分子聚合物
第二节 学习有机化学的重要性和方法
5. 有机化学与生命科学
1990 2005
诺 贝40 尔 奖 项30 (
20
~10
0
)
有机化学
生命科学
有机化学 生命科学
维生素B12
一、有机化合物和有机化学
无机化学 分析化学
物理有机化学 有机合成化学
化 学
有机化学
元素与金属有机化学
物理化学
生物有机化学
高分子化学
应用有机化学
一、有机化合物和有机化学
1. 有机化合物和有机化学的定义及特点 Organic :有机的、有生命的。 Organic Compound: 最初含义是指有生机之物。
1848年与富兰克兰(林)把乙腈碱性水解得到醋酸,后来发展成氰 水解合成有机酸的一般方法
第二节 学习有机化学的重要性和方法
1854年伯赛罗(M . Brethelot)合成油脂
1850-1900年,合成有机化学时代 煤焦油化学时代
100种有机化学反应

R -MgXOC OMgX H5C2O
2H5
O R R
13. Chichibabin 胺化反应 含氮杂环碱类,如吡啶,喹啉或其衍生物与金属胺基化物在一起加热,则起胺化反应, 生 成 氨 基 衍 生 物 。 产 率 一 般 为 50 % ~ 100 % 。
NaNH2 溶剂 105- 110℃, 66- 76% N N H2O 水解 NHNa N NH2
R
+RCl
AlCl 3
+ HCl
烷基化试剂除卤代烷外,醇类、烯烃、甲
苯 磺 酸 烷 基 酯 亦 可 。 各 种 路 易 斯 酸 的 催 化 效 应 : AlCl3>FeCl3> SbCl5>SnCl4>BF3>TiCl4>ZnCl2。醇类至少需 1mol 路易斯酸作催化剂。因为反应中生成 的水使等摩尔的催化剂失去活性,对于卤代烷和烯烃来说,催化量就已足够。酚类的反 应较令人满意(P258~259) ,而低碱度的芳烃如硝基苯、吡啶都不能反应。 32. Fries 重排 在当量数 AlCl3 存在下,加热脂肪或芳香羧酸苯基酯,酰基发生重排反应,脂肪酸苯基 酯比芳香酸苯基酯更易进行。根据反应条件,重排可以到邻位,也可以到对位。在低温 (100℃以下)时主要形成对位产物,在高温时一般得到邻位产物。
CH2Cl ZnCl 2
+ HCHO + HCl
+ H2O
对于取代烃类, 取代基
的性质对反应能力影响很 亲电取代,烷基,烷氧基一般使反应速度增加,而卤素、 羧基特别是硝基 用乙醛得到氯乙基化。在某些情况下用相应当醛可有氯丙基 代 替 HCl,溴甲基化以及在特殊情况下的碘甲基化都可发生。氯甲基化试剂除 HCHO/HCl 外,也可用 H2C(OMe)2/HCl 或 MeOCH2Cl 来代替。这个反应在有机合成上甚为重要, 因导入氯甲基后进一步可转化为-CH2OH,-CHO,-CH2CN,-CH2NH2 及-CH3 等基团。 7. Bouvealt 合成法 N,N-二烷基甲酰胺与一分子格氏试剂在干醚的存在下发生作用,生成的中间产物再经水 解,可得醛类化合物,R’MgX 中 R’基团越大,醛的产率越高。
有机化学和有机化合物(organic

第一章 绪 论Chapter 1 introduction第一节 有机化学和有机化合物(organic chemistry and organic compounds )一、有机化学的研究对象有机化学是化学学科的一个重要分支,它诞生于19世纪初期,迄今不足200年,但已成为与人类生活有着密切关系的一门学科。
有机化学的研究对象是有机化合物。
有机化合物大量存在于自然界,如粮、油、棉、麻、毛、丝、木材、糖、蛋白质、农药、塑料、染料、香料、医药、石油等大多数都是有机化合物。
1828年,德国化学家伍勒在研究氰酸盐的过程中,意外地发现了有机物尿素的生成。
这是世界上第一次在实验室的玻璃器皿中从无机物制得有机物。
有机化合物就是碳氢化合物及其衍生物..........,有机化学就是研究碳氢化合物及其衍生物的化..............学.。
在化学上,通常把含有碳氢两种元素的化合物称为烃。
因此,有机化合物就是烃及其衍....生物..,有机化学也就是研究烃及其衍生物........的化学。
二、有机化学与农业科学的关系有机化学既是学习农业科学的基础,又是进行农业科学研究的工具。
因此,只有掌握有机化学的基本理论、基本知识和基本操作技能,才能更好地学习农业科学技术和从事农业科学的研究。
三、有机化合物的特性有机化学作为一门独立的学科,其研究的对象有机化合物与无机化合物在性质上存在着一定的差异。
有机化合物一般具有如下特性。
1.易燃烧除少数例外,一般有机化合物都含有碳和氢两种元素,因此容易燃烧,生成二氧化碳和水,同时放出大量的热量。
大多数无机化合物,如酸、碱、盐、氧化物等都不能燃烧。
因而有时采用灼烧试验可以区别有机物和无机物。
2.熔、沸点低在室温下,绝大多数无机化合物都是高熔点的固体,而有机化合物通常为气体、液体或低熔点的固体。
例如,氯化钠和丙酮的相对分子质量相当,但二者的熔、沸点相差很大。
NaCl (氯化钠) CH 3COCH 3 (丙酮)相对分子质量 58.44 58.08熔点∕o C 801 -95.35沸点∕o C 1413 56.2大多数有机化合物的熔点一般在400 oC 以下,而且它们的熔、沸点随着相对分子质量AgOCN+NH4CNH4OCN+AgClNH4OCNNH2的增加而逐渐增加。
有机化学结构与功能第一章

The structure of the molecule is related to the reactions that it can undergo
What is organic synthesis? Organic synthesis is the making of new organic molecules
有 机化
H
C Br
Cl F
1
学
Chapter 1 Structure and Bonding In Organic Molecules
1-1 1-2 1-3 1-4 1-5 1-6 1-7 1-8 1-9 The Scope of Organic Chemistry: An Overview Coulomb Forces: A Simplified View of Bonding Ionic and Covalent Bonds: The Octet Rule Electron-Dot Model of Bonding: Lewis Structures Resonance Forms Atomic Orbitals: A Quantum Mechanical Description Molecular Orbitals and Covalent Bonding Hybrid Orbitals: Bonding in Complex Molecules Structures and Formulas of Organic Molecules
14
Elements tend to form molecules in such a way
有机化学英文课件chapter1

•• ••
••
Na+ F• • ••
• in forming Na+F-, the single 3s electron from Na is transferred to the partially filled valence shell of F
N a(1s22s 22p63s1) + F(1s 22s22p5)
1-7
Electron Configuration of Atoms
The pairing of electron spins
1-8
Electron Configuration of Atoms
Table 1.3 The Ground-State Electron Configuration of Elements 1-18
1-6
Electron Configuration of Atoms
Aufbau Principle:
• orbitals fill in order of increasing energy from lowest energy to highest energy
Pauli Exclusion Principle:
• an atom that gains electrons becomes an anion • an atom that loses electrons becomes a cation • the attraction of anions and cations leads to the
卤化反应

C 16 H 30 CH 3 Br2 /AcOH HO AcONa/Et2 O CH 3 HO HO H H HO H Br CH 3
C 16 H 30
Br C 16H 30 CH 3 Br Br
常见的副反应:1)当双键上有季碳取代基时,则重排生成副 产物。2)当邻位存在有利于烯烃重排的基团时,则易重排。
Br
Ph
H NBS/DMSO/H2O C C H CH3
Ph C HOH
Br H C CH3
第一节 不饱和烃的卤加成反应 三、不饱和烃和次卤酸(酯),N-卤代酰胺的反应
NBS
英文名称:N-Bromosuccinimide 别名:N-溴代琥珀酰亚胺。
NCS : N-氯代琥珀酰亚胺 NBA:N-溴代乙酰胺 NCA:N-氯代乙酰胺
+
立体化学问题
Me
Me
Br2
HO
Br Br
Me
HO Cl2 HO
Cl
Cl
立体化学主要取决于烯烃的结构及反应中的空间阻碍因素
1)无位阻的脂肪直链烯烃中,由于双键平面上、下二方均
有可能形成三元过渡态,而卤素负离子优先进攻其中能使 C+更稳定的双键碳,于是得到反向加成的外消旋化合物。 2)脂环烯烃的卤素加成反应中,由于存在邻位取代基的空 间障碍,故卤素必须进攻在双键平面位阻小的一面形成桥卤 离子,然后,卤负离子也从环的背面进攻有利于C+的部 位,形成1,2-二卤化物。如:
第一节 不饱和烃的卤加成反应
三、不饱和烃和次卤酸(酯),N-卤代酰胺的反应
t-BuOCl/ROH
Cl EtO
O
ROH EtO
O
Cl
OR
EtO
有机化学的10种反应类型

在σ迁移反应中,σ键在共轭体系中进行迁移,形成环状过渡态,然后生成产物。σ迁移反 应通常涉及π电子和σ电子的相互作用,因此也被称为π-σ反应。
07
酯化反应和酯交换反应
Chapter
酯化反应
酸催化酯化
羧酸与醇在酸性催化剂存在下加热,生成酯和水 。
碱催化酯化
羧酸盐与醇在碱性催化剂存在下加热,生成酯和 相应的盐。
某些芳香族化合物在特定条件下,也可以发生加聚反应生成高分子 化合物。
缩聚反应
酰胺化缩聚反应
羧酸和胺在催化剂的作用下,发 生酰胺化缩聚反应生成聚酰胺。
酚醛缩聚反应
酚和醛在催化剂的作用下,发生 酚醛缩聚反应生成酚醛树脂。
尿素甲醛缩聚反应
尿素和甲醛在催化剂的作用下, 发生尿素甲醛缩聚反应生成脲醛 树脂。
02 反应过程中,酮肟的氮原子上的羟基和碳原子上 的氢原子发生迁移,形成新的碳氮键。
03 贝克曼重排是一种重要的有机合成方法,可用于 制备多种酰胺类化合物。
霍夫曼重排
霍夫曼重排是指酰胺在溴或氯的存在下,加热发生分子 内重排生成少一个碳原子的伯胺的反应。
反应过程中,酰胺的羰基碳原子上的氢原子和氮原子上 的烃基发生迁移,形成新的碳氮键。
烯烃和炔烃的亲电加成
烯烃和炔烃在亲电试剂(如卤素、氢卤酸、硫酸等)的作用 下,可以发生亲电加成反应,生成相应的卤代烃或硫酸酯等 。
芳香烃的亲电加成
芳香烃在亲电试剂(如硝酸、硫酸、氯化铁等)的作用下, 可以发生亲电取代反应,生成相应的硝基化合物、磺酸酯或 氯化物等。
自由基加成反应
烯烃和炔烃的自由基加成
酯化缩聚反应
羧酸和醇在催化剂的作用下,发 生酯化缩聚反应生成聚酯。
乙烯基化合物的缩聚反应
有机化学Chapter醇和醚

X-
RX
1。醇:SN 2
差的离去基团 好的离去基团
R-OH H+ R-O+H2 -H2O R+ X- RX
正碳离子
3。、2。醇:SN 1
醇与HX反应时,常伴有重排现象
CH3 CH3-C-CH 2OH
HBr
CH3
CH3
CH3-C-CH2CH3 + CH3-C-CH2Br
CH3
Br
CH3
(主要产物) (次要产物)
R
R
R
H-O H-O H-O H-O H-O
思考:乙二醇和甘油的沸点高低?
答案: 乙二醇 197℃ 丙三醇 290 ℃
② 溶解度:
醇在水中有一定的溶解度。C3以下醇与水混溶, C4以上随C数↑,溶解度↓。
原因:
a. 醇与水可形成分子间氢键:
R
H
R
H
R
H-O H-O H-O H-O H-O
b. 随C数↑,R在ROH中比例↑,而R一般是疏水的。
H2
CC2l3HC5COHH2O+HNa>OCHlCH2CH2OHC2>HC5OHN3CaH+2HC2HO2OH
碱性 碱性:ROH + H
ROH2 钅羊离子
低级醇能与氯化钙形成络合物—结晶醇(CaCl2·4C2H5OH)
不能用氯化钙干燥醇 可用氯化钙去除少量杂质醇
2、与无机酸的作用
醇与酸失水生成酯。
较低温度
CH3CCHH22OOH-H+ 浓H2SO4 CHO H + 3HO-N
140oC
O
170oC
CH2O-H
O
CH3CHC2HO2COHN2OCH2 3 CH2=CCHH2 ONO 2 + 3H2O
有机化学习题集

第一章 绪 论Chaper1 intrduction1.将下列凯库勒式改写成路易斯式。
(1)(2)(3)(4)HH H H HH H HHHH HC C CC C C N OOO O ClO OO C HHHHH(5)(6)C 2H 5OH浓 H 2SO 4CH 2=CH 2 + H 2O 的反应热试计算23. 某化合物仅含碳、氢、氧元素,燃烧纯的该化合物 2.642mg ,得到CO 2 7.638mg,H 2O2.518mg ,试求其经验式。
4. 某化合物含碳45.44%、氢9.11%、氮21.20%、分子量132,求其分子式。
5. 试举例说明有机化合物在日常生活中的应用。
第二章 烷烃 Chapter 2 alkanes1、 写出下列化合物的构造式:1、 正戊烷 异戊烷 新戊烷2、 2,2,3-三甲基戊烷3、四甲基丁烷4、3-甲基-4-乙基己烷5、3-甲基-3-乙基-6-异丙基壬烷6、 2,5-二甲基-3,4-二氯己烷 2、 写出下列烷基的名称:CH 3CHCH 231.CH 3CH 2CH32.CH 3CHCH 2CH 2CH 233.(CH 3)3C CH 24.(CH 3)3C5.CH 33CH 36.3、 将下列化合物用系统命名法命名:(CH 3CH 2)22CH 22CH 3CH 3CH(CH 3)21. 2.CH 3CH 22CH 2CH 3CH(CH 3)23.(CH 3)2CCHCH 2CH 3CH 2CH 2CH 3CH 2CH 2CH 3(CH 3)2CHCHCHCCH 2CH 3CH 3CH 32CH 2CH 34.5.CH 3CH 2CHC 2CH 3CH 3CH 32CH 2CH 3CH 36.(CH 3CH 2CCH 2CH 2CH 3)3CHCH 3CH 37.CH 3CH 2CH 2CHCH 2CH 2CH 33)3(CH 3)3CCH 2CH(CH 2CH 3)28.4、 将下列烷烃的沸点按从高到低的顺序排列,然后与手册核对。
北京化工大有机化时Chapter杂环化合物补充

•α-C质子化
•β-C质子化
•N-质子化
•
•(3) 由于-C的质子化反应,吡咯在强酸作用
•
下会因聚合而被破坏;
•(4) 在稀的酸性水溶液中,呋喃的质子化在氧
•
上发生并导致水解开环。
•
2. 呋喃、噻吩、吡咯的亲电取代反应 •(1)概述
•*1 亲电取代反应的活性顺序为:
•①电子密度 ②σ-络合物
•八隅体结构最稳定
•
三 唑的反 应
•
•
•一 唑的结构
(1)互变异构
•N-N(单键) •N=N(双键)
•4-甲基咪唑
•5-甲基咪唑
•4(5)-甲基咪唑(因为4-甲基咪唑和5-甲基咪唑不可分离)
•
•(2)结构
•吡啶N(孤电子对不参与 共轭,所以碱性较强)
•碱性:
•吡咯N(孤电子对参与 共轭,所以碱性较弱)
•N 的孤电子对处 于sp2杂化轨道
•
•三 呋喃、噻吩、吡咯的反应
•1. 呋喃、噻吩、吡咯的质子化反应 •2. 呋喃、噻吩、吡咯的亲电取代反应 •3. 呋喃、噻吩、吡咯的加成反应
•
1. 呋喃、噻吩、吡咯的质子化反应 •分子接受一个质子的反应称为质子化反应.
•(1)呋喃、噻吩、吡咯在酸的作用下可质子化; •(2) 质子化反应主要发生在C-2上;
•r••.••t.
•B•a••(O•H••)2
•S•O•3
•B•a•2•+ •S •S•O•3•- •2
•
(4) 呋喃、噻吩、吡咯的卤化反应
• 反应强烈,易得多卤取代物。为了得一卤代(Cl, Br)产 物,要采用低温、溶剂稀释等温和条件。
•碘不活泼,要用催化剂才能发生一元取代
Chapter1 过渡金属(transition metal)介入的高选择性有机合成
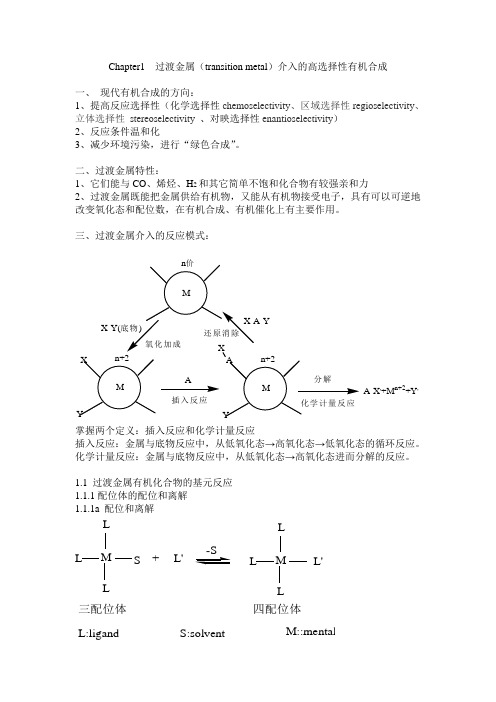
Chapter1 过渡金属(transition metal)介入的高选择性有机合成一、现代有机合成的方向:1、提高反应选择性(化学选择性chemoselectivity、区域选择性regioselectivity、立体选择性stereoselectivity、对映选择性enantioselectivity)2、反应条件温和化3、减少环境污染,进行“绿色合成”。
二、过渡金属特性:1、它们能与CO、烯烃、H2和其它简单不饱和化合物有较强亲和力2、过渡金属既能把金属供给有机物,又能从有机物接受电子,具有可以可逆地改变氧化态和配位数,在有机合成、有机催化上有主要作用。
三、过渡金属介入的反应模式:A-X,+M n+2+Y,插入反应X-Y(掌握两个定义:插入反应和化学计量反应插入反应:金属与底物反应中,从低氧化态→高氧化态→低氧化态的循环反应。
化学计量反应:金属与底物反应中,从低氧化态→高氧化态进而分解的反应。
1.1 过渡金属有机化合物的基元反应1.1.1配位体的配位和离解1.1.1a配位和离解M SLLL+MLLLL'L'三配位体四配位体L:ligand S:solvent M::mental外层:18个电子,饱和。
∴:K适中K很大,络合物太稳定;拿不到纯化合物K很小,络合物很不稳定。
常采用的配位络合物特征:(1)容易生成配位饱和的(saturate)络合物而得以分离纯化;(2)其中某个配体又容易在温和条件下解离,生成配位不饱和的络合物,从而与底物发生反应。
ex: 3)3 (饱和)Co271s22s22p63s23p63d74s2 外层电子很快提供9个电子,9个外层电子:外层达18个电子CoH(PPh3)3(不饱和))4(饱和)Pd461s22s22p63s23p离异外层电子5s24d83)3(不饱和)+PPh3Fe(CO)5(10个电子)Fe26 4s23d6Mo(N2)2(dppe)2 dppe=Ph2PCH2CH2PPh2双磷配体Mo42 5s24d4Cod:环辛二烯Ni:4s23d81.1.16 过渡金属与烯烃的配位乙烯与金属配位步骤1:烯烃的成键π轨道供给电子和金属的空d轨道相重叠。
有机化学反应机理(总结最好的)(共143张PPT)详解

实例:卤代烃双分子亲核取代反应的反应机理(SN2)
C6H13
H Br
C6H13 H HO CH3 Br HO
C6H13 H
HO - +
H3C
+ Br CH3
有两种分子参与了决定反应速度关键步骤的亲核取代反应 称为SN2 反应
构型保持和构型翻转
n-C6H13 H CH3
n-C6H13 H CH3
C
慢
N O O NO2
在芳香亲核取代反应中,吸电子基是一个 活化的邻对位定位基。
应用实例
O2N
OC2H5 + H2N NO2
-X
O OCH3
180 C
o
O2N
HN NO2
+ EtOH
HX
HO OCH3
-NO2
HNO2
SN1Ar反应机理
[C6H5N2]+ClF
HBF4
[C6H5N2] BF4
+
-
-N2
常用的催化剂有盐酸 、硫酸、苯磺酸等
CH3COOH + C2H5OH 投料 1 1 : : 1 10
H+
CH3COOC2H5 + H2O 产率 67% 97%
酯化反应是一个可逆的反应,为了使正反应有利, 通常采用的手段是: ①使原料之一过量; ②不断移走产物(例如除水;乙酸乙酯、乙酸、水 可形成三元恒沸物 bp 70.4℃)。
2 H 2SO4
— H 3O + HSO 4 + SO3
SO3H
稀 H2SO4 100 - 170oC
+ H2SO4
6 1,2-环氧化合物的开环反应
环氧乙烷类化合物的三元环结构使各原子的轨道不能正面充 分重叠,而是以弯曲键相互连结,由于这种关系,分子中存在一 种张力,极易与多种试剂反应,把环打开。酸催化开环反应时, 首先环氧化物的氧原子质子化,然后亲核试剂向C−O键的碳原子 的背后进攻取代基较多的环碳原子,发生SN2反应生成开环产物。 这是一个SN2反应,但具有SN1的性质,电子效应控制了产物,空 间因素不重要。碱性开环时,亲核试剂选择进攻取代基较少的环 碳原子,C−O键的断裂与亲核试剂和环碳原子之间键的形成几乎 同时进行,并生成产物。这是一个 SN2反应,空间效应控制了反 应。
有机反应机理知识点归纳

有机反应机理知识点归纳
有机反应机理是有机化学中非常重要的一部分,它描述了有机分子之间发生化学反应的详细过程。
下面是一些常见的有机反应机理知识点归纳:
1. 反应类型:
- 加成反应:两个单体结合形成一个新的化合物。
- 消去反应:一个大分子分解成两个或更多小分子。
- 变位反应:分子内原子或基团的位置重新排列。
- 取代反应:一个原子或基团被另一个原子或基团取代。
2. 反应机理的步骤:
- 初始步骤:包括反应物的活化和生成中间体。
- 中间体的转化:中间体经历一系列的转化步骤,最终形成产物。
- 生成产物:最终产物生成并结束反应。
3. 催化剂的作用:
- 催化剂可以加速反应速率,降低活化能。
- 酶是生物体内常见的催化剂。
4. 反应速率与反应底物浓度的关系:
- 当反应底物浓度增加时,反应速率也会增加。
- 反应速率与浓度之间的关系可以通过速率方程式表示。
5. 质子转移反应:
- 质子可以从一个分子转移到另一个分子,形成质子化和去质子化产物。
- 质子转移反应在有机化学中非常常见。
6. π电子的参与:
- π电子可以作为电子云,参与化学反应中的电子迁移。
以上是有机反应机理的一些常见知识点归纳,希望对您有所帮助。
(完整版)有机化学反应机理详解(共95个反应机理)

一、Arbuzow反应(重排)亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzow反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
有机化学反应方程式大全
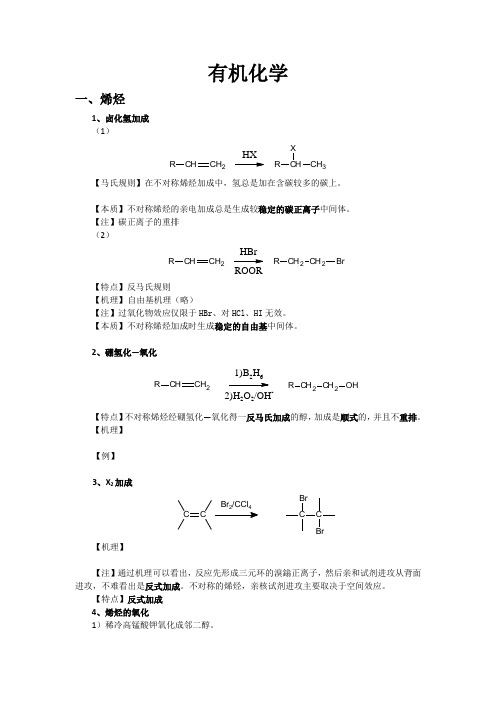
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
2、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】【例】3、X 2加成C CBr /CCl CC BrBr【机理】【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成 4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
3H 33H3稀冷KMnO433M n O OOOH 2O 3H 33H 3 2)热浓酸性高锰酸钾氧化C C H R R 2R 1KMnO 4H +CRR 1O +R 2CO3)臭氧氧化C C H R R 2R 1CRR 1O +R 2CHO1)O 32)Zn/H 2O4)过氧酸氧化C C HR R 2R 1ROOOH21C CH R R 2R 121Ag+O 25、烯烃的复分解反应CH 2RCH 2R 1+催化剂C H 2CH 2RR1【例】6、共轭二烯烃 1)卤化氢加成CH CH 2HXCH 3XCH 2CH 3X高温1,4加成为主低温1,2加成为主2)狄尔斯-阿德尔(Diels-Alder )反应【描述】共轭二烯烃和烯烃在加热的条件下很容易生成环状的1,4加成产物。
【例】CH 2CH 2+苯C H O2C HO二、脂环烃1、环丙烷的化学反应【描述】三元环由于张力而不稳定,易发生加成反应开环,类似碳碳双键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Mechanism involved: (a) Stable, reasonable species (b) Protonation and Removal of Protons (c) Intramolecular proton transfer
How do we know whether they are stable or not under a particular reaction condition?
O O C CD3 H H
BrMg O O C CH3 D
O O C CH3 D H
BrMg O O C CD3 H O D2 O C CD3 D H O C CD3 C CD3
CH3 MgBr
C CH3
C CH3
+
CH3 MgBr
C CD3
CH3D
+
CH4
Isotope Effect
O O
H2O
C CH3
O C CH3
pKa: pKa: 26.5
Why doesn’t the hydrogen abstraction happen at methyl group?
The protons of CH2 are more acidic than those of CH3
Mechanisms of Organic Reaction
H
(2) MeO
O
O
Cl
NaI Acetone
MeO
O
O
+
HI
+
Cl
-
Examples and Problems, You Will Start to Develop a Feel for This as Well.
Dual Functions of a Lewis Base as: Base: abstract a proton Nucleophile: Nucleophile: react with a positively charged atom
OTg COOMe
Na2CO3
Mechanisms of Organic Reaction
Mechanisms of Organic Reaction
Mechanism
I NaI Acetone MeO O O I
Tip
Cl
I
(1) MeO
O
O
+
Cl
-
Predicting the Course of a Reaction Can Be a More Difficult Task. However, As You Work Through a Number of
Mechanisms of Organic Reaction
Mechanisms of Organic Reaction
O
2.2 ElectronElectron-Rich Species: Bases or Nucleophiles? Nucleophiles?
O C CH2 CH3 CH3 O C CH O C CH3
CH3 MgBr
H CH H
C
+
C
CH4
CH3
pKa: pKa: 9.0
O C CH3 CH3 CH2
O CH3 MgBr O C CH2 CH3 CH2 BrMg O C CH2 O D2O CH2D C CH2 O C CH3 O C CH3
HO O2N
Mechanism
SOCl2
+
H CH2
C
+ CH4
MeO
O
O
OH
MeO
O
O
Cl
NaI Acetone
MeO
O
O
I
OH COOMe
TgO O2N
Mechanisms of Organic Reaction
Mechanisms of Organic Reaction
1.9 Nucleophiles / Electrophiles Definition: Nucleophiles / Electrophiles 亲核剂 / 亲电剂
C8H17 O H3C O Cl N
O C CH3 O: Esterification
H O C H O H O C H CH3 O HOCH3 H
O
CH3
O
CH3 O
CH3
CH3
C OH
C O H OCH3
+
CH3
CH3OH
+
O H
O C CH3 O OH2 CH3
O CH3 H C O H OH2 O
Mechanisms of Organic Reaction
2.2 ElectronElectron-Rich Species: Bases or Nucleophiles? Nucleophiles?
O O C CH3 D D
2.2 ElectronElectron-Rich Species: Bases or Nucleophiles? Nucleophiles?
PhSO3H 5%HCl
NH2
- 2.8 0
PhSO3Cl NH2
H2O
H2 N NH2
13.4
HN NH2
Dual functions of electronelectron-rich species MediaMedia-dependant mechanism: solvent, pH Structural Conformity between starting materials and products
Basic expression: balancing equations (atoms, charge), arrow direction (electron flow) Driving force: leaving groups/stable species Stability of intermediates: octet rule,structure, solvent
O O C CH3 H H
BrMg O O C CH3 H
O H2O C CH3 H H O C CH3
BrMg O O C CH3 H
O H2O C CH3 H H O C CH3
CH3 MgBr
C CH3
C CH3
+
CH4
CH3 MgBr
C CH3
C CH3
+
CH4
What’s the side product after workup?
What species are stable in strong acid like HCl ?
H
O H
H
O
H
?
H
O
H
?
Mechanisms of Organic Reaction
Mechanisms of Organic Reaction
Example 1: Hydrolysis of Methyl Acetate in NaOH
pKa values
Mechanisms of Organic Reaction
Mechanisms of Organic Reaction
Typical Acidities of Common Organic and Inorganic Substances
Conjugate Acid
HCl
Principles for writing mechanisms (game rule)
OMgBr
c. CH3 MgBr +
Cl
d.
+ H Cl
Mechanisms of Organic Reaction
Mechanisms of Organic Reaction
Prolegomena
2.1 Mechanisms in Acidic and Basic Media
In writing a reaction mechanism, ……, ……, These mechanisms do not have any objective existence; they are merely our attempt to represent what is going on in a reaction…… reaction…… we are free to write whatever mechanism we choose, subject only to the constraint that we conform to generally accepted mechanistic patterns.
CH3
O CH3 C O H O
CH3
+
H 3O
O CH3 C O CH3
Incorrect !
+
H3O
+
H2O
1
Mechanisms of Organic Reaction
Mechanisms of Organic Reaction
Example 2: Esterification
2.1 Mechanisms in Acidic and Basic Media
1
2
C H
3
H
C CH3
CH3
H 1 CH H
2
O C
O
D O O C CD3 H CD3
3
CH2
