双向电泳原理及实验步骤(1)
双向电泳

30% Acrylamide储液
搅拌溶解 10% NP40 两性电解质(pH3~9.5) 10% 过硫酸铵*
1.6 mL
1.5 mL 0.50 mL 15 µ L
TEMED*
10 µ L
State Key Laboratory of Food Science and Technology
PART 3 实验方法 (3)灌制第一向凝胶 取1支1 mL注射器和一根长针头,吸取约0.5mL第一向凝胶
约7~8 h)停止电泳。如果聚焦好的凝胶不能马上进行第二向电
泳,在管内放置了几小时以上, 可在走第二向电泳之前再聚焦 电泳1~2h,以消除样品受扩散的影响。 (7)退胶 电泳结束后,在整极端凝胶内插入约1cm长的铜丝作为标
记,用洗耳球从玻璃管上样端轻轻挤入空气,将凝胶退胶或
用10mL注射器和长针头吸入一定的蒸馏水,将长针头一边沿 管壁推入一边注入蒸馏水使凝胶退出。
入覆盖溶液至管口。
(5)安装电泳槽 加样后将玻璃管插入电泳槽的架子上,在上
槽中玻璃管上端露出1 cm,剥去玻璃管下端的封口膜,准备 电泳。在电泳槽的下槽加2000 mL 10 mmol/L H3PO4溶液,将 柱胶下端浸入到H3PO4溶液中,注意胶下端不可有气泡(如果
有气泡,可以先用注射器将胶下端用H3PO4溶液灌满,再将
冰箱中可保存3~4个星期。
State Key Laboratory of Food Science and Technology
PART 3 实验方法 3.实验步骤 (1)准备玻璃管 取4支18 cm的长玻璃管,洗净晾干。
表1 第一向凝胶溶液配方 尿素 重蒸水 3.84 g 2.0 mL
(2)配制第一向凝胶溶液(8mL /4组) 配制方法见表1。
蛋白质双向电泳的基本原理(一)

蛋白质双向电泳的基本原理(一)蛋白质双向电泳的基本原理蛋白质双向电泳是一种常用的分离和分析蛋白质的技术方法。
它通过利用蛋白质在电场中移动的特性,结合两个方向的电场,实现对复杂蛋白质混合物的分离和鉴定。
下面将从浅入深地解释蛋白质双向电泳的基本原理。
1. 电泳的基本原理电泳是一种基于物质在电场中迁移的原理,将带电粒子或分子分离开的技术。
在电泳过程中,带电的蛋白质分子会受到电场的作用力而移动,移动的速度与其电荷大小和分子质量有关。
2. 单向电泳的局限性在传统的单向电泳中,蛋白质样品被施加一个方向的电场,使得蛋白质分子按一维的方向进行迁移。
然而,由于蛋白质复杂性和电泳条件的限制,单向电泳难以有效地分离复杂的蛋白质混合物。
3. 双向电泳的优势双向电泳是为了克服单向电泳的局限性,实现更好的分离效果而发展起来的一种电泳技术。
它利用两个方向的电场交替施加,使得蛋白质分子在水平和垂直方向上均发生迁移,从而实现更高分辨率的蛋白质分离。
4. 蛋白质双向电泳的操作步骤•第一维电泳:将蛋白质样品在一个细长的电泳槽中垂直施加电场,使得蛋白质在水平方向上移动。
一般使用等电聚焦(IEF)技术,根据蛋白质的等电点来完成分离。
•电泳缓冲:在第一维电泳过程中,需要使用特定的电泳缓冲液,以确保蛋白质在移动过程中维持稳定的电荷状态。
•Gel转移:第一维电泳后,将蛋白质分离到一根细长的凝胶条上,凝胶条上有各种不同pH值的缓冲液。
•第二维电泳:将凝胶条垂直放置在另一个电泳槽中,施加另一个方向的电场。
凝胶条上的蛋白质会在垂直方向上继续移动,最终得到更高分辨率的蛋白质分离结果。
5. 蛋白质双向电泳的应用蛋白质双向电泳在生物医学和生命科学研究中得到广泛应用。
它被用于分离和鉴定复杂蛋白质混合物,寻找新的蛋白质标记物或生物标志物,研究蛋白质的功能和相互作用等。
6. 结论蛋白质双向电泳是一种重要的分离和鉴定蛋白质的技术方法,通过结合两个方向的电场,实现对复杂蛋白质混合物的高效分离。
双向电泳详细操作过程
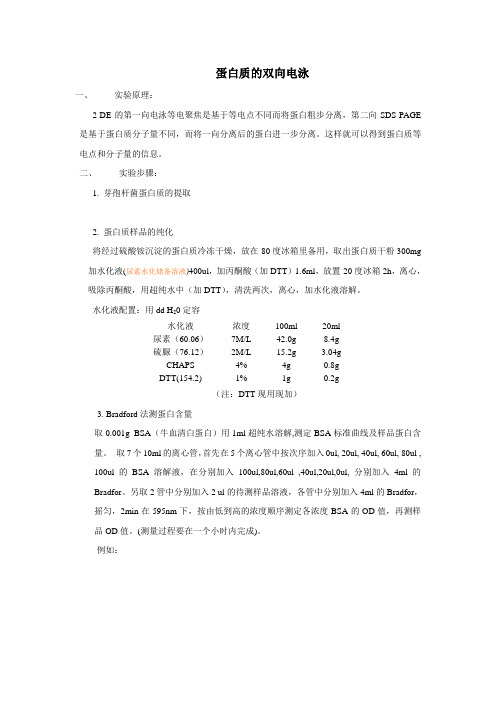
蛋白质的双向电泳一、实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE 是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。
这样就可以得到蛋白质等电点和分子量的信息。
二、实验步骤:1. 芽孢杆菌蛋白质的提取2. 蛋白质样品的纯化将经过硫酸铵沉淀的蛋白质冷冻干燥,放在-80度冰箱里备用,取出蛋白质干粉300mg 加水化液(尿素水化储备溶液)400ul,加丙酮酸(加DTT)1.6ml,放置-20度冰箱2h,离心,吸除丙酮酸,用超纯水中(加DTT),清洗两次,离心,加水化液溶解。
水化液配置:用dd H20定容水化液浓度100ml 20ml尿素(60.06)7M/L 42.0g 8.4g硫脲(76.12)2M/L 15.2g 3.04gCHAPS 4% 4g 0.8gDTT(154.2) 1% 1g 0.2g(注:DTT现用现加)3. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0ul, 20ul, 40ul, 60ul, 80ul , 100ul的BSA溶解液,在分别加入100ul,80ul,60ul ,40ul,20ul,0ul, 分别加入4ml的Bradfor。
另取2管中分别加入2 ul的待测样品溶液,各管中分别加入4ml的Bradfor,摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。
(测量过程要在一个小时内完成)。
例如:标准曲线方程式:Y= aX+b.其中Y为OD值,X为蛋白含量。
a、b通过作图输入数据可知G250的配置:称取G250 固体0.1g加水定容至1L。
使用前滤纸过滤。
比色皿用70%的乙醇保存,待用时用双蒸水冲洗,再用无水乙醇冲洗,双蒸水冲洗,再加入待测样品溶液润洗,然后,加入样品,测定OD值。
双向电泳技术的原理及应用

双向电泳技术的原理及应用1. 原理双向电泳技术是一种分离和鉴定蛋白质的常用方法。
它结合了凝胶电泳和电泳移动的优势,可以在同一实验中实现更高的分辨率和更好的分离效果。
双向电泳的原理基于两个关键因素:分子大小和电荷。
在实验中,蛋白质样品首先沿一个方向进行电泳。
由于蛋白质的不同大小和电荷,它们会在凝胶中形成不同的带状图案。
然后,凝胶会旋转90度,使蛋白质在垂直方向上进行电泳。
这样一来,蛋白质会在另一个方向上发生分离。
双向电泳的核心是双向凝胶,其结构类似于二维网络。
在第一个方向上,凝胶中的蛋白质会形成一维图案,而在第二个方向上,蛋白质会形成另一维图案。
通过对这两个图案的分析,可以得到更为准确的蛋白质信息。
2. 应用2.1 蛋白质分离和纯化双向电泳技术在蛋白质分离和纯化中有着广泛的应用。
由于双向电泳可以提供更高的分辨率,可以分离和鉴定更多的蛋白质。
这在研究蛋白质结构和功能以及疾病诊断中具有重要意义。
2.2 蛋白质组学研究双向电泳技术在蛋白质组学研究中发挥着重要作用。
通过双向电泳,可以分离出复杂样品中的蛋白质,并获得其质量和电荷信息。
这些信息可以用于鉴定蛋白质和研究其功能。
2.3 药物研发双向电泳技术在药物研发中也有广泛的应用。
通过双向电泳,可以分离和鉴定药物的靶点,进一步了解药物与蛋白质的相互作用机制。
这对于药物设计和优化具有重要意义。
2.4 分子生物学研究双向电泳技术在分子生物学研究中有着重要的应用。
通过双向电泳,可以鉴定蛋白质的表达变化,从而了解基因表达调控机制。
这对于研究细胞功能和疾病发生机制具有重要意义。
2.5 环境监测双向电泳技术在环境监测中也有着广泛的应用。
通过双向电泳,可以分离和鉴定环境中的污染物,从而评估环境质量和污染程度。
这对于环境保护和治理具有重要意义。
3. 优缺点3.1 优点•分辨率高:双向电泳可以提供更高的分辨率,可以分离和鉴定更多的蛋白质。
•信息丰富:双向电泳可以获得蛋白质的质量和电荷信息,有助于了解蛋白质的结构和功能。
蛋白质双向电泳实验流程

蛋白质双向电泳实验流程一.样品制备1.研磨研磨时间要尽量短,并需及时补充液氮,研磨要充分,同时要保证损失少。
2.重新加入8mltris饱和状态酚(ph8.8)和8ml裂解液,在通风橱内研磨30s。
先加8mltris饱和状态酚,tris饱和状态酚会变为液态,此时需以研磨碓将液态的tris饱和状态酚研磨变成小块。
接着重新加入8ml裂解液,也须要将液态的裂解液研磨变成小块。
等三者搅匀后,将粉末迁移至45mltube。
3.振荡30min。
室温静置,等待tube中液态变为液体后,已经开始震荡。
震荡须要持续30min,每震荡1min,放在冰上加热1min。
4.10000g,4℃,10min。
将酚相(topphase)转移至45mltube。
酚相(topphase)可置于冰上。
酚二者必须就是绿色的,水相必须就是淡黄色的。
5.取6ml的抽提液和6ml饱和酚加入水相,蜗旋振荡30min。
振荡需持续30min,每振荡1min,置于冰上冷却1min。
6.10000g,4℃,10min。
将酚二者(topphase)迁移至45mltube。
7.沉淀酚相。
取一定体积(是酚相的5倍)的0.1m乙酸铵/甲醇溶液(c20℃保存)于酚相(45mltube)。
振荡30s,c20℃培育1h或过夜。
8.冲洗结晶①15min,20,000g,4℃。
弃上清。
②提10ml0.1m乙酸铵/甲醇溶液,用移液器吸打。
c20℃结晶30min。
③15min,20,000g,4℃。
弃上清。
④重新加入10ml乙酸铵/甲醇溶液,用移液器吸打。
c20℃结晶30min。
⑤15min,20,000g,4℃。
弃上清。
⑥提10ml80%丙酮(ice-cold),用移液器吸打。
c20℃结晶30min。
⑦15min,20,000g,4℃。
弃上清。
⑧重新加入10ml80%丙酮(ice-cold),用移液器吸打。
c20℃结晶30min。
⑨15min,20,000g,4℃。
弃上清。
双向电泳操作步骤

双向电泳操作步骤双向电泳操作步骤及相关溶液配置A(实验过程一实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。
这样就可以得到蛋白质等电点和分子量的信息。
二实验步骤:1. 样品的溶解取纯化后的晶体蛋白3.0mg,加入300ul裂解液(1mg蛋白:100ul裂解液)振荡器上振荡10min左右,共处理一个小时。
其中每隔10,15分钟振荡一次,然后13200rpm离心15min除杂质,取上清分装,每管70ul,—80oC保存。
2. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0ul, 5ul,10ul, 15ul, 20ul 的BSA溶解液,另2管中分别加入2 ul的待测样品溶液,再在每管中加入相应体积的双蒸水(总体积为80ul),然后,各管中分别加入4ml的Bradford液(原来配好的Bradford液使用前需再取需要的剂量过滤一遍方能使用),摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。
(测量过程要在一个小时内完成)。
3. 双向电泳第一向---IEF(双向电泳中一律使用超纯水)3.1 水化液的制备称取2.0mg 的DTT,用700ul水化液储液溶解后,加入8ul 0.05, 的溴酚兰,3.5ul(0.5,v/v)IPG buffer (pH 3-10)振荡混匀,13200rpm离心15min 除杂质,取上清。
在含300ug 蛋白(经验值)的样品溶解液中加入水化液,至终体积为340ul,振荡器上振荡混合,13200rpm离心15min除杂质,取上清。
3.2 点样,上胶分两次吸取样品,每次170ul, 按从正极到负极的顺序加入点样槽两侧,再用镊子拨开 Immobiline DryStrip gels (18cm,pH 3—10)胶条,从正极到负极将胶条压入槽中,胶面接触加入的样品。
简述双向电泳的原理

简述双向电泳的原理
双向电泳是一种在凝胶电泳中使用的技术,用于分离和分析DNA、RNA、蛋白质等生物分子。
其原理是利用两个方向的电场来推动待分离的生物分子,以便在凝胶中获得更好的分离效果。
在双向电泳中,首先在一个方向上施加电场,使待分离的生物分子向一个方向移动。
然后,改变电场的方向,使其在另一个方向上移动。
这样,生物分子会在两个方向上进行移动,从而实现更好的分离效果。
双向电泳的原理涉及到凝胶电泳和电泳技术。
在凝胶电泳中,待分离的生物分子会在凝胶矩阵中随着电场的作用而移动,根据其大小和电荷的不同而被分离开来。
而双向电泳则是在凝胶电泳的基础上,通过改变电场的方向,使生物分子在两个方向上移动,以获得更好的分离效果。
双向电泳在生物分子分离和分析中具有重要的应用,尤其在蛋白质分离和分析中,可以帮助科研人员更准确地分离和鉴定不同的蛋白质。
通过掌握双向电泳的原理和技术,科研人员可以更好地开展生物分子研究,为生命科学领域的发展做出贡献。
总之,双向电泳的原理是利用两个方向的电场来推动待分离的生物分子,在凝胶中实现更好的分离效果,具有重要的生物分子分离和分析应用。
双向电泳原理及实验步骤

银染(Silver Stain Plus™ stain)
荧光染色(SYPRO® Ruby protein gel stain)
适用于质谱的染色方法
考马斯亮蓝染色
银染的检测灵敏度很高,可达到200pg,但其线性很差。普通的银染过程中因醛类的特异反应,而与下游质谱不兼容。
快速银染法,可与下游质谱兼容,但其检测灵敏度较低,并伴有很深的背景干扰。
聚焦时间的优化
IEF的基本条件
Stemp 1
Stemp 2
Stemp 3
total
voltage
Time
Volt-Hours
Ramp
250
20min
---
Linear
4000
4000
2hr
---
---
10,000V-hr
Linear
Rapid
5 hr
14,000V-hr
7 cm
Stemp 1
Stemp 2
双向电泳样品的溶解
是成功进行双向电泳的最关键因素之一 溶解的目标: 样品中非共价结合的蛋白质复合物和聚积体完全破坏,从而形成各个多肽的溶解液; 必须允许可能干扰2-DE分离的盐、脂类、多糖和核酸等物质的去除; 保证样品在电泳过程中保持溶解状态。
离液剂:通过改变溶液中的氢键结构使蛋白质充分伸展,将其疏水中心完全暴露,降低接近疏水残基的能量域。典型代表是尿素和硫尿。
02
样品上样缓冲液
标准溶液:
Reagent
Amount
8M urea
47ml of 8.5 stock or 24g urea in 25ml H2O
50mM DTT or 2mM TBP
385mg or 500ul of 200mM TBP stock
双向电泳操作步骤

双向电泳操作步骤双向电泳是一种常用的蛋白质分离和纯化方法。
下面是一篇超过1200字的双向电泳操作步骤:双向电泳是一种通过两个不同方向的电场来进行蛋白质分离的方法。
它可以更好地区分具有不同等电点和分子质量的蛋白质,并用于研究蛋白质组学以及生物化学等领域。
以下是一般的双向电泳操作步骤:1.确保准备充足的电泳装置,包括双向电泳槽、平衡缓冲液、电泳缓冲液、电泳细胞等。
2.准备样品:将待分离的蛋白质样品进行适当的前处理,包括样品提取、蛋白质浓缩、去除干扰物等。
将样品溶解在适当的电泳缓冲液中。
3.将样品加载到电泳槽中:在准备好的电泳缓冲液中加入样品,然后将样品加载到电泳槽中的样品孔中。
注意,为了保持电泳稳定性,在样品孔加载样品后,要尽快将缓冲液加入到其他储备槽以保持全面和均匀的电解质浓度。
4.进行等电点电泳:将电泳槽中的样品浸没在平衡缓冲液中,并在两侧分别连接正负极。
设置合适的电流和电压,开始进行等电点电泳。
在等电点电泳过程中,蛋白质根据它们的等电点被定向地分离。
5.停止等电点电泳:根据需要进行电泳时间的设定,一般情况下为2-3小时。
等电点电泳时间结束后,关闭电源,并小心地取出电泳舱。
6.水平电泳:停止等电点电泳后,将样品塘从上清洗掉,并用水平电泳缓冲液进行冲洗。
然后,在两侧连接正负极,设置合适的电流和电压,开始水平电泳。
在水平电泳过程中,蛋白质根据它们的分子质量被定向地分离。
7.停止水平电泳:根据需要进行电泳时间的设定,一般情况下为4-5小时。
水平电泳时间结束后,关闭电源,并小心地取出电泳舱。
8.染色和图像采集:将分离完毕的样品进行染色,常用的染色方法包括银染和荧光染色。
然后,使用图像采集系统获取电泳图像,可根据需要调整采集参数。
9.数据分析和解释:通过对电泳图像的分析,包括珠状图、分子质量标准物的修正和待测蛋白质的标定等,将分离出来的蛋白质鉴定和定位。
10. 验证和验证:对其中感兴趣的蛋白质进行验证和验证。
双向电泳实验操作流程

双向电泳实验操作流程机器型号:GE第一向:等电聚焦(IEF)1.对样品的要求:IEF能否成功主要取决于样品状态和离子强度,一般蛋白制备采用Trin-HCl 为缓冲液,加等渗蔗糖。
根据染色方法和胶条的长度决定上样量,一般是20μg/mL -1mg/mL。
考马斯亮蓝染色较银染需要较大的上样量。
2.IEF准备注意事项:DTT和IPG现用现配,由于DTT是还原剂,长时间放置易氧化,所以可以选择干物质使用。
DTT的作用是和尿素配合打散蛋白质结构,CHAPS为碱性去垢剂,和SDS作用相似,溶解尿素时温度不可超过37℃,因为超过37℃蛋白质会发生氨甲酰化,尽量在生产日期一年内使用。
清洗IEF胶条槽时用专用清洗剂,原液清洗或2%浓度浸泡清洗。
3.上样:胶条使用前20min从冰箱(4℃)中取出。
上样可以采用水化上样或者使用上样杯(先水化,后上样),上样杯上样适用于极性等电点蛋白质,水化12h后,在电泳槽上样。
以水化上样为例:先将250μL样品和水化液(需要当天配制)混合物加到胶条槽里,然后从尖端(阳性端)撕掉保护膜(带IO号),将胶条支持膜向上,胶面向下,用配用镊子夹住平端放入胶条槽中,注意不要产生气泡,用覆盖油覆盖,盖上盖子。
说明:放入胶条槽中的胶条上的字应该顺向能够读出,说明胶条放的对,如果读不出来,说明放反了。
在电脑软件中设置操作参数:水化上样分为被动上样(就是这种浸泡状态维持约16h)和主动上样(加电压30V,大约需要10h)。
上样后即可进行IEF电泳。
注意每种胶条最大的电流不能超过50μA。
一般是30V电压水化12h,然后200V、500V、1000V各1h,最后用8000V电压电泳至结束。
4.胶条的平衡:平衡液制备时先将SDS在加热的条件下溶解于水中,SDS溶解后冷却至20℃左右,在加入尿素充分溶解,然后加甘油混匀成水溶液。
将该水溶液分成两份,每份15mL,分装到两个平衡管中,其中一个管中加DTT,另一个管中加IAA,DTT可以打开蛋白的二硫键,防止在聚焦时形成的氧化导致在第二向拖尾,尿素、甘油可以降低电离效应,使胶条可以很好的转入第二向,IAA可以将去除DTT。
双向凝胶电泳的原理

双向凝胶电泳的原理双向凝胶电泳是一种常用的蛋白质分离技术,其原理基于电泳的原理和凝胶电泳的原理。
电泳原理:电泳是利用物质在电场中的带电性质而产生的运动现象。
在电场中,带电的分子或离子会受到电场力的作用而向相对带电性质相反的极移动。
电泳实验中,通常使用平行的电极极板,形成一个电场,分子或离子会在电场中进行迁移和分离。
凝胶电泳原理:凝胶电泳是在分离过程中使用凝胶作为介质,使得被分离物质在凝胶中进行迁移和分离。
凝胶是具有三维网状结构的聚合物或芯粒,可以提供一定的分子筛效应,使得分子按照大小逐渐沉积。
分子越大,迁移速度越慢,分离效果越好。
双向凝胶电泳原理:双向凝胶电泳是在凝胶电泳的基础上,通过在电泳过程中改变电场方向,实现不同方向上的分离。
通常情况下,第一维电泳是水平电场电泳,第二维电泳是垂直电场电泳。
具体步骤如下:1. 首先,将样品加入到凝胶电泳样品槽内,通常是在蛋白质样品中加入还原剂和样品缓冲液,使其在电泳过程中具有一定的带电性质。
2. 准备两个平行的平板凝胶,其中一个用于第一维电泳,另一个用于第二维电泳。
凝胶通常是聚丙烯酰胺凝胶或聚丙烯酰胺-琼脂糖双层凝胶。
第一维电泳凝胶的方向通常是水平的,第二维电泳凝胶的方向通常时垂直的。
3. 将第一维电泳凝胶浸泡在浸泡液中,然后将电泳样品加入到凝胶中定位。
开启电源,施加电场使样品在凝胶中迁移并分离,直至达到预期的分离效果。
可以根据需要调整电场的强度和时间。
4. 当第一维电泳结束后,将凝胶取出并固定,然后将其放入第二维电泳凝胶中。
将电泳样品加入到第一维凝胶的上方定位。
5. 开启电源,施加电场使样品在第二维凝胶中迁移并分离,直至达到预期的分离效果。
6. 最终,根据分子的大小和电荷,样品中的蛋白质会在凝胶中形成一系列分离带,可以通过染色等方法观察和分析分离结果。
通过双向凝胶电泳,可以实现对复杂混合物中的蛋白质的分离和分析,便于进一步的研究和应用。
双向电泳操作步骤蛋白质技术

双向电泳操作步骤-蛋白质技术水化上样(被动上样)1 .从冰箱中取出IPG胶条,室温放置IOmin o2 .沿水化盘槽的边缘从左向右线性加入样品,槽两端各Icm左右不加样,中间的样品液一定要连贯。
注意:不要产生气泡,否则会影响胶条中蛋白质的分布。
3 .用银子轻轻撕去IPG胶条上的保护层。
注意:碱性端较脆弱,应小心操作。
4 .将IPG胶条胶面朝下轻轻置于水化盘中样品溶液上。
注意:不要将样品溶液弄到胶条背面,因为这些溶液不会被胶条吸收;还使胶条下面的溶液产生气泡。
如产生了气泡,用镜子轻轻地提起胶条的一端,上下移动胶条,直到气泡被赶走。
5 .放置30~45min大部分样品被胶条吸收,沿着胶条缓慢加入矿物油,每根胶条约3m1(17cmIPG),防止胶条水化过程中液体蒸发。
6 .置等电聚焦仪于-20。
C水化11〜15h。
第一向等电聚焦1 .将纸电极置于聚焦盘的正负极上,加ddH205~8μ1润湿。
2 .取出水化好的胶条,提起一端将矿物油沥干,胶面朝下,将其置于刚好润湿的滤纸片上杂交以去除表面上的不溶物。
3 .将IPG胶条胶面朝下置于聚焦盘中,胶条的正极(标有+)对应于聚焦盘的正极,确保胶条与电极紧密接触。
4 .在每根胶条上覆盖2-3m1矿物油。
5 .对好正、负极,盖上盖子。
设置等电聚焦程序。
6 .聚焦结束的胶条,立即进行平衡、第二向SDS-PAGE电泳。
或将胶条置于样品水化盘中,-20。
水箱保存,电泳前取出胶条,室温放置10分钟,使其溶解。
第二向SDS-PAGE电泳1 .配制12%的丙烯酰胺凝胶。
2 .待凝胶凝固后,倒去分离胶表面的MiI1iQ水、乙醇或水饱和正丁醇,用MiIIiQ水冲洗。
3 .配制胶条平衡缓冲液I4 .在桌上先放置干的厚滤纸,聚焦好的胶条胶面朝上放在干的厚滤纸上。
将另一份厚滤纸用Mi1IiQ水浸湿,挤去多余水分,然后直接置于胶条上,轻轻吸干胶条上的矿物油及多余样品,这样可以减少凝胶染色时出现的纵条纹。
双向电泳法

双向电泳法双向电泳法(Bidimensional Electrophoresis,2-DE)是一种常用的蛋白质分离技术,可以同时分析样品中上千种蛋白质。
本文将详细介绍双向电泳法的原理、步骤和应用。
原理双向电泳法结合了等电聚焦(IEF)和SDS-PAGE两种技术,通过两个维度的分离将复杂的蛋白质混合物分解为一系列单独的斑点。
在第一维度中,根据蛋白质的等电点(pI)进行分离;在第二维度中,根据蛋白质的分子量进行分离。
通过将这两个维度的分离结果叠加,可以获得高分辨率的蛋白质图谱。
双向电泳法的关键步骤如下:1.等电聚焦(IEF):在第一维度中,使用等电聚焦技术将样品中的蛋白质按照其等电点进行分离。
等电聚焦是一种基于蛋白质在电场中向氧化物离子(OH-)或氢离子(H+)方向移动的分离方法。
在等电聚焦过程中,蛋白质会在pH梯度中向其等电点迁移,直到净电荷为零。
通过控制pH梯度和应用的电压,可以将蛋白质在等电聚焦过程中分离开。
2.SDS-PAGE分离:在第二维度中,将第一维度的等电聚焦凝胶与SDS-PAGE凝胶垂直叠加。
在SDS-PAGE凝胶中,蛋白质通过聚丙烯酰胺凝胶的孔隙随着电场的作用向阳极迁移。
由于SDS(十二烷基硫酸钠)的存在,蛋白质在SDS-PAGE凝胶中的迁移速度与其分子量成反比。
因此,蛋白质在SDS-PAGE 凝胶中会根据其分子量进行分离。
3.染色和分析:经过双向电泳分离后,凝胶可以通过染色方法显示出一系列斑点,每个斑点代表一个蛋白质。
常用的染色方法包括银染法、荧光染色、贵金属染色等。
对于银染法,它在灵敏度和线性范围上具有优势。
染色后可以使用成像设备捕捉图像并进行定量分析。
通过对斑点的比较和定量,可以识别不同样品之间的差异和变化。
步骤双向电泳法的步骤如下:1.样品制备:将待分析的生物样品(如细胞提取物)进行蛋白质提取,并使得蛋白质在石蜡中可溶解。
常用的方法包括总蛋白提取、亲和层析、激光捕获等。
2.等电聚焦(IEF):将蛋白质样品与具有连续pH梯度的凝胶进行接触。
双向电泳的原理及步骤

双向电泳的原理及步骤
双向电泳是一种分离蛋白质的方法,基于蛋白质在电场中的电荷和大小的不同进行分离。
以下是双向电泳的原理及步骤:
原理:
双向电泳是将蛋白质样品首先进行等电聚焦,然后再进行垂直于等电聚焦方向的SDS-PAGE电泳,从而获得更高的分离效率。
等电聚焦可以将蛋白质按照等电点的不同进行分离,而SDS-PAGE电泳可以将蛋白质按照分子量的大小进行分离。
通过这两个步骤的组合,可以更加准确地分离出蛋白质。
步骤:
1. 等电聚焦:将蛋白质样品加入到等电聚焦电极中,该电极包含有一系列等电点缓冲液。
在等电聚焦过程中,电极会产生一个电场,该电场会将带有不同电荷的蛋白质分子朝向不同方向移动,最终在等电点处停留。
这样可以将蛋白质按照等电点的不同进行分离。
2. SDS-PAGE电泳:在等电聚焦完成后,将电极旋转90度,使其与等电聚焦电极垂直。
然后将电极中的蛋白质样品注入到SDS-PAGE凝胶中,并进行电泳。
在SDS-PAGE电泳中,蛋白质会在电场中移动,但由于SDS的存在,蛋白质会被完全线性化。
这样可以将蛋白质按照分子量的大小进行分离。
3. 结果分析:通过电泳分离,可以得到一系列不同的蛋白质带,每个带代表一个蛋白质。
通过比对蛋白质带的大小和位置,可以鉴定蛋白质的分子量和等电点,从而确定蛋白质的特征。
蛋白质双向电泳

模块五蛋白质双向电泳1. 实验目的掌握双向电泳能根据等电点和分子量分离蛋白质的原理,第一向等电聚焦电泳(IEF)和第二向聚丙烯酰胺凝胶电泳(SDS-PAGE)操作步骤,掌握凝胶染色方法,掌握凝胶分析软件的使用,了解对分离出的特异蛋白质的进一步分析方法,了解利用电泳技术分析生物大分子的方法。
2. 实验原理从广义上讲,双向电泳是将样品电泳后为了不同的目的在垂直方向再进行一次电泳的方法。
目前蛋白质双向电泳常用的组合第一向为等电聚焦(载体两性电解质pH梯度或固相pH梯度),根据蛋白质等电点进行分离,第二向为SDS-PAGE,根据相对分子质量分离蛋白质。
这样经过两次分离后,在凝胶上显示出的蛋白点可以获得蛋白质等电点和相对分子质量信息。
双向电泳技术作为分离蛋白质的经典方法,目前得到了相当广泛的应用。
在植物研究中,成功建立了拟南芥、水稻、玉米等植物种类的双向电泳图谱数据库,对推动植物蛋白质组研究起到重要作用。
第一向等电聚焦:等电聚焦(isoelectrofocusing,IEF)是在凝胶柱中加入一种称为两性电解质载体(ampholyte)的物质,从而使凝胶柱在电场中形成稳定、连续和线性pH梯度。
以电泳观点看,蛋白质最主要的特点是它的带电行为,它们在不同的pH值环境中带不同数量的正电荷或负电荷,只有在某一pH时,蛋白质的净电荷为零,此pH即为该蛋白质的等电点(isoeletric point,PI)。
在电场中,蛋白质分子在大于其等电点的pH环境中以阴离子形式向正极移动,在小于其等电点的pH 环境中以阳离子形式向负极移动。
如果在pH梯度环境中将含有各种不同等电点的蛋白质混合样品进行电泳,不管混合蛋白质分子的原始分布如何,都将按照它们各自的等电点大小在pH梯度某一位置进行聚集,聚焦部位的蛋白质质点的净电荷为零,测定聚焦部位的pH即可知道该蛋白质的等电点。
第二向SDS聚丙烯酰胺凝胶电泳:SDS是一种阴离子表面活性剂,当向蛋白质溶液中加入足够量的SDS时,形成了蛋白质-SDS复合物,这使得蛋白质从电荷和构象上都发生了改变。
双向电泳实验流程

双向电泳实验流程样品制备( Sample preparation ) 固相预制胶条的水化( IPG strip rehydration ) 第一向等电聚焦( IEF)胶条的平衡( IPG strip equilibration )第二向SDS-PAG电泳(SDS-PAGE electrophresis )凝胶的染色及检测( Detection/Staining )PDQuest软件分析(Software analysis )质谱鉴定( Protein identification )目录第一章实验材料1.1 IPG 预制胶条及载体两性电解质1.2 蛋白质定量试剂盒及其试剂1.3 蛋白样品制备试剂盒及其试剂1.4 化学试剂1.5 蛋白质Marker1.6 染色试剂1.7 注意事项第二章SDS-PAGE 聚丙烯酰胺凝胶电泳2. 1 溶液的配制2. 2 SDS-PAGE 凝胶的配制2. 3 操作方法2. 4 注意事项ATy -_*双向电泳3. 1 溶液配制3. 2 操作步骤3. 3 注意事项附录1 双向电泳完整的操作步骤附录2 聚丙烯酰胺凝胶电泳凝胶的配置附录3 细胞样品的一般处理步骤附录4组织样品的一般处理步骤第一章实验材料1.1 IPG 预制胶条及载体两性电解质Bio-Rad公司),-20 C冰箱保存,每包12根一)IPG 预制胶条(美国项目规格货号原价(元)IPG 预制胶条pH 3-10 ,7 cm 163-2000 799 IPG 预制胶条pH 3-10 ,7 cm ,nonlinear (NL)163-2002 799 IPG 预制胶条pH 4-7 ,7 cm 163-2001 799 IPG 预制胶条pH 3-6 ,7 cm 163-2003 799 IPG 预制胶条pH 5-8 ,7 cm 163-2004 799 IPG 预制胶条pH 7-10 ,7 cm 163-2005 799 IPG 预制胶条pH 3.9-5.1 ,7cm 163-2028 799 IPG 预制胶条pH 4.7-5.9 ,7cm 163-2029 799 IPG 预制胶条pH 5.5-6.7 ,7cm 163-2030 799 IPG 预制胶条pH 6.3-8.3 ,7cm 163-2031 799 IPG 预制胶条pH 3-10 ,11cm 163-2014 957 IPG 预制胶条pH 3-10 ,11cm,nonlinear (NL)163-2016 957 IPG 预制胶条pH 4-7 ,11cm 163-2015 957 IPG 预制胶条pH 3-6 ,11cm 163-2017 957 IPG 预制胶条pH 5-8 ,11cm 163-2018 957 IPG 预制胶条pH 7-10 ,11cm 163-2019 957 IPG 预制胶条pH 3.9-5.1 ,11cm 163-2024 957 IPG 预制胶条pH 4.7-5.9 ,11cm 163-2025 957 IPG 预制胶条pH 5.5-6.7 ,11cm 163-2026 957 IPG 预制胶条pH 6.3-8.3 ,11cm 163-2027 957 IPG 预制胶条pH 3-10 ,17cm 163-2007 1079 IPG 预制胶条pH 3-10 ,17 cm ,nonlinear (NL )163-2009 1079 IPG 预制胶条pH 4-7 ,17cm 163-2008 1079 IPG 预制胶条pH 3-6 ,17cm 163-2010 1079 IPG 预制胶条pH 5-8 ,17cm 163-2011 1079 IPG 预制胶条pH 7-10 ,17cm 163-2012 1079 IPG 预制胶条pH 3.9-5.1 ,17cm 163-2020 1079IPG 预制胶条pH 4.7-5.9 ,17cm 163-2021 1079 IPG 预制胶条pH 5.5-6.7 ,17cm 163-2022 1079 IPG 预制胶条pH 6.3-8.3 ,17cm 163-2023 1079 IPG 预制胶条pH 3-10 ,18cm 163-2032 1079 IPG 预制胶条pH 3-10 ,18cm,nonlinear (NL )163-2033 1079 IPG 预制胶条pH 4-7 ,18cm 163-2034 1079 IPG 预制胶条pH 3-6 ,18cm 163-2035 1079 IPG 预制胶条pH 5-8 ,18cm 163-2036 1079 IPG 预制胶条pH 7-10 ,18cm 163-2037 1079 IPG 预制胶条pH 3.9-5.1 ,18cm 163-2038 1079 IPG 预制胶条pH 4.7-5.9 ,18cm 163-2039 1079 IPG 预制胶条pH 5.5-6.7 ,18cm 163-2040 1079 IPG 预制胶条pH 6.3-8.3 ,18cm 163-2041 1079 IPG 预制胶条pH 3-10 ,24cm 163-2042 1292 IPG 预制胶条pH 3-10 ,24cm,nonlinear (NL )163-2043 1292 IPG 预制胶条pH 4-7 ,24cm 163-2044 1292 IPG 预制胶条pH 3-6 ,24cm 163-2045 1292 IPG 预制胶条pH 5-8 ,24cm 163-2046 1292 IPG 预制胶条pH 7-10 ,24cm 163-2047 1292 IPG 预制胶条pH 3.9-5.1 ,24cm 163-2048 1292 IPG 预制胶条pH 4.7-5.9 ,24cm 163-2049 1292 IPG 预制胶条pH 5.5-6.7 ,24cm 163-2050 1292 IPG 预制胶条pH 6.3-8.3 ,24cm 163-2051 1292(二)载体两性电解质(美国Bio-Rad公司),4C冰箱保存项目货号原价(元)Bio-Lyte 3/10 Ampholyte ,40%,10ml 163-1112 1704 Bio-Lyte 3/10 Ampholyte ,40%,25ml 163-1113 2463 Bio-Lyte 3/5 Ampholyte ,20%,10ml 163-1132 3275 Bio-Lyte 4/6 Ampholyte ,40%,10ml 163-1142 3713 Bio-Lyte 4/6 Ampholyte ,40%,25ml 163-1143 9287 Bio-Lyte 5/7 Ampholyte ,40%,10ml 163-1152 2984 Bio-Lyte 5/7 Ampholyte ,40%,25ml 163-1153 7540 Bio-Lyte 6/8 Ampholyte ,40%,10ml 163-1162 3569 Bio-Lyte 6/8 Ampholyte ,40%,25ml 163-1163 8187Bio-Lyte 7/9 Ampholyte,40%,10ml 163-1172 3479 Bio-Lyte 8/10 Ampholyte ,20%,10ml 163-1182 1912Bio-Lyte 5/8Ampholyte,40%,10ml 163-1192 3275Bio-Lyte 5/8Ampholyte,40%,25ml 163-1193 8114(三)等电聚焦上样缓冲液(美国Bio-Rad 公司),4C冰箱保存项目货号原价(元)100x ReadyStrip Buffer , for pH 7-10 IPG Strips , 1ml 163-2093 744Bio-Lyte 3/10 Ampholyte , 100x, 1ml 163-2094 396100x ReadyStrip Buffer ,for pH 6.8-8.3 IPG Strips ,1ml 163-2095566 100x ReadyStrip Buffer ,for pH 5.5-6.7 IPG Strips ,1ml 163-2096 774100x ReadyStrip Buffer ,for pH 4.7-5.9 IPG Strips ,1ml 163-2097 545100x ReadyStrip Buffer ,for pH 3.5-5.1 IPG Strips ,1ml 163-20985921.2 蛋白质定量试剂盒及其试剂项目货号报价(元)Protein Assay Kit I , bovine 丫-globulin standard 500-0001 919Protein Assay Kit II ,BSA standard 500-0002 919Protein Standard I, bovine 丫-globulin , 1 bottle 500-0005429 Protein Assay Dye Reagent Concentrate,450ml 500-0006 690Protein Standard II,bovine serum albumin,1 bottle 500-0007 365Quick Start Protein Assay Kit I ,Bradford 法500-0201 934De Protein Assay Kit I , bovine 丫-globulin standard 500-0111 2281 De Protein Assay Kit n, BSA standard 500-0112 2281 RC DC Protein Assay Kit I , 丫-globulin , Lowry 法500-0121 3183 RC DC Protein Assay Kit II , BSA standard , Lowry 法500-0122 31831.3 蛋白样品制备试剂盒及其试剂项目Ready-Prep 2-D Cleanup KitReadyPrep Sequential Extraction Kit Tributylphosphine (TBP ),200mM ,0.6ml ReadyPrep Sequential Extraction Kit Reagent 1货号原价(元)163-2130 2533163-2100 2969163-2101 539 1vial 163-2102 1116ReadyPrep Sequential Extraction Kit Reagent 2 ,1vial 163-2103 909 ReadyPrep Sequential Extraction Kit Reagent 3 ,1vial 163-2104 646 ReadyPrep 2-D Starter Kit 163-2105 3250 ReadyPrep 2-D Starter Kit Rehydration/Sample Buffer 163-2106 331 ReadyPrep Starter Kit Equilibration Buffer I ,with DTT 163-2107 508 ReadyPrep Starter Kit Equilibration BufferII 163-2108 498E.coli Protein Sample ,lyophilized ,2.7mg 163-2110 446ReadyPrep Overlay Agarose,50ml 163-2111 287 ProteoMiner Protein Enrichment SmallCapacity Kit 163-3006 3699 ProteoMiner Protein Enrichment Large-Capacity Kit 163-2007 5618 Aurum Serum Protein Mini Kit 732-6701 1513 Aurum Affi-Gel Blue Mini Columns 732-6708 1873 ReadyPrep Protein Extraction Kit (Cytoplasmic/Nuclear) 163-2089 4919 ReadyPrep Protein Extraction Kit (Membrane I) 163-2088 4919 ReadyPrep Protein Extraction Kit (Membrane II) 163-2084 2986 ReadyPrep Protein Extraction Kit (Signal) 163-2087 28151.4 化学试剂项目尿素Urea,250g 尿素Urea,1kgAG 501-X8 (D)Mixed Bed ResinCHAPS ,1gTriton X-100 ,500mlDTT (Dithiothreitol ),1gDTT (Dithiothreitol ),5g Tributylphosphine ( TBP ),200mM ,0.6ml 碘乙酰胺Iodoacetamide,30g 溴酚蓝( Bromophenol Blue ),10g 矿物油( Mineral Oil ),500ml SDS,100gSDS,1kg Tris ,500g Tris ,1kg 低熔点琼脂糖,25g 甘氨酸,1kg 货号161-0730161-0731142-6425161-0460161-0407161-0610161-0611163-2101163-2109161-0404163-2129161-0301161-0302161-0716161-0719161-3111161-0718原价(元)22268527713904212917315391429501298368199181311511360713甘氨酸,2kg 161-0724 1671 丙烯酰胺(Acrylamide ), 99.9% , 500g 161-0101 919 丙烯酰胺(Acrylamide ), 99.9% , 2kg 161-0103 3411 丙烯酰胺(Acrylamide ), 99.9% , 1kg 161-0107 1870 丙烯酰胺(Acrylamide ), 99.9% , 5kg 161-0108 8514 甲叉双丙烯酰胺(Bis), 5g 161-0200 294 PDA (Piperazine Diacrylamide ), 10g 161-0202 1902 PDA (Piperazine Diacrylamide ), 50g 161-0203 17361 过硫酸氨(Ammonium Persulfate ), 10g 161-0700 155 过硫酸氨(Ammonium Persulfate ),100g 161-0754 1153 TEMED,5ml 161-0800 207 TEMED,50ml 161-0801 485 甘油Sigma硫尿Sigma1. 5 蛋白质标准品Marker项目货号原价(元)Unstained SDS-PAGE Standards,high range,200 'l 161-0303 689 Unstained SDS-PAGE Standards,low range,200'l 161-0304 689 Unstained SDS-PAGE Standards,broad range,200'l 161-0317 884 Polypeptide SDS-PAGE Standards,200._l 161-0326 692 Prestained SDS-PAGE Standards, high range,500^1 161-0309 689 Prestained SDS-PAGE Standards, low range,500^1 161-0305 689 Prestained SDS-PAGE Standards, broad range,500^1 161-0318 800 Precision Plus Std Unstained,1ml 161-0363 1168 Precision Plus Std Dual Color,500ul 161-0374 1080 2-D SDS-PAGE Standards,500 J 161-0320 1457 IEF Standards,pl range 4.45-9.6,250^1 161-0310 16211. 6染色试剂项目Coomassie Brilliant Blue R-250 , 10gCoomassie Brilliant Blue G-250 , 10gCoomassie Brilliant Blue R-250 Staining Solutions Kit Coomassie Brilliant Blue R-250 Staining Solutions ,货号原价(元)161-0400 413161-0406 670161-0435 1440 1L 161-0436 464Coomassie Brilliant Blue R-250 Staining Solutions ,4 X 1L 161-0437 1856 Coomassie Brilliant Blue R-250 Destaining Solutions ,1L 161-0438 488Coomassie Brilliant Blue R-250 Destaining Solutions ,4X 1L 161-0439 1952 Bio-Safe Coomassie Stain ,1L 161-0786 878 Bio-Safe Coomassie Stain ,5L 161-0787 3493 SYPRO Ruby Protein Gel Stain ,200ml 170-3126 2226 SYPRO Ruby Protein Gel Stain ,1L 170-3125 5725 SYPRO Ruby Protein Gel Stain ,5L 170-3138 16744Silver Stain Kit 161-0443 3933 Silver Stain Plus Kit (质谱兼容)161-0449 28541.7 注意事项1. 双向电泳中所用的化学试剂纯度要高,至少为分析级,尽量选用进口试剂。
简述双向电泳的原理

简述双向电泳的原理全文共四篇示例,供读者参考第一篇示例:双向电泳是一种分离蛋白质或核酸的方法,其原理基于电泳技术。
电泳是一种根据带电粒子在电场中的迁移速度不同而实现分离的方法,双向电泳则是在两个方向上施加电场,使样品能够在水平和垂直方向上进行迁移,以实现更加高效的分离。
双向电泳的原理主要包括以下几个方面:2. 分子大小和电荷:蛋白质或核酸的迁移速度取决于其大小和电荷。
较小的分子会更快地迁移,而带有更多负电荷的分子会受到更大的排斥力,迁移速度更快。
3. 凝胶介质的选择:凝胶是双向电泳中的分离载体,其选择对于分离效果至关重要。
凝胶的孔隙结构和导电性会影响样品的迁移速度和分离效率,因此需要根据样品的特性选择合适的凝胶介质。
4. 蛋白质或核酸的分子量和异质性:在双向电泳中,样品中存在不同分子量和异质性的蛋白质或核酸,这些成分会在电泳过程中以不同速度迁移,最终实现分离。
双向电泳技术的发展为蛋白质组学和基因组学研究提供了重要手段,能够有效实现不同类型的蛋白质或核酸的分离与鉴定。
通过结合其他分析技术,如质谱或序列测定,可以更全面地了解生物样品的组成和功能。
双向电泳在疾病诊断、药物研发和生物学研究等领域具有广泛的应用前景,成为生命科学研究中不可或缺的重要工具之一。
第二篇示例:双向电泳是一种常用的分离和分析生物分子的方法,它结合了水平电泳和垂直电泳的优点,能够在同一实验中同时进行两个方向上的电泳,从而达到更高的分辨率和更全面的信息提取。
双向电泳的原理基于生物分子在电场中的迁移速度与其电荷量、大小和形状有关。
在双向电泳中,通常先将样品加载在一维电泳胶中,然后将电泳胶直立放置,施加一个水平电场使样品向两侧扩散,形成一个均匀扩散的带状样品。
接下来,在垂直方向上施加另一个电场,使生物分子根据其电荷量、大小和形状不同而向上或向下迁移,从而实现在两个方向上的电泳。
双向电泳需要结合两个方向上的电场来进行,这样可以使得样品在两个维度上都得到分离,从而获得更加准确和直观的结果。
双向电泳的原理应用

双向电泳的原理应用1. 原理介绍双向电泳是一种用于分离和分析蛋白质的技术。
它利用电场的力作用将蛋白质分子根据其大小和电荷分离成不同的带状条带,从而实现对蛋白质的分离和分析。
在双向电泳中,电泳液在两个方向(水平和垂直)上施加电场。
水平的电场用于推动蛋白质分子在凝胶中移动,而垂直的电场用于将蛋白质分子根据其电荷进行分离。
2. 双向电泳的步骤双向电泳通常包括以下几个步骤:2.1 凝胶制备首先制备凝胶,常用的凝胶包括聚丙烯酰胺凝胶和聚酰胺凝胶。
凝胶的选择取决于所要分析的蛋白质的分子量范围。
2.2 样品制备将待分析的蛋白质样品进行处理,通常包括蛋白质提取、蛋白质纯化和蛋白质标记等步骤。
2.3 水平电泳将样品加载到凝胶上,并将凝胶放入水平电泳槽中。
施加水平电场后,蛋白质会根据其分子量在凝胶中移动,形成水平方向上的分离。
2.4 凝胶固定水平电泳后,将凝胶固定,通常使用乙醇或甲醛进行固定,以防止蛋白质在后续步骤中的移动。
2.5 垂直电泳固定后的凝胶被垂直放置,然后施加垂直电场。
此时,蛋白质会根据其电荷进行进一步的分离。
2.6 染色和可视化分离完成后,凝胶通常会被染色,以便观察和分析分离的蛋白质条带。
常用的染色方法包括银染和荧光染色。
3. 双向电泳的应用双向电泳在蛋白质分离和分析方面具有广泛的应用。
3.1 蛋白质组学研究双向电泳可以用于研究蛋白质组学,包括蛋白质的组成、结构和功能等。
通过双向电泳可以分离出不同的蛋白质条带,从而有助于研究蛋白质的表达和变化。
3.2 蛋白质质量测定双向电泳可以用于测定蛋白质的质量。
通过与已知质量的蛋白质进行比较,可以确定待测蛋白质的质量范围。
3.3 蛋白质互作研究双向电泳还可以用于研究蛋白质之间的相互作用。
通过在凝胶中一同加载多个蛋白质样品,可以观察到不同蛋白质之间的相互作用。
3.4 蛋白质标记双向电泳常常与蛋白质标记技术结合使用。
通过将蛋白质样品与荧光染料或同位素标记剂结合,可以在凝胶上可视化和定量分析蛋白质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
可编辑版
2
蛋白质组分析的首要要求
• 将来自于全细胞、组织或生物体中所包含 的多达几千种混合蛋白质进行分离、检测 和分析 。
• 2-DE技术依然是大多数蛋白质组研究中分 离复杂蛋白质混合物的首选技术 。
可编辑版
3
生物学问题 的提出
实验模型 的设计
实验组和对照组 样品的制备
感兴趣 蛋白点 的切取
蛋白样品的IEF和PAGE电泳分离 图像扫描和初步分析
可c编h辑a版rge
9
样品制备基本原则
• 使所有待分析的蛋白样品全部处于溶解状态(包 括多数疏水性蛋白),制备方法应具有可重现性。
• 防止样品在聚焦时发生蛋白的聚集和沉淀。 • 防止在样品制备过程中发生样品抽提后的化学修
饰(如酶性或化学性降解等)。
• 完全去除样品中的核酸和某些干扰蛋白。 • 尽量去除起干扰作用的高丰度或无关蛋白,从而
可编辑版
15
样品上样缓冲液
标准溶液:
Reagent
8M urea
50mM DTT or 2mM TBP 4% CHAPS 0.2%carrier ampholytes 0.0002%bromophenol blue ddH2O
Amount
47ml of 8.5 stock or 24g urea in 25ml H2O
还原剂:在离液剂和去垢剂联用条件下,加用还原剂可 使已变性的蛋白质展开更完全,溶解更彻底。常用含 自由巯基的DTT或-巯基乙醇,以及不带电荷的三丁 基膦(TBP)进行还原。
可编辑版
14
两性载体电解质:即便在离液剂和去垢剂存在的情 况下,某些蛋白质也需要在盐离子的作用下才能保 持其处于溶解状态,否则这些蛋白质在其处于PI点 时会发生沉淀。 两性载体电解质的作用在于补充样品中少量的盐分 ,从而保证蛋白质的溶解性。应用时,两性电解质 的浓度应小于0.2%(w/v)。浓度过高会使IEF的升 压困难、速度降低。另外,为了保证实验的精确性 ,在选择不同pH范围的IPG胶条时,也应使两性电 解质的pH值与之相符合。
385mg or 500ul of 200mM TBP stock
2g
See next table
100ul of 0.1% stock
To 50ml
可编辑版
16
胶条蛋白载样量
影响IPG胶条对蛋白载样量的因素包括: • 待分析的蛋白点的量需满足随后的质谱分
析。 • 电泳的研究目的。 • 待研究蛋白的丰度: • 样品的复杂度。 • IPG胶条的pH范围
蛋白质组双向电泳 实验操作
可编辑版
1
1994年,澳大利亚Macquarie大学的Wilkins 和Williams首先提出了蛋白质组(Proteome) 的概念,其定义为在一种细胞内存在的全部蛋
白质。
蛋白质组研究中主要应用的技术包括:双相电 泳(2-DE)、新型质谱(MS)技术、数据库设置 与检索系统等。
可编辑版
17
IPG胶条蛋白质大约载样量
IPG Strip length
Analytical Load (silver staining)
7cm
10~100 g /125 l
Preparative Load (Coom staining)
级抽提,按样品溶解度不同进行分离。
可编辑版
12
双向电泳样品的溶解
• 是成功进行双向电泳的最关键因素之一
• 溶解的目标:
– 样品中非共价结合的蛋白质复合物和聚积体完全破坏, 从而形成各个多肽的溶解液;
– 必须允许可能干扰2-DE分离的盐、脂类、多糖和核酸 等物质的去除;
– 保证样品在电泳过程中保持溶解状态。
第二向:SDS-PAGE电泳
–
Proteins migrate through the gel at a rate proportional to their size.
Smallest proteins travel the furthest distance
+
pH 3
pH 7.5
pH10
size
保证待研究蛋白的可检测性。
可编辑版
10
样品制备
• 细胞样品:反复冻融、超声破碎
• 组织样品:碾磨、匀浆
• 植物样品:碾磨
• 分泌蛋白
蛋白质样品的浓缩、去除滤液中的高丰度蛋白
• 菌体蛋白
裂解液处理、超声破可编碎辑版
11
不同样品的基本处理方法
可溶性样品
固体组织样品 细胞
样品的分级处理
通过采用亚细胞分级、液相电泳和选择性沉淀等方法 对蛋白质样品进行分级处理,可降低样品的复杂性并 富集低丰度蛋白质。当前最简单有效的处理是采用分
胰酶对脱色后蛋白质的消化 质谱的多肽指纹图、微测序分析
蛋白信息的 初步获得
质谱结果的生物信息学分析和比对 新蛋白质的发现
可编辑版
其它实验
的进一步
验证
4Байду номын сангаас
蛋白质组研究的基本技术路线
蛋白质样品的制备
凝胶中的蛋白
双向电泳
图像分析
转印至膜上的蛋白
溶液中的蛋白
混合肽
肽指纹图
肽序列质谱数据 蛋白质质量 N端测序
数据搜索 新的或已知蛋白
蛋白转录可编后辑修版 饰的鉴定
5
一、双向电泳的实验原理
可编辑版
6
第一向:等电聚焦
+
pH 3
+
pH 3
pH 7.5 pH 7.5
–
pH 10
–
pH 10
+
pH 3
+
pH 3
pH 7.5
pH 7.5 可编辑版
–
pH 10
–
pH 10 7
一维固相pH梯度等电聚焦 (IEF with IPG):
可编辑版
13
增加样品溶解性的手段
离液剂:通过改变溶液中的氢键结构使蛋白质充分伸展, 将其疏水中心完全暴露,降低接近疏水残基的能量域。 典型代表是尿素和硫尿。
去垢剂:经过离液剂处理而暴露蛋白质的疏水基团后, 还常需至少一种去垢剂来溶解疏水基团。常用的去垢 剂有离子去污剂SDS、非离子去污剂Triton X-100和 NP-40、两性离子去垢剂CHAPS、OBG等。其中 CHAPS应用最普遍。
