溶剂效应对反应速率的影响
化学反应速率影响因素

化学反应速率影响因素1.反应物浓度:反应物浓度的增加通常会导致反应速率的增加。
这是因为反应物浓度的增加会增加反应物之间的碰撞频率,从而增加反应速率。
反应物浓度的增加还会导致反应中分子间的碰撞发生频率增加,增加了反应发生的机会。
2.温度:温度的增加通常会导致反应速率的增加。
这是因为在较高温度下,分子的平均动能增加,使得分子之间的碰撞具有更多的能量。
这种更高的能量使得碰撞更有可能成功地克服反应的活化能,从而增加了反应速率。
3.催化剂:催化剂是一种可以增加反应速率的物质。
催化剂通过提供一个可以降低反应过渡态能量的反应路径来增加反应速率。
催化剂通常会与反应物反应生成一个中间产物,然后再解离生成反应产物。
由于催化剂参与反应的数量较小,可以在多个反应周期中重复使用,所以催化剂可以极大地增加反应速率。
4.表面积:当反应物处于固体或液体界面时,反应物的表面积对反应速率有重要影响。
表面积的增加会导致反应物和其他反应物之间的接触面积增加,从而增加反应发生的机会和速率。
例如,将固体反应物粉碎成粉末,会增加反应物的表面积,从而加快反应速率。
5.反应物的物理状态:不同物理状态的反应物对反应速率有不同的影响。
一般而言,气体反应物的速率较快,液体反应物的速率次之,而固体反应物的速率最慢。
这是因为气体分子比液体和固体分子更具自由度,可以更自由地运动并碰撞。
此外,还有其他因素也可能影响化学反应速率,例如压力、溶剂、化学反应机制等。
这些因素会根据不同的反应而有所变化。
了解和控制这些因素对于合理设计和改进化学反应过程是非常重要的。
简述溶剂对反应的影响

简述溶剂对反应的影响溶剂在化学反应中起着至关重要的作用,它不仅可以作为反应物和产物的介质,还可以影响反应的速率和选择性。
溶剂可以通过改变反应物的浓度、稳定反应中间体、调节反应温度等方式来影响反应的进行。
下面将从溶剂对反应速率、溶剂效应和溶剂选择性等方面进行详细阐述。
溶剂对反应速率有着显著的影响。
溶剂可以通过改变反应物的浓度来影响反应速率。
例如,在溶液中,溶剂可以使反应物分子间距离更近,增加它们之间的碰撞概率,从而加快反应速率。
此外,溶剂还可以通过溶解反应物,提高其浓度,进一步加快反应速率。
然而,并非所有溶剂对反应速率都有促进作用,有些溶剂反而会降低反应速率。
这是因为一些溶剂具有较高的粘度或较强的溶解力,使得反应物分子间的运动受到阻碍,从而减慢反应速率。
溶剂还可以通过溶剂效应影响反应的进行。
溶剂效应是指溶剂对反应物的电荷分布和反应活性的影响。
溶剂可以改变反应物的溶解度、极性和电导率,从而影响反应的进行。
例如,极性溶剂可以通过极化反应物分子,增加反应物的活性,促进反应的进行。
另外,溶剂还可以通过溶解反应物和产物,使它们在溶液中迅速离解或结合,从而影响反应的平衡位置和反应速率。
溶剂的选择性也对反应有着重要的影响。
不同的溶剂对不同类型的反应具有不同的选择性。
例如,极性溶剂通常对极性反应更为适用,而非极性溶剂则适用于非极性反应。
此外,溶剂的酸碱性也会影响反应的选择性。
酸性溶剂通常会促进酸碱反应,而碱性溶剂则促进酸碱中和反应。
因此,在选择溶剂时,需要根据反应的性质和要求来进行选择,以达到最佳的反应条件和产物选择性。
溶剂在化学反应中起着重要的作用。
它可以通过改变反应物的浓度、稳定反应中间体、调节反应温度等方式来影响反应的进行。
溶剂对反应速率、溶剂效应和溶剂选择性都有着显著的影响。
因此,在进行化学反应时,合理选择溶剂并控制好溶剂的使用条件,对于实现理想的反应结果具有重要意义。
溶剂概述和溶剂效应

溶剂概述和溶剂效应摘要:对化学反应中溶剂的种类和作用做概述,以及溶剂效应在紫外,荧光,红外,核磁波谱和液相色谱中的作用。
关键词:溶剂溶剂效应吸收光谱液相色谱1,溶剂1.1溶剂的定义溶剂是一种可以溶化固体,液体或气体溶质的液体,继而成为溶液,最常用的溶剂是水。
1.2溶剂的分类溶剂按化学组成分为有机溶剂和无机溶剂有机溶剂是一大类在生活和生产中广泛应用的有机化合物,分子量不大,常温下呈液态。
有机溶剂包括多类物质,如链烷烃、烯烃、醇、醛、胺、酯、醚、酮、芳香烃、氢化烃、萜烯烃、卤代烃、杂环化物、含氮化合物及含硫化合物等等,多数对人体有一定毒性。
(本文主要概述有机溶剂在化学反应以及波谱中的应用)2,溶剂效应2.1溶剂效应的定义溶剂效应是指溶剂对于反应速率,平衡甚至反应机理的影响。
溶剂对化学反应速率常数的影响依赖于溶剂化反应分子和相应溶剂化过渡态的相对稳定性。
2.2溶剂效应在紫外,荧光,红外,核磁中的应用2.2.1溶剂效应在紫外吸收光谱中的应用[5]有机化合物紫外吸收光谱的吸收带波长和吸收强度,与所采用的溶剂有密切关系。
通常,溶剂的极性可以引起谱带形状的变化。
一般在气态或者非极性溶剂(如正己烷)中,尚能观察到振动跃迁的精细结构。
但是改为极性溶剂后,由于溶剂与溶质分子的相互作用增强,使谱带的精细结构变得模糊,以至完全消失成为平滑的吸收谱带。
这一现象称为溶剂效应。
例如,苯酚在正庚烷溶液中显示振动跃迁的精细结构,而在乙醇溶液中,苯酚的吸收带几乎变得平滑的曲线,如图所示2.2.1.1溶剂极性对n→π*跃迁谱带的影响[2]n→π*跃迁的吸收谱带随溶剂的极性的增大而向蓝移。
一般来说,从以环己烷为溶剂改为以乙醇为溶剂,会使该谱带蓝移7nm:如改为以极性更大的水为溶剂,则将蓝移8nm。
增大溶剂的极性会使n→π*跃迁吸收谱带蓝移的原因如下:会发生n→π*跃迁的分子,都含有非键电子。
例如C=O在基态时碳氧键极化成Cδ+=Oδ-,当n电子跃迁到π*分子轨道时,氧的电子转移到碳上,使得羰基的激发态的极性减小,即Cδ+=Oδ-(基态)→C=O(激发态)。
溶剂效应

5
各种溶剂与溶质间的相互作用:非质子溶剂( 各种溶剂与溶质间的相互作用:非质子溶剂(1)
非质子极性溶剂具有未共有电子对,是良好的电子对给体溶剂; 非质子极性溶剂具有未共有电子对,是良好的电子对给体溶剂; 对于极性的或可极化的化合物,通常具有较强的溶解能力, 对于极性的或可极化的化合物,通常具有较强的溶解能力,而对于非极性 分子则溶解力很小; 分子则溶解力很小; 在非质子强极性溶剂中, 在非质子强极性溶剂中,离子型化合物中的正离子和负离子溶剂化程度不 正离子溶剂化更容易,正离子体积越小,越容易溶剂化: 同,正离子溶剂化更容易,正离子体积越小,越容易溶剂化:
3
有机溶剂的Parker分类法: 有机溶剂的Parker分类法:质子溶剂和非质子溶剂 Parker分类法
非质子非极性溶剂 脂肪烃、芳烃、 脂肪烃、芳烃、烷基 叔胺、 卤、叔胺、二硫化碳 15, 8.34× ε<15,μ<8.34× -30 C·m,E (30) 30) 10 m T 30~ 约30~40 非氢键给体
Cl-<Br-<I负离子在质子型溶剂和非质子极性溶剂中的亲核性能刚好相反: 负离子在质子型溶剂和非质子极性溶剂中的亲核性能刚好相反:Cl->Br->I6
各种溶剂与溶质间的相互作用:非质子溶剂( 各种溶剂与溶质间的相互作用:非质子溶剂(2)
非质子非极性溶剂对于离子型化合物的溶解力很小; 非质子非极性溶剂对于离子型化合物的溶解力很小; 非质子弱极性溶剂中, 非质子弱极性溶剂中,正离子和负离子容易发生离子缔合作用而形成离子 对(或缔合离子),只有很少溶剂化的“独立”正离子或“独立”负离子; 或缔合离子),只有很少溶剂化的“独立”正离子或“独立”负离子; ),只有很少溶剂化的 在亲核取代反应中,为了使二元缔合离子容易溶解, 在亲核取代反应中,为了使二元缔合离子容易溶解,应当选用能使正离子 专一溶剂化的非质子强极性溶剂。 专一溶剂化的非质子强极性溶剂。 二甲基甲酰胺、 亚丙酯、 如:六甲基磷酰胺、二甲亚砜、N,N-二甲基甲酰胺、碳酸 ,2-亚丙酯、 六甲基磷酰胺、二甲亚砜、 , 二甲基甲酰胺 碳酸-1, 亚丙酯 环丁砜、 甲基吡咯烷酮 甲基吡咯烷酮、 , , , 四甲基脲 开链聚乙二醇、冠醚、 四甲基脲, 环丁砜、N-甲基吡咯烷酮、1,1,3,3-四甲基脲,开链聚乙二醇、冠醚、 大环状氨基醚等, 大环状氨基醚等,
溶剂效应介绍

S R L R L s R‖L s Rs Ls
溶质
紧密离 子对
溶剂分离 离子对
(A)
ε<15
(B)
ε(15~40)
溶剂 化正 离子
溶剂 化负 离子 (C)
ε>40
溶剂极性不仅对溶质离子化过程有影响,而且对某 些反应速度也有影响。为此就要考察反应物的始态和过 渡态与溶剂分子间的静电作用,以比较起始反应物和过 渡态电荷分离程度的大小,从而可以预测溶剂极性对离 子型反应速率的影响。对过渡态比起始物分子具有较大 电荷分离程度的反应,溶剂极性的增加使反应速率加快; 而对于过渡态比起始反应物分子电荷分离程度减少的反 应,溶剂极性的增加使反应速率减慢。对溶剂极性减少 的情况来说,则情况刚好是相反的。能量变化与溶剂极 性的关系图所示。
溶剂 介电常数 相对反应速度 乙醇 24.55 1 甲醇 32.7 9 甲酸 58.5 12200 水 78.39 33500
上述静电溶剂化理论是一个简单的定性的纯静电理论, 有一定的局限性。它忽略反应中的熵变以及溶剂与溶剂的 相互作用等等。因此,有些情况例外。 7.3 特殊溶剂化效应 特殊溶剂化可分为负离子的特殊溶剂化和正离子的 特殊溶剂化两种。前者是靠氢键结合力,后者是靠电子 给体与受体之间的作用力。特殊的结构效应可使反应物 或过渡态特别强烈地被溶剂化.这比前述的溶剂静电效 应要强烈很多。
溶剂的性质主要有:极性、氢键以及酸碱性等。
按溶剂的性质和它与溶质间相互作用力的性质,分 别讨论两类不同的溶剂化效应:
1)静电溶剂化效应或静电溶剂效应;
2)特殊溶剂化效应或专一溶剂化效应。
7.2 静电溶剂化效应 这是一种溶剂化的静电理论。它主要是用溶剂极性来 确定相对的溶剂化能力及其对化学反应性的影响。极性溶 剂(如水或乙醇)可有效地把离子溶剂化,因此可降低其活 化能而使之稳定。使溶质的离解反应易于进行。在非极性 溶剂中(如苯或己烷等),离子不能很好地被溶剂化,因此 溶质的离解反应具有较高的活化能。溶质(R—L)在溶剂S 中全部离子化需经过如下式所示几个阶段:
溶剂对有机化学反应的影响

溶剂对有机化学反应的影Ⅱ向摘要介绍1溶剂对反应速率反应历程竞争反应产物比例和选择性的影在有机化学中,大多数反应是在溶剂中进行的,溶剂在有机化学反应中的作用越来越受到重视,特别是在合成中如何有效的使用溶剂,己成为一个很重要的问题。
一般可以把溶剂分为质子溶剂、极性非质子溶剂非极性非质子溶剂三种。
同一反应使用不同的溶剂,反应效果相差甚大。
例如,1一溴辛烷和氰化铺可以发生取代反应,但是如果简单地把1 溴辛烷和氰化铺的水溶液混在一起,既使于100 C回流两个星期也不反应。
这是因为溴代烷不溶于水,底钧不能接触试剂,因而不发生反应}如果用醇类做溶剂,反应虽可以进行,但反应速率很慢,产率低;若改用DMF作溶剂.其反应速度比以醇作溶剂时快10 倍。
可见溶剂,对反应速率有很大影响。
不仅如此,溶剂对反应历程、竞争反应产物比例立体化学选择性也有很大的影响。
l 溶剂对反应速率的影响1.1 溶剂对离解反应的影响当化合物在溶剂中溶解时,溶剂和溶质之间就会产生持殊的作用力,这些作用力包括:库仑引力、色散力感应力、氢键和电荷的传递作用等。
不同的溶剂知溶质之间产生的作用力也有区别,由于这些作用力的存在,使溶质改变原来的状态成为溶液对于在溶剂中进行的反应,溶剂的改变,必然强烈地影响反应物和过渡态的稳定性,强烈地影响反应过程和反应速度.影响反应的活化能。
在所有涉及离子的反应中,极性溶剂对参与反应的离子都有很大的稳定化作用。
溶剂的离子化能力主要决定于质子溶剂的给质子能力和极性非质溶剂的给电子能力。
在气相中没有溶剂的离子反应是高度活泼的,反应一般按自由基历程进行。
例如:在气相中,HC1离解为自由基只需要430.95kJ/tool,离解为离子需要1393.27kJ/tool,而HC1在极性溶剂中极易离解。
又如叔丁基溴在溶液中离子化疑需要83.68kJ/tool的能量.而在气相中离子化则需要836.8kJ/mol的能量,二者相差10倍。
由于极性溶剂如水和乙醇能有效地溶剂化和稳定化离子,因此能降低离解反应的活化能,促进离解反应的进行。
第三章 溶剂效应

+A
-A
B+
A B
A- + B+
A + B+
A B+
在非极性溶剂中有利 在极性溶剂中有利 在极性溶剂中稍有利
B+
B+
+
(4) A+
( 5) A
A B+
在非极性溶剂中稍有利
对溶剂极性不敏感
+ B
A B
A B
反应物
过渡态
产物
如消去反应和亲核取代反应竞争时,溶剂起重要作用。
一般,溶剂的极性大时(如水),容易发生取代反应;
C
C X
同样,由于过渡态的电荷分散程度不同,决定了SN1反 应在极性大的溶剂中进行,E1反应则易于在极性较小 的溶剂中进行。
• 如:三甲基硫正离子的碱性水解速度
(CH3)3S+
+
100oC OH
(CH3)2S + CH3OH
vR H2O 1.0 CH3COOH 19600 • (CH3)3CCl的溶剂分解速度 (CH3)3CCl
5、溶剂化效应的类型:①静电溶剂化效应
②特殊溶剂化效应
6.静电溶剂化效应(靠溶剂的静电作用力) 溶剂化静电理论:用溶剂极性确定相对的溶 剂化能力及其对反应的影响。
(1)溶剂极性对溶质离子化过程的影响;
溶质(R-L)在溶剂S中离子化过程:
R L S [R+L-]
紧密离子对 (A)
[R+ L- ]s
CH 3I + NaCN
CH 3CN + NaI
思考题1.
溶剂: H2O
THF
V = 1.0 V = 5 x 105
溶剂对Diels_Alder反应的影响

基金项目:山西高校科技研究开发项目(200611027)作者简介:李长多(19832),男,硕士,辽宁抚顺人,主要从事离子液体的制备与应用,E 2mail :haha 2duoduo @ 收稿日期:2008208214溶剂对Diels 2Alder 反应的影响李长多,蔡留青,李丽荣,黄利峰,张学俊(中北大学化工与环境学院,山西太原030051) 摘 要:Diels 2Alder 反应是有机合成中一类很重要的环加成反应,在精细化工,生物制药中有很广泛的应用。
溶剂对Diels 2Alder 反应的反应速率和选择性有很重要的影响。
本文综述了传统有机溶剂、水、超临界CO 2和离子液体对Diels 2Alder 反应的影响。
关键词:Diels 2Alder 反应;水;超临界CO 2;离子液体中图分类号:O 621.25+1 文献标识码:A 文章编号:167129905(2009)0120034205 Diels 2Alder 环加成反应是有机合成和化学工业中最重要的合成方法之一,是构成六元环加成产物的重要方法[1],广泛应用于复杂化合物的合成,如杀虫剂、香料、可塑剂和染料中的主要成分[2]。
该反应具有很高的“原子效率”,但选择性差,反应得到内外型异构体混合物。
因此,找到一种可以使Diels 2Alder 环加成反应得到一种产物的方法成为人们研究的热点。
反应介质是提高Diels 2Alder 反应速率和选择性的常用方法。
最近几十年,在原有的传统有机溶剂的基础上,涌现出了一系列“绿色的”,环境友好的新型溶剂,如水、超临界CO 2和离子液体等。
大量的研究证明这些溶剂对Diels 2Alder 反应有很明显的促进作用。
但是,它们是如何影响Diels 2Alder 反应的,反应的机理是什么,目前还并不为人们所了解。
1 传统有机溶剂传统有机溶剂是使用最广泛的反应介质,它有很宽的选择范围,可以针对不同的反应来选择合适的有机溶剂。
物理有机化学 第3章、溶剂效应

E.M.Kosower首先尝试用一个染料的电子跃迁来建立一套溶 剂极性标度.他选择碘化l-乙基-4-甲氧羰基吡啶盐.
在许多有用的经验溶剂参数中,基于溶剂化显色现象的Z值是最全 面的 .
§3.3 非质子极性溶剂
有一些溶剂具有较大的介电常数和电偶极矩, 但不含酸性氢, 不 能形成氢键. 一般称为非质子极性溶剂.
对于负离子与中性分子之间的双分子反应来说,在极性非质子 溶剂中的反应速率要比在质子溶剂中大得多.例如,
这些化合物的特殊的溶剂化性质是由于分子几何形状使它们对 正离子的溶剂化作用远远大于对负离子的溶剂化作用.
1. 必须满足Franck-Condon原理, 即电子跃迁必须发生得比核移 动快, 使成为一个非平衡的激发态, 其中溶剂围绕溶质的排 列如同基态一样; 2. 标准物吡啶盐在许多非极性溶剂中不溶解, 使用在这些非极 性溶剂中有较大溶解性的其它标准物, 可以克服这问题;
3. 在极性最大的溶剂中(基态溶剂化作用强, 自由能降低很多, λ <331nm, 相当于Z>86.4, 即需较大的能量来激发), 则在更强 的吡啶环的π→π*带不能区别出charge transfer band. 后来Dimroth又发展了一套更全面的溶剂极性标度ET, 是将吡啶 苯酚内铵盐作为标准物(Pyridinium-N-phenol betaines)
作为标准物的氯代叔丁烷几乎完全以SN1机理进行溶剂解反应, 但由于溶剂解反应是在大量过量的溶剂中进行的, 不可能以动力 学级数来判断溶剂是否有亲核行为, 因此氯代叔丁烷作为模型化 合物的合理性必须得到验验. 方法就是用其他模型化合物与氯代 叔丁烷的溶剂解速率进行比较,为此曾选择了下列桥头碳原子 的化合物.
溶剂效应

溶剂效应百科名片溶剂效应图解溶剂效应是溶剂对于反应速率、平衡甚至反应机理的影响,绝大多数在溶剂中发生的有机化学反应中,溶剂的性质不仅对反应速率而且对反应平衡都是非常重要的。
溶剂可分极性溶剂和非极性溶剂,极性溶剂又可分为质子溶剂和非质子偶极溶剂。
溶剂效应对反应速度常数的影响依赖于溶剂化反应物分子和相应溶剂化过渡态的相对稳定性。
目录Solvent Effect考虑溶剂效应,可以采用三种策略:IPCMSCIPCMCPCM或COSMOIEFPCM液相色谱中的溶剂效应Solvent Effect考虑溶剂效应,可以采用三种策略:IPCMSCIPCMCPCM或COSMOIEFPCM液相色谱中的溶剂效应Solvent Effect对于等级性过滤态和自由基过滤态反应,溶剂效应较小;对于偶极过渡态反应,溶剂效应较大,例如非质子偶极溶剂的特点是正端藏于分子内部,负端露于分子外部,负端可以与正离子起作用,而正端却不能与负离子起作用,因此,在非质子溶剂中,用负离子作为试剂时,由于它不被溶剂分子包围,可以很容易地进行反应,成为加快反应速度的重要手段。
溶剂效应对反应的影响的关注历史悠久。
不同的溶剂可以影响反应速率,甚至改变反应进程和机理,得到不同的产物。
溶剂对反应速率的影响十分复杂,包括反应介质中的离解作用、传能和传质、介电效应等物理作用,)和化学作用,溶剂参与催化、或者直接参与反应(有人不赞成将溶剂参与反应称作溶剂效应)。
通常我们对溶剂效应的静态模拟,关心的是溶剂效应的两个方面:一是溶剂分子反应中心有键的作用,包括配位键和氢键等,这种作用属于短程作用,另一个是极性溶剂的偶极距和溶质分子偶极距之间的静电相互作用,这个属于远程作用,当然溶剂和溶质之间的色散力作用也是重要的远程作用,特别是对于非极性溶剂而言,但是色散力的描述是量子化学模拟的一个难题。
考虑溶剂效应,可以采用三种策略:1.对于短程作用十分重要的体系,我们采用microsolvation model,或者称为explicit Solvation model。
溶剂对反应速率达影响
氨反应验证即可。
2021/4/21
13
(3)催化剂有选择性。例如不同的催化剂可以 使乙醇进行不同的反应(如书上187页所示)。
各种催化剂都有选择性,只是强弱不同而 已。 一般来说, 酶催化剂的选择性最强,络 合物催化剂次之, 金属催化剂及酸碱催化剂 最弱。 催化剂的选择性是非常可贵的, 工业 中常用下式来表达催化剂的选择性:
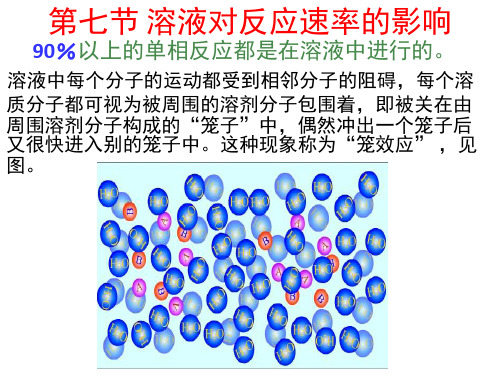
的反应与气相反应大致相当。反应物分子穿过笼
子所需的活化能(扩散活化能)一般小于20kJ/mol,小
于扩散大作多用数一化般学不反影应响的反活应化速能率(40。~400 kJ/m01),故
2021/4/21
2
但对于活化能很小(速率很快)的反应, 例如溶液中的某些离子反应、自由基复合反 应,则反应速率取决于分子的扩散速率。在 更多的情况下,溶剂分子与反应物分子之间 存在着某种相互作用,例如溶剂化作用。此 时溶液中的反应与气相反应相比,其动力学 参数常有显著改变。以下简述一些影响溶液 中反应速率的因素。
为离子强度, k0为离子强度为零时的速率常数
A为与溶剂和温度有关的常数,对25℃的水溶液而
言2021,/4/21A=0.509 。由上式可得如下规律:
7
lg
k k0
2z A zB A
I
(1) zБайду номын сангаасA zB >0,离子强度增
大,k增大,正原盐效应。 0.60
zA zB z4AzB 2
0.40
(2) z A zB <0,离子强度增
物分子之间的碰撞机会。然而,当两个反应物偶
然进入同一个笼子之后,则被关在笼中反复碰撞,
即增加了同一个笼子中反应物分子相互碰撞的机
会。在水溶液中,一对无相互作用的分子被关在
化学反应中的溶剂效应与反应速率

化学反应中的溶剂效应与反应速率溶剂在化学反应中扮演着至关重要的角色,它不仅影响反应的速率,还能改变反应的机理和产物的选择性。
本文将探讨化学反应中溶剂效应对反应速率的影响,并分析其中的机制。
一、溶剂的选择对反应速率的影响在进行化学反应时,选择合适的溶剂可以显著影响反应速率。
溶剂的选择应考虑其溶解能力、离子性、极性以及与反应物和产物的相互作用等因素。
1. 溶解能力溶剂的溶解能力决定了反应物在其溶液中的溶解度。
当反应物的溶解度较高时,反应物更容易相互接触和反应,从而加速反应速率。
例如,在水中进行的溶解度较高的反应常常比在有机溶剂中进行的慢。
2. 离子性如果反应中涉及到离子,溶剂的离子性将直接影响反应速率。
离子性溶剂可以通过溶剂化作用促进离子的离解和溶解,从而使反应进行更快。
因此,当反应物中含有离子时,选择离子性溶剂可以加速反应速率。
3. 极性溶剂的极性对于化学反应也有重要影响。
具有较高极性的溶剂在分子间相互作用中较为强烈,能够使反应物更易于解离或形成中间体,从而加速反应的进行。
因此,选择极性较高的溶剂可以加快反应速率。
二、溶剂效应的机制分析溶剂效应是指溶剂对反应机理和过渡态的影响。
其机制可以通过以下几个方面来解释:1. 溶剂的溶解度和极化能力溶剂的溶解度和极化能力决定了溶解过程的热力学和动力学。
当溶解度较高时,反应物更易于在溶剂中发生溶解,形成反应物分子的溶液。
而溶剂的极化能力则能够促进溶质分子中的极性的相互作用,从而改变反应物的构象并提供更有利的反应路径。
2. 溶剂的溶解度和溶解度对溶质的溶解和扩散有重要影响溶解度是指溶质在溶剂中的最大溶解量,而溶解度则是指溶质分子与溶剂分子之间的相互作用力。
溶解度较高的溶剂可以提供更多的反应物分子,加速了反应物的扩散和相互作用,从而使反应更容易发生,并提高反应速率。
3. 溶剂对反应物和中间体的溶解和溶剂化作用溶剂对反应物的溶解和溶剂化作用可以使反应物分子更好地相互接触,并促进反应的进行。
有机化学中的溶剂效应

有机化学中的溶剂效应溶剂效应是有机化学领域中一个重要而复杂的现象。
它指的是在溶液中,不同溶剂对化学反应速率、平衡常数以及化合物的物理性质产生的影响。
溶剂是有机合成中不可或缺的组成部分,它可以作为反应介质、溶解底物和产物、调节反应速率和平衡等环境因素的调控剂。
本文将针对溶剂效应在有机化学中的应用进行探讨。
一、溶剂对反应速率的影响不同的溶剂可以通过改变底物的电荷分布和引入特定的相互作用来影响有机反应的速率。
极性溶剂常常能够提供必要的溶解度和溶剂极化能力,使底物分子更容易解离或形成离子中间体,从而促进反应进行。
与此相反,非极性溶剂则能够降低底物分子的解离能力,减缓反应速率。
此外,溶剂的黏度和溶液的浓度也会对反应速率产生重要影响。
因此,在有机合成中,根据所需的反应速率,选择适当的溶剂至关重要。
二、溶剂对物理性质的影响除了对反应速率的影响外,溶剂还可以改变有机化合物的物理性质。
溶剂的极性和溶解度参数对溶液中溶质的溶解度、溶液的表面张力、熔点、沸点等性质都有一定的影响。
此外,溶剂的极性也会影响许多分析技术的效果,如红外光谱、质谱和核磁共振等。
因此,在有机合成和物性研究中,选择合适的溶剂对于实验结果的准确性和可靠性至关重要。
三、溶剂对平衡常数的影响在有机化学的平衡反应中,溶剂效应也起着重要的作用。
溶剂可以改变反应中化学物质的分布系数、离子化程度以及溶液中的活性,从而调节反应平衡位置。
例如,在溶液酸碱性反应中,溶剂的酸碱性会显著影响离子的解离程度,从而改变反应的平衡常数。
此外,溶剂的极性和溶解度参数也会影响气液平衡的相关性质,如溶液中电解质的蒸气压、溶液组成随温度的变化等。
溶剂效应的应用已经广泛涉及到有机合成、药物研发、催化机制和反应机理等领域。
研究人员通过精心选择合适的溶剂、混合溶剂甚至离子液体来调节反应条件,以提高产率、改善选择性和提供新的反应途径。
另外,溶剂效应的研究也为不同催化机理的解释提供了参考依据,有助于加深对有机反应的理解和控制。
什么是化学反应的溶剂效应

什么是化学反应的溶剂效应化学反应的溶剂效应是指在化学反应过程中,溶剂对反应物、产物和反应速率的影响。
溶剂在化学反应中扮演着至关重要的角色,它可以改变反应物的浓度、稳定性、活性以及反应速率。
溶剂效应对于理解化学反应机理、优化反应条件和提高化学品的产率具有重要意义。
溶剂效应主要包括以下几个方面:1.溶剂对反应物和产物的溶解度影响:溶剂可以影响反应物和产物的溶解度,从而影响反应的速率和平衡位置。
一般来说,溶剂的极性越大,对极性物质的溶解度越大。
因此,在选择溶剂时,需要根据反应物的性质选择合适的溶剂,以提高反应的效率。
2.溶剂对反应物活性的影响:溶剂可以与反应物分子发生相互作用,从而影响反应物的活性。
例如,某些溶剂可以降低反应物分子的活化能,使反应更容易进行。
此外,溶剂还可以通过氢键、范德华力等相互作用影响反应物分子的构象,进一步影响反应活性。
3.溶剂对反应速率的影响:溶剂可以影响反应物之间的碰撞频率和反应活性中心的选择性。
溶剂的极性、粘度和密度等性质会影响反应物分子的扩散速率,从而影响反应速率。
此外,溶剂还可以通过调节反应条件,如温度和压力,影响反应速率。
4.溶剂对产物稳定性的影响:溶剂可以影响产物的稳定性,从而影响反应的产率。
某些溶剂可以使产物分子更容易解离,从而提高产物的稳定性。
另一方面,溶剂也可以通过与产物分子发生相互作用,降低产物的稳定性,导致产物的降解或失活。
5.溶剂对反应机理的影响:溶剂可以参与反应过程,影响反应机理的步骤。
例如,在溶剂介质中,反应可能发生不同的途径,生成不同的产物。
此外,溶剂还可以影响反应中间体的稳定性,从而影响反应的进程。
总之,溶剂效应在化学反应中起着关键作用。
了解溶剂效应有助于我们更好地掌握化学反应的规律,为实际应用提供理论指导。
在化学研究和工业生产中,合理选择溶剂和优化反应条件,可以提高化学反应的效率和产率,降低生产成本,为我国的经济社会发展做出贡献。
化学反应机理的溶剂效应与溶剂选择

化学反应机理的溶剂效应与溶剂选择溶剂在化学反应中发挥着重要作用,其中最为明显的就是其对反应机理的影响。
溶剂效应是指在溶液中进行的化学反应与在气相或固相中进行的反应之间的差异。
溶剂选择则是指在化学反应中选择合适的溶剂以最大程度地影响反应机理和反应速率。
一、溶剂效应的影响1. 溶剂的极性和溶解能力溶剂的极性与溶解能力决定了其对离子反应的影响。
极性溶剂可通过溶解离子,增加离子间相互作用,从而改变反应速率和机理。
例如,在水溶液中,水分子能够形成氢键,使离子分散并增加反应速率。
而在非极性溶剂中,如烷烃等,由于无法形成氢键,离子很难溶解,从而导致反应速率较慢。
2. 溶剂的酸碱性溶剂的酸碱性对酸碱反应的速率和方向起着重要作用。
酸性溶剂能够提供H+离子,促进反应中的质子转移步骤。
碱性溶剂则能够提供OH-离子,影响酸碱中和反应的进行。
例如,氨水作为一种碱性溶剂,可以催化许多缩合反应。
3. 溶剂的介电常数溶剂的介电常数决定了其对静电相互作用的屏蔽效应。
介电常数越大的溶剂,对离子间相互作用的屏蔽能力越强。
例如,极性溶剂中的离子可以通过溶剂和周围分子之间的静电屏蔽而减少相互作用,影响反应动力学。
二、溶剂选择的原则1. 化学反应的类型根据化学反应类型的不同,选择的溶剂也应有所区别。
例如,在溶解、溶液反应、酸碱中和等反应中,一般选择极性溶剂,如水、醇等。
而在取代反应、加成反应等中,通常选择非极性溶剂,如烷烃。
2. 反应物和产物的溶解度选择溶剂时,需要考虑反应物和产物的溶解度。
如果反应物和产物在溶剂中溶解度较低,可能会导致反应速率较慢或反应无法进行。
因此,需要选择适当溶解度的溶剂以保证反应顺利进行。
3. 溶剂的安全性和环境友好性在选择溶剂时,还需要考虑其安全性和环境友好性。
一些常用的有机溶剂可能具有毒性或对环境造成污染,因此应该尽可能选择较为安全和环境友好的溶剂,以减少对人体和环境的危害。
三、实际案例1. 核磁共振(NMR)溶剂选择在核磁共振实验中,需要选择合适的溶剂以溶解待测试的样品。
乙酸乙酯水解的反应机理

乙酸乙酯水解的反应机理简介乙酸乙酯水解是一种常见的有机化学反应,它涉及到乙酸乙酯与水之间的反应。
本文将重点介绍乙酸乙酯水解的反应机理及其相关影响因素。
反应方程式乙酸乙酯水解的化学反应方程式如下所示:C H3C OO C2H5+H2O→C H3C OO H+C2H5OH这个反应中,乙酸乙酯与水的反应生成乙酸和乙醇。
反应机理乙酸乙酯水解的反应机理可以分为以下几个步骤:质子化步骤1.:水分子中的氢离子与乙酸乙酯中的羧基氧原子形成氢键,使乙酸乙酯分子质子化。
解离步骤2.:质子化的乙酸乙酯分子中的酯基氧原子与水分子中的氢离子形成氢键,使乙酸乙酯分子解离为相应的酸和醇。
酸碱中和步骤3.:质子化的乙酸乙酯分子中的羧基氧原子与水分子中的氢离子形成氢键,使生成的乙酸中和为相应的酸。
生成步骤 4.:解离后的乙酸乙酯中的酯基与水分子中的羟基形成醚键,生成乙醇。
影响因素乙酸乙酯水解的反应速率受到以下因素的影响:溶剂效应1.:溶剂的极性和离子性会影响乙酸乙酯分子和水分子的亲和力,从而影响水解反应的速率。
温度2.:反应速率随温度的升高而增加,因为高温可以提供更多的动力能使分子碰撞更频繁,增加反应速率。
浓度3.:反应速率与乙酸乙酯和水的浓度呈正相关关系,浓度越高,反应速率越快。
催化剂4.:一些适当的催化剂可以提高乙酸乙酯水解的反应速率,加速反应过程。
应用与实验乙酸乙酯水解是工业生产醋酸和乙醇的重要反应之一。
它也是有机合成中常用的转化反应之一。
在实验室中,可以通过以下步骤来进行乙酸乙酯水解实验:1.准备一定量的乙酸乙酯和水,并称量精确的量。
2.将乙酸乙酯和水倒入一个反应容器中,搅拌均匀。
3.将反应容器放入恒温水浴中,保持恒定的温度。
4.在一定的时间间隔内,取出适量的反应物,进行分析计算反应速率。
总结乙酸乙酯水解是一种重要的有机化学反应,它的反应机理涉及质子化、解离、酸碱中和和生成等步骤。
该反应受溶剂效应、温度、浓度和催化剂等因素的影响。
酰卤,酸酐,酯,酰胺的水解难易次序

水解是一种化学反应,其中一个化合物与水反应,产生两种或更多种新的化合物。
水解是许多生物体和人工体系中普遍存在的一种化学反应。
在有机化学中,酰卤、酸酐、酯和酰胺等化合物在水中的水解反应具有一定的难易次序。
本文将探讨这些化合物的水解难易次序,并对其进行详细的介绍和分析。
1. 酰卤的水解酰卤是一类含有羰基碳与卤素相连的有机化合物,常见的有酰氯、酰溴、酰碘等。
酰卤的水解是一种较为剧烈的化学反应,其反应活性较高。
以酰氯为例,其水解反应可由以下方程式表示:RCOCl + H2O -> RCOOH + HCl可见,酰氯在水中迅速水解生成对应的羧酸和氢氯酸。
这一反应是比较容易发生的水解反应。
2. 酸酐的水解酸酐是一类含有两个酯基的羧酸衍生物,它们有着特殊的结构和性质。
酸酐的水解反应需要在碱性条件下进行,而且反应速率较慢。
以醋酸酐为例,其水解反应可由以下方程式表示:RCOOCCH3 + H2O -> RCOOH + CH3COOH可以看出,酸酐在水中的水解需要较长的时间,并且需要在碱性条件下进行,因此其水解反应难度较大。
3. 酯的水解酯是一类含有羧酸酯基的有机化合物,其在水中的水解反应属于中等难度。
以乙酸乙酯为例,其水解反应可由以下方程式表示:RCOOC2H5 + H2O -> RCOOH + C2H5OH可以看出,酯在水中的水解反应需要一定的时间,并且需要在碱性条件下进行,因此其水解反应难度较大。
4. 酰胺的水解酰胺是一类含有酰基与氨基相连的有机化合物,其在水中的水解反应较为困难。
以乙酰胺为例,其水解反应可由以下方程式表示:RCOCONH2 + H2O -> RCOOH + NH3可以看出,酰胺在水中的水解反应需要较长的时间,并且需要在酸性或碱性条件下进行,因此其水解反应难度较大。
总结来看,酰卤的水解反应相对较易发生,其次是酯的水解反应,酸酐的水解反应难度较大,而酰胺的水解则是较为困难的。
解决液相溶剂效应的方法

解决液相溶剂效应的方法【摘要】液相溶剂效应是化学实验中常见的问题,影响实验结果的准确性和可重复性。
解决这一问题的方法有多种途径。
选择合适的溶剂非常重要,要根据实验需求选择相容性好、稳定性高的溶剂。
改变溶剂的性质,如调整极性或添加辅助剂,可以减少液相溶剂效应的影响。
优化溶剂的浓度、改变温度和压力也可以有效地解决这一问题。
采用其他技术手段如超声波辅助溶解或选择合适的容器材料也是解决液相溶剂效应的有效方法。
总结而言,解决液相溶剂效应的关键在于综合运用各种方法,并在实验中加以实践。
展望未来,可以进一步研究新型溶剂或技术,提高实验的精确性和可靠性。
【关键词】解决液相溶剂效应的方法、溶剂选择、溶剂性质、溶剂浓度、温度、压力、技术手段、未来研究方向1. 引言1.1 液相溶剂效应的概念液相溶剂效应是一种在化学反应中常见的现象,指的是溶剂对反应物质的影响导致反应速率或产物选择性发生变化的情况。
液相溶剂在参与反应的过程中可以通过溶解反应物质、形成溶剂化物质以及影响反应中间体的稳定性等方式影响反应的进行。
液相溶剂效应可能对反应结果产生积极的影响,使得反应更加高效或选择性更好,也可能对反应产生负面影响,导致产率降低或意外的产物生成。
了解并控制液相溶剂效应对于合成化学领域具有重要意义。
在实际研究和应用中,科学家们需要通过调节溶剂种类、浓度、性质以及反应条件等因素来解决液相溶剂效应带来的问题,以实现对目标产物的精确控制和高效合成。
通过对液相溶剂效应的深入了解和研究,可以为化学反应的设计和优化提供有益的指导和方法论。
1.2 问题背景液相溶剂效应是指在化学反应或分析过程中,溶剂的物理化学性质对反应速率、产物选择性和产率等方面的影响。
溶剂是许多化学反应和分析中不可或缺的组成部分,但有时候溶剂的选择和性质可能会对实验结果产生负面影响,这就是液相溶剂效应所造成的问题。
液相溶剂效应可能导致实验结果的不确定性、反应速率的变化、产物选择性的改变甚至催化剂活性的降低。
气相色谱溶剂效应_解释说明以及概述

气相色谱溶剂效应解释说明以及概述1. 引言1.1 概述气相色谱溶剂效应是指在气相色谱(GC)分析中,溶剂对样品分离和检测的影响。
溶剂效应通常由于溶剂与样品之间的相互作用引起,这种相互作用可导致样品分子在柱上产生不同的保留和分离行为。
了解和研究溶剂效应对于准确的分析结果至关重要。
1.2 文章结构本文将依次讨论气相色谱溶剂效应解释说明以及概述的相关内容。
首先,我们将介绍气相色谱溶剂效应的定义和背景知识,包括其基本概念和相关研究现状。
然后,我们将探讨影响气相色谱溶剂效应的因素,并介绍色谱分离机理与溶剂效应之间的关系。
接下来,我们将重点讨论溶剂效应在气相色谱中的实际应用。
具体而言,我们将探讨温度对溶剂效应的影响、不同溶剂对分析结果的影响以及样品前处理方法优化与溶剂选择之间的关系。
在展示实验方法和技术措施时,我们将介绍样品准备与处理步骤、色谱柱和条件选择的要点,以及数据分析和结果解读策略。
最后,我们将总结本文的主要观点,并提出对研究潜力与未来发展方向的建议。
1.3 目的本文旨在深入探讨气相色谱溶剂效应的解释和应用。
通过全面了解溶剂效应对气相色谱分析结果的影响,我们可以更好地理解该现象并提出相应的实验方法和技术措施。
同时,本文也希望为相关领域的研究者提供有关气相色谱溶剂效应的综合指南。
2. 气相色谱溶剂效应解释说明:2.1 定义和背景:气相色谱是一种常用的分离和分析技术,它通过将样品溶解在挥发性液体(溶剂)中,以气态物质在固定填充材料上的分配系数差异实现分离。
然而,溶剂的选择不同会引起溶剂效应,对色谱结果有着显著影响。
2.2 影响因素:气相色谱溶剂效应主要受以下几个因素影响:- 构成:不同溶剂由于其化学结构和性质的不同,可能与样品中的组分发生特定的相互作用,并改变它们在固定相中的吸附行为。
- 极性:极性溶剂(如醇类)与非极性物质(如烷烃)相互作用较弱,易于从固定相上解吸下来移动;而非极性溶剂(如正庚烷)则对非极性物质具有较强的吸附作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶剂效应对反应速率的影响
溶剂在化学反应中起着至关重要的作用。
它不仅可以作为反应物和产物的媒介,还可以通过溶剂分子与反应物之间的相互作用来影响反应速率。
溶剂效应是指溶剂对反应速率的影响,它可以通过溶剂的极性、溶解度、酸碱性等因素来体现。
一、溶剂的极性对反应速率的影响
溶剂的极性是指溶剂分子中正负电荷分布的不均匀程度。
极性溶剂能够与带电
的反应物分子进行相互作用,从而影响反应速率。
例如,在极性溶剂中,带正电荷的反应物分子会与溶剂中的负电荷部分发生静电作用,使反应物分子更容易解离或发生电子转移反应。
这种作用可以加快反应速率。
二、溶剂的溶解度对反应速率的影响
溶解度是指溶剂中能够溶解的溶质的最大量。
当溶解度较高时,溶剂中的溶质
浓度较大,反应物分子之间的碰撞机会也就更多,从而增加了反应速率。
另一方面,溶解度较低的溶剂可能会导致反应物分子间的碰撞机会减少,从而降低反应速率。
因此,溶解度对反应速率有着明显的影响。
三、溶剂的酸碱性对反应速率的影响
溶剂的酸碱性可以通过其pH值来衡量。
酸性溶剂具有较高的氢离子浓度,而
碱性溶剂则具有较低的氢离子浓度。
在酸性溶剂中,酸催化反应可以通过提供质子来加速反应速率。
而在碱性溶剂中,碱催化反应可以通过接受质子来加速反应速率。
因此,溶剂的酸碱性对反应速率有着显著的影响。
四、其他溶剂效应的影响因素
除了上述因素外,溶剂的粘度、温度和压力等因素也可以影响反应速率。
溶剂
的粘度越高,分子间的相互作用力就越大,反应物分子之间的碰撞机会也就减少,从而降低了反应速率。
温度的升高可以增加溶剂分子的动能,使反应物分子更容易
发生碰撞,从而增加反应速率。
压力的增加可以增加溶剂分子的浓度,从而增加反应物分子之间的碰撞机会,进而加快反应速率。
综上所述,溶剂效应对反应速率有着重要的影响。
溶剂的极性、溶解度和酸碱性等因素可以通过影响反应物分子之间的相互作用来改变反应速率。
此外,溶剂的粘度、温度和压力等因素也可以对反应速率产生影响。
因此,在设计和优化化学反应时,我们应该充分考虑溶剂的选择和条件,以实现更高效的反应过程。
