化学必修一第三章金属及其化合物总结及钠铝铁专题训练全解
2019年人教版高一化学必修一第三章金属及化合物复习专题——钠及化合物(有答案)

钠及其化合物学习目标:1.了解金属钠的保存方法。
2.掌握钠单质的物理性质和化学性质。
3.掌握钠的化合物的性质并了解焰色反应。
知识研读一、钠的性质1.钠的物理性质钠是一种银白色金属、质软、有金属光泽的固体,熔沸点低(97.7℃),密度比水小但比煤油大。
钠有良好的导热性、导电性,可作为核反应堆的导热剂。
2.钠的化学性质结构决定性质,钠元素是一种非常活泼的金属元素,它的原子结构示意图如右图所示。
钠原子极易失去最外层的1个电子,变成8电子的稳定结构。
所以金属钠表现出非常强的还原性,因此在自然界中通常以化合态的形式存在。
(1)钠与O2反应常温下,新切开的金属钠表面的银白色金属光泽迅速变暗,因为钠和氧气发生缓慢氧化反应,生成白色的氧化钠。
4Na + O2=2Na2O加热条件下,钠跟氧气剧烈反应,金属钠先熔化后剧烈燃烧,发出黄色火焰,生成淡黄色固体——过氧化钠(Na2O2)。
2Na + O2△Na2O2+11 2 8 1(2)钠与H2O反应在烧杯中加一些水,滴入几滴酚酞溶液,然后用镊子把钠从煤油中取出来,并用滤纸将表面的煤油吸干,用小刀切绿豆大小的金属钠投入到水中,在烧杯口盖上玻璃片,观察实验现象。
实验现象:钠浮在水面上(钠的密度比水小),迅速熔化成一个光亮的小球(该反应放热,钠的熔点低),并在水面上四处游动、发出嘶嘶的响声(生成了气体),加入酚酞溶液后,溶液变为红色(生成了碱性物质)。
化学方程式:2 Na + 2 H2O =2 NaOH + H2↑离子方程式:2 Na + 2 H2O =2 Na+ + 2 OH-+ H2↑思考:试解析上述现象答案:(3)钠的保存少量金属钠可保存在煤油中,大量的金属钠则用蜡密封保存在铁筒中。
【例1】下列关于钠的性质叙述中,不.正确的是()A.切下一小块钠,投入水中,钠熔成小球,说明钠与水反应有热量放出B.从钠能与水反应可推知钠也能与盐酸反应C.钠在空气中燃烧生成氧化钠D.切开一块钠,呈银白色,很快变暗,说明钠常温下能与氧气反应【答案】C现象解释钠浮在水面上钠熔成小球钠在水面上四处游动发出嘶嘶的响声溶液变红【解析】钠在空气中燃烧时发生反应:2Na +O 2=====点燃Na 2O 2,故C 选项错误。
高中化学必修一第三章金属及其化合物知识点总结

一、钠及其化合物K钠2、氧化钠以及过氧化钠第1页共7页第2页共7页3、碳酸钠以及碳酸氢钠第3页共7页(1)除杂问题1、NeuCO,固(NaHCO,固):加热【ZNaHCOFNeuCa+lLO+CO? f 】2、NmCO,溶液(NaHCOj:适量氢氧化钠【NaHg+NaOHuNmCOs+ILO】3、NaHCOs 溶液(Na2C05):通入过量C()2【Na2C0s+C03+H30=2NaHC0s ](2 )、如何鉴别Na2CO3和NaHCOs两种溶液?1、溶解量的多少:N Q CO S比NaHCOs易溶于水;2、温度变化:N&2C03溶于水比NaHCOs放出热量多;3、比较碱性强弱:分别加入几滴酚酿,看溶液变红的程度,更红的是NH2C03;4、加热固体:NaaCOs稳定,NaHCOs受热易分解产生C02;5、加入稀HC1: Nd2CO3的反应速率比NaHCOs慢;6、配成溶液滴加入SC12溶液:有沉淀生成的是Na2C03o(不可用Ca(OH)2或Ba(0H)2)二、焰色反应实验步骤:洗、烧、蘸、烧、观简要记忆步骤:用洁净的钳丝先蘸点盐酸灼烧,再蘸点待测溶液灼烧,观察现象。
第4页共7页钠:黄色火焰钾:(透过蓝色钻玻璃)紫色火焰三、铝及其化合物仁铝(两性金属)2、氧化铝(两性氧化物)3、氢氧化铝(两性氢氧化物)4、铝盐第5页共7页净水作用A1"+3H2O=A1(OH)3+3H+明矶与水反应生成的氢氧化铝胶体具有吸附性,吸附水中的悬浮物而使其下沉5、铝三角匚A1(OH)3->A1 卄:A1(OH)3+3H+=A13++3H2O匚A F+T A1(OH)3 : AP++ 3NH3 H2O== Al(OH)"+3NELrAI3>3OH =A1(OH)31【少量强碱】Al卄:OH = 1:3AI3++3A1O2+6H2O=4A1(OH)31 (A严与AKh•不能共存)rAl(OH)3->AlO2: Al(OH)j+OH =AIO2+2H1OrA1O2- ->A1(OH)3: A1O2 +H*+H2O=AI(OH)31【少量强酸】(A1O2 与FT不能大量共存)匚AKh JA1 卄:A1O2+4H*=A13*+2H2O【过量强酸】A严:H*=l:4LA13+->A1O2 : A13++4OH =AIO2+2H2O【过量强碱】Al3* : OH = 1:4四、铁及其化合物K铁铁在地壳中的含量仅次于氧、硅、铝,居第四位。
人教版高中化学必修一第三章金属及其化合物知识点总结,文档

高一化学金属及其化合物知识点总结1.元素的存在形式有两种:游离态和化合态。
1〕钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。
2〕铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。
2.金属单质的用途:1〕利用钠元素的特征焰色〔黄色〕制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反响堆的导热剂;利用钠单质制备过氧化钠,利用钠单质复原熔融态的四氯化钛制备金属钛。
2〕镁条燃烧发出耀眼的白光,用来做照明弹。
〔3〕利用铝的良好导电性,做导线。
利用铝块和铝粉的颜色都是银白色,铝粉制成银粉〔白色涂料〕。
3.金属化合物的用途:1〕过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。
2〕氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。
3〕明矾做净水剂。
4.金属的分类:1〕根据冶金工业标准分类:铁〔铬、锰〕为黑色金属,其余金属〔钠镁铝等〕为有色金属。
2〕根据密度分类:密度大于3的金属是重金属:如铁、铜、铅、钡,密度小于3的金属是轻金属:如钠、镁、铝。
5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物。
1〕氧化物〔根据氧化物中非氧元素的种类〕分为金属氧化物和非金属氧化物。
2〕金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
3〕非金属氧化物分为酸性氧化物、不成盐氧化物。
〔4〕氧化物〔根据氧化物是否与碱或酸反响生成盐〕分为成盐氧化物和不成盐氧化物〔CO、NO〕。
5〕成盐氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
6〕酸性氧化物分为高价态的金属氧化物〔Mn2O7〕和非金属氧化物〔CO2〕。
7〕碱性氧化物只能是金属氧化物〔CaO〕。
〔8〕两性氧化物只能是金属氧化物〔Al2O3、ZnO〕。
高中化学必修一第三章金属及其化合物知识点简单整理

化学必修一第三章《金属及其化合物》知识点简单整理1.了解钠、铝、铁、铜等金属及其重要化合物的主要物理性质(1).钠、铝、铁、铜在自然界中的存在形式。
(2)钠、铝、铁、铜单质的物理性质①.颜色:块状钠铝铁单质是银白色金属,纯铜是紫红色金属;粉末状的铝和铜颜色不变,粉末状的铁屑是黑色,没有粉末状的钠,钠在空气中马上氧化成白色的氧化钠,最终氧化成碳酸钠;冶金工业中铁属于黑色金属,钠、铝、铜属于有色金属。
③.熔点:钠的熔点低,钠与水反应产生的热量就可以使其熔化成小球;铝、铁、铜的熔点很高。
④.共性:不透明,有导电性、导热性、延展性;钠钾合金做原子反应堆的导热剂;铝、铁、铜可以做导线,金属的导电性:Ag>Cu>Al ;铝的延展性可以制成包装用的铝箔;铝、铁、铜可以制成各种容器等。
⑤.硬度:钠的硬度很小,可以用小刀切割;纯铝的硬度较小,铁和铜的硬度较大。
(3)钠、铝、铁、铜的重要化合物的物理性质①.氧化物的颜色:白色:Na2O 、Al2O3;黑色:FeO 、Fe3O4、CuO;淡黄色:Na2O2;红棕色:Fe2O3。
②.氧化物的溶解性:Na2O 、Na2O2溶于水生成强碱发生化学变化;Al2O3、FeO 、Fe2O3、Fe3O4、CuO不溶水。
③.氢氧化物的颜色:白色:NaOH 、Al(OH)3、Fe(OH)2;红褐色:Fe(OH)3;蓝色:Cu(OH)2。
④.氢氧化物的溶解性:溶于水的:NaOH;不溶于水的:Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2;其中Fe(OH)2溶于水变色:先变成灰绿色,再变成红褐色Fe(OH)3。
(4)钠、铝、铁、铜重要化合物的物理性质的用途②.为离子共存提供判断依据:ⅰ、有颜色的离子不能大量共存:黄色:Fe3+,浅绿色:Fe2+,蓝色:Cu2+;ⅱ、强碱性条件下不能共存的离子:Fe3+、Fe2+ 、Cu2+、Al3+;ⅲ、与HCO 不能大量共存(发生双水解反应)的离子:Fe3+、Fe2+、Cu2+、Al3+。
高一化学必修1第三章_金属及其化合物全章复习(最新)

Fe3+ 黄色 酸
碱 空气中 放置
Fe(OH)2 白色沉淀
Fe(OH)3 红褐色沉淀
[ 练习 ] 1、要除去FeCl2溶液中的少量FeCl3,可行的办法是____ D A. 滴入KSCN溶液 B. 通入氯气 C. 加入铜粉 D. 加入铁粉
溶液变红,显碱性 稳定,加热不分解
[怎样鉴别 Na2CO3和NaHCO3 ]
⑪在固体中加入相同浓度的盐酸,反应剧烈的 是碳酸氢钠 ⑫加热固体,产生能使石灰水变浑浊的无色气体 的是碳酸氢钠。
2NaHCO3 = Na2CO3 + H2O + CO2
⑬溶解,加入CaCl2溶液,产生沉淀的是碳酸钠。
Na2CO3 + CaCl2 = 2NaCl + CaCO3
(三)铁盐与亚铁盐:
1. Fe2+ 、Fe3+常用的检验方法 1)Fe3+的检验: a.观察颜色: Fe3+的溶液呈棕黄色 b.加碱液:Fe3 + 3OH = Fe(OH)3(红褐色沉淀) c.加KSCN溶液: 3 +3SCN=Fe(SCN)3(血红色溶液) Fe 2)Fe2+的检验: a.观察颜色: Fe2+的溶液呈浅绿色 b.加碱液:Fe2 + 2OH = Fe(OH)2 (白色絮状沉淀)
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
特性
碱 ___性氧化物
过 ___氧化物
2、碳酸钠、碳酸氢钠
高中化学一第三章金属及其化合物(知识梳理+章末综合复习试题)教师版含答案

第三章《金属及其化合物》复习知识梳理复习知识要点:1、钠及钠的重要化合物的性质2、铝及铝的重要化合物的性质3、铁及铁的重要化合物的性质复习目标:通过知识点内容梳理及例题练习,回忆并巩固本章所有知识点内容及其应用。
掌握钠和过氧化钠的重要性质;掌握铝及氢氧化铝既能和酸反应又能和碱反应的性质,并能正确书写相应方程式;掌握Fe2+盐和Fe3+盐之间的相互转换。
知识点一:钠1.物理性质颜色密度熔点_____ 比水____,比煤油____ ____100 ℃2.化学性质【特别提醒】(1)实验室中钠常保存在煤油或者石蜡油中,使之隔绝空气和水。
但不能保存在四氯化碳和汽油中。
(2)钠与氧气反应,条件不同产物不同。
【例题1】将一小块金属钠分别投入盛①水、②乙醇、③稀H2SO4的三个小烧杯中,反应速率由快到慢的顺序为______________。
解释反应速率不同的原因: _____________________。
3.Na实验现象实验结论浮.在水面上【例题2】将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有沉淀产生的是_______.①MgSO4溶液②NaCl溶液③Na2SO4溶液④饱和澄清石灰水⑤Ca(HCO3)2溶液【答案】1.银白;小;大;低于2.Na2O;Na2O2;2Na+2H2O===2Na++2OH-+H2↑;2Na+2H+===2Na++H2↑;2Na+2C2H5OH―→2C2H5ONa+H 2↑;2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑;2Na+2H2O+Cu2+===Cu(OH)2↓+2Na++H2↑3.钠的密度比水小;钠的熔点低,钠与水反应为放热反应;钠与水剧烈反应,产生气体;钠与水反应生成碱性物质【例题1】③〉①〉②;钠与上述三种物质反应的实质都是钠与H+间的置换反应,H+浓度的大小决定了反应速率的快慢,由三种物质电离H+的能力可知H+浓度的大小顺序为③〉①〉②,因而反应速率为③>①>②.【例题2】①④⑤知识点二:氧化钠和过氧化钠例题3]某溶液中含有HCO-3、SO错误!、CO错误!、CH3COO-等四种阴离子.向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)()A.CH3COO- B.SO错误! C.CO错误! D.HCO错误!【答案】(从左至右,从上至下)-2;-1;白色固体;淡黄色固体;Na2O;Na2O2;1∶2;1∶2;是不是;Na2O+H2O===2NaOH;2Na2O2+2H2O===4NaOH+O2↑;Na2O+CO2===Na2CO3;2Na2O2+2CO2===2Na2CO3+O2;Na2O+2HCl===2NaCl+H2O;【例题3】A知识点三:碳酸钠和碳酸氢钠的性质比较名称碳酸钠(Na2CO3)碳酸氢钠(NaHCO3)俗名物理性质色、态白色晶体细小白色晶体水溶性易溶于水,溶液呈___ _易溶于水(但比Na2CO3溶解度___ _ ,溶液呈碱性稳定性____ ,但结晶碳酸钠(Na2CO3·10H2O)易____不稳定,受热易分解,方程式:___________________化学性质与H+反应_____________________________________与碱反应Ca(OH)2]与OH-不反应,但Ca2++CO错误!===CaCO3↓_______________________(碱过量)____________________(碱不足)与盐反应CaCl2不反应硫酸铝3HCO错误!+Al3+===Al(OH)3↓+3CO2↑主要用途玻璃、造纸、制皂、洗涤发酵、医药、灭火器相互转化【例题4】下列几种试剂能把等物质的量浓度的Na2CO3、NaHCO3鉴别开的是__________。
高一化学必修一第三章章节总结

学习笔记与氢氧化钠现象:产生白色沉淀,快速变成灰绿色,最终变成红褐色。
FeCl2+2NaOH==F e(O H)2↓+2NaCl4F e(O H)2+O2+2H2O==4F e(O H)3现象:产生红褐色沉淀FeCl3+3NaOH==F e(O H)3↓+ 3NaCl与KSCN溶液无现象产生血红色Fe3++3SCN-==Fe(SCN)3氧化(还原性)主要表现:还原性,举例:2FeCl2+Cl2 ==2FeCl3表现:氧化性,举例:2FeCl3+Fe==3FeCl2相互转化FeCl2FeCl3:2FeCl2+Cl2 ==2FeCl3FeCl3 FeCl2:2FeCl3+Fe==3FeCl2名称氢氧化亚铁氢氧化铁化学式F e(O H)2F e(O H)3颜色、状态白色固体红褐色固体水溶性难溶于水难溶于水与酸反应F e(O H)2+2HCl==FeCl2+2H2OF e(O H)2+2H+==Fe2++2H2OF e(O H)3+3HCl==FeCl3+3H2OF e(O H)3+3H+==Fe3++3H2O氢氧化亚铁露置空气中4F e(O H)2+O2+2H2O ==4F e(O H)33、铁三角二、本章典型题剖析1、滴加依次不同,试验现象不同(1)稀Na2CO3溶液与稀盐酸间的反应向Na2CO3溶液中逐滴加入稀盐酸,起先时无气体产生,达到肯定量后才有气泡冒出,由少到多的过程中依次发生下列反应:是NaOH。
若将1克该样品放入含有HCl 3.65克的盐酸中使其完全反应后,残酸再用50克2%的NaOH溶液恰好中和反应,蒸干溶液,所得固体的质量是多少克?解:所得固体是NaCl ,是5.85克[小结]本题数据众多,反应物不纯,过程困难。
若按常规方法,一步步分析计算,不但费时还易出错,若仔细分析就会发觉,最终所得固体物质NaCl中全部的Cl全来自于HCl中的Cl1、有5.1gMg–Al合金,投入500mL 2mol/L HCl中,金属完全溶解后,又加4mol/LNaOH 溶液VmL,得最多沉淀8.6g,则V等于A. 425mLB. 560mLC. 250mLD. 500mL2、铝三角转化及铝的图像问题(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消逝方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH― ==AlO2―+H2O图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消逝方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀渐渐溶解。
化学必修一第三章《金属及其化合物》主要知识及化学方程式总结

化学必修一第三章《金属及其化合物》主要知识及化学方程式总结化学必修一第三章《金属及其化合物》主要知识及化学方程式总结高一化学必修I第三章主要知识及化学方程式一、钠及其化合物的性质:1.钠在空气中缓慢氧化:4Na+O2==2Na2O2.钠在空气中燃烧:2Na+O2====Na2O23.钠与水反应:2Na+2H2O=2NaOH+H2↑现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有响声;⑤滴有酚酞的水变红色。
4.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑5.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O26.碳酸氢钠受热分解:2NaHCO3==Na2CO3+H2O+CO2↑7.氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O8.在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO39.苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3+2HCl=2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl=NaHCO3+NaClCO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑10.小苏打与盐酸反应NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑二、铝及其化合物的性质1.铝与盐酸的反应:2Al+6HCl=2AlCl3+3H2↑2.铝与强碱的反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑3.铝在空气中氧化:4Al+3O2==2Al2O34.氧化铝与酸反应:Al2O3+6HCl=2AlCl3+3H2O5.氧化铝与强碱反应:Al2O3+2NaOH+3H2O=2Na[Al(OH)4]6.氢氧化铝与强酸反应:Al(OH)3+3HCl=AlCl3+3H2O7.氢氧化铝与强碱反应:Al (OH)3+NaOH=Na[Al(OH)4]8.实验室制取氢氧化铝沉淀:Al3++3NH3H2O=Al(OH)3↓+3NH4+9.NaAlO2与强酸反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaClAlO2-+H++H2O=Al(OH)3↓10.NaAlO2与弱酸反应(以CO2为例)1△点燃CO2少量:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-CO2过量:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-三、铁及其化合物性质1.Fe2+及Fe3+离子的检验:①Fe2+的检验:(浅绿色溶液)a)加氢氧化钠溶液,产生白色沉淀,继而变灰绿色,最后变红褐色。
化学必修一第三章知识点及习题(含答案)

第三章:金属及其化合物一、金属活动性Na>Mg>Al>Fe。
二、金属一般比较活泼,容易与O2反应而生成氧化物,可以与酸溶液反应而生成H2,特别活泼的如Na等可以与H2O发生反应置换出H2,特殊金属如Al可以与碱溶液反应而得到H2。
三、A12O3为两性氧化物,Al(OH)3为两性氢氧化物,都既可以与强酸反应生成盐和水,也可以与强碱反应生成盐和水。
四、五、Na2CO3和NaHCO3比较碳酸钠碳酸氢钠俗名纯碱或苏打小苏打色态白色晶体细小白色晶体水溶性易溶于水,溶液呈碱性使酚酞变红易溶于水(但比Na2CO3溶解度小)溶液呈碱性(酚酞变浅红)热稳定性较稳定,受热难分解受热易分解2NaHCO3=Na2CO3+CO2↑+H2O与酸反应CO32—HCO3—H+CO3-+H+==CO2↑+H2OHCO3-+H+==CO2↑+H2O相同条件下放出CO2的速度NaHCO3比Na2CO3快与碱反应Na2CO3+Ca(OH)2==CaCO3↓+2NaOH反应实质:CO32-与金属阳离子的复分解反应NaHCO3+NaOH==Na2CO3+H2O反应实质:HCO3—+OH-==H2O+CO32—与H2O和CO2的反应Na2CO3+CO2+H2O==2NaHCO3CO32-+H2O+CO2==HCO3-与盐反应CaCl2+Na2CO3==CaCO3↓+2NaCl Ca2++CO32— ==CaCO3↓主要用途玻璃、造纸、制皂、洗涤发酵、医药、灭火器六、.合金:两种或两种以上的金属(或金属与非金属)熔合在一起而形成的具有金属特性的物质。
合金的特点;硬度一般比成分金属大而熔点比成分金属低,用途比纯金属要广泛。
第三章《金属及其化合物》单元练习|一、选择题:(本题包括13 小题,1-9题为只有1个选项符合题意,每小题3分,10-13题有1-2个答案,每小题4分,共43 分。
)1在实验室中,通常将金属钠保存在A.水中B.煤油中C.四氯化碳中D.汽油中2下列物质中,不属于...合金的是A . 硬铝B .黄铜C . 钢铁D .金箔 3.下列物质中既能跟稀H 2SO 4反应, 又能跟氢氧化钠溶液反应的是... ①NaHCO 3②Al 2O 3③Al(OH)3 ④Al A .③④ B .②③④ C .①③④ D .全部 4.下列关于Na 和Na +的叙述中,错误的...是 )A .它们相差一个电子层B .它们的化学性质相似C .钠原子,钠离子均为同一元素D .灼烧时,它们的焰色反应都呈黄色 5.除去Na 2CO 3 固体中少量NaHCO 3的最佳方法是A .加入适量盐酸B .加入NaOH 溶液C .加热D .配成溶液后通入CO 26.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有A .AlO 2-B .Cu 2+C .Al 3+D .Mg 2+7.少量的金属钠长期暴露在空气中,它的最终产物是 : ?A .NaOHB . Na 2CO 3•10H 2OC .Na 2CO 3D .NaHCO 38. 只用一种试剂可区别()()Na SO MgCl FeCl Al SO NH SO 2422243424、、、、五种溶液, 这种试剂是 A .Ba(OH)2 B .H 2SO 4 C .NaOH D .AgNO 39.将Fe 、Cu 、Fe 2+、Fe 3+和Cu 2+盛于同一容器中充分反应,如Fe 有剩余,则容器中只能有A .Cu 、Fe 3+B .Fe 2+、Fe 3+C .Cu 、Cu 2+、FeD .Cu 、Fe 2+、Fe 10.将Na 2O 2投入FeCl 3溶液中, 可观察到的现象是A .生成白色沉淀B .生成红褐色沉淀C .有气泡产生D .无变化 11.下列离子方程式书写正确..的是 !A .铝粉投入到NaOH 溶液中:2Al+2OH -══ 2AlO 2-+H 2↑B .AlCl 3溶液中加入足量的氨水:Al 3++ 3OH -══ Al(OH)3↓ C .三氯化铁溶液中加入铁粉:++=+232Fe Fe FeD .FeCl 2溶液跟Cl 2反应:2Fe 2++Cl 2=2Fe 3++2Cl -12.下列离子在溶液中能大量共存的是A .Fe NH SCN Cl 34++--、、、B .Na H NO SO 342++--、、、 C .Fe Fe Na NO 233+++-、、、D .Fe NH Cl OH 24++--、、、13.向MgSO 4和Al 2(SO 4)3的混合溶液中, 逐滴加入NaOH 溶液。
高一化学人教必修1第3章《金属及其化合物》章末复习提升3(完整版)

(1)A、B、C、D 代表的物质分别为________、______、 ________、________(填化学式);
(2)反应①中的 C、D 均过量,该反应的化学方程式是 ________________________________________________ ________________________;
●例题分析
【例 4】 (2013·试题调研)相同质量的下列物质分别与等
浓度的 NaOH 溶液反应,至体系中均无固体物质,消耗碱的
量最多的是( )
A.Al2O3 B.AlCl3
B.Al(OH)3 D.Al
【解析】 四种物质和 NaOH 溶液反应最终都生成 NaAlO2,相同质量时,只有 D 项中 Al 的物质的量最大,故 消耗碱量最多的是 Al。
(3)反应②中,若 B 与 F 物质的量之比为 4:3,G、H 分 别是________、________(填化学式);
(4)反应③产物中 K 的化学式为________________; (5) 反 应 ④ 的 离 子 方 程 式 为 ______________________ __________________________________________________。
(1)Fe3+Cl2、HN②O强―3、―氧K→化M剂nO4H+Fe①S、较―H弱+―、氧→F化e剂3+ Fe2+ ①Fe+S==△===FeS
Fe+2HCl===FeCl2+H2↑ ②2Fe+3Cl2=点==燃==2FeCl3
Fe+4HNO3稀 ===FeNO33+NO↑+2H2O
(2)
③常见的强氧化剂:KMnO4(H+)、HNO3、Cl2、O2 等; 2Fe2++Cl2===2Fe3++2Cl- 4Fe(OH)2+O2+2H2O===4Fe(OH)3 (颜色变化:白色―→灰绿色―→红褐色)
高一化学第三章金属及其化合物的单元总结人教实验版知识精讲

高一化学第三章金属及其化合物的单元总结人教实验版【本讲教育信息】一. 教学内容:第三章金属及其化合物的单元总结二. 重点、难点1. 对几种常见金属的化学性质进行归纳总结,掌握金属的化学性质的共性和特殊性。
2. 把本章元素化合物的知识和前两章的知识有机的结合。
三. 具体内容第三章讲述了关于金属元素的相关知识,主要有Na、Al、Fe、Cu四种元素。
本章涉及的知识点主要涉及六点:(一)钠单质及其化合物1. 钠的单质钠与氧气的反应:常温和加热两种情况钠与水反应:现象、反应、说明的问题钠和氯气、硫的反应2. 钠的化合物氧化钠和过氧化钠的性质比较碳酸钠和碳酸氢钠的性质比较(二)铝单质及其化合物1. 铝单质铝和氧气反应铝和酸反应铝和碱反应2. 铝的化合物氧化铝和氢氧化铝的两性(三)铁单质及其化合物1. 铁单质铁和水的反应2. 铁的化合物几种铁的氧化物的比较几种铁盐的比较(四)焰色反应(五)金属材料常见金属材料的性质和应用(六)有关物质的量的运算【典型例题】[例1] 等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是()A. 第一块钠失去电子多B. 两块钠失去电子一样多C. 第二块钠的反应产物质量最大D. 两块钠的反应产物质量一样大答案:B解析:掌握钠在不同条件下反应的不同和氧化还原反应的判断。
NaNO)在空气中共热的方法制取氧化钠,反应的另一[例2] 通常采用将钠与亚硝酸钠(2N,则该反应的化学方程式为_______________,该反应的氧化剂是________,被产物为2氧化的元素是____。
试说明为什么不采用钠在氧气中燃烧的方法而采用此法制取氧化钠的原因_________________。
答案:↑+==+222462N O Na Na NaNO ;亚硝酸钠;钠元素;钠在氧气中燃烧会生成过氧化钠,不能得到氧化钠。
采用亚硝酸钠与钠在空气中共热制取氧化钠时,由于反应产物中有了氮气,隔绝了生成的氧化钠与空气中氧气的接触,氧化钠不能被氧气进一步氧化,故可得到较纯的氧化钠。
化学必修一第三章金属及其化合物总结及钠铝铁专题训练全解
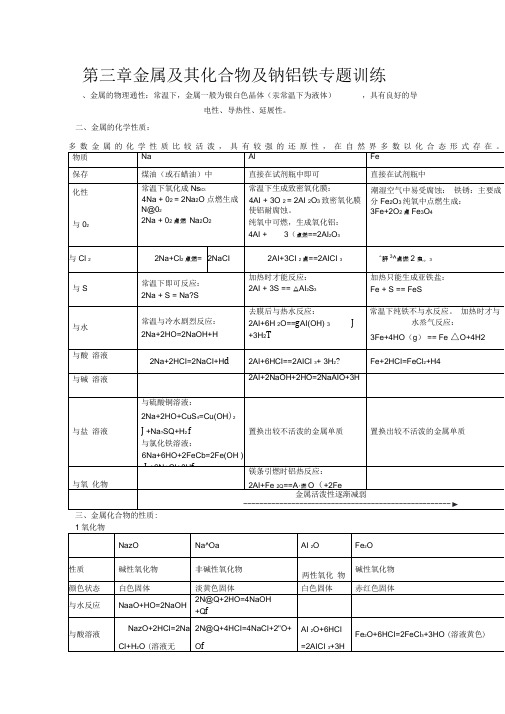
第三章金属及其化合物及钠铝铁专题训练、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。
二、金属的化学性质:三、金属化合物的性质:四、金属及其化合物之间的相互转化1铝及其重要化合物之间的转化关系,写出相应的化学反应方程式。
2、铁及其重要化合物之间的转化关系,写出相应的化学反应方程式。
3、钠及其化合物之间的相互转化,写出相应的化学反应方程式。
锂钠钾钙锶钡铜紫红色黄色紫色砖红色洋红色黄绿色蓝绿色2、碳酸钠、碳酸氢钠:NazCG又叫纯碱,俗称苏打。
无水碳酸钠是白色粉末。
NaHCO俗称小苏打,也叫酸式碳酸钠。
它是白色粉末,在水中的溶解度比碳酸钠略小,水溶液呈微碱性,固体碳酸氢钠受热即分解。
NaHCO是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。
将碳酸钠溶液或结晶碳酸钠吸收CO2可制得碳酸氢钠。
3、氧化铝、氢氧化铝(1)AI2G俗名矶土,是一种难熔又不溶于水的白色粉末。
它的熔点、沸点都高于2000 度。
(2)氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。
氢氧化铝可用来制备铝盐,作吸附剂等的原料。
氢氧化铝凝胶有中和胃酸和保护溃疡面的作用,可用于治疗胃和十二指肠溃疡、胃酸过多等。
10、合金:厂生铁:含碳崟2%-43%低碳钢(含碳量低于0.哺)素史钢金钢<含碳量:0.03 %-2 %合T 金合Y 钢垄不锈钢I镭钢硅钢鸭钢可以用于制成钢轨常用不锈钢主要合金元素含豊Cr 17-18%Ni 8-13%不易生锈附:1、焰色反应:用于在火焰上呈现特殊颜色的金属或它们的化合物的检验。
注:观察钾焰色反应时,应透过蓝色钴玻璃,以便滤去杂质钠的黄光。
中碳钢〔含碳量%a 3%-0.钠及其化合物练习题1、下列关于钠的说法不正确的是()A、金属钠与氧气反应,条件不同产物不同B、金属钠着火可用水扑灭C、少量的钠可保存在煤油中D、钠的化学性质活泼,但不可从CuS04溶液中置换出Cu2、将一小块金属钠放在石棉网上加热燃烧,下列实验现象描述正确的是()①金属钠会熔化②在空气中燃烧,产生黄色火花③燃烧后生成白色固体④燃烧火焰为黄色⑤燃烧后生成淡黄色粉末状物质A、①②B、①②③C、①④D、①④⑤3、金属钠长期放置于空气中,最后应变为()A、N a20 B Na202 C Na0H D Na2C034、为维持人体内体液浓度平衡,人在大量出汗后应及时补充的离子是()2+2++3+A. MgB. CaC. NaD. Fe5、下列关于金属钠的叙述中,说法正确的是()A、金属钠可以保存在少量水中B、钠在空气中燃烧,产物是Na20C、钠是银白色金属,硬度大,熔点高D、.Na、K合金可作原子反应堆的导热剂6、下列金属单质中,能从CuS0 4溶液中置换出铜的是()A、汞B、银C、钠D、铁7、下列实验操作正确的是()A、向盛水的烧杯中投入黄豆粒大小的钠块,观察现象B、将钠保存在汽油中C、将一小块钠放在试管中加热,观察现象D、用手掰开一块金属钠,观察钠的颜色。
超详细人教版必修一化学第三章金属及其化合物化学方程式总结

第三章 金属及其化合物方程式总结---------- 加粗的是对应的离子方程式1.金属钠的化学性质:钠露置空气中变暗: 4Na+O 2=2Na 2O(白色 )钠的焚烧: 2Na+O 2 Na 2O 2(淡黄色 )反响条件不一样,产物不一样钠投入水中: 2Na+2H 2O=2NaOH+H 2 ↑–2Na+2H 2O=2Na ++2OH +H 2↑(现象:浮、融、游、响、红)钠与盐酸( 先酸后水 ): 2Na+ 2HCl===2NaCl+H2↑2Na+ 2H +===2Na + +H 2↑钠与硫酸铜溶液( 先水后盐 ): 2Na+2H 2424 2 2O+CuSO =Na SO +Cu(OH)↓ +H ↑(总式)2Na+2H 2O=2NaOH+H 2↑2NaOH+CuSO 4=Cu(OH) 2↓+Na 2SO 42.氧化钠的化学性质:氧化钠与水: Na 2O+H 2 O=2NaOHNa 2 O+H 2O=2Na ++2OH –氧化钠与二氧化碳: Na 2O+CO 2=Na 2CO 3氧化钠与盐酸: Na 2O+2HCl=2NaCl+H 2 ONa 2O+2H +=2Na + +H 2O3.过氧化钠的化学性质(漂白性、强氧化性):过氧化钠与水: 2Na 2 O 2+2H 2O=4NaOH+O 2↑2Na 2O 2+2H 2 O=4Na +–+4OH +O 2过氧化钠与二氧化碳: 2Na 2O 2+2CO 2=2Na 2CO 3+O 24.碳酸钠与碳酸氢钠的化学性质: 溶解性的的比较: Na 2CO 3> NaHCO 3碱性的比较: Na 2CO 3> NaHCO 3热稳固性的比较: Na 2CO 3> NaHCO 3碳酸氢钠受热分解: 2NaHCO 323 22↑Na CO +H O+CO碳酸钠与酸的反响: Na 2 33CO 32 – += HCO 3-CO +HCl =NaCl+ NaHCO+ HNa 2CO 3+2HCl =2NaCl+H 2O+CO 2 ↑CO 3 2– + =CO 2↑ +H 2O+ 2H碳酸氢钠与酸的反响: NaHCO 3+HCl=NaCl+H 2O+CO 2↑HCO 3 -+H +=CO 2↑ +H 2O碳酸钠变换成碳酸氢钠(Na 2 CO 3→ NaHCO 3):通入 CO 2 :Na 2 CO 3 +H 2O+CO 2=2NaHCO 32 – 2O+CO 2 =2HCO-CO 3 +H 3加入适当稀盐酸: Na 2CO 3+HCl =NaCl+ NaHCO 32– += HCO -CO 3 + H 3碳酸氢钠变换成碳酸钠( NaHCO 3→ Na 2CO 3):碳酸氢钠受热分解: 2NaHCO3 23 2 23最正确方法)Na CO +H O+CO↑(除掉 NaHCO加入适当氢氧化钠:NaHCO 3 +NaOH= Na 2CO 3+H 2OHCO- -2–3 +OH =CO 3 +H 2O5.金属铝的化学性质:铝在空气中 常温或加热条件 下都生成致密的氧化膜: 4Al+3O 2=2Al 2O 3铝与稀盐酸的反响: 2Al+6HCl===2AlCl3+3H 2↑2Al+6H +=2Al 3++3H 2 ↑ 铝与氢氧化钠的反响: 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑2Al+2OH––+2H 2O=2AlO 2 +3H 2↑注意: 1.等质量的或等物质的量的铝与足量稀盐酸或氢氧化钠反响产生的氢气的量是相等的2.反响刚开始比较慢,是由于铝表面致密的氧化膜(Al 2 O 3)3.由于铝既可与盐酸反响又可与氢氧化钠反响生成盐和氢气,因此我们说Al 是两性金属。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章金属及其化合物及钠铝铁专题训练一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。
二、金属的化学性质:多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。
四、金属及其化合物之间的相互转化1、铝及其重要化合物之间的转化关系,写出相应的化学反应方程式。
2、铁及其重要化合物之间的转化关系,写出相应的化学反应方程式。
3、钠及其化合物之间的相互转化,写出相应的化学反应方程式。
注:观察钾焰色反应时,应透过蓝色钴玻璃,以便滤去杂质钠的黄光。
2、碳酸钠、碳酸氢钠:Na2CO3又叫纯碱,俗称苏打。
无水碳酸钠是白色粉末。
NaHCO3俗称小苏打,也叫酸式碳酸钠。
它是白色粉末,在水中的溶解度比碳酸钠略小,水溶液呈微碱性,固体碳酸氢钠受热即分解。
NaHCO3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。
将碳酸钠溶液或结晶碳酸钠吸收CO2可制得碳酸氢钠。
3、氧化铝、氢氧化铝(1)Al2O3俗名矾土,是一种难熔又不溶于水的白色粉末。
它的熔点、沸点都高于2000度。
(2)氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。
氢氧化铝可用来制备铝盐,作吸附剂等的原料。
氢氧化铝凝胶有中和胃酸和保护溃疡面的作用,可用于治疗胃和十二指肠溃疡、胃酸过多等。
10、合金:钠及其化合物练习题1、下列关于钠的说法不正确的是()A、金属钠与氧气反应,条件不同产物不同B、金属钠着火可用水扑灭C、少量的钠可保存在煤油中D、钠的化学性质活泼,但不可从CuSO4溶液中置换出Cu2、将一小块金属钠放在石棉网上加热燃烧,下列实验现象描述正确的是()①金属钠会熔化②在空气中燃烧,产生黄色火花③燃烧后生成白色固体④燃烧火焰为黄色⑤燃烧后生成淡黄色粉末状物质A、①②B、①②③C、①④D、①④⑤3、金属钠长期放置于空气中,最后应变为()A、Na2O B Na2O2 C NaOH D Na2CO34、为维持人体内体液浓度平衡,人在大量出汗后应及时补充的离子是()A. Mg2+B. Ca2+C. Na+D. Fe3+5、下列关于金属钠的叙述中,说法正确的是()A、金属钠可以保存在少量水中B、钠在空气中燃烧,产物是Na2OC、钠是银白色金属,硬度大,熔点高D、.Na、K合金可作原子反应堆的导热剂6、下列金属单质中,能从CuSO4溶液中置换出铜的是()A、汞B、银C、钠D、铁7、下列实验操作正确的是()A、向盛水的烧杯中投入黄豆粒大小的钠块,观察现象B、将钠保存在汽油中C、将一小块钠放在试管中加热,观察现象D、用手掰开一块金属钠,观察钠的颜色。
8、将少量金属钠放入盛有CuSO4溶液的烧杯中,剧烈反应,有蓝色沉淀及无色气体产生。
则烧杯中发生的反应是( )①2Na+CuSO4 = Na2SO4+Cu;②Cu+2H2O = Cu(OH)2↓+H2↑;③2Na+H2O = 2NaOH+H2↑;④2NaOH+CuSO4 = Cu(OH)2↓+Na2SO4A. ①B. ①②C. ③④D. ①③9、将金属钠投入到硫酸铜溶液中,产物是()A.NaOH和H2 B.Cu(OH)2、Na2SO4、 H2C.Cu和 Na2SO4 D.H2SO4、 Cu(OH)2、、 Na2SO410、下列六种物质:①Na 2O ②Na2O22CO3溶液⑤NaOH ⑥NaHCO3,其中不能与CO2反应的是 ( )A.①④B.②③C.③⑥D.⑤⑥11、下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是 ( )A. Na和O2B. NaOH和CO2C. Na2O2和CO2D. C和O212、金属钠着火,能用来灭火的是()A、水B、湿抹布C、泡沫灭火器D、干沙13、将2.3克钠放入100克水中,生成的溶液中溶质的质量分数为( )A、等于2.3%B、等于4%C、大于2.3%小于4%D、大于4%14、把少量的金属钠分别放入下列溶液中,写出相应反应的化学方程式。
(1)钠放入NaOH溶液中(2)钠放入稀盐酸中(3)钠放入CuSO4溶液中(4)过氧化钠与CO2反应(5)过氧化钠与水反应答案:1、B 2、D 3、D 4、C 5、D 6、D 7、A 8、C 9、B 10、C 11、C 12、D 13、C14、(1)2Na + 2H2O = 2NaOH + H2↑(2)2Na + HCl = 2NaCl + H2↑(3)2Na + 2H2O + CuSO4 = Na2SO4 + Cu(OH)2↓+ H2↑(4)2Na2O2 + 2H2O = 4NaOH + O2↑铝及其化合物练习题一、选择题1.欲迅速除去水壶底部的水垢,又不损坏铝壶,最好的方法是用( )A.浓盐酸B.稀硝酸C.冷的浓硫酸D.冷的浓硝酸2.1989年世界卫生组织把铝确定为食品污染源之一,加以控制使用,铝在下列应用时应加以控制的是()。
①制铝合金;②制电线;③制炊具;④明矾净水;⑤明矾和苏打制食品膨松剂;⑥用氢氧化铝凝胶制胃舒平药品;⑦银色漆颜料;⑧制易拉罐⑨包装糖果和小食品。
A.全部B.③⑤⑧⑨C.⑥⑧⑨D.③④⑤⑥⑧⑨3.将溶液(或气体)X ,逐渐加入(或通入)到一定量的Y 溶液中,产生沉淀的量与加入X 物质的量的关系如下图,符合图中情况的一组物质是( )。
43..A .Al(OH)3与过量的浓氨水反应生成NH 4AlO 2B .Al(OH)3是难溶于水的白色胶状物质C .Al(OH)3能凝聚水中的悬浮物,还能吸附色素D .Al(OH)3受热能分解5.取一块用砂纸打磨过的铝箔在空气中加热至熔化,下列说法中不正确...的是( )。
A .铝失去了光泽 B .剧烈燃烧,火星四射C .熔化的铝不滴落D .在加热熔化过程中生成了氧化铝 6.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能共存的是( )。
A .NH +4、NO -3、CO2-3、Na +B .Na +、Ba 2+、Mg 2+、HCO -3C .NO -3、Ba 2+、K +、Cl -D .NO -3、K +、AlO -2、OH -7.工业上用铝土矿(主要成分为Al 2O 3,含Fe 2O 3杂质)为原料冶炼铝的工艺流程如下:下列叙述正确的是( )A .反应②的化学方程式为NaAlO 2+CO 2+2H 2O =Al(OH)3↓+NaHCO 3B .反应①、过滤后所得沉淀为氢氧化铁C .图中所示转化反应都不是氧化还原反应D .试剂X 可以是氢氧化钠溶液,也可以是盐酸8.[2012·安徽理综化学卷13]已知室温下,Al(OH)3的KSP 或溶解度远大于Fe(OH)3。
向浓度均为0.1 m o l /L 的Fe(NO 3)3和Al(NO 3)3混合溶液中,逐滴加入NaOH 溶液。
下图中表示生成Al(OH)3的物质的量与加入NaOH 溶液的体积的关系 合理的是 (9mol·L-1AlCl3溶液,两烧杯中都有沉淀生成。
下列判断正确的是 ( )A.甲中沉淀一定比乙中的多B.甲中沉淀可能比乙中的多C.甲中沉淀一定比乙中的少D.甲中和乙中的沉淀一样多10.某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显变化; (2)继续滴加NaOH溶液,有白色沉淀;(3)滴入过量的氢氧化钠,白色沉淀明显减少。
实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。
下列说法错误的是( )A.该未知溶液中至少含有3种阳离子B.滴加的NaOH溶液的物质的量浓度为5 mol·L-1C.若另一种离子为二价阳离子,则a=10D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g11.有一镁铝合金,根据某同学的操作,回答下列问题:(1)将合金与过量NaOH溶液反应,所得溶液中不存在的离子是________。
A.Na+B.Mg2+C.OH-D.AlO-2(2)将合金溶于过量的盐酸中,充分反应后,溶液中新生成的离子是________;再加入过量的NaOH溶液,反应后溶液中新生成的离子是______________,减少的金属离子是____________。
12.某无色透明溶液,其中的溶质只能由H+、Ba2+、Mg2+、OH-、SO2-3、Cl-、CO2-3、NO-3中的若干种组成,它能与铝作用,且生成的气体中只有氢气,请填写以下空白:(1)若原溶液呈明显的酸性,则除H+外,溶液中还可能大量存在的离子有________________。
(2)若原溶液呈明显的碱性,则除OH-外,溶液中还可能大量存在的离子有________________。
13. 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的一种或几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。
回答下列问题:(1)溶液中一定含有的溶质是,一定不含有的溶质是(填化学式)。
(2)溶液中可能含有的溶质是_______________________(填名称),判断该物质是否存在的实验方法是,现象是。
(3)分别写出AB段、BC段发生反应的离子方程式:①AB段为;BC段为。
14、工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)设计了如下方案:请回答相关问题:(1)写出合金溶于足量烧碱溶液时相关反应的离子方程式:;写出途径Ⅰ中相关反应的离子方程式: 。
(2)由滤液A得AlCl3溶液的途径有Ⅰ和Ⅱ两种,你认为合理的是途径(填”Ⅰ”或”Ⅱ”),理由是。
(3)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,写出稀硫酸和H2O2溶解滤渣D的离子方程式。
(4)如何在实验室从滤液C中获得绿矾晶体(写出主要的实验操作名称) 。
铝及其化合物答案1-5DDBAB 6-10CACBD11.(1)B (2)Mg 2+、Al 3+ AlO -2 Mg 2+、Al 3+12.(1)Cl -、Ba 2+、Mg 2+ (2)Ba 2+、Cl -、NO -3解析:Al 在强酸溶液和强碱溶液中皆可反应产生H 2:2Al +6H +===2Al 3++3H 2↑,2Al +2OH -+2H 2O===2AlO -2+3H 2↑。
原溶液呈酸性时,则能与H +反应的OH -、SO 2-3、CO 2-3都不能存在,若NO -3存在,其在酸性条件下被还原产生氮的氧化物气体,与题设只生成H 2相抵触,所以NO -3也不能存在。
