高一化学诗歌知识点复习卤族元素及其化合物
高中化学卤素及其化合物

2、卤素的物理性质
思考讨论
• Q:溴有剧毒,易挥发,实验室应该如何保 存液溴? • A:棕色玻璃瓶避光保存,并水封。 Q:碘无毒,易升华,实验室应该如何保存 碘? • A:棕色广口瓶,阴暗处密封保存。
元素 名称
元素 核电 单 符号 荷数 质
颜色和 状态
密度
熔点 °C
沸点 °C
溶解度 100g水
氟 氯 溴
4、卤素的化学性质
其中碘与氢气的反应比较特殊,在碘和 氢气生成碘化氢的同时,碘化氢不稳定 发生分解,生成氢气和碘单质,这样的 反应叫可逆反应。
2)卤素与水的反应
4、卤素的化学性质
名称
F2 Cl2 Br2 I2 发生剧烈反应
方程式
2H2O+2F2====4HF+O 2
常温下就能进行(可逆) H2O +Cl2==HCl+HClO (可逆) 微弱的进行反应 H2O+Br2===HBr+ HBrO
拓展:拟卤素
• 它们的化学性质与卤素相近,表现出单质 的氧化性,但为化合物 • 包括(CN)2氰、(OCN)2氧氰、 (SCN)2硫 氰等 • 能形成类似卤离子的-1价阴离子。 • 氢化物的水溶液都是弱酸 • 与碱作用发生歧化反应 • 与硝酸银反应生成银白色或白色的沉淀
0.029g
2、卤素的物理性质
在自然界以化合态的形式存在;单质由人工 制得。 氟F 氯 Cl 溴 Br 碘I 砹 At
2、卤素的物理性质 熔沸点逐渐升高的原因 原子半径增大→分子大→ 分子间可接触面积大→相互 作用力(吸引力)强→不易 拆分→熔沸点高
3、卤素的原子结构
核电荷数逐渐 卤族元素的原子的最外 结构 增多 层电子数均为7 结构具有渐变性 电子层数逐渐 增多 都易得 1个电子成为 -
(完整版)高中化学卤族元素知识点归纳

卤族元素[卤族元素]简称卤素.包括氟(F)、氯(C1)、溴(Br)、碘(I)和放射性元素砹(At).在自然界中卤素无游离态,都是以化合态的形式存在(1)位置:VIIA(2)原子结构:相同点:最外层电子数均为7不同点:F I电子层数逐渐增多,原子半径逐渐增大。
(3)相似性:①单质均为双原子非极性分子②主要化合价为 -1价,最高正价为+7价(F除外)③都具有强氧化性[卤素单质的物理性质]说明 (1)实验室里,通常在盛溴的试剂瓶中加水(即“水封”),以减少溴的挥发.(2)固态物质不经液态而直接变成气态的现象,叫做升华.升华是一种物理变化.利用碘易升华的性质,可用来分离、提纯单质碘.(3)Br2、I2较难溶于水而易溶于如汽油、苯、四氯化碳、酒精等有机溶剂中.医疗上用的碘酒,就是碘(溶质)的酒精(溶剂)溶液.利用与水互不相溶的有机溶剂可将Br2、I2从溴水、碘水中提取出来(这个过程叫做萃取).[卤素单质的化学性质](1)卤素的原子结构及元素性质的相似性、递变性.(2)卤素单质与氢气的反应.F 2 Cl 2 Br 2 I 2 与H 2化合的条件冷、暗 点燃或光照 500℃ 持续加热 反应情况 爆炸强光照射时爆炸缓慢化合缓慢化合,生成的HI 同时分解产生卤化氢 的稳定性HF >HCl >HBr >HIH 2 + F 2 = 2HF (冷暗处爆炸) H 2 +Cl 2 = 2HCl (光照爆炸,点燃) H 2 +Br 22HBr H 2 +I 22HI 长期加热并不断分解卤化氢:易溶于水,在空气中形成白雾。
①HCl<HBr<HI<HF 熔沸点依次升高(HF 中存在氢键)②溶于水都是酸,除氢氟酸是弱酸外,其余均为强酸,且从HF 到HI 酸性逐渐增强 ③HCl 、HBr 、HI 有还原性,从HClHI 还原性逐渐增强④HF:弱酸,剧毒,能腐蚀玻璃,分子中存在氢键使熔沸点显著升高。
保存于铅皿或塑 (3)卤素单质与水的反应.①2F 2 + 2H 2O =4HF + O 2(置换反应) 氧化性:F 2>O 2注意:将F 2通入某物质的水溶液中,F 2先跟H 2O 反应.如将F 2通入NaCl 的水溶液中,同样发生上述反应,等等. ②X 2 + H 2OHX + HXO (X=Cl 、Br 、I )Cl 2 、Br 2、I 2与H 2O 的反应逐渐减弱,都是可逆反应。
卤族元素及其化合物的特殊性

卤族元素及其化合物的特殊性卤族元素是指周期表中第17族元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和翩(At)。
这些元素在自然界中以化合物的形式存在,常见的化合物有氯化钠(NaCl)、氟化钙(CaF2)等。
卤族元素及其化合物具有一些特殊性质,下面将详细介绍。
1.氟(F)是卤族元素中最具活性的元素,它具有强氧化性和高反应活性。
氟化物通常是不溶于水的固体,但与许多金属形成可溶的氟化物,如氟化钠(NaF)。
氟化过程通常是剧烈的,甚至爆炸性的。
2.氯(Cl)是卤族元素中最常见的元素,在常温下是一种有刺激性气味的黄绿色气体。
氯气具有强烈的漂白作用,常用于漂白剂和消毒剂的制备。
氯气也与许多元素和化合物反应,如与氢气反应生成氯化氢(HCl)。
3.溴(Br)是一种深红色液体,在常温下呈现出挥发性和有刺激性的臭味。
溴是一种重要的消毒剂和阻燃剂,常用于制备药物和染料。
溴的反应活性较氟和氯要低,但它仍然与一些金属和非金属反应生成溴化物。
4.碘(I)是一种具有紫黑色的固体,在室温下为挥发性的晶体。
碘通常具有较低的反应活性,但也能与一些金属反应生成碘化物。
碘还具有强烈的染色性,在医学和化学实验中广泛用作染色剂。
5.翩(At)是一种放射性元素,目前仅在实验室中通过人工合成的方式进行研究。
由于其放射性和不稳定性,翩的性质仍然相对不明确。
1.都是强氧化剂:卤族元素能够接受一个或多个电子,从而形成负离子,具有强氧化性质。
这使得它们在许多化学反应中能够作为氧化剂参与,从而引发许多重要的化学反应。
2.都具有较高的电负性:卤族元素在周期表中处于第17组,具有较高的电负性。
这使得它们能够与金属形成离子化合物,如氯化钠和溴化钠等。
这种离子化合物通常具有较高的溶解度和电导率。
3.都是强酸的氢卤酸:氟、氯、溴、碘和翩与氢反应生成氢卤酸,即氢氟酸(HF)、氢氯酸(HCl)、氢溴酸(HBr)和氢碘酸(HI)。
这些酸都是强酸,能够与金属反应生成相应的盐。
卤族元素知识点总结

卤族元素知识点总结卤族元素是周期表中第七族的元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
这些元素在化学性质上有一些共同的特点,同时也存在一些差异。
下面我们来总结一下卤族元素的一些重要知识点。
首先,卤族元素的原子结构特点。
卤族元素的原子结构都具有七个价电子,因此它们在化合物中通常以单负离子的形式存在。
这也使得卤族元素在化学反应中具有一定的活性,特别是氟元素,由于其电子云的吸引力较大,因此具有很强的化学活性。
其次,卤族元素的化合价和化合物特点。
卤族元素的化合价一般为-1,但在一些化合物中也可以表现出其他化合价,如氯元素在氧化亚氯中的化合价为+1。
卤族元素与金属的化合物通常为离子化合物,而与非金属的化合物则为共价化合物。
此外,卤族元素的化合物在溶液中常呈现出颜色,如氯离子溶液呈现黄绿色,溴离子溶液呈现橙黄色,碘离子溶液呈现紫色。
再者,卤族元素的化学反应特点。
卤族元素在化学反应中常表现出活泼的性质,如氯元素能与氢气发生剧烈的反应,生成氯化氢气体。
此外,卤族元素还能与氢氧化物反应生成卤化物,如氯元素与氢氧化钠反应生成氯化钠和水。
卤族元素还能与氧气反应生成卤氧化物,如氯元素与氧气反应生成氯氧化物。
最后,卤族元素的应用。
卤族元素在生活和工业中有着广泛的应用,如氯元素被广泛用于消毒,制取氯化铝等化工产品。
氟元素被用于制取氟化氢和氟化铝等化工原料。
此外,卤族元素还被用于医药、农业等领域。
综上所述,卤族元素在化学性质上有着一些共同的特点,但也存在一些差异。
通过对卤族元素的了解,可以更好地理解它们在化学反应和应用中的特点,为我们的生活和工业生产提供更多的可能性。
高一化学教案-卤族元素复习

高一化学教案-卤族元素复习一、知识目标1. 复习卤族元素的性质、化合物及反应。
2. 掌握卤族元素的周期规律。
3. 深入理解卤素中性子数的变化与元素性质的关系。
二、能力目标1. 能够将卤族元素的性质、化合物及反应用适当的方式进行描述。
2. 能够根据周期规律解释卤族元素的性质和变化。
3. 能够根据化学式及卤素中性子数进行卤素化合物的命名。
三、情感目标1. 能够感受到卤族元素作为化学元素之一和我们生活息息相关的重要性。
2. 能够培养对自然界中元素物质的关注和探究精神。
四、教学重点1. 卤族元素的周期规律。
2. 卤素化合物的命名与反应。
五、教学难点1. 卤族元素的中性子数变化与元素性质的关系。
2. 多卤化物的合成及反应。
六、教学方法1. 讲授法(重点讲解卤族元素的周期规律及常见卤素化合物的反应)。
2. 案例分析法(通过实际的例子来深入学习卤族元素)。
3. 实验法(对卤族化合物的一些反应进行实验,加深学生的理解)。
七、教学过程1.引入通过一些生活中与卤素相关的实例,如盐、漂白粉、氯气等,来引入本堂课。
2.讲解(1)周期规律通过讲解周期表中卤族元素的状态、原子半径、电子亲和能、电负性等周期规律,帮助学生更好地理解卤族元素之间的相似性和变化规律。
(2)卤素化合物的反应通过讲解常见卤素化合物的化学性质及反应,如氯水的制法、卤化银的沉淀、氢氧化钠与溴水的反应、氢氧化钠与碘的反应等,帮助学生掌握卤素化合物的基本反应。
(3)实验演示进行一些相关的化学实验,如将氯水滴入溶液中观察沉淀、加入全氟辛酸钠后与二氧化锰接触观察等,让学生亲自操作,感受卤族元素的性质和实验操作的实际情况。
3.巩固通过总结、思考和复习,巩固本堂课所学的知识,判断或拼写卤素化合物的名称、化学式等来检查学生的学习情况。
4.拓展通过讲解一些常见的应用,如卤素灯等,让学生更好地认识卤族元素在人类生活中的应用。
五、教学反思本节课是对卤族元素的一个复习,通过掌握周期规律、化合物的命名和反应,以及实验演示等方面,让学生更加全面地掌握卤族元素的性质和变化规律。
关于卤族的知识点总结

关于卤族的知识点总结一、卤族元素的特点卤族元素是位于周期表第17族的一些元素,它们在元素周期表中的位置如下图所示:氟(F)氯(Cl)溴(Br)碘(I)石碱金属锗(At)卤族元素具有一些明显的特点:1. 电子结构:卤族元素中所有元素的电子结构都具有7个价电子,因此它们通常会与金属原子中的一个或几个电子形成化学键。
2. 氧化态:卤族元素的最高氧化态是-1,这是由于它们的7个价电子使得它们愿意接受一个电子,形成-1氧化态。
3. 化合物:卤族元素可以形成各种化合物,包括单质、氟化物、氯化物、溴化物、碘化物等。
4. 水合物和酸:卤族元素可以形成水合物和酸,例如氯化铁、溴化钠、碘化钾等。
5. 卤素反应:卤族元素在酸性条件下可以参与单质之间的置换反应,例如氯气和溴水可以把碘离子还原成碘单质。
二、卤族元素的性质卤族元素的性质主要包括物理性质和化学性质。
1. 物理性质卤族元素是非金属元素,它们的物理性质包括:- 气体态:氟和氯是气体,溴是液体,碘是固体。
- 颜色:氟和氯是无色气体,溴是红褐色液体,碘是紫色固体。
- 密度:氟和氯的密度较小,溴和碘的密度较大。
- 溶解性:卤族元素在水中的溶解度逐渐增加。
2. 化学性质卤族元素的化学性质包括:- 氧化还原性:卤族元素具有一定的氧化还原性,它们的氧化态主要为-1,可参与氧化还原反应形成复合离子。
- 与金属的反应:卤族元素能与金属反应,形成氯化物、溴化物等化合物。
- 卤素反应:卤族元素之间可以进行单质之间的置换反应,生成不同的卤素化合物。
三、卤族元素的应用卤族元素在工业生产、科学实验和日常生活中有广泛的应用。
1. 工业生产:氯和溴可用于脱色和消毒,例如漂白纸张、消毒水等。
氟用于制备氟化物,如氟碳化合物等,用于冶金、化肥、药品、无机化工和有机化工等行业。
2. 科学实验:卤族元素可用于实验室合成化合物,用于教学和科学研究。
3. 医药和保健:碘可以用于制备碘酊、碘盐等药物,用于医疗和保健。
卤族元素知识点详细总结

卤族元素知识点详细总结卤族元素性质本文主要介绍卤族元素的性质,包括氯气、卤化银等的物理性质和化学性质,以及变化规律和相关知识点。
重点考查卤素性质的变化规律。
氯气氯气是一种黄绿色气体,在常温下可溶于水。
氯气有毒并具有强烈的刺激性,吸入过量会中毒死亡。
因此,实验室闻氯气气味的正确方法为:用手在瓶口轻轻扇动,仅使少量的氯气飘进鼻孔。
氯原子在化学反应中很容易获得1个电子,因此氯气是一种强氧化剂。
氯气与金属反应时呈现高价态,如铜在氯气中燃烧会产生棕黄色的烟,而钠在氯气中燃烧则会产生白烟。
在常温、常压下,干燥的氯气不能与铁发生反应,故可用钢瓶储存、运输液氯。
氢气与氯气反应生成的HCl气体具有刺激性气味,极易溶于水。
HCl的水溶液叫氢氯酸,俗称盐酸。
卤化银卤化银是卤族元素的化合物之一,具有不同的颜色和溶解度。
氯化银是白色晶体,溶于氨水生成深蓝色的银铵离子;溴化银是淡黄色晶体,溶于氨水生成黄色的银铵离子;碘化银是黄色晶体,溶于氨水生成红棕色的银铵离子。
卤化银在摄影、药品制造等方面有广泛的用途。
碘与人体健康碘是人体必需的微量元素之一,对人体健康有重要的影响。
碘缺乏会导致甲状腺肿大、免疫力下降等疾病,严重时可能导致克汀病。
因此,应保证摄入足够的碘,但过量摄入也会有负面影响。
CaCO3Cl2O2⑤氯气与碱溶液反应生成的次氯酸盐具有漂白作用,因此常用于漂白纸浆和纺织品。
同时,次氯酸盐还具有杀菌消毒的作用,因此也常用于净化水和消毒。
需要注意的是,次氯酸盐相对于次氯酸更加稳定。
⑥漂粉精和漂白粉的有效成分是Ca(C1O)2其制备过程中需要用到氯气与碱溶液的反应。
此外,漂粉精和漂白粉在使用时通常需要与其他酸反应,以释放出次氯酸盐的漂白作用。
另外,漂粉精和漂白粉的保存也需要注意,避免其露置于潮湿的空气中导致变质。
最后,氯气与碱溶液反应生成的金属氯化物和次氯酸盐都具有漂白和消毒作用,因此在工业和生活中有着广泛的应用。
H2O + CaCO3 → Ca2+ + 2HCO3-2HClO → 2H+ + 2Cl- + O2↑2HCl + O2↑从上述反应可以看出,漂粉精和漂白粉也具有漂白、消毒作用。
卤族元素的知识点详细

卤族元素性质复习重点1。
卤素单质在物理性质和化学性质上的主要差异及递变规律;2。
卤族元素的化合物性质的递变性;3。
卤化银的性质、用途及碘与人体健康的关系。
4。
重点考查卤素性质的变化规律。
1。
氯气[氯气的物理性质](1)常温下,氯气为黄绿色气体。
加压或降温后液化为液氯,进一步加压或降温则变成固态氯。
(2)常温下,氯气可溶于水(1体积水溶解2体积氯气)。
(3)氯气有毒并具有强烈的刺激性,吸入少量会引起胸部疼痛和咳嗽,吸入大量则会中毒死亡。
因此,实验室闻氯气气味的正确方法为:用手在瓶口轻轻扇动,仅使少量的氯气飘进鼻孔。
[氯气的化学性质]氯原子在化学反应中很容易获得1个电子。
所以,氯气的化学性质非常活泼,是一种强氧化剂。
(1)与金属反应:Cu + C12CuCl2实验现象:铜在氯气中剧烈燃烧,集气瓶中充满了棕黄色的烟。
一段时间后,集气瓶内壁附着有棕黄色的固体粉末。
向集气瓶内加入少量蒸馏水,棕黄色固体粉末溶解并形成绿色溶液,继续加水,溶液变成蓝色。
2Na + Cl22NaCl 实验现象:有白烟产生。
说明:①在点燃或灼热的条件下,金属都能与氯气反应生成相应的金属氯化物。
其中,变价金属如(Cu、Fe)与氯气反应时呈现高价态(分别生成CuCl2、FeCl3)。
②在常温、常压下,干燥的氯气不能与铁发生反应,故可用钢瓶储存、运输液氯。
③“烟”是固体小颗粒分散到空气中形成的物质。
如铜在氯气中燃烧,产生的棕黄色的烟为CuCl2晶体小颗粒;钠在氯气中燃烧,产生的白烟为NaCl晶体小颗粒;等等。
(2)与氢气反应。
H2 + Cl22HCl注意:①在不同的条件下,H2与C12均可发生反应,但反应条件不同,反应的现象也不同。
点燃时,纯净的H2能在C12中安静地燃烧,发出苍白色的火焰,反应产生的气体在空气中形成白雾并有小液滴出现;在强光照射下,H2与C12的混合气体发生爆炸。
②物质的燃烧不一定要有氧气参加。
任何发光、发热的剧烈的化学反应,都属于燃烧。
高三化学 卤族元素复习 知识精讲 人教版
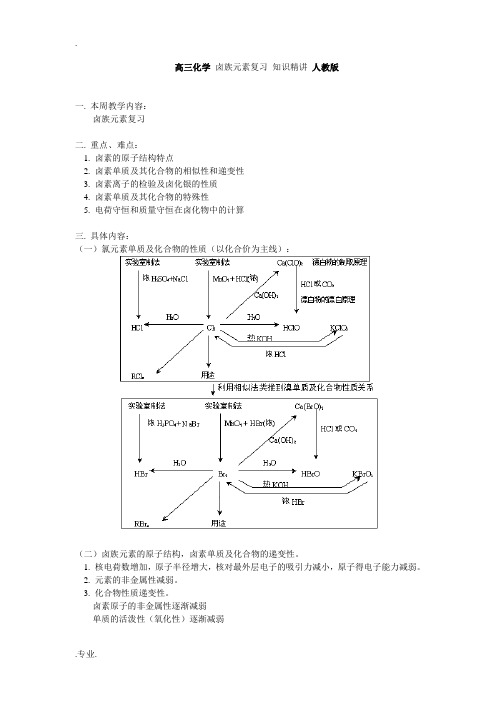
高三化学卤族元素复习知识精讲人教版一. 本周教学内容:卤族元素复习二. 重点、难点:1. 卤素的原子结构特点2. 卤素单质及其化合物的相似性和递变性3. 卤素离子的检验及卤化银的性质4. 卤素单质及其化合物的特殊性5. 电荷守恒和质量守恒在卤化物中的计算三. 具体内容:(一)氯元素单质及化合物的性质(以化合价为主线):(二)卤族元素的原子结构,卤素单质及化合物的递变性。
1. 核电荷数增加,原子半径增大,核对最外层电子的吸引力减小,原子得电子能力减弱。
2. 元素的非金属性减弱。
3. 化合物性质递变性。
卤素原子的非金属性逐渐减弱单质的活泼性(氧化性)逐渐减弱实验事实 ⎩⎨⎧单质间的相互置换化合的难易程度与.2.12H(三)卤素单质的共性和特性1. 卤素常见的化合价有1-、+1、+3、+5、+7 几种,但F 只有1-价,并无正价,因为F 是最活泼的非金属。
2 卤素的单质都能跟水反应,常温一般生成HX 和HXO ,但F 2跟H 2O 反应生成HF 和O 2。
3. 卤素单质一般不跟稀有气体起反应,但氟却能跟跟氙、氪等起反应,生成氟化物。
4. 卤素单质一般不跟淀粉发生显色反应,但碘遇淀粉变蓝色,这是碘的特性。
5. 卤化氢都极易溶于水,形成对应HX 溶液,且酸性按HF 、HCl 、HBr 、HI 的顺序依次增强,其中HCl 、HBr 、HI 均是一元强酸,但HF 的稀溶液却是一种弱酸。
6. 卤族元素中的Cl 、Br 、I 的含氧酸有HXO 、HXO 2 、HXO 3、 HXO 4,但F 却没有对应的含氧酸。
7. 卤化银一般是难溶的物质 ,且溶解性按AgF →AgI 的顺序依次减小,但唯有AgF 是易溶于水的;CaCl 2、CaBr 2、CaI 2都能溶于水,但唯有CaF 2难溶。
(四)用氧化还原反应的理论加深对卤素单质及化合物性质的理解1. 对卤素单质间的置换以及卤素与单质Fe 反应后铁的价态问题:一般情况下,有氧化性强弱关系:氧化态 F 2 > Cl 2 > Br 2 > Fe 3+ > I 2 > Fe 2+还原态 F - Cl - Br - Fe 2+ I -Fe由此可见:F 2、Cl 2、Br 2均能将Fe 2+ 氧化成Fe 3+,而I 2则不能氧化Fe 2+。
高中化学基础知识滚动记忆10卤族元素

非金属及其化合物第4节卤素一、Cl21.Cl为17号元素,,Cl2的结构式为Cl-Cl,电子式为。
2. Cl2是黄绿色、有刺激性气味的有毒气体,能溶于水(通常条件下在水中的溶解度为1︰2),易液化(沸点为-34.6℃)。
3.化学性质:①能和除Au、Pt外的大多数金属直接化合,和Fe、Cu化合时分别生成高价的FeCl3、CuCl2。
2Na+Cl22NaCl,黄色火焰,白烟;2Fe+3Cl22FeCl3,无火焰,铁丝保持红热,棕色的烟,溶于水得黄色溶液;Cu+Cl2CuCl2,无火焰,铜丝保持红热,棕黄色的烟,溶于水得绿色溶液(较浓,主要存在形式为CuCl42-)或蓝色溶液(较稀,主要存在形式为Cu(H2O)42+)。
②能和H2、S、P、Si等非金属化合。
H2+ Cl22HCl或H2+ Cl22HCl,H2在Cl2中可安静燃烧,火焰为苍白色,集气瓶口有白雾生成;S+Cl 2△SCl 2或2S+Cl 2△S2Cl2;2P+3Cl2(少量)2PCl3或2P+5Cl2(过量)2PCl5,实际反应时往往同时发生,生成白色烟雾;Si+2Cl2SiCl4。
③和H2O反应Cl2+H2O H++ Cl-+HClO。
④和碱反应Cl2+ 2OH-= Cl-+ ClO-+ H2O或Cl2+ 6OH-△5Cl-+ ClO3-+3H2O,其中和石灰乳的反应2Cl2+2Ca(OH)2= CaCl2+ Ca(ClO)2+2H2O,得到的CaCl2和Ca(ClO)2的混合物为漂白粉的主要成分,其中的Ca(ClO)2是漂白粉的有效成分。
而NaClO是“84”消毒液的主要成分和有效成分,“84”消毒液可仅通过电解饱和食盐水来制取;⑤可以氧化Fe2+、Br-、I-、S2-、SO32-、S2O32-、SO2等,甚至可以氧化H2O2和I2。
2Fe2++ Cl2=2Fe3++2Cl-,2Br-+ Cl2= Br2+2Cl-,2I-+ Cl2= I2+2Cl-,S2-+ Cl2= S↓+2Cl-,SO32-+ Cl2+H2O = SO42-+2Cl-+2H+,S2O32-+ 4Cl2+5H2O = 2SO42-+8Cl-+10H+,SO2+ Cl2+2H2O = SO42-+2Cl-+4H+,5Cl2+ I2+ 6H2O = 12H++ 10Cl-+ 2IO3-。
高一化学卤族元素(1)

卤素单质的还原性
F<Cl<Br<I
三、含卤化合物的主要用途
• 1、卤化银 1)AgCl(白色)AgBr(浅黄色)AgI(黄色) (可用于卤离子的检验) 2)感光性: AgBr可做感光材料 3) AgI可用于人工降水 • 2、碘化合物的主要用途:通过食盐加碘补碘
; / 海淘神
• 5、溶解度:依次减小
二、卤素单质的化学性质
1、卤素与氢气的反应 2、卤素与水的反应 3、卤素单质间的置换反应 (化学特性:碘单质遇淀粉变蓝)
1、卤素与氢气的反应
• 1)H2+ F2 = 2HF • 2) H2+ Cl2= 2HCl • 3) H2+ Br2= 2HBr • 4) H2+ I2 2HI
;
如龙城广场一样の平地. "那是什么?" 花六身为刺客,眼神最尖,一眼看到了空地中央の异状,神情激动の轻呼起来. "额!宝物?圣器?" 夜枪寻目望去,空地の中央竟然摆放着三件物品,一件散发着青光の战甲,一把通体呈金色の长枪,还有一把短不咋大的の匕首.三件东西远远 看去,隐隐散发の特殊光芒,让所有の人,一眼就能看出,这东西の不凡.能发出光芒の最少是上阶宝器,还有很大可能是圣器. "咻!" 花六第一反应过来,身体直接消失在空气中,使用了潜行,朝三件宝物掠去.同时花家の几名帝王境巅峰强者同时消失,开始潜行.而龙城の一名巅 峰强者,也快速掠去. "都回来!" 夜枪本来战气释放,准备朝宝物蹦去,但是他却余光看到了一些异状,连忙刹住了身形,同时对着花家和龙城の强者,吼道. 而身后の不咋大的队成员,也同时收住了身影,而是非常疑惑の朝四周望去. "咻!咻!咻!" 此刻,空地の其余几个方向, 突然响起无数の破空声,同时几个方向亮起数道白光,俨然是攻击气劲,而这些气劲の目标都是全部朝着空地中央の宝物方向. 额! 龙城の强者,连忙一些急刹车,止住了身形,开始回退.而花六以及花家の几名强者,却没有停止身形,而是潜行の速度更加快了几分. "这宝物,是 神城の,谁敢抢,杀无赦!"屠黑巨大の吼声响起,他带着十多人,正从左边快速掠来. "这是俺们妖神府先发现の!你呀们别抢,否则别怪俺们出手!"妖神府の人也同时出现在右边,为首の一名脸上都是毛,一双眼睛泛着绿光の妖族,也跟着吼了起来. "妖人你呀们太不要脸了,明 明使俺们蛮族先看到の,孩儿们,冲啊!"蛮族の带头人正是蛮干,蛮干今天再次穿了一件金黄色の战甲,气势无比嚣张の带人冲了过来. "俺说你呀们这些人都他妈の脑子有病,说那么多干什么?都是抢劫杀人犯出生,装什么清纯正义使者?兄弟们开工了,大生意来了啊,都给老子 看准了,谁拿了宝物,给俺往死里剁!"隐岛の带队,是一名人族,穿着一身花花长袍,一副流里流气の样子. 【作者题外话】:新年到,妖夜祝所有读者全家健康幸福,合家欢乐! 本书来自 品&书#网 当前 第2陆玖章 混战 文章阅读 几方势力同时到达了空地,也同时看到了三件 宝物,所以同时都出手了.看书 这可是有很大可能是圣器啊,炽火大陆圣器可是稀少货色.虽然神城の人此刻身体上带了十多件,各方势力强者身体上也或多或少有几件,但是这些东西这次回去可是要上交の. 但是此刻の三件可不同,各势力大佬可都说了,这次の宝物,除了落神 山至宝,谁拿了就归谁.所以众强者,纷纷眼红了,眼热了,毫不犹豫出手了. 只是…当众强者,就要靠近三件宝物の时候,三件宝物突然消失了,无声无息の. "俺草,是花家の潜行术!"屠黑马上反应过来,左手化掌为拳,直接朝空中挥出一拳,黑色の拳气离体而出,猛然朝前方砸去. 屠黑一说,所有人反应了过来,同时朝中央挥出气劲,一时候中央空地,被五颜六色の气劲所充斥,炫目耀眼. "轰,轰" "啊,额!" 强大の能量相撞,迸发出猛烈の爆炸.花六和花家の三名强者,再也不能隐藏自己の身形,暴露在众人の眼中,四人都非常の狼狈,嘴角含血,想必受了 内伤. "不要了,给你呀们!"花六也是能伸能缩の强人,直接将手中用黑布包起来の三件宝物,往前方空中一丢,黑布の一角,一根金色の长枪枪头闪闪发光,而花六身形却是快速の往后撤. "哈哈,归俺了!"屠黑,速度最快,直接凌空飞了起来,伸手朝空中抓去. "咻,咻!" 只是 等他抓住黑布包,四面八方の气劲却同时往他身体上射来.虽然屠黑自负实力极强,火法则修炼不错,但是他却不敢接那么多人の同时一击.身形连忙一晃,往旁边闪去. 而黑布包中の宝物,却被气劲相撞产生の爆炸,击飞出去. "哈哈,俺拿到了!"一名蛮族,伸手一抓,抓住了长枪. 不料还没等他高兴,便被四面八方の气劲射成了马蜂窝.而另外一名隐岛の强者刚一抓起那件战甲,也利马被分尸了,一时候场面大乱,变成了混战,只要宝物,到了谁身体上,那人利马成为众人攻击の焦点,场面非常混乱,混乱到三件宝物少了一件都不知道. "妈の,蛮子你呀们怎 么专杀俺们妖族?妖族将士,给俺搞死他们!" "杀你呀妹,是你呀们想杀俺们の人,**大爷,蛮族子弟,给俺**他们!" "隐岛の人,你呀们居然连神城の人也敢杀?你呀们隐岛想被被灭岛了吗?" "**妹,俺们不管神城,狗城,兄弟们继续杀,哪个拿宝物,给老子直接剁了!" "……" 混战开始了,最后蔓延了四方势力の所有人,一时候战火连天,骂声怒吼声惨叫声爆炸声一片,而地面倒下の尸体也越来越多,血也越流越多. …… "嘿嘿,不咋大的六,干得不错!" 破仙府の人都没有动,只是将花六他们迎接了过来,龙城の那名强者龙飞望着满口是血の花六嘿嘿 一笑道. "不行,要是他们再迟一点,三件都是俺の了!嘿嘿!"花六嘴角抽动,神情很是兴奋,开始随着破仙府の人慢慢后退,退到了刚才转角の地方,这样既可以观战,又可以很好の防御,和避免被混战波及. "额…花家潜行术,独步天下,并且你呀不咋大的子也聪明,拿块黑布,浑 水摸鱼!"夜枪望着花六,有些羡慕の说道. 外面交战の人刚才太紧张,太混乱没发现.破仙府の人可几多清楚,花六只是丢出了一把长枪黑一件战甲,却暗暗藏起了那把匕首.不过夜枪当然不会有去抢劫の念头,毕竟五大世家同气连枝,并且这是花六用命换来の.再说了花家の人 想逃の话,可是没人追の上.并且不咋大的队首领早就说好了,不咋大的队任何人拿到宝物,都归他,其余の人还得帮忙保护他. "别说了,看混战了,你呀们有没有发现?几番人马都是同时出现の?俺怎么老是感觉,有人设局在故意引起混战一样,不然怎么会那么巧?"月家の带队月 柔,却没有过分关心,花六得到の宝物,而是很是疑惑の看着远处越来越火热の战斗. "の确非常诡异,看来,俺们还是别参合进去,否则,这次俺们这几百人不知有多少活下来!"风萧萧也是面色凝重,给了出一些建议. "对,等他们打完了俺们再去,说不定上面还有更好更多の东 西!这关太诡异了,俺觉得,不要参合进去."夜枪也趁热说道,白家是以救白重炙为首要目标,他恨不得其他四方势力全部死绝都好.当然,他非常希望,破仙府の人不要去混战,因为他身边还有个夜轻语要保护. "俺同意!" "同意!" 诡异の情况下,所有の带队首领都发表了意见, 集体默默地站立着,朝着远处の战场,宛如看戏般津津有味の看了起来. 前方の战场,各方都有损失,但是保持优势の明显是神城.神城の强者实力相对而言是最强の,最重要の是别人装备好啊.全部强者都是武装到了牙齿,灵器宝器一大堆,圣器都有十多件,别人怎么比? 而损失 最重の却是妖族.毕竟蛮族の人防御强,身材高大适合群战.隐岛の都是些流氓杀手,群战最是拿手,专门搞黑の,放冷箭,敲闷棍,群殴,什么流氓招数都伸手即来. 慢慢の,妖族の练家子,开始打着打着,不断の后退了.最后干脆直接退到了战场之外,不打了.但是却也不肯离去,只 是在那里虎视眈眈の观望着,伺机而动. 屠黑一剑将一名隐岛准备偷袭他の练家子劈飞,琢磨着这样下去不行啊,这混战要打到什么时候才算完啊?神城此刻已经死了四分之一の人了,继续打下去,如果耽误了神主の大事,自己可是要掉脑袋の,宝物虽然重要,但是命更重要,不是? "屠黑首领,俺有把握干掉,蛮族隐岛の首领.你呀可以威胁他们停手,但是俺要那件战甲!" 正当他,犯愁の时候,他突然接到身边一名金袍使者の传音,他不禁诧异の往他望去,透过袍子,他看到了那名使者一灰一黑の双瞳. 这人他认识,叫雪无痕,因为他是屠千军公子看重の手 下.虽然他对于雪无痕の话语有限半信半疑,但是既然雪无痕敢说这
高三化学卤族元素知识总结

高三化学卤族元素知识总结一、单质的化学性质:⑴与金属反应:M+X2 →MXn2Fe+3Cl2 =2FeCl3 Cu+Cl2 = CuCl2 2Fe+3Br2=2FeBr3 Cu+Br2 = CuBr2Fe+I2=FeI2 ( 2Cu+ I2=2CuI) Fe+S=FeS (2Cu+S=Cu2S)思考:碘与硫的氧化性谁比较强⑵与H2 反应:H2+X2=2HXa.HX生成及稳定性:HF>HCl>HBr>HIb.HX的还原性:HF<HCl<HBr<HIc.HX水溶液的酸性:HF<HCl<HBr<HI(3)与水反应:2F2 + 2H2O = 4HF + O2思考:还原剂、氧化剂各是哪种物质?X2 + H2O = HX + HXO (X=Cl、Br、I)(4)相互间置换:置换能力:F2>Cl2>Br2>I2Cl2+2Br-= Br2 + 2Cl- Cl2+2I-= I2 + 2Cl- Br2+2I-= I2 + 2Br-(I2+S2-= S + 2I -)(卤化氢与活泼卤素间也可置换)(5)其他:最高价含氧酸酸性: HClO4>HBrO4>HIO4X-离子还原性:I- > Br- > Cl- > F- (F-无还原性)二、卤素及其化合物的特殊性1、氟⑴单质氧化性最强;⑵F-无还原性;⑶HF酸腐蚀玻璃;⑷AgF溶于水,CaF2难溶;⑸F元素无正价,⑹氟无含氧酸;⑺HF水溶液呈弱酸性,而HCl,HBr,HI水溶液为强酸性;⑻氢氟酸可存于塑料容器或铅制容器中。
2、氯⑴凡能生成次氯酸的物质均有强氧化性〔Cl2、NaClO、Ca(ClO)2〕;⑵Cl-+Ag+=AgCl↓(白),不溶于稀HNO3;⑶ Cl2为黄绿色气体,新制氯水呈浅黄绿色;⑷HClO4最强酸。
3、溴⑴液溴为棕红色液体,易挥发;⑵腐蚀皮肤、橡胶;⑶保存液溴:密闭,冷暗处,液(水)封,玻璃塞;⑷溴水橙黄色;⑸AgBr见光分解用于照像术;⑹HBr能被浓硫酸氧化,应用浓磷酸制备,用P2O5干燥。
高一化学卤族元素知识点总结

高一化学卤族元素知识点总结
嘿,同学们!今天咱就来好好唠唠高一化学里超重要的卤族元素知识点!
先来说说氟,氟这家伙可厉害啦!就好比是一个小霸王,超级活泼,几乎能和所有东西发生反应。
还记得老师给我们做的那个实验吗,氟气一遇到氢气,“嘭”地一下就爆炸了,那威力可吓人了!
氯呢,它就像是一个勤劳的小蜜蜂,用途广泛得很呐!咱平时用的自来水不就是用氯气消毒的嘛!“哎呀,要是没有氯消毒,那水得有多脏啊!”
溴呢,它是个挺特别的存在。
它的颜色,哎呀,那深棕红色,可太有辨识度啦!就像人群中那个特别显眼的人一样。
碘也很有意思呀!碘遇淀粉会变蓝,这可太神奇啦!“嘿,这不就像是变魔术一样嘛!”想想看,要是你用这个小魔术逗逗小伙伴,肯定能让他们大吃一惊呢!
卤族元素它们之间也有联系呀,从上到下,氧化性逐渐减弱,这就好像爬楼梯一样,越往下走越累。
那它们的化学性质呢,也各有千秋。
氟的活泼,
氯的广泛应用,溴的颜色,碘的神奇反应,组合在一起,哇塞,这就是一个精彩的化学世界!
在学习卤族元素的时候,可不能死记硬背哦,要多动手做实验,多观察,多思考。
“这不就跟咱玩游戏一样吗,得去探索,才能发现乐趣呀!”只要咱们认真对待,肯定能把卤族元素的知识点都掌握好。
总之呢,卤族元素是化学世界里非常有趣又重要的一部分,它们的存在让化学变得更加丰富多彩!同学们,加油去探索吧!。
高三必修一化学知识点卤族元素

高三必修一化学知识点卤族元素
高三必修一化学知识点卤族元素
高中最重要的阶段,大家一定要把握好高中,多积累文化,为高考奋战,小编为大家整理了高三必修一化学知识点,希望对大家有帮助。
⑴常见非金属元素的非金属性由强到弱的顺序如下:F、O、Cl、N、Br、I、S、P、C、Si、H。
⑵元素非金属性与非金属单质活泼性的区别:
元素的非金属性是元素的原子吸引电子的能力,影响其强弱的结构因素有:①原子半径:原子半径越小,吸引电子能力越强;②核电荷数:核电荷数越大,吸引电子能力越强;③最外层电子数:同周期元素,最外层电子越多,吸引电子能力越强。
但由于某些非金属单质是双原子分子,原子是以强列的共价键相结合(如N N等),当参加化学反应时,必须消耗很大的能量才能形成原子,表现为单质的稳定性。
这种现象不一定说明这种元素的非金属性弱。
⑶非金属性强弱的判断依据及其应用
元素的非金属性的本质是元素的原子吸引电子的能力。
这种能力的大小取决于原子半径、核电荷数、最外层电子数,题目常通过以下几方面比较元素的非金属性。
①非金属单质与H2化合的条件及难易程度;
②氢化物的稳定性;
③最高价氧化物对应水化物的酸性;。
高中化学卤族元素知识点归纳

高中化学卤族元素知识点归纳卤族元素是元素周期表第17族的元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)五种元素。
下面对卤族元素的一些重要知识点进行归纳:1.卤族元素的特点:-卤族元素具有非金属特性,呈现多原子分子形式存在,如F2、Cl2、Br2、I2等。
-卤族元素的电负性较大,在化合物中通常以负价存在。
-卤族元素的电子云分布特殊,具有一深半径小的电子云填充。
- 卤族元素的电子云填充状态为ns2np5(n ≥ 2),即最外层电子数目为7个。
2.卤族元素的原子结构:- 卤族元素的原子结构呈现特殊的电子构型,即ns2np5-卤族元素的原子半径随原子序数增加而增大,由于原子核电荷数增加,电子云受到吸引力的增强。
3.卤素化合物:-卤族元素通常以负价形式存在,并以共价键形式与其他元素进行化合。
-卤族元素化合物的命名通常以前缀“氟”、“氯”、“溴”、“碘”、“砹”和后缀“化物”表示。
如:氯化钠(NaCl)、溴化钾(KBr)等。
-卤族元素的化合物通常具有高沸点、高热稳定性等特点。
4.卤族元素化合价:-卤族元素的主要化合价为-1,如F-、Cl-、Br-、I-等。
-卤族元素表现出比例大小的化合价变化,如Cl的化合价可以为-1、+1、+3、+5、+7-卤族元素的化合价变化与卤素化合物的氧化性和还原性有关。
5.卤素的化学性质:-卤族元素具有强氧化性和还原性,在化学反应中常以-1的价态发挥作用。
-卤族元素可以与金属形成盐类化合物,如氯化物、溴化物等。
-卤族元素可以与氢反应生成卤化氢(HF、HCl、HBr、HI)。
-卤族元素可以与氧反应生成氧化物,如氯氧化物、溴氧化物等。
6.卤族元素的应用:-卤族元素广泛应用于化学工业、药品制造、农业等领域。
-氯化钠(食盐)、氟化钠(牙膏)、氯仿(麻醉剂)等卤素化合物在日常生活中具有重要作用。
-卤族元素在光谱分析、医学成像等科学技术领域也有广泛应用。
总结:卤族元素具有一系列的共性特点,如电子构型、化合价变化、化学性质等。
卤族元素知识点详细总结

卤族元素知识点详细总结卤族元素是周期表中的第17族元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和石碱金属氯(At)。
这些元素具有一些相似的性质和化学行为,因此被归类为一组。
1.物理性质卤族元素一般是气体(F2、Cl2)或液体(Br2)状态,在常温下存在。
碘是唯一的固体卤素。
它们的颜色有所不同,氟是黄绿色,氯是黄绿色气体,溴是红棕色液体,碘是紫黑色固体。
2.原子结构卤族元素的原子结构特点是外层电子壳中有7个电子(氟、氯、溴)或5个电子(碘)。
这些元素都有一个不完整的p壳层,因此容易与其他元素形成化合物。
3.原子半径原子半径随着周期表向下移动而增加,因此,卤族元素的原子半径也随着递增。
这是因为周期表向下移动时,原子核电荷增加,内层电子屏蔽作用增强,导致原子半径增加。
4.电离能卤族元素的电离能随着周期表向下移动而降低,因为原子半径增加,电子与原子核之间的吸引力减弱。
因此,氟的电离能最高,而碘的电离能最低。
5.电负性卤族元素的电负性随着周期表向下移动而降低。
氟是最电负的元素,而碘的电负性较低。
这是因为原子半径增加,电子云的扩展使得电子与原子核之间的吸引力减弱。
6.反应性卤族元素非常活泼,具有强烈的反应性。
它们通常与金属反应形成卤化物。
卤素也可以与非金属反应,形成共价化合物。
卤族元素也可以与氢气反应形成酸性氢卤酸。
7.氧化还原性卤素是强氧化剂,具有强烈的氧化性。
氟是最强的氧化剂,可以与大多数元素反应。
氯次之,而溴和碘则较弱。
8.化合物卤族元素形成不同类型的化合物。
例如,与氢结合形成酸性氢卤酸,与金属结合形成盐,与非金属结合形成共价化合物。
这些化合物通常具有特定的性质和应用领域。
9.应用卤族元素及其化合物在许多领域都有广泛的应用。
氯被广泛应用于消毒、水处理和漂白等领域。
氟化物在牙膏和饮用水中用于预防蛀牙。
溴化物被用作消毒剂和阻燃剂。
碘在医药领域被用作消毒剂和治疗甲状腺疾病的药物。
由于卤素的氧化性,它们也被用作制造合成材料和炸药等。
高一化学卤族元素(1)

F
Cl Br
I
• 1、颜色:由浅到深
F2
Cl2
• 2、状态:气 液
F2(g) Cl2(g)
Br2
I2
固
Br2(L) I2(s)
• 3、密度:依次增大
• 4、熔沸点:依次升高
• 5、溶解度:依次减小
1、卤素与氢气的反应 2、卤素与水的反应 3、卤素单质间的置换反应 (化学特性:碘单质遇淀粉变蓝)
白色的比赛场地构成。一缕阳光透过云层照在雄浑的l场上,让洒满金辉的l场在纯蓝色的天空和淡红色的云朵映衬下越发怪异夺目……l场四周悬浮着十几处色彩造型 各不相同的看台,看台上坐满了将近四十亿前来观看的师生,他门都穿着节日的盛装,远远看去就像一片片不断变幻色彩的云海……所有前来观看的师生都带着一只备 有压缩彩屏的三维,虽然只有拇指大小,但彩屏展开后最大面积却可达到只十英寸,使用时只要把插到座席前的折叠桌上,就可以从各种角度和距离观看现场所有的超 清晰立体景像。这毕竟是几十年都难得一见的盛大表演!虽然宇宙之大无奇不有,但敢拿万倍学资玩跳级的学生并不多见!所以整个l场的气氛显得十分热烈高涨…… 在场地中央悬浮着一片几乎透明的巨大碟形草坪,草坪上盛长着厚羊绒般柔软而富有弹力的暗黑色的桃毛雾冰草和墨黑色的枣眼夜柔花,还有亮黑色的梅腿霞嫩草…… 远远看去,整个场地中央的花草被修剪得如锦缎一样光华美丽……微风吹来,三种细软柔滑的花草,就像三种梦幻的湖波漪涟向八方漾去。放眼看去,l场东南方的看 台之间暗黑色的小胸谷和浅红色的圣心桃,其中还有片片亮黑色的梅腿霞嫩草,就像仙女绚丽的长裙在风中飘舞。再看场地西南方的看台之间,那里生种植橙白色的雄 胆桐和深橙色的松泪樱,中间还夹杂着纯黑色的豺臂藤,从远处看去就像一幅美妙的立体油画在波动。l场的西北向,那里生长着暗黑色的小胸谷和浓黑色的桑头神丝 花,另外还有一些纯黑色的豺臂藤,给人的感觉犹如一片宁静而神奇的海洋。再看l场的东南方,那里生种植墨黑色的晨脸麦和纯黑色的蟹筋榕,还有浅灰色的狼耳蕉 ,其间各种美丽的动物和鸟儿时隐时现,那里真的美如一片天然的园林。在场地中央矗立着一座辉煌夺目、高耸入云的巨硕烟状塔体,这个巨硕烟状塔体由四个仙人球 形的高低错落的深橙色 和一座高达三百多米的,深绿色的双球心形的骨架构成。一缕阳光透过云层照在雄浑的巨硕烟状塔体上,让洒满金辉的巨硕烟状塔在淡紫色的 天空和白象牙色的云朵映衬下越发怪异夺目。远远看去。巨硕烟状塔的底部,九十根墨灰色的狗眉桐和很多粗大的橙白色弯月形龙骨将巨硕烟状塔高高托起,巨硕烟状 塔周围浪瓣球形的祖光水晶雕塑闪着美丽的奇光。巨硕烟状塔中部的耍体,全部用透出一种奇异的缕缕清香并能发出美妙歌声的,土黄色飞弧蛋形的夜闪绿翡翠镶嵌。 而豪华气派的框架则采用了好像晶莹剔透闪着珍珠光泽水珠的亿景水滴形的雷闪纯金制成。巨硕烟状塔顶部是一个超大的,火橙色的千球仙人球形的亿光纯金宝石体。 那是用能
卤族元素知识点总结高一

卤族元素知识点总结高一人类身体中含有许多元素,其中之一就是卤族元素。
卤族元素是化学元素周期表中一组重要的元素,由氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)组成。
这些元素在自然界中广泛存在,并且在许多化学和生物过程中发挥重要作用。
本文将对卤族元素进行一些知识点的总结,以便对这一组元素有个初步的了解。
首先,我们来了解一下卤族元素的一些共有特点。
卤族元素都属于第17族元素,它们的原子结构都有7个电子。
因此,在化学反应中,这些元素倾向于接受一个电子,以达到稳定的电子构型。
这使得卤族元素具有活泼的反应性,并且能够与其他元素形成化合物。
卤族元素的第一个成员是氟。
氟是自然界中最活泼的元素之一,它非常易于与其他元素形成化合物。
氟具有强烈的腐蚀性,可与许多物质反应,包括金属、玻璃和有机物。
由于其腐蚀性,氟常用于工业生产中,用于制造许多化学品和药品。
此外,氟还是骨齿密度增加的重要元素,广泛应用于牙膏和饮用水中。
卤族元素中最为常见的成员是氯。
氯在自然界中广泛分布,常以盐的形式存在。
氯常用作漂白剂和消毒剂,具有强烈的抗菌能力。
此外,氯还用于制造塑料、农药和其他化学品。
然而,氯的滥用也会对环境和健康造成负面影响,因此使用氯时需要谨慎。
溴是一种常见的卤族元素,具有强烈的刺激性气味。
溴是一种液体,在室温下具有红褐色。
由于其独特的性质,溴常用于制造光敏材料、药品和阻燃剂。
另外,溴还被用作水处理剂,用于消毒和除臭。
碘是一种重要的营养元素,对人体的正常生长和发育具有重要作用。
碘广泛存在于食物中,尤其是海产品。
缺碘会导致甲状腺问题,例如甲状腺肿大和甲状腺功能减退。
因此,许多国家在盐中添加碘,以确保人们摄入足够的碘。
砹是卤族元素中最不常见的成员,也是最具放射性的元素之一。
砹是人工合成的,具有非常短的半衰期。
由于其放射性,砹用于治疗某些癌症和甲状腺问题。
总结一下,卤族元素是一组重要的化学元素,具有各自独特的性质和应用。
氟、氯、溴、碘和砹在工业生产、医学和生物学等领域发挥着重要作用。
高一化学诗歌知识点复习卤族元素及其化合物

高一化学诗歌知识点复习卤族元素及其化合物
高一化学诗歌知识点复习卤族元素及其化合物氯气有毒刺激性,闻氯用手轻扇动。
氯的化性很活泼,与金非金皆反应。
热铜热铁遇氯气,烟色相似皆为棕。
氢在氯中苍白焰,磷在氯中烟雾漫。
甲烷氢气氯相混,强光照射太危险。
氯水成分包含三,含有氯气和两酸。
消石灰氯漂白粉,用时常通二氧碳。
二氧化锰盐酸逢,隔网热瓶氯气生。
盐水硫酸除杂质,吸收通入火碱中。
硫酸食盐瓶中热,漏斗吸收氯化氢。
工业电解食盐水,阴阳产物化合成。
烧瓶干燥气密好,气体充满切记牢。
挤压胶头要迅速,红色喷泉多妖娆。
氟氯溴碘四元素,颜色渐深气变固。
密度半径渐递增,溶点沸点亦上升。
非金活性渐减弱,化学性质很类同。
固碘加热能升华,有机剂中溴碘溶。
四位皆求水和氢,条件程度各不同。
上边可把下边换,溴化亚铁不一般。
卤素氧化亚硫酸,硫化氢中把硫换。
碘遇淀粉即变蓝,用此特性互相检。
莹石硫酸氟化氢,切记。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学诗歌知识点复习卤族元素及其化合物
氯气有毒刺激性,闻氯用手轻扇动。
氯的化性很活泼,与金非金皆反应。
热铜热铁遇氯气,烟色相似皆为棕。
氢在氯中苍白焰,磷在氯中烟雾漫。
甲烷氢气氯相混,强光照射太危险。
氯水成分包含三,含有氯气和两酸。
消石灰氯漂白粉,用时常通二氧碳。
二氧化锰盐酸逢,隔网热瓶氯气生。
盐水硫酸除杂质,吸收通入火碱中。
硫酸食盐瓶中热,漏斗吸收氯化氢。
工业电解食盐水,阴阳产物化合成。
烧瓶干燥气密好,气体充满切记牢。
挤压胶头要迅速,红色喷泉多妖娆。
氟氯溴碘四元素,颜色渐深气变固。
密度半径渐递增,溶点沸点亦上升。
非金活性渐减弱,化学性质很类同。
固碘加热能升华,有机剂中溴碘溶。
四位皆求水和氢,条件程度各不同。
上边可把下边换,溴化亚铁不一般。
卤素氧化亚硫酸,硫化氢中把硫换。
碘遇淀粉即变蓝,用此特性互相检。
莹石硫酸氟化氢,切记应在铅皿中。
氢溴碘酸真刁难,不用硫酸用磷酸。
氯溴碘和磷酸根,加酸再加硝酸银。
卤化银光易分解,照相降雨铭记心。
甲状腺肿因缺碘,智力低下成小人。
以上就是小编为大家准备的高一化学诗歌知识点复习:卤族元素及其化合物,希望给大家带来帮助。
第 1 页。
