附表2-1:从药品生产单位抽验不合格药品情况
医院药品不合格处理报告表(NCR)
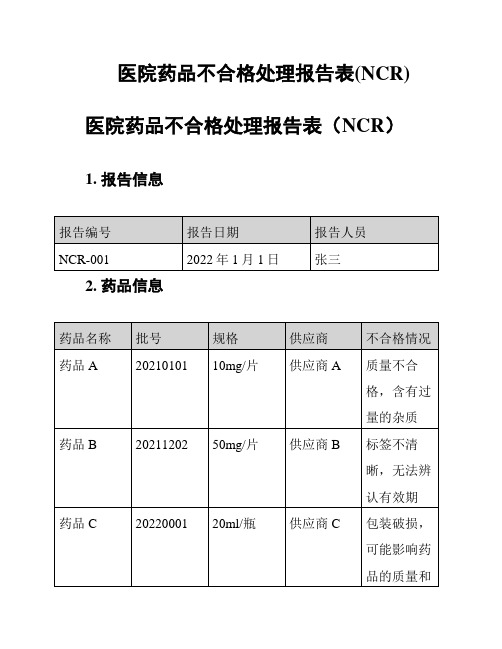
医院药品不合格处理报告表(NCR)医院药品不合格处理报告表(NCR)1. 报告信息
2. 药品信息
3. 处理情况
3.1 药品A
经过与供应商A沟通,供应商将负责回收并更换所有该批次药品,并提供质量合格的替代药品。
3.2 药品B
与供应商B协商后,供应商将提供新的药品,并确保标签清晰可辨,有效期等信息准确无误。
3.3 药品C
对于包装破损的药品C,将按照规定的处理程序进行封存,并联系供应商C,协商退换或补发药品。
3.4 药品D
供应商D将负责回收未通过检验的药品,并重新提供符合规定含量标准的药品。
3.5 药品E
对于过期的药品E,将按照规定的处理程序进行封存,并联系供应商E,协商退换或补发药品。
4. 处理结果
经过相关处理,所有不合格药品将被回收,并由供应商提供替代药品,确保医院药品的质量和安全。
5. 备注
如有其他不合格药品或处理情况,请在备注栏中详细说明,并及时通知相关部门进行跟进处理。
以下内容为其他不合格药品及处理情况的备注栏,请根据实际情况填写:
备注:
- 药品F:不合格原因及处理方案
- 药品G:不合格原因及处理方案
- ...。
药品不合格原因及药品检验原始记录细则

[鉴别]
2 显微鉴别:除用文字详细描述组织特征外,可根据 需要用HB、4H或6H铅笔绘制简图,并标出各特征组 织的名称,或用显微摄影;必要时可用对照药材进行 对比鉴别并记录。 中药材,必要时可绘出横(或纵)切面图及粉末的特征 组织图,测量其长度,并进行统计。 中成药粉末的特征组织图中,应着重描述特殊的组织 细胞和含有物,如未能检出某应有药味的特征组织, 应注明‘未检出××’;如检出不应有的某药味,则应 画出其显微特征图,并注明‘检出不应有的××’。
含量不合格原因: 1.原药材品种、产地、采收季节 2 生产工艺:药材质地和待测成分的理化性 质,溶媒品种用量、提取次数、浸提时间、 浸提温度,浓缩、干燥、精制等条件、工序 都对含量测定产生影响。 3.厂家投料不足、低限投料。
药品不合格原因
药品不合格原因主要有四种: 1.生产工艺 2.原药材、辅料 3.包装材料 4.贮存条件
前言
检验记录是出具检验报告书的依据,是进行科 学研究和技术总结的原始资料。 为保证药品检验工作的科学性和规范化,检验 记录必须做到:记录原始、真实,内容完整、 齐全,书写清晰、整洁。
前言
按GMP条款二百三十条规定,检验记录应当至少 包括以下内容: 1.产品或物料的名称、剂型、规格、批号或供货 批号,必要时注明供应商和生产商(如不同)的 名称或来源; 2.依据的质量标准和检验操作规程; 3.检验所用的仪器或设备的型号和编号; 4.检验所用的试液和培养基的配制批号、对照品 或标准品的来源和批号; 5.检验所用动物的相关信息;
[鉴别]
3 呈色反应或沉淀反应:记录简要的操作过程,供试品的 取用量,所加试剂的名称与用量,反应结果(包括生成物 的颜色,气体的产生或异臭,沉淀物的颜色,或沉淀物的 溶解等)。采用药典附录中未收载的试液时,应记录其配 制方法或出处。 4 薄层色谱(或纸色谱):记录室温及湿度,薄层板所用的 吸附剂(或层析纸的预处理),供试品的预处理,供试液与 对照液的配制及其点样量,展开剂、展开距离、显色剂, 色谱图;必要时,计算出Rf值。 5 气(液)相色谱:如为引用检查或含量测定项下所得的色 谱数据,记录可以简略;但应注明检查(或含量测定)项 记录的页码。
双氯芬酸制剂

北京市药品检验所 二〇〇九年十一月
目录Biblioteka 一、基本情况 ....................................................................................................................... 1 1. 药品的历史沿革,基本特性,适应症 ..................................................................... 1 2. 剂型、药品规格与包装材料 ..................................................................................... 1 2. 1 剂型 ....................................................................................................................... 1 2.2 规格 ........................................................................................................................ 1 2.3 包装材料 ............................................................................................................... 2 3. 药品处方与生产工艺简述 ......................................................................................... 2 4. 近几年临床使用不良反应信息 ................................................................................. 2 二、药品生产及抽样基本信息 ........................................................................................... 3 1. 全国该药品的生产企业与批准文号数 ..................................................................... 3 2. 抽取的样品总批次,在企业抽取的样品批次 ........................................................ 3 3. 抽取样品涉及的生产企业和批准文号数................................................................. 3 4. 抽取双氯芬酸制剂涉及生产企业和批准文号均占全国范围内 该药品的生产企业与批准文号的百分数 ................................................................. 4 5. 抽取样品的地域分布: ............................................................................................. 4 6. 样品的确认情况 ......................................................................................................... 4 三、检验标准 ....................................................................................................................... 4 四、依据现行标准检验结果及分析 ................................................................................... 5 1. 总的检验结果.............................................................................................................. 5 2. 不同抽样地域样品检验结果对比分析 ..................................................................... 5 3. 同一抽样地域(大区或省)不同抽样点(省级、县级与乡级) 样品检验结果对比分析 .............................................................................................. 6 4. 不同样品保存条件对检验结果影响分析................................................................. 6 5. 不合格批次分析 ......................................................................................................... 6 6. 双氯芬酸钠肠溶片结果分析 ..................................................................................... 6 7. 双氯芬酸钾片结果分析 ............................................................................................. 7 8. 双氯芬酸钠缓释片 ..................................................................................................... 7 9. 其他制剂 ...................................................................................................................... 8 五、开展的探索性研究 ....................................................................................................... 8 1. 有关物质 ...................................................................................................................... 8 1.1 杂质的液相色谱-质谱结构确证 ........................................................................ 8 1.2 双氯芬酸钠肠溶片检验情况 .............................................................................. 8 1.3 双氯芬酸钾片 ........................................................................................................ 9 1.4 双氯芬酸钠缓释片................................................................................................ 9
药品监督行政处罚程序规定最新版

《药品监督行政处罚程序规定》(局令第1号)国家食品药品监督管理局令第1号《药品监督行政处罚程序规定》于2003年3月28日经国家食品药品监督管理局局务会审议通过,现予发布。
本规定自2003年7月1日起施行。
局长:郑筱萸二○○三年四月二十八日药品监督行政处罚程序规定第一章总则第一条为保证药品监督管理部门正确行使行政处罚职权,保护公民、法人和其他组织的合法权益,根据《中华人民共和国行政处罚法》、《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》、《医疗器械监督管理条例》和国务院有关行政法规的规定,制定本规定。
第二条药品监督管理部门对违反药品、医疗器械管理法律、法规、规章的单位或者个人实施行政处罚,适用本规定。
第三条药品监督管理部门实施行政处罚,必须坚持以下原则:(一)法定依据的原则;(二)法定程序的原则;(三)公正、公开的原则;(四)处罚与教育相结合的原则;(五)保护公民、法人及其他组织合法权益的原则。
第四条药品监督管理部门应当建立行政处罚监督制度。
上级药品监督管理部门对下级药品监督管理部门实施的行政处罚进行监督。
上级药品监督管理部门对下级药品监督管理部门违法作出的行政处罚决定,可责令其限期改正;逾期不改正的,有权予以变更或者撤销。
第二章管辖第五条药品、医疗器械监督管理行政处罚由违法行为发生地的药品监督管理部门管辖。
第六条县级以上药品监督管理部门管辖辖区内的药品、医疗器械行政处罚案件。
省、自治区、直辖市人民政府药品监督管理部门管辖辖区内重大、复杂的药品、医疗器械行政处罚案件。
国务院药品监督管理部门管辖全国范围内有重大影响的药品、医疗器械行政处罚案件。
省、自治区、直辖市人民政府药品监督管理部门可依据药品、医疗器械管理法律、法规、规章和本地区的实际,规定辖区内级别管辖的具体分工。
第七条两个以上药品监督管理部门对管辖权有争议的,报请共同的上一级药品监督管理部门指定管辖。
第八条药品监督管理部门发现案件不属于本部门主管或者管辖的,应当填写《案件移送审批表》(附表1),经药品监督管理部门主管领导批准后即时填写《案件移送书》(附表2),并将相关案件材料一并移送有管辖权的药品监督管理部门或者相关行政管理部门处理。
山东省药品质量公告(2011年第3期,总第49期)附表
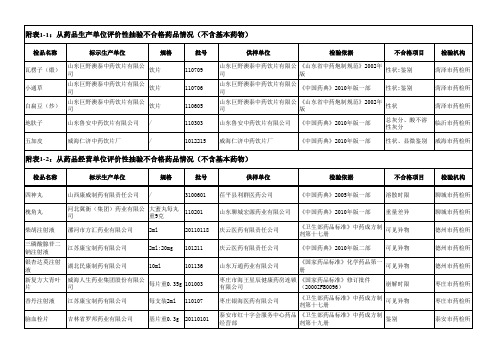
新乡市常乐制药有限责任公司 1ml:10mg 新乡市常乐制药有限责任公司 1ml:10mg 江西国药有限责任公司 吉林龙泰制药股份有限公司 四川蜀中制药有限公司 2ml:0.2g /
上海现代哈森(商丘)药业有限 2ml:0.25g 公司 辅仁药业集团有限公司 0.125g
银杏叶片 三磷酸腺苷二 钠注射液 盐酸利多卡因 注射液 海螵蛸 皂刺 川贝 通草
河北冀衡(集团)药业有限公 大蜜丸每丸 110201 司 重9克 漯河市方汇药业有限公司 江苏康宝制药有限公司 湖北民康制药有限公司 2ml 2ml:20mg 10ml 20110118 101211 101136
《卫生部药品标准》中药成方制 可见异物 剂第十七册 《中国药典》2010年版二部 可见异物
可见异物 可见异物 性状 性状 性状 性状
德州市药检所 德州市药检所 德州市药检所 东营市药检所 东营市药检所 东营市药检所
河北祁新中药颗粒饮片有限公 饮片 司 亳州市中药饮片厂 中药饮片
泰山中药饮片加工有限责任公 / 司 四川 /
海螵蛸 丝瓜络 猪苓 菟丝子 百合 苦杏仁 麦芽 党参 芒硝 茯苓 丹参 海桐皮 通草 徐长卿 防己 白扁豆(炒) 败酱草
亳州市中药饮片厂 济宁邦尔中药饮片有限公司 济宁邦尔中药饮片有限公司 安徽海鑫中药饮片有限公司 安徽海鑫中药饮片有限公司 产地:四川
/ / / / / /
20110216 201106181 201104051 20110601 20110601 101216 110602 110102 110322 20090101 100104 20101106 1006001 20100326 20100402 110219 20110607
兖州市鲁恒医药有限公司 兖州市鲁恒医药有限公司 兖州市御风药业有限责任公 司 兖州市御风药业有限责任公 司 青岛天合医药股份有限公司 市南分公司 青岛老郎中医药连锁有限公 司 青岛海风药业有限公司 青岛海风药业有限公司 山东鲁中圣和药业有限公司 东营市医药公司垦利分公司 第十一药店 泰安市红十字会服务中心药 品经营部 泰安市红十字会服务中心药 品经营部 泰安市红十字会服务中心药 品经营部 淄博春天经贸有限公司春天 大药房 (淄博)张店建联药店 山东省沂源县医药有限公司
药品注册检验工作程序和技术要求规范(试行)(2020年版)

附件药品注册检验工作程序和技术要求规范(试行)(2020年版)一、目的 (1)二、定义和适用范围 (1)三、药品注册检验申请人和药品检验机构 (1)四、药品注册检验分类 (4)五、药品注册检验分工 (5)六、药品注册检验工作程序 (5)(一)境内生产药品 (5)1.准备申请 (5)2.提出申请 (6)3.接收审核 (8)4.注册检验 (9)5.报告发送 (11)(二)境外生产药品 (12)1.准备申请 (12)2.提出申请 (12)3.接收审核 (13)4.注册检验 (14)5.报告发送 (14)(三)样品抽取 (14)(四)特殊情形 (15)(五)与药品审评中心的信息沟通 (16)(六)工作时限 (17)七、药品注册检验基本技术要求 (18)(一)资料审核 (18)(二)样品检验和标准复核 (18)(三)注册检验用标准物质 (19)八、附件 (20)附件1注册检验资料、样品、标准物质和特殊实验材料的要求 (21)附件1.1 (21)附件1.2 (24)附件1.3 (27)附件1.4 (31)附件2药品标准复核意见撰写要求 (34)附件3药品标准物质原料申报备案细则 (36)附件3.1 (41)附件4 药品注册检验相关表单文书 (42)附件4.1 (42)附件4.2 (43)附件4.3 (44)附件4.4 (45)附件4.5 (46)附件4.6 (47)附件4.7 (50)附件4.8 (51)一、目的为落实《药品注册管理办法》(国家市场监督管理总局令第27号)有关药品注册检验的规定,进一步规范药品注册检验工作程序,明确注册检验技术要求,制定本规范。
二、定义和适用范围药品注册检验包括样品检验和标准复核。
样品检验是指按照申报药品质量标准对样品进行的实验室检验,以及有因抽样检验。
标准复核是指对申报药品质量标准中设定项目的科学性、检验方法的可行性、质控指标的合理性等进行的实验室评估。
本规范适用于药品检验机构开展的,为支撑中药、化学药、生物制品和按药品管理的体外诊断试剂上市许可申请审评审批的样品检验和标准复核,以及制剂审评需要的化学原料药、药用辅料、直接接触药品的包装材料和容器的检验。
抽验检出的159批不合格药品情况分析与思考

19批不合格药 品情况分 析如下 。 5
1 基本情况 2O 年黄山市药品检验所对抽检的 66批药品进 O7 0
表 1 不合格药 品类别情 况
行了依法检验, 其不合格药品为 19 5 批次, 具体隋况详见表 1 4 -。
维普资讯
安 徽 医 药
A h i d a n h r aet a o ra 2 0 e ;2 9 n u i l dP am cui l un l 0 8S p 1 ( ) Me c a c J
・7 8 9・
◇药 品检 验 ◇
抽 验 检 出 的 19批 不 合 格 药 品情 况 分 析 与 思 考 5
发生后应 注意患者及 家属 的心理疏 导 , 主动 与家属 和患者 沟
围神经病变 3 1例[ ] 安徽 医药 ,0 5,( )5 1— . J. 2 0 9 7 :0 2 [ 张宪安 主 编. 用 药物 学 [ . 京 : 国医药 科技 出 版社 , 5] 实 M] 北 中
19 1 2 9 7: 2
3 思 考 与讨 论
中药成分 中含 有糖分 , 片剂大多又是包糖衣 。包 衣工艺 、
包 衣材料 的理化性 质 、 粘度 、 含糖 浓度 都直 接影 响片剂 质量 , 中药 所含 的酸性 、 水溶性 、 吸潮性成分 因素也会导致 片剂膨胀
而使 片衣裂 开或使 糖衣 变色 。所 以 , 气 、 、 天 温 湿度是 产生
2 结 果 与 分 析
从表 1 情况分 析。检 出不合格 药品 阳性率最高 的是 中成 药 和 中药 饮 片 ; 这充 分表 明 中成 药和 中药 饮片 的质量有 待加
强 和提高 。从表 2来 源分 析。从 乡 ( ) 镇 基层 涉药 单 位抽 样
医药产品生产检查记录表

医药产品生产检查记录表医药产品生产检查记录表是用于记录医药产品生产过程中各个环节的检查情况,以确保产品质量和符合相关法规、标准的一种重要文件。
下面是关于医药产品生产检查记录表的参考内容:医药产品生产检查记录表产品名称:___________ 生产日期:___________产品批号:___________ 检查日期:___________检查项目检查结果检查人员1. 原辅材料检查1.1 原辅材料名称1.2 供应商名称1.3 进货合格证明检查1.4 外观检查1.5 化学成分检查1.6 纯度及含量检查1.7 微生物检查1.8 检查结论2. 生产设备检查2.1 生产设备名称2.2 生产设备编号2.3 设备清洁度检查2.4 设备运行状态检查2.5 传动系统检查2.6 控制系统检查2.7 检查结论3. 生产操作检查3.1 操作员姓名3.2 操作员资质检查3.3 工艺操作规程检查3.4 操作步骤执行情况检查3.5 操作参数记录检查 3.6 管理记录检查3.7 检查结论4. 中间检验4.1 中间产品名称4.2 中间产品批号4.3 中间产品外观检查 4.4 中间产品含量检查 4.5 中间产品满意度检查4.6 检查结论5. 成品检验5.1 成品名称5.2 成品批号5.3 外观检查5.4 化学成分检查5.5 纯度及含量检查 5.6 微生物检查5.7 检查结论6. 包装检查6.1 包装材料检查6.2 包装过程检查6.3 外观检查6.4 包装记录检查6.5 检查结论7. 质量控制记录7.1 温湿度记录7.2 灭菌记录7.3 检测设备校准记录7.4 不合格品处理记录7.5 索证索票记录7.6 检查结论检查总结及签名:____________________以上是医药产品生产检查记录表的参考内容,在实际使用时,可以根据具体的医药产品生产过程进行调整和细化。
同时,记录表中应包含签名栏,在每次检查完成后由相关人员进行签字确认,以确保记录的真实性和有效性。
《药品养护质量信息汇总分析报告》

《药品养护质量信息汇总分析报告》目的:为便于质量管理部和业务部能及时全面的掌握储存药品的质量信息,合理调节库存药品的结构和数量,保证所经营的药品符合质量要求,现就11至12月份药品养护质量信息汇总分析如下:一、公司经营品种的结构、数量公司库存药品主要包括:粉针、水针、输液、糖浆、滴眼、片剂、胶囊、颗粒剂、丸剂和口服等十几种剂型。
公司业务部门根据公司销售情况采取“勤进勤销”的原则,杜绝药品积压。
在库药品因养护员在日常的管理过程中,能及时采取调控措施,使药品储存的稳定性100%、合格率100%。
二、药品养护质量报告药品养护的各项工作内容都是紧紧围绕保证药品质量为主要目标。
检查控制在库药品的储存条件,对药品进行定期质量检查,从药品质量报表中反映,11至12月份公司养护员工养护检查在库药品批次,阴凉库区库内最高为10℃,最低为3℃,相对湿度最高为68%,最低为48%,养护员按时进行监控及时进行调节,保证了在库药品的质量。
二、对今后养护工作的改进意见和养护目标药品的储存质量是受储存环境和药品性状的制约,在我们实际工作中,应根据经营药品的品种数量和结构,药品储存条件、自然环境变化,监督管理要求,在确保日常养护工作有效开展的基础上,采取有针对性的养护方法。
养护员:张玲202x年12月31日第二篇:养护质量汇总分析内江市一生好药业连锁有限公司202x年度养护质量信息汇总分析本年度在质量管理部门的技术指导下,在库养护品规数共计xx 个(西药xx个,中药xx个,重点养护xx个)。
其中首营品种xx个,贮存期较长的品种xx个,近期发生质量问题品种xx个。
现将养护质量信息汇总如下:1.加强了贵重药品、近效期药品、易变质药品、贮存期较长的药品、己发现质量问题的相邻批号药品、生物制品等重点养护品种的检查次数,坚持做到每月养护一次。
2普通药品均按照“三、三、四”原则进行,即药品在库三个月后就进入循环养护周期。
对有质量问题的品种及时采取了养护措施,保证了在库药品的质量。
《〈场地管理文件〉编写指导原则(试行)》

《场地管理文件》编写指导原则(试行)《场地管理文件》(Site Master File,SMF)是指由药品生产企业编写的药品生产活动概述性文件,针对企业每个生产地址建立,至少应当包含质量管理策略及在本生产地址进行的药品生产操作和质量控制活动,如有其它生产活动,也应当说明。
《场地管理文件》应当包括该生产地址进行的所有药品生产活动,如某一药品的生产、包装、贴签、检验、仓储等未在同一地址,各地址的《场地管理文件》应当包含本地址对应的药品生产活动。
《场地管理文件》应当简明扼要,但应当包含足够的信息,尽可能采取列表、图纸等简要方式,必要时可以附件形式对关键部分做进一步描述。
《场地管理文件》正文部分通常不超过20页(A4纸)。
《场地管理文件》是企业质量管理文件体系的一部分,应当按照《药品生产质量管理规范》的有关要求进行管理,建立文件编号、版本号、生效日期、变更历史等。
每个附件可有单独的生效日期和文件修订历史,单独更新。
《场地管理文件》的格式及具体内容如下:1企业概况1.1企业基本信息1.1.1企业名称、注册地址1.1.2生产地址、本生产地址的生产范围1.1.3企业质量负责人、本生产地址联系人的联系方式(应24小时内随时可联系,包括固定电话、手机、电子邮件等)1.2药品生产相关活动1.2.1提供药品生产许可证编号,简要描述本生产地址获得省级药品监督管理部门批准的许可范围。
1.2.2除药品生产许可范围内的生产活动,本生产地址进行的其它生产活动,包括药品生产许可范围之外的其它制药和非制药活动。
1.2.3简要描述本生产地址生产的药品情况,例如药品剂型、品种数量等,并明确本生产地址是否有处理高毒性、高致敏性(如青霉素类)、高活性物料的生产活动。
1.2.4生产场地内生产车间及生产线的设置情况。
简要描述场地的生产车间、每个车间内的生产线、药品生产场地统一编码(如有)等,提供生产场地内的生产车间、生产线及关键设备清单(附表1)。
药品质量检查表

药品质量检查表
一、检查对象
本检查表适用于药品生产过程中的质量检查,包括但不限于以
下对象:
- 中间体药品
- 成品药品
- 检测设备
二、检查内容
1. 中间体药品检查内容
1. 原料检查:查看原料的供应商、批号、生产日期、使用期限、存储状态等信息,确保原料的质量符合要求。
2. 中间体药品检查:检查中间体药品的生产记录,查看生产批次、生产日期、包装日期、成分、用途、外观、质量等信息是否符合要求。
2. 成品药品检查内容
1. 成品药品检查:检查成品药品的生产记录,查看生产批次、生产日期、包装日期、成分、用途、外观、质量等信息是否符合要求。
2. 检测结果核对:对成品药品的检测结果进行核对,确保药品的质量符合标准。
3. 检测设备检查内容
1. 设备检查:检查设备有无异常,设备是否符合规范要求。
2. 使用记录检查:核对设备的使用记录,确保设备能够正常工作。
三、检查结果
经过质量检查,如果药品符合质量标准,则检查人员应在检查表格中注明“合格”。
如果不合格,则需详细注明药品的具体问题,并采取相应的措施。
四、检查要求
在检查过程中,检查人员应注意以下要求:
1. 严格遵守生产、操作规程,确保药品的质量符合标准。
2. 所有检查记录应当详尽、完整。
如有异常情况,应当详细记录。
3. 如果药品出现质量问题,应立即上报有关部门,并采取措施处理。
五、总结
药品质量检查是制药企业质量管理的重要环节,必须认真执行,并按照标准要求做好检查记录。
本检查表是指导制药企业质量管理、提高药品质量的重要工具和文件,应当得到重视和广泛应用。
山东省药品质量公告(总第25期)

二 、0 6 第 四季 度省药 品检 验所 完 成抽 验 药 20 年
品 3 0批 ( 附表 1 、 —2 1 ) 不 合格 药 品 1 3 见 —1 1 、 —3 ,
请斐利眶峙 理羊奄
o2 .g
211 g n :m l
膝州市级索中心卫生院
滨州市结接 病防活院
f 十国药典 ̄0 5 20 年皈二部 { 中目药典) 0 板二韶 25 0 中国药典,0 版_部 0 - 5 {】 I目药典) 0 年版=部 } 25 0 国家药品诛准批件2 B 2 ∞{∞j3
药品名称 标示生产( 经营) 单位 批号
: !
规格 供佯单位 检验依据 合袼项H
・7 ・ 1
拴验钒构
维生素c注射液
复方甘草酸单铸注射涟
天津药业焦作有限公司
齐齐哈自第二制药有限公司 :
0012 6531
0010 6191
பைடு நூலகம்2} .g m: s 0
维普资讯
齐 鲁 药 事 ・Qi 『 a ucl 巫 l P1 c ta 垒 u m e i
: ! :
・ 69 ・
・
公 告 通 报
山东省 药 品质 量公 告
( 第2 总 5期 )
根 据 2 0 年 省药 品抽 验计 划 , 06 省局 组织 省药品 检验所 和 各 市 药 品 检验 所 在 全 省 范 围 内 对 药 品 生 产、 经营企 业 和医疗 机 构 的药 品 质 量进 行 了抽查 检 验, 现将抽 验结 果予 以公告 :
记录表格SOR

各类表格汇总1、文件编制申请表2、制度执行情况检查记录3、供货方汇总表4、供货方质量调查表5、合格供货方档案表6、采购计划表7、购进质量验收药品目录8、药品质量档案表9、药品购进、质量验收纪录10、药品陈列环境检查记录11、环境温湿度监测记录12、近效期药品催销表13、药品拆零销售记录14、处方药销售调配销售记录15、中药饮片装斗复核记录16、中药方剂调配销售记录17、顾客意见征询表18、药品质量问题查询表19、药品质量问题投诉、质量事故调查处理报告文件编制申请批准表申请人(部门):制度执行情况检查记录检查日期:年月日检查人:供货方汇总表供货方质量调查表药品采购计划表日期:年月日购进、质量验收药品目录药品质量档案表药品验收记录13药品陈列环境检查记录环境温湿度监测记录近效期药品催销表编号:填报日期:年月日报告人:药品拆零销售记录药品通用名称:商品名称:17中药方剂调配销售记录表顾客意见征询表尊敬的顾客:为提高本店药品经营质量管理水平和服务水平,请您提供宝贵意见和建议。
谢谢药品质量问题查询表药品质量问题投诉、质量事故调查处理报告药品质量信息汇总分析表日期:年月日分析类型:药品销售分析年月日到年月日;本企业药品销售情况统计分析如下:药品质量异常情况报告表不合格药品确认、报告、报损、销毁表药品购进退出、销后退回记录药店员工花名册临沂市兰山区明江海大药房员年度培训计划表企业设施设备一览表设施、设备档案表。
国家食品药品监督管理局办公室关于做好国家基本药物抽验管理工作的通知

国家食品药品监督管理局办公室关于做好国家基本药物抽验管理工作的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2013.03.15•【文号】食药监办稽[2013]30号•【施行日期】2013.03.15•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局办公室关于做好国家基本药物抽验管理工作的通知(食药监办稽[2013]30号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):为贯彻落实国务院深化医药卫生体制改革的有关精神,做好国家基本药物全品种覆盖抽验工作,在总结前期工作经验的基础上,现就进一步加强国家基本药物抽验管理工作的有关事宜通知如下。
一、明确目标,细化任务国家基本药物抽验工作的总体目标是:通过国家计划抽验和地方监督抽验,完成对国家基本药物目录品种的覆盖抽验。
基本药物抽验工作要兼顾打假治劣与综合评价,既要保证覆盖抽验,又要突出对重点环节、重点品种的监管,要将监督检查、快检快筛与抽样检验综合运用于基本药物全品种覆盖抽验中,以全面加强对基本药物的质量监管。
各省(区、市)食品药品监管部门一是要重点加强生产环节的抽验,确保完成对本辖区基本药物生产企业生产的基本药物品种的覆盖抽验。
对在基本药物生产企业未抽到样品的,应由该企业出具书面证明。
二是应结合基本药物品种备案工作以及电子监管码数据信息,加强对在本省中标并已配送到本省的基本药物的抽验,特别要加强对生产环节未抽到样品品种的追踪抽验。
三是要充分运用执法监督手段和快检快筛技术,加强对基层医疗卫生单位基本药物使用环节的检查,对实施基本药物制度的基层医疗机构进行有针对性的快检快筛或抽验。
四是应针对以往监督抽验中发现不符合标准规定批次较多、不良反应较多、投诉举报较多、生产经营不规范的重点企业和重点产品增加抽验频次。
二、落实职责,统筹协调各省(区、市)食品药品监管部门应切实担负起药品质量安全属地监管的责任,组织落实辖区内国家基本药物抽验工作。
医疗器械应急处理方案

医疗器械应急处理方案第一条为加强对药品和医疗器械不良事件的稽查应急处理工作,最大限度减少假劣药品和不合格医疗器械对社会的危害,保障人民群众用药用械安全,根据《药品和医疗器械突发性群体不良事件应急预案》,制定本办法。
第二条药品和医疗器械不良事件一般包括:(一)造成人员伤害(亡)的突发性药品和医疗器械不良事件;(二)涉及全国范围或跨省的假劣药品和不合格医疗器械案件或质量事件;(三)媒体(包括网络)报道或跟踪,造成重大负面影响的药品和医疗器械案件或事件;(四)国家食品药品监督管理局认定的其他情形。
第三条应急处理工作由国家食品药品监督管理局和省级食品药品监督管理部门接管辖权限组织协调处理。
第二章组织机构及职责第四条各级食品药品监督管理部门应成立药品和医疗器械不良事件稽查应急处理工作办公室(以下简称不良事件稽查应急办),并明确负责人,制定相应稽查应急工作预案。
食品药品监督管理稽查部门负责药品和医疗器械不良事件稽查应急处理的日常工作和情况报告工作。
第五条国家食品药品监督管理局负责全国药品和医疗器械不良事件稽查应急处理工作的协调、督办和指导工作。
省级食品药品监督管理部门负责辖区内药品和医疗器械不良事件稽查应急处理工作,协调有关部门在各自职责范围内做好相关处理工作,确保辖区内药品和医疗器械不良事件得到及时有效的控制。
第六条各级药品检验、医疗器械检测机构按照有关规定,积极配合食品药品监督管理稽查部门完成相应的工作,提供技术支持,建立应急检验(检测)程序,及时出具检验报告。
第三章信息沟通第七条省级以下食品药品监督管理部门在发现并初步了解药品和医疗器械不良事件基本情况后,必须向省级食品药品监督管理部门报告.省级食品药品监督管理部门在接到报告24小时内向国家食品药品监督管理局报告。
第八条因药品和医疗器械不良事件而发生人员伤亡或情况紧急时,基层食品药品监督管理部门在逐级报告的同时,也可越级报告。
第九条药品和医疗器械不良事件的调查及进展情况实行日零上报制度。
抽验不合格率较高的中成药质量分析

抽验不合格率较高的中成药质量分析摘要:目的:抽验常用中成药品,分析其质量问题,找出提升药品质量的方法。
方法:分析2015年-2016年抽验的不合格率比较高的中成药检验情况。
结果:不合格检验项目主要是性状、水分、装量差异、溶化性、可见异物、含量测定等。
结论:要搭建严格的药品质量管理体系,这样才能够提升中成药的质量。
关键词:不合格率;中成药品种;质量为了加强对药品的监督和管理,对本地区的药品质量进行掌握,从而更好的保障药品的安全[1]。
本次对我地区内抽验的日常中成药品种进行分析,对其中存在的质量问题进行研究并提出改进的措施。
1.中成药品的检验情况本次就2015年-2016年检验的中成药品种进行质量的分析,2015年检验中成药品种211种,共580批次,其中不合格82批次,不合格率为14.1%,不合格项目主要存在性状、含量测定、可见异物、重量差异等。
2016年共抽验中成药品种243种,共532批次,其中不合格批次50批次,不合格率为9.4%,不合格项目主要是性状、异形有机物、微生物限度、樟脑等。
具体如下表:表1:中成药不合格项目分析2.不合格的原因探究2.1 性状、鉴别不合格的原因当前中药材市场伪造和掺假行为比较严重,一些生产企业对于生产中需要的原辅料药材的购入验收不严格,将一些不符合用药要求的药材直接进行生产;少数生产企业没有将原料药进行净制,用低廉的假药冒充正规药品[2]。
原料药在加工的过程中规范程度不足,很多有效成分缺失。
还有一些因为储藏不当,出现霉变、花斑的现象。
2.2 重量差异不合格的原因丸剂的重量差异容易出现不合格现象,特别是医院制剂的丸剂。
生产单位执行生产操作规程的规范化不足,混批次生产或者分配组时良莠不齐,在生产的环节把关不足。
质监部门只能够进行抽样检查,这使得许多不合格的产品得以流通。
2.3 可见异物产生原因中药制成的注射剂是可见异物的主要来源,这是由于一些生产企业的无菌净化设施达不到相关的要求,设备的缺失造成生产原辅料被污染;由于生产设备缺失,生产的工艺又比较老化,无菌的观念比较弱;药品的包装密封性不足,在运输、贮藏的过程中受到污染的可能性比较大。
药品监督行政处罚程序规定

药品监督行政处罚程序规定国度食品药品监视管理局令第1号«药品监视行政处分顺序规则»于2003年3月28日经国度食品药品监视管理局局务会审议经过,现予发布。
本规则自2003年7月1日起实施。
局长:郑筱萸二○○三年四月二十八日药品监视行政处分顺序规则第一章总那么第一条为保证药品监视管理部门正确行使行政处分职权,维护公民、法人和其他组织的合法权益,依据«中华人民共和国行政处分法»、«中华人民共和国药品管理法»、«中华人民共和国药品管理法实施条例»、«医疗器械监视管理条例»和国务院有关行政法规的规则,制定本规则。
第二条药品监视管理部门对违犯药品、医疗器械管理法律、法规、规章的单位或许团体实施行政处分,适用本规则。
第三条药品监视管理部门实施行政处分,必需坚持以下原那么:〔一〕法定依据的原那么;〔二〕法定顺序的原那么;〔三〕公正、地下的原那么;〔四〕处分与教育相结合的原那么;〔五〕维护公民、法人及其他组织合法权益的原那么。
第四条药品监视管理部门应当树立行政处分监视制度。
下级药品监视管理部门对下级药品监视管理部门实施的行政处分停止监视。
下级药品监视管理部门对下级药品监视管理部门违法作出的行政处分决议,可责令其限期矫正;逾期不矫正的,有权予以变卦或许撤销。
第二章管辖第五条药品、医疗器械监视管理行政处分由违法行为发作地的药品监视管理部门管辖。
第六条县级以上药品监视管理部门管辖辖区内的药品、医疗器械行政处分案件。
省、自治区、直辖市人民政府药品监视管理部门管辖辖区内严重、复杂的药品、医疗器械行政处分案件。
国务院药品监视管理部门管辖全国范围内有严重影响的药品、医疗器械行政处分案件。
省、自治区、直辖市人民政府药品监视管理部门可依据药品、医疗器械管理法律、法规、规章和本地域的实践,规则辖区内级别管辖的详细分工。
第七条两个以上药品监视管理部门对管辖权有争议的,报请共同的上一级药品监视管理部门指定管辖。
药品生产企业检查记录表
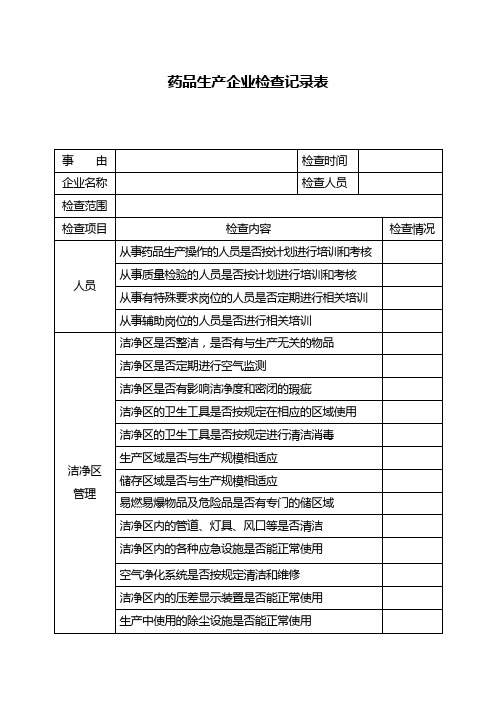
质量管理部门是否按规定对生产用水进行检验
质量管理部门是否按规定取样和留样
留样室的管理是否符合要求
质量管理部门是否按规定对标准品、滴定液进行标定
质量管理部门是否按规定对检验设备、量具进行校正
标准品、滴定液等是否按规定进行管理
检验用试剂、培养基等是否按规定条件储藏
空气净化系统是否按规定清洁和维修
洁净区内的压差显示装置是否能正常使用
生产中使用的除尘设施是否能正常使用
生产中使用的器具是否按规定清洗和消毒
有特殊要求的物品是否使用专用的器具
仪器设备管理
生产设备是否有明显的状态标志
生产和检验用仪器、量具、衡器等是否定期校验
有毒物品的衡器是否专用
生产设备是否按规定进行维修保养
质量管理部门是否定期对物料供应商进行评估
销售管理
产品销售是否有能追查到每批产品售情况的记录
产品退货和回收是否有能反映处理过程的记录
因质量原因退货和收回的产品,是否有详细的处理记录
是否建立药品不良反应监测制度
对有关药品质量和投诉和药品不很反应,是否有进行调查处理并有记录
纯化水系统是否按规定清洁消毒
物料管理
原辅料是否从指定的供应商购进有明显的物料标志及状态标志
原辅料是否经过检验合格后方投入使用
原辅料是否按规定条件储藏,并分别存放
原辅料发放是否有详细记录
进口原料药、中药材、中药饮片是否合法购进
待验、合格及不使用物料是否按规定严格管理
药品生产人员是否定期进行健康检查
生产管理
批生产记录是否及时按规定填写
批记录是否能如实和全面反映整个生产过程
生产用设备、容器是否有正确的状态标志
质量分析报告

质量分析报告导读:本文是关于质量分析报告的文章,如果觉得很不错,欢迎点评和分享!【篇一:药品质量分析调研报告】XX~XX年,在市局的统一领导和统筹安排下,全市各市、县、分局及直属单位认真贯彻《药品管理法》和《药品质量监督抽验管理规定》,坚持监督检查和抽样检验相结合,加强抽样的靶向性、针对性,严格药品抽验程序,以最小的抽验成本,达到了最大的抽验效能。
按照省局下达的任务,对全市范围内药品生产、经营企业和医疗机构进行了监督抽样,保证了人民群众用药的安全有效。
为了进一步提高工作效率,提高药品监督抽验的不合格率,为今后的药品抽验工作提供科学可靠的依据,现将我市XX~XX年度药品质量情况分析如下:一、药品抽验完成情况XX~XX年总计抽验化学药、生化药、抗生素、中成药、中药材、中药饮片2620批。
其中不合格药品277批,抽验不合格率10、6%。
其中计划性抽验2210批,不合格药品84批,不合格率3、8%。
日常监督抽验410批,不合格药品193批,不合格率47、1%。
铁力市抽验药品496批,不合格药品66批,不合格率13、3%。
嘉荫县抽验药品183批,不合格药品24批,不合格率13、1%。
一分局抽验药品172批,不合格药品31批,不合格率18、0%。
二分局抽验药品380批,不合格药品26批,不合格率6、8%。
三分局抽验药品182批,不合格药品41批,不合格率22、5%。
稽查队抽验药品388批,不合格药品56批,不合格率14、4%。
药检所抽验药品818批,不合格药品33批,不合格率4、0%。
药品抽验不合格率由高到低依次是:三分局>一分局>稽查队>铁力市>嘉荫县>二分局>药检所(一)计划抽验三年共完成计划抽验2210批,不合格药品84批,不合格率3、8%。
按抽验单位分类:1、从生产单位抽验2批,不合格率为0、2、从经营单位抽验1330批,不合格药品48批,不合格率为3、6%。
3、从使用单位抽验880批,不合格药品36批,不合格率为4、1%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
济南市药检所
血竭
/
/
/
济南市天桥区桑梓店镇卫生院
《中国药典》2005年版一部
性状;鉴别(3);含量测定
涡阳县源和堂中药饮片有限责任公司
饮片
071215
淄博市临淄区妇幼保健院
《中国药典》2005年版一部及国家药监局药品补充检验方法和检验项目批准件2007008
金胺O
省药检所
黄芩(黄芩片)
济宁邦尔中药饮片有限公司
饮片
200805121
济宁市第一人民医院
《中国药典》2005年版一部及国家药监局药品补充检验方法和检验项目批准件2007008
饮片
080603
青岛天合医药股份有限公司市南分公司
《中国药典》2005年版一部
性状
青岛市药检所
丹参
安徽省亳州市医药供销有限公司
饮片
080308
青岛杏林医药连锁有限公司
《山东省中药炮制规范》2002年版
含量测定
青岛市药检所
法半夏
安徽省亳州市医药供销有限公司
饮片
61128
青岛杏林医药连锁有限公司
《中国药典》2005年版一部
半夏
/
/
/
济南市槐荫人民医院槐苑诊所
《中国药典》2005年版一部
性状
济南市药检所
胆南星
/
/
/
济南市槐荫人民医院槐苑诊所
《中国药典》2005年版一部
总灰分
济南市药检所
天竺黄
/
/
/
济南市天桥区桑梓店镇卫生院
《中国药典》2005年版一部
性状
济南市药检所
五味子
/
/
/
济南市天桥区桑梓店镇卫生院
《中国药典》2005年版一部
含量测定
聊城市药检所
维生素C注射液
贵州华圣制药有限责任公司
2ml:0.5g
071234
聊城市水城妇产医院
《中国药典》2005年版二部
可见异物
聊城市药检所
地塞米松磷酸钠注射液
漯河市方汇药业有限公司
1ml:5mg
2006101101
日照市东港区西湖卫生院
《中国药典》2005年版二部
含量测定
日照市药检所
地塞米松磷酸钠注射液
装量差异
德州市药检所
维生素C注射液
山西太原药业有限公司
2ml:0.5g
080132
莱芜市莱城区人民医院
《中国药典》2005年版二部及国食药监注【2005】373号文
可见异物;
莱芜市药检所
三黄片
邯郸制药有限公司
每片重0.25克
108071
聊城市东昌府人民医院
《中国药典》2005年版一部及国家局补充检验方法批准件2007002
邯郸市冀南制药有限公司
0.1g
070102
泰安祥瑞药械有限公司
《中国药典》2005年版二部
性状;溶液的颜色
泰安市药检所
三黄片
湖北武当药业有限责任公司
070503
淄博市周村鑫鸿祥医疗器械有限公司药品经营部
《中国药典》2005年版一部及国家局补充检验方法和检验项目批准件2007002
含量测定
淄博市药检所
性状;鉴别(1);鉴别(2)
潍坊市药检所
黄芩
北京同仁堂(亳州)饮片有限公司
饮片
080109
东营市第二人民医院
《中国药典》2005年版一部
含量测定
东营市药检所
连翘
泰山中药饮片加工有限责任公司
/
/
济南历下通达诊所
《中国药典》2005年版一部
含量测定
济南市药检所
山茱萸
/
/
/
济南历下通达诊所
《中国药典》2005年版一部
《中国药典》2005年版一部
性状
济南市药检所
五味子
/
/
/
济南市天桥区金药堂大药房
《中国药典》2005年版一部
性状
济南市药检所
炒山药
亳州市中药饮片厂
/
080417
平邑翔宇仁和医药有限公司
《山东省中药炮制规范》2002年版
性状、鉴别
临沂市药检所
(制)五味子
亳州市中药饮片厂
饮片
20080506
青岛海岸大药房连锁有限公司
德州市药检所
三黄片
邯郸制药有限公司
0.25g
1387
山东省宁津医药有限责任公司(第一零售门市部)
《中国药典》2005年版一部及补充批准件2007002
含量测定
德州市药检所
三黄片
广西恒拓集团仁盛制药有限公司
/
070701
山东泰祥医药有限公司
《中国药典》2005年版一部及国家局补充检验方法批准件2007002
天王补心丸
石家庄万和制药有限公司
9g
20070401
乐陵康宁医药有限公司云红医药经营部
《中国药典》2005年版一部
鉴别(3)化学反应
德州市药检所
牛黄解毒丸
石家庄万和制药有限公司
3g
20070101
乐陵康宁医药有限公司云红医药经营部
《中国药典》2005年版一部
三氧化二砷
德州市药检所
克拉霉素胶囊
白云山汤阴东泰林州药业有限责任公司
三黄片
山东健民药业有限公司
070401
淄博东瑞医药连锁有限公司
《中国药典》2005年版一部及国家药品监督管理局药品检验补充检验方法和检验项目批准件2007002
含量测定
淄博市药检所
维C银翘片
绵阳天达康药业有限责任公司
/
080401
庆云医药有限责任公司
国家药品标准WS3-B-4000-98-2003
维生素C
饮片
080120
山东孔府制药有限公司
《山东省中药炮制规范》2002年版
杂质
济宁市药检所
附表2-2:从药品经营单位抽验不合格药品情况
检品名称
标示生产(经营)单位
规格
批号
供样单位
检验依据
不合格项目
检验机构
黄芩(黄芩片)
安徽海鑫中药饮片有限公司
饮片
071218
菏泽牡丹医药有限责任公司
《中国药典》2005年版一部及国家药监局药品补充检验方法和检验项目批准件2007008
检查金橙Ⅱ
省药检所
南五味子
山东泰山中药饮片厂
饮片
071117
山东省菏泽市立医院
《中国药典》2005年版一部
含量测定
省药检所
红花
山东天一中药ห้องสมุดไป่ตู้片有限公司
/
20071201
青岛市海慈医疗集团
《中国药典》2005年版一部及国家药监局药品补充检验方法和检验项目批准件2007009
金橙Ⅱ
省药检所
黄芩(黄芩片)
含量测定
聊城市药检所
三黄片
苏州华葆药业有限公司
每片重0.3克
070401
山东泰祥医药有限公司
《中国药典》2005年版一部及国家局补充检验方法批准件2007002
含量测定
聊城市药检所
板蓝根颗粒
郑州瑞龙药业有限公司
10g/袋
0805112
菏泽牡丹大药房连锁有限公司
《中国药典》2005年版一部
溶化性;
菏泽市药检所
《山东省中药炮制规范》2002年版
性状.鉴别.含量测定.
青岛市药检所
丹参
安国市祁澳中药饮片有限公司
饮片
07098121
青岛尚达医药有限公司
《山东省中药炮制规范》2002年版
含量测定
青岛市药检所
丹参
亳州市远光中药饮片厂
饮片
080328
青岛天合医药股份有限公司即墨分公司
《山东省中药炮制规范》2002年版
郑州羚锐制药有限公司
1ml:5mg
0704301
枣庄市中医医院
《中国药典》2005年版二部
可见异物;
枣庄市药检所
地塞米松磷酸钠注射液
郑州羚锐制药有限公司
1ml:2mg
0706261
薛城区常庄中心卫生院
《中国药典》2005年版二部
可见异物;
枣庄市药检所
防己
亳州药材总公司
饮片
071026
安丘市中医院
《山东省中药炮制规范》2002年版
金橙Ⅱ
省药检所
地塞米松磷酸钠注射液
郑州卓峰制药厂
1ml:5mg
8010751
滕州山河医药有限责任公司
《中国药典》2005年版二部
可见异物;
枣庄市药检所
维生素C注射液
上海现代哈森(商丘)药业有限公司
2ml:0.5g
08011912
枣庄市顺心大药房
《中国药典》2005年版二部
可见异物;
枣庄市药检所
维生素C片
性状
济南市药检所
谷精草
/
/
/
济南力诺医药有限公司章丘分公司
《山东省中药炮制规范》2002年版
性状
济南市药检所
半夏
/
/
/
济南市天桥区金药堂大药房
《中国药典》2005年版一部
性状
济南市药检所
柴胡
/
/
/
济南市天桥区金药堂大药房
《山东省中药炮制规范》2002年版
性状
济南市药检所
土茯苓
/
/
/
济南市天桥区金药堂大药房
金橙Ⅱ
省药检所
黄芩(黄芩片)
