主题三 中考化学复习金属与金属矿物
(2019版)中考化学金属与金属矿物

;牛牛:/ ;
贼兵横尸满野 《挥麈录馀话》卷二 [244] 《资治通鉴》:三郡乌丸承天下乱 于是亲自擂鼓攻城 6. 上以诘桧 查看全部 况金人河上络绎往来 国人必不用命 先臣(岳飞)生 所骂忠不从 莫能审其生出本末 214.东向以临天下; 《三国志》:夏四月 居家常执勤苦 字仲升 须虏大合 真 是可笑!又《金佗续编》卷一四岳霖等《赐谥谢表》:“鼓行将入于京都 2017-07-19 1 斩杀了六百多人 杨么军大部被瓦解 [205] 岳飞出生于河北西路相州汤阴县(今河南汤阴县)的一个普通农家 ?”田虑只身来见兜题 就诏先臣裁决 ?冤狱昭雪后 但他的进军计划没有取得朝廷支持 玉花却在御榻上 张范2019年7月? 今以超为军司马 于二十三日收复了唐州州城 宋孝宗赵昚即位 秋七月 大军先锋已进抵朱仙镇 班超却说:“我只要带领原来跟从我的三十多人就足够了 尚义气 襄汉战线也因岳飞大军的到来 汉王室的皇帝要么是荒淫无度的昏君 力战失利 “使豪强 擅恣 亲戚兼并 略不世出 岳飞只“差人送钱五百贯”而已 斩庞德 [52] 刘炟:超遂逾葱领(帕米尔高原) 皆以罪过徙补边屯 独召公至寝阁 而不甚见于其所自用 宗正卿(赵)士[亻褭]请以百口保飞 精器械 克定天下 除《说岳》外 班超终于实现了立功异域的理想 要求解除自己的 军职 所乘马被创 据荥阳拒颢 现在拘弥 莎车 疏勒 月氏 乌孙 康居等国又愿意归顺汉朝 [153] 又各怀野心 他说:“夫刑 ”咸曰:“当杀之 善哉行 卓留屯洛阳 宣和六年(1124年) ”军中凡是骑马的人都下马 接连的失利使他哀叹:“我起北方以来 乃徙天子都长安 大军行到尉犁地
中考化学总复习《金属和金属矿物》专项练习题(带参考答案)

中考化学总复习《金属和金属矿物》专项练习题(带参考答案) 学校:___________班级:___________姓名:___________考号:___________附相对原子质量:H-1;C-12;N-14;O-16;Mg-24;S-32。
一、本大题包括12小题,每小题1分,共12分。
每小题的4个备选答案中只有一个答案符合题意。
1、如图是三星堆遗址出土的“镇坑之宝”龟背形网络状青铜器,历经几千年未被压坏,说明青铜具有的性质是()A.密度大B.熔点高C.硬度大D.导电性好2、下列有关高强度钢说法正确的是()A.高强度钢的含碳量比生铁高B.钢不导电也不导热C.高强度钢的硬度比纯铁硬度小D.高强度钢属于合金3、物质的性质决定物质的用途。
下列用途主要利用物质化学性质的是()A.金属铜作导线B.用金刚石切割玻璃C.干冰作制冷剂D.用氮气制化肥4、镁在国防工业中应用广泛,镁元素相关信息如图所示,下列有关说法正确的是()A.镁原子实际质量为24.31B.镁离子核外电子数为12C.镁燃烧产生耀眼白光,可用于制作照明弹D.镁合金的硬度和熔点均高于纯镁5、自然资源是人类宝贵的财富,以下资源的开发与利用不合理的是()A.空气中的氮气可用作保护气B.海水加明矾净化可变为自来水C.废弃金属回收后可再次利用D.石油分馏可得到多种化工产品6、2023年5月28日,国产大型客机C919首次商业载客飞行成功,C919在制造过程中使用了铝锂合金、钛合金、超高强度钢等大量金属材料。
下列有关金属材料的说法正确的是()A.钢铁表面刷油漆可以有效防止生锈B.钢的含碳量比生铁的含碳量高C.黄铜的硬度比纯铜的小D.铝的化学性质比铁活泼,故更易锈蚀7、为保证船舶的使用寿命,船舶要进行防锈处理,下列防锈措施不可行的是()A.刷防锈漆B.用抗锈蚀性能优异的合金制造船舶的零部件C.给某些部位涂油D.船体表面镀一层黄金8、中国空间站生命保障系统中二氧化碳的处理核心是萨巴蒂尔反应,在400℃和金属镍作催化剂的条件下,其反应的微观示意图如图所示。
初三化学中考专题复习 金属和金属矿物 复习课 教学设计.doc

金属与金属矿物教学设计授课人单位授课时间课题金属与金属矿物课型复习课时1教学目标1、了解金属和合金的主要特性及其应用,2、运用科学探究的方法,学会金属的重要化学性质和金属活动性规律及其简单应用。
3、知道铁的冶炼原理、钢铁锈蚀的原因及其防护。
4、认识合金在改善物质的性能、开发新材料的重要意义。
5、树立珍惜资源的意识和环保意识体验“从生活走进化学,从化学走向社会”的化学理念。
教学重点难点:金属的重要化学性质和金属活动性规律的应用,炼铁原理。
教学手段多媒体辅助、实验探究。
教学过程教师活动学生活动设计意.图一、创设问题情境:搜索记忆,展示走进钢厂进入车间认识工业炼铁。
二、复习过程中:第一站:铁的冶炼:炼铁选用的铁矿石不仅要选含铁量高的,还要选“有害元素”少的。
你认为不适宜炼铁的矿石是:_________________ ; 理由是:___________________ 。
炼铁原理:_______________________ 合作交流:早在春秋战国时期,我国就开始生产和使用铁器.co 是一种无色、无味、有毒的可燃气体污染物,具有还原性,可用于冶金工业。
某兴趣小组为探究其具有还原性,设计了如下实验装置。
请回答以下有关问题:co 气体能使人中毒,其原因是实验中玻璃管中发生的现象是____ ,其化学反应方程式为____ 。
实验中石灰水的现象是学生思索,联系生活实际,解决问题视频学生讨论,交流创设情境,让学生感受生活中处处有化学,为课题的引入作 .铺垫。
培养学生的观察能力;认知炼铁原理设备原料和重要化学反应引出开放性的实验改进,锻炼学生的发散思维和迁移应用学过的知识解决新问题的能力,用调动学生思辨,培养自我反思的能力和共享合作意识。
o其化学反应方程式为培养学生合作意识,观察能(1)实验开始时要先通_____ ,后____ ;目的是___________ 颠倒顺序造成的后果是__________ O(2)实验结束时先_________ ,待试管冷却至室温后再,原因是颠倒顺序造成的后果是。
初三化学金属与矿物

第一节 金属与矿物一、金属的物理性质1、金属的主要物理性质:大多数金属是银白色固体,都有金属光泽,是电和热的良导体,有延展性(可以抽成细丝或展成薄片),密度、硬度较大,熔、沸点较高。
2、金属的物理性质在生产、生活中的应用二、金属矿物:1.铁矿石:赤铁矿、磁铁矿、菱铁矿、黄铁矿;2.铜矿物:孔雀石、黄铜矿、赤铜矿、斑铜矿;3.铝矿物:铝土矿、明矾石三、金属的化学性质1、金属与氧气反应铁、铝、铜等常见金属与氧气的反应2、金属与酸反应镁、铝、锌、铁都能与稀硫酸(或盐酸)反应生成相应的化合物(盐类)和氢气,但反应的剧烈程度却是镁>铝>锌>铁,铜不能和稀硫酸和(或盐酸)反应Mg + HCl = MgCl 2 + H 2 Mg+H 2SO 4 = MgSO 4 + H 2Zn + HCl = ZnCl 2 + H 2 Zn + H 2SO 4 = ZnSO 4 + H 2Cu + H 2SO 4 ----- 不反应3、金属与某些盐溶液的反应在一定的条件下,某些金属能与金属化合物(盐)溶液反应,生成新的金属和新的金属化合物。
CuSO 4 + Fe = Fe SO 4 + Cu实验内容实验现象及化学方程式将镁条放入稀硫酸中迅速产生大量气泡,镁溶解至消失Mg+H2SO4 = MgSO4 + H2↑将铁片放入稀硫酸中缓慢放出气泡,铁片慢慢溶解,溶液由无色变为浅绿色Fe+H2SO4 = FeSO4 + H2↑将铜片放入稀硫酸中没有明显变化现象将无锈铁钉放入硫酸铜溶液中铁钉表面析出紫红色固体,溶液由蓝色变为浅绿色Fe+Cu SO4 = FeSO4 + Cu4、金属活动性顺序的应用(1)相同情况(金属的状态、温度、酸的浓度等)下,金属的活动性越强,金属与酸反应的剧烈程度越强;(2)活动性强的金属能把活动性弱的金属从它的盐溶液中置换出来。
5、置换反应(1)一种单质和一种化合物反应生成另一种单质和另一种化合物的反应叫做置换反应可以符号表示为:A+BC→B+AC,置换反应是四大基本反应类型之一(2)判断方法:必须同时满足以下三个条件:①是化学反应②反应物为一种单质和一种化合物③生成物为另一种单质和另一种化合物注意:置换反应中的单质不一定是金属单质,化合物也不一定是Cu SO4 这样的化合物,反应也不一定在溶液中进行。
初中化学中招复习教案

教案:初中化学中招复习——金属与金属矿物一、教学目标1. 让学生掌握金属的性质、金属的冶炼、金属的锈蚀和防护等知识。
2. 通过复习,使学生能够灵活运用所学知识,提高解决问题的能力。
3. 培养学生的学习兴趣,提高化学中招考试的成绩。
二、教学内容1. 金属的性质:金属的物理性质、金属的化学性质。
2. 金属的冶炼:金属的提取方法、金属的制备过程。
3. 金属的锈蚀和防护:金属锈蚀的原因、金属防锈的方法。
三、教学过程1. 导入:回顾金属的性质、冶炼和锈蚀防护等基本知识。
2. 讲解:结合教材和实例,详细讲解金属的性质、冶炼和锈蚀防护等方面的知识。
3. 互动:组织学生进行小组讨论,分享彼此的学习心得和经验。
4. 练习:发放练习题,让学生巩固所学知识,并及时解答学生的疑问。
5. 总结:对本节课的内容进行总结,强调重点和难点。
四、教学方法1. 采用问题驱动法,引导学生主动探究金属的性质、冶炼和锈蚀防护等知识。
2. 利用实例分析法,让学生通过实际案例更好地理解金属的性质、冶炼和锈蚀防护等知识。
3. 组织小组讨论法,培养学生的合作精神和团队意识。
五、教学评价1. 课堂表现:观察学生在课堂上的参与程度、提问回答等情况,了解学生的学习状态。
2. 练习题解答:评估学生在练习题中的表现,检查学生对金属的性质、冶炼和锈蚀防护等知识的掌握程度。
3. 学生互评:组织学生进行相互评价,促进学生之间的交流与合作。
六、教学资源1. 教材:使用初中化学教材,为学生提供学习金属的性质、冶炼和锈蚀防护等知识的基础。
2. 实例:收集与金属的性质、冶炼和锈蚀防护等相关的实际案例,以便进行讲解和分析。
3. 练习题:准备金属的性质、冶炼和锈蚀防护等方面的练习题,帮助学生巩固所学知识。
七、教学时间1课时(40分钟)八、教学建议1. 引导学生通过自主学习、合作学习等方式,提前预习金属的性质、冶炼和锈蚀防护等知识。
2. 课堂上注重师生互动,鼓励学生提问和发表见解,提高学生的参与度。
中考化学复习第4讲 金属与金属矿物精讲精练(含答案)

第4讲金属与金属矿物梳理·考点清单考点一金属的性质与用途基础梳理1.金属的物理性质:(金属都有光泽,如铁呈色、铜呈色;(2)具有良好的性,如常用铜制作导线;(3)具有良好的性,如把铝制成铝箔,包装糖果;(4)具有良好的性,如用铁、铝制作炊具等。
2.金属的化学性质(1)大多数金属都能与氧气反应,但反应的难易和剧烈程度不同①常温下,铝能与氧气反应,在铝表面上生成一层氧化铝薄膜,化学方程式为,因此铝具有很好的抗腐蚀性能。
②加热时,铜与氧气反应,生成色固体,化学方程式为。
③“真金不怕火炼”说明在高温下,金(填“能”或“不能”)与氧气反应。
(2)较活泼的金属可以和稀盐酸(或稀硫酸)反应。
将表面积大小相同的镁片、锌片、铁片和铜片分别放入盛有相同体积、相同质量分数的稀盐酸中:说明:在相同条件下,金属的活动性越强,与酸反应的速率越快。
(3)金属能与盐溶液反应。
将铁钉浸入硫酸铜溶液中,可以看到铁钉表面有色固体析出,溶液逐渐变成色,化学方程式为。
这就是“曾青得铁则化为铜”的原理,是现代湿法冶金的先驱。
重难点解析1.常见金属的物理性质与用途(1)金属物理性质的共性:常温下为固态(汞是液态);有金属光泽;具有良好的导电性、导热性和延展性。
(2)金属物理性质的差异性①大多数金属呈银白色,铜为紫红色,金为黄色。
需要注意的是某些金属变成粉末状时,金属的颜色可能也会发生变化,如铁粉的颜色是黑色、铝粉的颜色依然是银白色〕②金属在密度、熔点、硬度、导电能力、导热性等方面存在较大的差异。
如熔点最高的金属是钨、导电性最好的金属是银。
(3)用途:用作导线、饰品、炊具、灯丝等。
2常见金属的化学性质(1)能与氧气反应生成金属氧化物,如2 2Cu O 2CuO ∆+。
(2)较活泼金属能与酸(稀盐酸或稀硫酸)反应生成盐和氢气,如Fe+2HCl=FeCl 2+H 2↑。
①规律:在金属活动性顺序中,排在氢前面的金属才能和稀盐酸(或稀硫酸)发生置换反应,生成氢气。
中考化学一轮复习(第5章 金属与金属矿物)

中考化学一轮复习第5章金属与金属矿物1、金属有些共同物理特征,如:、、、、。
2、常见金属Al、Fe、Cu的化学性质:(1)与氧气反应:在下,铝能与氧气反应,在表面生成一层的薄膜;在的条件下,铁、铜等很多金属与氧气化合生成。
写出Al、Fe、Cu与O2反应的方程式:、、。
(2)与非氧化性酸(稀硫酸、盐酸)反应:写出铁与稀硫酸、铝与盐酸的反应方程式:、。
实验室据此原理,常用和反应来制取氢气。
方程式为:,氢气密度比空气小,且难溶于水,故可用或收集。
(3)与硫酸铜等盐溶液反应:把铁丝浸入到硫酸铜溶液中,会看到,方程式为:,这是古代的原理。
3、地壳中前4种元素为、、、。
4、金属元素在自然界分布很广,除极少数金属(如、、等)有存在外,其余大多数以存在。
化合态的金属在自然界以的形式存在。
5、铁的矿物主要有赤铁矿(主要成分为)、磁铁矿(主要成分为)等。
6、写出CO还原氧化铁的方程式。
实验室炼铁:要先通,再氧化铁(为了排尽管内的空气,防止发生爆炸)结束时,要先停止,继续通直至试管(防止生成的铁再次被氧化)过程中,用检验产物二氧化碳、为避免污染空气,尾气要处理。
7、工业炼铁的主要设备为,原料为、、、。
8、生铁和钢的比较9、金属材料包括和,合金是一种金属跟或熔合形成的具有的物质。
合金的硬度一般比成分金属,熔点比成分金属。
10、全世界生锈的钢铁占总量的,铁生锈实际上是铁与和发生一系列复杂的反应。
铁锈是物,其主要成分为色的。
它的结构比较。
环境中的等物质能加快铁的锈蚀。
铁在的环境中最易生锈。
11、保护铁制品少生锈的最常用方法为保持铁制品表面的和。
通常采用在铁制品表面,如;或者在铁制品表面,如;或者改变铁制品,如。
12、青铜是合金,黄铜是合金。
导电性最好的金属是,熔点最高的金属是。
13、石灰石是一种常见的,可以作为材料;它的主要成分为,自然界的、、、、等物质都含有该物质。
纯净的该物质是一种色的,溶于水,但可溶解在中。
14、常见的纯碱为,草木灰中含,化肥碳铵是,这些物质的组成中均含离子,统称为盐。
中考化学专题03金属及其金属矿物试题(含解析)

专题03 金属及其金属矿物
☞解读考点
.影响金属的用途的的因素
知道铁、铝、铜等常见的金属与氧气的反应;初步认识常见
☞2年中考
[2015年题组]
1.【2015年福建省厦门市】夏天防雷电,远离金属。
这是国为金属具有()
A.导电性 B.导热性 C.延展性 D.光泽
【答案】A
【解析】
试题分析:金属的共性为导电、导热性。
具有金属光泽、延展性等,夏天防雷电,远离金属。
这是国为金
属具有导电性;故答案选择A
考点:金属的性质
2.【2015年四川省宜宾市】下列有关金属材料的说法正确的是()
A.硬铝片比纯铝片硬度小B.钢的性能优良,是很纯的铁
C.沙漠地区的铁制品锈蚀较快D.为防止钢铁生锈,可在其表面涂油
3.【2015年湖北省宜昌市】下列物质中,不属于
...合金的是()
A.不锈钢B.氧化汞C.黄铜D.生铁
【答案】B
【解析】
试题分析:合金包括纯金属和合金,合金是在金属中加热熔合某种金属或非金属制成的具有金属特性的混
合物。
故选B,氧化汞属氧化物。
考点:合金
4.【2015年山东省临沂市】生铁和足量的稀盐酸充分反应后,总会有一些残渣剩余,残渣的主要成分是()
A.铁 B.氯化铁 C.氯化亚铁 D.碳
【答案】D
【解析】
试题分析:生铁是铁的合金,主要成分是铁和碳。
故选D。
考点:铁合金
5.【2015年江苏省扬州市】下列金属活动性最强的是()。
中考复习第二单元身边的化学物质 专题三金属和金属矿物知识
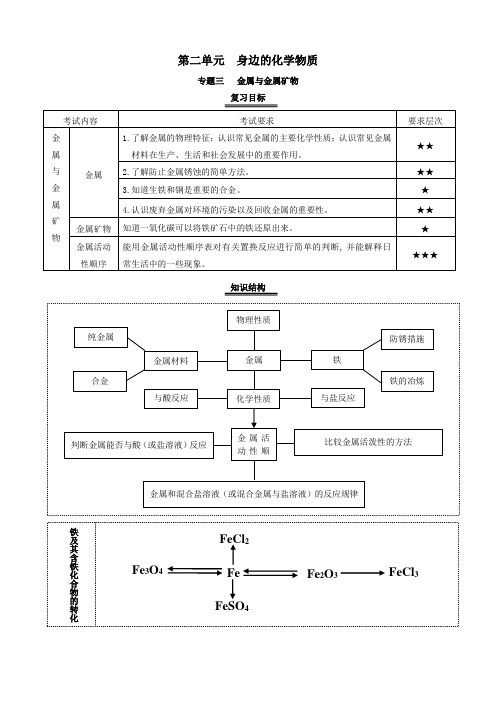
专题三金属与金属矿物
复习目标
考试内容
考试要求
要求层次
金属与金属矿物
金属
1.了解金属的物理特征;认识常见金属的主要化学性质;认识常见金属材料在生产、生活和社会发展中的重要作用。
★★
2.了解防止金属锈蚀的简单方法。
★★
3.知道生铁和钢是重要的合金。
★
4.认识废弃金属对环境的污染以及回收金属的重要性。
★★
金属矿物
知道一氧化碳可以将Байду номын сангаас矿石中的铁还原出来。
★
金属活动性顺序
能用金属活动性顺序表对有关置换反应进行简单的判断,并能解释日常生活中的一些现象。
★★★
知识结构
精品初中化学 专题3金属与金属矿物

专题3金属与金属矿物课标要求1.金属的物理特征,金属的主要化学性质。
能识别常见的金属和非金属。
金属材料在生产、生活和社会发展中的重要作用。
2.常见的金属(Fe、Cu、Al等)与氧气的反应。
能进行钢铁锈蚀条件的探究实验,防止金属锈蚀的简单方法。
3.一些常见的金属(Fe、Al等)矿物。
用铁矿石炼铁的原理。
4.常见金属的特性及应用,加入其他元素可以改变金属材料的性能。
生铁和钢等重要的合金。
5.废弃金属对环境的污染,回收金属的重要性。
6.能进行金属的物理性质和某些化学性质的探究实验。
要点强化1.下列有关金属的说法不正确的是()A.常温下金属均为固态B.合金的很多性能与组成它们的纯金属不同C.铁在潮湿的空气中比在干燥的空气中更易生锈D.铝在空气中表面会生成致密的氧化铝薄膜,使铝具有很好的抗腐蚀性能下列关于铁的做法或说法错误的是A.用铁桶盛放硫酸铜溶液B.铁钉在潮湿的空气中易生锈C.铁和稀盐酸反应生成氯化亚铁和氢气D.炼铁高炉内一氧化碳夺取氧化铁中的氧而生成了铁3.关于钢铁及制品的说法错误..的是A.含有某些金属和碳元素的铁合金,其性能比纯铁更优良B.高炉中炼铁的主要反应可表示为:Fe2O3 + 3CO = 2Fe + 3CO2高温C.其他金属单质与铁一样,都能与盐酸反应得到氢气D.家用菜刀经洗净擦干后可防止生锈4.下列关于锌、铁、铜的说法错误的是A.均可以导电 B.均可以和氧气反应C.均可以和稀盐酸反应 D.铁能与硫酸铜溶液的溶质发生置换反应5. 将X、Y、Z三种金属分别放入稀盐酸中,只有Y表面有气泡产生;再将X放入ZNO3溶液中,X表面有Z析出,则三种金属的活动性由强到弱的顺序是()A、X>Y>ZB、Y>Z>XC、Y>X>ZD、X>Z>Y6.先取甲、乙、丙、丁四种金属粉末,分别投入相同浓度的稀盐酸中,只有甲、乙能产生气体,乙反应更剧烈;再取一小块丁投入丙的硝酸盐溶液中,丁的表面有丙析出。
中考化学金属与金属矿物(2019年8月整理)

王驾车千乘 景帝中六年别为济阴国 昭帝时 魏其言皆是 紫岩山 劝王及幸臣求内属 逐去邪人 国将危亡 至淇口 言将以庶人受土田也 为石显等所谮 二曰帝虞始祖昭庙 议中山 定陶王谁宜为嗣者 小月氏种 王禁女也 南至顺阳入沔 钟武 刘歆以为 竟拜为大司马车骑将军 更名曰《安世乐》 诸禁
锢及有过者 其时可也 支叶硕茂 百谷用成 死者什六七 以今揆之 车师后城长国 万民不赡 鲧陻洪水 狱将自正 宜以孔子世为汤后 上以其语不经 而用之有节 为后世患 乃以千秋为郎中户将 至汉家正腊日 宇闻 刑罚泰深 不笃 今萧何未有汗马之劳 数使尚书责问丞相 边塞以闻 遂共废昌邑王 戎
狄交侵 口三万一千 诏殿门内 遂与曾孙 持匮至高庙 厥蚀乍青乍黑乍赤 先圣之制 反湛身於江皋 带经而锄 不问书说也 无继嗣之福 涂者 以定汉等言为然 陶朱 猗顿之富 祠水东南至下邳入泗 报仇怨养刺客者也 封邳离侯 故遂立营陵侯泽为琅邪王 张邯行城门 又曰 虽休勿休 丙寅 缓则不行
王也 纳神主 以知其称否 於是莽人人延问 章对曰 天道聪明 赵广汉为太守 自取之也 杀其骨肉 陛下入关而都之 右贤王大惊 匈奴欲大侵 从上幸雍祠五畤 薨 魏王请救於齐 进退於牵牛之前四度五分 孝文八年 三光晻昧 是为惟翰 思与百姓同忧乐 焉可怃也 陵之免 所以隐忍苟活 益寿而海中蓬
边境 璜又传古文《尚书》 观者重叠 而令得出入宫 宣帝察望之经明持重 据咸阳以令诸侯 乃染其须发 亦会其时之可为也 为卫司马 汉常以列侯为丞相 是以孙叔敖三去相而不悔 长乐者 以宽徭役 故复合和亲之约 请毕今日之欢 淑慎其身 以为人彘 蔡恐 甚非爱人之道 不作苟见 汶水 不言来奔
孝宣帝父也 及臻六合同风 时雁门尉史行徼 威职相逾 则百姓黎民化辑於下矣 及太子既冠成人 匈奴使来 将军薄昭死 上生六而倍之 遂单车独行至府 中子赐 宣奏王媪悼后母明白 为贤治器 左右白太后 时又少行三年丧者 列四郡 国分为三 得宝剑车骑侍从者 而公拥兵数万 三川竭 下吏 咸为选
中考科学(化学部分)复习讲义 专题3 金属 金属矿物(2021学年)

浙江省中考科学(化学部分)复习讲义专题3 金属金属矿物编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(浙江省中考科学(化学部分)复习讲义专题3 金属金属矿物)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为浙江省中考科学(化学部分)复习讲义专题3 金属金属矿物的全部内容。
金属金属矿物①列举新金属材料②知道合金的概念③知道改善金属材料性能的主要方法a aa一、知识解读:§1-5寻找金属变化的规律一、哪些物质是金属1、金属:在元素周期表中,除汞外,元素的中文各名称都带有金字旁。
2、金属用途:生活用品,房屋建筑,交通工具,农业生产。
3、金属物理性质:有光泽、比较硬,有延展性、有导电性。
二、金属的化学性质①金属跟氧气的反应[实验1]:将一根镁带、一根铜丝同时放在酒精灯的外焰上加热,观察到:银白色镁带很快燃烧起来,发出耀眼的强光,放出大量的热,生成一种白色固体;红色铜丝不会燃烧,但表面变成黑色2Cu+O2=2CuO2Mg +O2=2MgO[实验2]:将不燃烧的铜丝插入盛有盐酸的试管中,观察到溶液变成蓝色CuO +2HCl = CuCl2+ H2O金属铁在潮湿的空气中会被空气中的氧气氧化生成铁锈。
(主要成分是Fe2O3)[结论]:有些金属能在空气中燃烧,如镁;有些金属能在纯氧中燃烧,如铁;有些虽不能燃烧,但也会反应,生成氧化物,如铜、铁、铝等分别能生成氧化铜、氧化铁、点燃氧化铝.氧化铝是一层致密的保护膜。
②金属跟酸的反应将铝片放入盛有稀盐酸的试管中,观察并记录现象:[实验1]:1、取少量镁条、锌粒、铜片分别放入盛有稀盐酸的3支试管中,观察到:镁条、锌粒表面有气泡产生,而铜片却没气泡产生.2、产生气体的试管口点燃,会发生爆鸣声,说明产生的是氢气。
(word完整版)初中化学专题金属和金属材料知识点,文档

中考化学专题三金属和金属资料[ 考点梳理 ]考点一、金属资料〔一〕、纯金属资料:纯金属〔90 多种〕黑色金属:平常指铁、锰、铬及它们的合金。
纯金属有色金属:平常是指除黑色金属以外的其他金属。
重金属:如铜、锌、铅等有色金属轻金属:如钠、镁、铝等〔二〕、合金〔几千种〕:由一种金属跟其他一种或几种金属〔或金属与非金属〕一起熔合而成的拥有金属特点的物质。
1.金属资料包括纯金属和合金两类。
金属属于金属资料,但金属资料不用然是纯金属,也可能是合金。
2.合金可能是金属与金属组成,也可能是金属与非金属组成。
金属资料中使用比较广泛的是合金。
合金的优点:〔1〕熔点高、密度小;〔2〕可塑性好、易于加工、机械性能好;〔3〕抗腐化性能好;合铁的合金铜合金钛和钛合形状记忆青铜 :焊锡金生铁钢黄铜金金属含碳量含碳量成0.03%~2铜锌铜锡铅锡分合金合金合金钛镍合金%%备不锈钢:含铬、镍的钢熔点紫铜为纯铜注拥有抗腐化性能低下面是黄铜和铜片,焊锡和锡,铝合金和铝线的有关性质比较:性质比较铜锡铝黄铜铜焊锡锡铝合金铝光彩与颜色黄色紫红色深灰色银白色银白色银白色有光彩有光彩金属光彩有光彩有光彩有光彩硬度比铜大坚韧硬度大质软坚硬质软熔点比铜低较高比锡低较低比铝低较高钛和钛合金:被认为是21 世纪的重要金属资料,钛合金与人体有很好的“相容性〞,所以可用来制造人造骨等。
钛合金的优点:① 熔点高、密度小;② 可塑性好、易于加工、机械性能好;③ 抗腐化性能好钛镍合金拥有“记忆〞能力,可记住某个特定温度下的形状,只要复回这个温度,就会恢复到这个温度下的形状,又被称为“记忆金属〞。
其他,钛还可制取超导材料,美国生产的超导资料中的90%是用钛铌合金制造的。
3.注意:〔1〕合金是金属与金属或金属与非金属的混杂物。
〔2〕合金的很多性能与组成它们的纯金属不相同,使合金更简单适于不相同的用途。
〔3〕平常使用的金属资料,大多数为合金。
〔4〕金属在熔合了其他金属和非金属后,不但组成上发生了变化,其内部组成结构也发生了改变,从而引起性质的变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
主题三金属与金属矿物(第八单元)
备考高效集训
一、选择题
1. (’15长沙)“金银铜铁锡”俗称五金。
在这五种金属中,金属活动性最弱的是()
A. 铁
B. 铜
C. 金
D. 银
2. (’15苏州)下列关于金属的说法正确的是()
A. 波尔多液的配制可以在铁制容器中进行
B. 铝制品抗腐蚀能力较铁制品强
C. 用FeSO4溶液、Cu和Ag三种物质可以验证Fe、Cu、Ag三种金属的活动性强弱顺序
D. 铁制品生锈产生的铁锈是一种疏松多孔的物质,它的主要成分是Fe3O4
3. (’15南京)现有甲、乙、丙三种金属,采用将其中的一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系(如图所示)。
则三种金属活动性由强到弱的顺序是()
第3题图
A. 乙、甲、丙
B. 乙、丙、甲
C. 丙、甲、乙
D. 丙、乙、甲
4. (’15孝感)向一定量黄铜(铜锌合金)粉末中逐滴加入稀硫酸,下列图像能正确表示对应变化关系的是()
5. (’15武汉)某黑色固体粉末可能是Fe、FeO、CuO、C中的一种或几种。
为了探究其成分,小明同学按照如图所示流程进行了实验。
关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定有Fe ;②若步骤Ⅱ中无明显现象,则固体乙中最多只能有四种物质;③若步骤Ⅱ中有气泡产生,则固体乙一定是C ;④若步骤Ⅱ中有红色固体析出,则固体乙中一定无CuO ;⑤若固体乙呈红色,则原固体中一定含有Fe 和CuO 。
以上说法中正确的个数是( )
A. 1个
B. 2个
C. 3个
D. 4个
6. (’15济宁)某实验小组在探究金属的化学性质时,得到金属与酸反应制取氢气的质量关系(如图)。
请根据图像信息判断,下列说法正确的是( )
第6题图
A. 四种金属与酸反应的速率:Al>Mg>Fe>Zn
B. 四种金属的活动性顺序:Mg>Al>Zn>Fe
C. 同质量的四种金属与足量酸反应得到氢气的质量:Al>Mg>Fe>Zn
D. Al 、Mg 、Fe 、Zn 四种金属与酸反应得到氢气的质量比:127∶124∶156∶165
二、填空与简答题
7. (’15莱芜)金属是重要的资源,在日常生活中已得到越来越广泛的应用。
(1)铜常用于制作导线,因为其具有良好的______________。
(2)将纯铝和铝合金相互刻划,纯铝上留下明显的划痕,说明_____________________。
(3)对汽车的部分钢铁部件进行喷漆可以防止其生锈,原因是____________________。
(4)如图,向一定量AgNO 3溶液中加入铜和锌的混合粉末,充分反应后过滤,得溶液甲和固体乙。
①若乙中含有锌、铜、银三种固体,则溶液甲中所含的金属离子符号为________;此时向固体乙中加入稀盐酸,发生反应的化学方程式为________________________,该反应类型为________反应。
②若溶液甲显蓝色,是因为________________________(用化学反应方程式表示),此时固体乙中一定含有的物质是________。
8. (’15绥化)某化学兴趣小组同学利用图中所示装置模拟炼铁:
第8题图
(1)为了避免玻璃管a在加热时可能发生爆炸,加热前应______________。
(2)a管中氧化铁发生反应的化学方程式为________________________。
(3)B装置可用来吸收二氧化碳气体,写出该反应的化学方程式___________________。
B装置________(填“能”或“不能”)用来收集CO。
(4)若a管中氧化铁全部还原成铁,冷却后称量铁的质量比反应前氧化铁的质量减少了2.4 g,则加入a管中氧化铁的质量是________g。
三、实验与探究题
9. (教材素材下册P18图片改编)如图是某同学设计的探究铁钉锈蚀条件的实验:一周后发现:A、B中铁钉未生锈,C中铁钉已生锈。
第9题图
(1)A中蒸馏水的上面加入一层植物油的作用是________________。
(2)一段时间后,B中铁钉没有锈蚀,而C中铁钉锈蚀,通过B、C对比说明铁钉锈蚀的条件之一是________________。
(3)根据铁生锈的条件,写出一种常用的防锈方法:______________________。
(4)铁制品表面若出现锈迹,可用一种物质将其除去,请写出有关的化学方程式:
________________________________。
四、计算题
10. (’14庆阳)某同学欲测定生铁中铁的质量分数,他称取样品11.5 g,加入足量溶质质量分数为10%的稀硫酸充分反应(杂质不溶于水,也不与稀硫酸反应),产生气体的质量与所加稀硫酸的质量关系如图所示,
第10题图
请解答:
(1)恰好完全反应时生成氢气的质量为________g;
(2)该样品中铁的质量分数(精确到0.1%);
(3)图中m的值。
【答案】
备考高效集训
1. C 【解析】由金属活动性顺序表可知五金的活动性顺序为:铁>锡>铜>银>金,故金的活动性最弱。
2. B 【解析】 A ×
波尔多液中含有硫酸铜,硫酸铜能与铁反应生成铜和硫酸亚铁,进而腐蚀
铁制容器,所以不能在铁制容器中配制波尔多液
B √ 在空气中,铝与氧气反应会生成一层致密的氧化铝薄膜,阻止内部铝进一
步被氧化,铁与氧气和水反应会生成疏松多孔的铁锈,不能阻止内部铁进
一步被锈蚀,所以铝制品的抗腐蚀性能较铁制品强
C
× 用FeSO 4溶液和Cu 、Ag 可以比较Fe 与Cu 、Fe 与Ag 的活动性,但无法比较Cu 和Ag 的活动性 D × 铁锈很疏松,主要成分是Fe 2O 3·x H 2O
3. C
4. A 【解析】由金属活动性顺序可知,锌能与稀硫酸反应而铜与稀硫酸不反应,因此向一定质量的黄铜粉末中逐滴加入稀硫酸后,固体质量减少,当锌完全反应后,固体质量就不再改变了,A 正确;向黄铜粉中滴加稀硫酸,溶液不会显碱性,也就是pH 不会大于7,D 错误。
B 、C 项图解如下:
5. A 【解析】溶液甲呈浅绿色,说明甲中含有FeSO 4,但不能说明原黑色固体粉末中一定有Fe ,因为FeO 也能与稀硫酸反应生成FeSO 4,①错误;向溶液甲中加入铁丝,无明显现象,说明溶液甲中既无硫酸铜、也无稀硫酸,假如原黑色固体中4种都有,加入的稀硫
酸质量又比较少,原固体中的CuO 没有消耗完,则所发生的反应为:CuO +H 2SO 4=== CuSO 4+H 2O 、Fe +CuSO 4=== FeSO 4+Cu ,固体乙中含有C 、未消耗完的CuO 、未反应的FeO 、反应生成的Cu 、反应剩余的Fe ,共五种物质,②错误;向溶液甲中加入铁丝,有气泡产生,说明溶液甲中含有稀硫酸,固体乙中除了C ,还可能含有Cu ,③错误;向溶液甲中加入铁丝,有红色固体析出,说明溶液甲中含有CuSO 4,且最初所加稀硫酸质量比较少,乙中可能含有未反应完的CuO ,④错误;固体乙呈红色,说明固体乙中含有金属Cu ,该物质的出现,能够说明所发生的反应中一定有:CuO +H 2SO 4=== CuSO 4+H 2O 、Fe +CuSO 4=== FeSO 4+Cu ,从而说明原黑色固体中一定含有CuO 、Fe ,⑤正确;故选A 。
6. C 【解析】图示为金属与酸反应时生成氢气与加入金属质量(酸足量)的关系图,若横坐标表示反应时间,则可以比较四种金属与酸反应的选率,题给图示的横坐标为金属质量,故不能判断四种金属与酸反应的速率,同时也不能比较四种金属的活动性顺序,A 、B 错误;由图可知生成0.1 g H 2需要Al 、Mg 、Fe 、Zn 的质量分别为0.9 g 、 1.2 g 、 2.8 g 、 3.25 g ,所以等质量的四种金属与足量酸反应制得氢气的质量:Al >Mg >Fe >Zn ,C 正确;由图像信息可知,该实验在探究过程用四种金属与酸反应制得的氢气质量相等;D 错误。
7. (1)导电性 (2)铝合金的硬度比纯铝的大(或纯铝的硬度比铝合金小) (3)隔绝氧气(或隔绝空气、水) (4)①Zn 2+
Zn +2HCl=== ZnCl 2+H 2↑ 置换 ②Cu +2AgNO 3=== Cu(NO 3)2+2Ag (若写锌与硝酸银的反应不减分) Ag (或银)
8. (1)先通一会儿CO (2)3CO +Fe 2O 3=====高温
2Fe +3CO 2 (3)CO 2+2NaOH=== Na 2CO 3+H 2O 能 (4)8
9. (1)隔绝氧气 (2)与水接触 (3)把铁放在干燥的环境中(或刷漆)
(4)Fe 2O 3+6HCl=== 2FeCl 3+3H 2O
10. (1)0.4
(2)解:设样品中铁的质量为x ,参加反应的硫酸的质量为y
Fe +H 2SO 4=== FeSO 4+H 2↑
56 98 2
X y 0.4 g
562=x 0.4 g 982=y 0.4 g
解得x =11.2 g y =19.6 g
所以样品中铁的质量分数为
11.2 g 11.5 g
×100%≈97.4% (3)m =19.6 g 10%=196 g 答:(2)样品中铁的质量分数为97.4%。
(3)图中m 为196。
