物质分类与胶体
高一必修一第二章第一节物质的分类和胶体

(1)加热;例:牛奶的加热
(2)加入电解质溶液 ;例:卤水点豆腐 (3)加入带相反电荷的胶粒 ;例:明矾净水
【学以致用—胶体聚沉的应用】
盐卤点豆腐;加入电解质溶液 钢笔用不同种墨水混合会堵塞; 加入带相反电荷的胶粒 FeCl3溶液用于伤口止血 加入电解质溶液
土壤胶体有保肥作用、土壤在入海口易形成三角洲
CuSO4
探究:如何区别溶液与胶体?胶体分散系为什么可 以产生丁达尔效应?而溶液为什么不行? 用丁达尔效应
(4)★胶体的聚沉(凝聚)P29 豆浆、土壤、牛奶都是胶体,为什么豆浆能变成豆 腐,土壤会沉积形成平原、牛奶加热会结块呢? a 胶体具有介稳性的主要原因: 胶粒带电荷,带同种电荷的胶粒会互相排斥,并且胶粒 做布朗运动,所以胶粒会互相排斥而不会聚集成沉淀。 按照以上原理,如何破坏胶体的介稳性,使胶体聚 集成沉淀。 b.胶体的聚沉:其原理是中和胶粒的电荷或增加胶粒 的结合机会以使胶粒结合在一起形成大颗粒而沉淀
树状分类法
化合物
酸
碱
盐
氧化物
HCl H2SO4
NaOH Ca(OH)2
Na2SO4 CaCO3
CO2 CaO
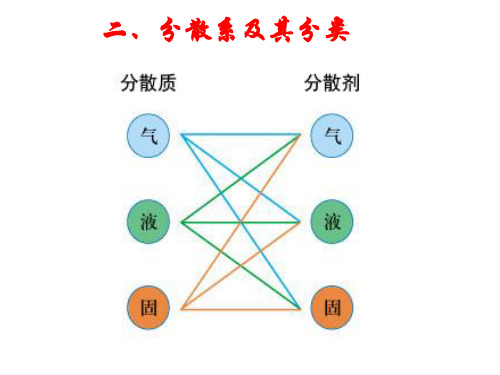
二、分散系及其分类
1、分散系:(即混合物体系 )
把一种或多种物质分散在另一种(或多种) 物质中所得到的体系。 1)分散质: 被分散的物质。
2)分散剂: 起容纳分散质作用的物质。
例如:河水,蔗糖水,牛奶、豆浆的
用交叉分类法对下列物质进行分类 多种分类标准 如果根据酸的分子里是否含有氧原子,可以把酸分成含 氧酸和无氧酸两类;根据酸分子电离时所能生成的氢离子 个数,可以把酸分成一元酸,二元酸和三元酸等。
H2SO4 HCl HNO3 H2SO3 含氧酸 无氧酸 一元酸 二元酸
第2章 第1讲 2.1物质的分类和性质 胶体

A.直径介于1~100 nm之间的微粒称为胶体
B.电泳现象可证明胶体属于电解质溶液 C.利用丁达尔效应可以区别溶液与胶体 D.胶体粒子很小,可以透过半透膜
考基梳理
助学提升
考点通解
能力对接
考向集训
名师揭秘
解析
A项,胶体是指分散质微粒的直径在1~100 nm之
间的分散系,并不只是分散质微粒,还包括分散剂;B
不能
Fe(OH)3胶 泥水、石 体、淀粉 灰乳 胶体
植物油和 水的混合 物
胶体和浊液可通过静置鉴别;胶体和溶液可通过 丁达尔现象鉴别 特别提醒:三种分散系的本质区别是分散质粒子的直径大小 鉴别方法
不同。
考基梳理 助学提升 考点通解 能力对接 考向集训 名师揭秘
【典例2】 (2013·株洲5月质检)下列叙述正确的是 ( )。
属氧化物也不一定是酸性氧化物,如CO、NO。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定 是碱性氧化物,如Mn2O7 是酸性氧化物,Al2O3 是两性氧 化物。 (3)酸性氧化物、碱性氧化物形成对应的酸、碱时,元素
化合价不变。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相 应的酸、碱(如SiO2、Fe2O3)。
考基梳理
助学提升
考点通解
能力对接
考向集训
名师揭秘
Hold住考向
考向1
考向2
物质的组成、分类、性质与转化
胶体和分散系 名师揭秘
5年8考
5年7考
物质的分类和胶体,以基础性考查为主,题型多为选择 题。预计2014年高考对本讲考查仍会以对知识的识记、再
2.分类法
常用的两种是 交叉分类 法和 树状分类 法。 由于物质分类可以有不同的标准,也就是说对某一物质而 言就可以在不同的分类标准下“扮演不同的角色”。
物质的分类,胶体

交叉分 类法
特点:物 质类别间 有相交叉 的部分
特点:同 层次中各 类别间相 互独立
树状分 类法 分类标准唯一
二、分散系
分散系:一种物质(或几种物质)以 纯净物 粒子形式分散到另一种物质里所形成 物质 非分散系 的混合物。 混合物 分散成微粒的物质—分散质 分散系 微粒分布在其中的物质—分散剂
二、分散系
化合物的其他分类
从结构角度,化合物可以分为共价化合物和离子 化合物; 从导电性看: 化 合 物 非电解质 强电解质 电解质 所有的离子化合物, 如强酸、强碱和 大多数盐, 弱酸、弱碱、少数 盐以及H2O、 H2O2
弱电解质
小 结:常 用 的 简 单 分 类 方 法 单一分 类法 分类角度多样
-
重要胶粒带电的一般规律:
带正电荷胶粒 金属氢氧化物 金属氧化物 AgI 带负电荷胶粒 金属硫化物(如Sb2S3) 非金属硫化物(如As2S3) 非金属氧化物(如SiO2泥沙) 硅酸盐(土壤和水泥) AgI
胶粒带同种电荷,相互间产生排斥作 用,不易结合成更大的沉淀微粒,这是胶 体具有稳定性的主要因素。
练习: 符合下图部分的物质是:
正盐 A D B
A:KCO3 …… B:Na2SO4 …… C:NaHCO3 …… D:Na2CO3
碳酸盐
钠盐
C
2.树状分类法 树状分类图的分类原 则:同一层次的物质 类别间一般是相互独 立,没有交叉的。 化合物
化学物质 纯净物 单质 化合物 酸 碱 盐 氧化物 混合物
胶体的分类
Fe(OH)3
雾、 云、 烟 有 色 玻 璃 Fe(OH)3 AgI胶体
AgI胶体
淀粉 胶体
胶体的丁达尔现象
点击观看视频 原因:当光束通过胶体时,看到的光柱是被胶体 散射 粒子散射的现象,并不是胶体粒子本身发光,可 见光的波长在400~700nm之间,胶体粒子的直径 在1 ~100nm,小于可见光的波长,能使光波发生 10 ~10 m 散射。溶液也发生光散射,但由于溶液中粒子的 丁达尔现象 直径小于1nm,散射极其微弱。所以,光束通过 >10 m 胶体时产生丁达尔效应。而通过溶液则没有。
物质的分类--胶体

B、Fe(OH)3胶体 D、豆浆
丁达尔效应:
当光束通过胶体时,从光路的侧面可以观察 到一条光亮的“通路”,这种就是丁达尔效 应。
原因: 胶体粒子对光线的散射
第一节 物质的分类
分散系及其分类
分散系的分类:
按照分散质或分散剂所处的状态,可有9种组合方式。
分散质
分散剂
气态
气态
液态
液态
固态
九种分散系(分类)
固态
按分散质粒子大小分类 溶液 < 1nm 胶体 1 ~100 nm 浊液 >100nm
实验示意图
雾
白云
分散质:液体 分散剂:气体
烟 分散质: 固体
分散剂:气体
4、当光束通过下列分散系时,可能产生
丁达尔效应的是(BD )
A、NaCl溶液 C、盐酸
B、Fe(OH)3胶体 D、豆浆
3、鉴别FeCl3溶液和Fe(OH)3胶体用 (丁达尔效应 );分离Fe(OH)3胶体 和悬浊液用(过滤 )方法。
4、当光束通过下列分散系时,可能产生
丁达尔效应的是(BD )
A、NaCl溶液 C、盐酸
不稳定
问题二
胶体为什么具有介稳性?
胶体粒子表面积很大,可通过吸附离子而 带有相同电性的电荷,相互排斥阻碍胶体粒 子的聚集; 布朗运动—胶体粒子在不停的做无规则的
电泳
由于胶体粒子带有电荷, 在电场作用下胶体粒子 在分散剂中作定向移动, 这种现象叫做电泳。
Fe(OH)3胶体粒子向阴极移动,阴极附近颜色 变深,说明Fe(OH)3胶体粒子带正电。
质是 ( C )
A、分散质颗粒直径都在1nm~100nm之间 B、都具有丁达尔效应 C、都能透过滤纸 D、都呈红褐色
物质分类、胶体1

化学变化
氧化还原反应 非氧化还原Байду номын сангаас应
4、胶体 (1)胶体的定义:分散质分散到分散剂中形成界稳定、界均匀的混合物。胶体
的分散质叫胶粒。胶粒直径为 纳米( 米)
(2)胶体的分类: 气溶胶 、固溶胶 、液溶胶; 分子胶体 、粒子胶体
(3)胶体的性质 丁达尔效应(现象):用一束光透过胶体,出现一条明亮的光带 布朗运动 电泳 粒子胶体---电泳 分子胶体---不电泳
浊液
物质的小颗粒 大于100纳米
均一、稳定、 不分层
光完全透过
介均一、介稳定、 不分层
明亮光带
不均一、不稳定、 分层
不透光
聚沉 :胶粒形成沉淀的过程 加热聚沉 加电解质 加带相反电荷胶粒的胶体 (4)胶体的制备:A.稀溶液反应法 (5)胶体的提纯方法: 渗析 B.浓溶液水解法
渗析装置图
四、溶液、浊液、胶体的比较
溶液
分散质
分散质直径 性质 丁达尔现象 例证 单个分子、离子 小于1纳米
胶体
分子的集合 体 1纳米~100纳米
物质的分类
达州新世纪学校 刘德标
1、物质的分类方法
(1)树状分类法:
(2)交叉分类法: 2、物质的分类 混合物 (分散系) 溶液 浊液 胶体 单质 纯净物
金属 非金属 氧化物 酸性氧化物 碱性氧化物 两性氧化物 酸 碱 盐
化合物
3、物质的变化分类:
物理变化
四种基本分类法
化合反应 分解反应 置换反应 复分解反应
物质的分类及胶体性质

物质的分类【复习目标】1:了解分类法的意义和常见分类法。
2:掌握胶体的性质和应用。
【知识梳理】一.元素与物质的关系1.元素与物质的关系:______是物质的基本组成成分,物质都是由_______组成的。
①每一种元素都能自身组成物质叫___ _.②相同的元素可以组成不同的物质,例:__ __;③绝大多数元素可以与其它种类的元素组成物质叫__ ___;2.元素在物质中的存在形态(1)游离态:元素以___ __形式存在的状态。
(2)化合态:元素以_ _ _形式存在的状态。
二.物质的分类1.纯净物与混合物的区别:2.物质分类的方法:可以根据研究需要从多种角度进行分类:①根据有无固定组成分为________________;②根据元素组成分为__________________;③根据在水溶液或熔化状态能否导电可将化合物分为____________ _____;④根据分散物质颗粒大小,将混合物分为________ ______;物质纯净物混合物:根据分散物质的颗粒直径大小,可分为、______单质化合物 __________,如Na 、Mg 、Al __________,如Cl 2、N 2、O 2___性氧化物,例SO 2、___性氧化物,例Na 2O 氧化物 酸 碱 盐⑤根据在氧化还原反应中的表现,将反应物分为 ________。
三.一种重要的混合物————胶体1.分散系:分散质微粒的直径在______ _____粒的直径在____________体。
2.胶体的性质(1)丁达尔现象:用一束光通过盛有Fe (OH )3胶体的烧杯时,在与光束垂直的方向观察,可以看到______________________,这个现象称作______________或________________.这是由于胶体微粒对可见光的____________________和(2)电泳:在_______________的作用下,胶_________移动,这种现象成为电泳。
物质的分类和胶体

非金属氧化第二章 物质的分类和胶体常见物质的俗称:①纯碱、苏打Na 2CO 3 ②烧碱NaOH ③生石灰CaO ④熟石灰、石灰水、消石灰、石灰乳Ca(OH)2 ⑥石灰石、大理石CaCO 3 ⑦胆矾、蓝矾CuSO 4·5H 2O ⑧明矾KAl(SO 4)2·12H 2O ⑨铜绿、孔雀石Cu 2(OH)2CO 3 ⑩小苏打NaHCO 3一、酸性氧化物、碱性氧化物1、酸性氧化物:和碱反应只生成盐和水的氧化物。
主要有:CO2、SO 2、SO3、P 2O 5、SiO 2等。
2、碱性氧化物:和酸反应生只成盐和水的氧化物。
主要有:Na 2O 、CaO 、FeO 、MgO 等。
注意:1、金属氧化物:可能是酸性氧化物,碱性氧化物,还有两性氧化物(Al 2O 3等);2、非金属氧化物:可能是酸性氧化物,也可能是不成盐氧化物(H 2O ,CO ,NO 等)。
3、酸性氧化物:可以是金属氧化物(Mn 2O 7,CrO 3等),也可以是非金属氧化物(SO 3,SO 2,P 2O 5等);4、碱性氧化物:只能是金属氧化物;5、不成盐氧化物(H 2O ,CO ,NO 等)既不是酸性氧化物,也不是碱性氧化物。
它们之间的关系如图所示:二、胶体1、溶液、胶体和浊液这三种分散系的根本(本质)区别是分散系粒子的大小。
2、区别胶体和溶液的最简单方法是一种常用的物理方法——丁达尔效应。
3、Fe(OH)3胶体的制备:将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入饱和FeCl 3溶液(棕黄色),继续煮沸至溶液呈现红褐色,立即停止加热。
酸性氧化物金属氧化物 碱性氧化物方程式: FeCl 3+3H 23(胶体)+3HCl4、其他常见的胶体有:云、雾、烟、豆浆、牛奶、果冻、墨汁、碳素墨水、肥皂水、淀粉溶液、鸡蛋清等。
5、胶体的主要性质:胶体的主要性质有:①丁达尔效应:当光束通过胶体时,可以看到胶体中有一条光亮通路,这是由于胶体粒子对光线的散射而形成的。
2-1 物质的分类及胶体

结论:胶体分散质粒子的直径小于浊液分散质粒子的 大小。
3.胶体与浊液、溶液的区别
(半透膜:只能容许某些分子或离子通过的薄膜)
一定时间后,烧杯中能够检测出的 是:氯化钠。检测不出的是:淀粉
胶体微粒能透过滤纸
HNO3 NaOH CO2 CaCO3
物质 混合物
氧化物
均匀混合物
非均匀混合物 空气 自来水
分类原则:同一层次的物质类别间一般是相 互独立,没有交叉的。
按反应物、生成物 的形式变化划分
化 学 反 应
化合反应 A+B+ … =C 分解反应 A=B+C+… 置换反应 A+BC=AC+B 复分解反 AB+CD=AD+CB
将HCl 、SO2、 CaO、 KOH、 Na2SO4 、H2SO4 进行分类,并指出依据。 HCl 、H2SO4 酸:
化合物 碱: KOH 盐: NaSO4 氧化物: SO2 、CaO
2.树状分类法
金属单质
单质
酸 碱 化合物 盐
Fe
Cu S Cl2
非金属单质 C
纯净物
H2SO4 Ba(OH)2 NaCl GaO
超市里成千上万种商品,如何能够 迅速找到某种商品?
图书馆里有许多书籍,如何很快就找到几米 《我的心中每天开出一朵花》?
每组物质中都有一种与其他物质在分类上不 同,将这种物质找出来。 1、NaCl、KCl、NaClO、BaCl2 ( NaClO ) Cl2 )
2、HClO3、KClO3、Cl2、NaClO3 ( 4、空气、氮气、氯化氢、碳酸钠
物质分类胶体
3.下列事实与胶体性质无关的是( D)
A.在豆浆里加入盐卤做豆腐 B.河流入海处易形成沙洲 C.一束平行光线照射蛋白质溶液时,从侧面可 看到光亮的通路 D.FeCl3溶液中加入NaOH溶液出现红褐色沉淀
4.能将胶体与溶液相区别开来的是__A__
A、丁达尔效应
B、是否能透过滤纸
C、电泳
D、布朗运动
实例
溶液
<1nm 均一 稳定 无
通过
通过
胶体
浊液
1nm
>100nm
~100nm 介稳性、均一
不均一
不稳定
有
无
通过
不能
不通过 Fe(OH)3胶体 淀粉胶体
不通过
(5)胶体的聚沉 ①加入电解质 (如卤水点豆腐)
例:把稀H2SO4溶液逐滴加入到氢氧化铁胶体中的现 象是__先___产__生__红__褐___色__沉__淀__,___后__沉__淀__溶___解__。
气溶胶:烟、云、雾 分散剂状态分 液溶胶:淀粉溶液
固溶胶:有色玻璃
气溶胶
云
烟
雾
液溶胶
固溶胶
墨水、胶水、血液、 鸡蛋清的水溶液、 肥皂水、淀粉溶液 都属于胶体。
2、胶体的性质
(1)介稳性
分散系 溶液 胶体
浊液
稳定性 最稳定 介稳性 很不稳定
主要原因: 胶体粒子通过吸附离子而带有电荷;
次要原因: 胶体粒子做布朗运动。
(2)丁达尔效应
Fe(OH)3胶体的制备:
书26页: 向沸水中滴加FeCl3饱和溶液。 继续煮沸至溶液呈红褐色,停止加热。
FeCl3+3H2O(沸)== Fe(OH)3(胶体)+3HCl
丁达尔效应:光束通过胶体时,可以看到 一条光亮的通路。
2.物质分类及胶体
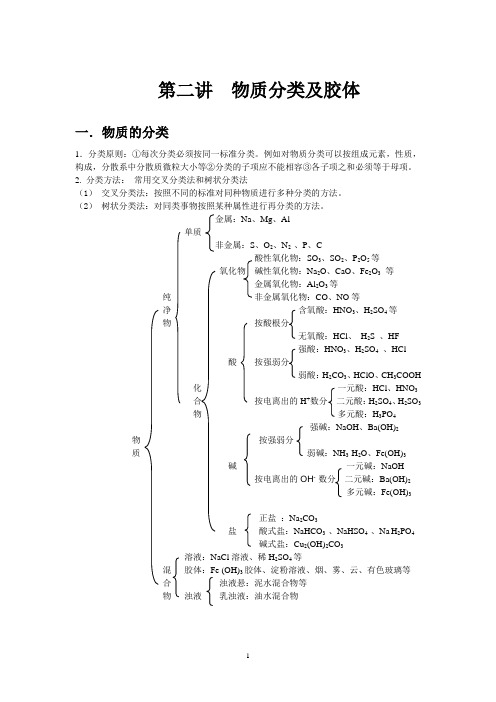
第二讲物质分类及胶体一.物质的分类1.分类原则:①每次分类必须按同一标准分类。
例如对物质分类可以按组成元素,性质,构成,分散系中分散质微粒大小等②分类的子项应不能相容③各子项之和必须等于母项。
2. 分类方法:常用交叉分类法和树状分类法(1)交叉分类法:按照不同的标准对同种物质进行多种分类的方法。
(2)树状分类法:对同类事物按照某种属性进行再分类的方法。
金属:Na、Mg、Al单质非金属:S、O2、N2 、P、C酸性氧化物:SO3、SO2、P2O5等氧化物碱性氧化物:Na2O、CaO、Fe2O3等金属氧化物:Al2O3等纯非金属氧化物:CO、NO等净含氧酸:HNO3、H2SO4等物按酸根分无氧酸:HCl、H2S 、HF强酸:HNO3、H2SO4、HCl酸按强弱分弱酸:H2CO3、HClO、CH3COOH化一元酸:HCl、HNO3合按电离出的H+数分二元酸:H2SO4、H2SO3物多元酸:H3PO4强碱:NaOH、Ba(OH)2 物按强弱分质弱碱:NH3·H2O、Fe(OH)3碱一元碱:NaOH按电离出的OH- 数分二元碱:Ba(OH)2多元碱:Fe(OH)3正盐:Na2CO3盐酸式盐:NaHCO3 、NaHSO4 、Na H2PO4碱式盐:Cu2(OH)2CO3溶液:NaCl溶液、稀H2SO4等混胶体:Fe (OH)3胶体、淀粉溶液、烟、雾、云、有色玻璃等合浊液悬:泥水混合物等物浊液乳浊液:油水混合物二、分散系相关概念1. 分散系:一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物,统称为分散系。
(按分散质和分散剂的状态可分为九种分散系)2. 分散质:分散系中分散成粒子的物质。
分散剂:分散质分散在其中的物质。
(分散质和分散剂是总的概念,只有溶液中才可称为溶质和溶剂)3、分散系的分类:当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为:溶液、胶体和浊液。
物质的分类 胶体

物质的分类(粘在教材P24—25)单质 金属单质。
如Na Mg Al Fe Hg非金属单质。
如H 2 N 2 O 2 F 2 Cl 2 He Br 2 I 2 S氢化物 非金属元素的气态氢化物(H 为+1价)。
如HCl H 2O H 2S NH 3 CH 4 金属元素的氢化物(H 为—1价)。
如NaH CaH 2纯 按 酸性氧化物(酸酐)——与水反应只生成酸、与碱反应生成盐和水。
非金属的氧化物组 金属的高价氧化物。
如CO 2 SO 2 SO 3 SiO 2 P 2O 5 Mn 2O 7 成 碱性氧化物(金属的低价氧化物——与水反应只生成碱、与酸反应生成盐和水)。
如 净 和 氧化物 Na 2O CaO MgO FeO Fe 2O 3 CuO性 两性氧化物(与强酸强碱都能反应生成盐和水)。
如Al 2O 3 (第三章学习) 质 不成盐氧化物(不能与酸、碱反应生成盐和水)。
如CO NO物 分 酸 强酸(都易溶于水、在水溶液中完全电离)。
如HCl H 2SO 4 HNO 3 HBr HI HClO 4 弱酸(在水溶液中少部分电离)。
如HF CH 3COOH H 2CO 3 H 2S H 2SiO 3 HClO(中强酸H 2SO 3H 3PO 4 也属于弱酸类)碱 强碱(活泼金属的氢氧化物,在水溶液中完全电离)。
如KOH Ca(OH)2 NaOH Ba(OH)2 化 弱碱(在水溶液中少部分电离)。
NH 3 H 2O M g (O H )2~AgOH(不活泼金属的氢氧化物) 正盐(由碱根离子和酸根离子组成)。
如NaCl Na 2SO 4 Na 2CO 3 Na 2SO 3 Na 2S Na 3PO 4 合 盐 酸式盐(由碱根离子和酸式根离子组成)。
如N a H S O 4 NaHCO 3 NaHSO 3 NaHS 碱式盐(由碱根离子和OH —、酸根离子组成,相当于由碱和盐组成)。
如Cu 2(OH)2CO 3物 复盐(由多种碱根离子和酸根离子组成,相当于由多种盐组成)。
分类方法及胶体

分类方法及胶体一、基本概念辨析1、只含一种元素的物质为单质。
()2、单质只含一种元素。
()3、在水溶液中能电离出氢离子的化合物为酸。
()4、酸能在水溶液中电离出氢离子。
()5、含有氧元素的化合物为氧化物。
()6、氧化物含有氧元素。
()二、分散系:根据分散质的大小划分1、溶液:小于1 nm 胶体:1—100 nm 之间浊液:大于100 nm2、常见胶体:(根据分散剂的状态)气溶胶:云、烟、雾固溶胶:烟水晶、有色玻璃液溶胶:Fe(OH)3胶体、Al(OH)3胶体、H2SiO3胶体、淀粉溶液、蛋白质溶液、肥皂水、泥水、牛奶、豆浆等三、胶体的制备1、物理方法:淀粉、蛋白质溶于水,研墨2、化学方法:Fe(OH)3胶体的制备(1)操作:向沸水中逐滴加入饱和FeCl3溶液,继续加热至溶液呈红褐色,停止加热(2)相关离子方程式:Fe3++ 3H2O == Fe(OH)3(胶体)+ 3 H+(FeCl3溶液能与水反应,条件不同反应程度不同。
当为稀溶液不加热时,生成的Fe(OH)3少,聚集程度小,属于溶液的范畴;用浓溶液加热时生成的Fe(OH)3多,聚集程度增大,属于胶体的范畴;若继续加热,或用玻璃棒搅拌,聚集程度继续增大,就到浊液沉淀的范畴。
NaOH或氨水提供的OH—太多,直接生成沉淀。
)四、胶体的鉴别:丁达尔效应五、胶体的净化提纯:渗析(半透膜)能通过滤纸:溶液和胶体能通过半透膜:溶液分离溶液和浊液:过滤(滤纸)分离溶液和胶体:渗析(半透膜)六、胶体的电泳(胶体粒子在外加电场的作用下定向移动)1、胶体不带电,呈电中性。
2、胶体粒子吸附溶液中的阴、阳离子带电。
胶体粒子带正电:金属氧化物、金属氢氧化物胶体粒子带负电:非金属氧化物、金属硫化物胶体粒子带正电→移向阴极→与电源负极相连的一极胶体粒子带负电→移向阳极→与电源正极相连的一极氢氧化铁胶体电泳:阴极区颜色加深,阳极区颜色变浅七、胶体的聚沉1、胶体属于介稳性:主要原因是胶体粒子带同种电荷,相互排斥。
-物质的分类和胶体

(2)电泳— 在外加电场的作用下,胶体分散质
微粒在分散剂里向阴极(阳极)作定向运动的现象。
胶体发生电泳现象说明 [Fe(OH)3]胶体颗 粒带电荷 应用:1、提纯和精制胶体 2、胶体稳定存在的原因**
胶体的性质
(3)胶体的聚沉方法
①加入电解质等方法能使胶体凝聚。
丁达尔现象
当一束强光透过胶体时,可以看到一条 光亮的通路,这种现象叫做丁达尔现象。
溶液
胶体
三、胶体的性质
(1)丁达尔现象
胶体微粒对光线散射而形成一条光亮的通路。 (应用:区分胶体和溶液)
树林中的丁达尔效应
海洋中的丁达尔效应
电影放映时的丁达尔效应
胶体的性质
(1)丁达尔现象— 胶体微粒对光线散射而形成
2.阳光灿烂的清晨,在茂密的树林 里,你会看到有什么景象?
3.你知道烟、云、雾是怎么形成的 吗?
一、分散系及其分类
1、分散系:把一种(或多种)物质分散在另
一种(或多种)物质中所得到的体系。
2、分散系的组成:
分散质: 被分散的物质 分散剂:起容纳分散质作用的物质
3、分散系的分类:
分散系的分类
从分散质和分散剂的状态考虑,可
Ca(OH) 2、Ba(OH)2、难Fra bibliotek碱 强碱碱
从碱性强 弱分
弱碱 一元碱 二元碱 多元碱
据碱分子 电离出的 氢氧根离 子数
Fe(OH) 3
物质的分类
可溶盐
是否溶于 水分
K+ Na+ NH4+ NO3- CL- SO42CaCO3、BaSO4、Agcl 硫酸盐
难溶盐 钠盐
按阴阳 离子分
物质的分类及胶体

物质的分类一、简单分类法及其应用1.交叉分类法Na2CO3钠盐Na2SO4钾盐K 2SO4硫酸盐K 2CO3碳酸盐2、树状分类法二、分散系( dispersion system)及其分类1、分散系(1) 分散系:将一种或几种物质以粒子形式分散到另一种物质里所形成的混合物,称为分散系。
(2) 分散质和分散剂:分散系中分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
(3)分类:常见的分散系有溶液、悬浊液、乳浊液、胶体等。
一般地说,溶液分散质粒子小于1nm,浊液中离子通常大于100nm,介于1nm~100nm的为胶体。
常见的分散系及其特征分散质分散剂实例气气空气液气云、雾固气烟灰尘气液泡沫液液牛奶、酒精的水溶液固液糖水、油漆气固泡沫塑料液固珍珠(包藏着水的碳酸钙)固固有色玻璃、合金分散系溶液胶体粗分散系粒子大小<1 nm 1-100nm >100nm例子盐水硫酸铜溶液淀粉溶胶氢氧化铁胶体泥水油水能否透过半透膜能不能不能能否透过滤纸能能不能丁达尔效应没有没有有三、胶体( colloid )1、胶体的分类2、胶体的制备:FeCl3+3H2O Fe(OH)3(胶体) +3HCl四、胶体的性质1.丁达尔效应:光束通过胶体,形成光亮的“通路”的现象叫丁达尔效应。
2.布朗运动:胶体分散质粒子作不停的、无秩序的运动,这种现象叫做布朗运动。
3.电泳:在外加电场作用下,胶体粒子在分散剂里向电极作定向移动的现象4.胶体的聚沉:分散质粒子相互聚集而下沉的现象,称为胶体的聚沉。
方法:加电解质溶液;加带相反电荷的胶粒。
5、胶体的应用(1)工业除杂、除尘(2).土壤的保肥作用(5)豆腐的制作原理(4)江河入海口处形成三角洲(3)明矾的净水作用一、胶体的分类(1)、根据分散质微粒组成的状况分类:如:F e(O H)3胶体胶粒是由许多F e(O H)3等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体。
物质分类和胶体PPT课件
布朗运动
胶体粒子在分散系中不断地作无规则的运动— 布朗运动
原因:分散剂分子对胶 粒无休止的随机撞击
注意:并不是胶体粒子本身固有的性质!
小结:溶液、胶体与浊液三类分散系的比较
分散系
溶液
胶体
浊液
粒子的直 径
特征
能否透过 滤纸
<1nm
1nm~100nm >100nm
均一、透明、 均一、透明 不均一、不透
溶解性
易溶: KOH、NaOH、Ba(OH)2 微溶: Ca(OH)2 难溶:Al(OH)3、Fe(OH)3
正盐:
酸式盐: 组成 碱式盐:
复盐: 盐
溶解性 易溶: 微溶:
难溶:
判断正误: 1.酸性氧化物一定是非金属氧化物 Mn2O7 2.非金属氧化物一定是酸性氧化物 NO、CO 3.金属氧化物一定是碱性氧化物 Mn2O7 4.碱性氧化物一定是金属氧化物 下列哪些物质为纯净物: 液氯、明矾、、HNO3、纯碱、酒精、澄清石
(2)树状分类法:对同类事物按照某种属性进行再分类
化学反应分类
化合反应A+B=AB
按产物种类、 分解反应AB=A+B
类别分类
置换反应A+BC=AC+B
复分解反应AB+CD=AD+CB
化学反应
氧化还原反应
按是否有氧得失 非氧化还原反应
一、物质的分类
金属
单质 非金属
纯净物
氧化物 无机化合物
非金属氧化物
分散质: 分散成粒子均的一物、质稳定的混合物
分散剂: 起容纳分散质作用的物质
常见的分散系
分散系 食盐水
糖水 淀粉试液
碘酒
分散质 食盐 糖 淀粉 碘
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章化学物质及其变化导学案
第一节物质的分类(第一课时)
【学习目标】1.感受分类是学习和研究化学物质及其变化的一种重要科学方法。
2.了解常用的两种简单分类方法:“交叉分类法”和“树状分类法”。
3.能用不同的方法对化学物质及其变化进行分类。
【学习重点】了解常见化学物质及其变化的分类方法。
【学习难点】能根据物质的组成和性质对物质进行分类。
【学习过程】
预习回顾
1.根据物质存在的状态,将物质分为_____、____、____。
(练习1)有常温常压下的物质①氧气②水③二氧化碳④甲烷⑤硫酸⑥五氧化二磷⑦乙醇⑧氧化铜,请同学们根据物质的状态进行分类(用序号填空),气态
________液态________固态________。
2.根据物质导电性,将物质分为__________、__________、__________。
(练习2)有下列几种物质①石墨②铁③硅(Si)④塑料⑤玻璃,请同学们根据物质导电性进行分类(用序号填空),导体________、半导体_______、绝缘体_ ____
3.根据物质在水中的溶解性,将物质分为_________、_________、_________。
(练习3)有下列几种物质①氧气②二氧化硫③氯化钠④氢氧化钠⑤硝酸⑥乙醇
附录Ⅱ“部分酸、⑦碳酸镁⑧硫酸钡,请同学们根据初中所学知识并查阅书P
110
碱和盐的溶解性表”对上述物质进行分类(用序号填空),可溶性物质______、微溶性物质_____、难溶性物质_____。
探求新知
一、简单分类法及其应用
1.分类的含义
分类,即根据事物的特点分别归类。
2.分类的意义
能够提高人们工作、学习的效率,使人们更快、更便捷的达到目的。
3.分类的依据和标准
分类的依据和标准很多,可以按物质的状态、组成、性质分类,还可以按物质的颗粒大小分类等。
例:根据物质的组成和性质,对下列物质进行分类:
①海水②蒸馏水③氨水④食盐水⑤汞⑥液溴⑦硝酸溶液⑧硝酸银⑨纯碱⑩烧碱⑾乙醇⑿生石灰
其中属于混合物的是,属于纯净物的是,属于单质的是,属于化合物的是,属于盐的是,属于氧化物的是,属于有机物的是。
4.分类的方法
(1)单一分类法
含义:只用标准进行分别归类的分类方法。
(2)交叉分类法:根据标准,对同一事物进行多种分类的一种分类方法。
例:某些盐的交叉分类
按阴离子分类按阳离子分类
Na2CO3 Na2CO3既是盐,又是盐
碳酸盐Na2SO4钠盐Na2 SO4既是盐,又是盐
K2SO4K2SO4 既是盐,又是盐
硫酸盐K2CO3钾盐K2CO3 既是盐,又是盐
(3)树状分类法:对事物按照某些属性进行再分类的分类法。
对事物认识更深入。
例:化合物树状分类
酸HCl、H2SO4、
HNO3 等
碱NaOH 、KOH 、NH3·H2O 等
化合物盐Na2CO3 、K2CO3 、NaCl等
氧化物CO 、H2O 、Al2O3等
5.分类的主要规则
⑪每次分类必须按同一个标准进行;⑫分类的子项应当互不相容;⑬子项之和必须等于母项。
问题探究
课题一:交叉分类法1.请你从不同的角度认识下列物质所属类别
例:Na
2CO
3
按所含阳离子分:钠盐① H
2
SO
4按所含阴离子分:碳酸盐②NaOH
按溶解性分:可溶性盐③CO
2
2.根据下图中物质及其类型之间的关系分别作出有关连线
可溶性盐Na2CO3钠盐
难溶性盐NaHCO3钡盐
正盐Na2 SO4碳酸盐
酸式盐BaSO4硫酸盐课题二:树状分类法用树状分类法根据物质的组成对物质分类
氧化物
酸
碱
盐物质
练习. 按照物质的组成和性质,用树状分类法对下列物质进行分类。
O2、Cu、H2SO4、NaOH、KNO3、SO2、空气和含氧60%的MgO。
教后记。
