有机化学方程式总结
有机化学方程式最全总结

有机反应方程式总结(一)烷烃1.甲烷与氯气在光照条件下反应生成氯仿:2.烷烃燃烧通式:(二)烯烃1.乙烯的制取:2.乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应:3.乙烯与溴的四氯化碳溶液反应:4.乙烯的催化加氢:5.乙烯的加聚反应:6. 1,3-丁二烯与溴(1:1)的反应:1,4加成:1,2加成:7.丙烯加聚:8. 2-甲基-1,3-丁二烯加聚:9.丙烯与氯气加热条件下反应(α-H的取代):(三)炔烃1.乙炔的制取:2.乙炔与足量溴的四氯化碳溶液反应:3.乙炔制聚氯乙烯:(四)芳香烃1.甲苯与酸性KMnO4溶液反应:2.苯的催化加氢:3.苯与液溴催化反应:4.苯的硝化反应:5.苯的磺化反应:6.甲苯与浓硝酸、浓硫酸的混合酸加热时获得三硝基甲苯:(五)、卤代烃1.溴乙烷在氢氧化钠水溶液中加热反应:2.溴乙烷在氢氧化钠醇溶液中加热反应:3. 2-甲基-2-溴丁烷消去溴化氢:4. 溴乙烷制备丙酸:(六)、醇类1.乙醇与钠反应:2.乙醇的催化氧化:3.乙醇制乙烯:4.乙醇制乙醚:5.乙醇和浓的氢溴酸加热反应制溴乙烷:(七)、酚类1.苯酚与氢氧化钠溶液反应:2.苯酚钠与CO2反应:3.苯酚与溴水反应:4.制备酚醛树脂:(八)、醛类1.乙醛的催化加氢:2.乙醛的催化氧化:3.乙醛与银氨溶液反应:4.乙醛与新制氢氧化铜反应:5.乙醛与HCN溶液反应:(九)、羧酸1.乙酸与乙醇发生酯化反应:2.乙酸与氨气加热条件下发生反应:3.乙酸发生还原反应生成乙醇:4.乙酸与氯气催化剂条件下反应(α-H被取代):5.两分子乳酸脱去两分子水:(十)、酯类1.乙酸乙酯与H2O混合加入稀硫酸水解:2.乙酸乙酯碱性水解:3.油脂的皂化反应(以硬脂酸甘油酯为例) :(十一)、高分子化合物1.苯乙烯合成聚苯乙烯:2.异戊二烯合成聚异戊二烯(天然橡胶):3.甲基丙烯酸甲酯合成聚甲基丙烯酸甲酯(有机玻璃):4.己二酸与己二胺脱水缩合合成纤维聚酰胺-66(尼龙-66):5.乳酸合成聚乳酸6.两分子乳酸成环。
必修二 有机化学 方程式总结

乙烯与HX:C2H4+HX催CH3CH2X
乙烯与H2O:C2H4+H2O催CH3CH2OH
乙烯的加聚:nC2H4催[CH2-CH2]n
苯的燃烧: +15O2点12CO2+6H2O
苯的溴代:+Br2Br
苯的硝化:+HNO3浓硫酸50-60℃NO2+H2O
苯的磺化:+H2SO4(浓)70-80℃SO3H +H2O
乙醇与HX:C2H5OH+HX C2H5OX+H2O
乙酸与钠:2CH3COOH+Na 2CH3COONa+H2O
乙酸与NaOH:CH3COOH+NaOH CH3COONa+H2O
乙酸Na2CO3:CH3COOH+Na2CO3CH3COONa+H2O+CO2
乙醇与乙酸:CH3COOH+C2ห้องสมุดไป่ตู้5OH浓硫酸△CH3COOC2H5+H2O
必修二
甲烷和Cl2:CH4+Cl2CH3Cl+HCl
CH3Cl+Cl2CH2Cl2+HCl
CH2Cl2+Cl2CHCl3+HCl
CHCl3+Cl2CCl4+HCl
甲烷燃烧:CH4+2O2点CO2+2H2O
甲烷分解:CH41000℃C+2H2
乙烯燃烧:C2H4+3O2点2CO2+2H2O
乙烯与Br2:C2H4+Br2C2H4Br2
苯与H2:+3H2Ni△
乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2
有机化学常用反应方程式汇总

有机化学常⽤反应⽅程式汇总光照光照光照光照⾼温CaO△催化剂加热、加压催化剂△催化剂有机化学⽅程式汇总1. CH 4 + Cl 2CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 2312. nCH 2 = CH 2 ] n13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2ONaOHH 2O 醇△140℃催化剂△24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 33738. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O41CH 3O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸CH2-CH244. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O46. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO 252. C12H22O11+H2O C6H12O66蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH257. C17H35COO-CH2 CH2-OHC17H35COO-CH +3NaOH 3C17H35COONa+ CH-OH C17H35COO-CH2 CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+→24光HClClCHClClCH+→+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+?→??18.19.20.21.⾼中有机化学知识点总结 1.需⽔浴加热的反应有:(1)、银镜反应(2)、⼄酸⼄酯的⽔解(3)苯的硝化(4)糖的⽔解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不⾼于100℃的条件下反应,均可⽤⽔浴加热,其优点:温度变化平稳,不会⼤起⼤落,有利于反应的进⾏。
高中有机化学方程式总结(默写版)

高中有机化学方程式总结(默写版) 高中有机化学方程式默写一、烃1.甲烷烷烃通式:1) 氧化反应甲烷燃烧产生二氧化碳和水:CH4 + 2O2 -。
CO2 + 2H2O甲烷不能使酸性高锰酸钾溶液和溴水褪色。
2) 取代反应一氯甲烷:CH3Cl二氯甲烷:CH2Cl2三氯甲烷:CHCl3四氯化碳:CCl42.乙烯烯烃通式:乙烯的制取:1) 氧化反应乙烯燃烧产生二氧化碳和水:C2H4 + 3O2 -。
2CO2 + 2H2O乙烯能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H4 + Br2 -。
C2H4Br2 与氢气加成:C2H4 + H2 -。
C2H6与氯化氢加成:C2H4 + HCl -。
C2H5Cl 与水加成:C2H4 + H2O -。
C2H5OH 3) 聚合反应乙烯加聚,生成聚乙烯。
3.乙炔乙炔的制取:1) 氧化反应乙炔燃烧产生二氧化碳和水:C2H2 + 5/2O2 -。
2CO2 + H2O乙炔不能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H2 + Br2 -。
C2H2Br2与氢气加成:C2H2 + H2 -。
C2H4与氯化氢加成:C2H2 + HCl -。
C2H3Cl3) 聚合反应氯乙烯加聚,得到聚氯乙烯。
乙炔加聚,得到聚乙炔。
4.苯苯的同系物通式:1) 氧化反应苯燃烧产生二氧化碳和水:2C6H6 + 15O2 -。
12CO2 + 6H2O苯能使溴水和酸性高锰酸钾溶液褪色。
2) 取代反应①苯与溴反应②硝化反应3) 加成反应5.甲苯1) 氧化反应甲苯燃烧产生二氧化碳和水:C7H8 + 9O2 -。
7CO2 + 4H2O甲苯能使溴水褪色和酸性高锰酸钾溶液褪色。
2) 取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯(TNT)。
二、烃的衍生物烃的衍生物的重要类别和主要化学性质:类别通式代表性物质分子结构特点主要化学性质卤代烃 R—X 溴乙烷 C-X键有极性,易断裂 1.取代反应 2.消去反应醇 R—OH 乙醇有C-O键和O-H键,有极性;-OH与链烃基直接相连 1.与钠反应,生成醇钠并放出氢气 2.氧化反应:生成乙醛 3.脱水反应:乙醚、乙烯 4.酯化反应酚 -OH 苯酚 -OH直接与苯环相连取代反应醛 O || CH3-C-H C=O双键有极性,具有不饱和性氧化反应:生成酮羧酸 COOH 乙酸有C=O双键和C-OH单键,有极性 1.与碱反应,生成盐 2.酯化反应酯 R-COOR' 乙酸乙酯 C=O双键和O-C单键,有极性 1.水解反应:生成醇和羧酸 2.酸催化下的加成反应注:删除了明显有问题的段落,对每段话进行了小幅度的改写。
有机化学方程式总结

烯烃的复分解反应
卡宾与烯烃的加成反应
1、乙炔加H2O
【特点】炔烃水合符合马式规则。
【注】只有乙炔水合生成乙醛,其他炔烃都生成相应的酮。
2、乙炔亲核加成
(1)维尼纶合成纤维
(2)羊毛制造
(3)乙炔与乙醇
(4)炔基负离子
①傅-克烷基化反应
②傅-克酰基化反应
4、苯的侧链氧化
1)用高锰酸钾氧化时,产物为酸。
【描述】苯环不易被氧化,当其烷基侧链上有α氢的时候,则该链可被高锰酸钾等强氧化剂氧化,不论烷基侧链多长。
结果都是被氧化成苯甲酸。
3)用MnO2为氧化剂时,产物为醛或酮。
四、卤代烃
1、取代反应
(1)水解:
(2)醇解:
(3)氰解:
(4)氨解:
(5)酸解:
(6)与炔钠反应:
(7)卤素交换反应:
2、消除反应
(1)脱卤化氢①β-消除:【注】当有多种β-H时,其消除方向遵循萨伊切夫规律,即
卤原子总是优先与含氢较少的β碳上的氢一起消除。
(2)脱卤素
①顺式邻二醇
六、酚
(3)醇的脱水
环氧化合物
(2)环氧的制备①过氧酸氧化
机理
6、醛(酮)的还原
【注】芳环上有烃基、烷氧基,则醛基按定位规则导入,以对位产物为主。
如果芳环上带有羟基,反应效果不好;如果连有吸电子基团,则反映不发生。
九、羧酸
8、α卤代反应。
高中有机化学方程式总结
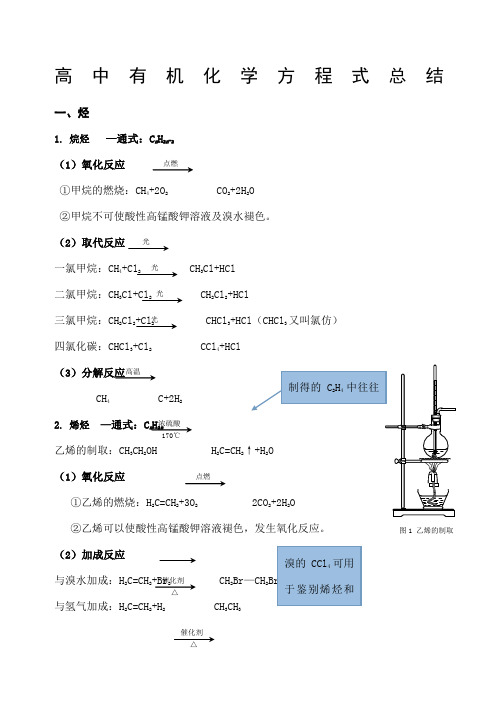
高中有机化学方程式总结一、烃1. 烷烃 —通式:C n H 2n -2(1)氧化反应①甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O ②甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl(3)分解反应CH 4 C+2H 22. 烯烃 —通式:C n H 2n乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应①乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O ②乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3点燃光光 光 光 浓硫酸 170℃点燃催化剂 △图1 乙烯的制取催化剂 △高温 溴的CCl 4可用于鉴别烯烃和制得的C 2H 4中往往与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH 2 n3. 炔烃 —通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH↑+Ca(OH)2(1)氧化反应①乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O②乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CH BrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC ≡CH n4. 苯 C 6H 6催化剂 加热加压催化剂CH 2-CH 2点燃图2 乙炔的制取催化剂 △催化剂 △BrCH —CH催化剂 C 催化剂CH=CH 电石中含有的CaS与水反应会生成(1)氧化反应①苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O ②苯不能使溴水和酸性高锰酸钾溶液褪色。
有机化学方程式总结

有机化学方程式总结CH4甲烷⑴取代反应CH4+Cl2光照CH3Cl+HCL(将一个H换为一个Cl,一次换一个)注:CH3Cl为液态,CH2Cl2,CHCl3,CCl4为油状物质⑵燃烧反应CH4+2O2点燃CO2+2H2O(l)(完全燃烧)⑶高温分解CH4 高温C+2H2⑷烷烃燃烧通式CnH2n+2 + 3n+1∕ 2O2 nCO2 + n+1H2O⑸烷烃均有以上的化学式C2H4乙烯燃烧反应C2H4+3O2点燃2CO2+2H2O(完全燃烧)加成反应CH3-CH3CH2=CH2+Cl2→CH2Cl-CH2ClCH2=CH2+HCl→CH3-CH2ClCH2=CH2+H2O加热加压催化剂CH3-CH2-OH聚合反应:nCH2=CH2 催化[ CH2-CH2]n(将双键拆开分别加上两个元素即可)烯烃燃烧通式CnH2n + 3∕ 2O2 nCO2 + n ∕ 2H2O苯燃烧反应2C6H6+15O2点燃12CO2+6H2O取代反应+Br2 Fe硝化反应加成反应CH3CH2OH乙醇CH3CH2OH+3O2点燃2CO2+3H2O(完全燃烧)2CH3CH2OH+2Na 2CH3CH2ONa+H2↑CH3CH2OH+HCl浓硫170℃CH3CH2Cl+H2OCH3CH2OH浓硫酸、170℃CH2=CH2↑+H2OCH3CH2OH+CH3COOH浓硫酸、△ CH3CH2COOCH3+H2O (酸脱羟基醇脱氢)注:此实验需熟练掌握任何步骤(醇类化学反应一般为以一个H去换一个元素或原子团一般为卤素和金属元素,此类重点记忆反应条件)CH3COOH 乙酸2CH3COOH+2Na2CH3COONa+H2↑ 2CH3COOH+Na2O CH3COOH+NaOH CH3COONa+H2O CH3COOH+NH3 CH3COONH4CH3COOH+NaHCO3浓硫酸、△ CH3COONa+CO2↑+H2O CH3CH2OH+CH3COOH CH3CH2OOCCH3+H2O(乙酸类反应与醇类反应类似,均为以H 换原子或原子团)。
高中有机化学方程式总结(高三总复习)

8 乙 醇 分 子 间 脱 水 成 C2H5OH+HOC2H5 浓硫酸 C2H5OC2H5+H2O
醚
140C
9
乙醇与浓氢卤酸的 取代
CH3CH2OH+HBr CH3CH2Br+H2O
10
乙醇与酸的酯化反 应
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
3 乙烯能使酸性高锰 5CH2=CH2 + 12KMnO4 + 18H2SO4―→10CO2 + 12MnSO4 + 6K2SO4 +
酸钾褪色
28H2O
4
乙烯与溴水加成 CH2==CH2+Br2 CCl4 CH2Br—CH2Br
5
乙烯与水加成
CH2==CH2+H2O 催化剂 CH3CH2OH
加热、加压
2CH3CH2OH+O2 Cu /Ag 2CH3CHO+2H2O
5 正丙醇催化氧化
2CH3CH2CH2OH+O2 Cu /Ag 2CH3CH2CHO+2H2O
6 异丙醇催化氧化
2
+O2 Cu /Ag 2
+2H2O
7
乙醇直接被氧化成 乙酸
CH3CH2OH 酸性高锰酸钾/酸性重铬酸钾 CH3COOH
C16H34 高温 C14H30+C2H4
C16H34 高温 C12H26+C4H8
第 1 页 共 14 页
2、乙烯及烯烃 (易氧化、能使酸性高锰酸钾褪色、易加成、易加聚)
1
乙烯的制备
CH3CH2OH 浓硫酸 CH2===CH2↑+H2O 170C
2
乙烯的燃烧反应 CH2=CH2+3O2 点燃 2CO2+2H2O
有机化学方程式汇总
1、甲烷及烷烃 (易燃烧、易取代、可裂解)
有机化学方程式总结
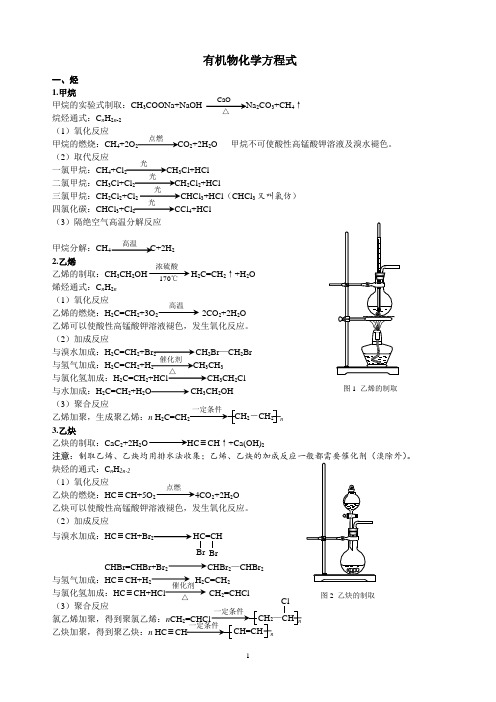
有机物化学方程式一、烃 1.甲烷甲烷的实验式制取:CH 3COONa+NaOH Na 2CO 3+CH 4↑烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl(3)隔绝空气高温分解反应甲烷分解:CH 4 C+2H 22.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成:H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2注意:。
炔烃的通式:C n H 2n-2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH n乙炔加聚,得到聚乙炔:n HC ≡ nCaO△点燃光光光光高温浓硫酸170℃ 高温催化剂 △2-CH 2 图1 乙烯的制取点燃图2 乙炔的制取催化剂△Br 2—CH ClCH=CH4.苯苯的同系物通式:C n H2n-6(1)氧化反应苯的燃烧:2C6H6+15O212CO2+6H2O 苯不能使酸性高锰酸钾溶液褪色,能使溴水褪色。
高中有机化学常考方程式总结

高中有机化学常考方程式总结一、加成反应①CH2==CH—CH3+Br-Br CH2BrCHBrCH3;②CH2==CH—CH3+H-O-H (需注意加成的方向)③醛基中的羰基()可与H 2、HCN 等加成,但不与Br2加成。
RCHO+H 2 RCH 2OH二、聚合反应(加成聚合、缩合聚合)(一)加成聚合1.聚单烯类(塑料纤维)①② a.nCH2==CH—CH3b.C.2.聚二烯类(橡胶)R可为—H、—Cl、—CH3等。
3.混聚:两种或两种以上单体加聚nCH2==CH—CH==CH2 + nCH2==CH—CN(二)缩合聚合(缩聚反应)1.聚酯类:—OH与—COOH间的缩聚① nHOCH2—CH2—OH + nHOOC—COOH②2.聚氨基酸类:—NH2与—COOH间的缩聚①②3.酚醛树脂类三、取代反应(一)芳香族多元取代规律(受支链影响多取代邻对位)1、取代:苯与硝酸反应后只被一个硝基取代。
而苯的同系物的苯环上能被三个硝基取代:+3HO—NO2――→浓硫酸△—C—O催化剂催化剂2.苯环上的取代反应(羟基影响苯环)(二)浓硫酸作用下的取代1.常见酯化反应的类型①一元羧酸与一元醇间的酯化反应 :CH 3COOH +C 2H 5OH CH 3COOC 2H 5+H 2O ②多元羧酸与多元醇间的酯化反应成环反应:HOOC —COOH + HOCH 2—CH 2OH聚合反应:nHOOC —COOH +n HOCH 2CH 2OH H +(2n -1)H 2O ③羟基羧酸自身酯化反应2.醚化反应①140 ℃时发生副反应: 2CH 3CH 2OH CH 3CH 2OCH 2CH 3+H 2O 。
四、氧化反应(一)与KMnO 4(H +)反应,使KMnO 4(H +)褪色:1.CH 3C ≡CHCH 3COOH + CO 22.3.CH 3CH 2OHCH 3COOH4.CH 3CHO CH 3COOH(二)醇(R —CH 2OH ) R —CHOR —COOH2R —CH 2OH + O 2 2R —CHO + 2H 2O(三)醛基(-CHO )被弱氧化剂氧化:RCHO + 2Ag(NH 3)2OH ———→水浴 RCOONH 4+3NH 3+2Ag ↓+H 2O (银镜反应)。
有机化学方程式总结

有机化学方程式总结有机化学是一门研究有机化合物的组成、结构、性质和变化的科学。
在有机化学的学习中,掌握各种有机化合物的化学反应方程式是非常重要的一部分。
下面是对一些常见有机化学反应方程式的总结:1、烷烃的取代反应CH4 + Cl2 → CH3Cl + HCl2、烯烃的加成反应CH2=CH2 + H2 → CH3CH33、炔烃的加成反应CH≡CH + 2H2 → CH3CH34、醇的氧化反应2CH3CH2OH + O2 → 2CH3CHO + 2H2O5、酮的氧化反应2RCOCH3 + O2 → 2RCOCHO + 2H2O6、羧酸的酯化反应CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O7、酯的水解反应CH3COOCH2CH3 + H2O → CH3COOH + CH3CH2OH8、醛的还原反应R-CHO + H2 → R-CH2OH9、酮的还原反应R-CO-R' + H2 → R-CH2-R' + H2O10、酰胺的水解反应NH2CO-R + H2O → NH3 + R-COOH以上仅是一些常见的有机化学反应方程式,但它们是学习有机化学的基础。
通过理解和记忆这些反应方程式,可以更好地理解有机化学的原理和应用。
对于一些复杂的有机化学反应,需要更加深入的学习和理解。
真空泄污系统自控系统是一种高效、环保的自动化设备,专门设计用于处理和减少废物排放。
此系统利用真空技术,自动抽取和处理废气、废液等污染物,达到国家环保排放标准。
真空泵:用于产生负压,从污染源抽取污染物。
传感器:检测污染物的种类和浓度,以便控制系统能够做出相应的调整。
控制系统:根据污染物的种类和浓度,自动调整真空泵的工作状态和净化设备的运行。
净化设备:对抽取的污染物进行过滤、吸附、化学反应等处理,降低或消除污染。
排放系统:经过处理的污染物被安全地排放到大气中。
自动检测:系统自动检测污染物的种类和浓度,实时调整处理策略。
高中有机化学方程式总结

高中有机化学方程式总结Last revised by LE LE in 2021高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n 乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应 乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n H 2C=CH 2 n 3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2点燃光光 光 光 浓硫酸170℃ 点燃催化剂△催化剂加热加压 催化剂CH 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC ≡CH n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
有机化学反应方程式总结

有机化学反应方程式总结一. 取代反应1.CH4 + Cl2—1:1光照C2H6 + Cl2-1:1光照2. C6H6 + Br2—铁屑3. C2H5OH + HBr--加热4. C6H6+ HNO3--H2SO4 水浴加热7. C2H5Cl + H2O—NaOH8. CH3COOC2H5 + H2O--无机酸8. CH3COOC2H5 + H2O—碱9. (C17H35COO)3C3H5 + 3NaOH →皂化反应二. 加成反应10. CH2=CH2 + H2→Ni加热13. CH2=CH2 + HCl--催化剂,加热14. C2H2 + HCl 1:1--催化剂,加热C2H2 + 2H2-- Ni,加热16. CH2=CH-CH=CH2 + Br2 1,2加成17. CH2=CH-CH=CH2 + Br2 1,4加成18. CH2=CH-CH=CH2 + 2Br2 1,2,3,4加成19. CH3CHO + H2 –Ni20. CH2OH-(CHOH)4-CHO(葡萄糖) + H2 --Ni21. C6H6 + 3H2—Ni23. CH2=CH2 + H2O三. 消去反应24. CH3CH2OH-- 浓H2SO4 ,170℃25. CH3CH2Br + NaOH--醇,加热四. 酯化反应(亦是取代反应)26. CH3COOH + CH3CH2OH-- 浓H2SO4,加热27. C3H5(OH)3 + 3HNO3 --浓H2SO4五. 水解(卤代烃、酯、油脂的水解见上,亦是取代反应)32. CH3CH2ONa + H2O33. C6H5ONa + H2O36. 2(C6H10O5)n(淀粉) + nH2O --H2SO4,加热38. C12H22O11 (蔗糖) + H2O --H2SO439. C12H22O11(麦芽糖)+ H2O -六. 氧化反应41. 2C2H5OH + O2 --Cu或Ag43. 2CH3CHO + O2 →2CH3COOH47. CH3CHO + 2[Ag(NH3)2]OH→48. CH3CHO + 2Cu(OH)2 加热→49.CH2OH(CHOH)4CHO(葡萄糖)+2[Ag(NH3)2]OH→50.CH2OH(CHOH)4CHO+2Cu(OH)2--加热→57. HCHO + 4[Ag(NH3)2]OH →58. HCHO + 4Cu(OH)2 加热→七. 还原反应59. CH3COCH3 + H2 --Ni →60. HCHO + H2 --Ni →61. C6H5CH=CH2 + 4H2 --Ni →八. 加聚反应62. nCH2=CH2 →63. nCH3-CH=CH2 →64. nCH2=CHX →69. nCH2=CH-CH=CH2 →72. nCH2=CH2 + nCH3-CH=CH2 →九. 缩聚反应73. C6H5OH + HCHO---浓HCl,加热→74. HOOC- -COOH + HO-CH2CH2-OH →十. 其他(一)有机物跟钠的反应75. CH3CH2OH + Na76. C6H5OH + Na77. CH3COOH + Na(二)炭化78. C12H22O11 --浓H2SO4 →12C + 11H2O(三)分子间脱水79. 2C2H5OH-- 浓H2SO4,140℃(四)氨基酸的两性。
高中有机化学方程式总结1

高中化学方程式总结(第二部分),第二—1页,共3页有机化学方程式总结甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成:H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH乙烯加聚:n H 2C=CH 2 n 苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯与溴反应:苯的硝化反应 +HO —NO +H 2O苯与氢气加成甲苯与硝酸反应制取TNT溴乙烷的水解:C 2H 5—Br+ NaOH C 2H 5—OH+HBr 溴乙烷消去反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O点燃 光光 光 高温 催化剂△ CH 2-CH 2 点燃 +Br +HBrBr NO 2 +3H CH 3 | +3HNO 3 浓硫酸 O 2N — CH 3 | —NO 2 | NO 2+3H 2O 醇 △ 光高中化学方程式总结(第二部分),第二—2页,共3页 乙醇的催化氧化:2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O (乙醛)乙醇消去反应:17032222CH CH OH CH =CH +H O −−−−→↑浓硫酸℃乙醇与浓硫酸在140℃时发生的反应 2C 2H 5OHC 2H 5—O —C 2H 5+H 2O (乙醚) 苯酚与氢氧化钠 苯酚钠与盐酸的反应: + HCl +NaCl苯酚钠与CO 2反应: +CO 2+H 2 +NaHCO 3苯酚与溴水 +3Br 2 ↓+3HBr(乙醛与氢气反应:CH 3—C —H+H 2 CH 3CH 2OH 乙醛与氧气反应:2CH 3—C —H+O 2 2CH 3COOH (乙酸)乙醛的银镜反应: CH 3CHO +2Ag(NH 3)2OH CH 3COONH 4+2Ag+3NH 3+H 2O (乙酸铵) 乙醛还原氢氧化铜:CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O乙醇与钠反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑(乙醇钠)乙酸与钠反应:CH 3COOH+Na CH 3COO Na +H 2乙酸与碳酸钠反应:CH 3COOH+Na 2CO 3 CH 3COO Na +H 2O+ CO 2乙酸与乙醇发生酯化反应 CH 3—C —OH+C 2H 5—OH CH 3—C —OC 2H 5+H 2O (乙酸乙酯)乙酸乙酯酸性条件水解反应CH 3COOC 2H 5+H 2O CH 3COOH+C 2H 5OH乙酸乙酯碱性条件水解反应CH 3COOC 2H 5+NaOH CH 3COONa+C 2H 5OH 催化剂 △ 浓硫酸 140℃ —OH +H 2O ONa —ONa OH —OH —Br Br — | Br | 催化剂 △ O || 催化剂 △ △ △ O || 浓硫酸 △ 无机酸 —OH —ONa高中化学方程式总结(第二部分),第二—3页,共3页。
化学有机物方程式总结

化学有机物方程式总结有机物是指碳元素为主要组成元素的物质,其构成的化学键主要是碳碳键和碳氢键。
有机物方程式是描述有机物反应和转化的化学方程式,它们对研究有机化学的基本原理和应用具有重要意义。
下面将对一些常见的有机物方程式进行总结。
1.烷烃的燃烧反应:烷烃是由碳氢键构成的最简单的有机物,其分子式为CnH2n+2、烷烃的燃烧反应是指烷烃与氧气反应生成二氧化碳和水。
反应方程式通常表示为:烷烃+氧气→二氧化碳+水。
2.烯烃的加成反应:烯烃是由碳碳双键构成的有机物,其分子式为CnH2n。
烯烃具有较高的反应活性,可以与其他化合物发生加成反应。
例如,乙烯(C2H4)与溴(Br2)反应生成1,2-二溴乙烷,反应方程式为:乙烯+溴→1,2-二溴乙烷。
3.炔烃的加成反应:炔烃是由碳碳三键构成的有机物,其分子式为CnH2n-2、炔烃的加成反应是指炔烃与其他化合物发生加成反应。
例如,乙炔(C2H2)与氢气(H2)反应生成乙烯,反应方程式为:乙炔+氢气→乙烯。
4.醇的酸碱中和反应:醇是一类带有羟基(-OH)官能团的有机物,其分子式为ROH。
醇可以与酸反应生成酯,也可以与碱反应生成醇盐。
例如,乙醇(C2H5OH)与硫酸反应生成乙酯(C2H5OC2H5),反应方程式为:乙醇+硫酸→乙酯+水。
5.醛的氧化反应:醛是由羰基(C=O)官能团连接一个氢原子的有机物,其分子式为RCHO。
醛可以发生氧化反应,生成相应的羧酸。
例如,乙醛(CH3CHO)经过氧化反应生成乙酸(CH3COOH),反应方程式为:乙醛+氧气→乙酸。
6.酮的加氢还原反应:酮是由羰基连接两个碳基团的有机物,其分子式为RCOR'。
酮可以通过加氢还原反应转化为相应的醇。
例如,丙酮(CH3COCH3)经过加氢还原反应生成异丙醇(CH3CHOHCH3),反应方程式为:丙酮+氢气→异丙醇。
以上只是对一些常见有机物方程式进行了简要总结,实际上有机化学领域有着丰富且复杂的方程式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学方程式总结
1. 甲烷与氯气 CH 4+Cl 2CH 3Cl+HCl
CH 3Cl+Cl 2CH 2Cl 2+HCl
CH 2Cl 2+Cl 2CHCl 3+HCl
CHCl 3+Cl 2CCl 4+HCl
2. 乙烯实验室制法(浓硫酸作催化剂,脱水剂)
CH 3CH 2OH H 2O + CH 2=CH 2 ↑
3. 乙烯通入溴水中 CH 2=CH 2 + Br 2
CH 2BrCH 2Br
4.乙烯和HBr 的反应 CH 2=CH 2 + HBr 催化剂
CH
3CH 2Br
5. 乙烯水化制乙醇 CH 2=CH 2 + H 2O CH 3CH 2OH
6. 制取聚乙烯、聚丙烯 n CH 2=CH 2 催化剂
n CH 3–CH=CH 2
催化剂
CH 3
7. 乙炔的制取 CaC 2 + 2H 2O Ca(OH)2 + ↑
8. 由乙炔制聚氯乙烯 + HCl H 2C=CHCl
n H 2C=CHCl 催化剂
9. 苯与液溴反应(需铁作催化剂)
+ Br 2 +HBr
CH 2-CH 2 n Fe 催化剂 △
HC ≡CH HC ≡CH CH -CH
2 n
Cl
CH -CH 2
n
10. 苯的硝化反应
+ HNO 3
+ H 2O
11. 苯与氢气加成生成环己烷
+ 3H 2 催化剂
△
12. 甲苯发生硝化反应
+3HONO 2 浓硫酸 △ + 3H 2O
13. 乙醇与钠反应 2CH 3CH 2OH + 2Na 2CH 3CH 2ONa + H 2↑
14. 乙醇催化氧化 2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O
15.乙醇脱水(分子间、分子内)CH 3CH 2OH H 2O + CH 2=CH 2 ↑
2CH 3CH 2OH H 2O + CH 3CH 2O CH 2 CH 3
浓H 2SO 4 55-60℃
NO 2 ––NO 2
| NO 2
O 2N
–– CH 3
|
Cu
△ 浓H 2SO 4 140℃
16. 乙醛制乙酸
2CH 3CHO + O 2 催化剂 △ 2CH 3COOH
17. 银镜反应:配银氨溶液:AgNO 3 + NH 3·H 2O == AgOH↓ + NH 4NO 3
AgOH + 2NH 3·H 2O == Ag(NH 3)2OH + 2H 2O
RCHO + 2Ag(NH 3)2OH 2 A g ↓+ RCOONH 4 + 3NH 3 + H 2O
CH 3CHO + 2Ag(NH 3)2
OH
H 2O + 2Ag↓+ 3NH 3 + CH 3COONH 4 18. 醛与新制氢氧化铜悬浊液 配氢氧化铜:2NaOH + CuSO 4 == Cu(OH)2↓+ Na 2SO 4 RCHO + 2Cu(OH)2
RCOOH + Cu 2O↓+ 2H 2O CH 3CHO + 2Cu(OH)2
Cu 2O ↓+ 2H 2O + CH 3COOH
19. 乙酸与氢氧化铜悬浊液(变成蓝色溶液)
2CH 3COOH + Cu(OH)2 = (CH 3COO)2Cu + 2H 2O
20. 酯的制取(用饱和碳酸钠溶液收集)
CH 3COOH + CH 3CH 2OH
CH 3COOC 2H 5 + H 2O 21. 酯的水解
CH 3COOCH 2CH 3+NaOH
CH 3COONa+CH 3CH 2OH 22. 葡萄糖与银氨溶液
CH 2OH (CHOH )4 CHO +2Ag(NH 3)2OH
H 2O + 2Ag↓+ 3NH 3 + CH 2OH (CHOH )4 COO NH 4 CH 2OH(CHOH)4CHO + 2Cu(OH)2
CH 2OH(CHOH)4COOH + Cu 2O↓+ 2H 2O
浓硫酸
△
23. 蔗糖水解方程式
C12H22O11 + H2O 催化剂
C6H12O6 + C6H12O6
蔗糖葡萄糖果糖24. 麦芽糖水解方程式
C12H22O11 + H2O 催化剂
2C6H12O6
麦芽糖葡萄糖25. 淀粉水解
(C6H10O5)n + nH2O 催化剂
nC6H12O6
淀粉葡萄糖26. 硬脂酸甘油酯皂化反应
+3NaOH 3 C17H35COONa + 26、油脂的氢化(油酸甘油酯变硬脂酸甘油酯)CH2–OH |
CH–OH |
CH2–OH
C17H35COO─CH2 C17H35COO─CH C17H35COO─CH2。
