过渡金属配合物的发光材料ppt课件
完整的PPT讲解

(3)发光很弱的稀土离子:Pr3+,Nd3+,Ho3+,Er3+,Tm3+,Yb3+
一.金属-有机配合物(MOFs)发光材料
1.MOFs的定义: MOFs 材料是由无机金属中心(金属离子 或金属簇)与桥连的有机配体通过自组装相互 连接,形成的一类具有周期性网络结构的晶
态多孔材料。
2.特点: 无机材料刚性和有机材料柔韧性
/10.1021/cr200101d |Chem. Rev.2012, 112,1126–1162
3.稀土配合物的荧光
稀土有机配合物具有优异的发光特性,但是具 有较差的热稳定性。由于杂多酸盐具有很好的热 稳定性,所以,稀土取代杂多酸盐可以克服稳定 性差的特点。稀土配合物的荧光发射具有特征性, 其发射峰出现的位置相对稳定,不会因为所选配 体的不同产生较大的峰位移。 与过渡金属配合物的荧光发射相比,稀土配合 物的荧光发射拥有谱带窄,色纯度很高,转换效 率高,光吸收能力强等优点。
3. syntheses of MOFs:
(1)diffusion technique defect:time-consuming 、 the yield is typically low. (2)Hydrothermal syntheses (3)mechanochemical solid-state grinding advantage: not to use organic solvents. (4)liquid-assisted grinding advantage:The construction of MOFs is accelerated (5)sonochemical homogeneous nucleation and short crystallization time (6)microwave-assisted syntheses advantage:instant syntheses of high-quality MOF crystals within a minute
《过渡金属》PPT课件

Cr6+中(3d0)无d-d跃迁,但都显色,原因是Cr6+有较强的正 电场,O一端电子向Cr的3d轨道跃迁(此跃迁属p-d跃迁,是 电荷迁移跃迁的一种),吸收可见光区一定波长的光,使化合 物显色。
[
C
r2
O
2 7
]
[
C
r
O
2 4
]2 [ H
]2
1014
[
C
r2
O
2 7
]
[
C
r
O
2 4
]
2Байду номын сангаас
1014[H
]2
酸性 [H+]>10-7 [Cr2O72-]>[CrO42-]橙 中性 [H+]=10-7 [Cr2O72-]≈[CrO42-] 碱性 [H+]<10-7 [Cr2O72-]<[CrO42-]黄
➢钨丝还用于制做灯丝(温度可高达2600℃不熔化,发光率高、寿 命长),高温电炉的发热元件等。
3、存在和冶炼: 存在:铬铁矿[Fe(CrO2)2],灰鉬矿(MoS2), 白钨矿(CaWO4),黑钨矿[(Fe,Mn)WO4]
冶炼:MoO3 + 2Al 灼热 Mo + Al2O3 MoO3 + H2 450-650℃ MoO2 + H2O MoO2 + H2 950-1100 ℃ Mo + 2H2O WO3 + 3H2 650-820℃ W + 3H2O
显然,这是因为这类阳离子铬酸盐 有较小的溶度积的原因.
过渡金属配合物的电子光谱

紫 紫 蓝 480 红 红 绿蓝 490 650 蓝绿 橙 黄 绿 500 598 黄 绿
580
560
二 配体内部的电子光谱
配位体如水和有机分子等在紫外区经常出现吸收谱带。形成配合物后, 这 些谱带仍保留在配合物光谱中, 但从原来的位置稍微有一点移动。
配位体内部的光谱包括以下三种类型: ① n→* 处于非键轨道的孤对电子到最低未占据的空轨道 ζ*反键轨道的跃迁。水、醇、胺、卤化物等配体常发生这类跃 迁。 ② n→* 处于非键轨道的孤对电子到最低未占据空轨道* 反键分子轨道的跃迁, 常出现在含羰基的醛和酮类分子中。 ③ →* 处于最高占据轨道分子轨道的电子向最低未占 据的空轨道*反键分子轨道跃迁, 这类跃迁经常出现在含双键、 叁键的有机分子中。
Td d2 、 d 7
相 反 相 相反
Oh d 3 、 d8
相 反
同
相 同
Td d3 、 d8
相反
Oh d2 、 d7
由d2、d8、d3、d7组态 的Orgel图可以发现: ① F谱项在配位场中 分裂为T1、T2和A2, 而P谱 项不分裂但变成T1, 基态F 谱项与P谱项能量差为 15B'。 ② 相同类型的线 , 如 T1(P) 和 T1(F) ( 图的左边 ) 是禁止相交的 , 他们发生 弯曲, 互相回避, 其弯曲的 程度以C表示, 称为弯曲系 数。
ⅱ d-d跃迁吸收峰的半宽度
① 由于振动将使得配体-金属之间的键长不停地 变化, 从而分裂能将随键长的增加而减小。而分裂能的 变化将导致配位场谱项之间的能量间隔发生变化, 并维 持在一定的范围。
② Janh-Taller效应导致轨道能级进一步分裂, 这 种分裂常使吸收峰谱带加宽。
3.1-配合物的UV-vis光谱

过度金属配合物的紫外-可见吸收光谱主要是由于配体与金属离子间 的结合而引起的电子跃迁,因此也称为电子光谱(electronic spectrum)
在紫外-可见吸收光谱中,根据吸收带来源的 不同划分:
紫外-可见吸收光谱
配位场吸收带Leabharlann 电荷跃迁吸收带配体内的电子跃迁吸收带
定性定量分析
金属向配体的跃迁 MLCT
n
等跃迁,研究配体间的作用方式和关系。波长范围大多在近紫外-可见光区。
生色团:分子结构的某些基团吸收某种波长的光,而不吸收另 外波长的光,从而使人觉得好像这一物质“发出颜色”似的, 因此把这些基团称为“发色基团/发色团”。例如>C=C<, >C=O,-N=N-,-C C-,-C N-等。 助色团:分子中本身不吸收辐射而能使分子中生色基团的吸收峰 向长波长移动并增强其强度的基团,如羟基、胺基和卤素等。助 色团可以分为两类: 酸性助色团: -COOH, -OH, -SO3H 碱性助色团:-NHR,-NR2,-NH2
包括d-d跃迁和f-f跃迁,对于过渡金属配合物而言也称为d-d跃 迁吸收带,其位置变化和裂分可跟踪考察配合物的反应和形式, 波长范围大多在可见光区。下面为d-d跃迁。
中心离子所带电量越大,周期数越高,分裂能越大。不同的配位场, 平面四方>八面体>四面体。
配体向金属的跃迁 LMCT 电荷跃迁吸收带
吸收的光与透过的光互为补色。
定性分析
定量分析
过渡元素的配合物的成键理论过渡金属化合物的电子光谱过渡元素

一般地说, 只有惰性配位化合物才表现出异构现象, 因为不 安定的配位化合物常常会发生分子内重排, 最后得到一种最稳定 的异构体。
配合物的立体异构
立体异构可分为几何异构和光学异构两种
1 几何异构 在配合物中, 配体可以占据中心原子周围的不同位置。所研
1 电离异构 名词用于描述在溶液中产生不同离子的异构体, 一个经典
的例子是,[Co(NH3)5Br]SO4紫红色和[Co(NH3)5SO4]Br(红色), 它们在溶液中分别能产生SO42-和Br-。
2 溶剂合异构 当溶剂分子取代配位基团而进入配离子的内界所产生的溶
剂合异构现象。与电离异构极为相似, 最熟悉的例子是: [Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2·H2O [Cr(H2O)4Cl2]Cl·2H2O 它们各含有6、5、4个配位水分子, 这些异构体在物理和化
◆并非化学式为MX3都是三配位的。如, CrCl3为层状结 构, 是六配位的;而CuCl3是链状的, 为四配位, 其中含有氯桥 键, AuCl3也是四配位的, 确切的分子式为Au2Cl6。
3 四配位化合物
四配位是常见的配位, 包括 平面正方形和四面体 两种构型。
一般非过渡元素的四配位化合物都是四面体构型。这是因 为采取四面体空间排列, 配体间能尽量远离, 静电排斥作用最小 能量最低。但当除了用于成键的四对电子外, 还多余两对电子时 , 也能形成平面正方形构型, 此时, 两对电子分别位于平面的上下 方, 如XeF4就是这样。
十一配位的化合物极少, 理
论上计算表明, 配位数为十一的 配合物很难具有某个理想的配 位多面体。可能为单帽五角棱 柱体或单帽五角反棱柱体, 常见 于大环配位体和体积很小的双 齿硝酸根组成的络合物中。
第4章(4)过渡金属配合物的电子光谱
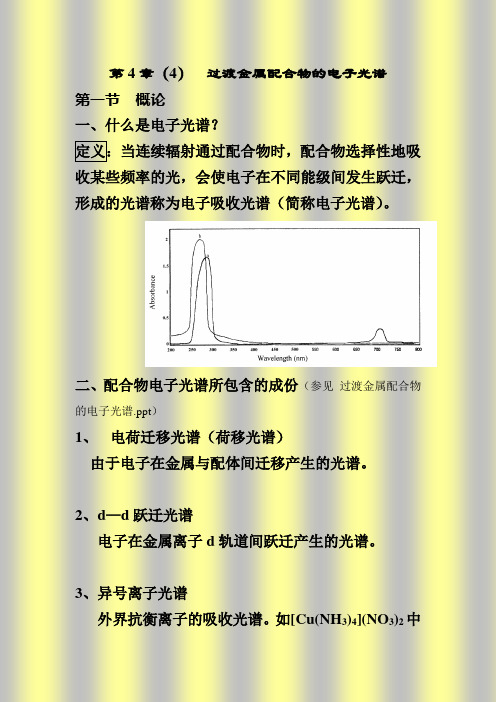
二、配合物电子光谱所包含的成份(参见过渡金属配合物.ppt)电荷迁移光谱(荷移光谱)由于电子在金属与配体间迁移产生的光谱。
—轨道角量子数注*矢量用黑体字母表示。
*角动量:就是质量乘以角速度(单位角度/秒)。
自旋角动量:角动量是由物体自旋产生的,而不是外力给它的。
轨道角动量:角动量是由轨道运动产生的2、电子间相互作用在多电子体系中,l i与l j主要是通过电性相互作用;而s i与l i或s j之间则主要通过磁性作用。
s i s jl i l j对轻元素(原子序数<30),电子间偶合强于电子内偶合,即:l i——l js i——s j的作用要大于s i——l i的作用。
此时电子间相互作用,可用L—S偶合方案处理:(参见L—S偶合方案.pdf)Σl L (总轨道角动量)Σs S (总自旋角动量)即可用L、S描述多电子体系的状态。
│S│=[S(S+1)]1/2(h/2π) │L│=[L(L+1)] 1/2(h/2π)S——总自旋角量子数L——总轨道角量子数如何求S、L见“物质结构”。
3、d n组态金属离子的谱项多电子体系的能量状态可用谱项符号表示:2S+1L L 0 1 2 3 4 5符号S P D F G H(2S+1)为谱项的自旋多重度。
如S=1/2,L=2时,为2D谱项。
组态谱项d1 d92Dd2 d83F,3P,1G,1D,1Sd3 d74F,4P,2H,2G,2F,2x2D,2Pd4d65D,3H,3G,2x3F,3D,2x3P,1I,2x1G,1F,2x1D,2x1Sd56S,4G,4F,4D,4P,2I,2H,2x2G,2x2G,2x2F,3x2D,2P,2S* d n体系,不考虑电子间作用时,只有一种能量状态。
考虑电子间作用后,产生多个能量状态(谱项)。
d1体系除外,因其只含一个电子。
4、基态谱项1)定义:能量最低的谱项称为基态谱项(基谱项)。
1)如何确定基谱项?A、同一电子组态的各谱项中,自旋多重度最大者能量最低。
过渡金属配合物催化剂及其相关催化过程ppt课件

一、过渡金属配合物种的化学键
四类配体:
4)配体同时提供一个充满的成键轨道和一个空的反键 轨道,与金属的相应轨道作用。配体的成键轨道与金 属的空轨道作用,形成/ 键;配体空的反键轨道与 金属的充满轨道作用,形成键。如CO、烯烃、磷化
氢等。
一、过渡金属配合物种的化学键
一、过渡金属配合物种的化学键
插入反应:一个原子或分子插入两个初始键合的金
属-配体间。
烯烃向金属-烷基间的插入反应假定机理:
三、相关催化过程
烯烃加氢
能够活化氢的的金属配合物: RuCl63-;Co(CN)53-;RhCl(PPh3)3(即Wilkinson配合物, 对均相催化加氢非常有效)
三、相关催化过程
烯烃加氢
这类催化剂在加氢反应中 的作用为:
二、有机金属配合物的反应与催化反应
氧化加成:配体加成至金属原子并使价态升高的反
应(如H2对配合物的加成)。
氧化加成要求金属周围有两个空配位点,并且金属具 有差值为2 的两种氧化态,比如金属Rh。H2、HI和 CH3I等可以发生氧化加成反应。
二、有机金属配合物的反应与催化反应
插入反应:一个原子或分子插入两个初始键合的金
三、相关催化过程
乙烯氧化制乙醛——Wacker过程
4)在反应体系中直接加入乙醇,有乙醇转化为醛的速率要 比乙烯直接氧化得到醛的速率慢得多,这说明乙烯氧化为乙 醛不是以乙醇作为中间产物; 5)用重水所作的实验表明,所得乙醛分子中不含有D,说明 乙醛中的四个H全部来自乙烯内部; 6)动力学研究表明,插入反应是速控步,根据这一速控步 骤的机理可以导出总反应速率方程
C2H4 PdCl2 H2O CH3CHO Pd 2HCl
2)Pd(0)被氧化为Pd(II),Cu2+还原为Cu+:
稀土_稀土-过渡金属配合物的合成、结构及发光性质

稀土/稀土过渡金属配合物的合成、结构及发光性质摘要稀土/稀土过渡金属配合物不仅具有迷人的结构,而且因其在单分子磁体、低温温度计等领域的潜在应用成为研究热点。
近十几年所报道的稀土/稀土-过渡金属配合物大多数是通过水热/溶剂热法合成得到的。
本文在水热条件下合成了四例稀土金属配位聚合物(化合物1-4)、两例零维的稀土-过渡金属簇合物(化合物5和6),两例零维的稀土-过渡金属配合物(化合物7和8)以硝酸钬为稀土源,二甘醇酸(C4O5H6)为配体,水热条件下得到了一例二维稀土金属配位聚合物[Ho2(C4O5H4)3(H2O)4]·2H2O(1)。
化合物1属于正交晶系,空间群为C2221。
该化合物中的稀土Ho离子通过与二甘醇酸配体上的羧基氧原子相互连接形成二维层状结构。
以硝酸钆为稀土源,4,4’-二苯醚二甲酸(C14O5H10)为配体,水热条件下得到了一例三维稀土金属配位聚合物Gd2(C14O5H8)3(H2O)4(2)。
化合物2属于单斜晶系,空间群为P21/c。
该化合物中的稀土Gd离子通过与2,2-二苯醚二甲酸配体上的羧基氧原子相互连接形成二维层,层与层之间通过配体氧原子连接形成三维网状结构。
以氧化镝为稀土源,亚氨基二乙酸(H2ida)为配体,水热条件下得到了一例三维稀土金属配位聚合物[Dy2(ida)3]·H2O(3)。
化合物3属于四方晶系,空间群为I41/a。
该化合物中的稀土Dy离子通过与亚氨基二乙酸配体上的氧原子相互连接形成二维层,层与层之间通过配体氧原子连接形成三维骨架结构。
以硝酸钬为稀土源,2,3-吡嗪二羧酸(2,3-pzdaH2)为配体,水热条件下得到了一例三维稀土金属配位聚合物[Ho2(2,3-pzda)3(H2O)5]·3H2O(4)。
化合物4属于三斜晶系、空间群为P-1。
该化合物中的稀土Ho离子通过与2,3-吡嗪二羧酸配体上的羧基氧原子互相连接形成二维层,层与层之间通过配体氧原子连接形成三维骨架结构。
有机-过渡金属配合物的三重态发光问题

( 中国 科 学 院 理 化 技 术研 究 所 , 京 1 09 ) 北 0 10
摘
要 :近年 来 , 随着 OI D 器件 的发展 , 关有 机一 渡 金 属 配合 物 的三 重 态 E 有 过
发 光 问题 受到人 们广 泛的 关注 。这 不仅是 与 电致发 光 器件 效 率的提 高相 关联 ,
合作 用 ( O 和构 型相互作 用( I的 影响 下 , S c) C) 导致 单 重 态与 三 重 态的 混合 和促
进 从 最 低 三 重 态到 基 态 的 发 光 跃 迁进 行 了讨 论 .
关 键 词: 机 过 度金属 配合 物 ; 场一 有 零 分裂 ( F ) 自旋一 道偶 合 ; ZS; 轨 光物理 行 为 ;
特别是 它们 的光 物理性 能进 行 了大量 研究 l . 】 众所 周 知 , 合 物 的光致 发光性 质 决定 于 ] 化
分 子轨 道 ( MO) 中那些被 称 为“ 线 轨 道” 前 的性 质 , 子最 低 激发 态 与基 态 问 的跃 迁 对应 分
其 发光. 同样 , 电致发 光过 程 中 , 在 器件 的发光 也 同样 取决 于 其分 子轨 道 的性 质 , 然 , 当 二 者 激发态形 成 与“ 布居 ” 过程 有所不 同. 机分 子在受 光激 发下 , HO 有 其 MO轨 道 上 的 电子
三 重 态 的 发 光
文章 编 号 :1 7 — 4 5 2 1 ) 20 8 —8 6 40 7 ( 0 1 0 — 0 11 中图分类号 : 4 06 文献标识码 : A
自上世纪 后期有 机一 电子 学 , 别 是有 机 发 光 二 极管 ( D) 到 迅 速 的发 展 以来 , 特 OI E 得 为提高 器件 的电一 转换 效率 和寻找新 型三 重态 发光材 料 , 们 对有 机一 渡金 属配 合 物 , 光 人 过
《过渡金属配合物》课件

选择性。
配合物合成方法
1
配体置换法
我们将学习通过配体置换反应合成配合
还原法
2
物的方法,并举例说明。
另一种常用的合成方法是通过还原反应
获得过渡金属配合物。
3
水解法
水解反应可以用于制备某些类型的过渡 金属配合物。
结论和总结
在本次《过渡金属配合物》PPT课件中,我们深入讨论了配合物的基本概念、 命名、性质与应用。希望您通过这次课件对过渡金属配合物有了更全面的了 它们的重要一步。本节中,我们将学习命名规则,并通过示例加深理解。
配合物的性质与应用
1 光谱性质
我们将研究过渡金属配合物在紫外-可见光谱和红外光谱中的表现。
2 催化性质
我们将探讨过渡金属配合物的催化应用,如氧化反应、加氢和缩合等。
3 生物学应用
过渡金属配合物在生物学中具有重要的应用,包括药物开发和医学成像。
《过渡金属配合物》PPT 课件
欢迎来到本次《过渡金属配合物》PPT课件,让我们一起探索这个引人入胜的 化学领域。通过本次课件,您将了解到配合物的基本概念、性质和应用。
配合物简介
在这一部分,我们将介绍什么是过渡金属配合物,包括它们的结构、特征以 及有机酸和配体的作用。
配位键与配体
配位键是什么?什么是配体?在这一部分中,我们将深入探讨配位键的概念和不同类型的配体。
过渡金属配合物的示例
五硝酰胺钛(III)配合物
这种配合物由五个硝酰胺分子和 一个钛(III)离子组成,形成了令人 惊叹的多彩晶体。
顺式-二氨基环己烷铂(II)配 合物
这种配合物是重要的白细胞减少 症治疗药物,可以用于癌症治疗。
四-[α-侧醇]环己基[α-(二苄 基亚甲基)异腈]铜(II)配合 物
第7章-过渡金属卡宾和卡拜配合物PPT课件

Cp(CO)2Mn=CPh2 + N2 + THF
R N
Base Cl N R
R
R
N Fe(CO)5
N
(CO)4Fe
N
N
R
R
•9
R
R
N
N
Mo(CO)6 +
N
N
R
R
Ph
Cl
Na2Cr(CO)5 +
Ph
Cl
R
N (CO)5M
N
R
(CO)5Cr
Ph
+ 2NaCl Ph
•10
2-
(CO)nM
+ Ph2C=NMe2
•1
• 7.1过渡金属卡宾配合物的结构与类型
OC
OC
Cr
CO C
CO
CO
Ph OCH3
Cr C 204pm ( Cr C 221pm)
C卡 O 133pm CH3 O 146pm
( C O 143pm )
(
O 127pm)
θ C卡 O CH3 121°
图7-1 Fischer铬卡宾配合物结构数据
•2
R
O
Me
H
OH
H2C
•34
Petasis试剂 Cp2Ti(CH2R)2 → [Cp2Ti = CH R] R = H, Ph
O
Cp2TiMe2
RX
O
O
Ti试剂
O
CH2 RX
X=H, R', OR', NR'2,
O OCR'
CH2
O
Ti试剂: Tebbe 试剂 6%
O
有机-过渡金属配合物的三重态发光问题

有机-过渡金属配合物的三重态发光问题近年来,有机-过渡金属配合物的三重态发光受到了广泛关注。
1. 发光原理:有机-过渡金属配合物在电子共振和协同团簇有序发光机理,以及外加基团之间辐射偶合关系等方面形成三重态发光。
2. 分子结构:由于有机-过渡金属配合物的结构丰富多变,其有序发光
机理亦有很多种,由于偶联环、聚合物形式,配合物的分子结构可以
设计各种组合,使配合物具有良好的热稳定性和光学性能,以实现三
重态发光。
3.发光性质:有机-过渡金属配合物具有高亮度、高平均功率密度、低
能量消耗等发光特点,使配合物变为理想的发光材料。
另外,由于有
机-过渡金属配合物对外加基团具有敏感度,因此可以使用其实现调制
发光性质以及多向发光功能,满足各类特殊的应用需求。
4.应用:有机-过渡金属配合物三重态发光性质可广泛应用于光显示器、各种标记及示踪物质释放、以及生物分析技术等方面。
综上所述,有机-过渡金属配合物的三重态发光对现代科技有着重要的
作用。
除了研究和改善其发光性质和功能,也应当深入研究其制备方
法以及由此形成的应用发展趋势,为人类科技进步做出贡献。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
好的发光材料必须具备以下特征: (1)具有色纯度高的发光色; (2)在电子或光的照射下性能稳定; (3)适合显象管的制造工艺。
21
(四) 常用光学材料:
自从1828年W.Nicol发 明
偏光显微镜以后,人们就系
统地研究天然矿物晶体的光
学性质,而偏光显微镜的心
脏就是由方解石制成的Nicol
棱镜。
[3] 冯巧等. 五配位Cu(Ⅰ)配合物[Cu(4′Phtpy)(PPh3)2] (BF4)的合成、结构及光谱性质研 究[J]. 化学学报. 2002, 60(12)
[4]李奇等. 材料化学[M]. 北京: 高等教育出版社, 26
Thank you !
27
22
几种Hale Waihona Puke 见的发光材料2324
25
参考文献:
[1] 赫奕. 8-羟基喹啉对甲基苯酚合锌配合物的合成 及光致发光和电致发光性能[J]. 高等学校化学学 报, 2003, 23(9)
[2] 谭松庭等. 双8-羟基喹啉-席夫碱-锌高分子配合 物的制备及发光性能[J]. 发光学报. 2003, 24(1)
过渡金属配合物发光材料的研究大多集中 在d10
、d8及Ru2+、Os2+、Rh3+等金属离子的配合 物,
所用配体要是炔烃类、多联吡啶类、苯基膦
类、叶
13
这些材料的发光主要来自配合物的电荷 转移跃
迁。其中,d10金属配合物的发光性质研究主 要集
中在Zn2+、Cu+、Ag+和Au+的配合物,所用 配体
• 在化学反应过程中,某些反应产物接
受化学能而被激发,从激发态返回基态时, 发射出一定波长的光。
•
A + B = C + D*
•
D* → D + h
5
6
• (1)能快速地释放出足够的能量。 • (2)反应历程有利于激发态产物的形成; • (3)激发态分子能够以辐射跃迁的方式返
回基态
7
(2)金属配合物的紫外光谱产生机理主要有三 种类型
9
• 3.金属离子影响下配体的 → * 跃迁
显色剂大多含有生色团和助色团,与金属 离子配 位时,其共轭结构发生变化导致吸收光谱发 生红移 或蓝移。
10
激发
发射
激发态
h
基态
11
配离子形成的化合物有颜色的两个条件是:
d轨道上的电子没有全充满
配离子吸收光的能量在可见光能量范 围之内
12
3 Zn2+、Cu+、Ag+和Au+的配合 物的发光料
(2) 颜色的形成:
颜色是人对光产生的一种感觉,当一束 光的波 长在一定范围内时,这束光就可以被人眼看 到,人 就可以感觉到这束光的颜色。
3
大量事实表明,对于过渡金属元素来说, 其d 电 子的状态是影响其颜色的决定性因素(对于 镧系、 锕系的元素,f 电子同样影响重大)。
4
(二) 发光机理
• (1)化学发光反应条件
1. d一d 配位场跃迁
必须在配体的配位场作用下才可能产生;
一般的规律:轨道分裂能随场强增加而增 加,吸收峰波长则发生紫移。
例:水合铜离子(Ⅱ)是浅蓝色的λmax=794nm ,
8
• 2.电荷转移跃迁
电荷转移跃迁:是指络合物 中配位体和金属离子之间, 一方的电子向主要属于另一 方的轨道的跃迁,所产生的 吸收光谱称为荷移光谱。
变化非常丰富。
14
(1)发光Zn2+配合物
以双(三联吡啶)配体为有机构筑单元,以 Zn2+作为模板自组装得到一系列高分子聚 合链,依R基的不同,这些高分子链的发光 由紫到黄,并具有高的发光亮度和热稳定 性,是很有潜能的电致发光材料。
15
16
R=
图2 含锌-三联吡啶发色团的高分子聚合链 17
目前应用于有机EL 金属配合物的发光材 料大多 配位数均为偶数,四配位的8-羟基喹啉锌配 合物 (Znq2)的荧光来自受金属微扰的配体。
主要内容:
1 绪论; 2 发光机理; 3 Zn2+、Cu+、Ag+和Au+的配合物的发光
料; 4 常用的光学材料及其应用
1
(一) 绪论
(1) 概念: 发光:是一种物体把吸收的能量,不经过热 的阶
段,直接转换为特征辐射的现象。
发光现象广泛的存在各种材料中,发光材 料品种
很多,按激发方式可分为:光致发光材料电 2
18
采用新的方法合成了三配位的锌配合物: 8-羟基喹啉对甲基苯酚合锌配合物(ZnqP, 见
图3), 它的发光性质,应用于有机电致发光器件。
19
(2) 发光Au+、Ag+、Cu+配合物
一系列含苯基膦类及炔烃类配体的三核、 四核 及六核Ag+、Cu+配合物,通过改变炔烃配体 的 取代基团可以精细调控配合物的发光性质。
