2020-2021中考化学 利用化学方程式的简单计算 培优练习(含答案)及详细答案
2020-2021全国中考化学利用化学方程式的简单计算的综合中考真题分类汇总含详细答案

2020-2021全国中考化学利用化学方程式的简单计算的综合中考真题分类汇总含详细答案一、初中化学利用化学方程式的简单计算1.在加热条件下,将一定量的一氧化碳气体通过12g 氧化铜粉末,充分反应后,将生成的气体通入足量氢氧化钠溶液中,测得溶液增重4.4g ,则加热后得到的固体混合物中,铜、氧元素的质量比为 A .14:1 B .12:1 C .8:1 D .4:1【答案】B 【解析】 【详解】设反应的氧化铜质量为x ,生成铜的质量为y ,2=806444xy CuO CO Cu CO 4.4g∆++x 804.4g 44= x =8g , y 644.4g 44= y =6.4g , 剩余氧化铜中铜元素质量为:(12g ﹣8g )×6480=3.2g ,氧元素质量为:4g ﹣3.2g =0.8g ,则加热后得到的固体混合物中,铜、氧元素的质量比为:(6.4g+3.2g ):0.8g =12:1。
故选B 。
2.Fe 2O 3、CuO 的固体混合粉末a g ,在加热条件下用足量CO 还原,得到金属混合物2.41g ,将生成的CO 2气体用足量的澄清石灰水吸收后,产生0.05mol 白色沉淀。
则a 的数值为 A .3.21 B .3.59C .4.01D .7.41【答案】A 【解析】 【分析】 【详解】根据CO 2+Ca(OH)2=CaCO 3↓+ H 2O 中CO 2与CaCO 3的物质的量的关系,可知CO 2为0.05mol ,即0.05mol×44g/ mol=2.2g ,即碳元素的物质的量为0.05mol ,则参加反应的CO 物质的量为0.05mol ,即0.05mol×28g/ mol=1.4g ,然后根据质量守恒定律,可列等式:a+1.4g=2.41g+2.2g ,a=3.21g ,故选A.3.下图是某反应的微观示意图,下列说法不正确的是A.B为单质B.生成物中C和D的分子个数比为1:1C.参加反应的A和B的质量比为17:16D.A中氢元素与硫元素的质量比为1:16【答案】C【解析】试题分析:从分子构成看B中只有一种元素所以属于单质,根据配平后的结果看生成物中C和D的分子个数比为1:1;参加反应的A和B的质量比为=34×2:32×3=17:24;;A的化学式为H2S其中氢元素与硫元素的质量比为1:16。
2020-2021中考化学专题《利用化学方程式的简单计算》综合检测试卷附答案

【解析】
【分析】
结合图示,根据质量守恒定律及反应物生成物可知,反应的方程式为:
催化剂
= 2CO+2NO
N 2+2CO 2 ,结合方程式进行分析即可。
【详解】
A、由微粒的变化可知,分子的种类及数目发生了变化,故
A 正确;
B、由方程式可知,反应的生成物质量之比是 C、方程式未配平,故 C 错误;
28:( 44× 2)= 7:22,故 B 错误;
C、 R 相对原子质量: 76+96-128-32=12, R 元素和硫元素来自于 X, X 中氧元素质量:
4.4g ×+12.8g ×-9.6g=0,即 X 中不含有氧元素,该选项说法不正确; D、 R 相对原子质量是 12,是碳元素,二氧化硫是污染物,二氧化碳不是污染物,该选项 说法不正确。 故选: B。
D、催化剂能加快反应的速率,但不会增加生成物的质量,故 【点睛】
D 错误。故选 A。
此类题目重在从图中提炼信息,根据信息进行题目的解答和分析。要注意排除干扰微粒以 及补充缺少的微粒,让图恰好体现反应的本质关系。
12. 氧化钙和过氧化钙( CaO2)的混合物 6.4g 溶于足量水后,加入足量的 Na2CO3 溶液,
溶液中的 Ca2+全部转化为沉淀,过滤、干燥,得到
10gCaCO3。则原 6.4 g 混合物中钙元素
与氧元素的质量之比为(已知: 2CaO2+2H 2O=2Ca OH 2 +O2 )
A.1∶ 1 【答案】 C 【解析】
B. 5∶4
C. 5∶ 3
D. 5∶ 2
【详解】
氧化钙和过氧化钙中的钙元素完全转化到碳酸钙中,则钙元素质量为:
6. 在 CO、 CO2 的混合气体中,氧元素的质量分数为 64%,将该混合气体 10 克通过灼热的 氧化铜,充分反应后,将气体再全部通过足量的澄清石灰水,过滤,得到白色沉淀的质量 是( )
2020-2021中考化学压轴题专题复习——利用化学方程式的简单计算的综合附详细答案

【解析】
【分析】
结合图示,根据质量守恒定律及反应物生成物可知,反应的方程式为:
催化剂
= 2CO+2NO
N 2+2CO 2 ,结合方程式进行分析即可。
【详解】
A、由微粒的变化可知,分子的种类及数目发生了变化,故
A 正确;
B、由方程式可知,反应的生成物质量之比是
28:( 44× 2)= 7:22,故 B 错误;
A、由图可知,乙为纯净物,密闭容器中的气体为混合物,故选项错误;
B、甲、丁为反应物,乙为生成物,丙为催化剂或未参加反应,该反应可以表示为:甲
+丁
乙,或甲 +丁
乙,故选项错误;
C、参加反应的甲和丁的质量比为( 8g-4g):( 12g-2g)=2:5 ,故选项正确;
D、由于不知化学方程式中甲、丁的相对分子质量,故无法确定乙、丁物质的化学计量数
, 该反应的微观示意图如下。
A.反应前后分子总数不变
B.反应中 X、 Z 两种物质的质量比为 3:7
C.反应中 Y 和 W 的物质的量之比为 4:5
D.参加反应的 Y 中氮元素的质量一定等于生成 【答案】 D
Z 的质量
【解析】
根据所学知识和题中信息知, 3C+ 4NH3 高温,催化剂 2N2+ 3CH4。A、 反应前后分子总数
已变,故 A 错误; B、 反应中 X、 Z 两种物质的质量比为 12×3∶4×17= 9∶ 17, 故 B 错 误; C、 反应中 Y 和 W 的物质的量之比为 4:3, 故 C 错误 ;D、根据质量守恒定律知,参加 反应的 Y 中氮元素的质量一定等于生成 Z 的质量,故 D 正确。
点睛 ∶ 任何一个化学反应都必然遵循质量守恒定律 量比,物质的量之比。
2020-2021中考化学 利用化学方程式的简单计算 培优 易错 难题练习(含答案)及详细答案

2020-2021中考化学利用化学方程式的简单计算培优易错难题练习(含答案)及详细答案一、初中化学利用化学方程式的简单计算1.纳米级TiO2有广泛的应用,制备的一步反应为2FeTiO3+7Cl2+6C=2TiClx+2FeCl3+6CO。
该化学方程式中,x的值为A.2 B.4 C.8 D.14【答案】B【解析】【详解】根据质量守恒定律,化学反应前后原子的数目不变,反应前氯原子的个数为14个,反应后氯原子的个数为2x+6个,则2x+6=14,得x=4。
故选B。
2.质量守恒定律是帮助我们学习认识化学反应实质的重要理论,在化学反应aA+bB═cC+dD中,下列说法正确的是A.化学计量数a与b之和一定等于c与d之和B.若A和C都是盐,则该反应一定是复分解反应C.反应物A和B的质量比一定等于生成物C和D的质量比D.若取xgA和xgB反应,生成C和D的质量总和不一定是2xg【答案】D【解析】试题分析:A、化学方程式中化学式前面化学计量数实际就是物质的分子个数,而质量守恒定律告诉我们:分子个数在化学反应前后可能发变化,故化学计量数a与b之和不一定等于c与d之和,错误,B、若A和C都是盐,则该反应不一定是复分解反应,还可能是置换反应,错误,C、反应物A和B的质量比不一定等于生成物C和D的质量比,错误,D、若取xgA和xgB反应,由于可能有反应物过量,故生成C和D的质量总和不一定是2xg,正确,故选D考点:质量守恒定律,基本反应类型3.向一定量的锌粉中滴加稀盐酸至过量,下图表示反应过程中某种物质的质量m随加入盐酸质量的变化关系,则m不可能表示()A.溶液总质量B.消耗锌粉的质量C.生成ZnCl2的质量D.生成H2的质量【答案】A【解析】【详解】A、不是溶液总质量,随着稀盐酸的加入,溶液总质量应一直增加,故A错误;B、消耗锌粉的质量,随着稀盐酸的加入,消耗锌粉的质量应逐渐增加,直至消耗完,故B 正确;C、生成ZnCl2的质量,随着稀盐酸的加入,生成的ZnCl2质量应逐渐增加,直至达一定值,故C正确;D、生成H2的质量,随着稀盐酸的加入,生成的氢气的质量应逐渐增加,直至达一定值,故D正确。
2020-2021中考化学利用化学方程式的简单计算综合经典题含答案

2020-2021中考化学利用化学方程式的简单计算综合经典题含答案一、初中化学利用化学方程式的简单计算1.硝酸在光照或加热条件下可发生如下反应:4HNO3 △4NO2 ↑+X↑+2H2O,则下列说法中错误的是A.反应属于分解反应B.X的化学式为O2C.反应前后原子总数不变D.反应前后氮元素的化合价不变【答案】D【解析】试题分析: A.反应物一种,生成物三种,符合分解反应的特点,选项说法正确;B.质量守恒定律可知:反应前后元素种类和原子个数都不变,反应前氢氮氧的原子个数分别为4、4、12,已知反应后氢氮氧的原子个数为4、4、2,故X中含两个氧原子,化学式为O2,选项说法正确;C.反应前后原子总数不变,选项说法正确;D.反应前后氮元素的化合价分别为:+5、+4,化合价改变,选项说法错误;故选D考点:化学方程式;质量守恒定律2.宏观世界是五彩缤纷的,微观世界更是充满了神奇色彩。
微观思维是化学思维的重要组成部分。
已知某反应的微观示意图如下所示,下列说法错误的是A.甲和乙两种物质参加反应的分子个数比为1:1B.化学反应前后原子个数没有改变C.该反应属于氧化反应D.丙物质中所含碳、氧元素的质量比为3:8【答案】A【解析】试题分析:由反应的微观示意图可知该反应的反应物是C2H2和O2,生成物 CO2和H2O,反应的化学方程式为:2C2H2+5O24CO2+2H2O,甲和乙两种物质参加反应的分子个数比为2:5,A错误;依据质量守恒定律化学反应前后原子的种类和数目不变,B正确;该反应是物质与氧气的反应,属氧化反应,C正确;二氧化碳中碳元素与氧元素的质量比=12:32=3:8,D正确。
故选A。
考点:化学反应的微观过程3.下图为某化学反应的微观粒子示意图,关于该反应说法错误的是A.参加反应的物质分子个数比为1:1B.该反应为置换反应C.生成物的质量比为7:22D.反应物均为氧化物且该反应遵循质量守恒定律【答案】B【解析】试题分析:A.该反应的化学方程式为:2CO+2NO===N2+2CO2;则参加反应的物质分子个数比为1:1,正确;B.该反应不属于置换反应,错误;C.生成物的质量比为7:22,正确;D.反应物均为氧化物且该反应遵循质量守恒定律,正确。
2020-2021全国中考化学利用化学方程式的简单计算的综合中考真题分类汇总及详细答案

2020-2021全国中考化学利用化学方程式的简单计算的综合中考真题分类汇总及详细答案一、初中化学利用化学方程式的简单计算1.在反应A+2B═C+D中,7.6gA与5.3gB恰好完全反应生成12.7gC,现要得到0.6gD,则需要A的质量为()A.5.6g B.16.8g C.22.8g D.无法计算【答案】C【解析】【详解】根据题意“在反应A+2B═C+D中,7.6gA与5.3gB恰好完全反应生成12.7gC”和质量守恒定律,则可知反应生成D的质量:7.6g+5.3g﹣12.7g=0.2g;设参加反应A物质的质量为x,A2B C D7.6g0.2gx0.6g+=+x7.6g0.6g0.2g=x=22.8g;所以参加反应A物质的质量为22.8g。
故选C。
2.下图是某反应的微观示意图,下列说法不正确的是A.B为单质B.生成物中C和D的分子个数比为1:1C.参加反应的A和B的质量比为17:16D.A中氢元素与硫元素的质量比为1:16【答案】C【解析】试题分析:从分子构成看B中只有一种元素所以属于单质,根据配平后的结果看生成物中C和D的分子个数比为1:1;参加反应的A和B的质量比为=34×2:32×3=17:24;;A的化学式为H2S其中氢元素与硫元素的质量比为1:16。
故选C.考点:分子的构成物质之间的质量关系3.宏观世界是五彩缤纷的,微观世界更是充满了神奇色彩。
微观思维是化学思维的重要组成部分。
已知某反应的微观示意图如下所示,下列说法错误的是A.甲和乙两种物质参加反应的分子个数比为1:1B.化学反应前后原子个数没有改变C.该反应属于氧化反应D.丙物质中所含碳、氧元素的质量比为3:8【答案】A【解析】试题分析:由反应的微观示意图可知该反应的反应物是C2H2和O2,生成物 CO2和H2O,反应的化学方程式为:2C2H2+5O24CO2+2H2O,甲和乙两种物质参加反应的分子个数比为2:5,A错误;依据质量守恒定律化学反应前后原子的种类和数目不变,B正确;该反应是物质与氧气的反应,属氧化反应,C正确;二氧化碳中碳元素与氧元素的质量比=12:32=3:8,D正确。
2020-2021中考化学培优专题复习计算题练习题及详细答案

一、中考初中化学计算题1.现有Fe和Fe2O3的固体混合物,东东同学为了分析混合物中Fe和Fe2O3的含量,设计了如下实验方案:(注意:100g是Fe与Fe2O3两种物质的总质量)(实验数据)实验共记录了两组实验数据:第①组,完全吸收气体后,NaOH溶液质量增加了66g;第②组,完全反应,冷却后称量剩余固体的质量为Wg。
根据实验设计及有关数据进行分析与计算。
(1)根据第①组数据,CO与Fe2O3,反应产生CO2 g。
(2)混合物中Fe2O3的质量为多少?(3)第②组数据W是 g。
【答案】(1)66(2)80 (3)76【解析】试题分析:(1)根据题意知,氢氧化钠能与二氧化碳发生反应,则溶液增加质量即为二氧化碳质量。
(2)利用化学方程式进行计算。
具体步骤如下:解:设氧化铁的质量为X3 CO +Fe2O3高温2 Fe + 3 CO2160 132X 66g160/132=X/66gX=80g答:略(3)根据题意知,减少固体质量即为氧化铁中氧元素质量。
可列关系式为:Fe2O3------ 3O160 4880g 100g-W 160/48=80g/(100g-W) W=76g考点:利用化学方程式进行计算。
2.学校探究小组为了测定市面销售的某品牌纯碱(杂质为NaCl)中碳酸钠的质量分数,在一烧杯中加入11g样品,加足量水溶解,制成溶液。
向其中逐渐滴加溶质质量分数为10%的CaCl2溶液,生成沉淀的总质量与所滴入CaCl2溶液的质量关系曲线如下图所示。
请根据题意回答问题:(1)当滴加了111gCaCl2溶液时,生成沉淀的总质量为 g。
(2)当滴加CaCl2溶液至图中B点时,烧杯中溶液里的溶质是(写化学式)。
(3)样品中Na2CO3的质量分数是多少?(计算结果精确到0.1%)。
当滴加了111gCaCl2溶液时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量。
【答案】(1)10;(2)NaCl 、CaCl2;(3)96.4%; 12.1g【解析】纯碱样品中氯化钠不与氯化钙发生反应,碳酸钠与氯化钙反应生成氯化钠和碳酸钙沉淀;根据质量关系曲线图,当加入111g氯化钙溶液时,恰好完全反应;继续加入氯化钙溶液,氯化钙过量,溶液中溶质为过量的氯化钙和反应生成的氯化钠.解:(1)设生成碳酸钙沉淀的质量为xNa2CO3+CaCl2 = CaCO3↓+2NaCl111 100111g×10% x111/100=(111g×10%)/x x=10g(2)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,当二者恰好完全反应时,反应后溶液为氯化钠溶液;继续加入氯化钙溶液,过量的氯化钙溶液不再发生反应,形成混合溶液,溶质为氯化钠、氯化钙;(3)解:111g10%的CaCl2溶液中含CaCl2的质量是:111g×10%=11.1g设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为yNa2CO3 + CaCl2=CaCO3↓+2NaCl106 111 117x 11.1g y106/111=x/11.1g x=10.6gNa2CO3的质量分数=10.611gg×100%=96.4%117/111=y/11.1g y=11.7g烧杯里不饱和溶液中溶质的质量为:11.7g+(11g-10.6g)=12.1g答:样品中Na2CO3的质量分数是96.4%;当滴加了111gCaCl2溶液时烧杯中为不饱和溶液,其中含溶质的质量12.1g。
2020-2021中考化学与利用化学方程式的简单计算有关的压轴题附详细答案

2020-2021中考化学与利用化学方程式的简单计算有关的压轴题附详细答案一、初中化学利用化学方程式的简单计算1.在一定的条件下,A和B能发生化学反应生成C和D ,其微观示意图如下所示:下列说法错误的是A.B的化学式为NH3B.反应前的物质为混合物C.若该反应为置换反应,则生成的C和D的质量比为27:14D.若D为氧化物,反应掉的A和B的分子个数比为5:4,D的化学式为NO2【答案】D【解析】【分析】【详解】A、根据图示,B中含有一个氮原子和3个氢原子,化学式为NH3,故正确;B、反应前是氧气和氨气的混合物,故正确;C. 根据图示,反应物A、B中含有氢、氧、氮元素,生成物C中含有氢元素和氧元素,根据质量守恒定律,若该反应为置换反应,则D为氮气,反应的化学方程式为:4NH3+3O2点燃6H2O+2N2,则生成的C和D的质量比为(6×18):(2×24)=27:14,故正确;D. 若D为氧化物,反应掉的A和B的分子个数比为5:4,反应的方程式为:5O2+4NH3点燃6H2O+xD,可知xD中含有4个N原子和4个O原子,故D的化学式为NO,故错误;故选D。
2.甲和乙在一定条件下反应生成丙和丁的微观示意图如下,结论正确的是()A.丁的式量为18g B.生成物都是氧化物C.参与反应的甲和乙的质量比为22:3D.反应前后分子个数不变【答案】C【解析】A、由图可知,丁物质的化学式为H2O,它的式量是18,不能带“g”,错误;B、丙物质由三种元素组成,故不可能是氧化物,错误;C、该反应的方程式为CO2+3H2=CH3OH+H2O ,故参加反应的甲和乙的质量比为44:6=22:3,故正确;D、参加反应的分子个数为4个,反应后分子个数为2个,故D错误。
故选C。
3.关于化学反应2X+Y=2Z的叙述正确的是()A.Z可能是单质,也可能是化合物B.反应中X、Y、Z三种物质的质量比是2:1:2C.若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为M+ND.若ag的X完全反应生成bg的Z,则同时消耗(b﹣a)g 的Y【答案】D【解析】试题分析:A、该反应的反应物是两种,生成物是一种,属于化合反应,因此Z不可能是单质,故A说法错误;B、反应中X、Y、Z三种物质的质量比不等于其化学式前的计量数之比,因不知道X、Y、Z的化学式,所以不能计算反应中X、Y、Z三种物质的质量比,故说法错误;C、若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为,故说法错误;D、若ag的X完全反应生成bg的Z,由质量守恒定律可知,则同时消耗(b﹣a)g 的Y,故说法正确;考点:质量守恒定律及其应用.4.已知2A+3B==C+3D,用足量的A和49 g B恰好完全反应,生成57 g C和1 g D,若B 的相对分子质量为98,则A的相对分子质量为( )A.16 B.27 C.44 D.56【答案】B【解析】【详解】根据质量守恒定律可知A的质量=57g+1g-49g=9g 设A的相对分子质量为x2A+3B=C+3D2x 98×39g 49g2x/9g =98×3/49gx=27 故选B。
2020-2021中考化学 利用化学方程式的简单计算 综合题含答案

2020-2021中考化学利用化学方程式的简单计算综合题含答案一、初中化学利用化学方程式的简单计算1.硝酸在光照或加热条件下可发生如下反应:4HNO3 △4NO2 ↑+X↑+2H2O,则下列说法中错误的是A.反应属于分解反应B.X的化学式为O2C.反应前后原子总数不变D.反应前后氮元素的化合价不变【答案】D【解析】试题分析: A.反应物一种,生成物三种,符合分解反应的特点,选项说法正确;B.质量守恒定律可知:反应前后元素种类和原子个数都不变,反应前氢氮氧的原子个数分别为4、4、12,已知反应后氢氮氧的原子个数为4、4、2,故X中含两个氧原子,化学式为O2,选项说法正确;C.反应前后原子总数不变,选项说法正确;D.反应前后氮元素的化合价分别为:+5、+4,化合价改变,选项说法错误;故选D考点:化学方程式;质量守恒定律2.宏观世界是五彩缤纷的,微观世界更是充满了神奇色彩。
微观思维是化学思维的重要组成部分。
已知某反应的微观示意图如下所示,下列说法错误的是A.甲和乙两种物质参加反应的分子个数比为1:1B.化学反应前后原子个数没有改变C.该反应属于氧化反应D.丙物质中所含碳、氧元素的质量比为3:8【答案】A【解析】试题分析:由反应的微观示意图可知该反应的反应物是C2H2和O2,生成物 CO2和H2O,反应的化学方程式为:2C2H2+5O24CO2+2H2O,甲和乙两种物质参加反应的分子个数比为2:5,A错误;依据质量守恒定律化学反应前后原子的种类和数目不变,B正确;该反应是物质与氧气的反应,属氧化反应,C正确;二氧化碳中碳元素与氧元素的质量比=12:32=3:8,D正确。
故选A。
考点:化学反应的微观过程3.密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法不正确的是A.X的值为165.6B.该反应可能为复分解反应C.反应过程中,B与D的质量比为36∶142D.若A与C的相对分子质量之比为98∶40,则A与C的化学计量数比为2∶1【答案】D【解析】试题分析:从反应的质量看AC的质量减少属于反应物,且分别有9.8克和8克参加了反应,D的质量增加属于生成物,且产生的质量为14.2克,根据质量守恒定律得出B是生成物,且有3.6克的B物质生成,反应过程中,B与D的质量比为36∶142;则X的值是162g+3.6g=165.6g;因为反应物和生成物都是两种说明该反应可能为复分解反应;若A与C 的相对分子质量之比为98∶36,则A与C的化学计量数比为1∶1,D错误,故选D.考点:质量守恒定律反应中物质的质量关系4.现有下列四组物质:①乙炔(C2H2)和苯(C6H6);②乙烷(C2H6)和乙醇(C2H6O);③丁烷(C4H10)和乙醚(C4H10O);④甲苯(C7H8)和甘油(C3H8O3)。
2020-2021九年级中考化学利用化学方程式的简单计算解答题压轴题提高专题练习含答案解析

2020-2021九年级中考化学利用化学方程式的简单计算解答题压轴题提高专题练习含答案解析一、初中化学利用化学方程式的简单计算1.深圳进行机动车限牌,汽车尾气污染得到控制。
如图是汽车处理尾气反应的微观过程,有关说法正确的是( )A .反应前后分子的种类、数目都发生了变化B .反应的生成物质量之比是7:11C .反应的化学方程式为22 CO+NO N+CO 催化剂D .催化剂加快反应速率,增加了生成物的质量【答案】A 【解析】 【分析】结合图示,根据质量守恒定律及反应物生成物可知,反应的方程式为:222CO+2NON+2CO =催化剂,结合方程式进行分析即可。
【详解】A 、由微粒的变化可知,分子的种类及数目发生了变化,故A 正确;B 、由方程式可知,反应的生成物质量之比是28:(44×2)=7:22,故B 错误;C 、方程式未配平,故C 错误;D 、催化剂能加快反应的速率,但不会增加生成物的质量,故D 错误。
故选A 。
【点睛】此类题目重在从图中提炼信息,根据信息进行题目的解答和分析。
要注意排除干扰微粒以及补充缺少的微粒,让图恰好体现反应的本质关系。
2.下图为某化学反应的微观粒子示意图,关于该反应说法错误的是A .参加反应的物质分子个数比为1:1B .该反应为置换反应C .生成物的质量比为7:22D .反应物均为氧化物且该反应遵循质量守恒定律 【答案】B 【解析】试题分析:A.该反应的化学方程式为:2CO+2NO===N2+2CO2;则参加反应的物质分子个数比为1:1,正确;B.该反应不属于置换反应,错误;C.生成物的质量比为7:22,正确;D.反应物均为氧化物且该反应遵循质量守恒定律,正确。
故选B考点:质量守恒定律的应用。
3.密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法不正确的是A.X的值为165.6B.该反应可能为复分解反应C.反应过程中,B与D的质量比为36∶142D.若A与C的相对分子质量之比为98∶40,则A与C的化学计量数比为2∶1【答案】D【解析】试题分析:从反应的质量看AC的质量减少属于反应物,且分别有9.8克和8克参加了反应,D的质量增加属于生成物,且产生的质量为14.2克,根据质量守恒定律得出B是生成物,且有3.6克的B物质生成,反应过程中,B与D的质量比为36∶142;则X的值是162g+3.6g=165.6g;因为反应物和生成物都是两种说明该反应可能为复分解反应;若A与C 的相对分子质量之比为98∶36,则A与C的化学计量数比为1∶1,D错误,故选D.考点:质量守恒定律反应中物质的质量关系4.Fe和FeO的混合物,测得其中铁元素的质量分数为80%.取该混合物7.0g,加足量稀硫酸完全溶解,生成FeSO4的质量为()A.7.6g B.15.2g C.20.0g D.40.0g【答案】B【解析】试题分析:根据题意可知Fe和FeO中的铁元素都上了硫酸亚铁中去了,根据铁元素的质量算出硫酸亚铁的质量。
2020-2021备战中考化学 计算题 培优练习(含答案)及详细答案

一、中考初中化学计算题1.生活中处处有化学,小明把学到的化学知识用于生活中,进行下列探究.(1)如图所示,小明把一只新鲜鸡蛋放入盛水的玻璃杯中,鸡蛋沉入水底(蛋壳的主要成分是碳酸钙).若向玻璃杯中逐渐滴加浓盐酸,鸡蛋壳表面将出现的现象是_____,相应的化学反应方程式为_____.(2)小明同学在家里做了如右图所示的小实验.①图Ⅰ中观察到的主要现象是鸡蛋壳表面有气泡产生,蜡烛火焰熄灭.由此得出有关CO2性质的结论是_____.并依此性质确定CO2的一个主要用途是_____.②当蜡烛熄灭后,在玻璃杯口迅速盖﹣块蘸有石灰水的玻璃片(见图Ⅱ).观察到的现象是玻璃片上的石灰水_____,此现象说明在杯中有_____气体产生,写出气体与石灰水反应的化学方程式_____.(3)小明把含碳酸钙85%的鸡蛋壳20g和足量的稀盐酸反应,计算产生的气体是多少克?_____.【答案】(1) 鸡蛋壳表面出现无色气泡; CaCO3+2HCl=CaCl2+CO2↑+H2O。
(2) ①二氧化碳不支持燃烧、也不能燃烧、且相同条件下密度比空气大。
二氧化碳气体能灭火。
②变浑浊、二氧化碳、CO2+Ca(OH)2=CaCO3↓+H2O。
(3) 7.48g【解析】(1)碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,蛋壳表面会出现气泡,故填:鸡蛋壳表面出现无色气泡; CaCO3+2HCl=CaCl2+CO2↑+H2O.(2)①蜡烛火焰熄灭,说明二氧化碳既不燃烧也不支持燃烧,密度比空气大,能用于灭火,故填:二氧化碳不支持燃烧、也不能燃烧、且相同条件下密度比空气大.二氧化碳气体能灭火.②二氧化碳能与氢氧化钙反应生成碳酸钙和水,使石灰水变浑浊,故填:变浑浊、二氧化碳、CO2+Ca(OH)2=CaCO3↓+H2O.(3)解:设产生的气体的质量为x碳酸钙的质量=20g×85%=17g (1分)CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O100 4417g x ……… …(1分)100/44 =17g/x ………………… (1分)X=7.48g ………………… (1分)答:产生的CO2气体的质量为7.48g2.把2.4g镁加入到一定质量的硫酸中,反应完毕后,向溶液中滴加质量分数为10%的NaOH溶液,一段时间后有白色沉淀生成。
2020-2021中考化学 利用化学方程式的简单计算 培优练习(含答案)含详细答案
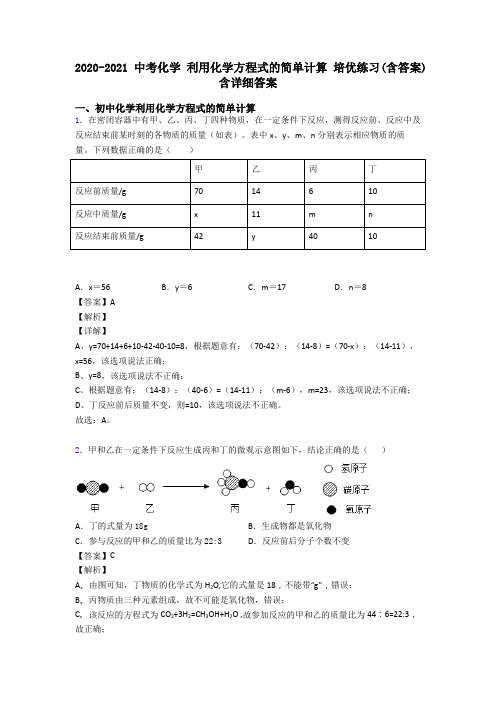
2020-2021中考化学利用化学方程式的简单计算培优练习(含答案)含详细答案一、初中化学利用化学方程式的简单计算1.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前、反应中及反应结束前某时刻的各物质的质量(如表)。
表中x、y、m、n分别表示相应物质的质量。
下列数据正确的是()甲乙丙丁反应前质量/g7014610反应中质量/g x11m n反应结束前质量/g42y4010A.x=56 B.y=6 C.m=17 D.n=8【答案】A【解析】【详解】A、y=70+14+6+10-42-40-10=8,根据题意有:(70-42):(14-8)=(70-x):(14-11),x=56,该选项说法正确;B、y=8,该选项说法不正确;C、根据题意有:(14-8):(40-6)=(14-11):(m-6),m=23,该选项说法不正确;D、丁反应前后质量不变,则=10,该选项说法不正确。
故选:A。
2.甲和乙在一定条件下反应生成丙和丁的微观示意图如下,结论正确的是()A.丁的式量为18g B.生成物都是氧化物C.参与反应的甲和乙的质量比为22:3D.反应前后分子个数不变【答案】C【解析】A、由图可知,丁物质的化学式为H2O,它的式量是18,不能带“g”,错误;B、丙物质由三种元素组成,故不可能是氧化物,错误;C、该反应的方程式为CO2+3H2=CH3OH+H2O ,故参加反应的甲和乙的质量比为44:6=22:3,故正确;D、参加反应的分子个数为4个,反应后分子个数为2个,故D错误。
故选C。
3.向一定量的锌粉中滴加稀盐酸至过量,下图表示反应过程中某种物质的质量m随加入盐酸质量的变化关系,则m不可能表示()A.溶液总质量B.消耗锌粉的质量C.生成ZnCl2的质量D.生成H2的质量【答案】A【解析】【详解】A、不是溶液总质量,随着稀盐酸的加入,溶液总质量应一直增加,故A错误;B、消耗锌粉的质量,随着稀盐酸的加入,消耗锌粉的质量应逐渐增加,直至消耗完,故B 正确;C、生成ZnCl2的质量,随着稀盐酸的加入,生成的ZnCl2质量应逐渐增加,直至达一定值,故C正确;D、生成H2的质量,随着稀盐酸的加入,生成的氢气的质量应逐渐增加,直至达一定值,故D正确。
2020-2021中考化学利用化学方程式的简单计算综合题汇编及答案

2020-2021中考化学利用化学方程式的简单计算综合题汇编及答案一、初中化学利用化学方程式的简单计算1.物质R在0.96g氧气中恰好完全燃烧,反应方程式为:R+3O2点燃XO2+2SO2,测得XO2和SO2的质量分别为0.44g和1.28g.下列判断正确的是()A.参加反应的R的质量为0.86gB.R的相对分子质量为76C.R中含有X元素、S元素和O元素D.XO2和SO2都是形成酸雨的主要物质【答案】B【解析】试题分析:依据质量守恒定律化学反应前后物质的总质量不变可知参加反应的R的质量为:1.28g+0.44g-0.96g=0.76g,A错误;设R的相对分子质量为X,则根据方程式计算R+3O2=XO2+2SO2X 960.76 0.96x=96*0.76/96=76,B正确;在化学反应中物质的质量比即为相对分子质量之比,那么XO2的相对分子质量为44,可能是二氧化碳;根据质量守恒定律化学反应前后元素的种类和质量不变,生成物中氧元素的质量=0.32g+0.64g=0.96g,等于反应物中氧气的质量,那么R中含有X元素、S元素,不含氧元素,C错误;二氧化碳主要是造成温室效应,D错误。
故选B。
考点:质量守恒定律2.25℃时,某气态碳氢化合物与氧气混合后装入密闭容器中,经充分反应后,又恢复25℃,此时容器内气体分子是反应前的一半。
再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。
此碳氢化合物可能是( )A.CH4 B.C2H6 C.C2H2 D.C3H8【答案】D【解析】容器内气体分子是反应前的一半。
再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。
由定组成定律和化学方程式知,此碳氢化合物可能是D. C3H8。
点睛∶本题主要考查化学方程式的应用。
3.甲和乙在一定条件下反应生成丙和丁的微观示意图如下,结论正确的是()A.丁的式量为18g B.生成物都是氧化物C.参与反应的甲和乙的质量比为22:3D.反应前后分子个数不变【答案】C【解析】A、由图可知,丁物质的化学式为H2O,它的式量是18,不能带“g”,错误;B、丙物质由三种元素组成,故不可能是氧化物,错误;C、该反应的方程式为CO2+3H2=CH3OH+H2O ,故参加反应的甲和乙的质量比为44:6=22:3,故正确;D、参加反应的分子个数为4个,反应后分子个数为2个,故D错误。
2020-2021中考化学利用化学方程式的简单计算综合题汇编含答案解析

2020-2021中考化学利用化学方程式的简单计算综合题汇编含答案解析一、初中化学利用化学方程式的简单计算1.物质R在0.96g氧气中恰好完全燃烧,反应方程式为:R+3O2点燃XO2+2SO2,测得XO2和SO2的质量分别为0.44g和1.28g.下列判断正确的是()A.参加反应的R的质量为0.86gB.R的相对分子质量为76C.R中含有X元素、S元素和O元素D.XO2和SO2都是形成酸雨的主要物质【答案】B【解析】试题分析:依据质量守恒定律化学反应前后物质的总质量不变可知参加反应的R的质量为:1.28g+0.44g-0.96g=0.76g,A错误;设R的相对分子质量为X,则根据方程式计算R+3O2=XO2+2SO2X 960.76 0.96x=96*0.76/96=76,B正确;在化学反应中物质的质量比即为相对分子质量之比,那么XO2的相对分子质量为44,可能是二氧化碳;根据质量守恒定律化学反应前后元素的种类和质量不变,生成物中氧元素的质量=0.32g+0.64g=0.96g,等于反应物中氧气的质量,那么R中含有X元素、S元素,不含氧元素,C错误;二氧化碳主要是造成温室效应,D错误。
故选B。
考点:质量守恒定律2.下图是某反应的微观示意图,下列说法不正确的是A.B为单质B.生成物中C和D的分子个数比为1:1C.参加反应的A和B的质量比为17:16D.A中氢元素与硫元素的质量比为1:16【答案】C【解析】试题分析:从分子构成看B中只有一种元素所以属于单质,根据配平后的结果看生成物中C和D的分子个数比为1:1;参加反应的A和B的质量比为=34×2:32×3=17:24;;A的化学式为H2S其中氢元素与硫元素的质量比为1:16。
故选C.考点:分子的构成物质之间的质量关系3.宏观世界是五彩缤纷的,微观世界更是充满了神奇色彩。
微观思维是化学思维的重要组成部分。
已知某反应的微观示意图如下所示,下列说法错误的是A.甲和乙两种物质参加反应的分子个数比为1:1B.化学反应前后原子个数没有改变C.该反应属于氧化反应D.丙物质中所含碳、氧元素的质量比为3:8【答案】A【解析】试题分析:由反应的微观示意图可知该反应的反应物是C2H2和O2,生成物 CO2和H2O,反应的化学方程式为:2C2H2+5O24CO2+2H2O,甲和乙两种物质参加反应的分子个数比为2:5,A错误;依据质量守恒定律化学反应前后原子的种类和数目不变,B正确;该反应是物质与氧气的反应,属氧化反应,C正确;二氧化碳中碳元素与氧元素的质量比=12:32=3:8,D正确。
2020-2021中考化学培优(含解析)之计算题含详细答案

一、中考初中化学计算题1.取某碳酸钠样品(含有一定量的氯化钠)15g,加入80g水,固体完全溶解,再向其中加入76g氯化钙溶液,两者恰好完全反应,过滤后得到161g滤液。
请计算:(1)产生沉淀的质量是________g;(2)反应后所得溶液中溶质的质量分数_______。
【答案】10g 10%【解析】【分析】(1)根据氯化钠、碳酸钠的性质,氯化钠不能与加入的氯化钙发生反应,碳酸钠与氯化钙生成碳酸钙沉淀和氯化钠,根据质量守恒计算碳酸钙沉淀的质量;(2)恰好完全反应后所得溶液为氯化钠溶液,此时溶液中的溶质氯化钠由原固体中的氯化钠和反应后生成的氯化钠两部分构成。
【详解】(1)产生沉淀的质量为15g+80g+76g-161g=10g;(2)设Na2CO3的质量为x,生成NaCl的质量为y,2323Na CO+CaCl=CaCO+2NaCl106100117x10g y106100117==x10g yx=10.6g,y=11.7g反应后所得溶液中溶质的质量=15g-10.6g+11.7g=16.1g;反应后所得溶液中溶质质量分数为16.1g161g×100%=10%答:(1)产生沉淀的质量为10g;(2)反应后所得溶液中溶质质量分数为10%.【点睛】本道题比较难,难点有两个:一是滤液中的溶质氯化钠包括原混合物中的氯化钠和反应生成的氯化钠;二是所得滤液的质量比较难算,不是用溶质的质量+溶剂的质量,而是将所加入的物质的质量全部加起来,再减去生成沉淀的质量。
2.在我国青海湖地区有一种说法,冬天捞碱,夏天晒盐。
这里的碱是指Na2CO3,盐是指NaCl。
人们从盐湖中捞得的碱会含有少量的NaCl。
某研究性学习小组称取含NaCl的Na2CO3固体25.0g,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为7.3%的稀盐酸,使气体完全放出,共收集到8.8gCO2气体。
试计算:(1)原固体中Na2CO3的质量分数________。
2020-2021九年级中考化学利用化学方程式的简单计算解答题压轴题提高专题练习含详细答案

2020-2021 九年级中考化学利用化学方程式的简单计算解答题压轴题提升专题练习含详尽答案一、初中化学利用化学方程式的简单计算1.在一密闭容器中,有四种物质,在必定条件下存在某个反响,测得反响前后各物质的质量以下表:已知X 的相对分子质量为n、 Q 的相对分子质量为2n.以下推理中正确的选项是( )物质X Y Z Q反响前质量410121/g反响后质量01215待测/gA.该反响后待测Q 质量为 12gB.反响后生成15gZC.该化学方程式中X 与 Q 的化学计量数之比为2: 3D.该反响中Y 与 Q 质量之比为1: 1【答案】 C【分析】【剖析】本题是借助质量守恒定律对反响物生成物先做出判断,再利用质量关系进行求解,反响中反响物质量会减少,生成物质量会增添,从而判断生成物与反响物,即可判断反响的类型,且反响物与生成物质量相等可求出Q 的质量。
【详解】依据质量守恒定律,反响后 Q 的质量为 4g+10g+1g+21g-0g-12g-15g=9g, Y、 Z 物质反响后质量增添,是生成物; X、Q 物质反响后质量减少,是反响物。
A、反响后Q 的质量为9g,故错误;B、反响后生成Z 的质量为: 15g-1g=14g,故错误;4g : 12g=2:3,故正确;C、化学方程式中X 与 Q 的化学计量数之比为:n 2nD、反响中Y 与 Q 发生改变的质量之比为:(12g-10g):( 21g-9g) =1:6,故错误;应选 C。
【点睛】在化学反响中按照质量守恒定律,参加反响的物质的质量等于反响后生成的物质的质量。
2.以下图为某化学反响的微观粒子表示图,对于该反响说法错误的选项是A.参加反响的物质分子个数比为1:1B.该反响为置换反响C.生成物的质量比为7:22D.反响物均为氧化物且该反响按照质量守恒定律【答案】 B【分析】试题剖析: A.该反响的化学方程式为: 2CO+2NO===N2 +2CO2;则参加反响的物质分子个数比为 1:1,正确; B.该反响不属于置换反响,错误; C.生成物的质量比为 7:22,正确;D.反响物均为氧化物且该反响按照质量守恒定律,正确。
2020-2021中考化学培优(含解析)之计算题及答案

一、中考初中化学计算题1.某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示.则:(l)以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为_______g;(2) 4.0g样品中杂质CaCO3的质量为_________?(写出计算过程)(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为__________(精确到0.1%)。
若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果_______(填“有”、“没有”)影响。
原因是________________。
【答案】2.2g 0.3g 4.2% 没有未溶解的氢氧化钙也能与二氧化碳生成碳酸钙【解析】【分析】二氧化碳和氢氧化钙反应生成碳酸钙和水【详解】(l)二氧化碳和氢氧化钙反应生成碳酸钙和水,由图可知以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为2.2g;(2) 设4.0g样品中氢氧化钙的质量为x,生成的碳酸钙的质量为y()Ca OH+CO=CaCO+H O↓23227444100x 2.2g y7444100==x 2.2g yx=3.7gy=5g2.某补钙药剂说明书的部分信息如图所示,现将用20片该药剂制成的粉末与40盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为55.6g,请回答下列问题(计算请写出过程):(1)青少年缺钙易出现的疾病是;(2)该品牌补钙药剂每片含CaCO3的质量为多少?(3)该盐酸中溶质的质量分数是多少?(精确到0.1%)【答案】(1)佝偻病(2)0.5g(3)18.3%【解析】试题分析:根据质量守恒定律化学反应前后物质的质量不变,故减少的质量即为生成的二氧化碳的质量。
利用二氧化碳的质量即可计算出碳酸钙的质量。
(1)缺钙老年人会引起骨质疏松、青少年会患佝偻病.(2)依据质量守恒定律,生成二氧化碳的质量为20g+40g﹣55.6g=4.4g设20片该药剂中含CaCO3的质量为x,40g盐酸中含HCl的质量为y,CaCO3+2HCl=CaCl2+H2O+CO2↑100 73 44x y 4.4g100/44 =x/4.4g 100/73 y/4.4gx=10g y=7.3g(2)每片含CaCO3的质量为10g÷20片=0.5g(3)该盐酸中溶质的质量分数是7.3g/40g×100%=18.3%答:略考点:有关化学方程式的计算3.现有NaOH、NaCl和Na2CO3固体混合物109.1g。
2020-2021中考化学 计算题 培优易错试卷练习(含答案)及详细答案

一、中考初中化学计算题1.现有10%的Na2CO3溶液,请按下面要求计算:(1)106 g上述溶液中所含溶质量为 g;(2)106 g 上述溶液与足量10%的盐酸反应,最多可生成CO2多少克?(3)向106 g 上述溶液中逐滴加入10%的盐酸并不断搅拌,此时发生的反应为:Na2CO3 + HCl =NaHCO3+ NaCl;当Na2CO3 全部转化为NaHCO3后,再加入盐酸才开始放出CO2 。
请在“题25图”中画出产生气体的曲线。
(4)另取10% Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:物质Na2CO3HCl X NaCl CO H2O质量/g31.814.616.823.4 4.4m则m=;该反应的化学方程式为。
【答案】(1)10.6 g;(2)4.4g;(3);(4)1.8;3Na2CO3+ 4HCl=2NaHCO3+4NaCl+H2O + CO2↑【解析】【分析】【详解】(1)106g溶液中所含溶质的质量=106g×10%=10.6g,故填:10.6。
(2)设生成二氧化碳的质量为x,消耗的盐酸溶液中溶质的质量为a,则有2322Na CO +2HCl =2NaCl+H O+CO 106734410.6g 10610.6g=7310610.6g=44a xa xx =4.4g ,a =7.3g ;答:最多生成二氧化碳的质量为4.4g 。
(3)设全部转化为碳酸氢钠需要盐酸溶液中溶质的质量为y233Na CO +HCl =NaHCO +NaCl 10636.510.6g 10610.6g=36.5y yy =3.65g 盐酸溶液的质量为3.65g=36.5g 10%碳酸钠完全反应消耗盐酸的质量为:7.3g=73g 10%故碳酸氢钠完全反应生成二氧化碳消耗盐酸的质量为73g-36.5g=36.5g ,故曲线为:。
(4)根据表格提供的数据,生成4.4g 二氧化碳,需要碳酸钠的质量是10.6g ,生成氯化钠的质量是11.7g ,说明给出的碳酸钠有一部分转化生成了碳酸氢钠和氯化钠,X 为NaHCO 3,碳酸钠和HCl 是反应物,碳酸氢钠、氯化钠、二氧化碳和水是生成物,根据质量守恒定律可得31.8g+14.6g=16.8g+23.4g+4.4g+m ,m=1.8g ; 设反应方程式为aNa 2CO 3+bHCl ═cNaHCO 3+dNaCl+eH 2O+fCO 2↑31.6g 14.6g 16.8g 23.4g 1.8g 4.4ga:b:c:d:e:f=:::::=3:4:2:4:1:110635.58458.51844方程式为3Na 2CO 3+4HCl ═2NaHCO 3+4NaCl+H 2O+CO 2↑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020-2021中考化学利用化学方程式的简单计算培优练习(含答案)及详细答案一、初中化学利用化学方程式的简单计算1.密闭容器中甲、乙、丙、丁四种物质在一定条件下发生化学反应,不同时刻的质量如表所示。
已知甲的相对分子质量为丁的2倍,下列有关说法错误的是()A.a为32B.该反应属于分解反应C.丙可能是催化剂D.该反应的化学方程式中甲与丁的化学计量数之比为1:1【答案】A【解析】【详解】解:数据处理得如下结果:根据增加的一行(变化量,是反应后减去反应前,负值表示质量减少,为反应物,正值为质量增加,为生成物)可知甲为反应物,乙和丁为生成物,且质量比为2:1:1,由于64=32+32,丙变化的质量为0,所以反应类型为分解反应。
根据质量比为2:1:1,可得a=26,b=1,丙在过程中质量不变,所以可能为催化剂;甲的相对分子质量为丁的2倍,且甲为反应物,乙和丁为生成物,且质量比为2:1:1,则该反应方程式中甲与丁的化学计量数之比为22=11=1:1(计量系数之比等于各自的质量比上各自的相对原子质量或者相对分子质量)。
故选A。
2.宏观世界是五彩缤纷的,微观世界更是充满了神奇色彩。
微观思维是化学思维的重要组成部分。
已知某反应的微观示意图如下所示,下列说法错误的是A.甲和乙两种物质参加反应的分子个数比为1:1B.化学反应前后原子个数没有改变C.该反应属于氧化反应D.丙物质中所含碳、氧元素的质量比为3:8【答案】A【解析】试题分析:由反应的微观示意图可知该反应的反应物是C2H2和O2,生成物 CO2和H2O,反应的化学方程式为:2C2H2+5O24CO2+2H2O,甲和乙两种物质参加反应的分子个数比为2:5,A错误;依据质量守恒定律化学反应前后原子的种类和数目不变,B正确;该反应是物质与氧气的反应,属氧化反应,C正确;二氧化碳中碳元素与氧元素的质量比=12:32=3:8,D正确。
故选A。
考点:化学反应的微观过程3.向一定量的锌粉中滴加稀盐酸至过量,下图表示反应过程中某种物质的质量m随加入盐酸质量的变化关系,则m不可能表示()A.溶液总质量B.消耗锌粉的质量C.生成ZnCl2的质量D.生成H2的质量【答案】A【解析】【详解】A、不是溶液总质量,随着稀盐酸的加入,溶液总质量应一直增加,故A错误;B、消耗锌粉的质量,随着稀盐酸的加入,消耗锌粉的质量应逐渐增加,直至消耗完,故B 正确;C、生成ZnCl2的质量,随着稀盐酸的加入,生成的ZnCl2质量应逐渐增加,直至达一定值,故C正确;D、生成H2的质量,随着稀盐酸的加入,生成的氢气的质量应逐渐增加,直至达一定值,故D正确。
故选A4.Fe和FeO的混合物,测得其中铁元素的质量分数为80%.取该混合物7.0g,加足量稀硫酸完全溶解,生成FeSO4的质量为()A.7.6g B.15.2g C.20.0g D.40.0g【答案】B【解析】试题分析:根据题意可知Fe和FeO中的铁元素都上了硫酸亚铁中去了,根据铁元素的质量算出硫酸亚铁的质量。
解:由Fe和FeO的混合物质量为7.0g,铁元素的质量分数为80%,解出铁元素质量为:7.0g×80%=5.6g;用铁元素质量除以硫酸亚铁中铁元素的质量分数,算出硫酸亚铁的质量:=15.2g故选B。
考点:有关化学式的计算和推断;化合物中某元素的质量计算;混合物中某元素的质量计算;质量守恒定律及其应用。
点评:已知化合物中某元素的质量,求化合物的总质量方法是:用该元素的质量除以该元素在化合物中的质量分数。
5.偏二甲肼(C2H8N2)与N2O4反应能放出巨大的能量,化学方程式为C2H8N2+2N2O4═2X↑+3N2↑+4H2O↑,下列说法正确的是()A.该反应属于化合反应B.X的化学式为COC.偏二甲肼中氮的质量分数最大D.生成N2和H2O的质量比14:1【答案】C【解析】【详解】A、反应物是两种,生成物是三种,不属于化合反应,故不正确;B、由C2H8N2+2N2O4═2X↑+3N2↑+4H2O↑可知,反应前后氢原子都是8个,氮原子都是6个,反应前碳原子是2个,反应后应该是2个,包含在2X中,反应前氧原子是氧原子是8个,反应后应该是8个,其中4个包含在2X中,因此X的化学式是CO2,故不正确;C、偏二甲肼中,碳原子相对原子质量和是24,氢原子相对原子质量和是8,氮原子相对原子质量和是28,因此氮的质量分数最大,故正确;D、生成N2和H2O的质量比为:84:72=7:6,故不正确。
故选C。
6.已知2A+3B==C+3D,用足量的A和49 g B恰好完全反应,生成57 g C和1 g D,若B的相对分子质量为98,则A 的相对分子质量为( ) A .16 B .27C .44D .56【答案】B 【解析】 【详解】根据质量守恒定律可知A 的质量=57g+1g-49g=9g 设A 的相对分子质量为x 2A+3B=C+3D 2x 98×3 9g 49g 2x/9g =98×3/49g x=27 故选B 。
7.氧化铜和铜的混合物14.4g ,将其充分还原后,将所得固体加入到400g 溶质质量分数为17%的硝酸银溶液中,恰好完全反应,则原混合物中氧化铜与单质铜的质量比为( ) A .1:1 B .5:7C .5:4D .4:7【答案】C 【解析】 【详解】解:设参加反应的铜的质量为x ,332Cu 2AgNO Cu NO 2Ag400g =64340x 17%++⨯() 400g 17x 6%4=340⨯x =12.8g ,固体减少的质量为:14.4g ﹣12.8g =1.6g , 所以氧化铜的质量为:1.6g÷1680=8g ,铜的质量为6.4g , 原混合物中氧化铜与单质铜的质量比为:8g :6.4g =5:4。
故选C 。
8.现有一包碳酸钙和生石灰的混合物,为测定其中碳酸钙的含量,取样品21.2g 将其放入足量的稀盐酸中,充分反应后,将溶液蒸干,得白色固体33.3g ,则样品中碳酸钙的含量约为( ) A .52.8% B .47.2%C .36%D .64%【答案】B 【解析】 【详解】解:设样品中碳酸钙的质量分数为x ,3222 10011121.2gx11121.2gxCaCO1002HCl CaCl H O CO+++=⨯↑22CaO2HCl CaCl5611121.2g(1x)11121.2g(1x)5H6O=⨯-⨯⨯++-由题意可得:11121.2gx100⨯+11121.2g(1x)56⨯-=33.3g;x≈47.2%。
故选B。
9.在点燃条件下,A和B反应生成C和D,反应前后分子变化的微观示意图如图所示,下列判断不正确的是( )A.该反应中有两种化合物分子B.该反应中,参加反应的A、B分子的个数比为4:3C.物质C的化学性质不活泼,常用作保护气D.在该反应中,生成C和D的质量比为14:9【答案】D【解析】将图对应成微粒相等如图:化学方程式为:4NH3+3O22N2+6H2OA 、通过观察题中的图,可以发现物质A 和C 是由不同种原子构成的分子,为化合物,故A 正确;B 、根据质量守恒定律可知,参加的A 和B 的分子个数比为4:3,故B 正确;C 、通过观察题中的图,物质C 为氮气,化学性质不活泼,常用作保护气,故C 正确;D 、由图示物质的构成可知,A 是氨气,B 是氧气,C 是氮气,D 是水,根据化学方程式,可计算生成C 和D 的质量比为:(2×14×2):【6×(1×2+16×1)】=14:27,故D 错误。
10.取NaCl 、NaOH 、Na 2CO 3固体混合物28.6g 于烧杯中,向其中加入过量的稀盐酸至充分反应后,共生成二氧化碳气体4.4g ,将溶液蒸干,得无水固体33.4g ,则原混合物中氯化钠质量为 A .8.4g B .10.0gC .11.7gD .13.6g【答案】B 【解析】 【分析】 【详解】解:设碳酸钠的质量为x ,对应生成的氯化钠的质量为y2322Na CO +2HCl=2NaCl +H O+CO 10611744xy 4.4g↑ 10611744=x y 4.4g= 解得x=10.6g ,y=11.7g则原混合物中氯化钠和氢氧化钠的质量和为28.6g-10.6g=18g 对应的氯化钠和氢氧化钠生成的氯化钠的质量和为33.4g-11.7g=21.7g 设氢氧化钠的质量为z2NaOH HCl NaCl H O 4058.558.5-40=18.5z 21.7g 18 3.7g g+=+-=固体质量差量 4018.5z 3.7g= 解得z=8g则原混合物中氯化钠的质量为18g-8g=10.0g 。
故选B 。
11.在CO 和CO 2的混合气体中,氧元素的质量分数是64%,将该气体5g 通过足量的灼热的CuO 粉末,完全反应后,气体通过足量的澄清石灰水得到白色沉淀的质量是( ) A .5g B .6.7gC .15gD .20g【答案】C 【解析】解法1:设5g 混合气体中一氧化碳的质量为m ,则二氧化碳质量为5g-m ,根据题意得: m×1628×100%+(5g-m )×3244×100%=5g×64%,m=2.8g ;设2.8g 一氧化碳与氧化铜完全反应生成二氧化碳的质量为x , CO+CuO∆Cu+CO 228 44 2.8g x44=2.828x g x=4.4g ,10g 混合气体通过足量的灼热的氧化铜粉末后,二氧化碳气体质量=4.4g+(5g-2.8g )=6.6g ,设生成沉淀的质量为y , CO 2+Ca (OH )2═CaCO 3↓+H 2O 44 100 6.6g y1006.644y g = y=15g 。
故选C 。
解法二:(巧妙计算)由于碳元素最终全部在碳酸钙中,所以可以用关系式法直接计算;碳元素的质量为5g×(1-64%)=1.8g ,设生成的碳酸钙的质量为x , 则有C ~~~CaCO 3 12 100 1.8g x1001.812x g = x=15g ;或者由于碳元素最终全部在碳酸钙中,所以可以用碳酸钙中碳元素的质量分数直接计算。
碳元素的质量为5g×(1-64%)=1.8g ;由于碳酸钙中碳元素的质量分数为:121401121163⨯⨯+⨯+⨯ ×100%=12%,则1.8g 碳元素对应的碳酸钙的质量为:1.812%g=15g 。
故选C 。
12.有A 、B 、C 三种物质,发生反应2A+B ═2C ,若16gA 与足量B 充分反应得到20gC ,则A 、B 、C 三种物质的相对分子质量之比为( ) A .8:1:5 B .4:1:5C .8:2:5D .4:2:5【答案】D【分析】 【详解】解:由16gA 与足量的B 反应能生成20gC ,则参加反应的B 的质量为20g ﹣16g =4g , 设A 、B 、C 三种物质的相对分子质量分别为a 、b 、c ,则:2A B 2C 2a b 2c 16g 4g 20g+= 2a b2c16g 4g 20g== a :b :c =4:2:5。
