第16章 d 区元素(一)
无机分析12第十六章d区元素

Fe2+
浅绿色
Co2+
酒红色
Ni2+
绿色
Cu2+
蓝色
Zn2+
无色
上页 下页 目录 返回
许多二价过渡元素金属离子 M 2+ (aq)的 颜色与d-d 跃迁或 f-f 跃迁有关。这种 跃迁发生在金属离子本身,通常强度都 很弱,不能解释无机颜料的颜色。副篇 介绍了荷移跃迁和价层间跃迁。
第一过渡系金属水合离子的颜色
●熔点、沸点高
同周期元素单质的熔 点,从左到右一般是先逐渐
升高,然后又缓慢下降。在
同一族中,第二过渡系元素 的单质的熔点、沸点大多高 于第一过渡系,而第三过渡 系的熔点、沸点又高于第二 过渡系(第 3 族除外),熔点 最高的单质是钨。 熔点最高的单质: 钨(W) 3683±20℃
上页 下页 目录 返回
(4)
金属元素的电极电势
φθ的单位为V
元素
Ca -2.87 Sc Ti V Cr Mn Fe Co Ni Cu 0.34 Zn -0.76
φθ(M2+/M)
Φθ (M3+/M2+)
- -1.63 -1.18
-0.91 -1.18 -0.44 -0.28 -0.23
-
-
-0.37 -0.256 -0.41 +1.51
d 电子组态 M2+(aq)
d1 d2 Sc2+ Ti2+
d3 d4 V2+ Cr2+
d5 d6 d7 Mn2+ Fe2+ Co2+
d8 d9 d10 Ni2+ Cu2+ Zn2+
稳 定 性 增 大
无机化学课件16-d区元素(一)

4
Cr2O72 H2O (橙)
pH<2:Cr2O72-为主,pH>6:CrO42-为主。 编辑ppt
(4) Cr(Ⅵ) 的难溶盐
铬酸盐比相应的重铬酸盐溶解度小。 K sp (Ag2CrO4) 1.1×1012 K sp (Ag2Cr2O7 )2.0×107
(3) Cr(Ⅵ) 含氧酸及其离子在溶液中的转化
•H2Cr2O7, H2CrO4均为强酸,仅存在于稀溶液
HC2rO7 H Cr2O72 Ka2 0.85
H2CrO4 H HCrO4 Ka1 9.55
HCrO4 H CrO24 •pH的影响
Ka2 3.2×107
2CrO
2 4
2H
(黄)
2HCrO
2. d区元素原子的价电子层构型
(n-1)d1-10ns1-2 (Pd为5s0)
编辑ppt
3. d区元素的3原. 同六子族周半元期径素(除从Ⅲ上B往)外下由原于子镧半系径收增缩大使,其但同五、
Cs 250 Rb
过族 性渡元质元素相素原似的子。半原径子十半分接径近,导致其元素
原子半径/pm
K 200
编辑ppt
16.1.3 d区元素的化学性质
元素
M2/M
EV
可溶该 金属的
酸 元素
E M2/M V 可溶该 金属的 酸
Sc ---
各种酸
Fe -0.409 稀 HCl H2SO4
等
Ti
-1.63
热 HCl HF Co
-0.282 缓慢溶解 在 HCl 等
酸中
V -1.2 (估算值) HNO3, HF 浓 H2SO4 Ni
同多酸和杂多酸及其盐
编辑ppt
d区元素一(相关知识点)
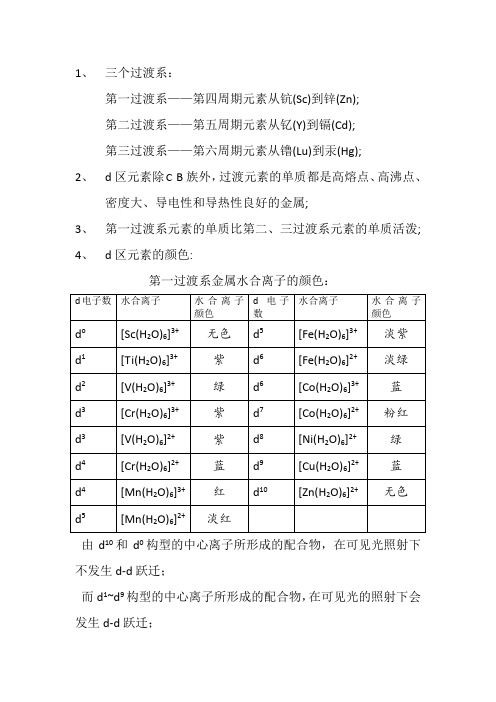
1、三个过渡系:第一过渡系——第四周期元素从钪(Sc)到锌(Zn);第二过渡系——第五周期元素从钇(Y)到镉(Cd);第三过渡系——第六周期元素从镥(Lu)到汞(Hg);2、d区元素除 B族外,过渡元素的单质都是高熔点、高沸点、密度大、导电性和导热性良好的金属;3、第一过渡系元素的单质比第二、三过渡系元素的单质活泼;4、d区元素的颜色:第一过渡系金属水合离子的颜色:由d10和d0构型的中心离子所形成的配合物,在可见光照射下不发生d-d跃迁;而d1~d9构型的中心离子所形成的配合物,在可见光的照射下会发生d-d跃迁;对于某些具有颜色的含氧酸根离子,如:VO 43-(淡黄色)、CrO 42-(黄色)、MnO 4-(紫色)等,它们的颜色被认为是由电荷迁移引起的; 5、(1)钛(Ti)是银白色金属,其表面易形成致密的氧化物保护膜,使其具有良好的抗腐蚀性,特别是对湿的氯气和海水具有良好的抗腐蚀性能;(2)加热TiO 22nH O 可得到白色粉末状的TiO 2:3002222CTiO nH O TiO nH O −−−→+;(3)自然界中存在的金红石是TiO 2的另一种存在形式,由于含少量的铁、铌、钒、钽等而呈红色或黄色;(4)TiO 2在工业上用作白色涂料和制造钛的其他化合物; (5) TiO 2+H 2SO 4(浓)=TiOSO 4+H 2O ; TiO 2+2C(s)=Ti(s)+2CO(s) ; (6)制取Ti 的方法:通常用TiO 2、碳和氯气在800C~900C 时进行反应:800~900224222C CTiO C Cl TiCl CO ++−−−−→+ ;用Mg 还原TiCl 4: TiCl 4+2Mg=Ti+2MgCl 2 ; (7)TiCl 4在加热的情况下:2TiCl 4+H 2=2TiCl 3+2HCl ;(8)Ti 4+由于电荷多,半径小,使它具有强烈的水解作用,甚至在强酸溶液中也未发现有[Ti(H 2O)6]4+的存在,Ti 4+在水溶液中是以钛氧离子(TiO 2+)的形式存在;(9)在中等酸度的Ti 4+的盐溶液中加入H 2O 2:TiO2++H2O2=[TiO](H2O2)]2+(橘黄色) ;(10)在酸性溶液中用Zn还原TiO2+时,可形成紫色的[Ti(H2O)6]3+(可简写成Ti3+):2TiO2++Zn+4H+=2Ti3++Zn2++2H2O ;(11)向含有Ti3+的溶液中加入碳酸时:2Ti3++3CO32-+3H2O=2Ti(OH)3(s)+3CO2;(12)在酸性溶液中,Ti3+是一种比Sn2+略强的还原剂,它易被空气中的氧所氧化:4Ti3++2H2O+O2=4TiO2++4H+;(13)有机化学中常用Ti3+来证实硝基化合物的存在,它可将硝基还原为氨基:RNO2+6Ti3++4H2O=RNH2+6TiO2++6H+;6、(1)钒在自然界中的存在极为分散,很少可以见到钒的富矿;(2)钒是银灰色金属,在空气中是稳定的,其硬度比刚大;(3)钒对于稀酸也是稳定的,但在室温下,它能溶于王水或硝酸中,生成VO2+;浓硫酸和氢氟酸仅在加热条件下与钒发生作用;(4)加热时。
第十六章d区元素一

第十六章d区元素(一)[教学要求]1.了解过渡元素的原子结构特征和通性。
2.了解钛、钒及其重要化合物的性质。
3.了解铬单质的性质。
掌握Cr(Ⅲ)、Cr(Ⅵ)化合物的酸碱性、氧化还原性及其相互转化。
*了解钼、钨的重要化合物。
4.掌握Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的性质。
5.掌握Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)重要化合物的性质及其变化规律。
掌握Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)重要化合物的性质及其变化规律。
熟悉铁、钴、镍的重要配合物。
[教学重点]1.过渡元素的价电子构型特点及其与元素通性的关系。
2.Ti、V、Cr、Mn、Fe、Co、Ni的单质及化合物的性质。
[教学难点]第四周期d区金属元素氧化态、最高氧化态氧化物及其水合氧化物的酸碱性、氧化还原稳定性、水合离子以及含氧酸根颜色等变化规律。
[教学时数]10学时[主要内容]1.第一过渡系元素的基本性质。
2.Ti、TiO2、H4TiO4、TiCl4、TiCl3的性质。
3.V、V2O5、钒酸盐和多钒酸盐的性质。
4.Cr的性质,Cr(III)、Cr(VI)化合物的性质。
5.Mn的性质,Mn(II)、Mn(IV)、Mn(VI)、Mn(VII)化合物的性质。
6.Fe、Co、Ni的单质及化合物的性质和用途。
[教学内容]§16.1 d区元素概述16.1.1 d区元素概述1.d区元素在周期表中的位置d区元素(d区金属):周期表中具有部分填充d壳层电子的元素.第一过渡系:周期表中第四周期的d区(3d)元素包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni.第二过渡系:周期表中第五周期的d区(4d)元素包括Zr、Nb、Mo、Tc、Ru、Rh、Pd.第三过渡系:周期表中第六周期的d区(5d)元素包括Hf、Ta、W、Re、Os、Ir、Pt.第四过渡系:周期表中锕(89号)到112号元素。
镧系元素:镧(57号)和镥( 71号)之间的15种元素。
无机化学大连理工第十六章-d区元素(一)-习题解

第十六章 d区元素(一) 习题解1.完成并配平下列反应方程式。
(1)2TiO2+ + Zn + 4H+→2Ti3+ + Zn2+ + 2H2O(2)2Ti3+ + 3CO32- + 3H2O →2Ti(OH)3(s) + 3CO2(g)(3)TiO2 + H2SO4(浓) →TiOSO4 + H2O(4)TiCl4 + 3H2O →H2TiO3(s) + 4HCl(5)TiCl4 + 2Mg →2MgCl2 + Ti(s)2.完成并配平下列反应方程式。
(1)V2O5 + 2Cl- + 6H+→2VO2+ + Cl2(g) + 3H2O(2)2NH4VO3→V2O5 + 2NH3(g) + H2O (加热)(3)2VO2+ + SO32- + 2H+→ 2VO2+ + SO42- + H2O(4)5VO2+ + MnO4- + H2O →5VO2+ + Mn2+ + 2H+3.已知下列电对的标准电极电势:VO2+ + 2H++ e-→VO2+ + H2O φθ = 0.9994VVO2+ + 2H++ e-→V3+ + H2O φθ = 0.337VV3+ + e-→V2+φθ = -0.255VV2+ + 2e-→V φθ = -1.2V在酸性溶液中分别用1mol·L-1Fe2+,1mol·L-1Sn2+和Zn还原1mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?解:查附表六可知:Fe3+ + e-→Fe2+φθ(Fe3+/ Fe2+) = 0.769VSn4+ + 2e-→Sn2+φθ(Sn4+/ Sn2+) = 0.1539VZn2+ + 2e-→Zn φθ(Zn2+/ Zn) = -0.7621V当用1mol·L-1 Fe2+还原1mol·L-1的VO2+时,只能得到VO2+离子;当用1mol·L-1 Sn2+Z 在酸性溶液中还原1mol·L-1的VO2+时,首先被还原为VO2+离子,可继续被被还原为V3+离子。
大学无机化学d区元素介绍
3.物理性质
(1) 熔点、沸点高
熔点最高的单质:钨(W)
(2) 硬度大 (3) 密度大
熔点: 3410℃ 沸点: 5900℃
硬度最大的金属:铬(Cr)
以金刚石为10,铬为9
密度最大的单质:锇(Os)
(4) 导电性,导热性,延展性好
22.7gcm-3
4.离子呈现多种颜色
物质显色的原因是由于可见光作用到物质上以后物质
12.2.3(2)钒的化学性质
•价电子层结构3d34s2,主要氧化态+5,也能形成氧化态为 +4,+3,+2的化合物。化学性质相当复杂。
VO2+ 1.0 VO2+ 0.36 V3+
-0.25
-0.25
V2+ -1.2 V
17
12.2.3(3)钒的氧化物(V2O5)
•酸碱性: VO碱O2+ 2C +2Cl2 = TiCl4 +2CO 四氯化钛是无色液体,有剌鼻的气味,极易水解, 在潮湿的空气中由于水解而发烟——利用此反应可 制造烟幕:
•TiCl4高温氧化制备优质钛白——氩气氛保护下得Ti: TiCl4(l) +Mg = Ti +2MgCl2
16
12.2.3(1) 钒
•钒在地壳中的含量比锌、铜、铅等普通元素还要多,但分 布很分散,属稀有元素。 •钒被广泛用于制造特种钢和催化剂。
在钛的化合物中,以+4氧 化态的化合物最稳定。二 氧化钛在自然界中有三种 晶型:金红石、锐钛矿和 板钛矿。其中最重要的是 金红石,天然金红石中因 含少量杂质而呈红色或橙 色。
金红石的结构
13
12.2.1(3) 化学性质
•室温下金属钛较稳定,但受热时,钛可与许多非金属,如: 氧、氮、碳、卤素等反应。 •钛在室温下不能与水或稀酸反应,但可溶于浓盐酸或热的 稀盐中形成三价钛离子:
湖南理工学院无机化学习题库第16章d 区元素(一)

第16章 d 区元素(一)一是非题1.按照酸碱质子理论,[Fe(H2O)5(OH)]2+的共轭酸是[Fe(H2O)6]3+, 其共轭碱是[Fe(H2O)4(OH)2]+。
()2. 由Fe3+能氧化I-,而[Fe(CN)6]3-不能氧化 I-,可知[Fe(CN)6]3-的稳定常熟小于[Fe(CN)6]4-的稳定常数。
()3. 某溶液中共存有NO− , Cr O 2− , K + , Fe3+ , Cl −I 和I-,并无任何反应。
()GAGGAGAGGAFFFFAFAF4. 在[Ti(H2O)6]3+配离子中,Ti3+的d轨道在H2O的影响下发生能级分裂,d 电子可吸收可见光中的绿色光而发生d-d 跃迁,散射出紫红色光。
()5. 在 M n+ +ne ====M 电极反应中,加入M n+的沉淀剂,可使标准电极电势Eθ的代数值增大,同类型的难溶盐的K sp值越小,其Eθ的代数值越大。
()二选择题1. 下列过渡元素中能呈现最高氧化数的化合物是()⑴ Fe⑵ CoGAGGAGAGGAFFFFAFAF⑶ Ni⑷ Mn2. Fe3O4与盐酸作用的产物为()⑴ FeCl3+H2O ⑵ FeCl2+H2O⑶ FeCl3+FeCl2+H2O ⑷ FeCl3+Cl2GAGGAGAGGAFFFFAFAF3. Co3O4与盐酸作用的产物为()⑴ CoCl2+H2O ⑵ CoCl3+CoCl2+H2O ⑶CoCl2+Cl2+H2O ⑷ CoCl3+ H2O4. 欲除去 FeCI3中含有的少量杂质 FeCI2,应加入的物质是()⑴通 CI2⑵KMnO4⑶HNO3⑷ K2C r2O75. 下列哪个溶液中,当加入 NaOH 溶液后,仅有颜色发生变化而无沉淀生成的是()⑴ FeSO4⑵KMnO4⑶GAGGAGAGGAFFFFAFAFNiSO4⑷ K2 Cr2O76. 欲制备Fe2+的标准溶液,应选择的最合适的试剂是()⑴ FeCI2溶于水⑵硫酸亚铁铵溶于水⑶ FeCI3溶液中加铁屑⑷铁屑溶于稀酸7. 用来检验 Fe2+离子的试剂为()GAGGAGAGGAFFFFAFAF⑴ NH4SCN ⑵ K3[Fe(CN)6]⑶ K4[Fe(CN)6]⑷ H2S8. 用来检验 Fe3+离子的试剂为()⑴ KI ⑵NH4SCN ⑶ NaOH⑷ NH3·H2O9. [Co(CN)6]4-与[Co(NH3)6]2+的还原性相比较()⑴ [Co(NH3)6]2+还原性强⑵ [Co(CN)6]4-还原性强GAGGAGAGGAFFFFAFAF⑶两者都强⑷两者都不强10 CoCl3·4NH3用H2SO4溶液处理再结晶, SO 可取代化合物中的 Cl-,但NH3的含量不变,用过量AgNO3处理该化合物溶液,每摩尔可得到1mol的AgCl沉淀这种化合物应该是()⑴ [Co(NH3)4]Cl3⑵ [Co(NH3)4Cl]Cl2⑶ [Co(NH3)4Cl2]Cl⑷ [Co(NH3)4Cl3]GAGGAGAGGAFFFFAFAF11. 由 Cr2O3出发制备铬酸盐应选用的试剂是()⑴浓 HNO3⑵ KOH(s) +KCIO3(s) ⑶CI2⑷H2O212. 下列哪一种元素的氧化数为+ IV 的氧化物,通常是不稳定的()⑴ Ti ( IV ) ⑵V( IV ) ⑶Cr( IV ) ⑷ Mn ( IV ) 13. 镧系收缩的后果之一,是使下列哪些元素的性质相似()GAGGAGAGGAFFFFAFAF⑴ Sc 和 La ⑵Cr 和Mo ⑶ Fe、Co 和Ni ⑷ Nb 和 Ta14. 下列各组元素中最难分离的是()⑴ Li 和 Na ⑵ K 和Ca ⑶ Cu 和Zn ⑷ Zr 和 Hf15. 在酸性介质中,欲使 Mn2+氧化为 MnO4,采用的氧化剂应为()⑴ H2O2⑵王水⑶ K2C r2O7+ H2SO4⑷ NaBiO3GAGGAGAGGAFFFFAFAF16 . 向 FeCl3溶液中加入氨水生成的产物之一是()⑴Fe(NH)⑵Fe(OH)Cl2⑶Fe(OH)2Cl ⑷ Fe(OH)317. 下列物质不能在溶液中大量共存的是()⑴ Fe(CN)和OH-⑵Fe(CN)和I-⑶ Fe(CN)和I-⑷Fe3+和Br18. 下列新制出的沉淀在空气中放置,颜色不发生变化的是()GAGGAGAGGAFFFFAFAF⑴ Mg (OH)2⑵Fe(OH)2⑶Co(OH)2⑷ Ni(OH)219. 下列化合物中与浓盐酸作用没有氯气放出的是()⑴ Pb2O3⑵Fe2O3⑶ C o2O3⑷ Ni2O320. 酸性条件下 H2O2与 Fe2+作用的主要产物是()GAGGAGAGGAFFFFAFAF⑴ Fe, O2 和 H+⑵ Fe3+和H2O ⑶ Fe 和H2O ⑷ Fe3+和O2三填空题1. 在地壳中储量居前十位的元素中属于过渡金属的有2. 向 FeCl3溶液中加入KSCN溶液后,溶液变为色,再加入过量的NH4F溶液后,溶液又变为色,最后滴加NaOH溶液时,又有生成。
d区金属
后果
(1) Y3+半径88pm落在Er3+88.1pm附近,Y进入稀土元素。 Sc半径接近Lu3+,常与Y3+共生,Sc也成为稀土元素。 (2) Zr与Hf、Nb与Ta、Mo与W三对元素半径十分接近、化 学性质十分相近,常伴生在一起,难以分离。 Zr(IV) Nb(V) Mo(VI)
80pm
Hf(IV) 79pm
度大,是宇航、航海、化工设备等的
理想材料。
• 强度好: Al的2-3倍,Mg的5倍 耐热合金用于飞机发动机 • 刚性大 : 约为钢的一半,比AlMg大 钛能与骨骼肌肉生长在一 • 质轻: 4.54g/ml钢的一半 起,称为“生物金属”。 时 间 强度/重量比: 1957 1968 1948 1952 金属中最大 1978 1990 2000 • • 抗腐蚀: 960 2000 钛关节 104005 21000 420000 年产量/T 3 与不锈钢相同,对海水与铂同 45053
所以第五和第六周期的同副族 元素及其化合物,性质相似, 结构相似,以致给分离工作带 来了困难。
ý É ª Ø Ó ë ¶ ¹ ¶ Ô Ë Ô ×°¾ 200 190 180 170 160 150 140 130 120 110 100 20 30
六
五 四
同 族 从 上 到 下 原 子 半 径 略 增 加
Cr -0.90 稀 HCl H2 SO4 Cu +0.339 HNO3 , 浓 热 H2 SO4
Mn -1.18 稀 HCl H2 SO4 等 Zn -0.762 稀 HCl H2 SO4 等
可溶该 金属的 酸 元素
各种酸 Fe -0.409 稀 HCl H2 SO4 等
M
2
ds区元素[1]详解
![ds区元素[1]详解](https://img.taocdn.com/s3/m/fdaf6df46294dd88d0d26b99.png)
ds区元素
11.1 ds区元素概述 11.2 ds区元素单质的重要性质 11.3 ds区元素的重要化合物
11.1 ds 区元素概述
IB族: Cu
IIB族: Zn
Ag
Cd
Au
Hg
(n-1)d10ns1
(n-1)d10ns2
虽然这些元素的最外层电子数分别与IA族和IIA族相同,
但它们之间的性质却有很大的差异。
Zn:419℃; Cd:321℃ Hg:-39℃,是室温下唯一的液态金属
(3)铜族导电性很好:Ag > Cu > Au
(4)易形成合金,可用于提取贵金属 黄铜:Cu-Zn;汞齐:Na-Hg, Au-Hg, Ag-Hg
(5)铜族延展性好: Au > Ag > Cu (6)Hg慢性中毒;Cd使蛋白酶失活。
我国铜矿储量世界第三,江西德兴有我国最大铜业基地。 银矿:自然界有辉银矿Ag2S、角银矿AgCl深红银矿Ag3SbS3; 也有单质银矿。
金矿:主要以单质存在,分成岩脉金(散布在岩石中)和冲 积金(分散在砂砾中);山东、黑龙江和新疆有很多金矿,
如碲金矿AuTe2
锌矿: 闪锌矿ZnS,菱锌矿ZnCO3 镉矿: 镉常与锌共生在一起。
这是因为ds区元素的有效核电荷比相应的s区元素高得
多 (d,f 电子对外层电子的屏蔽作用不完全 ) ,所以 ds 区 元素的化学性质远不如s区元素活泼。
IB族元素d轨道都是刚好填满10个d电子,由于刚填满的d 电子不很稳定,除失去1个s电子外,还有可能失去1个或2 个d电子而形成+2或+3氧化态; IIB族元素d轨道电子已比较稳定,只能失去最外层的2个 s电子,呈+2氧化态; ds区与s区元素性质对比 IB IIB IA IIA
ds区元素

96
72 750
126
89 735
137
85(M3+) 895
Ei,2/(kJ· -1) mol
h H m (M ,g)/(kJ mol )
+ 1
1970
-582 -2121 340 1.9
1
2083
-485 ─ 285 1.9
1987
△
2A g 2O
A g 2O + C O
4Ag + O 2 ↑
2Ag + C O 2
氧化银具有较强氧化性,容易被 CO 还原: Ag2O 和 MnO2、Co2O3、CuO 的混合物在室温 下就能将 CO 氧化成 CO2,常用于防毒面具中。
(二) 硝酸银
硝酸银是最重要的可溶性银盐。将银溶于硝酸 溶液中,蒸发、结晶,得到硝酸银晶体: 3Ag + 4H N O 3 3 A g N O 3 + N O↑+ 2 H 2 O 硝酸银加热到 713 K 时,按下式发生分解: △ 2AgN O3 2 A g + N O ↑ + O2 ↑ 2 在日光照射下,硝酸银也会按上式缓慢分解,因此 硝酸银晶体或溶液应装在棕色试剂瓶中。 硝酸银具有氧化性,遇微量的有机化合物即被 还原为黑色的单质银。 硝酸银主要用于制造照相底片所需的溴化银乳 剂,它还是一种重要的分析试剂。医药上常用它作 消毒剂和腐蚀剂。
二、铜的重要化合物
(一) 氧化物和氢氧化物
氧化铜为黑色晶体,不溶于水,但可溶于酸溶 液。氧化铜的热稳定性很高,加热到 1000 ℃ 才分 解为氧化亚铜和氧气:
1000 ℃
4C uO
化学竞赛元素部分——d区
H2Cr2O4酸性强:K1=4.1,K2=10-5,不易形成多酸
有强氧化性--测定铁、洗液、与乙醇反应(检验是否酒后驾车) H2O2与重铬酸盐反应(用乙醚萃取)生成蓝色的CrO5,可以鉴定Cr(VI):
有多种优异性质
密度: 4.54g·cm-3,比钢轻 43% 强度大:合金抗拉强度达180
kg·mm-2,适应温度宽
耐腐蚀 (不怕酸、碱、海水)
用途广泛:飞机;潜艇材料, 可增加深度 80% 达 4500 m 以 下; Ni-Ti记忆合金;亲生物金属,可做人造关节等。
5
F22
6
单质的反应
铬铅矿 磷铬铅矿
Cr、Mo的价电子构型为(n-1)d5ns1,W的价电子构型为
5d46s2,它们中的6个电子都可以参加成键。按Cr、Mo、W
的顺序最高氧化态的稳定性增强,低氧化态的稳定性减弱。
25
钼钨
白钨矿 钨铁矿
辉钼矿
黑钨矿
26
铬 (chromium)
制备方法
Fe(CrO2)2(s)
1000 ~ 1300 ℃ 空气 ①
性质 强氧化性 不稳定
CrO3 + H2CrO4
<30℃
2 Cr2(SO4)3 + 3 O2 + 6 H2O
>470℃ CrO3 → Cr3O8 →
Cr2O5 → CrO2 → Cr2O3
酸性氧化物
CrO3 + 2H2O → H2CrO4
33
Cr(III)化合物
铬绿 ( Cr2O3 )
d区元素

(3)与B、C、N形成间充式化合物,m.p.比 纯金属还高 ,TiC、 WC、TiN、TiB 的 m.p. > 3000℃,硬度都接近于金刚石
ZnS (硫化锌) ZnS (BaSO4) (锌钡白) CdS/CdSe (镉红)
铬酸盐
白色
红色
Pb(Cr, Mo, S)O4 (钼红)
黄色
CdS (镉黄)
PbCrO4或Pb(Cr, S)O4 (铬黄) ZnCrO4 (铬酸锌)
绿色
Cr2O3 铬绿 (氧化铬绿) (铅铬黄+铁蓝) (Co, Ni, Zn)2O4 (尖晶石绿)
许多国家都在颁布相应的法律限制使用含有危害人体健康和 环境的重金属元素(如 Cd、Cr、Hg、Mo等)的颜料, 因此, 发展新型、无毒的无机颜料材料已迫在眉睫 。已有人将 γ– Ce2S3 掺杂着碱金属作为红色和黄色颜料. 它们可用于染色制衣 工业和塑料工业,从而替代了CdSe1-xSx材料。
(1 ) 颜色的互补 (2 ) 无机化合物生色机理— 产生能量较低的激发态
水可以部分地被氯离子所置换,形成不同的水合异 构体,并呈现不同的颜色:
[Cr(III)(H2O)6] Cl3
紫色 淡绿色
[Cr(III)Cl(H2O)5]Cl2· H2O
[Cr(III)Cl2(H2O)4]Cl· 2H2O
暗绿色
实验室见到的三价铬离子溶液常为淡绿色,就是 因为部分内界H2O被溶液中的氯离子所置换的缘故。
第一电离能
总趋势: 同周期 左→右 小→大 同副族 不规律
d区金属元素钛钒铬锰实验报告(一)

d区金属元素钛钒铬锰实验报告(一)D区金属元素钛钒铬锰实验报告本次实验旨在对D区金属元素的物化性质进行研究,其中涉及到钛(Ti)、钒(V)、铬(Cr)和锰(Mn)四个元素的实验。
实验目的1.理解各元素的化学性质和重要用途;2.对各元素的物理性质进行测试;3.消除关于D区金属元素的疑虑和误解。
实验步骤1.准备实验仪器和物质,包括D区金属元素的样本、实验台、试管、酸和水等;2.确定实验方案,选定测试手段和参数;3.准确称取金属样本,并将样本放入试管中加入预处理液,让其溶解;4.进行物理性质测试,如密度、熔点等;5.进行化学性质测试,如反应速率、纯度等。
实验结果钛1.密度:4.54g/cm³;2.熔点:1668℃;3.化学性质:能被强氧化剂蚀刻,产生钛酸钠(Na2TiO3)等物质。
钒1.密度:6.0g/cm³;2.熔点:1910℃;3.化学性质:可以和氮气反应,生成氮化钒(VN),在强碱性介质中可以产生VO43-等离子体。
铬1.密度:7.19g/cm³;2.熔点:1907℃;3.化学性质:铬能在强氧化剂作用下产生CrO42-等离子体,能制成各种合金。
锰1.密度:7.43g/cm³;2.熔点:1246℃;3.化学性质:可以被轻度氧化剂氧化,在水中可以形成锰离子(Mn2+)和锰酸根离子(MnO42-)。
实验结论在此次实验中,我们对D区金属元素钛、钒、铬、锰进行了物理性质和化学性质的测试,并得出了一定的结论:1.四种金属元素具有不同的密度、熔点等物理性质;2.钛、钒、铬和锰都能在适当反应条件下与其他物质发生化学反应;3.各元素的化学性质差异较大,可用于不同的生产工艺中。
综上,此次实验结果为我们更深入了解金属元素的物化性质提供了重要参考和支撑,也有助于我们在日常使用中更加合理地使用这些元素。
实验注意事项1.实验过程需严格遵守实验操作规范,注意安全;2.实验仪器和物质需事先检查,确保能正常使用;3.测试结果需准确记录,不得遗漏;4.测试前需对实验方案进行充分讨论和确认,确保测试方法和参数的准确性。
大学无机化学d区元素介绍

失去结晶水
水溶液中铬的各种离子
颜色
Cr2O
27
橙红
CrO
24
黄
Cr3+(aq) 紫
Cr(OH)
4
亮绿
Cr2+(aq) 蓝
Cr2+(aq)
存在的pH
<2
>6
酸性
强碱 酸性
Cr3+(aq)
1. (1)Cr(Ⅵ) 含氧酸及其离子在溶液中的转化
•H2Cr2O7, H2CrO4均为强酸,仅存在于稀溶液
(2) Cr(Ⅵ) 的难溶盐 铬酸盐比相应的重铬酸盐溶解度小。 Ksp(Ag2CrO4) =1.1×10-12 Ksp(Ag2Cr2O7 )=2.0×10-7
4Ag Cr2O72- H2O 2Ag2CrO4 (s,砖红) 2H 2Ba2 Cr2O72- H2O 2BaCrO4 (s,柠檬黄)2H 2Pb2 Cr2O72- H2O 2PbCrO4 (s,黄) 2H
如:VH18,TaH0.76,LaNiH5.7 。 4. 与硼、碳、氮形成间充式化合物。
5.多种氧化态 红色为常见的氧化态
§12.2 钛 钒
12.2.1.(1)金属钛的物理性质
银白色光泽,熔点较高,密度比钢小,机 械强度大,抗腐蚀性很强。 航天、航海、军械兵器等部门不可缺少的 材料。
12.2.1 (2)钛的 化合物
18
•V2O5与强酸反应(pH < 1) 得到的不是五价钒离子,而是含五价钒的钒氧离子:
V2O5 + 2H+ = 2VO2+ + H2O
•五氧化二钒具有氧化性,可以氧化盐酸:
V2O5 + 6HCl = 2VOCl2 + Cl2 + 3H2O
过渡元素(1)

VO2 Fe2 2 H VO 2 Fe3 H 2O 2VO2 H 2C2O4 2 H VO 2 2CO2 2 H 2O VO2 2 I 4 H V 3 I 2 2 H 2O 2VO2 3Zn 8H 2V 2 3Zn 2 2 H 2O
在酸性溶液中,VO2+可被Fe2+,SO32-,H2C2O4,I-,Zn等还原剂还原,还原 产物具有丰富多彩的颜色。 Fe2+只能将V(V)还原为VO2+,I-只能将V(V)还原 为V3+,而Zn可将其还原为V2+。如在NH4VO3的酸性溶液中加入Zn,会依次 看到蓝色(VO2+)绿色(V3+)及紫色(V2+),这是一种分级还原的过程。 V(Ⅲ),V(Ⅱ)是强还原剂,尤其在碱性条件下,很容易被空气中的氧所氧化, V(Ⅱ)的化合物还能从水中置换出氢。
二、钛及其化合物
二氧化钛的制取
二氧化钛的工业生产,几乎包括了全部无机化学工艺过程,因而被喻 为“工艺艺术品”。
二氧化钛的生产可采用硫酸法或氯化法,以钛铁矿为原料的二氧化钛 生产常以硫酸法为主。该法主要过程有:(1)硫酸分解精矿制取硫酸氧钛溶 液(2)净化除铁(3)水解制偏钛酸(4)偏钛酸煅烧制二氧化钛。 钛铁矿精矿成分除FeTiO3外,还有Fe2O3以及SiO2, Al2O3, MnO, CaO, MgO等杂质。160~200°C下,用浓硫酸分解精矿的主要反应如下:
四、铬及其化合物
铬的价电子结构为3d54s1,可形成氧化值为+2、+3、+6的化合物,其中 +3、+6的化合物较常见。铬的化合物主要有氧化物、氢氧化物、含氧酸及其 盐类,呈现多种颜色。
第十五章 d区元素(一)

2 4MnO4 4OH 4MnO4 O2 ( g ) 2 H 2O; E 0.564V
优点:氧化性强,尤其在酸性溶液中; 缺点:溶液易分解,不宜长期放置。 少量酸,微量杂质都会加速分解。 MnO 4 H 4MnO 2 2H 2 O 3O( 4 2 g)
Cr 3 被氧化成Cr2O72要用更强的氧化剂, 在酸性溶液中通常用(NH 4) 2 S 2O8 , 在碱性溶液中通常用H 2O2。
2Cr 3S 2O 7 H 2O Cr2O 6SO 14 H
2 4
3
2 8
2 7
2 4
2[Cr (OH ) 4 ] 3H 2O2 2OH 2CrO 8H 2O
return
2.物理性质
(1) 熔点、沸点高
(2) 硬度大
熔点最高的单质:钨(W)
3387℃ 硬度最大的金属:铬(Cr)
莫氏9度
(3) 密度大 密度最大的单质:锇(Os)
22.48
(4)导电性最好 银(Ag) 铜(Cu) 金(Au) 铝(Al)
(5) 导热性,延展性好
熔点变化示意图
密度变化示意图
第十五章
§15.2 钛 钒
d区元素(一)
§15.1 d区元素概述
§15.3 铬 钼 钨
§15.4 锰
§15.5 铁 钴 镍
§15.1 d区元素概述
一、d区元素通性
包括
ⅢB-Ⅷ ,ⅠB、ⅡB 1、原子的价电子层构型
(n-1)d1-10ns1-2
第一过渡系:第四周期从钪(Sc)到锌 (Zn) 第二过渡系:第五周期从钇(Y)到镉 (Cd) 第三过渡系:第六周期从镥(Lu)到汞 (Hg)
第十四章 d区元素(一) 铬锰铁钴镍

第十四章d区元素(一)铬锰铁钴镍第一节d区元素通论(p290)一、原子的电子层结构和原子半径ⅢB~ⅠB,d区和ds区,价电子构型:(n-1)d1-10ns1-2,见p111面原子的电子层结构。
同一过渡系元素,随着原子序数的增加,原子半径依次减小,但从第5族开始变得缓慢。
见p292面图14-2。
二、氧化态ns和(n-1)d能量相差不大,d电子也能部分参与成键,形成多种可变氧化态。
见p293面。
三、单质的物理性质ⅡB族:Zn、Cd、Hg,低熔点金属,其余m.p.、b.p.、密度、硬度都较高。
见p293面。
许多过渡元素的单质及其化合物呈现顺磁性(顺磁,定义为左旋物质体系,S极向上)。
四、单质的化学性质活泼性差别很大。
第一过渡系元素都是比较活泼的金属,从左至右,金属性逐渐减弱。
与第一过渡系元素相比,第二、三过渡系元素较不活泼,即同族元素自上而下,金属活泼性逐渐减弱。
五、氧化物及其水合物的酸碱性d区元素高氧化态的氧化物是酸性氧化物,相应的水合物为酸。
低价态的氧化物为碱性氧化物,其相应的水合物为碱。
同一过渡系的氧化物及其水合物的碱性,从左至右逐渐减弱,高氧化态时表现为从碱到酸。
在同一族中各元素自上而下,氧化态相同时酸性减弱而碱性增强。
见p295面表14-4。
六、配合物形成体易生成配位化合物(有空轨道,半径小,对配位体有较强吸引力)。
七、水合离子的颜色Cu+、Ag+、Au+、Zn2+、Cd2+、Hg2+,(n-1)d10ns0构型,无未成对电子,水合离子无色。
见p296面表14-5。
八、催化性催化性与电子在d轨道未填满有密切关系。
第一节铬及其化合物一、铬的物理性质和化学性质物理性质:自然界:铬铁矿,FeO·Cr2O3(FeCr2O4)纯Cr,银白色金属,硬度大,耐磨性好,反光率强,化学性质稳定(在空气中不起变化,不变色,强烈的钝化作用)其用途:①常作保护装饰性镀层;②加入钢中,增强钢的耐磨性、耐热性、耐腐蚀性、硬度、弹性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第16章 d 区元素(一)一是非题1.按照酸碱质子理论,[Fe(H2O)5(OH)]2+的共轭酸是[Fe(H2O)6]3+, 其共轭碱是[Fe(H2O)4(OH)2]+。
()2. 由Fe3+能氧化I-,而[Fe(CN)6]3-不能氧化I-,可知[Fe(CN)6]3-的稳定常熟小于[Fe(CN)6]4-的稳定常数。
()3.某溶液中共存有NO−, Cr O 2−, K +, Fe3+, Cl −I和I-,并无任何反应。
()4. 在[Ti(H2O)6]3+配离子中,Ti3+的d轨道在H2O的影响下发生能级分裂,d 电子可吸收可见光中的绿色光而发生d-d 跃迁,散射出紫红色光。
()5. 在M n++ne ====M 电极反应中,加入M n+的沉淀剂,可使标准电极电势Eθ的代数值增大,同类型的难溶盐的K sp值越小,其Eθ的代数值越大。
()二选择题1. 下列过渡元素中能呈现最高氧化数的化合物是()⑴Fe ⑵Co ⑶Ni ⑷Mn2. Fe3O4与盐酸作用的产物为()⑴FeCl3+H2O ⑵FeCl2+H2O ⑶FeCl3+ FeCl2+H2O ⑷FeCl3+Cl23. Co3O4与盐酸作用的产物为()⑴CoCl2+H2O ⑵CoCl3+ CoCl2+H2O ⑶CoCl2+Cl2+H2O ⑷CoCl3+ H2O4. 欲除去FeCI3中含有的少量杂质FeCI2,应加入的物质是()⑴通CI2⑵ KMnO4⑶ HNO3⑷K2Cr2O75. 下列哪个溶液中,当加入NaOH 溶液后,仅有颜色发生变化而无沉淀生成的是()⑴FeSO4⑵ KMnO4⑶ NiSO4⑷K2Cr2O76. 欲制备Fe2+的标准溶液,应选择的最合适的试剂是()⑴FeCI2溶于水⑵硫酸亚铁铵溶于水⑶FeCI3溶液中加铁屑⑷铁屑溶于稀酸7. 用来检验Fe2+离子的试剂为()⑴NH4SCN ⑵K3[Fe(CN)6] ⑶K4[Fe(CN)6] ⑷H2 S8. 用来检验Fe3+离子的试剂为()⑴KI ⑵NH4SCN ⑶NaOH ⑷NH·H2O39. [Co(CN)6]4-与[Co(NH3)6]2+的还原性相比较()⑴[Co(NH3)6]2+还原性强⑵ [Co(CN)6]4-还原性强⑶两者都强⑷两者都不强10CoCl3·4NH3用H2SO4溶液处理再结晶,SO可取代化合物中的Cl-,但NH3的含量不变,用过量AgNO3处理该化合物溶液,每摩尔可得到1mol的AgCl 沉淀这种化合物应该是()⑴[Co(NH3)4]Cl3⑵[Co(NH3)4Cl]Cl2⑶[Co(NH3)4Cl2]Cl ⑷[Co(NH3)4Cl3]11. 由Cr2O3出发制备铬酸盐应选用的试剂是()⑴浓HNO3⑵KOH(s) + KCIO3(s) ⑶CI2⑷H2O212. 下列哪一种元素的氧化数为+ IV 的氧化物,通常是不稳定的()⑴Ti ( IV ) ⑵V ( IV ) ⑶Cr( IV ) ⑷Mn ( IV )13. 镧系收缩的后果之一,是使下列哪些元素的性质相似()⑴Sc 和La ⑵Cr 和Mo ⑶Fe、Co 和Ni ⑷Nb 和Ta14. 下列各组元素中最难分离的是()⑴Li 和Na ⑵K 和Ca ⑶Cu 和Zn ⑷Zr 和Hf15. 在酸性介质中,欲使Mn2+氧化为MnO4,采用的氧化剂应为()⑴H2O2⑵王水⑶K2Cr2O7+H2SO4⑷NaBiO316 . 向FeCl3溶液中加入氨水生成的产物之一是()⑴Fe(NH)⑵ Fe(OH)Cl2⑶ Fe(OH)2Cl ⑷Fe(OH)317. 下列物质不能在溶液中大量共存的是()⑴Fe(CN)和OH-⑵ Fe(CN)和I-⑶ Fe(CN)和I-⑷ Fe3+和Br18. 下列新制出的沉淀在空气中放置,颜色不发生变化的是()⑴Mg (OH)2⑵ Fe(OH)2⑶ Co(OH)2⑷Ni(OH)219. 下列化合物中与浓盐酸作用没有氯气放出的是()⑴Pb2O3⑵Fe2O3⑶Co2O3⑷Ni2O 320. 酸性条件下H2O2与Fe2+作用的主要产物是()⑴Fe, O2 和H+⑵ Fe3+和H2O ⑶ Fe 和H2O ⑷Fe3+和O2 三填空题1. 在地壳中储量居前十位的元素中属于过渡金属的有2. 向FeCl3溶液中加入KSCN溶液后,溶液变为色,再加入过量的NH4F 溶液后,溶液又变为色,最后滴加NaOH溶液时,又有生成。
3. 离子V3+,Cr3+,Mn2+,Fe2+与弱场配体生成配合物按顺磁性由大到小排列这些金属离子,其顺序是4. 向热的氢氧化铁浓碱性悬浮液中通入氯气以,溶液变为色,再加入BaCl2溶液则有色的生成。
5. 给出下列物质的化学式绿矾,铁红,摩尔盐,赤血盐,黄血盐,二茂铁,普鲁士蓝6. 在配制FeSO4溶液时,常向溶液中加入一些和,其目的是7. FeCl3 的蒸气中含有分子,其结构类似于蒸气,其中Fe3+的杂化方式为8. 现有四瓶绿色溶液,分别含有Ni ( II )、Cu( II )、Cr( III )、MnO⑴加水稀释后,溶液变蓝的是⑵加入过量酸性Na2SO3 溶液后,变为无色的是⑶加入适量NaOH 溶液有沉淀生成,NaOH 过量时沉淀溶解,又得到绿色溶液的是⑷加入适量氨水有绿色沉淀生成,氨水过量时得到蓝色溶液的是9. 在Cr3+、Mn2+、Fe2+、Fe3+、Co2+、Ni2+中,易溶于过量氨水的是10. 向CoSO4溶液中加入过量KCN 溶液,则有生成,放置后逐渐转化为11. 具有抗癌作用的顺铂,其分子构型为,化学组成为,Ni(CN)的构型为,中心离子的未成对电子对为,而Ni(CN)构型为,未成对电子对为12. 铁系元素包括,铂系元素则包括,铂系元素因而在自然界中往往以态形式共生在一起,在金属单质中,密度最大的是13. d 区元素的价电子层结构的特点通式是,它们的通性主要有、、和14. d 区元素氧化数的变化规律是:同一过渡系从左向右氧化数,但随后氧化数又;同一副族自上向下,元素氧化数变化趋向是15. 同过渡系元素的最高氧化数的氧化物及其水合物,从左向右其酸性,而碱性;同副族自上向下,各元素相同氧化数的氧化物及其水合物,通常是酸性,而碱性16. 络合物分裂能∆大于成对能P 时,该络合物通常是属于型,其磁性四完成并配平反应方程式1. 写出下列反应方程式⑴加热三氧化铬⑵三氧化铬溶于水⑶加热重铬酸铵⑷在重铬酸钾溶液中加入钡盐⑸在重铬酸钾溶液中加碱后再加酸⑹在铬酸钾或重铬酸钾中加浓硫酸⑺向硫酸亚铁溶液加入Na2CO3后滴加碘水⑻硫酸亚铁溶液与赤血盐混合⑼强碱性条件下向Fe(OH)3加过量次氯酸钠⑽过量氯水滴入FeI2溶液中2. 完成并配平下列反应的离子方程式⑴KMnO4+H2S+H2SO4 →⑵KMnO4+FeSO4+ H2SO4 →⑶KMnO4+K2SO3+KOH→⑷KMnO4+Na2C2O4+ H2SO4 →五简答题1. 在Fe2+、Co2+和Ni2+离子的溶液中,分别加入一定量的NaOH 溶液,放置在空气中,各有什么变化?写出反应方程式。
2. Fe3+能腐蚀Cu,而Cu2+也能腐蚀Fe。
这一事实是否有矛盾?试有关电对的电极电位的相对大小加以说明,并写出有关反应式。
3. 现有五瓶透明溶液分别为Ba(NO3)2、Na2CO3、KCI、Na2SO4和FeCI3,要求不用任何其它试剂和试纸将它们区别开来。
4. 运用晶体场理论解释下列问题⑴[Cr(H2O)6]3+在水溶液中是较稳定的⑵[Cr(H2O)6]3+较[Cr(CN)6]4-络离子的磁性要大5. 某物质A为棕色固体,难溶于水。
将A与KOH混合后,敞开在空气中加热熔融得到绿色物质B。
B可溶于水,若将B的水溶液酸化就得到A和紫色的溶液C。
A与浓盐酸共热后得到肉色溶液D和黄绿色气体E。
将D与C混合并加碱使酸度降低,则又重新得到A。
E可使KI淀粉试纸变蓝,将气体E通入B的水溶液中又得到C。
电解B的水溶液也可获得C。
在C的酸性溶液中加入摩尔盐溶液,C的紫色消失,再加KCNS,溶液呈摁红色。
C和H2O2溶液作用时紫色消失,但有气体产生,该气体可使火柴余烬点燃。
问:A、B、C、D和E各是什么物质?并写出上述现象各步的主要反应式。
无机化学习题库参考答案:第一题判断题第二题选择题三填空题1. Fe 和Ti2. 血红。
无,棕色Fe(OH)3 沉淀3. Mn2+>Fe2+>Cr3+ >V3+4. 紫红,红棕,BaFeO45. 绿矾,FeSO4·7H2O;铁红Fe2O3;摩尔盐(NH4)2SO4·FeSO4·6H2O;赤血盐K3[Fe(CN)6];黄血盐K4[Fe(CN)6]·3H2O;二茂铁Fe(C5H5)2;普鲁士蓝KFe[Fe(CN)6]6. 铁屑和硫酸防止Fe2+水解和被氧化7. 聚体Fe 2Cl6,AlCl3;sp3;FeCl3中Fe —Cl 键共价成分较多8. (1)Cu(Ⅱ);(2)MnO42-;(3)Cr( III );(4) Ni(Ⅱ)。
9. Co2+,Ni2+10. Fe(CN )64-,Co(CN )63-11. 正方形,Pt(NH3)2 Cl2,正方形,0,四面体,212. Fe Co Ni,Ru Rh Pd Os Ir Pt,单质活泼性差,游离。
Os13. (n-1)1-9ns1-2;金属性,同种元素有多种氧化数,离子常带色,易形成络合物14 升高,下降,高氧化数化合物稳定性增加15. 增强,减弱,减弱,增强16. 高自旋,磁性强四完成并配平反应方程式(1) 1 4CrO3 ∆ 2Cr2O3+3O22 2CrO3+H2O=H2Cr2O7加热3 (NH4)2Cr2O-7=Cr2O3+N2↑+4H2O4 2Ba2++ Cr2O-7 =2BaCrO4+2H+5 Cr2O-7 +2OH=2CrO-4 +H2O2CrO-4+2H+=Cr2O-7 +H2O6 CrO-4+2H+=CrO-3 +H2O7 Fe2++ CO-3+2H2O=Fe(OH)2 ↓+2 HCO-32Fe(OH)2+2 CO-3 +2H2O= 2Fe(OH)3 +2I-+2 HCO-38 Fe2++ Fe(CN)63-+K+= K Fe [Fe(CN)6]↓9 2Fe(OH)3+3ClO-+4OH-=2 FeO42-+3Cl-+5H2O10 2Fe I2+13 Cl2+12H2O=2FeCl3+4HIO3+20HCl(2) 1 2MnO 4−+5H2S+6H+=2Mn2++5S+8H2 2MnO 4−+ 5Fe2++8H+=Mn2++5Fe3++4H2O3 2MnO 4−+ SO-3 +2OH-=2MnO 24−+ SO-4+H2O4 2MnO 4−+ 5C2O 24−=2Mn2++10CO2↑+8H2O五简答题1. Fe2+产生白色胶状沉淀的Fe(OH)2,在空气中易氧化为棕色的Fe(OH)3 沉淀Fe2++2OH-= Fe(OH)2; 4 Fe(OH)2+O2+2H2O=4 Fe(OH)3Co2+生成蓝色胶状沉淀Co(OH)2,在空气中放置可缓慢地氧化为粉红色Co(OH)3沉淀Co2++2OH-= Co(OH)2; 4 Co(OH)2+O2+2H2O= 4 Co(OH)3Ni2+与NaOH 作用生成的绿色胶状沉淀Ni(OH)2 在空气不能使之氧化2. 因形成[Fe](NCS)n]而使溶液呈血红色Fe3++nNCS-=[Fe(NCS)n] (n-3)加入少许铁屑后,使Fe3+还原为Fe2-,破坏了[Fe(NCS)n] (n-3),故血红色消失3 由溶液显黄色,可确定为FeCl3溶液。
