N'-金刚烷基-N-Fmoc-O-乙酰基-L-酪氨酰胺的合成
氨基酸手性色谱分离

218Univ. Chem. 2023, 38 (10), 218–224收稿:2023-01-26;录用:2023-02-13;网络发表:2023-02-28*通讯作者,Email:*******************.cn基金资助:国家重点研发计划(2018YFC1602400)•知识介绍• doi: 10.3866/PKU.DXHX202301022 氨基酸手性色谱分离杜瑾,石宜灵,唐安娜*,孔德明南开大学化学学院,分析科学研究中心,天津市生物传感与分子识别重点实验室,化学国家级实验教学示范中心,天津 300071摘要:光学活性和立体构象不同的氨基酸,具有不同的生理活性和作用,因此,实现氨基酸的有效手性分离具有重要意义。
色谱法是常用的氨基酸手性分离方法,具有分离效率高、速度快、灵敏、成本低和绿色环保等特点,在氨基酸手性分离和检测领域应用广泛。
本文综述了色谱法在氨基酸手性分离方面的最新进展,并对其发展趋势进行了展望。
关键词:氨基酸;手性分离;色谱法中图分类号:G64;O6Chiral Separation of Amino Acids by ChromatographyJin Du, Yiling Shi, Anna Tang *, Deming KongResearch Center for Analytical Sciences, Tianjin Key Laboratory of Biosensing and Molecular Recognition,National Demonstration Center for Experimental Chemistry Education, College of Chemistry, Nankai University,Tianjin 300071, China.Abstract: Amino acids with different optical activities and stereo-configurations have different physiological activities and effects. Therefore, it is important to achieve the chiral separation of amino acids effectively. Chromatography is a commonly used method for the chiral separation and detection of amino acids, and is characterized by high separation efficiency, high speed, sensitivity, low cost, and environmental friendliness. In this paper, we review the recent progress of chromatographic methods in the chiral separation and analysis of amino acids and provide an outlook on their development trends.Key Words: Amino acids; Chiral separation; Chromatographic methods手性(Chirality)起源于希腊语,表达了某种化合物和其镜像化合物不能重叠的关系,正如人的左手和右手不能完全重叠(图1)。
cardogan-sundberg indole synthesis 反应条件 -回复

cardogan-sundberg indole synthesis 反应条件-回复首先,我们需要理解在合成indole化合物时常用的Cardogan和Sundberg方法。
这种方法是以Cardogan试剂和Sundberg试剂为基础的,它们是将硝基苯乙酮或硝基苯甲酮转化为indole的关键反应试剂。
Cardogan方法的合成步骤如下:步骤1:溶媒选择选择一个合适的溶媒,以溶解硝基苯乙酮或硝基苯甲酮。
常用的溶剂包括二甲基亚砜(DMSO)、二甲亚砜(DMF)和乙二醇。
步骤2:加入碱向硝基苯乙酮或硝基苯甲酮溶液中加入碱,通常使用强碱如氢氧化钠(NaOH)或碳酸钠(Na2CO3)。
这个步骤使溶液中的硝基化合物脱去硝基。
步骤3:加入Cardogan试剂向溶液中加入Cardogan试剂,它是一种含硼的化合物,通常用三丁基硼(Bn-Bu3)来进行indole合成反应。
Cardogan试剂将硝基苯乙酮或硝基苯甲酮转化为氨基苯乙酮或氨基苯甲酮,生成intermediate产物。
步骤4:加入酸向溶液中加入强酸,如氢氯酸(HCl)或盐酸(HCl),以中和胺基产物的阴离子。
步骤5:水解将反应混合物加入水中,在酸的作用下,使intermediate产物水解为indole化合物。
上述Cardogan方法的综述可以总结为:硝基苯乙酮或硝基苯甲酮是通过脱硝反应,然后还原为氨基化合物,最后水解形成所需的indole化合物。
Sundberg方法又称为Curtius Rearrangement反应,步骤如下:步骤1:底物的准备首先合成出一个含有氨基和钠盐的硝酸酯(nitro acid ester)。
常用的底物包括硝基酯、硝基酮等。
步骤2:生成异氰酸酯将硝酸酯与碳酸二苯酯(diphenyl carbonate)在碱的作用下反应,生成异氰酸酯(isocyanate)中间体。
常用的碱包括三乙醇胺(TEA)或碳酸钠(Na2CO3)。
步骤3:Curtius Rearrangement反应将生成的异氰酸酯溶液加热并加入有机溶剂,通常使用甲苯(toluene)或二氯甲烷(dichloromethane)。
N-乙酰-L-酪氨酸537-55-3

1 化学品及企业标识1.1 产品标识符化学品俗名或商品名:N-乙酰-L-酪氨酸CAS No.:537-55-3别名:N-乙酰基-L-酪氨酸;乙酰酪氨酸;N-乙酰基-L-酪胺酸;乙酰-L-酪氨酸;N-乙酰基-L-酪氨酸N-乙酰基-L-酪胺酸;1.2 鉴别的其他方法无数据资料1.3 有关的确定了的物质或混合物的用途和建议不适合的用途仅供科研用途,不作为药物、家庭备用药或其它用途。
2 危险性概述2.1 GHS分类健康危害严重损伤/刺激眼睛:EyeDam.12.2 GHS 标记要素,包括预防性的陈述危害类型GHS05:腐蚀性物质;信号词 【危险】危险申明H318 造成了严重的视力损害。
警告申明P280 戴防护手套/防护服/护眼/防护面具。
P305+P351+P338 如进入眼睛:用水小心清洗几分钟。
如果可以做到,摘掉隐形眼镜,继续冲洗。
RSHazard symbol(s) XiR-phrase(s) R41S-phrase(s) S26;S392.3 其它危害物-无3 成分/组成信息3.1 物质分子式 - C11H13NO4分子量 - 223.234 急救措施4.1 必要的急救措施描述一般的建议请教医生。
向到现场的医生出示此安全技术说明书。
如果吸入用大量水彻底冲洗至少15分钟并请教医生。
在皮肤接触的情况下用肥皂和大量的水冲洗。
请教医生。
在眼睛接触的情况下无数据资料如果误服用水雾,抗乙醇泡沫,干粉或二氧化碳灭火。
4.2 最重要的症状和影响,急性的和滞后的主要症状和影响,急性和迟发效应4.3 及时的医疗处理和所需的特殊处理的说明和指示如必要的话,戴自给式呼吸器去救火。
5 消防措施5.1 灭火介质火灾特征无数据资料灭火方法及灭火剂碳氧化物,氮氧化物产品分解后性质不明碳氧化物,氮氧化物5.2 源于此物质或混合物的特别的危害使用个人防护用品。
避免粉尘生成。
避免吸入蒸气、烟雾或气体。
保证充分的通风。
人员疏散到安全区域。
碱基符号
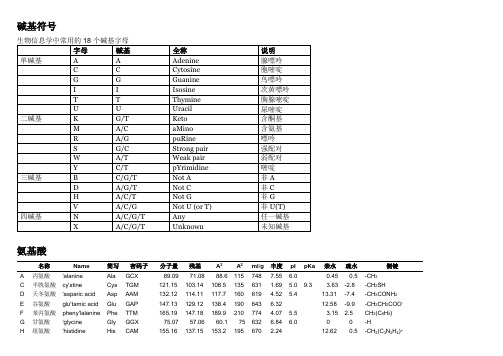
碱基符号名称Name简写密码子分子量残基A A ml/g丰度pI pKa亲水疏水侧链A 丙氨酸'alanine Ala GCX 89.09 71.08 88.6 115 748 7.55 6.0 0.45 0.5 -CH3C 半胱氨酸cy'stine Cys TGM 121.15 103.14 108.5 135 631 1.69 5.0 9.3 3.63 -2.8 -CH2SHD 天冬氨酸'asparic acid Asp AAM 132.12 114.11 117.7 160 619 4.52 5.4 13.31 -7.4 -CH2CONH2E 谷氨酸glu'tamic acid Glu GAP 147.13 129.12 138.4 190 643 6.32 12.58 -9.9 -CH2CH2COO-F 苯丙氨酸pheny'lalanine Phe TTM 165.19 147.18 189.9 210 774 4.07 5.5 3.15 2.5 CH2(C6H5)G 甘氨酸'glycine Gly GGX 75.07 57.06 60.1 75 632 6.84 6.0 0 0 -HH 组氨酸'histidine His CAM 155.16 137.15 153.2 195 670 2.24 12.62 0.5 -CH2(C3N2H4)+I 异亮氨酸iso'luecine Ile ATM,ATA 131.17 113.17 166.7 175 884 5.72 6.2 0.24 2.5 -CH(CH3)CH2CH3K 赖氨酸'lysine Lys AAP 146.19 128.18 168.6 200 789 5.93 11.91 -4.2 -(CH2)4NH3+L 亮氨酸'luecine Leu CTX,TTP 131.17 113.17 166.7 170 885 9.33 6.0 0.11 1.8 -CH2CH(CH3)2M 蛋氨酸me'thionine Met ATG 149.21 131.21 162.9 185 745 2.35 5.8 10.4 3.87 1.3 -(CH2)2SCH3N 天冬酰胺a'sparagine Asn GAM 133.10 115.09 111.1 150 579 5.30 4.5 12.07 -0.2 -CH2COO-P 脯氨酸'proline Pro CCX 115.13 97.12 122.7 145 758 4.92 6.3 -3.3 -(CH2)3-Q 谷氨酰胺'glutamine Gln CAP 146.15 128.14 143.9 180 674 4.02 5.7 4.6 11.77 -0.3 -CH2CH2CONH2R 精氨酸'arginine Arg CGX,AGP 174.20 156.20 173.4 225 666 5.15 ~12 22.31 -11.2 -(CH2)3CH(NH2)+NH2S 丝氨酸'serine Ser TCX,AGM 105.09 87.08 89.0 115 613 7.22 5.7 7.45 -0.3 -CH2OHT 苏氨酸'threonine Thr ACX 119.12 101.11 116.1 140 689 5.74 6.5 7.27 0.4 -CH(OH)CH3V 缬氨酸'valine Val GTX 117.15 99.14 140.0 155 847 6.52 6.0 0.40 1.5 CH(CH3)2W 色氨酸'tryptophan Trp TGG 204.23 186.21 227.8 255 734 1.25 8.28 3.4 -CH2(C8N1H6)Y 酪氨酸'tyrosine Tyr TAM 181.19 163.18 193.6 230 712 3.19 9.7 8.50 2.3 CH2(C6H4)OH注:密码子说明见碱基符号;A3和A2分别是埃为单位的体积和面积;ml/g为溶解1g所需水量;丰度为SwissProt蛋白质数据库中的氨基酸丰度。
fmoc-ala-oh结构式

fmoc-ala-oh结构式标题:FMOC-ALA-OH的合成及应用引言:FMOC-ALA-OH是一种常用的氨基酸保护基,广泛应用于肽合成和蛋白质工程领域。
本文将介绍FMOC-ALA-OH的合成方法以及其在科学研究和药物开发中的应用。
一、FMOC-ALA-OH的合成方法1.1 原料准备FMOC-ALA-OH的合成需要以下原料:氨基酸Ala、FMOC-Cl、N,N-二甲基甲酰胺(DMF)等。
1.2 合成步骤将Ala溶于DMF中,加入二甲基咪唑(DMAP)作为催化剂,与FMOC-Cl反应,生成FMOC-ALA。
将FMOC-ALA与带有羟基的试剂反应,去除保护基,得到FMOC-ALA-OH。
二、FMOC-ALA-OH在肽合成中的应用2.1 肽合成FMOC-ALA-OH可以作为氨基酸保护基,用于肽合成中的氨基酸激活和保护。
通过反复进行保护基的去除和氨基酸的激活,可以逐步合成目标肽链。
2.2 蛋白质工程FMOC-ALA-OH在蛋白质工程中也有重要应用。
通过将FMOC-ALA-OH引入目标蛋白质的特定位点,可以实现对蛋白质结构和功能的改造。
这对于研究蛋白质的结构-功能关系以及开发新型蛋白质药物具有重要意义。
三、FMOC-ALA-OH的优势和前景3.1 保护基稳定性FMOC-ALA-OH具有较高的稳定性,可以在多次反应中保护氨基酸的活性,从而保证合成过程的高效性和纯度。
3.2 应用广泛性由于FMOC-ALA-OH可以用于合成各种不同序列的肽链和改造蛋白质,因此具有广泛的应用前景。
结论:FMOC-ALA-OH是一种重要的氨基酸保护基,它在肽合成和蛋白质工程中发挥着重要作用。
通过合理的合成方法和灵活的应用,FMOC-ALA-OH为科学研究和药物开发提供了有力支持。
未来,随着对FMOC-ALA-OH的进一步研究和应用,相信它将在更多领域中展现出巨大的潜力。
蛋白质降解及-氨基酸代谢

第一节 蛋白质的酶促降解及N平衡
一、 蛋白质消化吸收
哺乳动物的胃、小肠中含有胃蛋白酶、胰 蛋白酶、胰凝乳蛋白酶、羧肽酶、氨肽酶、 弹性蛋白酶。经上述酶的作用,蛋白质水解
成游离氨基酸,在小肠被吸收。
被吸收的氨基酸(与糖、脂一样)一般不能 直接排出体外,需经历各种代谢途径。
肠粘膜细胞还可吸收二肽或三肽,吸收作用 在小肠的近端较强,因此肽的吸收先于游离
脱氨基作用主要在肝脏中进行。第一步 ,脱氢,生成亚胺。第二步,水解。
-氨基酸 磷酸吡哆醛
醛亚胺
互变异构
-酮酸
磷酸吡哆胺
酮亚胺
磷酸吡哆醛的作用机理
谷丙转氨酶和谷草转氨酶
谷丙转氨酶 (GPT)
谷草转氨酶 (GOT)
3、联合脱氨基作用
(1)概念 (2)类型
转氨基作用 和氧化脱氨基 作用联合进行 的脱氨基作用 方式。
在大脑中发生上述反应,大量消耗了-酮戊二 酸和NADPH, 引起中毒症状。
在肌肉中,可利用这一反应生成的谷氨酸的转氨基作用,生 成丙氨酸,将氨转运到肝脏中去。
谷氨酸+丙酮酸
转氨酶
-酮戊二 酸+ 丙氨酸
谷氨酰胺的生成和利用
ATP
ADP+Pi
+NH2
Mg2+
谷氨酰胺合成酶
+H2O
Gln中性无毒,易透过细胞膜,是氨的主要运输形式。
氨基酸代谢库
氮平衡
食物中的含氮物质,大部分是蛋白质,非蛋 白质的含氮物质含量较少。
氮平衡:机体摄入的氮量和排出的氮量, 在正常情况下处于平衡状态。摄入氮=排
出氮。 氮正平衡:摄入氮>排出氮。部分摄入的
氮用于合成体内蛋白质,儿童、孕妇。
fmoc-osu合成方法

fmoc-osu合成方法
Fmoc-Osu是一种常用的保护氨基酸侧链羟基的化合物,可用
于固相合成中氨基酸衍生物的合成。
下面是Fmoc-Osu的合成
方法:
材料:
1. Fmoc-氨基酸(已经保护好的氨基酸)
2. Oxalyl亚胺
3. N,N'-二乙基甲酰胺(DEA)
4. 二甲基亚砜(DMSO)
5. 氯甲烷
6. 乙酸乙酯
7. 水
步骤:
1. 将Fmoc-氨基酸溶解在二甲基亚砜中,加入适量的DEA
(用于中和反应中产生的副产物)。
2. 将Oxalyl亚胺加入溶液中,混合均匀。
3. 在室温下搅拌溶液数小时,直到反应完全进行。
4. 将反应溶液浓缩,得到Fmoc-Osu固体。
5. 用氯甲烷洗涤Fmoc-Osu固体,将洗涤液收集。
6. 用乙酸乙酯洗涤固体,将洗涤液收集。
7. 将洗涤液通过旋转蒸发装置去除溶剂,得到粗品Fmoc-Osu。
8. 用氯甲烷将粗品溶解,并通过滤液去除固体杂质。
9. 用氯甲烷沉淀Fmoc-Osu,并将沉淀物收集。
10. 将沉淀物在真空中干燥,得到纯品Fmoc-Osu。
注意事项:
1. 在合成中使用化学品时请注意安全操作,佩戴好防护手套和眼镜。
2. 溶液搅拌可以使用磁力搅拌器。
3. 洗涤时要尽量使反应产物与固体杂质分离。
4. 合成反应的时间和温度可以根据具体情况进行调整。
5. 某些步骤端产物需要在真空下干燥,确保溶剂的充分去除。
氨基的保护与脱保护

O
S
Cbz-Cl
O
NH2.HCl
K2CO 3
98%
O S
O NHCbz
Org. Syn., 70, 29
化学合成部培训材料, 药明康德版权所有,
6
6
1.1.2 苄氧羰基的脱去
苄氧羰基的脱去主要有以下几种方法
1). 催化氢解 2). 酸解裂解(HBr, TMSI) 3). Na/NH3(液)还原 实验室常用简洁的方法是催化氢解(用H2或其它供氢体,一般常温 常压氢化即可); 当分子中存在对催化氢解敏感(有苄醚,氯溴碘 等)或钝化催化剂的基团(硫醚等)时,我们就需要采用化学方法 如酸解裂解HBr或Na/NH3(液)还原等。
2
2
氨基保护基的选择策略
选择一个氨基保护基时,必须仔细考虑到所有的反应物,反 应条件及所设计的反应过程中会涉及的底物中的官能团。
最好的是不保护. 若需要保护,选择最容易上和脱的保护基, 当几个保护基需要同时被除去时,用相同的保护基来保护不 同的官能团是非常有效。要选择性去除保护基时,就只能采 用不同种类的保护基。
NaOH, t-BuOH, H2O 78%
NHBoc COOH
NH2.HCl HO
COOMe
Boc2O
Et3N 95%
NHBoc HO
COOMe
H N
HN
O
NH O
Boc2O
DMAP, Et3N 83%
Bo c N
Boc N O
O
N Boc
化学合成部培训材料, 药明康德版权所有,
13
13
1.2.3 叔丁氧羰基的脱去
在中性的无水条件下Me3SiI在CHCl3或CH3CN中除了能脱除Boc 外,也能断裂氨基甲酸酯、酯、醚和缩酮。通过控制条件可 以得到一定的选择性。
精氨酸类表面活性剂的合成与性能

O
NH
. R2O-C-CH-(CH2)3-NH-C-NH2 HCl
NH-COR 1
H2N-(CH2)n-NH2
O
NH
. H2N-(CH2)n-NH-C-CH-(CH2)3-NH-C-NH2 HCl
NH-COR 1
O
NH
. R2O-C-CH-(CH2)3-NH-C-NH2 HCl
NH-COR 1
Papain
先对精氨酸的胍基部分进行保护,酰胺化时用三(二甲基氨基)1-苯并三唑氧基六氟磷酸季鏻盐(BOP)
作催化剂,最后在 4136.88MPa 压力下进行加氢反应。
O
N NO2
HO-C-CH-(CH2)3-NH-C-NH2 R1COOH
NH 2
O
N NO2
HO-C-CH-(CH2)3-NH-C-NH2
NH-COR 1
BOP H2N-(CH2)3-NH2
O
N NO2
H2, Pd/C
(CH2)n/2-NH-C-CH-(CH2)3-NH-C-NH2
MeOH/HCl
NH-COR 1
2
. O
NH
(CH2)n/2-NH-C-CH-(CH2)3-NH-C-NH2 HCl
NH-COR 1
R1: C7H15, C9H19, C11H23, n: 3, 6, 9. 图式 2 Gemini 类精氨酸表面活性剂的化学合成
剂即得目的产物。在此反应体系中十二碳酸、精氨酸甲酯盐酸盐、DDC 以及水的重量百分比各为
2.1%、2.35%、2.52% 和 85%。以此种体系为反应介质所得产品收率(63%)与在 N, N-二甲基甲酰胺
(DMF)中相近(66%),其优点是避免使用有毒有机溶剂 DMF,且产物易纯化。
适应性进化和改造质粒稳定性促进枯草芽孢杆菌合成N-乙酰神经氨酸

2021年第47卷第5期(总第425期)1DOI:10.13995/ki.11-1802/ts.025580引用格式:钱蕾,刘延峰,李江华,等.适应性进化和改造质粒稳定性促进枯草芽孢杆菌合成N -乙酰神经氨酸[J].食品与发酵工业,2021,47(5):1-6.QIAN Lei,LIU Yanfeng,LI Jianghua,et al.Regulating the synthesis of N -acetylneuraminic acid based on adaptive evolution and plasmid stability modification in Bacillus subtilis [J].Food and Fermentation Industries,2021,47(5):1-6.适应性进化和改造质粒稳定性促进枯草芽孢杆菌合成N -乙酰神经氨酸钱蕾1,2,刘延峰1,2,李江华2∗,刘龙1,2,堵国成1,21(工业生物技术教育部重点实验室(江南大学),江苏无锡,214122)2(江南大学生物工程学院,江苏无锡,214122)摘㊀要㊀N -乙酰神经氨酸(N -acetylneuraminic acid ,NeuAc )作为营养化学品和药物中间体在保健品和医药领域具有广泛的应用㊂为了提升重组枯草芽孢杆菌(Bacillus subtilis)合成NeuAc 的产量,首先利用NeuAc 生物传感器(NeuAc-Biosensor )调控抗生素抗性基因表达,在抗生素存在条件下将细胞生长与NeuAc 合成相关联㊂进而通过增加抗生素浓度进行适应性进化,促进NeuAc 合成效率提升㊂研究结果显示,当利用NeuAc-Biosensor 分别调控壮观霉素抗性基因(spc)和红霉素抗性基因(erm)时,高产菌株能够在较高抗生素浓度条件下生长㊂通过在培养过程中逐步增加抗生素浓度开展适应性进化,结果表明采用壮观霉素和红霉素进行双抗性适应性进化时,进化获得的菌株中假阳性率(产量未提高的菌株比例)为46.7%,显著低于采用壮观霉素或红霉素单一抗生素进化获得的菌株中假阳性率(73.3%和66.7%)㊂通过适应性进化与发酵验证得到1株NeuAc 产量为(3.16ʃ0.19)g /L 的菌株,产量比出发菌株提高了31.7%㊂为进一步解决发酵过程中重组B.subtilis 质粒丢失的问题,通过将必需基因folB(编码二氢喋呤醛缩酶,dihydroneopterin aldolase )插入携带NeuAc 合成途径关键酶编码基因重组质粒并且敲除基因组中的folB 基因,质粒的丢失率由34.1%下降至11.8%㊂该研究提升了重组B.subtilis 合成NeuAc 的产量和稳定性,为重组B.subtilis 发酵法生产NeuAc 奠定了基础㊂关键词㊀生物传感器;适应性进化;质粒稳定性;N -乙酰神经氨酸;枯草芽孢杆菌第一作者:硕士研究生(李江华教授为通讯作者,E-mail:lijianghua@)基金项目:国家重点研发计划项目(2018YFA0900300);国家自然科学基金项目(31972854);江苏省重点研发计划(社会发展)项目(BE2019628)收稿日期:2020-09-04,改回日期:2020-09-21唾液酸(sialic acids,SA)是9碳氨基糖家族,目前发现大于40种形式源自神经氨酸[1]㊂在结构上,其2㊁4㊁5㊁7㊁8和9位上的各种类型的组合有助于SA的多样性[2]㊂最常见的SA 分子是N -乙酰神经氨酸(N -acetylneuraminic acid,NeuAc),一种羧化的9碳单糖,5位上带有N -乙酰基[3]㊂NeuAc 在细菌和动物中无处不在,是人类SA 的主要形式㊂此外,NeuAc 在调节生物识别㊁细菌免疫和疾病方面具有重要作用[4],并且是唾液酸化人乳寡糖重要单体之一,对改善婴儿发育至关重要[5]㊂因此,NeuAc 是一种具有较大市场需求的新型生物发酵产品㊂提高NeuAc 的发酵产量以及降低其生产成本一直是推动NeuAc 在生物发酵领域被应用的重要前提㊂在过去的研究中,对NeuAc 代谢途径中的关键酶做理性改造以提高转化效率[6],但全细胞催化所需的底物昂贵增加了生产成本[7]㊂而且在微生物代谢改造中,通常利用较强的转录翻译元件以加强产物途径[8],弱化[9]甚至敲除竞争途径[10],代谢流量大量用于产物合成从而导致细胞生长受损[11]㊂生物传感器与适应性进化的组合策略能够缓解这种平衡失调[12],在应用选择压力时富集高产菌株[13]㊂进一步地,适应性进化对于稳定微生物表型以及分析进化过程中特定基因的变化情况是一种有效的办法[14]㊂同时,基于质粒的基因表达系统是微生物代谢途径改造的常用工具,然而质粒的不稳定往往降低了菌株产物合成效率[15]㊂为了提升重组枯草芽孢杆菌(Bacillus subtilis )合成NeuAc 的产量以及解决发酵过程中重组枯草芽孢杆菌质粒丢失的问题,本文在前期研究的基础上,利用已成功构建的NeuAc-Biosensor 调控spc 和erm 抗性基因表达,实现细胞生长与产物产量偶联,进而通过适应性进化提升NeuAc 合成效率㊂同时通过将必需基因folB 插入携带NeuAc 合成途径关键酶编码基因重组质粒并且敲除基因组中的folB 基因,有效降2㊀2021Vol.47No.5(Total 425)低了发酵过程中的质粒丢失率㊂1㊀材料与方法1.1㊀材料1.1.1㊀菌株与质粒本实验所使用的菌株及质粒如表1所示㊂目的基因扩增引物及敲除引物如表2所示㊂表1㊀本研究中使用的质粒和菌株Table 1㊀Plasmids and strains used in this study质粒/菌株描述来源p136NeuAc-Biosensor 质粒实验室保存[16]BS1,BS2,BS3NeuAc 产量不同的B.subtilis 菌株实验室保存p136-spc 单抗性筛选质粒,表达spc 基因本研究构建p136-erm 单抗性筛选质粒,表达erm 基因本研究构建p136-spc-erm 双抗性筛选质粒,表达spc 基因和erm 基因本研究构建BS3C适应性进化筛选得到菌株,作为质粒稳定性改造出发菌株本研究构建p43NMK-AN 表达NeuAc 合成相关的age 基因和neuB 基因实验室保存p43NMK-folB 表达必需基因folB 本研究构建表2㊀本研究中使用的引物Table 1㊀Primers used in this study引物名称引物序列(5 -3 )spc -F1CGTTTAAAATAGTGAGGAGGATATAATGTTTGGATCAGGAGTTGAGAGTGGACTAAAAC spc -R1CATTTCACCTCCTTTTAACGCCAGGGTTTTCCCAGTCACGerm -F1CGTTTAATTAAGAAGGAGTGATTACATGAACAAAAATATAAAATATTCTCAAAACTTT TTAACGAGTGAAAAAGTerm -R1GTGTACATTTCACCTCCTTTTTATTTCCTCCCGTTAAATAATAGATAACTATTAAAAATA GACAATACTTspc -F2CGTTTAAAATAGTGAGGAGGATATAATGTTTGGATCAGGAGTTGAGAGTGGACTAAAAC spc -R2CACTCCTTCTTAATTTAACGCCAGGGTTTTCCCAGTerm -F2GGCGTTAAATTAAGAAGGAGTGATTACATGAACAAAAATATAAAATATTCTCAAAACTTTTTAACGAGT erm -R2GTGTACATTTCACCTCCTTTTTATTTCCTCCCGTTAAATAATAGATAACTATTAAAAATAGACAATACTT p136-spc -F GGCGTTAAAAGGAGGTGAAATGTACACATGGGTAAGGGAGAAGAACTTTTCACTGGAGT p136-spc -R CCTCCTCACTATTTTAAACGATATACCTTTATACCTGTTATACCATTGTACAACACGAG p136-erm -F AAAGGAGGTGAAATGTACACATGGGTAAp136-erm -R CACTCCTTCTTAATTAAACGATATACCTTTATACCTGTTATACCATTGTACAAC p136-spc -erm -F AAAGGAGGTGAAATGTACACATGGGTAAGGGAGAAGAACTTTTCACTGp136-spc-erm -R CCTCCTCACTATTTTAAACGATATACCTTTATACCTGTTATACCATTGTACAACACGAG p43-F TCATGATGATGAAAGCTTGGCGTAATCATGGTCATAG p43-R CCTTGATCCTTCACTTGGGGTTGACGACCGAGTAGTfolB -F GAGGGGTGCACCATGGATAAAGTTTATGTAGAAGGTATGGAGTTTTACGGATATCACG folB -R CCAAGCTTTCATCATCATGACTTTTTTCTCGTAATTTCAATTGCTACTGATTT folB -L-F TCATGATGATGAAAGCTTGGCGTAATCATGGTCATAGfolB -L-R GTTTCCTGTGTGAAATTGTTATCCGCTCTTGCTTAAATCCAGCTCAGCGGT folB -R-F GACTGGGAAAACCCTGGCGTTAACCTTGAGCAAACGATCAACTATGCT folB -R-R CTCCCGCATCGCATTTTGTAATCT RH-folB -F ACTATGGAAGCCAAAGCGGAGAAG RH-folB -R GCTCAGTGGTTTCTCACGTTCATCAzeo -F GAGCGGATAACAATTTCACACAGGAAACAGCT zeo -RTAACGCCAGGGTTTTCCCAGTCACGAC1.1.2㊀酶与试剂质粒提取试剂盒㊁DNA 片段纯化试剂盒㊁感受态制备试剂盒,生工生物工程(上海)有限股份公司;PrimeStar max 聚合酶㊁限制性内切酶,TaKaRa㊂ 1.1.3㊀培养基LB 培养基(g /L):胰蛋白胨10,酵母粉5,NaCl5,pH 7.0;发酵培养基(g /L):酵母粉12,胰蛋白胨6,(NH 4)2SO 46,K 2HPO 4㊃3H 2O 12,KH 2PO 42.5,MgSO 4㊃7H 2O 3,葡萄糖60,尿素6;枯草芽孢杆菌感受态培养基(均为质量分数):SPI-A:0.4%(NH 4)2SO 4,2.8%K 2HPO 4㊃3H 2O,1.2%KH 2PO 4,0.2%C 6H 5Na 3O 7㊃2H 2O,SPI-B:0.04%MgSO 4㊃7H 2O㊂100ˑCAYE:2%酪蛋白水解物,10%酵母粉,100ˑEGTAʒ10mmol /L EGTA;SPI:980μL SPI-A,980μL SPI-B,20μL 100ˑCAYE,20μL 50%的葡萄糖溶液;SPII:2mL SPI,20μL 50mmol /L CaCl 2,20μL 250mmol /L MgCl 2㊂1.2㊀实验方法1.2.1㊀重组抗性质粒构建方法以质粒p136为模板,分别以引物136-spc -F /R 和136-erm -F /R 进行扩增得到大小为8744bp 的线性化质粒载体;以质粒p7s6为模板,引物spc -F1/R1和spc -F2/R2进行扩增得到大小为783bp 的spc 基因;以质粒p7e6为模板,引物erm -F1/R1和erm -F2/R2进行扩增得到大小为738bp 的erm 基因㊂将扩增得到的线性DNA 片段回收纯化后进行Gibson 组装[17],并转化至E.coli JM109进行质粒扩增,得到正确重组质粒p136-spc ㊁p136-erm 和p136-spc-erm ㊂1.2.2㊀质粒构建与基因敲除方法以p43NMK-AN 为模板,引物p43-F /R 进行扩增得到大小为9094bp 的线性化质粒载体,以B.subtilis168基因组为模板,引物folB -F /R 进行扩增得到大小为363bp 的folB 基因㊂将扩增得到的线性DNA 片段回收纯化后进行Gibson 组装,并转化至E.coli JM109进行质粒扩增㊂菌落PCR 和测序验证后,得到正确重组质粒p43-folB ,进一步将质粒转化菌株BS3C㊂然后对基因组上folB 进行敲除[18],以p7Z6质粒为模板,引物zeo -F /R 为引物扩增得到大小为656bp 的zeo 基因,以B.subtilis 168基因组为模板,分别使用引物folB -L-F /R 和f olB -R-F /R 扩增得到大小为944和1022bp 左右同源臂,将扩增得到的线性DNA 片段回收纯化后以引物RH-folB-F /R 进行PCR 融合,将得到融合产物转化上述菌株BS3C,选择zeo转化子后将pTSC 引入,组成型表达的Cre 重组酶介导lox 71和lox 66之间的重组,涂布于无抗性平板并在51ħ下培养,消除了pTSC,从而获得了目标菌株BS3B㊂2021年第47卷第5期(总第425期)3㊀1.2.3㊀培养方法24孔深孔板发酵:挑取单菌落接种至发酵培养基中,每孔培养基为1.5mL,37ħ㊁220r /min 培养50h 左右㊂上述培养基中加入相应筛选浓度的壮观霉素和红霉素㊂1.2.4㊀感受态细胞制备大肠杆菌感受态制备和转化:参照上海生工大肠杆菌超级感受态细胞制备试剂盒说明书㊂枯草感受态制备和转化:挑取宿主菌接种于1支2mL SPI 培养基中,于14mL 摇菌管中,37ħ摇床培养过夜;取40μL 过夜培养的菌液,接种至用2mL SPI 培养基中,37ħ摇床培养5~6h 后,取200μL 接种到2mL SPII 培养基中,37ħ220r /min 培养1.5~2h;加入20μL 100ˑEGTA 溶液,37ħ220r /min 摇床培养10min,用1.5mL 离心管分装成500μL 每管;加入适量的质粒0.5~1μg,轻轻混匀,37ħ220r /min 培养1.5~2h;以4000r /min 离心2min 收集菌体,弃部分上清液,留100μL 重悬菌体,涂布于相应的抗性平板,37ħ过夜培养㊂1.2.5㊀分析方法假阳性率测定:将传代结束之后的发酵液系列稀释后涂布于抗性平板上,挑取平板上全部单菌落进行发酵验证NeuAc 产量,产量较出发菌株并未提高的计为假阳性细胞,计算得到假阳性率㊂NeuAc 浓度测定:通过HPLC 测定分析产物浓度,色谱柱为Aminex HPX-87H 柱(300nm ˑ7.8nm);流动相为10mmol /L H 2SO 4溶液,流速为0.5mL /min,NeuAc 的保留时间为9.5min㊂将发酵液8000ˑg 离心10min 后取上清液,用30mmol /LH 2SO 4溶液处理混匀后过滤以测定浓度[19]㊂质粒丢失率测定:将单菌落接种至100mL 液体LB 培养基中,12h 后以10%接种量接种至LB 培养基中,连续培养3代,每12h 转接1次㊂选择3个培养时间,随机挑取100个单菌落点板转接至LB 和卡纳抗性平板,比较2种平板上菌落数,计算质粒丢失率㊂上述实验均设置了3组平行㊂2㊀结果与分析2.1㊀NeuAc-Biosensor 调控spc 和erm 基因表达效果验证利用前期成功构建的NeuAc-Biosensor 质粒p136来构建的重组质粒,调控抗性基因spc 和erm 表达㊂这里使用的NeuAc-Biosensor 是基于自FadR /GntR 家族的转录调控因子NanR 所构建[8]㊂NeuAc-Biosen-sor 由2个反向连接的启动子组成,分别调控NanR 基因和GFP 基因,为了将荧光蛋白的表达与细胞内NeuAc 联系起来,在调控表达GFP 基因的不同启动子中插入NanR 结合位点,从而形成动态开关,即当细胞内NeuAc 浓度低时,NanR 与启动子中的结合位点结合,阻止RNA 聚合酶与启动子结合并抑制下游GFP 基因转录;当细胞内NeuAc 浓度高时,NanR 的活性被NeuAc 的变构调节所消除,使得启动子与NanR 结合得到释放,启动子与RNA 聚合酶结合并正常开启下游基因的转录[16]㊂考虑到产NeuAc 宿主菌株中质粒带有卡纳霉素抗性基因,因此选取枯草芽孢杆菌中另外2种常用抗性基因作为调控靶基因,即壮观霉素抗性基因spc 和红霉素抗性基因erm ,利用NeuAc-Biosensor 调控spc 和erm 表达,将胞内NeuAc 浓度与壮观霉素或红霉素抗性相关联㊂将PCR 扩增后的spc 基因和erm 以及载体质粒通过Gibson 组装构建重组质粒,如图2所示㊂然后将质粒p136-spc ,p136-erm 转化入NeuAc 产量不同的枯草芽孢杆菌中,分别为BS1(0.8g /L)㊁BS2(1.5g /L)㊁BS3(2.4g /L),将成功转化的上述菌株挑取单菌落后进行24孔深孔板发酵,发酵培养时培养基内添加相应抗生素,以半抑制浓度来表征调控效果,结果如表3所示㊂a-p136-spc 重组质粒;b-p136-erm 重组质粒;c-p136-spc-erm 重组质粒图1㊀重组抗性质粒图Fig.1㊀Map of recombinant resistance plasmid4㊀2021Vol.47No.5(Total 425)表3㊀不同NeuAc 产量重组枯草芽孢杆菌生长的抗生素半抑制浓度单位:mg /LTable 3㊀IC 50of different NeuAc-producing recombinantB.subtilis菌种IC 50值NeuAc 产量壮观霉红霉素BS1800800.4BS215001100.6BS324001400.8从表3可知,高产菌株能够在较高抗生素浓度条件下生长,说明biosensor 对于抗性基因有较好的调控效果㊂2.2㊀基于适应性化的BS3菌株发酵产NeuAc适应性进化对于提高微生物在相关培养基上的生长和抗应变能力很重要㊂通常,实验室中常用的定向进化方法为分批培养-连续传代,这种方法成本比较低并且可以通过深孔板等更小培养体积的设备进行大规模培养,物理化学因素也比较可控㊂因此在这里我们选择分批培养-连续传代培养方法㊂在之前的研究中,通过对2个关键前体N -乙酰氨基葡萄糖(GlcNAc)和磷酸烯醇式丙酮酸的供应途径进行模块途径工程以及平衡NeuAc 的生物合成和细胞生长,NeuAc 产量达到2.18g /L[10]㊂为了进一步提高NeuAc 产量且平衡细胞生长,我们将生物传感器与适应性进化结合,在进化过程中不断提高抗生素浓度,使得高产细胞形成生长优势,从而富集得到高产菌株㊂由2.1小节可知,NeuAc-biosensor 对抗性基因的调控效果在菌株BS3中效果较显著,因此以带有单抗性和双抗性的BS3菌株为出发菌株,抗生素的筛选浓度梯度如表4所示,对其进行适应性进化,孔板发酵每隔24h 以10%的接种量进行取样及传代,5次传代之后结束发酵㊂前期研究发现,在进化过程中,小部分细胞在没有指定代谢物产生的情况下也能存活[19],这种 逃逸 是由于永久选择敏感性的突变引起的[20-21],因此我们使用了双抗性标记筛选来减少这种假阳性者的存活㊂经过5轮进化筛选之后,我们对3种抗性筛选平板均选取了15个单菌落进行了发酵验证,通过HPLC 方法测定NeuAc 浓度后发现壮观霉素和红霉素筛选分别有4个和5个菌落较出发菌株产量有提高,而双抗性筛选则有8个菌落较出发菌株产量有所提高,不同菌株的产量如图2所示㊂按照上述假阳性率测定方法得到单抗性筛选的假阳性率为73.3%(壮观霉素)㊁66.7%(红霉素),而双抗性筛选的假阳性率则为46.7%㊂通过单抗性标记与双抗性标记筛选的对比实验发现,双重选择能够有效减少假阳性菌株,再次体现了双抗性筛选策略的优势,同时得到1株产量为(3.16ʃ0.19)g /L 的菌株BS3C,较出发菌株产量提高了31.7%㊂表4㊀适应性进化抗生素筛选浓度表Table 4㊀Concentration of antibiotic for adaptiveevolution screening传代数A 单抗性筛选B 双抗性筛选壮观霉素添加质量浓度/(mg㊃L -1)红霉素添加质量浓度/(mg㊃L -1)所用抗生素添加质量浓度/(mg㊃L -1)11400.8壮观霉素1402160 1.0红霉素0.83180 1.2壮观霉素1604200 1.4红霉素 1.05220 1.6壮观霉素180假阳性率/%73.366.746.7a-壮观霉素筛选产量验证;b-红霉素筛选产量验证;c-壮观霉素和红霉素筛选产量验证图2㊀适应性进化后NeuAc 产量验证Fig.2㊀NeuAc production verification after adaptive evolution2.3㊀基于对必需基因folB 的改造提高质粒稳定性抗生素抗性是重组质粒常用的筛选标记,添加抗生素可以提供选择压力,抑制质粒丢失的细胞生长㊂然而,抗生素在培养过程的降解会造成选择压力失效㊂另外,抗生素的添加还增加了成本,可能在工业环境中污染最终产品㊂虽然染色体整合表达具有更高的稳定性,但在许多情况下,基因整合效率低和表达强度不足阻碍了染色体整合表达的应用[22]㊂为了在不使用抗生素的情况下实现对质粒的选择和维持,我们敲除了枯草芽孢杆菌基因组中的必需基因folB (编码二氢喋呤醛缩酶),同时在表达NeuAc合成途径关键基因的质粒中插入必需基因folB,获得BS3C 菌株,使细胞中必需基因folB的表达依赖于质粒的存在和质粒中folB表达(图3)㊂通过上述改造,质粒的丢失率由34.1%下降至11.8%,BS3C菌株NeuAc 产量为(3.34ʃ0.22)g/L,维持在稳定水平㊂上述结果说明,利用必需基因改造的方法可以有效的保证产NeuAc枯草芽孢杆菌中质粒的稳定性㊂a-质粒稳定性改造策略;b-质粒稳定性改造后产量与质粒丢失率图3㊀质粒稳定性改造Fig.3㊀Modification of plasmid stability3㊀结论NeuAc在食品和生物医药等领域具有广泛的应用,代谢改造是提高重组枯草芽孢杆菌中NeuAc产量和降低生产成本的重要手段㊂本研究利用NeuAc-Biosensor调控抗生素抗性基因表达,进而通过增加抗生素浓度进行适应性进化,NeuAc合成效率提升了33.8%㊂进一步通过将必需基因folB插入携带NeuAc合成途径关键基因重组质粒,并且敲除基因组中的folB基因,有效降低了发酵过程中的质粒丢失率㊂本研究提升了重组枯草芽孢杆菌合成NeuAc的产量和稳定性,为重组枯草芽孢杆菌发酵法生产NeuAc奠定了基础㊂参考文献[1]㊀CHENG J,ZHUANG W,TANG C,et al.Efficient immobilization ofAGE and NAL enzymes onto functional amino resin as recyclable and high-performance biocatalyst[J].Bioprocess and Biosystems En-gineering,2017,40(3):331-340.[2]㊀ZHU D,ZHAN X,WU J,et al.Efficient whole-cell biocatalyst forNeu5Ac production by manipulating synthetic,degradation and trans-membrane pathways[J].Biotechnology Letters,2017,39(1): 55-63.[3]㊀LUNDGREN B R,BODDY C N.Sialic acid and N-acylsialic acidanalog production by fermentation of metabolically and genetically engineered Escherichia coli[J].Organic and Biomolecular Chemis-try,2007,5(12):1903-1909.[4]㊀DROUILLARD S,MINE T,KAJIWARA H,et al.Efficient synthesisof6ᶄ-sialyllactose,6,6ᶄ-disialyllactose,and6ᶄ-KDO-lactose by meta-bolically engineered E.coli expressing a multifunctional sialyltrans-ferase from the Photobacterium sp.JT-ISH-224[J].Carbohydr Res, 2010,345(10):1394-1399.[5]㊀TEN BRUGGENCATE S J,BOVEE-OUDENHOVEN I M,FEITSMAA L,et al.Functional role and mechanisms of sialyllactose and othersialylated milk oligosaccharides[J].Nutrition Reviews,2014,72(6):377-389.[6]㊀LIU Y,ZHU Y,MA W,et al.Spatial modulation of key pathway en-zymes by DNA-guided scaffold system and respiration chain engi-neering for improved N-acetylglucosamine production by Bacillus subtilis[J].Metabolic Engineering,2014,24:61-69. [7]㊀KANG J,GU P,WANG Y,et al.Engineering of an N-acetylneura-minic acid synthetic pathway in Escherichia coli[J].Metabolic Engi-neering,2012,14(6):623-629.[8]㊀UHDE A,BRUHL N,GOLDBECK O,et al.Transcription of sialicacid catabolism genes in Corynebacterium glutamicum is subject to catabolite repression and control by the transcriptional repressor NanR[J].Journal of Bacteriology,2016,198(16):2204-2218.[9]㊀SIEDLER S,STAHLHUT S G,MALLA S,et al.Novel biosensorsbased on flavonoid-responsive transcriptional regulators introduced into Escherichia coli[J].Metabolic Engineering,2014,21:2-8.[10]㊀ZHANG X,LIU Y,LIU L,et al.Modular pathway engineering ofkey carbon-precursor supply-pathways for improved N-acetylneura-minic acid production in Bacillus subtilis[J].Biotechnology and Bi-oengineering,2018,115(9):2217-2231.[11]㊀KALIVODA K A,STEENBERGEN S M,VIMR E R,et al.Regula-tion of sialic acid catabolism by the DNA binding protein nanr inEscherichia coli[J].Journal of Bacteriology,2003,185(16):4806-4815.[12]㊀WANG Z,ZHUANG W,CHENG J,et al.In vivo multienzyme com-plex coconstruction of N-acetylneuraminic acid lyase and N-acetyl-glucosamine-2-epimerase for biosynthesis of N-acetylneuraminicacid[J].Journal of Agricultural and Food Chemistry,2017,65(34):7467-7475.[13]㊀SHI S,CHOI Y W,ZHAO H,et al.Discovery and engineering of a1-butanol biosensor in Saccharomyces cerevisiae[J].BioresourceTechnology,2017,245(Pt B):1343-1351.[14]㊀SANDBERG T E,SALAZAR M J,WENG L L,et al.The emer-gence of adaptive laboratory evolution as an efficient tool for biolog-ical discovery and industrial biotechnology[J].Metabolic Engineer-ing,2019,56:1-16.[15]㊀ZHANG R,YANG Y,WANG J,et al.Synthetic symbiosis combi-ning plasmid displacement enables rapid construction of phenotype-2021年第47卷第5期(总第425期)5㊀6㊀2021Vol.47No.5(Total 425)stable strains[J].Metabolic Engineering,2019,55:85-91.[16]㊀ZHANG X,CAO Y,LIU Y,et al.Development and optimization of N -acetylneuraminic acid biosensors in Bacillus subtilis [J].Biotech-nology and Applied Biochemistry,2020,67(4):693-705.[17]㊀GIBSON D G,BENDERS G A,ANDREWS-PFANNKOCH C,et al.Complete chemical synthesis,assembly,and cloning of a mycoplasma genitalium genome[J].Science,2008,319(5867):1215-1220.[18]㊀YAN X,YU H J,HONG Q,et al.Cre /lox system and PCR-based genome engineering in Bacillus subtilis [J].Applied and Environ-mental Microbiology,2008,74(17):5556-5562.[19]㊀ZHAO L,TIAN R,SHEN Q,et al.Pathway engineering of Bacillussubtilis for enhanced N -Acetylneuraminic acid production via whole-cell biocatalysis [J].Biotechnology Journal,2019,14(7).DOI:10.1002/biot.201800682.[20]㊀RAMAN S,ROGERS J K,TAYLOR N D,et al.Evolution-guidedoptimization of biosynthetic pathways[J].Proceedings of the Na-tional Academy of Sciences of the United States of America,2014,111(50):17803-17808.[21]㊀NYERGES A,CSORGO B,NAGY I,et al.Conditional DNA repair mutants enable highly precise genome engineering [J ].Nucleic Acids Res,2014,42(8):e62.[22]㊀SHUKAL S,CHEN X,ZHANG C.Systematic engineering for high-yield production of viridiflorol and amorphadiene in auxotrophic Escherichia coli [J].Metabolic Engineering,2019,55:170-178.Regulating the synthesis of N -acetylneuraminic acid based on adaptiveevolution and plasmid stability modification in Bacillus subtilis QIAN Lei 1,2,LIU Yanfeng 1,2,LI Jianghua 1,2∗,LIU Long 1,2,DU Guocheng 1,21(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)2(College of Bioengineering,Jiangnan University,Wuxi 214122,China)ABSTRACT ㊀N -acetylneuraminic acid (NeuAc)has applications as nutritional chemicals and pharmaceutical intermediates in the fields of health care products and medicine.To increase NeuAc production in Bacillus subtilis ,NeuAc-biosensor was used to regulate the expres-sion of antibiotic resistance genes,and cell growth was correlated with NeuAc synthesis in the presence of antibiotic,which was further used for adaptive evolution to promote the efficiency of NeuAc synthesis.The results showed that high-yielding strains could grow under conditions of higher antibiotic concentration.The adaptive evolution was carried out by gradually increasing the concentration of antibiot-ics.When NeuAc-Biosensor was used to regulate spc and erm for dual resistance (spectinomycin and erythromycin)adaptive evolution,the false positive rate (the proportion of strains with no increase in NeuAc production)was 46.7%,which was significantly lower than that (73.3%and 67.7%)of the strains obtained by the evolution of using single antibiotic of spectinomycin or erythromycin,respective-ly.Fermentation experiments verified that the production of NeuAc in evolutionary strain reached (3.16ʃ0.19)g /L,which was 31.7%higher than the original strain.In order to further solve the problem of plasmid loss in recombinant B.subtilis during fermentation,the es-sential gene folB (encoding dihydroneopterin aldolase)was inserted into the recombinant plasmid carrying the gene encoding the key en-zyme of NeuAc synthesis pathway with deletion of folB in the genome.The plasmid loss rate dropped from 34.1%to 11.8%.In this stud-y,the yield and stability of NeuAc production was improved by recombinant B.subtilis ,which lays a foundation for the industrial produc-tion of NeuAc by recombinant B.subtilis .Key words ㊀biosensor;adaptive evolution;plasmid stability;N -acetylneuraminic acid;Bacillus subtilis。
fmoc-osu合成方法

fmoc-osu合成方法
Fmoc-osu的合成方法主要有两种常见的方法:
1. Fmoc-OSu的酯化法合成:首先,将取得的N-羟基丁酰亚胺(N-hydroxybutyrimide),加入到二甲基甲酰胺(DMF)中溶解。
然后,在低温下,将N,N'-二甲基甲酰胺-1-甲基吡咯烷烷
(N,N'-dimethylformamide-1-methylpyrrolidin)加入到溶液中,继
续搅拌。
然后,向溶液中缓慢地加入Fmoc-Cl,并保持反应温度在0-5℃下进行。
反应结束后,使用水稀释混合物,并将有机相抽提。
使用饱和盐酸溶液洗涤有机相。
然后,使用NaHCO3稀释有
机相,将酯化产物转化为酸。
最后,通过浓缩和冷却,得到纯的Fmoc-OSu。
2. Fmoc-OSu的酰化法合成:首先,将Fmoc-Cl加入到二甲基
甲酰胺(DMF)中溶解,并在低温下进行搅拌。
然后,向溶液中
缓慢加入OSu。
反应进行时,温度需要保持在0-5℃。
反应结
束后,使用稀硫酸溶液洗涤,然后使用饱和氯化钠溶液清洗有机相。
然后,将有机相浓缩并进行冷却,得到纯的Fmoc-OSu。
需要注意的是,在合成过程中,应该注意反应温度的控制,以避免副反应的发生。
并且,在反应结束后,需要使用合适的洗涤剂清洗有机相,以去除杂质。
最后,使用适当的浓缩方法,得到纯净的Fmoc-OSu。
同时,合成过程中应注意安全操作,佩戴适当的防护设备,并遵守实验室安全规范。
具有金刚烷基的季铵盐的制备方法

具有金刚烷基的季铵盐的制备方法
制备金刚烷基季铵盐(alkyl-imidazolium salts)是合成
有机/无机复合材料(ORMOCERs)研究中极具活性的
一类化合物。
金刚烷基季铵盐是一类中等活性的有机无机复合材料,采用生物有机前驱体反应物,在Generali Simpkins反应体系中植入ilridazolium-type有机结构,
可以制备不同的金刚烷基季铵盐。
金刚烷基季铵盐的制备包括三步:有机反应、ILridazolium盐的加入和ILridazolium盐的添加。
第一步,采用有机无水反应方法,用脂肪醇(Fatt Alcohol)和异丙基胺(Ipropylamine)作为前驱体反应物,在一
定温度下进行反应,能够得到含有C≡N单碳键的有机物,即有机基团。
第二步,加入已准备好的ILridazolium盐。
该反应中加入的配体为金刚烷基羧酸,如偏苯三酸等;另外,通过合成的另外一组配体,如含硫的氰化物或醇及氯化物等,作为添加剂可以助于加快反应速度(例如甲基硫脲和乙
酸乙酯)。
第三步,加入ILridazolium盐。
在添加ILridazolium盐时,应按照ILridazolium盐和反应物的比例,即ILridazolium盐和反应物的比例;否则会影响目标金刚
烷基季铵盐的质量。
当反应速度和生成金刚烷基季铵盐有一定助推时,它就可以向目标物质生成。
以上就是制备金刚烷基季铵盐的方法,金刚烷基季铵盐的质量极具活性,可以用于合成ORMOCERs和其他新型复合材料。
这种材料具有优良的光学性能、热稳定性和耐酸碱性,可以用于生产地毯、航空应用,绿色汽车、牙齿压力传感器等的制造应用。
n-乙酰对苯醌亚胺结构

n-乙酰对苯醌亚胺结构
乙酰对苯醌亚胺结构是一种重要的有机化合物结构。
它是有机化
学合成中经常使用的原料。
本文将首先简要介绍乙酰对苯醌亚胺结构,然后讨论其主要组成、性质、合成方法及其在生物医学领域的应用。
乙酰对苯醌亚胺(ACA)是一种普遍存在的环状含氮醛酮。
ACA具有
四种氢原子和一种氧原子作为主要结构组分。
它的分子式为C6H7NO,
分子量为115.14。
ACA由两个羟苯基与乙酰基连接合成的环状高分子,也可以称为“水溶胺二磷酸盐”。
ACA的物理性质主要有:熔点为76-77℃;沸点为227-228℃;相
对密度为1.21;折射率为1.45。
乙酰对苯醌亚胺有一定的酸性和碱性,耐腐蚀性强,不溶于水及乙醇,能稳定于100℃的蒸汽中。
乙酰对苯醌亚胺通常由两种方法合成:一种是直接缩合式合成,
该方法利用碱催化重氮化反应,将各自二酰基夹在碱周围,以形成相
应的环状分子;另一种是用树脂的媒介,将乙酰基氯化或变性,然后
再进行水解。
乙酰对苯醌亚胺可广泛应用在合成染料、制冷剂、磁性记忆介质、电子粉末等行业中。
同时,乙酰对苯醌亚胺还有很多用途,尤其在生
物医学领域,如降低血脂、促进记忆力、免疫调节等。
综上所述,乙酰对苯醌亚胺结构是一种重要的有机结构,具有独
特的组成成份、性质以及有效的合成方法,在有机化学行业有广泛的
应用,也在生物医学领域具有广泛的应用前景。
由于乙酰对苯醌亚胺
的优异性能和多种用途,它将继续发挥重要作用。
沙格列汀中间体N-叔丁氧羰基-3-羟基-1-金刚烷基-甘氨酸的合成及其手性拆分

当代化工研究Modem Chemical Research155 2021・06科研开发沙格列汀中间体N-叔丁氧拨基-3-经基-1-金刚烷基一甘氨酸的合成及其手性拆分*张少平讥=>陈旖仁.3李培和2.3漆定超Z3(1.沧州那瑞化学科技有限公司河北0611082.沧州市高级医药中间体技术创新中心河北0611083.河北省糖尿病和精神疾病药物中间体重点实验室河北061108)摘耍:本实验的合成方法是以金刚烷甲酸⑴为起始原料,经过氯化亚砚和丙二酸二乙酯餉反应,成功合成1-金刚烷甲酸二甲酯(1-金刚烷隸基)丙二酸二甲酯,再经水解、脱竣、高猛酸钾氧化合成的金刚烷甲基酮⑵,然后一步一步氧化2-(3-務基-1-金刚烷基)-2-隸基乙酸⑶,2-(3-凳基-1-金刚烷基)-2-讖基乙酸与盐酸務胺反应⑶的2-(3-凳基-1-金刚烷)-2-乙醛厢■酸⑷,然后使用Ni-铝合金还原2-(3-凳基-1-金刚烷)-2-乙醛厢■酸得到3-卷基-1-金刚烷基甘氨酸,然后用B0C酸軒保守氨基-叔丁基讖基氧-3-卷基-1-金刚烷基-甘氨酸⑸”通过查阅相关文献,探索新的合成DPP-IV抑制剂沙格列汀重要中间体NFl丁氧裁基-3-凳基-1-金刚烷基甘氨酸餉方法和其手性拆分.得到了新化合物2-(3-務基-l-4r刚烷基)-2-乙醛酸岳(4),以金刚烷甲酸⑴为原料计算总收率可达36%.本实验方法所用原料价廉易得,反应条件温和,操作简便,收率高,适合工业化生产.关键词:沙格列汀;NFl丁氧惑-3-務基-1-金刚烷基-甘氨酸;手性拆分中圈分类号:T文献标识码:ASynthesis and Chiral Resolution of Saxagliptin Intermediate N-tert-butoxycarbonyl-3-hydroxy-1-adamantyl-glycineZhang Shaoping1A3,Chen Yi1,2,3,Li Peishen1,2,3,Qi Dingchao1,2'3(1.Cangzhou Narui Chemical Technology Co.,Ltd”Hebei,0611082.Cangzhou Advanced Pharmaceutical Intermediates Technology Innovation Center,Hebei,0611083.Hebei Key Laboratory of Drug Intermediates for Diabetes and Mental Disorders,Hebei,061108)Abstract:In this experiment,adamantane formic acid(1)was used as the starting material,and dimethyl1-adamantane formate(1-ada-mantane carbonyl)malonate was successfully synthesized by the reaction of t hionyl chloride and diethyl malonate.Then adamantane methyl ketone (2)was synthesized by hydrolysis,decarboxylation and potassium permanganate oxidation,and then2-(3-hydroxy-l-adamantane)-2was oxidized step by step.2-(3-hydroxy-l-adamantane)-2-acetaldehyde oxime acid(4)obtained by reacting2-(3-hydroxy-l-adamantyl)-2-carbonyl acetic acid with hydroxylamine hydrochloride(3),then reducing2-(3-hydroxy-l-adamantane)-2-acetaldehyde oxime acid"with Ni-aluminum alloy to obtain3-hydroxy-1-adamantylglycine.Then amino-tert-butylcarbonyloxy-3-hydroxy-l-adamantyl-glycine(5)was conserved with BOC anhydride.A new method f or the synthesis(rfN-tert-butoxycarbonyl-3-hydroxy-l-adamantyl g lycine,an important intermediate ofDPP-IV i nhibitor s axagliptin,and its chiral resolution were explored through consulting relevant literature.The new compound2-(3-hydroxy-l-adamantyl)-2-glyoxylic acid oxime(4)was obtained.The total yield calculated f rom adamantanecarboxylic acid(1)was up to36%.The raw materials used in this experimental method were cheap and readily available,"with mild reaction conditions,simple operation and high yield.It was suitable f or industrial p roduction.Key words:saxagliptin^N-tert-butoxycarbonyl-3-hydroxy-l-adamantyl-glycine;chiral resolution引言心血管疾病己成为大多数糖尿病患者死亡的主要原因。
Fmoc固相合成法_刘振南

Fmo c基 团是 在有 Na HCO3 或 N a2 CO3 存在 的二 氧六 环 溶液中 ,通过以下反 应引入到氨基酸中的:
○
O
R
O R′+ H2N CH COO H — → ○
○
O R
O N H CH CO O H ( R′= Cl. N3 ) ○
理想的 Fmo c- 氨基 酸的侧链保 护基应 在碱性 条件下 稳 定 ,在酸性条件下脱 除 .下面对其做一介绍 . 4. 1 Asp和 Glu
OCH2 ○ ○P
( 2)
R1
H2N CH CO O - C H2 ○ O C H2 ○ ○P
( 3) Fmoc - 氨基酸 - pfb
R2
R1
Fm oc N H CH CON H CH COO - CH2 ○
O CH2 ○ ○P
( 4)
Fm oc - N H (肽 ) CO O - C H2 ○ OC H2 ○ ○P
在 Boc合成法中 ,反复地用酸来脱保 护 ,这种处 理带来了 一 些 问题: 如 在 肽 与树 脂 的 接 头处 ,当 每次 用 50% T F A 脱
Bo c基时 ,有约 1. 4% 的肽从树脂上 脱落 ,合成 的肽越大 ,这样 的丢 失越 严重 ; 此外 ,酸 催化 会引 起侧 链的 一些 副反 应 . Bo c 合成 法 尤其 不适 于 合成 含 有色 氨 酸 等对 酸 不稳 定 的肽 类 . 1978 年 , Chang、 M eienlo fer 和 Ather ton 等 人采 用 Ca rpino[3] 报道的 Fmoc ( 9- 芴 甲氧羰基 )基团作为 α- 氨基保护基 ,成功 地进行了多肽 的 ቤተ መጻሕፍቲ ባይዱmo c固相合成 . Fmoc法与 Boc 法的根本 区 别在于采用了碱可脱除的 Fmoc 为 α- 氨基的 保护基 .侧 链的 保护采 用 T F A可脱 除的叔丁 氧基等 ,树脂 采用 90% T F A 可 切除的对烷氧苄醇型树脂和 1% T F A可切除的二烷氧苄 醇型 树脂 ,最终的脱保护 避免了强酸处理 .
扑热息痛的又一合成路线_谢剑华

( Dep t. of Med icinal C hemistr y, Zh ej iang Medical Uni versit y, Han gz hou 310006 )
扑热息痛 ( 1) ,化 学名为 N -( 4-羟基 苯 基 )乙酰胺 ,为常用的解热镇痛药。 文献报道 的合成方法有: 以对硝基氯苯 [1 ]为原料 ,经水 解还原酰化制备 ; 以硝基苯为原料 ,在 Pt /C 或 PtO2 存在下还原得对氨基酚 ,再经酰化而 得 [2, 3 ] ; 硝基苯在 Al -H2 SO4存在下 还原再转
∶ 33 3 U S Pharmacopeia. ⅩⅩⅢ , 1995∶ 443 4 中国药典 . 二部 , 1995∶附录 44
S TU DY ON PREPA RA T IO N AN D S T ABILITY O F M ICRO EM U LSIO N PRECON CEN T RA T E CO N T AIN IN G
ABSTRACT A micro em ulsio n preconcent ra te containi ng cyclosporin A( Cy A-M EPC-
sol ) f or o ral admi nist ra tion w as dev eloped. The Cy A cont ent of the preparatio n w as
quanti tativ e det ermi na tion
[1998年 10月 26日收稿 ]
(上接第 294页 )
参考文献
1 ( Bri t 1967: 1098717) CA 1967; 69: 10221m 2 ( Fr 1970: 1559841) CA 1970; 72: 31434k 3 ( Ger Of f en 1972: 2118334) CA 1972; 76: 24898u 4 ( Levi M , Pesh eva I. Farmasiya( Sofia ) , 1965; 15( 3):
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H0
O
N
E DC, H2 2 C CI
L Q质 谱仪 . 始 原 料 金 刚 烷 胺 从 东 北 制 药 总 C 起
1 实
验
厂 购 买 ; 一 甲 基. 琥 珀 酰 亚 胺 基 碳 酸 酯 9芴 Ⅳ_ ( mo— u 由 南 京 科 邦 医 药 化 工 有 限公 司 生 F cOS ) 产 ;一 L 酪氨 酸购 于沈 阳国药集 团化 学试 剂有 限公 司 ; 层析 硅胶 (o 柱 20~30目) 青 岛海 洋化 工 厂 0 ,
第2 5卷
2 1. 01 09
第3 期
沈
阳
化
工
大
学
学
报
Vo_ 5 No. l2 3 Sp2 1 e . 01
J OUR AL N OF SHENYANG UNI VERS TY I OF CHEM I CAL TECHNOLOGY
文 章 编 号 : 2 9 2 9 (0 1 0 02 0 0 5— 18 2 1 )3— 2 9— 3
基 )3 乙基 碳二 亚胺 盐 酸 盐 ( DC) 0 4 27g 一一 E ( .0 ,
2 4m 1缓慢滴入上 述体系 , . mo) 室温下反 应5 h 结束 ; 反应 液 中加 入 2 LH O, 0m 分去 水层 , 机 有 相水 洗 , 以无 水硫 酸 钠干燥 , 去 干燥 剂 , 并 滤 减压 分数为1 0%的碳酸钠溶液, p 1. 调 H: 1冰浴下, 将 蒸除 二氯 甲烷 , 得淡 黄 色油状 物 ( .8 ) 硅胶 060g . 溶于 1 0 mL二 氧 六 环 的 F cO u 113 g 35 mo — S ( .8 ,. 柱提 纯 , 脱剂 为 ( 油 醚 ) ( 酸 乙酯 )= 洗 石 : 乙 m 1缓慢滴加入反应体 系 , mo) 滴毕 , 逐渐升 至室温 , 4 1得 白色 固 体 化 合 物 1 04 , 量 分 数 为 :, ( .4g 质 7 9% ) mp 8 — 8 o E I m z 5 9 5 , T 2 C. S— MS / : 7 . 反应结 束 . 入 3 L 水 , 加 0l n 乙醚 ( 5m ×3 萃 3 . 1 L ) 取 , 层用 1mo/ 水 lL盐 酸 调 p =2 析 出大 量 白 ( +H) , 9 . M +NH ) ; / / : H , M 5 6 2( 4 MS MS m z 色固体 ; 乙酸乙酯 (0 m ) 2 L X 萃取 , 并有机 37 1 ( +H)F c+H] ,2. ( mo ) , 3 合 5.[ M -mo 229 F c 相 , 机 相 以水 、 和食 盐 水 洗 , 水 硫 酸 钠 干 18O C。 。 C;o) 其一级质谱 、 有 饱 无 7.( HN . 二级质谱 燥 . 去干 燥剂 , 除 乙酸 乙酯 , 无色 油状 化合 和裂 解途径 分别 见 图 1 图 2和 图 3 滤 蒸 得 、 . 参照文 献 [ ] 3 的方法, 酪氨 酸 (. 5 g 29 05 , 2 . m 1 、 (5m 置 于 20m mo)水 1 L) 5 L三颈瓶 , 滴加 质量
/ 刚烷 基 一 F c D_ 、一 /金 N-mo - 乙酰基 一- 氨 酰胺 的合成 L酪
姜 家妹 , 刘 丹 , 朱 秀杰 , 孔 建
o
( 阳化工大学 化学工 程学 院 , 沈 辽宁 沈 阳 104 ) 1 12 摘 要 : 以 L 酪氨酸、 - 一 9 芴甲基一 琥珀 酰亚胺 基碳 酸 酯和 乙酸酐 为原料 , M 经过 F c氨基 保 护 , mo
其与经过氨基 、 酚羟基保护 的酪氨酸缩合 , 合成 了 Ⅳ 刚烷 基一 F cO 乙酰 基 一 一 氨 酰 胺 ・ 金 N-mo — 一 L酪
( 合物 1 , 化 ) 为进 一 步合成 金 刚烷胺 的衍 生物 奠 定基 础 , 其合 成路 线如 下 :
O
H O
— o J O L L 、 o J
酚 羟 基 乙酰 化 , 得 中 间体 N F cO 乙酰 基 一一 氨 酸 ( 合 物 3 ; 1( - 甲氨 基 丙 基 )3 乙 制 -mo— 一 L酪 化 ) 在 一3二 -一 基 碳 二 亚胺 盐酸 盐 ( D H 1 为缩 合 剂 、 氯 甲烷 为溶 剂 的条 件 下 , E C. C ) 二 与金 刚炕 胺 缩 合 , 成 了 目标 合
关键词 : 金刚烷胺 ; A型 流感病毒 ; L 酪氨酸 ・
中 图分 类 号 : T 4 3 Q 6 文 献 标 识码 : A
啦
病 毒性 流行 性感 冒 ( 感 ) 年 都 在全 世 界 流 每 流行 , 波及 范 围之 广 , 其 造成 经 济 损 失 之 大位 于 传染 性疾 病之 首 . 刚烷胺 是 最 早 上 市 的 M: 金 离 子通 道 蛋 白抑 制 剂 , 用 于 M: 子 通 道 蛋 白 , 作 离 可 以通 过阻 断 M 离子 通道 蛋 白阻 止病 毒 脱 壳 , 使病 毒 不能 释放 到细 胞质 中 , 病毒 的早 期复 制被 中断 , 而起 到抗 流 感病 毒 的作 用 . 该类 药物 从 但
沈
阳
化
工
大
学
学
报
2 1 年 01
生 产 ; 层析 所用洗 脱 剂为 石油 醚 ( 柱 沸程 6 9 0— O ℃ ) 乙酸 乙酯 的混合 溶液 . 与
12 N-mo -一 . F c L酪氨 酸 ( 化合 物 2 的合成 )
甲烷 (5mL) 2 置于 20mL单 口瓶 中 , 5 搅拌 ; 冰浴 下将 溶 于 2mL 二 氯 甲 烷 的 1( 一 甲 氨 基 丙 一3二
化合 物 Ⅳ 金刚烷基- F cO 乙酰基一 - N-mo— . L 酪氨 酰胺 ( 化合 物 1 , ) 3步 总收 率为 1. 5%. 87 根据 二级 质谱碎 片峰 , 出化合物 的裂解途径 , 给 为其 结构确 证提供 质谱依 据. 实验 过程 中, 对各 步反应 条件
进 行 优 化 , 最 终 确 定 合 适 的保 护 剂 和 催 化 剂 . 并
1 1 仪器 和试 剂 .
所 用 仪器 为 X- 微 熔 点 仪 , 电一 根 4显 热 菲
收稿 日期 : 2 1 0 0—1 2 0— 6
作者简介 : 姜家妹 (9 3一), , 18 女 黑龙 江大庆人 , 硕士研 究生在读 , 主要从 事抗 病毒药物合成 的研究 . 通讯联 系人: 刘丹 (9 1一)女 , 宁沈阳人 , 17 , 辽 副教授 , 士 , 博 主要从 事现有药物的结构改造 及活性研究 , 肿瘤前体药 物的设计 、 抗 合 成及 活性研究 .
O o H
1 %N a O3Dix n / 2 0 C , o a e 0 H
存 在 神经 毒性 、 B 型流 感 无 效 、 对 长期 服用 易 产 生 耐药毒 株等 缺 陷¨ J为 了寻 找 高效低 毒 的抗 . 流感 化 合 物 , 文 以金 刚 烷 胺 为先 导 化 合物 , 本 将
