乙烯氧化生产环氧乙烯过程设计
乙烯直接氧化法生产环氧乙烷

5
第七章 烴類選擇性氧化
載體的主要功能是分散活 性組分銀和防止銀微晶的 半熔和結塊,使其活性保 持穩定。常用的載體有碳 化矽、α-Al2O3和含有少 量Si02 的α-Al2O3等
在銀催化劑中加入少量的硒、碲、氯、溴 按一下此處編輯母版標題樣式 2. 催化劑 等,可抑制二氧化碳的生成,對提高銀催 化劑的選擇性有較好的效果,但催化劑活 性卻降低了。這類物質稱為抑制劑也稱為 按一下此處編輯母版文本樣式 調節劑。如加氯化物
• 按一下此處編輯母版文本樣式
– 第二級
• 第三級
氮氣做致穩氣
– 第四級 » 第五級
不用碳酸鉀溶液來脫除CO2
東南大學化學化工學院
12
第七章 烴類選擇性氧化
按一下此處編輯母版標題樣式
EO生產工藝技術新進展
環氧乙烷回收技術 • 第三級 碳酸乙烯酯
– 第四級 » 第五級
• 按一下此處編輯母版文本樣式 氧-烴混合技術
– 第二級
節能技術
超臨界萃取 EO、膜式等溫吸 收器、熱泵精餾利用低位能
東南大學化學化工學院
13
第七章 烴類選擇性氧化
按一下此處編輯母版標題樣式
可加入第三種氣體來改變乙烯的爆炸限, •這種氣體通常稱為致穩氣,致穩氣是惰 按一下此處編輯母版文本樣式 – 第二級 性的,能減小混合氣的爆炸限,增加體 • 第三級 系安全性;具有較高的比熱容,能有效 – 第四級 地移出部分反應熱,增加體系穩定性。 » 第五級
第七章 烴類選擇性氧化
乙烯直接氧化法生產環氧乙烷
•
二、反应 原理 按一下此處編輯母版文本樣式
按一下此處編輯母版標題樣式
– 第二級
• 第三級
EOEG(乙二醇)装置工艺技术特点及基本原理

E O E G(乙二醇)装置工艺技术特点及基本原理-标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII工艺技术特点及基本原理基本原理乙烯氧化生成环氧乙烷的反应机理乙烯氧化过程按氧化程度可分为选择性氧化(部分氧化)和深度氧化(完全氧化)两种情况。
乙烯分子中的碳—碳双键(C=C)具有突出的反应活性,在一定氧化条件下可实现碳—碳双键的选择氧化而生成环氧乙烷,但在通常氧化条件下,乙烯分子骨架很容易被破坏,发生深度氧化而生成二氧化碳和水。
目前工业上乙烯直接氧化生成环氧乙烷的最佳催化剂是银催化剂。
(1)主反应乙烯氧化生成环氧乙烷是放热反应,在250℃时,每生成一摩尔环氧乙烷要释放出25.19千卡的反应热。
(2)副反应乙烯氧化时除生成产物环氧乙烷外,还发生其它反应:在工业生产中,反应产物里实际主要是环氧乙烷、二氧化碳和水,而甲醛量远小于1%,乙醛量则更小。
反应(2)是主要副反应,也是放热反应,250℃时,每反应掉1摩尔乙烯要放出315.9千卡反应热,如果反应温度过高或其它条件影响会产生反应(3),其反应也是强放热反应,每反应掉1摩尔环氧乙烷要放出314.4千卡的热量,副反应(2)和(3)与主反应(1)的反应进行比较,便可看出副反应的反应热是主反应热的卡几倍,因此必须严格控制工艺条件,以防副反应增加。
不然,副反应加剧,势必引起操作条件恶化,造成恶性循环,甚至发生催化剂床层"飞温"(由于催化剂床层大量积聚热量造成催化剂层温度突然飞速上升的现象)而使正常生产遭到破坏。
近代对乙烯在银催化剂条件下的选择性氧化机理做了大量的研究,比较统一的看法是:A.氧被银表现吸附的形态初始时,在各种不同温度下氧被高速度吸附,此时活化能很低,约为3千卡/克分子,这个过程发生在四个邻近的清洁的银原子上氧分子的解离吸附(非活化解离吸附)。
O2+4Ag(邻近)→2O2-(吸附)+4Ag+(邻近) (a)如果银表面有四分之一被氯遮盖时,则上述过程被完全吸附。
乙烯环氧化制环氧乙烷

乙烯環氧化製環氧乙烷低級烯烴的氣相氧化都屬非均相催化氧化範疇。
催化劑為毫米級或μ級微粒,它們分別用於固定床或流化床反應器。
環氧乙烷是乙烯工業衍生物中僅次於聚乙烯而占第二位元的重要有機化工產品。
它除部分用於製造非離子表面活性劑、氨基醇、乙二醇醚外,主要用來生產乙二醇,後者是製造聚酯樹脂的主要原料。
也大量用作抗凍劑。
1. 生產方法環氧乙烷有兩種生產方法:氯醇法和直接氧化法。
(1)氯醇法本法於1925年由美國聯碳公司(UCC)首先實現工業化。
生產過程包括二個基本反應:乙烯與次氯酸反應(俗稱次氯酸化)和氯乙醇脫氯化氫反應(俗稱環化或皂化)。
A次氯酸化反應主要副反應有:還有生成二氯二乙醚的副反應:次氯酸化反應溫度為40~60℃,C2H4∶Cl2=1.1~1.2∶1,即乙烯是過量的。
壓力對反應沒有影響,只需滿足克服系統阻力就行。
B氯乙醇的皂化(環化)反應副反應為:當有氧化鎂雜質存在時,還可能生成少量醛類:工業上除用Ca(OH)2作皂化劑外,還採用NaOH溶液。
操作中應將皂化劑緩慢加入氯乙醇中。
否則,在鹼性介質中生成的環氧乙烷會大量水解生成乙二醇。
皂化反應壓力為0.12MPa,溫度為102~105℃,在此條件下,可保證生成的環氧乙烷立即從液相逸出(環氧乙烷沸點10.7℃),避免環氧乙烷的水解。
本法可以採用低濃度乙烯(50%左右)為原料,乙烯單耗低、設備簡單、操作容易控製,有時還可聯產環氧丙烷。
但生產成本高(生產1噸產品,需消耗0.9噸乙烯、2噸氯氣和2噸石灰),產品只能用來生產表面活性劑。
氯氣和氫氧化鈣沒有進入產品分子中,而是變成工業廢渣,不僅浪費了氯氣和石灰資源,而且還會嚴重污染環境。
此外,氯氣、次氯酸和HCl等都會造成設備腐蝕和環境污染。
因此本法從20世紀50年代起,已被直接氧化法取代。
(2)直接氧化法本法於1938年也由美國聯碳公司開發成功。
由於受當時工業技術水準的限制,直至50年代才開始建造大型工業生產裝置。
EOEG(乙二醇)装置工艺技术特点及基本原理

工艺技术特点及基本原理基本原理乙烯氧化生成环氧乙烷的反应机理乙烯氧化过程按氧化程度可分为选择性氧化(部分氧化)和深度氧化(完全氧化)两种情况。
乙烯分子中的碳—碳双键(C=C)具有突出的反应活性,在一定氧化条件下可实现碳—碳双键的选择氧化而生成环氧乙烷,但在通常氧化条件下,乙烯分子骨架很容易被破坏,发生深度氧化而生成二氧化碳和水。
目前工业上乙烯直接氧化生成环氧乙烷的最佳催化剂是银催化剂。
(1)主反应乙烯氧化生成环氧乙烷是放热反应,在250℃时,每生成一摩尔环氧乙烷要释放出25.19千卡的反应热。
(2)副反应乙烯氧化时除生成产物环氧乙烷外,还发生其它反应:在工业生产中,反应产物里实际主要是环氧乙烷、二氧化碳和水,而甲醛量远小于1%,乙醛量则更小。
反应(2)是主要副反应,也是放热反应,250℃时,每反应掉1摩尔乙烯要放出315.9千卡反应热,如果反应温度过高或其它条件影响会产生反应(3),其反应也是强放热反应,每反应掉1摩尔环氧乙烷要放出314.4千卡的热量,副反应(2)和(3)与主反应(1)的反应进行比较,便可看出副反应的反应热是主反应热的卡几倍,因此必须严格控制工艺条件,以防副反应增加。
不然,副反应加剧,势必引起操作条件恶化,造成恶性循环,甚至发生催化剂床层"飞温"(由于催化剂床层大量积聚热量造成催化剂层温度突然飞速上升的现象)而使正常生产遭到破坏。
近代对乙烯在银催化剂条件下的选择性氧化机理做了大量的研究,比较统一的看法是: A.氧被银表现吸附的形态初始时,在各种不同温度下氧被高速度吸附,此时活化能很低,约为3千卡/克分子,这个过程发生在四个邻近的清洁的银原子上氧分子的解离吸附(非活化解离吸附)。
O2+4Ag(邻近)→2O2-(吸附)+4Ag+(邻近) (a)如果银表面有四分之一被氯遮盖时,则上述过程被完全吸附。
第二种过程是表面缺乏四个邻近的清洁银原子时,则发生氧分子的非离解吸附,此时氧分子一个电子,这个过程的活化能约为7.9千卡/克分子。
乙烯制环氧乙烷

乙烯氧化制环氧乙烷过程的开发一.产品简介:环氧乙烷(EO)是乙烯工业衍生物中仅次于聚乙烯和聚氯乙稀的重要有机化工产品。
全球约60%的环氧乙烷用于生产聚酯纤维、树脂以及防冻剂用单体乙二醇,13%的环氧乙烷用于生产其他多元醇和生产洗涤剂乙氧基化合物、乙醇胺、乙二醇醚、熏蒸剂和药物的消毒剂等。
目前,环氧乙烷的生产均采用氧气直接氧化法。
二.生产方法1. 生产技术现状早期环氧乙烷生产采用氯醇法工艺。
1922年UCC(联碳公司)建成首套工业装置;之后根据法国Lefort的研究结果,UCC在1938年又建成了首套空气法工业装置。
1958年Shell(壳牌公司)建成首套氧气法工业装置。
氯醇法存在三废污染问题,因此目前国内外环氧乙烷生产几乎全部采用乙烯直接氧化法技术,而且大部分厂商以氧气作氧化剂,大规模的工业装置采用氧气法可节省设备投资费用。
全球环氧乙烷专利技术大部分仍为英荷Shell、美国SD(科学设计公司)和UCC三家公司所垄断,这三家公司的技术占环氧乙烷总生产能力的90%以上,其中Shell只提供氧气法技术,SD提供空气法和氧气法,UCC虽也具有氧气法和空气法技术,但只供自己生产厂使用。
我国由氯醇法生产环氧乙烷始于1960年代,由于氯醇法对乙烯质量要求不高,所以采用酒精发生乙烯和渣油裂解混合烯烃生产环氧乙烷在我国石油化工发展初期具有一定意义。
随着大规模引进环氧乙烷装置的建成和投产,加上环保法规的日益严格,国内小规模的氯醇法环氧乙烷装置已无生命力,于1993年下半年淘汰。
因经济原因,早期引进的空气法环氧乙烷装置大多也改造为氧气法。
2.生产方法比较A.氯醇法制环氧乙烷氯醇法制环氧乙烷原理:两步环氧化,一次产物用脱氧化生成EO。
氯醇法生产环氧乙烷的过程中,不经分离的中间产物氯乙醇与石灰水工热生成环氧乙烷:氯醇法被淘汰的原因:1.氯气消耗太高2.盐的生成量大3.生成副产物B.直接氧化法制环氧乙烷直接氧化法制环氧乙烷原理:乙烯与空气或氧在载体Ag催化剂上发生气相反应。
乙烯制取环氧乙烷生产工艺设计

乙烯制取环氧乙烷生产工艺设计环氧乙烷(EO)是一种重要的有机化工原料,广泛应用于合成表面活性剂、塑料、合成纺织品和起泡剂等领域。
下面将介绍乙烯制取环氧乙烷的生产工艺设计。
首先,乙烯是环氧乙烷的主要原料,可以通过烃解乙烷来制取。
烃解乙烷反应采用乙烷和热空气在催化剂的作用下,进行高温裂解反应。
主要反应方程式如下:C2H6+热空气->C2H4+H2O+热量烃解乙烷反应装置一般由进料系统、反应系统、冷却系统、分离系统和废气治理系统组成。
进料系统将乙烷、热空气和催化剂送入反应系统;反应系统中的催化剂在高温下催化乙烷裂解生成乙烯;冷却系统通过冷却装置将反应系统中的产物冷却到室温;分离系统通过精馏等方法将乙烷、乙烯和其他副产物分离;废气治理系统用于处理排放的废气。
接下来是环氧化反应。
环氧化反应是将乙烯与过氧化氢(H2O2)在存在催化剂的条件下,发生环氧化反应。
主要反应方程式如下:C2H4+H2O2->C2H4O+H2O环氧化反应一般采用银催化剂,可选择液相或气相进行。
液相环氧化反应采用连续搅拌反应器,反应温度约在55-60摄氏度,压力在0.5-1.0MPa之间;气相环氧化反应采用固定床反应器,反应温度约在200-300摄氏度,压力在0.5-3.0MPa之间。
最后是环氧乙烷的分离和提取。
由于环氧乙烷与水和其他副产物之间的溶解度较大,可以通过水洗和精馏的方式进行分离和提取。
水洗将含有环氧乙烷的混合物与水接触,使环氧乙烷转移到水相中;精馏则通过升华和冷凝的方式将环氧乙烷高纯度地分离出来。
总的来说,乙烯制取环氧乙烷的生产工艺包括乙烷的烃解、乙烯的环氧化以及环氧乙烷的分离和提取。
通过合理的反应条件和工艺设计,可以提高环氧乙烷的产率和纯度,满足市场需求。
同时,还需进行废气治理和产品质量检测,确保生产过程的环保性和产品的质量稳定性。
乙烯催化氧化制备环氧乙烷

废弃物处理和资源化利用
废弃物分类
对产生的废弃物进行分类处理,如有机废液、无机废盐、废气等。
资源化利用
尽可能将废弃物转化为有价值的资源,如废气中的二氧化碳可用于 生产尿素等。
环保处理
对无法资源化利用的废弃物进行环保处理,确保达到国家排放标准。
06 经济效益分析与市场前景 展望
投资成本估算及回报周期预测
国内外市场对比
分析国内外环氧乙烷市场供需状况,了解市场差异及 竞争格局。
未来市场趋势
预测未来环氧乙烷市场发展趋势,关注新技术、新应 用对市场的影响。
竞争力提升策略探讨
技术创新
加强催化剂研发,提高催化氧化反应的选择性和转化率 ,降低生产成本。
产业链整合与协同
加强与上下游企业的合作,实现产业链整合与协同发展 ,降低成本,提高整体竞争力。
乙烯催化氧化制备环氧乙烷
目录
• 乙烯催化氧化概述 • 原料与催化剂选择 • 反应原理及设备介绍 • 生产工艺流程详解 • 安全生产与环境保护要求 • 经济效益分析与市场前景展望
01 乙烯催化氧化概述
乙烯催化氧化定义与原理
定义
乙烯催化氧化是指乙烯在催化剂作用 下与氧气发生反应,生成环氧乙烷的 过程。
精馏提纯
采用精馏塔对冷凝后的环氧乙烷进行提纯, 去除其中的轻组分和重组分杂质。
包装储存
将纯化后的环氧乙烷进行包装,并储存在阴 凉、干燥、通风良好的地方。
05 安全生产与环境保护要求
危险源辨识及风险评估
辨识危险源
明确乙烯、氧气、催化剂 等原料及反应过程中可能 产生的危险物质。
评估风险
针对辨识出的危险源,评 估其可能导致的火灾、爆 炸、中毒等风险。
原料气组成
乙烯空气氧化法制备环氧乙烷的设备选型与优化

乙烯空气氧化法制备环氧乙烷的设备选型与优化环氧乙烷 (Ethylene Oxide, EO) 是一种重要的有机合成原料,广泛应用于化工、医药、农药和日化等领域。
乙烯空气氧化法是目前制备环氧乙烷的主要工艺路线,该方法通过将乙烯与空气催化反应,制得环氧乙烷。
本文将讨论乙烯空气氧化法制备环氧乙烷的设备选型与优化。
一、反应器选型乙烯空气氧化法制备环氧乙烷的反应器是整个过程中最关键的设备之一。
常用的反应器类型包括固定床反应器、流化床反应器和循环流化床反应器等。
1. 固定床反应器固定床反应器是最常见的反应器类型之一,其主要特点是结构简单、操作稳定,并且适应性广。
然而,乙烯空气氧化反应属于高度放热反应,固定床反应器存在热失控的风险。
此外,催化剂在操作过程中容易受到积碳和中毒,需要定期更新和再生,增加了生产成本。
2. 流化床反应器流化床反应器是另一种常见的反应器类型,其主要特点是具有良好的传热和传质性能,有利于催化剂的再生和控制反应温度。
然而,流化床反应器的操作复杂,催化剂的悬浮性需要进行良好的控制,以避免颗粒的沉积和外泄。
此外,流化床反应器对催化剂的选择也有较高的要求。
3. 循环流化床反应器循环流化床反应器是对传统流化床反应器的改进,可以有效地控制催化剂的循环和再生。
该反应器通过循环流化床内的气体进行催化剂的再生,避免了催化剂在操作过程中的积碳和中毒问题。
循环流化床反应器还具有较好的传热和传质性能,能够稳定控制反应温度。
二、适宜催化剂选择催化剂是乙烯空气氧化法制备环氧乙烷的关键组成部分,其催化性能直接影响反应效果和设备的稳定性。
常用的催化剂主要包括磷钼酸盐、银催化剂和铁催化剂等。
磷钼酸盐是一种常见而有效的催化剂,具有较高的催化活性和稳定性,适用于固定床反应器和流化床反应器。
银催化剂具有良好的选择性,可以提高环氧乙烷的产率和纯度,适用于固定床反应器和循环流化床反应器。
铁催化剂具有较好的耐热性和抗中毒性能,适用于循环流化床反应器。
环氧乙烷工艺技术

环氧乙烷工艺技术环氧乙烷(Ethylene Oxide,简称EO)是一种重要的有机化工原料,广泛应用于制造各种化工产品和合成材料。
环氧乙烷工艺技术是指利用乙烯和氧气作为原料,通过一系列反应和分离工序生产环氧乙烷的过程。
本文将介绍环氧乙烷工艺技术的基本原理和主要步骤。
环氧乙烷的制备主要应用环氧乙烷法和直接氧化法两种技术路线。
其中,环氧乙烷法是主要工业化生产技术,其反应原理是乙烯与过氧化氢在催化剂的作用下发生反应生成环氧乙烷。
直接氧化法则是利用乙烯与氧气在高温下直接反应生成环氧乙烷。
而本文将以环氧乙烷法为例。
环氧乙烷工艺技术的主要步骤包括催化剂准备、原料预处理、反应器反应、产物分离、纯化和废气处理等环节。
首先是催化剂准备。
环氧乙烷制备的催化剂一般采用酸碱型催化剂,常见的有银催化剂、氯化银钴催化剂等。
催化剂的制备涉及多道工序,包括计量、混合、搅拌、干燥等操作。
接下来是原料预处理。
乙烯和过氧化氢是环氧乙烷制备的主要原料,在进入反应器之前需要进行预处理来净化原料。
乙烯通过玻璃纤维过滤器去除杂质和水分,然后经过脱乙烯器来除去乙烯多余的部分。
过氧化氢也需要经过脱氢器处理来去除水分和杂质。
反应器反应是整个工艺过程中最核心的部分。
原料进入反应器后,在酸碱型催化剂的作用下,乙烯和过氧化氢发生反应生成环氧乙烷。
反应器通常是采用连续流动系统,通过调节反应器的温度、压力和原料进料速率等参数来控制反应的进行。
产物分离是指将反应器中生成的环氧乙烷和未反应的乙烯、过氧化氢等物质进行分离。
通常采用的方法包括凝结、吸附、蒸馏等。
其中,凝结是通过降低温度来使环氧乙烷和其他气体凝结成液体,然后通过分离器将液体环氧乙烷和非反应物进行分离。
纯化是指对产物进行进一步的提纯处理,以获得符合工业用途的环氧乙烷。
纯化方法主要包括溶剂萃取法、蒸馏法等。
这些方法可以去除环氧乙烷中的杂质和不纯物,提高产品的纯度和质量。
最后是废气处理。
环氧乙烷工艺中会产生大量的废气,其中含有环氧乙烷、乙烯和过氧化氢等有毒有害物质。
反应工程乙烯空气氧化法制环氧乙烷课程设计

反应工程课程设计设计题目:乙烯催化氧化制环氧乙烷的反应器设计专业名称:化学工程与工艺*名:***学号:*********系别:化学与化学工程系****: **设计时间:2012-5-28 至2012-6-7目录设计任务书第一章绪论 (2)1.1反应过程分析 (2)1.2催化剂的选择 (2)1.3反应器的选择 (3)1.4反应条件的分析 (3)第二章工艺流程及说明 (4)2.1乙烯的氧化 (4)2.2环氧乙烷的吸收与解析 (6)第三章物料衡算 (8)3.1原料气的组成 (8)3.2物料衡算图及反应原理 (9)3.2反应器的物料衡算 (10)第四章热量衡算 (12)4.1反应器的热量衡算 (12)4.2热量衡算 (14)第五章反应器的设计 (16)5.1催化剂的用量 (17)5.2确定氧化反应器的基本尺寸 (20)5.3床层压力降的计算 (20)5.4传热面积的核算 (20)5.5反应器塔径的确定 (22)5.6设备壁厚的计算 (24)5.7 附属设备的计算 (24)第六章设计结果汇总 (26)符号说明 (27)参考文献 (28)第一章绪论环氧乙烷(简称EO)是最简单也是最重要的环氧化合物,在常温下为气体,沸点10.5℃。
可以与水、醇、醚及大多数有机溶剂以任意比混合。
有毒,易自聚,尤其当有铁,酸,碱,醛等杂质或高温下更是如此,自聚时放出大量热,甚至发生爆炸,因此存放环氧乙烷的贮槽必须清洁,并保持在0℃以下。
环氧乙烷是以乙烯为原料产品中的第三大品种,仅次于聚乙烯和苯乙烯。
它的用途是制取生产聚酯树脂和聚酯纤维的单体、制备表面活性剂,此外还用于制备乙醇胺类、乙二醇醚类等。
1.1 过程分析工业上生产环氧乙烷最早采用的方法是氯醇法,该法分两步进行,第一步将乙烯和氯通入水中反应生成2-氯乙醇,2-氯乙醇水溶液浓度控制在6%-7%(质量);第二步使2-氯乙醇与Ca(OH)2反应,生成环氧乙烷。
该法的优点是对乙烯的浓度要求不高,反应条件较缓和,其主要缺点是要消耗大量氯气和石灰,反应介质有强腐蚀性,且有大量含氯化钙的污水要排放。
乙烯直接氧化法生产环氧乙烷图文

氧气供应和纯度保障措施
氧气供应
采用空气分离法或电解水法制取氧气,确保连续、稳定的氧气供应。
纯度保障措施
通过分子筛吸附、金属氧化物吸收等方法去除氧气中的杂质,提高氧气纯度, 以满足反应要求。
原料预处理方法
乙烯预处理
包括脱水、脱硫、脱碳等步骤,以去除乙烯中的水分、硫化物和二氧化碳等杂质,防止对催化剂和反 应产生不良影响。
资源利用效率。
自动化控制策略
自动化仪表
采用高精度、高稳定性的 自动化仪表,实现反应温 度、压力、流量等关键参 数的实时监测和控制。
DCS控制系统
利用DCS控制系统对生产过 程进行集中监控和管理,实 现生产过程的自动化、智能 化和远程化控制。
安全联锁装置
设置安全联锁装置,确保 在异常情况下及时切断进 料、停机等操作,保障生 产安全。
原料配比
优化乙烯和氧气的配比, 确保反应物充分接触,提 高反应效率和产物纯度。
节能减排技术应用
余热回收
01
利用反应过程中产生的余热,通过热交换器等设备回收热能,
用于预热原料或生产蒸汽等,降低能源消耗。
废气处理
02
对生产过程中产生的废气进行处理,减少有害气体的排放,保
护环境。
节水措施
03
采用先进的节水技术和设备,减少生产过程中的水耗,提高水
质量评价指标体系建立
外观指标
包括产品的颜色、状态等,应符合相关标准 规定。
纯度指标
环氧乙烷的纯度应达到一定标准,以满足不 同应用领域的需求。
有害杂质指标
对生产过程中可能产生的有害杂质进行严格 控制,确保产品安全环保。
稳定性指标
产品在储存和运输过程中应保持稳定,避免 发生化学反应导致质量变化。
科技成果——乙烯氧化生产环氧乙烷高性能银催化剂技术

科技成果——乙烯氧化生产环氧乙烷高性能银催化剂技术技术类别减碳技术适用范围石油化工行业环氧乙烷/乙二醇生产领域行业现状环氧乙烷/乙二醇(EO/EG)是第二大乙烯衍生物,是用途广泛的大宗石油化工产品,在国民经济中占有重要地位。
工业生产中,乙烯和氧气在银催化剂作用下发生氧化反应生产环氧乙烷,再由环氧乙烷水解生产乙二醇。
目前我国EO/EG生产企业约有37家,产能约600万吨/年。
乙烯成本占环氧乙烷生产成本的70%以上,乙烯价格随着原油价格的升高而升高,为降低生产成本,提高竞争力,企业都采用高性能银催化剂以提高环氧乙烷产率。
高性能银催化剂主要包括高选择性银催化剂和中等选择性银催化剂,目前国产高性能银催化剂综合性能达到国际先进水平,但是国内市场占有率仅12%,具有很大的推广潜力。
成果简介1、技术原理在银催化剂作用下,乙烯和氧气发生氧化反应,主反应生成环氧乙烷,副反应生成二氧化碳和水,随着银催化剂选择性的提高,消耗同样的乙烯,生成环氧乙烷的量越多,生成CO2的量越少。
在装置产能不变的前提下,提高催化剂的选择性,不仅可以节约一定量的乙烯,提高原料的转化率,有效降低企业生产成本,同时可减少生产过程中CO2生成,实现温室气体减排。
2、关键技术(1)新型载体制备技术优化载体制备配方,改善载体孔分布,制备出比表面提高50%以上的新型载体,提高了高性能银催化剂稳定性,满足工业使用要求;(2)高性能银催化剂制备技术通过添加助剂调节催化剂表面电子效应和微观化学环境,提高催化剂的选择性。
采用新型载体,优化催化剂组成和制备工艺,成功开发出选择性比传统银催化剂高7%的高选择性银催化剂;(3)发挥催化剂最佳性能工艺优化技术通过优化反应器入口乙烯、氧气、二氧化碳浓度和调节剂浓度,确定发挥催化剂最佳性能的工艺条件技术,实现装置长周期稳定运行。
3、工艺流程乙烯氧化生产环氧乙烷工艺示意图见图1。
图1 乙烯氧化制环氧乙烷工艺示意图主要技术指标1、高选择性银催化剂最高选择性在89%以上,三年平均选择性87%,比传统催化剂提高约7%;2、中等选择性银催化剂最高选择性在86%以上,三年平均选择性82.7%,比传统催化剂提高2.7%。
乙烯氧气氧化制环氧乙烷工艺流程

乙烯氧气氧化制环氧乙烷工艺流程下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!乙烯氧气氧化制环氧乙烷工艺流程1. 引言环氧乙烷是一种重要的有机化工产品,在化工工业中有着广泛的应用。
乙烯催化氧化制备环氧乙烷解读课件

乙烯催化氧化制备环氧乙烷的技术现状
目前,乙烯催化氧化制备环氧乙烷的主 要技术是采用催化剂和反应器,通过控 制反应温度、压力和物料流量等参数实
现高效、低能耗的环氧乙烷生产。
催化剂是乙烯催化氧化制备环氧乙烷的 关键因素,目前主要采用贵金属催化剂 如铂、钯等,同时也有一些非贵金属催
化剂的研究和应用。
反应器是乙烯催化氧化制备环氧乙烷的 重要设备,目前主要采用固定床反应器
06
实验与操作注意事项
实验前的准备与安全须知
实验材料准备
确保乙烯、催化剂、氧 化剂等材料齐备且质量
合格。
实验设备检查
对反应釜、管道、阀门 等设备进行全面检查,
确保无泄漏或故障。
安全防护措施
佩戴实验服、化学防护 眼镜和化学防护手套, 确保实验操作区域通风
良好。
应急处理用品
准备急救箱、灭火器等 应急处理用品,并熟悉
停留时间
原料在反应器内的停留时 间影响反应深度和产物分 布。
工艺流程与设备对生产效率的影响
工艺流程设计
合理的工艺流程可以提高生产效 率和安全性。
设备材质与结构
设备的耐高温、耐腐蚀性能以及 结构合理性对生产效率和产品质量 有重要影响。
自动化水平
自动化程度越高,生产效率越高, 同时降低人工操作失误的风险。
和流化床反应器等类型。
技术发展趋势与展望
随着环保意识的提高和能源消耗的增加,乙烯催化氧化制备环氧乙烷技 术需要不断改进和优化,以实现更加高效、环保、节能的生产。
新型催化剂的研究和应用是乙烯催化氧化制备环氧乙烷技术的重要发展 方向,未来需要加强新型催化剂的研发和应用,以提高生产效率和降低
能耗。
开发新型反应器也是乙烯催化氧化制备环氧乙烷技术的重要方向,新型 反应器可以提高反应速度和产物收率,同时降低副产物的生成。
乙烯催化氧化制备环氧乙烷解读
▪ 下面介绍的是苏联学者М.И.乔姆金和Η.Β. 库利科夫提出的动力学方程式。他们认为
在催化剂表面上乙烯氧化生成环氧乙烷和 乙烯深度氧化为CO2和水的活性中心是同 一氧化物,即Ag2(S)O2。由此提出的 反应机理如下:
乙醛为中间产物,它氧化生成CO2和水。
Ag(S)表示银的表面化合物,Z表示Ag2(S)O,ZO表示 Ag2(S)O2。
kJ/mol)。 O2+4Ag(非邻近)→2O2-(吸附)+4Ag+(邻近)
②乙烯与吸附氧之间的相互作用。乙烯与吸附态原子 氧离子作用强烈,放出大量反应热,产物是二氧化碳和 水,只有吸附态的分子氧离子才能与乙烯发生环氧化,
③氯有较高的吸附热,它能优先占领银表面的强吸附中 心,从而大大减少吸附态原子氧离子的生成,抑制了深 度氧化反应。当银表面有四分之一被氯适宜遮盖时, 深度氧化反应几乎完全不会发生。因此在生产中,在 适宜温度下,加适量氯,银催化剂表面的第一种吸附状 态将被完全抑制,第三种吸附态因吸附活化能很高,也 可以忽略。这样乙烯便只与吸附态的分子氧离子进 行选择性氧化:
氧气氧化法 选择性高 乙烯单耗低 规模大
工艺构成 催化氧化反应 环氧乙烷分离与精制
注意点 安全性的保障 移热 反应气体的混合
7 工艺流程说明
工艺生产的几个要点- 安全性的保障(爆炸极限、反应气体混合) 生产经济性的保障(选择性、能量利用率)
a 原料、产品的爆炸极限
物质 乙烯
空气中 爆炸下限
(%,v/v)
解离吸附,氧分子双键均裂,形成原子氧离子: O2+4Ag(邻近)→2O2-(吸附)+4Ag+(邻近) (原子氧离子)
当银表面缺乏四个邻近的清洁银原子时,氧分子就难吸附上去(吸附活化 能约33.02 kJ/mol)而且不发生氧分子的解离: O2+Ag→ O2-(吸附) + Ag+ (分子氧离子)
乙烯氧化法

乙烯氧化法摘要:1.乙烯氧化法的原理2.乙烯氧化法的工艺流程3.乙烯氧化法的应用领域4.乙烯氧化法的优缺点5.我国乙烯氧化法的发展现状与展望正文:乙烯氧化法是一种重要的有机化学反应,广泛应用于高分子材料、医药、农药等领域。
乙烯氧化法主要是通过将乙烯气体催化氧化生成高价值产品,其中最具代表性的是聚乙烯醇(PVAL)和环氧乙烷(EO)。
一、乙烯氧化法的原理乙烯氧化法是指将乙烯气体在催化剂的作用下,与氧气进行催化氧化反应,生成乙烯醇、乙醛、环氧乙烷等产物。
其中,环氧乙烷是乙烯氧化法的主要目标产物,它具有广泛的应用前景。
二、乙烯氧化法的工艺流程乙烯氧化法的工艺流程主要包括三个步骤:1.乙烯气体的制备:通过石油裂解、煤化工等方法获得乙烯气体。
2.催化氧化反应:将乙烯气体与氧气混合,在催化剂的作用下进行催化氧化反应。
催化剂一般采用贵金属,如铂、钯等。
3.产物的分离与提纯:将反应生成的混合物进行分离和提纯,得到目标产物。
三、乙烯氧化法的应用领域乙烯氧化法生成的环氧乙烷广泛应用于以下几个领域:1.化工领域:环氧乙烷是制造聚醚、聚酯、环氧树脂等高分子材料的重要原料。
2.医药领域:环氧乙烷用于生产抗生素、激素等药物。
3.农药领域:环氧乙烷用于生产农用化学品,如除草剂、杀虫剂等。
四、乙烯氧化法的优缺点优点:1.乙烯氧化法反应条件温和,易于控制。
2.催化剂量较少,成本较低。
3.产物纯度高,易于分离和提纯。
缺点:1.反应过程中会产生副产物,影响产率。
2.催化剂活性较高,容易导致设备腐蚀。
五、我国乙烯氧化法的发展现状与展望近年来,我国乙烯氧化法技术取得了显著进展,产能不断扩大。
然而,与国外先进水平相比,我国在乙烯氧化法的催化剂、反应工艺等方面仍有一定差距。
未来,我国乙烯氧化法发展应着力于以下几个方面:1.研发高效、耐腐蚀的催化剂,提高催化氧化反应的效率。
2.优化工艺流程,降低能耗和污染。
3.开发新型环氧乙烷衍生物,拓展应用领域。
乙烯氧化法生产环氧乙烷

编号:No.22课题:乙烯氧化法生产环氧乙烷授课内容:●乙烯氧化法生产环氧乙烷反应原理●乙烯氧化法生产环氧乙烷工艺流程知识目标:●了解环氧乙烷物理及化学性质、用途、生产方法●掌握乙烯氧化法生产环氧乙烷反应原理●掌握乙烯氧化法生产环氧乙烷工艺流程能力目标:●分析影响反应过程的主要因素●分析和判断工艺流程特点思考与练习:●乙烯氧化法生产环氧乙烷反应催化剂组成和特点●影响乙烯氧化法生产环氧乙烷反应过程的主要因素●乙烯氧化法生产环氧乙烷工艺流程的构成授课班级:授课时间:年月日第六章乙烯系产品的生产乙烯是碳原子数最少的烯烃,由于它具有极其活泼的双键结构,因而其反应能力很强,且成本低、纯度高、易于加工利用,所以是有机化工中最重要的基本原料。
通过乙烯的聚合、氧化、卤化、烷基化、水合、羰基化、齐聚等反应的实现,可以得到一系列极有价值的乙烯衍生物,如环氧乙烷、乙二醇、乙醛、醋酸、醋酸乙烯、乙苯、聚乙烯等,由乙烯出发还可生产溶剂、表面活性剂、增塑剂、合成洗涤剂、农药、医药等。
乙烯系主要合成产品及其用途如图6-1所示。
目前,乙烯的产量在各种有机产品中居首位。
就用途而言,乙烯最大的消费是塑料工业,其中尤以聚乙烯所需乙烯量最大,乙烯的其它消费依次为环氧乙烷、乙苯、乙醛、乙醇,还有醋酸乙烯、α-烯烃、卤代烷等。
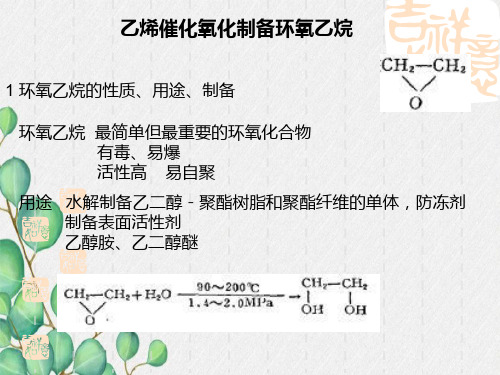
第一节乙烯直接氧化法生产环氧乙烷一、概述1.环氧乙烷的性质和用途环氧乙烷(EO)又叫氧化乙烯。
它是无色易挥发的具有醚类香味的液体,能与水、醇、醚及其它有机溶剂以任意比例互溶。
沸点 10.5℃, 熔点 -111.3℃, 燃点 429℃。
环氧乙烷能与空气形成爆炸性混合物,其爆炸范围为 3.6~80%(体积)。
环氧乙烷有毒,如停留于环氧乙烷蒸气的环境中10min,会引起剧烈的头痛、眩晕、呼吸困难、心脏活动障碍等,接触液体E0会被灼伤,尤其是40~80%的EO水溶液,较其它浓度的EO水溶液能更快地引起严重的灼伤。
工作环境的空气中EO的允许浓度,美国职业防护与保健局(0SHA)1984年规定:8h的平均允许浓度为1ppm,废除了以前工作环境中最大允许浓度为50ppm的规定。
乙烯催化氧化制备环氧乙烷解读

N2为致稳气时 C2H4的浓度 20% CH4为致稳气时 C2H4的浓度 25%
O2的浓度 7% O2的浓度 8%
d 反应选择性的提高 采用高选择性的催化剂; 采用抑制剂二氯乙烷-抑制副反应的发生
抑制剂的加入方法 N2为致稳气-用中压氮气稀释抑制剂并做载气 CH4为致稳气-用C2H4稀释,用中压氮气做载气
空速大,物料在催化剂床层停留时间短,若属表面反应控制,则转化 率降低,选择性提高。反之,则转化率提高,选择性降低。适宜的空 速与催化剂有关,应由生产实践确定。对空气氧化法而言,工业上主 反应器空速一般取7000 h-1左右,此时的单程转化率在30%~35% 之间,选择性可达65%~75%。对氧气氧化法而言,空速为5500~ 7000 h-1,此时的单程转化率在15%左右,选择性大于80%。
3.45
b 原料气的混合方法 将原料气(新鲜C2H4, 循环C2H4)和致稳气(稀释气-N2或CH4)先行
混合,然后采用多孔喷射器对着混合气流的下游将氧高速度喷入
第19页/共21页
c 采用致稳气(稀释气) 采用氧作为氧化剂时,为使反应不致太过剧烈,需控制乙烯和
氧的浓度-采用致稳气(稀释气)
常用的致稳气-氮气、CH4 CH4的导热性高,CH4存在时还可提高O2的爆炸极限
作者根据上述反应机理,导出了以载于浮石上的银为催化剂,以氯 为助催化剂的反应动力学方程:
第12页/共21页
式中:
第13页/共21页
影响因素
温度 温度过高 反应速度快、转化率高、选择性下降、 催化剂活性衰退快、易造成飞温
温度过低 速度慢、生产能力小 适宜温度 220-260℃
第14页/共21页
• 空速 影响较温度的影响低,适宜
乙烯生成环氧乙烷的反应类型

乙烯生成环氧乙烷的反应是一个氧化反应,属于部分氧化反应。
具体来说,乙烯与过氧化氢(H2O2)在催化剂存在下进行反应生成环氧乙烷。
常见的催化剂包括过硫酸盐和过氧化钙等。
乙烯生成环氧乙烷的反应方程式如下:
CH2=CH2 + H2O2 →CH2OCH2 + H2O
这个反应发生在高温和高压条件下,常常在工业上进行。
环氧乙烷是一种重要的化学原料,在各种化工和合成材料的生产中有广泛应用,用于合成树脂、溶剂、表面涂层等。
需要注意的是,由于这个反应过程具有一定的危险性(可能形成爆炸性的环境),在工业生产中需要严格控制操作条件和安全措施。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化工过程及设备课程设计(本)
题目乙烯氧化生产环氧乙烷的过程与系统课程设计
班级10工艺2班
学号201041511246、201041511247、201041511245
学生姓名王少平潘树灿何东宝
组长
组员王少平潘树灿何东宝
指导教师黄卫清、廖文波
完成日期 2013年12月
乙烯氧化生产环氧乙烷的过程与系统课程设计
环氧乙烷的主要生产方法有氯醇法和直接氧化法两种, 其中直接氧化法又分为空气氧化法和氧气氧化法, 现在以空气氧化法为例对乙烯氧化生产环氧乙烷的过程进行物料和热量衡算。
一、课程设计要求及原始数据
进塔气(A)组成:10%C2H4、90%空气(其中79%N2、21%O2)
乙烯(C2H4)的转化率为:25%
环氧乙烷(C2H4O)的收率为:80%
氧化反应器进口温度为2270C,出口温度为277 0C
热损失为总热量的5%
要求:(1) 对乙烯氧化生产环氧乙烷的过程进行物料衡算
(2)计算为稳定生产需要移走的热量
(3)计算利用这些热量可产生多少饱和水蒸气
(4)列出物料衡算表和热量衡算表
(5)进行项目经济性评估
二、乙烯氧化生产环氧乙烷的物料衡算
(1)首先写出化学反应方程式:
CH
2=CH
2
+3O
2
→2CO
2
+2H
2
O
(2)画出反应过程示意图
(3)以进塔气1000mol/h为计算基准进行各组分计算
C2H4: 0.1×1000mol/h=100mol/h
O2: 0.9×0.21×1000mol/h=189mol/h
N2: 0.9×0.79×1000mol/h=711 mol/h
因为C2H4的转化率为25%,则发生反应的C2H4的量为:
0.25×100mol/h=25mol/h
出塔气中,C 2H 4的出料量=(100-25)mol/h=75mol/h
由于进塔气和出塔气中,N 2的物质的量是不变的,为711mol/h ,而环氧乙烷(C 2H 4O )的收率为:80%,即:
(产物中C 2H 4O 的物质的量/原料C 2H 4O 反应的物质的量)×100%=80%,所以 产物中C 2H 4O 的出料量=0.8×25mol/h=20mol/h
对C 元素进行物料衡算,可算得出料口中CO 2 的出料量 =10mol/h 同理可得C 2H 4出料量=10mol/h O 2出料量=164mol/h (4)列出物料衡算表
乙烯氧化生产环氧乙烷过程的物料衡算
三、乙烯氧化生产环氧乙烷的热量衡算
已知氧化反应器进口温度为227C ,出口温度为277C
热损失为总热量的5% (1)首先写出化学反应方程式:
CH 2=CH 2+3O 2→2CO 2+2H 2O
(2) 查出相关物质的等压摩尔热容(反应温度下的平均等压摩尔热容Cp)和标准生成热(△H ○一
298)数据,见表。
相关物质的热力学数据
(3)按照下列途径计算过程热量,见图.
△H 1
△H 1 为原料气由500K 到298K 的焓变,△H 2为298K 状态下的反应热,△H 3为原料气由298K 到550K 的焓变:
△H=△H 1+△H 2+△H 3
具体计算:
△H 1= ƩnMF ,I C pMF,I ×△T
= (0.046×100+0.031×189+0.029×711) ×1000×(298-500) = -6.2×106
(KJ/h )
△H 2 = Ʃ(n RP,i —n MF,i ) △H i
= [(75-100)×52.28+(20-0)×(-51.04)+(10-0)×(-393.51)+(10-0)
×(-241.83)]
=-8.68×106(KJ/h)
△H3 = Ʃ n RP,i c pRP,i×△T
= (75×0.046+20×0.053+164×0.031+711×0.029+10×0.041+10×0.034)×1000×(550-298)
=7.8×106(KJ/h)
△H=△H1+△H2+△H3= -6.2×106 -8.68×106 + 7.8×106
=-7.08×106(KJ/h)
需要移走的热量Q移=△H-Q损=(1-0.05)×7.08×106=6.726×106(KJ/h)
查得2.0Mpa饱和水蒸气的温度=211.4℃,蒸发热△H蒸发=34.1(KJ/mol)
利用此热量可产生的饱和水蒸气=(6.726×106/34.1) ×(18/1000)= 3550.38 (KJ/h)
值得注意的是:只是指饱和热水也是211.4℃状态下可产生的饱和水蒸汽,如水的温度小于此值,则产生的饱和水蒸气量会小于计算值。
(4)列出热量衡算表
乙烯氧化生产环氧乙烷过程的热量衡算
四、乙烯氧化生产环氧乙烷过程的经济性评估。
