元素2
元素第二课时教案

课题2元素(第二课时)教案课题分析:在仔细研读《全日制义务教育化学课程标准(实验稿)》的基础上,对于每一个内容标准的模块仔细分析,元素处于一级标题物质构成的奥秘中的二级标题认识化学元素中,该主题旨在通过认识一些与人类关系密切的常见元素的学习,拉近学生学习化学与生活之间的距离。
教学目标⑴知识与技能目标①能认识碳、氢、氧、氮等与人类关系密切的常见元素;②能记住一些常见元素的名称和符号;③知道元素的简单分类;④能根据原子序数在元素周期表中找到指定的元素;⑤形成“化学变化过程中元素不变”的观念。
⑵过程与方法目标①体验微观想象、分析、讨论、对比的学习过程;⑶情感态度价值观目标①会逐步地增强科学的物质观,增进对物质的宏观组成与微观结构的认识;②逐步积累化学用语,真正进入一个化学世界。
教学重、难点元素的概念、元素符号的书写与意义。
教学方法探究讨论法教学材料教材,教辅,黑板,粉笔。
教学过程《元素》教学过程设计(第二课时D板书设计(第二课时)二.元素符号1.元素符号的写法:采用拉丁文一大二小(第一个字母大写,第二个字母小写);2.元素符号的读法:3.元素符号的涵义:①表示一种元素;②表示该元素的一个原子。
记忆:氢氧锂镀硼,碳氮氧氟敏钠镁铝硅磷,硫氯氤钾钙三.元素周期表简介1周期:(电子层数)每一横行叫一周期,共7个周期。
2.族:每一纵行叫一族(其中8、9、10三纵行共成一族)3.元素周期表的起始:金属一►非金属一A稀有气体4.原子序数原子序数=核电荷数=核内质子数=核外电子数.。
表示元素的符号2

6、请根据两种不同的方法将下列8种元素进行分类, 并说明你的分类依据: H He C N O Na Mg Al
Na Mg AlSiPSCl
Ar
2、用元素符号表示1个碳原子、3个单原子、2个钙原子。
C
3、符号S代表什么意义? 表示硫元素或一个硫原子。
3N
2Ca
4、下列符号中能够表示某种元素的是( D ) (A)H2 (B)2S (C)2O2 (D)N 5、用符号表示: 氧元素 O 5个碳原子 5C 1个氢原子 H m个铜原子 m Cu
元素周期表对我们的意义有哪些?
哲学上: 说明世间万物都是有联系的; 自然科学:指导新物质的合成,预测新物质的性质 生产上:指导在一定区域内寻找新物质(农药所 含元素的确定,半导体材料的选择,催 化剂的选择,特殊合金材料的选取等)
1、不看周期表,写出核电荷数从1—18号元素的元素 符号 H Li Be B C N O F He Ne
第5节 表示元素的符号
已知的元素 有110多种
科学 有序 排列
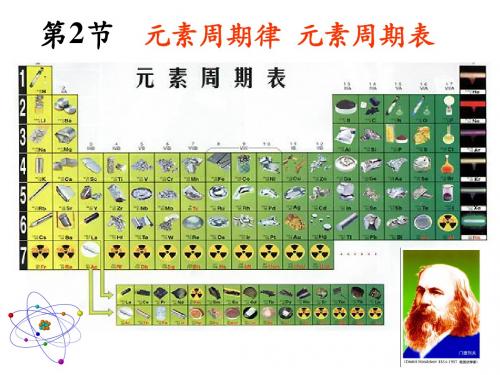
元素周期表
三、元素周期表 1、发展历史
2、结构特点
7个横行,每一横行叫做一个周期,一共有7个周期。 18个列,每纵行叫做族。同族各元素的化学性质相似。
金属元素主要分布在元素周期表的左边。 非金属元素主要分布在元素周期表的右边。 稀有气体元素分布在元素周期表的最后一族。 原子序数:元素周期表按元素原子核电荷数递增的顺序给元素编的号. 原子序数与原子核电荷数在数值上相同。
3、作用:
查找:元素符号,相对原子质量等。
推测:元素的性质,新元素等。
练习:说说下列符号的意义
8
O
氧 16.00
8---原子序数(质子数) O---元素符号 氧---元素名称 16.00---相对原子质量
3.3.2 元素符号 元素周期表 (2)

(2)按要求写出下列符号: ①氢元素____H____; ②2个铜原子__2_C__u___; ③氦气___H__e___; ④地壳中含量最多的元素____O____; ⑤空气中含量最多的元素____N____。
(3)指出下列符号的意义: ①O:_氧__元__素__,__一__个__氧__原__子_____________; ②3P:_三__个___磷__原__子___________________; ③Fe:_铁__元__素__,__一__个__铁__原__子__,__金__属__铁____; ④5Cu:五__个__铜__原__子___________________。
1 知识小结
元
书写
“一大二小”
素
符
意义
宏观意义:表示一种元素 微观意义:表示这种元素的一个原子
号
元素周期表简介
元素周期表简介
原子序数 (核电荷数)
18 Ar 氩
39.95
元素符号 元素名称 相对原子质量
2 易错小结
10 (1)下面是一次练习中,王老师收集的一些错误符号, 请你将其改正过来: 钙 CA 镁 mg 汞 Ag 铝 Cl 氖 Ni _钙__C_a____镁__M__g___汞__H__g____铝__A_l___氖__N__e_____。
知1-讲
【例1】下列元素名称与其对应的元素符号完全正确的是 ( C)
A.氯cl C.镁Mg
B.氖Na D.铜Ca
导引:氯的元素符号应为Cl, 氖的元素符号为Ne, 镁的元素符号为Mg, 铜的元素符号为Cu。
知1-讲
总结
知1-讲
书写元素符号时一定要书写规范,大小写要分清, 特别是用两个字母表示的,注意“一大二小”,同时 还应注意元素名称中的偏旁部首,如“碳”不能写成 “炭”,“锰”不能写成“猛”,“汞”不能写成 “贡”等。
元素周期表 (2)

探秘元素周期表
探秘元素周期表
6C 碳
12.01
3 Li 锂
6.941
13 Al 铝
26.98
17 Cl 氯
10 Ne 氖
35.45
7N 氮
14.01
16 S 硫
32.07
9F 氟
19.00
20.18
1H 氢
1.008
8O 氧
16.00
2 He
氦 18 Ar
4.003
互动百科: 据悉,近来俄国科学家宣布他们找到了元 素周期表上的第119号元素,符号是Une.
如果真有119号元素,在元素周期表中它的位置可能会在哪儿?
它的结构及性质的相关信息你又能推测出多少?
组内合作:制作1-18号元素的“名片”
总结提升
得失电子
构成
离子
原子
分子
构 成
元素 组成
构成
物质
知识网络图
这一点对你现在的学习或生活有哪些启示?
探索永无止境 元素组成物质
分类可使事物更有序、简约,提高研究效率
物质
物质 种类
纯净物
元素 种类
单质 化合物
混合物 请按照自己喜欢的标准给下列物质分类?
水 H2O 氧气 O2 一氧化碳 CO 金刚石 C 甲烷 CH4 氢气 H2 二氧化碳 CO2
想想前面的学习中,哪些化学知识也用到了分类的方法?
氩
39.95
15 P 磷
4 Be 铍
9.012
30.97
5 B 11 Na
硼
钠
10.81
22.99
14 Si 硅
28.09
1-2 元素周期律和周期表
性质
Na
Mg
Al
单质与水(或酸) 的反应情况
与冷水反应缓慢,与沸 与冷水剧烈反 与酸迅速反应放 水迅速反应,放出氢气, 应放出氢气 出氢气 与酸剧烈反应放出氢气
最高价氧化物对应 水化物的碱性强弱
NaOH 强碱
Mg(OH)2 中强碱
Al(OH)3 两性氢氧化物
金属性的强弱: Na > Mg > Al
内容 原子半径 电子层结构 失电子能力 得电子能力 金属性非金属性 主要化合价 同周期(从左到右) 同主族(从上到下) 大→小 电子层数相同、 最外层电子增多 逐渐减小 逐渐增大 小→大 电子层增多最外层 电子数相同 逐渐增大 逐渐减小
金属性减、非金属性增 金属性增、非金属性减
最高正价+1→+7 最高价氧化物对应的 碱性逐渐减弱 水化物酸碱性 酸性逐渐增强 形成:难→易 非金属元素气态氢 化物的形成与稳定性 稳定性:弱→强
元素性质呈周期性变化
归纳出
原子半径 大→小 (稀有气体元素突然增大)
化合价:+1→+7 -4→-1 (稀有气体元素为零)
元素周期律
3.微粒半径大小的判断规律 一层、二核、三电子
影响 半径 大小 的因素
①电子层数: 电子层数越多,原子半径越大 ②核电荷数: 当电子层数相同时核电荷数增多,使原子 半径有减小的趋向。 ③核外电子数: 电子数增多,增加了相互排斥,使原子 半径有增大的倾向。
最高正价=族系数 碱性逐渐增强 酸性逐渐减弱
形成:易→难 稳定性:强→弱
非金属性逐渐增强
ⅠA ⅡA
ⅢA ⅣA ⅤA
ⅥA ⅦA
0
1
2 3 4 5 6 7
金属性逐渐增强 金 属 性 逐 渐 增 强
元素周期表1-1-2

CE
)
A、最外层都只有一个电子,在化学反应中
容易失去;
B、都是强还原剂; C、都能在O2里燃烧生成过氧化物; D、都能与水反应生成碱; E、 密度都较小,都能浮在水面上。
★碱金属元素除了单质的性质具有相似性和递变 性外,其化合物的性质也具有相似性和递变性。
[思考]根据规律推测:
2NaHCO3 == Na2CO3 + H2O + CO2↑ 2KHCO3 == K2CO3 + H2O + CO2↑ 2Na2O2 + 2CO2 = 2Na2CO3 + O2 2K2O2 + 2CO2 = 2K2CO3 + O2
必修二
第一章 物质结构 元素周期律 第二节 碱金属元素
1、碱金属元素原子结构特点元素名称填写下表
最外层
电子数
元素
符号
核电
荷数
原子结构
示意图
+3
电子
层数
原子半
径/nm
碱 锂 金 属 元 钠
Li
3
2 1
2 8 1
1
1
2
3 4
0.152 0.186
Na 11
K
+11
钾
19
+19
2 8 8 1 2 8 18 8 1 2 8 18 18 8 1
配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列
图像能正确表示加入盐酸的体积和生成CO2的物质的 量的关系的是( C )。
[解析]此题考查了元素化合物、图像数据的处理知 识。向NaOH和Na2CO3混合溶液中滴加盐酸时, 首先和NaOH反应生成水和氯化钠,当滴入0.1L 时,两者恰好反应完全;继续滴加时,盐酸和 Na2CO3开始反应,首先发生:HCl+ Na2CO3= NaHCO3+NaCl,不放出气体,当再加入0.1L时, 此步反应进行完全;继续滴加时,发生反应: NaHCO3+HCl =NaCl+H2O+CO2↑;此时开始放 出气体,分析图像,可知选C。
第1-5节 表示元素的符号(2)

短周期
,
4、5、6、7
周
期称为长周期,第 称为不完全周期,因为
三个短周期、四个长周期(包括一个不完全周期)。
【课堂练习1】请大家根据元素周期表,完成下表内容。 类别 周期序 数 1 2 3 4 5 6 7 起止元 包括元素 核外电子层 素 种数 数 2 1 H—He 8 Li—Ne 2 8 Na—Ar 3 18 4 K—Kr 5 Rb—Xe 18 6 32 Cs—Rn Fr—112 26 7 号
2、不能作为元素周期表中元素排列顺 序的依据的是( D ) A.原子的核电荷数 B.原子的核外电子数 C.原子的质子数 D.原子的中子数
3、请仔细观察元素周期表,你可以发现 七 七 其中有_____个横行,也即有____个周期, 短周期指 一二三 周期,长周期 四五六七 周 十八 期。元素周期表有______个纵行,分为十六 ___ 一 七 七 个族,其中____个主族,___个副族,___个 一 第Ⅷ族,____个0族,0族即是 稀有气体 元 素。由短周期和长周期共同构成的 族 主族和零族 。
【课堂练习4 】 1、下表是元素周期表的一部分,数字是该元素的原子序 数,请填出其同主族下一周期元素X、Y的原子序数:
11 X 19 …… …….
17 Y 35
2. 甲、乙是周期表中同一主族中相邻的两种元素,
若甲的原子序数为x,则乙的原子序数不可能为
( B ) A. x+2 B. x+4 C. x+8 D. x+18
5.零族元素都是什么种类的元素?
6.碱金属元素位于哪一族?第ⅦA元素又称之为什 么元素?
【自主学习 】请同学们阅读教材P5,同时思考下面问题:
1.周期表中有多少个纵行?分为多少个族? 元素周期表有7个周期,16个族。每一个横行 叫作一个周期,每一个纵行叫作一个族。这7个周 期又可分成短周期(1、2、3)、长周期(4、5、 6)和不完全周期(7)。共有16个族,又分为7个 主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第 Ⅷ族,一个零族。
高中化学06氧族元素-2

)
) )
二、递变性
氧 族 元 素
2、化学性质
O S Se Te
与氢化合的难易程度( ( Te不直接化合) 反应剧烈程度逐渐( ) )
氢化物稳定性逐渐(
)
3、非金属性逐渐( ),单质的氧 化性逐渐( )。
二、递变性
氧 族 元 素
4、物理性质
O S Se Te
单质的熔、沸点逐渐( )。
C.能跟大多数金属直接化合
D.都能与氢气直接化合成氢化物
氧 族 元 素
下列物质的酸性强弱排列正确的是( C)
A.H2SO4 >HClO4>H2SO3
B.H2S> H2SO3>HCl
C. HClO4> H2SO4 >H2SO3
D.HF>HCl>H2S
密度逐渐(
)。
氧 族 元 素
氧族元素的非金属性与同周期 的卤族相比较怎样?
从周期表中的位置考虑 从原子结构角度考虑 从化学反应角度考虑
氧 族 元 素
下列化合物中,不能由组成该化合物的两 种元素的单质直接化合而成的是( A) A.CuS B.SO2 C.FeS D.Na2S
下列有关氧族元素的叙述不正确的是(BD ) A.随着原子序数递增,单质熔、沸点升高 B.都能形成+4和+6价化合物
氧 族 元 素
一、相似性
1、原子结构相似 2、化学性质相似 (1)氢化物:氧、硫、硒的单质可以 ( )与氢气化合生成( )。碲不 能与氢直接化合。 (2)氧化物及对应水化物:硫、硒、碲 均有( ),( )且均是酸酐。 (3)与大多数金属化合 Fe+O2 Fe+S
元素(第二课时)课件

拉丁文名称 Hydrogenium Carbonium Helium
元素符号
H
C
He
Calcium
Ca
元素符号可以表示哪些含义呢? 以氧元素符号—O为例。
课题3 元素
原子是微观概念 既讲种类,也讲个数
元素是宏观概念, 只讲种类,不讲个数
氧元素符号的含义
课题3 元素
【练习】
1.用符号填空:
碳元素__C___
注意: 1.元素符号前面数字不为1(如2C),只表示原子的个数; 2.某些元素符号,还可以表示 某种物质;
课题3 元素
如何用符号表示物质的呢?(以二氧化碳为例)
【历史史话】
贝采里乌斯在会议上,还建议用元
素符号表示物质的化学符号,并约
定一个元素符号代表一个原子。
..
C
CO2
CO2
道尔顿的化学符号
①物质的元素组成 ②分子的原子构成
科学家发现元素的种 类由质子数决定
第 门捷列夫
一 张 元 素 周 期 表
现
按照质子数(即核电荷数)
代
由小到大依次进行排列
元
素
周
期
原子序数
表
原子序数=核电荷数=质子数=电子数
课题3 元素
【元素周期表的结构】
1._七___个横行,_1_8__个纵行; 2._七___个周期,_1_6__个族;
所有的元素可分为哪几种类型?
课题3 元素 【练习】
二氧化碳的符号—CO2的含义有: 1.二氧化碳由___碳_元__素____和___氧__元__素___组成; 2.二氧化碳分子由___碳__原__子___和___氧__原__子___构成; 3.1个二氧化碳分子由__1_个_碳__原__子__和__2_个_氧__原__子__构成;
人教版九年级下册化学 元素1-2

5.元素只讲种类,用于描述物质的组成;而原子既讲种类, 也讲个数。通常用于描述分子的构成。
复习巩固
1.什么叫元素? 元素是质子数(即核电荷数)相同的一类原子
的总称; 2.一种元素与另一种元素最本质的区别是什么?
质子数不同或核电荷数不同。
Fe表示铁元素 H表示一个氢原子
例如:
“2H”表示:两个氢原子 “3C”表示:三个碳原子
Fe表示一个铁原子 要表示多个原子时,原子的数目 应写在元素符号的正前方。如要 表示两个氧原子,应写“2O”, 但此时该符号就不再表示元素概 念了,不能说成两个O元素,因 为元素只能讲种类,不能讲个数
拓展:由同种元素组成的纯净物叫做单质; 由不同种元素组成的纯净物叫做化合物。
4.“××山泉”饮用天然水上标明了各种矿物的成分,这里所
标的成分指的是() C
A.分子B.原子C.元素D.物质
学完本课题,你又知道了哪些化学知识?
1.元素是质子数(即核电荷数)相同的一类原子的总称。
2.在物质发生化学变化时,原子的种类不变,元素的种 类也不变。 3.自然界中,由一百多种元素组成的几千万种物质都是由 分子、原子或离子构成的。
元素周期表能提供元素的以下几方面信息:
1.原子序数—— 1 H ——3.元素符号 2.元素名称———— 氢氢
1.008 ———4.相对原子质量
5.可以根据元素名称知道属于哪类元素; (金属元素、非金属元素、稀有气体元素)
6.可以根据原子序数得出该元素的核电荷数、原子核内的 质子数以及该原子核外的电子数;
碳元素符号为C,铜元素符号为Cu,元素 符号为Cl,钙元素符号为Ca。
2.元素符号的书写原则:一大二小
元素符号2

元素符号
ቤተ መጻሕፍቲ ባይዱ习提问
一,分子与原子的关系 二,国际上相对原子质 量是如何规定的? 量是如何规定的?
几种碳原子
质子数 6 6 6 中子数 6 7 8
一,元素
1,概念:具有相同核电荷数(即质子数)的一类原子的总称. (说明:由于元素是一类原子的总称,所以它是宏观概念, 只讲种类,不讲个数 .用来描述物质的组成) 2、元素间的本质区别:核电核荷数或质子数不同 3,表示方法:元素符号 (1) 、元素符号的写法与读法: (2),元素符号表示的意义:表示一种元素,还表示该元素 一个原子. 如: C u 表示铜元素(宏观意义),表示一个铜原子 (微观意义). 2Cu ————表示两个铜原子(只有微观意义)
4,元素的分类: 金属元素:Na ,Mg,Fe,Zn-----非金属元素:O,C,H,S,P,-----稀有气体元素: He,Ne,Ar-----(见课本38页左上角) 5、元素的种类: 一百余种 6、元素在地壳中的含量:
氧、硅、铝、铁 O Si Al Fe
7、物质、元素、分子、原子、之间的关系 、物质、元素、分子、原子、
物质 组成
构 成 成
数 相 同
元素
构
子 质
宏观概念
只讲种类,不讲个数 只讲种类 不讲个数
分子
成
原子
观概念
讲种类, 讲种类 讲个数
: 分子 个
元素组成的. 元素 元素组成 原子 原子 成的. 原子 个 原子 成的.
原子
成的
分子 成的. 个 分子
练习题
1,一种元素与另一种元素的本质区别是:〈 〉 A,相对原子质量不同. B,核外电子数不同. C,核内质子数不同. D,中子数不同. 2,"H"表示的意义< > A,只表示氢元素. B,只表示一个氢原子 C,表示一个氢 元 D,既表示氢元素,又表示一个氢原子. 3,过氧化氢(H2 O2)是隐性眼镜的洗液 成份,下列说法 正确的 〈 〉 A,它由氢气和氧气组成 .B,它由氢元素和氧元素 组成. C,它由一个氢分子和一个氧分子构成. D,它由两个氢元素和两个氧元素构成.
《2 元素》课件

中文名称
氢 氧
拉丁文
Hydrogenous Oxygenium
元素符号
H O
碳 铜
Carbonium
Cuprum
C
Cu
注意:第一个字母大写,第二个字母小写。
在这一前提下应防止出现以下几种错误:
如:吸入的空气中含有氧气,氧气是由氧元素 组成的;水中含有氢元素、氧元素;吃的蔬菜中含有 铁元素,铁锈中也含有铁元素;海水中含有大量的钠 元素、镁元素,对绿色植物而言,镁元素是不可缺少 的……
关于元素,你还知道些什么?请你将你知道 的元素的情况填入下表中: 你熟悉的元素 含该元素的物质 该元素的作用
原子序数
13
16 26 80
对单质或化 元素名称、符号 合物的认识 铝是一种银白 铝、Al 色的金属 硫是一种黄色 硫、S 的固体 纯铁是一种银 铁、Fe 白色的金属
汞、Hg
俗称:水银
二、自然界中元素的存在
各种元素在自然界的含量一样吗?
不一样。有些元素含量多,有些元素含量少。 例如:在地壳里含量最多的是氧元素, 几乎占了整个地壳质量的一半,其次是硅, 依次是铝、铁等。
元素
人民生活水平提高了,饮食讲营养,对 于吃用的东西,人们总爱问一句:它的成分是什 么?目前,为健康劝人们补铁、补钙的广告随处 可见,这里所说的“铁”、“钙”指的是什么?
从古到今,人们一直在探索,世上万物最 基本的组成成分究竟有哪一些? 经过长期努力,人们终于知道了自然界千千万 万种物质总共是由100多种元素组成的(其中含有人 工合成的元素2柿、茄子、 土豆称为原子,蔬菜只可以论“种”,不可以论 “个”,而原子既可以论“种”,又可以论“个”。
wxy元素周期表2-2

6
Li
Na
K
Rb
Cs
增强 ; 元素金属性逐渐
单质还原性逐渐 增强 ; 单质与水或酸反应置换氢气越 易 ; 最高价氧化物对应水化物碱性越 强 ; 对应最高价阳离子氧化性越 弱 ;
7
元素的性质与原子结构
同族元素的化学性质变化情况: 卤素: 同一主族,从上到下,随着核电荷数 增加 ,
电子层数逐渐 增多 ,原子半径逐 渐 增大 ,原子核对最外层电子的引力逐
21
慧眼识珠:
原子
1H 2H 3H
质子数 1
中子数
0 1
名称
氕 氘 氚
俗名
普氢 重氢 超重氢
或D
1 1
或T
2
以上三个原子有何不同? 它们是质子数相同的同种元素,但中子
数不同,又是不同种原子。
22
基本概念:
一定数目质子和一定数目的中子的一种原子,叫核素。 质子数相同,中子数不同的同一元素的不同原子 间,互称同位素。
24
⑷ 同种元素的不同的同位素原子也可 组成不同的单质或化合物的分子。 如: 氢: 氕、 氘、 氚 氢 重氢 超重氢 元素符号: H H H 2H 3H 原子符号: 11H 1 1 H D T 单质: H2、 D2 、 T2、HD、HT、DT 与氧化合成水: H2O、D2O、T2O、HDO、DTO、HTO
e-
2+ 2
e-
电子
10
知识重现:
核外电子
原子 质子 原子核 中子
核电荷数=核内质子数=核外电子数
11
1个质子带一个单位正电荷 中子不带电 1个电子带一个单位负电荷
12
构成原子的 粒子
电子
原子核
质子 中子
元素 元素符号2

§3-2 元素元素符号(第二课时)——物质的分类1.水是 ---------------------------------------------------------------------()①单质②化合物③纯净物④混合物A.①②B.②③C.③④D.①②2.下列物质中属于化合物的是--------------------------------------------------()A.空气B.河水C.冰D.红磷3.美国和日本的三位科学家以导电有机高分子材料的研究成果荣获2000年度诺贝尔化学奖,在其相关技术中用碘来掺杂聚合物,使其导电能力增强107倍,具有金属般的导电能力。
碘(I2)属于-----------------------------------------------------------------------------------------------------------()A.金属单质B.非金属单质C.化合物D.混合物4.下列各组物质中,前一种是纯净物,后一种是混合物的是-------------------------------------()A、水、海水B、氧气、液态氧C、铁、四氧化三铁D、氯酸钾、水银5.下列说法中正确的是------------------------------------------------------------------------------------()A.空气是一种单质B.空气是一种化合物C.空气是几种元素的混合物D.空气是几种单质和几种化合物的混合物6.下列关于二氧化碳的叙述,其中正确的是---------------------------------------------------------()A.二氧化碳由碳元素和氧元素组成B.二氧化碳由二氧化碳分子构成C.每个二氧化碳分子中含有一个碳原子和两个氧原子D二氧化碳分子是由碳和氧气组成的7.据有关资料介绍,儿童缺钙会得佝偻病,成年人缺钙会得软骨病;血液中也有少量钙,它对皮肤伤口处血液的凝固起着重要作用。
元素化学2012副族元素 (2)

第一过渡系第四周期Sc~Zn;
第二过渡系第五周期Y~Cd;
第三过渡系第六周期La(Lu)~Hg;
在自然界储量以第一过渡系较多。过渡金属是金属元素
性质最丰富多彩的:如硬度最大的Cr、熔点最高的W、熔点
最低的Hg、导电性最好的Ag、延展性最好的Au、密度最大的
Os、最耐酸的Ta等等。
6/4/2019
元素 化学
1
过渡元素的原¹ý子¶É 半Ôª ËØ径Ô × Ó ° ë ¾¶
Ô Ó×ë°¶¾ /pm
200
第一过渡系
同第
190
族 二、
180 170 160 150 140 130 120 110 100
20
第二过渡系 第三过渡系
从三 上过 到渡 下系 原基 子本 半接 径近 30 略
Sc Ti V Cr Mn Fe Co Ni Cu(●-●) Y Zr Nb Mo Tc Ru Rh Pd Ag(■-■)
d 区元素所有以上特征在不同程度上
与价层d 电子的存在有关,因而有人将d区
元素的化学归结为d 电子的化学。
6/4/2019
元素 化学
5
2.钛分族
(1) 概述 本族特征氧化态 +4
四川攀枝花钒钛铁矿(FeTiO3)探明 储量约15亿吨。钛是未来的钢铁:质轻, 抗腐蚀,硬度大,是宇航、航海、化工 设备等的理想材料。
+2 +2 +2 +2 +2
+3 +3 +3 +3 +3
+4
+4 +4
+5
+6 +6 +6
+7
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫 + 氧气
点燃
二氧化硫
(S) (O2) (SO2) 反应物跟生成物相比较,分子是否 发生了变化?元素是否发生了变化?
三、元素与原子的区别与联系
原子
元素
区 别 联 系
1、粒子; 1、是粒子的总称; 2、既讲种类,又讲个数; 2、只讲种类,不讲个数; 3、微观角度描述分子的构 3、从宏观角度描述所有 成或某些物质的构成。 物质的组成 元素的概念建立在原子的基础上,原子的核电荷数 (即核内的质子数)决定元素的种类
5,Mg_____、Mn_______、Zn________
六、元素的分类:
1、稀有气体:气字头(氦、氖、氩、氪、氙) 2、金属元素:“钅”字旁(汞除外,俗称“水 银”) 非 固态非金属元素(“石”字旁)碳、 金 磷 液态非金属元素(“氵”字旁)溴 3 属
元 素 气态非金属元素(除稀有气体)氧、氢
本课题小结
一、元素 1、元素的定义: 2、元素在自然界的分布 二、元素符号: 1、读法及写法 2、涵义 三、元素的分类: 四、元素周期表的结构:
附1:课堂练习一 1.元素是具有_____的一类_____的总称。 2.氧化镁和氧气中都存在着______元素。 3.一种元素与另一种元素的本区别是( ) A.原子量 B.中子数 C.质子数 D.电子数 4.二氧化硫、氧化汞、氧气中都含有( ) A.氧气 B.氧原子 C.氧分子 D.氧元素 5.二氧化硫是由硫____和氧____组成的。
元素 符号
砷
As
74.92
元素 名称
元素周期表中各符号含义 原子 序数 33 相对 原子 质量
元素 符号
砷
As
74.92
元素 名称
思考题:
1、地壳中含量最多的元素? 2、地壳中含量最多的金属元素? 3、地壳中含量最多的非金属元素? 4、空气中含量最多的元素?物质呢? 5、生物细胞中含量最多的元素?其次是? 6、宇宙中含量最多的元素? 7、海水中含量最多的元素?
一、选择题 1.氯酸钾中含有 ( ) A.三个氧元素 B.三个氧分子 C.氧元素 D.三个氧原子 2.下列元素符号书写错误的是 ( ) A.MN(锰) B.Cu(铜) C.Na(钠) D.Al(银) 3.下列元素名称书写正确的是 ( ) A.炭 B.绿 C. 汞 D.钙 4.下列物质属于化合物的是( ) A.水蒸气 B.氮气 C.液态氧 D.水银
思考 5O表示什么意义?能否表示氧
气这种物质 五个氧原子
请说出下列符号的含义: 1,O_____、2O_______、O2________
2,nMn_____、10S________、7P________ 3,Al___、Cl___、Ar___、Ag___、Au____
4,C_____、Ca_______、Cu________
定义:具有相同的核电荷数 (质子数)的一类原子的总称
说明:元素是一个宏观概念。包括三个要素 1、具有相同的核电荷数 2、同一类原子。只论种类不论个数 3、总称
分析问题:
2 、下列说法有没有错误?将错误的说
法加以改正:
(1)水是由一个氧元素和两个氢元素组成的。 (2)二氧化硫中有硫和氧两个元素。
元 素 在 地 壳 和 中 的 页 含 资 量
课堂练习:
判断下列说法是否正确,并将错误的说 法加以改正。 (1)加热氧化汞生成汞和氧气,氧化汞中含 有氧气分子。 (2)二氧化硫分子是由硫元素和氧元素构成 的。 (3)水是由氢原子和氧原子构成的。 (4) 具有相同质子数同一类粒子属于同种元 素
活动与探究
元素?分子?原子?单质?
练习:某药品说明书中标明:本品每克含碘 150mg、镁65mg、锌1.5mg、铜2mg、锰 1mg,这里所标的各成分是指 ( ) A.分子 B.原子 C.元素水的实验说明水是由什么组成的?什么是 元素? 2、写出水,二氧化碳,氧气,氯酸钾的化学符号? 请思考这些符号有什么相同点? 2、什么是相对原子质量?其中一种碳原子是指哪 一种碳原子?有没有别的碳原子呢?
介绍:几种碳原子
质子数为6,中子数为6 质子数为6,中子数为7
一、元素:
金属
非金属
稀有气体
4、原子序数= 核电荷数=核内质子数=核外电子数
元素周期表
元素周期表的规律 1、周期序数=电子层数 2、主族(A)序数=最外层电子数 金属元素:最外层电子数<4个; 非金属元素:最外层电子数≥4个;
稀有气体:最外层电子数=8个(He为2 个)。(稳定结构)
元素周期表中各符号含义 原子 序数 33 相对 原子 质量
四、元素符号:
为什么要使用元素符号?
1、元素符号的读法
O--氧元素 Fe--铁元素 2、元素符号的写法: H--氢元素
例:找出下列元素符号书写正确的一项 ag CA Na mG 镁 钙 银 钠
一大二小
五、元素符号的涵义
Fe
铁元素(宏观)(铁这种物质) 一个铁原子(微观)
O表示什么意义?
氧元素、一个氧原子
5.符号“S”表示(
A.硫元素 二、填空题
)
B.硫的原子核
C.一个硫元素 D.原子量 6.请你写出你所知道的,分别以A、C、M为字头的元素 符号: A________;C________;M________。
7.在五氧化二磷、氯酸钾、氧气、碳、空气、汞等六种 物质中:______是纯净物;______是混合物。在这些纯 净物中,______由同一种元素组成的,______是由二种 元素组成的,______是氧化物
说出下列元素属于何种类别? 硅____、磷_____、氢_____、氮_____ 氖____、镁_____、钠_____、碘_____ 钙____、金_____、汞_____、氯_____
七、元素周期表的结构简介(门捷列夫)
1、周期: 每一横行叫一周期,共7个周期。 2、族 每一纵行叫一族(其中8,9,10三个纵行共同组成一个 族 3、元素周期表的起始:
请 思 考 图 料
4-4 74
二、元素在自然界的分布
1、地壳中含量最多的元素是:
氧元素 铝元素
O Si Al Fe Ca
2、地壳中含量最多的金属元素
3、生物细胞中含量最多的元素
氧元素
O C H Ca
分析讨论:
水
(H2O)
结论:化学变化中元 下述化学反应中: 素种类不变
通电 氢气 + 氧气
(H2) (O2)
6.下列物质中:(A)空气(B)氧气(C)二氧化 碳(D)氯酸钾(E)五氧化二磷(F)红磷(G) 高锰酸钾,其中属于单质的是______;属于化合物 的是______;属于氧化物的是______。 7.某药品说明书中标明:本品每克含碘150mg、镁 65mg、锌1.5mg、铜2mg、锰1mg,这里所标的各成 分是指 ( ) A.分子 B.原子 C.元素 D.无法确定 8.写出下列元素符号: 钠 氧 硫 铁 钡 碳 氮 氯 氖 9.微粒符号(1)“H”表示__(2)“2H”表示__。
