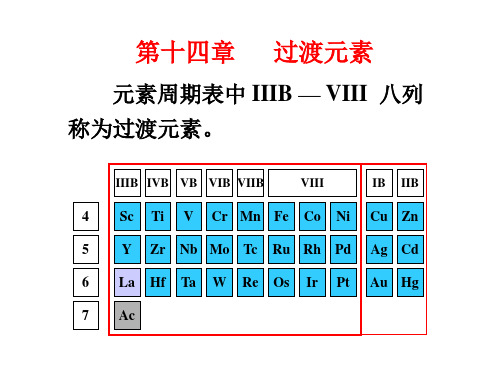
过渡元素
过渡元素课件

Cr3+的配合物有数千种,绝大多数配位数:6 常见的是:[Cr(H2O)6]3+, 配合物多有颜色
[Cr(H2O)6 ]Cl2紫色 [Cr(H2O)5Cl]Cl2 H2O蓝绿色
[Cr(H2O)4Cl2 ]Cl 2H过渡2元O素绿色
18
12.2.4 铬(Ⅵ)盐 1. Cr2O72-与CrO42-间的转化
4.形成多种配合物
过渡元素
11
12.1 过渡元素通性
过渡元素
12
12.1 过渡元素通性
5.催化性
许多过渡元素及其化合物具有独特的催化性能,Pt,Pd, Fe,Cu,V,…..,PdCl2 , V2O5….等常用的催化剂
6.磁性
多数过渡金属原子或离子有未成对电子,具有顺磁性,未 成对电子数越多,磁矩越大
Sc
Ti
Eθ M 2 /M
/
V
可溶该金属 的酸 元素
---
各种酸 Fe
-1.63
热 HCl HF Co
E / V θ M2 /M
可溶该金属 的酸
-0.44
稀 HCl H2SO4 等
-0.29
缓溶解在 HCl 等酸中
V -1.2 (估算值) HNO3,HF 浓 H2SO4 Ni
-0.25
稀 HCl H2SO4 等
Cr 2H (稀) Cr2( 蓝) H2
O2 Cr3 (紫)
2Cr
2H 2SO 4
(浓)
Cr(2 SO
)
43
3SO2
H2O
在冷、浓硝酸中钝化
2. 铬(Ⅲ)的化合物
(1)Cr2O(3 铬绿) ——两性氧化物 制备:4Cr 3O2 Δ 2Cr2O3
过渡元素

过渡元素(一)(一) 过渡元素通性过渡元素一般是指原子的电子层结构中d轨道或f轨道仅部分填充的元素。
d区元素价电子构型为(n-1)d1~8ns1~2 (Pd 4d10和Pt 5d96s1例外), 最外两层电子均未填满。
由此构成了d区元素如下通性:(1)单质的相似性(2) 原子半径变化趋势(3) 有可变氧化态例1对同一族元素来说,随周期数增加,为什么主族元素低氧化态趋于稳定而过渡元素高氧化态趋于稳定?例如,处于同一纵列的Ni和Pt,前四个电离能为I1+I2/kJ·mol-1I1+I2/kJ·mol-1Ni 2.49 8.69Pt 2.66 6.70(3) 过渡元素的氧化物及氢氧化物的性质(4) 容易形成配合物(5)配离子大多有颜色d-d跃迁MnO4-、CrO42-、VO43-等:荷移跃迁(6) 具有磁性和催化性能例2Ziegler-Natta 催化剂(6)间充化合物如r.t.下用Pd吸收H2所得氢化钯中,氢的最大含量可达PdH0.8,其他如LaH-,CeH2.69等(为原子数比值)。
这种化2.76合物仍保持金属结构特征,其间除金属键外,还存在金属和B、C、N、H等的共价键。
(二) 几种晶格类型1.钙钛矿具有边长为3.84 Å的立方晶胞,Ca、Ti和O 原子分别处在它的顶角、体心和面心的位置上。
i)给出钙钛矿的化学计量式。
ii)计算晶体密度。
iii)描述三种离子的配位情况。
(ⅰ) CaTiO3(ⅱ) ρ= 3.99 g·cm―3(ⅲ) Ca2+12个O2―围绕12面体Ti(IV) 6个O2―围绕八面体O2―2个Ti4+和4个Ca2+围绕八面体2.Fe3O4的结构:反式尖晶石结构尖晶石的通式M II M2III O4常式尖晶石中,M II占据四面体位置,M III占据八面体位置反式尖晶石中,一半M III占据四面体位置,另一半M III和M II占据八面体位置,所以Fe3O4的结构可表示为[Fe III]t[Fe II Fe III]o O4其电导是Fe2O3的106倍例尖晶石是一种金属氧化物M3O4,它的氧离子接近于按密堆积排列。
过渡元素

简介
综合介绍
信息介绍
性质特征
信息介绍
周期表中从IIIB族到VIII族的元素。共有三个系列的元素(钪到镍、钇到钯和镧到铂),电子逐个填入他 们的3d、4d和5d轨道。有时人们把过渡元素的范围扩大到包括镧系元素和锕系元素。因此有时也把铜族元素包括 在过渡元素范围之内。锌族元素(IIB)形成稳定配位化合物的能力上与过渡元素很相似,因此也有人建议把锌 族元素归入过渡元素范围。各系列过渡元素的与阿兹半径自左而右缓慢递减,各族元素的半径自上而下略有增加, 但不像主族元素增加的那样显著。
制作模式
过渡金属大多有其独特的生产方法:电解法、金属热还原法、氢还原法和碘化物热分解法。 存在: 大多数过渡金属都是以氧化物或硫化物的形式存在于地壳中,只有金、银等几种单质可以稳定存在。
催化剂
过渡金属催化剂或是生命起源的关键
要解释生命如何在地球上出现这个悬而未决的大问题,就像是回答先有鸡还是先有蛋的悖论:诸如氨基酸和 核苷酸这样的基本生化物质,是如何在生物催化剂(蛋白质或核酶)出现之前而完成其构造的?在最新一期《生 物学通报》上,科学家发表论文指出,或是第三种类型的催化剂启动了深海热泉中的新陈代谢以及生命。
原子结构
原子构型
原子半径
原子构型
过渡元素原子电子构型的特点是它们的d轨道上的电子未充满(Pd例外),最外层仅有1~2个电子,它们的 价电子构型为(n-1)d1-9ns1-2(Pd为4d5s)。
过渡元素原子的价电子层结构和氧化态 注:划横线的表示比较常见、稳定的氧化态;带括号的表示不稳定的氧化态。 多电子原子的原子轨道能量变化是比较复杂的,由于在4s和3d、5s和4d、6s和5d轨道之间出现了能级交错 现象,能级之间的能量差值较小,所以在许多反应中,过渡元素的d电子可以部分或全部参加成键。
无机化学 过渡元素-13.1过渡元素概述

13-1-8 磁性
多数过渡元1素3-或1-8离磁子性具有顺磁性
多数过渡元素的原子或离子有 未成对电子,所以具有顺磁性
离子 VO2+ V3+ Cr3+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ d电子数 1 2 3 5 6 7 8 9 未成对 1 2 3 5 4 3 2 1
最小(低) Cs 22.8
Cs 0.2
13-1-3 金属活泼性
元素 13S-c1-3 T金i 属活V泼性Cr Mn
E (M2+/M)/V -2.03 -1.63 -1.13 -0.90 -1.18
可溶该金 属的酸
各种 酸
热HF HCl
浓H2SO4 HNO3、HF
稀HCl
H2SO4
稀H2SO4 HCl等
其活泼性减弱
3. 同族元素(除Sc分族外)自上往下 金属活泼性降低
Ⅷ E (M2+/M)/VⅡB E (M2+/M)/V 第一过渡系 Ni -0.257 Zn -0.7626 第二过渡系 Pd +0.92 Cd -0.403 第三过渡系 Pt +1.2 Hg +0.8535
3. 同族元素(除IIIB族外)自上往下 金属活泼性降低
元 素 Sc Ti V C的rM离n子Fe无C色o Ni CuZn
M2+中d电子数 0 1 2 3 4 5 6 7
[M(H2O)6]3+ 无 紫 绿 蓝 红 浅 绿 粉
颜色
紫 紫红
13-1-7 配位能力和催化性
过渡元素易形成配合物
过渡元催素化剂的原子或离子反具应有部分 空的 (n-1)d, 空的ns、np轨道, 可 接受配Fe体-M的o 孤电子对合成氨 过渡元Pt素-R的h 离子一氨般氧具化有为较NO高的 电荷、V较2O小5 的半径SO,2氧极化化为力SO强3 , 对P配d体, R有an较ey 强Ni的吸引催力化加氢
过渡元素

油状 绿色
MnO2+O2+O3
MnO42- +CO2 MnO2 + CO2 Mn2++CO2
由软锰矿制备KMnO4
软锰矿 粉碎
氧化剂
OH- △
K2MnO4 墨绿色
常用的氧化剂有O2、KNO3和KClO3。反应介质为KOH或K2CO3。
2MnO2+4KOH+O2 == 2K2MnO4+2H2O 3MnO2+6KOH+KClO3 == 3K2MnO4+KCl+3H2O MnO2+K2CO3+KNO3 == K2MnO4+KNO2+CO2↑
过渡元素的通性
具有部分填充d或f壳层电子的元素。 狭义:(n-1)d1~8ns1~2 ⅢB~Ⅷ 8列 10列
广义:(n-1)d1~10ns1~2 ⅢB~ⅡB
过渡元素全部为金属,其化合物颜色多、 变 价多、形成配合物多。
• (n-1)d1~10ns1~2 (Pd:4d105s0) • d电子数较多. • d电子可部分或全部成键. • d轨道未充满可接受孤电子
1.33V -0.41V -0.91V 2-————Cr3+————Cr2+————Cr
Ea
θ:
Cr2O7
酸性介质氧化性强,碱性介质还原性强
Cr2O7
酸 性 Cr3+ 介 质 MnO 4-+H+
Ag+
2- +ຫໍສະໝຸດ SO42-S2O82-
H2O2 碱 性 CrO2- 介 质 Br2
CrO42-+H2O
元素周期表中的过渡元素

元素周期表中的过渡元素元素周期表是描述化学元素的分类和属性的重要工具。
其中,过渡元素是周期表中的一类特殊元素,具有许多独特的化学和物理性质。
本文将介绍过渡元素的定义、特点、应用以及对人类社会的重要意义。
一、过渡元素的定义和特点过渡元素是周期表中d区的元素,它们的原子结构中有不满的d电子壳层。
根据IUPAC的定义,从原子序数21(钪,Sc)到原子序数30(锌,Zn)以及从原子序数39(钇,Y)到原子序数48(银,Ag)的元素属于过渡元素。
过渡元素具有以下几个特点:1. 多种氧化态:过渡元素的d电子壳层不是完全填满的,因此它们可以容易地失去或获得电子,形成多种氧化态。
这使得过渡元素在化学反应中具有多样性和灵活性。
2. 良好的催化性能:由于其电子结构的特殊性质,过渡元素常常表现出良好的催化活性。
它们可作为催化剂参与许多重要的化学反应,促进反应速率和选择性。
3. 彩色化合物:过渡元素离子在溶液中或固体中具有吸收和发射特定波长光谱的能力,因此它们通常形成彩色的化合物。
这也是过渡元素被应用于颜料、染料和激光材料等领域的原因之一。
4. 高熔点和密度:大多数过渡元素具有较高的熔点和相对密度。
这与它们的原子结构和离子半径有关,使得过渡元素在高温和高压条件下具有许多特殊的物理性质。
5. 磁性: 过渡金属元素中的许多具有未配对的d电子,这使得它们具有磁性。
这些元素在物理和材料科学中的磁学研究中非常重要。
二、过渡元素的应用过渡元素在许多领域都有广泛的应用,下面是一些重要的应用领域:1. 工业催化剂:过渡金属催化剂在化学工业中广泛应用,用于促进氢气合成、石油加工、氨的合成和环保领域。
2. 电子材料:许多过渡金属元素具有优异的电导率、热导率和磁性。
它们被广泛应用于电子、计算机、通信和数据存储等领域。
3. 生物学:过渡金属离子在生物学过程中发挥关键作用。
例如,铁在血红蛋白和细胞色素中起到氧气运输的重要作用。
4. 颜料和染料:由于过渡元素形成彩色的化合物,它们被广泛用于颜料、染料和陶瓷等领域,为我们的生活增添了色彩。
过渡元素

(3)还原法
原理:用还原剂还原化合物(如氧化物等)来制取单 质,一般常用的还原剂是焦炭,CO、H2、活泼金属等。
例: 高炉炼铁: Fe2O3+3CO 2Fe+3CO2 铝热剂法: Fe2O3+2Al 2Fe+Al2O3 应用范围:用于制取活泼性不是很强的金属及以正氧 化值存在的非金属单质。 氧化物能否被还原,可以用消耗1mol O2生成氧化物过 程的△G变化对温度作图(见p322图8-5,Ellingham图)来 分析。 一些金属还可以从卤化物中用还原法提取,也可采用 电解、水溶液电积等方法提取。
0 5 10 15 20 24
3d
r/a0
8.2.2(n-1)d与ns轨道能级高低
▲ 电子组态:由n,l表示的电子排布方式。 ● 多电子原子核外电子的填充顺序:
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p…
▲ 过渡元素在周期表中为何延迟出现?3d排在4s之后,4d 在5s后,4f,5d在6s后,5f,6d在7s后。 ● 电子在原子轨道中的填充顺序,并不是原子轨道能级高低 的顺序,填充次序遵循的原则是使原子的总能量保持最低。 填充次序表示,随Z增加电子数目增加时,外层电子排布的规 律。(见 图8-4,p317)
2、单质的制取方法 通常有五种:物理分离法,热分解法,还原法,氧
化法和电解法。 (1)物理分离法 原理:单质与杂质在某些物理性质(如密度、沸
点等)上有显著差异的特点。 例: “沙里淘金”(密度差异);
应用范围:分离、提取以单质状态存在,且某些物理 性质与杂质差异较大的元素。
元素周期表中的过渡元素

元素周期表中的过渡元素元素周期表是化学中一张重要的“地图”,该表按照化学元素的原子序数,显示了各元素的基本信息和特性。
其中,过渡元素是周期表中的一类重要元素,具有特殊的电子排布和化学性质。
本文将从过渡元素的定义、周期表中的位置、特性以及应用等方面进行探讨。
一、过渡元素的定义过渡元素是指周期表中d区的元素,它们的d轨道电子不满足“2n^2”原则。
具体来说,过渡元素的外层电子排布为(n-1)d^1-10ns^1-2,其中n为外层电子壳层的主量子数。
过渡元素特有的电子排布使其具有独特的物理和化学性质。
二、周期表中的过渡元素过渡元素主要分布在周期表的d区,从第3周期开始,一直延伸到第7周期。
常见的过渡元素包括钛(Ti)、铁(Fe)、铜(Cu)、银(Ag)等,共有38个元素。
在周期表中,它们有着相似的电子排布和共同的化学性质。
三、过渡元素的特性1. 高熔点和高密度:过渡元素具有较高的熔点和密度,这归功于它们结构中复杂的d电子排布和较强的金属键。
2. 多样的氧化态:过渡元素的d电子容易参与化学反应,具有多样的氧化态。
例如,铁可以呈现+2、+3和+6等多种氧化态。
3. 彩色化合物:过渡元素的d电子能级跃迁引起了它们的彩色性质,使得许多过渡金属化合物呈现出各种各样的颜色。
4. 优良的催化性能:过渡元素广泛应用于催化反应中,其复杂的电子结构和多样的氧化态使其具有较强的催化活性和选择性。
四、过渡元素的应用1. 金属合金:许多金属合金中含有过渡元素,通过调节过渡元素的含量和种类,可以改变合金的硬度、强度和导电性等性质。
2. 催化剂:过渡元素广泛应用于化工和能源领域的催化反应中,如催化剂的合成、汽车尾气净化等。
3. 生物学:一些过渡元素在生物学中发挥重要的作用,如铁在血红蛋白中的载氧功能、锌在酶催化中的作用等。
4. 电子行业:许多过渡金属元素在电子行业中具有重要的应用,如铜用于导线、钛用于制造电池等。
综上所述,过渡元素是周期表中一类特殊的元素,具有独特的电子排布和化学性质。
元素周期表中的过渡元素

元素周期表中的过渡元素元素周期表是化学家们用来组织和分类元素的基本工具。
其中,过渡元素是周期表中一个重要的类别,它们在化学和物理性质上都有着独特的特点。
本文将介绍过渡元素的概念、特性以及它们在日常生活中的应用。
一、过渡元素的概念元素周期表是按照原子核中的质子数(即原子序数)递增的顺序排列的。
而过渡元素是指周期表中的d区元素,这些元素具有不完全填充的d电子层。
具体来说,它们的最外层电子结构可表示为(n-1)d(n-2)fnp,其中n代表能级,np代表填充的外层电子。
过渡元素包括3d系、4d系、5d系和6d系,分别位于周期表的第3至12组、第4至12组、第5至12组和第6至12组。
由于它们的外层电子结构不同,导致了它们之间的化学特性差异。
二、过渡元素的特性1. 化学性质:过渡元素在化学反应中通常表现出多价性。
由于d电子的相对能量较高,容易参与化学反应,并能形成稳定的离子化合物。
此外,由于外层电子的分布情况不同,过渡元素在形成氧化物时可能会形成不同的氧化态,这也是其多价性的表现。
2. 金属性质:过渡元素大多数都是金属,具有良好的导电性和导热性。
此外,它们还具有韧性、延展性和磁性等金属特性。
3. 催化性质:许多过渡元素、尤其是过渡金属,具有良好的催化活性。
它们可以通过吸附、解离或转移电子等方式参与化学反应,从而降低反应活化能,加速反应速率。
4. 彩色离子:过渡元素离子在溶液中呈现出丰富的颜色。
这是由于过渡元素离子的d电子能级间的跃迁所引起的。
三、过渡元素的应用1. 催化剂:由于过渡金属的催化活性,它们被广泛应用于化学工业中的催化反应过程,如重要的工业过程氨合成、有机合成和汽车尾气催化转化等。
2. 电池材料:过渡金属在电池材料中具有重要作用。
例如,锂电池中的过渡金属氧化物可用作正极材料。
3. 金属合金:过渡金属常用于制备各种金属合金,如不锈钢、合金钢等。
这些合金通常具有较高的强度和耐腐蚀性能。
4. 彩色玻璃和陶瓷:某些过渡金属元素可以通过调节其氧化态来改变颜色。
元素周期表中的过渡元素

元素周期表中的过渡元素元素周期表是化学中最为重要的工具之一,它按照元素的原子序数排列,将各种元素分类并展示其基本性质。
其中,过渡元素是元素周期表中的一个重要分类。
本文将对过渡元素进行详细的介绍和解析。
一、什么是过渡元素过渡元素,又称过渡金属元素,是指元素周期表中位于d区的元素。
具体来说,它们位于周期表的第4至7周期,并且填充d轨道的电子数量从1至10,即d1至d10。
过渡元素具有一些特殊的性质,使得它们在化学反应和催化过程中起到重要的作用。
二、过渡元素的特性和性质1. 原子结构和电子配置过渡元素的原子结构是它们特殊性质的基础。
由于过渡元素具有填充d轨道的电子,其电子配置比较复杂。
以铁(Fe)为例,其电子配置为 [Ar] 3d^6 4s^2。
可以看出,过渡元素的电子配置中包含了未填满的d轨道和填满的s轨道。
2. 多种化合价和化合物形成过渡元素常常能够形成多种化合价和化合物。
这是因为过渡元素的d轨道中的电子容易发生配位反应,形成不同化合物的结构。
以铜(Cu)为例,它可以形成Cu+和Cu2+两种离子,分别与不同的配体形成多种不同的配合物。
3. 颜色和催化性能过渡元素及其化合物常常具有鲜艳的颜色,这是由于它们的d轨道电子发生跃迁所致。
这种特性使得过渡元素被广泛应用在染料、颜料和催化剂等领域。
例如,钛(Ti)被广泛用于催化剂制备中,而铬(Cr)则用于制造不锈钢。
4. 磁性和电导性由于过渡元素具有未填充的d轨道电子,它们常常表现出良好的磁性和电导性。
例如,铁(Fe)和钴(Co)是常见的磁性材料,可以用于制造磁铁和磁带。
铜(Cu)和银(Ag)则是良好的电导体,广泛用于导线和电路中。
三、过渡元素的应用1. 催化剂过渡元素及其化合物在催化剂制备中具有重要的应用。
催化剂可以加速化学反应速率,降低反应温度和能源消耗。
铂(Pt)和钯(Pd)常被用作催化剂,例如在汽车尾气净化中,它们能将有害气体转化为无害物质。
2. 电池和电子器件过渡元素在电池和电子器件中也发挥着重要的作用。
第十四章过渡元素
Cu(I)也有氧化性, CuI 可
以将 Hg 氧化成黄色的 Hg2I2 2 CuI + 2 Hg —— Hg2I2 + 2 Cu
将涂有白色 CuI 的纸条挂在 室内,若常温下 3 h 白色不变,表 明空气中汞的含量不超标。
( 2 ) Ag(I)的氧化还原性 Ag2+ 1.980 V 0.799 V + Ag Ag
从银的元素电势图看出,在水 溶液中 Ag+ 不歧化,也很难被氧化 成 Ag2+ 。
Ag2+
1.980 V 0.799 V + Ag Ag
Ag(I)有氧化性,它和醛基 之间的银镜反应,就是将醛基氧化 成羧基,自身被还原成单质银。
Ag(I)可以氧化 H3PO2, H3PO3,N2H4,NH2OH 等。 在碱性介质中 Ag(I)的氧 化性较强,有如下反应
E ⊖(M+ / M)/ V K Rb Cs - 2.931 - 2.98 - 3.026
( 1 ) 在空气中的稳定性 Cu 在常温下不与干燥空气中的
O2 反应,加热时生成黑色的 CuO
2 Cu + O2 —— 2 CuO Au,Ag 加热时也不与空气中的
△
O2 反应 。
Cu 在常温下与潮湿的空气反
这里的 CN- 既是还原剂,又
是 Cu(I)的络合剂。
还原剂和沉淀剂(或络合剂) 不一定是同种物质,如
Cu2 + + Cu + 6 Cl- —— 2 [ CuCl3 ]2-
Cu2 + + Cu + 6 Cl- —— 2 [ CuCl3 ]2-
还原剂 Cu,络合剂 Cl-。
由于 Cl- 的浓度不同,配离子
第9章过渡元素概论

9.1
过渡元素概述
过渡元素的通性
具有部分填充d或f壳层电子的元素。
狭义:(n-1)d1~8ns1~2 广义:(n-1)d1~10ns1~2 IIIB~VIII IIIB~IIB 8列 10列
1. 过渡元素定义:
轻过渡元素:第四周期过渡元素 重过渡元素:第五、六周期过渡元素
IIA IIIB Be Mg Ca Sc Sr Y Ba La Ra Ac
1. 羰基配合物:通常金属价态较低
(1) 金属与羰基成键特征:以Ni(CO)4为例
Ni(0) 3d84s2 ↑↓ ↑↓ ↑↓ ↑ ↑ 3d Ni(CO)4 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
—— —— ——
4s
—— —— —— ——
4p
×× ×× ×× ×× 四面体 sp3杂化
问
实测:Ni—C键长184pm
理论:Ni—C键长198pm;
CO把电子给予Ni,Ni上负电荷过多,使该化合物不稳 定,而事实Ni(CO)4十分稳定。
题
CO的分子轨道
接受Ni的d电子
(σ1s)2 (σ1s*)2 (σ2s)2 (σ2s*)2 (π2p)4 (σ2px)2 (π2p*)0 (σ2p*)0
点击观看动画
给与Ni的sp3杂化轨道
π反馈键。
协同成键作用加强了金属与N2分子的作用力,但却削弱 了N2分子内部的键,相当于活化了N2分子。过渡金属双氮配
合物的出现为常温、常压下固氮提供了途径 。
(2)一氧化氮配合物(亚硝酰配合物)
NO作为配位体(NO+为亚硝酰离子)与过渡金属原子 通常有三种键合方式:
A.直线形端基配位
B. 弯曲型端基配位
上
170 160 150 140 130 120 110 100 20 30
第十一章过渡元素

0.1mol·dm-3
pH = 4.9 ~ 6.8
pH = 12 ~ 15
11.2.2 铬(III)盐及其性质
➢ Cr(III)盐的还原性
EA Cr2O72- 1.33 Cr3+ EB CrO42- –0.13 Cr(OH)3
• Cr(III)盐在碱性介质中有较强的还原性
2Cr3+ + 3H2O2 + 10OH– ( Cl2、Br2、Na2O2)
§11.1 过渡元素及 d 区元素的通性
11.1.1 过渡元素简介
➢ 过渡元素(transition elements): 原子的电子层结构中d 轨道 或 f 轨道仅部分填充的元素
➢ 分类: • 内过渡元素:f 区元素 • 外过渡元素:d 区元素
钪 钛 钒 铬 锰 铁系元素 铜 锌
副 副 副 副 副 铂系元素 副 副
[Cr(NH3)2(H2O)4]3+ (紫红色) [Cr(NH3)3(H2O)3]3+ (浅红色)
[CrCl2(H2O)4]Cl ·2H2O [Cr(NH3)4(H2O)2]3+ (橙红色)
(绿色) [Cr(NH3)5(H2O)]3+ (橙黄色)
[Cr(NH3)6]3+ (黄色)
配体:C2O42–、OH–、CN–、 SCN– 配位数为6,采取d2sp3杂化方式
2C黄r色O42– + 8H2O
• Cr(III)盐在酸性介质中稳定,只有强
氧化剂才能将其氧化
橙色
Ag+催化
2Cr3+ + 3S2O82– + 7H2O Cr2O72– + 6SO42– + 14H+
第八章过渡元素

第⼋章过渡元素第⼋章过渡元素8.1 过渡元素简介原⼦或其重要氧化物种中d轨道部分充满,其特征电⼦构型为(n-1)d1~9 ns1~2的元素称为过渡元素,不包括锌分族。
⼴义上,过渡元素也包括锌分族。
过渡元素⼏乎都是熔点⾼、导热导电性好、硬度⼤、⽐重⼤的典型⾦属元素;⼤多数都能溶于⽆机酸;可呈多种氧化态,易形成配位化合物,离⼦和化合物⼤多数都有⾊,易形成顺磁性化合物。
表8-1 过渡元素在周期表中的位置过渡元素的原⼦化焓具有相同的变化趋势,因⽽其熔点和升华热从左到右逐渐升⾼,在第6、7族达到最⼤值,然后下降;第⼆、第三系列过渡元素⽐第⼀过渡系列元素⼤很多。
过渡元素电离能从左到右总体上逐渐增⼤,但在破坏半满和全满构型处出现电离能增⼤的点,在⽣成半满和全满构型处出现电离能减⼩的点,曲线出现折点。
因⽽过渡元素电离能随原⼦序数的变化曲线不是平滑的⽽是出现⼀些折点。
8.2 d轨道特性与过渡元素原⼦的电⼦构型d轨道⽐s、p轨道数⽬多,成键可能性增多。
(n-1)d轨道的能量与np、ns⽐较接近,是易参与成键的内层轨道。
电⼦在原⼦核外距离为r的⼀薄层球壳中出现的概率,随半径变化时的分布情况⽤概率的径向分布函数D(r)表⽰,其峰值的数⽬为(n-1)。
3d电⼦⽐同层的s、p电⼦峰的数⽬少,钻到原⼦核附近的概率⼩,能量低。
这个特点导致不同主量⼦数轨道的能级交错。
过渡⾦属价电⼦构型的通式为:(n-1)d1~9 ns1~2。
原⼦核外电⼦排布遵循能量最低原理、保⾥不相容原理和洪特规则。
L. Pauling 原⼦轨道近似能级图如下:1s; 2s 2p ; 3s 3p; 4s 3d 4p; 5s 4d 5p; 6s 4f 5d 6p ; 7s 5f 6d也有⼀些电⼦排布例外的情况,例如:Z = 24,41 ~ 46:Nb 铌4d45s1不是4d35s241W 钨 5d46s2不是4d55s142Ru 钌4d75s1不是4d65s244Rh 铑4d85s1不是4d75s245Pd 钯4d105s0 不是4d85s2468.3过渡元素的氧化态及其稳定性1.氧化性过渡⾦属元素常表现为多种氧化态,其根本原因在于内层电⼦的排布,过渡⾦属外层电⼦排布为:(n-1)d1~9 ns1~2 ,(n-1)d轨道与ns轨道能量相近,部分(n-1)d电⼦参与成键。
元素周期表中的过渡元素

元素周期表中的过渡元素在化学的广袤世界里,元素周期表就像是一座神秘的宝库,而其中的过渡元素则是宝库中璀璨夺目的明珠。
过渡元素以其独特的性质和多样的用途,在化学、材料科学、生物学等众多领域发挥着至关重要的作用。
让我们先来了解一下什么是过渡元素。
过渡元素是指元素周期表中d 区的一系列元素,包括了从第 3 族到第 12 族的元素。
它们的最外层电子构型通常为(n 1)d 1 10 ns 1 2 。
这一特殊的电子构型赋予了过渡元素许多与众不同的化学性质。
过渡元素的一个显著特点是它们具有多种氧化态。
这是因为其 d 轨道上的电子可以参与成键,并且在不同的条件下,d 轨道上电子的得失相对较为容易。
比如铁元素,常见的氧化态有+2 价和+3 价;锰元素则有+2、+4、+6、+7 等多种氧化态。
这种多氧化态的特性使得过渡元素在化学反应中表现出丰富的化学行为。
由于存在未充满的 d 轨道,过渡元素常常形成配合物。
配合物是由中心原子或离子与围绕它的一组分子或离子(称为配体)通过配位键结合而成的化合物。
例如,铜离子可以与氨分子形成深蓝色的四氨合铜离子Cu(NH 3 ) 4 2+ 。
这些配合物在生物体内也具有重要意义,例如血红蛋白中的铁离子与卟啉环形成的配合物,能够实现氧气的运输。
过渡元素的物理性质也颇具特色。
它们大多具有较高的熔点和沸点,这是由于过渡元素原子之间存在较强的金属键。
此外,过渡元素的金属往往具有良好的导电性、导热性和延展性。
在实际应用中,过渡元素的身影无处不在。
在催化领域,过渡元素可谓是“明星选手”。
许多重要的化学反应都需要催化剂来加速反应进程,而过渡金属及其化合物常常充当着这一关键角色。
例如,在工业生产中,铂、钯等过渡金属常用于催化加氢反应;在汽车尾气处理中,铂和铑等元素的催化剂能够将有害气体转化为无害物质。
材料科学中,过渡元素也功不可没。
钛合金由于其高强度、低密度和良好的耐腐蚀性,被广泛应用于航空航天领域;不锈钢中加入铬、镍等过渡元素,大大提高了其抗腐蚀性能。
化学中的过渡元素

化学中的过渡元素
过渡元素是化学元素周期表中3到12族元素的总称,它们在化学性质上表现
出许多独特的特征。
过渡元素在化学反应中常常扮演催化剂的角色,对催化反应具有重要影响。
在自然界中,过渡元素广泛存在于矿物、岩石和生物体系中。
过渡元素的特性
1.电子结构复杂:过渡元素的原子内电子结构相对较为复杂,其中的
电子填充到d轨道中,形成不同的电子排布。
2.多价态:过渡元素常常呈现不同的氧化态,由于d轨道的电子容易
失去或获得,使其能在不同的氧化态之间转变。
3.催化活性:过渡元素常常表现出良好的催化活性,对于许多化学反
应中的反应速率有显著影响。
过渡元素的应用
1.合金制备:过渡元素常用于合金的制备中,如钛合金、钨合金等,
合金常常具有优良的机械性能和耐高温性能。
2.催化剂:过渡元素广泛应用于化学工业中的催化剂制备,如铂、钯、
铁等元素在氢化反应、氧化反应中发挥着重要作用。
3.生物体系:过渡元素在生物体系中也扮演着重要角色,如铁元素在
血液中的氧气运输、锌元素在酶活性中的作用等。
过渡元素的周期表分布
过渡元素在周期表中主要分布在3到12族之间,包括铁系、铬系、锰系、镍
系等,它们的物理化学性质各有不同,但都具有过渡元素的共同特征。
总之,过渡元素在化学中扮演着重要角色,其多样的化学性质和广泛的应用使
其成为化学领域中不可或缺的一部分。
希望通过对过渡元素的研究和应用,能够推动化学技术的发展和创新。
《过渡元素化学》课件

化学工业:用 航空航天工业: 于制造催化剂、 用于制造耐高 染料、农药等 温、耐腐蚀的
合金材料
核工业:用于 制造核燃料和 核反应堆的部
件
环保工业:用 于处理废水、 废气等污染物
过渡元素在生物体内 的作用:如铁、铜、 锌等在血液、骨骼、 神经等系统中的作用
过渡元素在药物中 的应用:如铁、铜、 锌等在药物中的作 用
汇报人:
原子结构:过渡元素原子核外电子排布具有周期性规律 电子排布:过渡元素原子核外电子排布具有周期性规律 电子排布特点:过渡元素原子核外电子排布具有周期性规律 电子排布规律:过渡元素原子核外电子排布具有周期性规律
金属性:过渡元素中,金属性最强的是铼,最弱的是铋 非金属性:过渡元素中,非金属性最强的是铋,最弱的是铼 电离能:过渡元素中,电离能最高的是铼,最低的是铋 过渡元素的物理性质与其金属性和非金属性有关,电离能是衡量元素化学性质的重要指标
磁性:过渡 元素具有磁 性,其中铁、 钴、镍等元 素具有较强 的磁性
热导率:过 渡元素的热 导率较高, 其中铜、银 等元素具有 较高的热导 率
电导率:过 渡元素的电 导率较高, 其中铜、银 等元素具有 较高的电导 率
熔点:过 渡元素的 熔点较高, 其中钨、 钼等元素 具有较高 的熔点
硬度:过 渡元素的 硬度较高, 其中钨、 钼等元素 具有较高 的硬度
应用:氧化物和氢氧化物在工业、化学实验和日常生活中有广泛的应用,如催化剂、颜料、药物等
盐类:过渡元素与 酸或碱反应生成的 化合物,如氯化铁、 硫酸铜等
络合物:过渡元素 与有机配体形成的 化合物,如铁氰化 钾、铜氨络合物等
性质:盐类和络合物 具有不同的物理和化 学性质,如颜色、溶 解度、稳定性等
过渡元素的名词解释

过渡元素的名词解释过渡元素,也称为过渡金属,是化学元素周期表中的一部分。
它们位于周期表的中间,处于主族元素和稀有气体之间。
过渡元素的特征是具有多种化学价态,并且具有良好的热和电导性能。
本文将通过对过渡元素的性质和应用的介绍,来深入解释这一概念。
1. 过渡元素的性质过渡元素具有许多独特的性质,使它们在化学和物理领域中具有广泛的应用。
首先,过渡元素的电子配置具有特殊性。
它们的电子填充在d轨道中,因此能够容纳更多的电子。
这也是为什么过渡金属能够形成多个氧化态的原因之一。
正因为这种电子配置的特殊性,过渡元素之间的相互作用和混杂非常复杂,导致它们具有丰富的化学性质。
其次,过渡元素的离子半径逐渐减小。
在周期表中,随着元素的原子序数的增加,过渡金属离子的半径逐渐减小。
这一性质使得过渡元素可以形成复杂的配合物,与其他离子或分子进行配位反应。
这也是过渡金属在催化剂和生物学中广泛应用的原因之一。
另外,由于过渡元素在周期表中的位置接近稀有气体,因此具有稳定的电子云分布和较高的原子核电荷。
这使得过渡元素具有良好的热和电导性能,并且能够形成稳定的化合物。
例如,许多过渡金属是良好的催化剂,它们能够加速化学反应的速率,提高产率和选择性。
2. 过渡元素的应用过渡元素在各个领域具有广泛的应用。
以下将介绍几个重要的领域。
首先是催化剂领域。
过渡金属催化剂被广泛应用于化学反应中。
在催化剂作用下,化学反应的速率可以被显著提高,反应条件也变得更加温和。
许多工业生产中的重要反应都依赖于过渡金属催化剂,如加氢反应、氧化反应和聚合反应等。
其次是生物学领域。
许多生物体内的重要酶活性中心含有过渡金属。
例如,血红蛋白中的铁离子能够与氧气结合,用于氧气的运输;叶绿素中的镁离子参与光合作用过程。
这些过渡金属离子在生物学中起着关键的作用,保证了生物体正常的新陈代谢和生命活动。
此外,过渡元素还被广泛应用于材料科学和电子工程领域。
过渡金属的合金和化合物具有良好的热和电导性能,使它们成为制造高温材料和半导体器件的重要原料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、分类
为了讨论的方便,可以根据过渡元素的综合化学性质进行分类:
★周期表
位置
前过渡元素:IVB-VIIB,不包括Mn,位于d区前部, 其特征是其高价离子在水溶液中常发生聚合作用。 后过渡元素: Mn到Cu,第一过渡系的后部,其特点 是以水溶液化学和配位化学为其特征。
(1) Cr2O3(铬绿) 微溶于水, 具有-Al2O3的结构
[制备]
4Cr 3O2 2Cr2O3 ( NH 4 )2 Cr2O7 Cr2O3 N 2 4 H 2O
[两性]
Cr2O3 6 H 2Cr 3 3H 2O
亚铬盐(紫色)
3H 2O Cr2O3 2OH 2Cr (OH ) 4 亚铬酸盐(绿色)
★贵金属元素:Ⅷ的第五、六周期元素有:Ru、Rh、Pd,Os、 Ir、Pt,再加上Ag、Au,特征:丰富的配位化学。 ★不同 周期
★电子进
第四周期:第一过渡系,又称轻过渡元素;
第五、第六周期:第二、三过渡系,又称重过渡元素。
第一、第二和第三过渡系总称为“主过渡元素”;
f区元素称为“内过渡元素”。
入轨道
3)过渡元素的多变氧化态
过渡元素一般都有多变的氧化态。 如:Fe有+2、+3、+6 三种氧化态(FeO、Fe2O3、Na2FeO4等) Cr有+2、+3、+6 三种氧化态(CrO、Cr2O3、CrO3等) Mn有+2、+3、+4、+6、+7 多种氧化态(MnO、Mn2O3、 MnO2、K2MnO4、KMnO4等)
第一过渡系
第二过渡系 第三过渡系
Ru Rh Pd Os Ir Pt
Ag Cd Au Hg
2-2 过渡元素的价电子层结构
过渡元素价电子层结构:(n-1)d 1-10 ns 1-2 (Pd:4d105s0) 为了便于学习和理解,我们又把过渡元素分成两大类: (1)从ⅢB族—Ⅷ族元素 其结构特点是:最后一个电子依次填充在次外层的d
§9-2 过渡元素
2-1 过渡元素的定义和分类 1、定义:三种划分方法
第一种: ⅢB-Ⅷ共8个竖行25种元素,其原子电子层结构特点: 有未充满的d电子亚层。电子构型:(n-1)d1-9ns1-2。
第二种: ⅢB-ⅠB共9个竖行28种元素,电子结构特点:原子及 其重要的氧化态有未充满的d亚层,电子构型:(n-1)d轨道部 分充满。(n-1)d 1-10 ns 1-2 第三种: ⅢB-ⅡB共10个竖行31种元素。(n-1)d 1-10ns 1-2。这 种划分,“过渡” 的含义是指从活泼金属元素到非金属元素 的过渡或由周期表 s区元素过渡到 p区元素。 我们采用第三种说法,从ⅢB族到ⅡB族10个从行包括7 个副族和1个Ⅷ族)共31种元素,称为过渡元素。
其他还有:如许多过渡元素及其化合物具有独特的催
化性能;多数过渡元素的原子或离子具有顺磁性,以及过 渡金属氧化物的水化物的酸碱性的递变规律等,在以后 介绍具体元素时再讨论,在此不介绍了。
§9-3 铬(Cr)
3-1 铬 单 质
ⅥB族包括:铬(Cr)、钼(Mo)、钨(W)三个元素。 铬的价电子构型:3d54S1 氧化态:+2、+3、+6。其中以+3和+6的化合物较常见。 铬在地壳中的丰度为:约0.018%,主要以矿物形式存在。 如:铬铁矿:Fe(CrO2)2
过渡金属水合离子呈现的多种颜色 Ti3+ V2+ V3+ Cr3+ Mn2+ Fe2+ Fe3+ Co2+ Ni2+ 紫红 紫 绿 蓝紫 肉色 浅绿 淡紫 粉红 绿
Mn (II)
hγ
Fe(II)
Co(II)
Ni(II)
Cu(II)
Zn(II)
未成对d电子发生跃迁
5)过渡元素容易形成配位化合物
过渡金属离子和某些过渡金属原子,由于存在空的nS、nP和 部分甚至全空的 d 轨道,可以接受配体提供的孤对电子,形成 配位键,形成配位离子和配位化合物。 如:K4[Fe(CN)6]、K3[Fe(CN)6]、 [Ag(NH3)2]OH、 [Cu(H2O)4]2+等 铂系元素由于原子半径小,d电子数较多,且易变形,更易 形成配位化合物。如:H2 [PtCl6]。
这和Al2O3的性质很相似
2-3过渡元素结构特征与通性 1、过渡元素电子层结构的特点与成键情况:
(1) (n-1)d 轨道的能量与ns、np轨道比较接近,是参与成键
的内层轨道,所以次外层也是价电子层。 (2) d轨道比s、p轨道数目多,不但成键可能性大,而且成键 的数目多。 (3)d轨道未充满其空轨道可以接受孤电子,形成配位化合物 (4)(n-1)d与 ns 轨道能级的高低: 当3d轨道无电子时,4s轨道的能量小于3d轨道;(钻穿效应为主) 当3d轨道有了电子之后,其能量下降; 能量低于4s轨道。 此时,3d电子就成了内层电子。(屏蔽效应为主)
第一过渡系元素的常见氧化数
族序
元素符号
ⅢB
Sc
3d14S2
ⅣB
Ti
3d24S2
ⅤB
V
3d34S2
ⅥB
Cr
3d54S1
ⅦB
Mn
3d54S2
Ⅷ
Fe
3d64S2
Ⅷ
Co
3d74S2
Ⅷ
Ni
3d84S2
+2、+3
ⅠB
Cu
3d104S1
+1、+2
ⅡB
Zn
3d104S2
+2
价电子构型
常见氧化数
+2、+3、 +2、+3、 +2、+3、 +2、+3、 +2、+3、 +2、+3 +4、+6、 +2、+3 +4 +6 +6 +4、+5 +7
2)从左到右原子半径先逐步减小,但接近d10时半径又
稍增大(d电子屏蔽效应小,d电子充满后,屏蔽效应加 强有关)。
3)同族元素的原子半径从上到下增大,但第二、三过 渡系元素同族半径相差极小。(镧系收缩的缘故)。 4)离子半径的规律与原子半径相似,d5半充满有例外。
3、过渡元素的通性
过渡元素的通性主要表现为: (1)全部是金属 (2) 有多变的氧化态 (3)水溶液中的离子往往有颜色 (4)易形成配合物
-0.41
Cr 2
-0.74
-0.91
Cr
Cr
2 CrO4 -0.13 Cr(OH )4
-1.1
Cr(OH ) 2 -1.4
-1.5
由铬的标准电极电位可见,铬具有较强的还原性,是比较活 泼的金属,但由于表面易形成氧化膜而变为钝态,活泼性下降
(1)与非氧化性的无机酸反应
如:与盐酸或稀H2SO4的反应 Cr + 2HCl = CrCl2 + H2↑ 蓝色溶液 4CrCl2+ 4HCl + O2 = 4CrCl3+ 2H2O 空气中变绿
e、过渡元素的最外层S电子和次外层的d电子都参加成键, 且堆积程度大所以表现出,晶体的熔点高,硬度大。如:
铯(Cs)的熔点为28.59℃,钨(W)的熔点为3380℃。
2)过渡金属的活泼性
a、过渡元素一般不与水反应,但第一过渡系的金属能与盐酸 或硫酸作用,置换出H2,但活泼性逐渐减弱。这从它们的 标准电动势较低可以得到反应。 第一过渡系元素的标准电极电动势(伏)
或者说:对于原子:4s<3d<4p
对于离子: 3d<4s<4p
2、原子结构特征
(1)原子半径和离子半径:
ⅢB—ⅡB元素的原子半径/pm
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
结论:1)与同周期碱金属和碱土金属相比,原子半径都较小。如: r(k)=203pm,r(Ca)=174pm,原因:电子层数没变,核电荷数增加
3、用途
(1)做各种不锈钢的器件,不锈钢中铬含量在12%~14% (2)制造其它合金 (3)做金属陶瓷 (含77%的Cr, 23%的Al2O3)
(4)作金属表面的电镀保护层
3-2 铬的化合物
铬的化合物中氧化态有:+2、+3、+6。 其中以+3 和+6 的化合物较常见。
1、Cr (III)化合物
常见的: Cr2O3 、 Cr(OH)3、 Cr2(SO4)3和亚铬酸盐等
轨道上(d1-9)。因而他们都是d区元素,它们的最外层
和次外层电子都没有填满,最外层电子数只有1或2个, 且保持不变。 价电子层构型为: (n-1)d 1-9 ns 1-2 (此n表示电子所处的电子层数)
(2)从ⅠB族—ⅡB族的元素
其结构特点是:它们次外层的d轨道已经填满,最后一 个电子依次填充在最外层的S轨道上(S1-2)。因而他 们不是d区元素,但是,这些族中的某些元素的原子, 它们的次外层上的d电子也参加成键;而且他们的氧化 态时d轨道并没有排满,如:Cu2+外围电子构型为3d9, Au3+为5d8等,它们的性质与d区元素很相似所以我们把 ⅠB族、ⅡB族统称为dS区。 所以可以认为,过渡元素是d区元素和dS区元素的总称。 由于过渡元素的最外层电子数比较少,只有1或2个,所 以都属于金属,所以过渡元素又称谓过渡金属 价电子层构型为: (n-1)d 10 ns 1-2
电动势 电对 金属
Sc
-2.0
Ti
Cr
-7.1
Mn
Fe
Co
Ni
