第14章过渡元素(二)
实验二十四:第一过渡系元素(二)(铁、钴、镍)
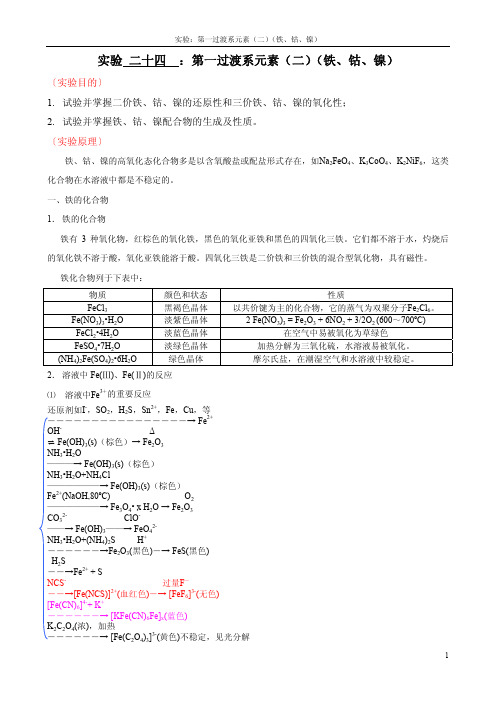
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。
第一过渡系元素(二)——铁、钴、镍

第一过渡系元素(二)——铁、钴、镍铁、钴、镍是第一过渡系元素中应用广泛的三种金属。
它们都具有相似的化学性质和金属特性,因此在很多方面都有类似的应用。
下面我们就来看看这三种金属的特性和应用。
铁(Fe)是地球上广泛存在的元素,人类使用铁的历史已经有几千年了。
铁是一种重要的结构材料,它的强度和硬度很高,并且具有很好的可塑性和可焊性。
此外,铁还有很好的耐腐蚀性能。
由于其性能稳定、价格低廉,因此广泛应用于制造汽车、船舶、建筑等领域。
此外,铁还应用于电力行业,比如铁芯变压器核心、电缆等。
铁还是一种重要的磁性材料,被广泛应用于制作各种永磁体。
钴(Co)是一种稀有金属,它具有高强度、高耐磨性、高熔点等特性,因此被广泛应用于军工、航空航天等领域。
钴还是一种重要的磁性材料,被广泛用于制作磁记录材料、计算机硬盘等。
钴还被广泛应用于医疗行业,如制作人工骨骼、人工关节等。
钴的化合物被用作化学反应催化剂、生物体内一些酶的结构成分等。
镍(Ni)是一种有色金属,与铁、钴类似,具有高强度、高耐腐蚀性、高温性等特性。
镍是一种重要的合金元素,被广泛用于制造高强度的合金钢、高温合金、耐腐蚀合金等。
比如,合金钢通常采用镍铬或镍铬钼合金,具有较高的强度和硬度,广泛应用于汽车、船舶、机械制造等领域。
此外,镍还被广泛应用于电镀行业,用于制作各种饰品、厨房用具、电器外壳等。
镍的化合物也被广泛用作催化剂、电池材料等。
除了以上的应用,铁、钴、镍还有很多重要的应用,如铁和镍被用于生产不锈钢、硬质合金等材料,钴被用于生产永磁体、高温涂层等材料。
此外,在新能源、电子信息、医疗等领域,铁、钴、镍的应用也越来越广泛。
总之,铁、钴、镍是第一过渡系元素中应用广泛的三种金属,它们的性质相似,应用领域也有很大的交叉。
随着科技的不断发展和应用需求的不断变化,铁、钴、镍的应用也会不断扩展和深化。
过渡元素化学(二)

过渡元素化学(二)过渡元素是周期表中的一组元素,其电子排布在第3到第12组之间。
这个区域由于有半满或近半满的d轨道和未填满的f轨道,使得这些元素具有特殊的性质,可以表现出很多不同的化学行为。
本文将深入探讨过渡元素的化学性质以及它们在化学反应中所扮演的角色。
1. 过渡元素的物理特征过渡元素具有许多独特的物理特征。
首先,它们具有高密度,高熔点和沸点,因为它们拥有许多未填满的d轨道,这些轨道的电子之间相互作用会导致较强的金属-金属键。
其次,它们通常是良好的导体,因为它们的未填满的d轨道使它们具有离子化趋势,容易失去电子形成正离子或者吸收电子形成负离子。
2. 过渡元素离子的颜色许多过渡元素的离子具有强烈的颜色,这是由于它们的d轨道未填满。
当电子从一个未填满的d轨道移到另一个未填满的d轨道时,会吸收光,而吸收波长的颜色就是离子呈现的颜色。
例如,二价铜在水溶液中呈现蓝色,因为它的四对未填满的d电子在s和p电子之间能吸收波长为580 nm左右的光线,这些电子从第一对d电子到第三对d电子转移。
过渡元素可以呈现多种不同的氧化态,这使得它们在许多有机和无机化学反应中都有不同的用途。
例如,铁可以以氧化态+2形式存在,也可以存在于+3的氧化态下。
由于不同的氧化态会影响到元素的化学性质,因此过渡元素在反应中所扮演的角色也会因其氧化态的不同而有所不同。
4. 过渡元素在催化反应中的作用过渡元素在催化反应中发挥着重要的作用,常见的过渡金属催化反应包括原料的直接活化、分子间的加成、还原等。
许多过渡金属催化剂的成功应用可以归功于它们容易形成中间态,也可以通过自旋、电荷、配体效应等变化调节反应活性。
与此同时,过渡元素也可以得到良好的选择性,这是由于它们的每一种氧化态具有不同的反应性能,所以它们可作为特异性催化剂。
总之,过渡元素是化学反应中非常重要的一类元素,它们具有独特的性质和特征,使得它们在许多不同的化学反应中都有不同的贡献和应用。
过渡元素
2、分类
为了讨论的方便,可以根据过渡元素的综合化学性质进行分类:
★周期表
位置
前过渡元素:IVB-VIIB,不包括Mn,位于d区前部, 其特征是其高价离子在水溶液中常发生聚合作用。 后过渡元素: Mn到Cu,第一过渡系的后部,其特点 是以水溶液化学和配位化学为其特征。
(1) Cr2O3(铬绿) 微溶于水, 具有-Al2O3的结构
[制备]
4Cr 3O2 2Cr2O3 ( NH 4 )2 Cr2O7 Cr2O3 N 2 4 H 2O
[两性]
Cr2O3 6 H 2Cr 3 3H 2O
亚铬盐(紫色)
3H 2O Cr2O3 2OH 2Cr (OH ) 4 亚铬酸盐(绿色)
★贵金属元素:Ⅷ的第五、六周期元素有:Ru、Rh、Pd,Os、 Ir、Pt,再加上Ag、Au,特征:丰富的配位化学。 ★不同 周期
★电子进
第四周期:第一过渡系,又称轻过渡元素;
第五、第六周期:第二、三过渡系,又称重过渡元素。
第一、第二和第三过渡系总称为“主过渡元素”;
f区元素称为“内过渡元素”。
入轨道
3)过渡元素的多变氧化态
过渡元素一般都有多变的氧化态。 如:Fe有+2、+3、+6 三种氧化态(FeO、Fe2O3、Na2FeO4等) Cr有+2、+3、+6 三种氧化态(CrO、Cr2O3、CrO3等) Mn有+2、+3、+4、+6、+7 多种氧化态(MnO、Mn2O3、 MnO2、K2MnO4、KMnO4等)
第一过渡系
第14章-1过渡金属元素通性分析
Mn
Fe
717.4
759.4
1509.1
1561
3259
2957.4
Co
Ni Cu
758
736.7 746
1646
1753.0 1958
3232
3393 3554
二、电离能与氧化态
元素的电离能是衡量元素化学活泼性和说明元素 氧化态特征的参数之一:
1. 过渡金属的电离能随离子电荷的增加没有发生突变, 只是逐渐增大,(n-1)d电子与ns电子能量接近,都能起价 电子的作用,所以过渡金属表现出多种氧化态; 2. Fe3+离子的价电子构型为半充满的 3d5 稳定结构,所以 Fe具有比较小的第三电离能, Fe可直接氯化生成 FeCl3, 而 Fe 后的Co、Ni 由于第三电离能较大,直接氯化不能生 成三氯化物;
第14章-1 过渡金属元素通性
过渡金属元素在周期表中的位置
第14章-1 过渡金属元素通性
过渡元素占据长周期的第4、5、6、7周期;从 第ⅢB 族的钪族开始,到第ⅠB 族的铜族为止, 共9个直列36个元素,不包括镧系和锕系元素; 填充d电子,亦称d区元素; 1. 单质相似性,同一周期金属性递变不明显; 2. 可变的氧化态,d电子可以参与成键;
二、电离能与氧化态
第一过渡系元素的电离能 (kJ· mol-1)
元素 K Ca Sc Ti V Cr 第一电离能 418.9 589.8 631 658 650 652.8 第二电离能 3051.4 1145.4 1235 1310 1414 1496 第三电离能 4411 4912.0 2389 2652.5 2828.0 2987
3. 易形成配合物,配离子大多有颜色;
4. 单质或化合物往往具有磁性和催化性;
过渡元素

油状 绿色
MnO2+O2+O3
MnO42- +CO2 MnO2 + CO2 Mn2++CO2
由软锰矿制备KMnO4
软锰矿 粉碎
氧化剂
OH- △
K2MnO4 墨绿色
常用的氧化剂有O2、KNO3和KClO3。反应介质为KOH或K2CO3。
2MnO2+4KOH+O2 == 2K2MnO4+2H2O 3MnO2+6KOH+KClO3 == 3K2MnO4+KCl+3H2O MnO2+K2CO3+KNO3 == K2MnO4+KNO2+CO2↑
过渡元素的通性
具有部分填充d或f壳层电子的元素。 狭义:(n-1)d1~8ns1~2 ⅢB~Ⅷ 8列 10列
广义:(n-1)d1~10ns1~2 ⅢB~ⅡB
过渡元素全部为金属,其化合物颜色多、 变 价多、形成配合物多。
• (n-1)d1~10ns1~2 (Pd:4d105s0) • d电子数较多. • d电子可部分或全部成键. • d轨道未充满可接受孤电子
1.33V -0.41V -0.91V 2-————Cr3+————Cr2+————Cr
Ea
θ:
Cr2O7
酸性介质氧化性强,碱性介质还原性强
Cr2O7
酸 性 Cr3+ 介 质 MnO 4-+H+
Ag+
2- +ຫໍສະໝຸດ SO42-S2O82-
H2O2 碱 性 CrO2- 介 质 Br2
CrO42-+H2O
实验二十四第一过渡系元素(二)(铁、钴、镍)

生成铁蓝。
鉴定Fe3+离子的反应:
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3
(4)FeCl3溶液中加入氨水,直至过量
得到棕红色沉淀;加入过量氨水,沉淀不消失;
Fe3+在氨水中不能得到配合物,只得到沉淀:
Fe3++3OH-=Fe(OH)3
c.加入Cl2水很快被氧化:
4Co(OH)2+O2+2H2O=4Co(OH)3(棕色或褐色)
2Co(OH)2+Cl2+2NaOH=2Co(OH)3+2NaCl
3 镍(II)的还原性
NiSO4溶液中加入NaOH,所得沉淀分成两份。一份在空气中放置,另一份加入Cl2水。
a.Ni2+?溶液中加入NaOH后,得到绿色沉淀。
总:
铁、钴、镍的主要化合价为+2和+3。
其中+2氧化态具有还原性,+3氧化态具有氧化性。
通常,酸性条件下的氧化能力增加;碱性条件下物质还原能力增加;
配合物的形成能够在较大的程度上能改变元素电对的电极电势;
还原性增强
Fe(II)
Co(II)
Ni(II)
Fe(III)
Co(III)
Ni(III)
氧化性增强
Fe3++nSCN-=[Fe(SCN)n]3-n(n=1~6)
(2)碱性介质:除去空气的酸性Fe2+溶液中缓慢加入3mL6molL-1的NaOH。沉淀留一段时间观察
首先观察到白色沉淀,放置,沉淀很快变成棕红色,其中可以观察到白-灰绿-黑色-棕红的颜色变化
Fe2+生成了氢氧化物沉淀Fe(OH)2为白色。Fe(OH)2的还原性很强,很容易被空气氧化生成Fe(OH)3而呈红棕色。期间可以观察到一系列颜色变化。中间产物Fe(OH)2.2Fe(OH)3为黑色
第十四章过渡元素
Cu(I)也有氧化性, CuI 可
以将 Hg 氧化成黄色的 Hg2I2 2 CuI + 2 Hg —— Hg2I2 + 2 Cu
将涂有白色 CuI 的纸条挂在 室内,若常温下 3 h 白色不变,表 明空气中汞的含量不超标。
( 2 ) Ag(I)的氧化还原性 Ag2+ 1.980 V 0.799 V + Ag Ag
从银的元素电势图看出,在水 溶液中 Ag+ 不歧化,也很难被氧化 成 Ag2+ 。
Ag2+
1.980 V 0.799 V + Ag Ag
Ag(I)有氧化性,它和醛基 之间的银镜反应,就是将醛基氧化 成羧基,自身被还原成单质银。
Ag(I)可以氧化 H3PO2, H3PO3,N2H4,NH2OH 等。 在碱性介质中 Ag(I)的氧 化性较强,有如下反应
E ⊖(M+ / M)/ V K Rb Cs - 2.931 - 2.98 - 3.026
( 1 ) 在空气中的稳定性 Cu 在常温下不与干燥空气中的
O2 反应,加热时生成黑色的 CuO
2 Cu + O2 —— 2 CuO Au,Ag 加热时也不与空气中的
△
O2 反应 。
Cu 在常温下与潮湿的空气反
这里的 CN- 既是还原剂,又
是 Cu(I)的络合剂。
还原剂和沉淀剂(或络合剂) 不一定是同种物质,如
Cu2 + + Cu + 6 Cl- —— 2 [ CuCl3 ]2-
Cu2 + + Cu + 6 Cl- —— 2 [ CuCl3 ]2-
还原剂 Cu,络合剂 Cl-。
由于 Cl- 的浓度不同,配离子
实验二十四-第一过渡系元素(二)-铁钴镍

钴的配合物
(1)往盛有1mL CoCl2 溶液的试管中加入少量硫氰酸钾固体,观察 固体颜色。再加入0.5mL 戊醇于0.5mL 乙醚,观察水相与有机相 的颜色,该反应可鉴别Co2+。
Co2++4SCN-
[Co(NCS)4]2-(蓝色)
(2)往0.5mL CoCl2溶液中滴加浓氨水,至生成的沉淀刚好溶解为 止,静置一段时间后观察溶液颜色。
•
♦0.1 mol·L-1KI
•
♦0.1 mol·L-1KMnO4
•
♦NH4Cl
•
♦KSCN
•
♦(NH4)2Fe(SO4)2
四、实验步骤
♦(一) Fe(II)、Co(II) 、Ni(II)化合物的还原性
1 铁(Ⅱ)的还原性
酸性介质 往盛有0.5mL氯水的试管中加入3 滴6mol•L-1 H2SO4溶液,然后滴加
2Fe3++2I-=2Fe2++I2
♦(三) Fe Co Ni的配合物
• 铁的配合物
(1)往盛有1mL六氰合铁(Ⅱ)酸钾溶液的试管中 加入约0.5mL碘水,摇动试管后,滴入数滴硫 酸亚铁铵溶液,观察现象。此为Fe2+的鉴定反 应。
2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2
(2)向盛有1mL新制(NH4)2Fe(SO4)2溶 液中加入碘水,摇动试管,将溶液分成 两份,各滴入数滴硫氰酸钾溶液,然后 向其中一支试管中加入约0.5mL 3% H2O2 溶液,观察现象。此为鉴定Fe3+的反应。
3 镍(Ⅱ)的还原性 用NiSO4溶液按2(1)(2)实验方法操作, 观察现象,第二份沉淀留作下面实验用。
近现代化学导论第14章-6过渡金属元素CuAgAu课件

2. CuSO4 硫酸铜
Cu2+是弱的氧化剂
2Cu2+ + 4I¯→ 2CuI↓+ I2
碘量法测定Cu2+
白色
溶液中不存在
CuI2×
EӨ(Cu2+/Cu+ )= + 0.153 V,EӨ(I2 / I¯) = + 0.534 V
EӨ(Cu2+/CuI )= + 0.86 V, EӨ(I2/ I¯) = + 0.534 V
金属单质稳定,金属活泼性差
V
V
V
V
V
V
V
V
V
V
V
V
高等教育出版社 高等教育电子音像出版社
一、铜族元素单质
金属单质稳定,金属活泼性差
V
V
V
V
V
V
高等教育出版社 高等教育电子音像出版社
一、铜族元素单质
单质铜在潮湿空气里生成绿色铜锈,即 碱式碳酸铜,铜绿可以防止金属进一步 腐蚀,银和金的活性差,不与空气中的 氧作用,但银易与空气中的H2S 作用生 成黑色Ag2S 而失去银白色光泽。
这个水分子结合牢固
高等教育出版社 高等教育电子音像出版社
2. CuSO4 硫酸铜
CuSO4与石灰乳混合制得“波尔多”溶液,可用于防治或 消灭植物的多种病虫害,加入贮水池中可以防止藻类生长。
波尔多液配方:
CuSO45H2O : CaO : H2O = 1 : 1 : 100
无水CuSO4为白色粉末,不溶于乙醇和乙醚,其吸水性很 强,吸水后即显出特征蓝色。可利用这一性质来检验乙醚、 乙醇等有机溶剂中的微量水分,并可作干燥剂使用除去水 分。
过渡元素的结构特点与基本性质

过渡元素的结构特点与基本性质过渡元素的结构特点与基本性质元素周期表中第四、五、六七周期元素中,第ⅢB~ⅤⅢ族,共25种元素,统称为过渡元素。
过渡元素的单质都是⾦属,所以也称为过渡⾦属元素。
见表16.1.5s0,是⼀种例外的电⼦排布)。
镧系、锕系的元素的电⼦排布,增加的电⼦填⼊(n-2)f亚层,例如:57La 4f 05d1 6s 2,在结构上,它们最外层⼆个电⼦层都是未充满的,因此在元素周期表的划分上不属于过渡⾦属元素,⽽属于内过渡元素。
也称之为镧系、锕系元素。
镧系57La ~ 71Lu (15种元素) 4f 0~145d0-1 6s2锕系89Ac~103Lr铹(15种元素)5f 0~146d0~1 7s216.1.1 价电⼦构型过渡⾦属价电⼦构型的通式为:(n-1)d1~9 ns1~2。
原⼦核外电⼦排布遵循能量最低原理、保⾥不相容原理和洪特规则。
L. Pauling 原⼦轨道近似能级图如下:1s; 2s 2p ; 3s 3p; 4s 3d 4p; 5s 4d 5p; 6s 4f 5d 6p ; 7s 5f 6d也有⼀些电⼦排布例外的情况,例如:Z = 24,41 ~ 46:Nb 铌4d45s1不是4d35s241W 钨 5d46s2不是4d55s142Ru 钌4d75s1不是4d65s244Rh 铑4d85s1不是4d75s245Pd 钯4d105s0 不是4d85s24616.1.2 氧化态的规律过渡⾦属元素常表现为多种氧化态,其根本原因在于内层电⼦的排布,过渡⾦属外层电⼦排布为:(n-1)d1~9 ns1~2 ,(n-1)d 轨道与ns轨道能量相近,部分(n-1)d电⼦参与成键。
例:Mn:+2 ~ +7均出现,主要+2,+3,+4,+6,+7.Fe:+2 ~ +6均出现,主要+2,+3,+6.过渡⾦属元素的最⾼氧化态与所在的族相等,最⾼氧化态= 所处的族数例:Sc +3 Ⅲ3d14s2Cr +6 Ⅵ3d54s1Mn +7 Ⅶ3d54s1但Ⅷ族:多数最⾼氧化态⼩于其族数,是因为随着有效核电荷的增加(Z *↑),不是所有(n-1)d 电⼦都参与成键。
副族元素

第 20 章
过渡元素 (I)
Chapter 20
The transition elements (I)
20.1.1 过渡区元素简介
过渡元素在元素周期表中的位置
过渡元素
. 过渡元素包括 d 区和 ds 区元素,即周期系第 IIIB ~
VIIB,VIII,IB ~ IIB 元素,不包括镧系和锕系元素。 其在周期表中位于 s 区元素和 p 区元素之间,均为金属, 因此也称为过渡金属。
第一过渡系元素 第二过渡系元素 第三过渡系元素
20.1.4 过渡元素单质的化学性质
过渡元素单质的化学性质概述 过渡金属第一过渡系(四周期):较活泼的轻过渡金属; 过渡金属第二、三过渡系(五、六周期):不活泼的重 过渡金属(原因也是由于“镧系收缩”的结果)。 同一周期元素:从左向右过渡,总的变化趋势是电极电势 E (M2+/M) 值逐渐变大,即其活泼性逐渐减弱。 钝化作用的影响:金属的表面性质,如一些金属的表面易 形成致密的氧化膜,也影响其化学活性。
d6
[Fe(H2O)6]2+ 淡绿色
d2
[V(H2O)6]3+ 绿色
d6
[Co(H2O)6]3+ 蓝色
d3
[Cr(H2O)6]3+ 紫色
d7
[Co(H2O)6]2+ 粉红色
d3
[V(H2O)6]2+ 紫色
d8
[Ni(H2O)6]2+ 绿色
d4
[Cr(H2O)6]2+ 蓝色
d9
[Cu(H2O)6]2+ 蓝色
. 过渡金属元素的原子的价电子层构型 :
(n-1)d1-10 ns1-2 (Pd 为 5s0)
过渡元素(二)

10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
17
二氯化钴的结晶水随温度不同而不同
325K 363K 393K
CoCl2· 6H2O
粉红
CoCl2· 2H2O
紫红
CoCl2· H2 O
蓝紫
CoCl2
蓝
变色硅胶就是用硅胶浸泡CoCl2溶液后干燥而成的。
27
化学性质
1. 在常温下,只有粉末Os会慢慢氧化,形成挥发性的具有特 殊气味的OsO4,其余稳定,在高温下会与F2,Cl2,S等反应 2. 对酸稳定,钌和锇、铑和铱不但不溶于普通强酸,甚至也 不溶于王水。 Pd可溶于硝酸,王水或热的浓硫酸 Pt可溶于王水
3Pt+4HNO3+ 18HCl ==3H2[PtCl6]+4NO+8H2O
红棕色
棕黑色
黑色
10
均难溶于水,为碱性氧化物
+2
还原性
Fe(OH)2 白色
空气氧化还原性减弱 Co(O)2 Ni(OH)2 粉红 绿色
缓慢氧化 强氧化剂
Fe2++2OH- = Fe(OH)2 4Fe(OH)2+O2 +2H2O = 4Fe(OH)3 Co2++2OH- = Co(OH)2
4Co(OH)2+O2 +2H2O = 4Co(OH)3
12
高铁酸的制备:
2Fe(OH)3+3ClO- +4OH- = 2FeO42-+5H2O+3Cl-
高铁酸盐很不稳定,遇酸分解:
4FeO42-+20H+= 4Fe3++3O2 +10H2O
无机化学 过渡元素2-锌族元素

与与氨O水2反反应过应H量可g2+在H+g其\HO[\H\·溶gN\g→I\H液4\]2\2N中H-\Og加322+入Hg少[HOH·量gNgIH(4N金2]N2O-O+属33H)2+HgHgg
热稳定性 HgO + NO2+ O2 HgO + NO2
第十硝四酸章汞过和渡硝元素酸(亚二)汞 第十四章 过渡元素(二)
反应 过量 Hg↓(黑色)
与KCl反应
[HgCl4]2-
——
配HH制g2gHH2HCCgggllC2∴2C2CH+l+HH2ll2g溶22g2NCg++2N液H2lCCS32SH时lnln+223→CC应,2→l光lC2可2保Hlg-→→加H存(以HNg入→在H增g(H22NKC)H棕加gCHCl[2gl2HCHl色2+),glg+C2+瓶CCHllHSlg2+中4g的n]+2SC-溶+NnlN4CH解Hl444度CCll
[2(H[奈Hg溶易g斯I制4I解水]4勒2取]-性解可2试-+用4剂O于H)H-检+gN易OH验H·g溶4HH++N→gHg(HHO(NNg4;+OOO(2H+红33)g)22棕N过H色2HH量I易)gg+H(2溶N(7gOIO(+H-H3+)H)g23N+2NHHO2)OOg33 ;
与KI反应 适量 HgI2 (橘红色) Hg2I2 (浅绿色)
制取
Hg(NO3)2
HgO; Hg+HNO3
Hg2(NO3)2
过量Hg + HNO3 ; Hg(NO3)2+Hg
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)Cu(Ⅱ)
Cu(Ⅰ)
加入还原剂,使Cu2+ 配合物:
Cu+,且转化为沉淀或
2Cu2+ + 4I- = 2CuI + I2 白色
Cu 2
0.86V
I2
0.535V
2Cu2+CuI + Cu + 2CI l- = 2CuCl
Cu 2 0.509 CuCl 0.170 Cu
酸碱性:
Cu(OH)2:常温放置或加热脱水
Cu(OH)2
CuO(黑色) + H2O
CuO:弱碱,易溶于酸
CuO + 2H+ Cu2+ + H2O
Cu(OH)2:两性偏碱,易溶于酸,溶于浓的强碱及氨水
Cu(OH)2 + 2H+
Cu2+ + 2H2O
Cu(OH)2 + 2OH-
[Cu(OH)4]2-
Cu(OH)2 + 4NH3
2CuCl + H2O 2AgCl + H2O
生成配合物:
与NaCN或NH3·H2O反应,生成相应配合物 Cu2O + 4CN- + H2O 2[Cu(CN)2]- + 2OHAg2O + 4CN- + H2O 2[Ag(CN)2]- + 2OH-
②氢氧化物 CuOH(黄)
溶解性: 难溶的弱碱 热稳定性:不稳定,易脱水
弱碱
HgO 红或黄 难溶 弱碱
(2)氢氧化物
问题一:Zn2+、Cd2+、Hg2+与强碱作用
生成:
Zn2+ + OHCd2+ + OHHg2+ + OH-
Zn(OH)2 Cd(OH)2 HgO
(白色) (白色) (黄色)
问题二:Zn(OH)2、Cd(OH)2、HgO显什么性质
性质:Zn(OH)2有明显两性,与过量强碱作用生成 [Zn(OH)4]2-,也可溶于NH3水,生成[Zn(NH3)4]2+。
的共价性,不管在程度上或范围上都比IIA族元素的化合物所表 现的共价性为大。IIB族金属离子形成配合物的倾向比IIA族金 属离子强得多。
4.氢氧化物的酸碱性 II B族元素的氢氧化物是弱碱性的,且易脱水分解。 IIA的氢氧化物则是强碱性的,不易脱水分解。 而Be(OH)2和Zn(OH)2都是两性的。
2.化学活泼性 锌族元素活泼性较碱土金属差。 II A族元素在空气中易被氧化,不但能从稀酸中置换出氢气,而且
也能从水中置换出氢气。 II B族在干燥空气中常温下不起反应,不能从水中置换出氢 气,在稀的盐酸或硫酸中,锌易溶解,镉较难,汞则完全不溶解。
3.化合物的键型及形成配合物的倾向 IIB族元素的离子具有18电子构型,因而它们的化合物所表现
Cd(OH)2两性微弱。可溶于NH3水,生成 [Cd(NH3)4]2+
2.氯化物
(1)氯化锌
无水氯化锌为白色固体,易溶于水,水溶液由于 Zn2+的水解而显酸性:
Zn2+ + H2O
ⅠA:密度低、熔点低 硬度小、延展性、导电性差
(2)化学性质 ⅠB:活泼性低 ⅠA:活泼性高 ①与O2反应:ⅠB: 2Cu + O2 CuO(黑)
ⅠA:很易与氧反应,生成M2O(Li2O)、 M2O2(Na2O2)或MO2(KO2) ②与H2O反应: ⅠB:无作用 ⅠA:反应剧烈 ③与酸反应:ⅠB:只与氧化性酸反应 ⅠA:反应剧烈
-0.763V -0.403V +0.851V
M
在水溶液中,金属活泼性减小。
4.配位性:金属离子已形成配离子,一般无色。
5.物理性质:Ⅱb金属的硬度小,熔沸点低。Hg是金 属中唯一液态的金属。
二、重要的化合物 1.氧化物和氢氧化物
(1)氧化物
ZnO
CdO
颜色: 白
棕黄
溶解性: 难溶
难溶
酸碱性: 两性
5.盐的溶解度及水解 两族元素的硝酸盐都易溶于水。II B族元素的硫酸盐易溶,而 钙、锶、 钡的硫酸盐则是微溶。两族元素的碳酸盐又都难溶 于水。
IIB族元素的盐在溶液中都有一定程度的水解,而钙、锶和 钡的盐则不水解。 6.某些性质的变比规律 II B族元素的金属活泼性自上而下减弱,但它们的氢氧化物 碱性则自上而下增强。 而IIA族元素的金属活泼性以及它们的氢氧化物碱性,自上而 下一致增强。
I A族元素:是极活泼的轻金属,在空气中极易被氧化,能与水剧烈反应, 同族内的活泼性自上而下增大;
3.元素价态
铜族元素:有+1、+2、+3等三种氧化态。铜族水合离子大多数显颜色。 碱金属:只有+1一种。碱金属离子一般是无色的,
4.化合物 I B族元素: IB族化合物有相当程度的共价性。氢氧化物碱性
较弱,且不稳定,易脱水形成氧化物。 IA族元素:IA族形成的化合物多数是离子型化合物,氢氧化物
都是极强的碱,并且非常稳定。
5.配合物 IB族的离子有很强的配合能力。 IA族的离子一般很难成为配合物的形成体。
二、II B族元素和II A族元素性质的对比
1.物理性质 IIB族金属的熔、沸点都比II A族低,汞在常温下是液体。II A 族和II B族金属的导电性、导热性、延展性都较差(只有镉有延 展性)。
2CuOH Cu2O + H2O
AgOH(白)
难溶的弱碱
不稳定,极易脱水
2AgOH Ag2O + H2O
Ag+ + OH-
Ag2O (棕)
(2)氧化数为+2的化合物
溶解性: CuO:难溶于水 Cu(OH)2:难溶于水
热稳定性:CuO:大于1000℃分解 4CuO 1000℃ 2Cu2O(红色) + O2
学习ⅠB、ⅡB族元素 时, 可分别与ⅠA、ⅡA对比学习。
一、 I B族元素和I A族元素性质的对比
1.与同周期的碱金属相比
铜族元素:原子半径较小,第一电离势较大。 熔点和沸点较 高,有良好 的延展性、导热性和导电性。
I A族元素:单质金属的熔点、沸点、硬度均低;
2.化学活泼性
铜族元素:铜族元素标准电极电势比碱金属为正。IB族都是不活泼的重金 属,在空气中比较稳定,与水几乎不起反应,同族内的活泼性自上而下减小。
黄血盐
Cu2[Fe(CN)6] 红棕色
第三节 锌族元素的重要化合物 一、锌族元素的通性
1.阶层电子构型:Zn
Cd
3d104s2 4d105s2
Hg 5d106s2
2.氧化态:他们均可形成氧化数为+2的化合物。Hg还 可形成氧化数为+1的化合物,两个Hg以共价键相连
3.金属活泼性: Zn
Cd
Hg
M 2
3.化合物
(1)氧化态: (2)氢氧化物:
ⅠB
+1,+2,+3 不稳定、易脱水
为弱碱
ⅠA
+1 稳定、为强碱
(3)卤化物: 多数为共价化合物 (4)盐的溶解性: 大多数难溶
少数易溶
多数为离子化合物 大多数易溶 少数难溶
(5)配合物:
易形成
难形成
二、铜族元素化合物
1.氧化物与氢氧化物
(1)氧化数为+1的化合物
①氧化物 Cu2O(红或黄)
溶解性:
难溶
Ag2O(暗棕) 难溶
酸碱性: 弱碱性
弱碱性
与酸反应:Cu2O溶于稀硫酸而被岐化
Cu2O + 2H+
Cu2+ + Cu + H2O
Ag2O溶于稀硫酸生成相应的盐
Ag2O + H2SO4
Ag2SO4 + H2O
与HX反应均生成相应卤化物沉淀
Cu2O + 2HCl Ag2O + 2HCl
淡黄色
[Ag(S2O3)2]3-
I- AgI CN- [Ag(CN)2]-
黄色
S2- Ag2S
黑
4.Cu(Ⅰ)与Cu(Ⅱ)的相互转化
(1)Cu(Ⅰ) Cu(Ⅱ)
A
: Cu 2
0.170
Cu
0.522
Cu
高温、干态时,Cu(Ⅰ)的盐稳定,水溶液中Cu+ 歧化分解为Cu2+及Cu。
2Cu+ = Cu2+ + Cu
锌族:(n-1)d10ns2
从最外层电子来看: 铜族和IA族的碱金属元素都只有1个电子,失去S电子后都呈现+1氧化态。 锌族和II A族的碱土金属元素都有两个S电子,失去S电子后都能呈+2氧化态。 因此在氧化态和某些化合物的性质方面I B与I A、II B与II A族元素有一些相似之 处,但由于I B与IIB族元素的次外层比I A与II A族元素多出10个d电子,它们又有一 些显著的差异。
[Cu(NH3)4]2+、[CuCl4]2-、[Cu(OH)4]2-、[Cu(H2O)4]2-
Ag(Ⅰ):
[Ag(NH3)2]+、[Ag(SCN)2]-、[Ag(S2O3)2]3-、[Ag(CN)2]-
4)银的沉淀与配离子间的相互转化
Ag++Cl-
AgCl
白色
NH3·H2O [Ag(NH3)2]+ Br - AgBr S2O32-
2CuCl
(Ⅱ)性质
(a)难溶于水、硫酸及稀硝酸
(b)形溶成于[浓Cu盐(N酸H生3)2成]+ 配位数不同的配离子;溶于NH3·H2O、
②Cu(Ⅱ)盐
(Ⅰ)氯化铜(CuCl2·2H2O) 在卤化铜中,CuCl2较为重要,由氧化铜或硫酸铜 与盐酸反应获得,也可由单质直接合成。性质如下:
