(完整版)实验40植物组织中过氧化氢含量及过氧化氢酶活性测定
过氧化氢酶活力的测定实验报告

竭诚为您提供优质文档/双击可除过氧化氢酶活力的测定实验报告篇一:实验35过氧化氢酶的活性测定植物在逆境下或衰老时,由于体内活性氧代谢加强而使h2o2发生累积。
h2o2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除h2o2,是植物体内重要的酶促防御系统之一。
因此,植物组织中h2o2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
一、过氧化氢含量的测定【原理】h2o2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被h2so4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与h2o2浓度呈线性关系。
【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/Lh2o2丙酮试剂:取30%分析纯h2o257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(w/V)硫酸钛;丙酮;浓氨水。
【方法】1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。
待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml 刻度,415nm波长下比色。
2.样品提取和测定:(1)称取新鲜植物组织2~5g(视h2o2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
植物组织中过氧化氢含量及过氧化氢酶活性测定

的余多
�
e2
) HO+3+eF(R==2O2H+)2+eF(R
� �
e2
�氧子分和水为解分氢化氧过化催能它�铁有含�酶白蛋红血于属�TAC�酶氢化氧过
。剂原还是又剂化氧是既则氢化氧过�用作的子电递传起中程过此在 】理原【
�
。性活的酶氢化氧过出测可即度速化变的率光吸量测据根。低降而间时应反随
法收吸外紫——定测性活的酶氢化氧过、三
。定标新重过经要前用临液溶 2O2H 及液溶 4OnMK 用所 】意注【 。2O2H gm7.1 于当相 4OnMK 的 L/lom1.0 lm1—7.1 � �g�重鲜品样—W
;�lm�量液酶用所应反—1V �数升毫定滴 4OnMK 后应反酶—B
�算计果结.3 待�lm5 酸硫 lom2 入加中淀沉的后涤洗向)3(。素色物植除去到直�次 5�3 涤洗复反酮丙用 。色比并容定法方的样同线曲准标与�后解溶全完
表按�lm1 液取提品样取吸管液移用)2(。液取提品样为即液清上�渣残去弃�nim01 心离下 提与料材按� �定而少多量含 2O2H 视�g5~2 织组物植鲜新取称)1(�定测和取提品样.2
物植�此因。一之统系御防促酶的要重内体物植是�2O2H 除清以可酶氢化氧过。体解和老 接直以可 2O2H。积累生发 2O2H 使而强加谢代氧性活内体于由�时老衰或下境逆在物植 衰的胞细速加而从�害损受遭膜胞细使并�子分大物生等质白蛋�酸核内胞细化氧地接间或
定测性活酶氢化氧过及量含氢化氧过中织组物植 04 验实
� �lm�积体液酶粗用定测—1V � �lm�积体总液取提酶粗—tV �值光吸管品样—2SA ,1SA
植物组织内过氧化物酶(POD)活性的测定

实验七植物组织内过氧化物酶(POD)活性的测定
一、实验目的
掌握植物组织内过氧化物酶活性测定的原理和方法。
二、实验原理
过氧化物酶广泛存在于植物的各个组织器官中。
在有过氧化氢存在的条件下,过氧化物酶可以使愈创木酚氧化,产生茶褐色物质,在470nm处有最大吸收峰,可根据单位时间内A470的变化值,计算POD活性大小。
三、实验材料与设备
1.实验设备与仪器
电子天平、冰冻高速离心机、可见光分光光度计、电动玻璃匀浆剂等。
2.实验材料与试剂
20mM KH2PO4,
100mM PBS:取0.2M Na2HPO4,87.7ml与0.2MNaH2PO4,12.3ml混合。
反应液:取100mM PBS 50ml,加入愈创木酚28μl,搅拌溶解,待溶液冷却后加入30%的H2O219μl,混合均匀保存于冰箱中备用。
四、实验步骤
1.酶液制备
取1.0g植物叶片剪碎,置入玻璃匀浆杯中,加入预冷的20mM KH2PO45ml进行冰浴研磨提取。
匀浆液低温离心8500rpm 15min,上清液为酶粗提液,定容到50ml供测定。
2.酶活性测定
取光程为1cm的玻璃比色杯2只,一只加入反应液3ml,20mMKH2PO41ml作为调零管。
另一只加入反应液3ml,提取的酶液1ml,立即开始计时,在470nm波长处进行比色,开始记录数据,然后每隔一分钟记录一次吸光度值,共测3min。
3.计算
以每分钟A470的化变值0.01为一个相对酶活单位,计算植物组织内过氧化物酶酶活力的大小(单位:U/g鲜重)。
植物生理学-过氧化氢酶的活性的测定
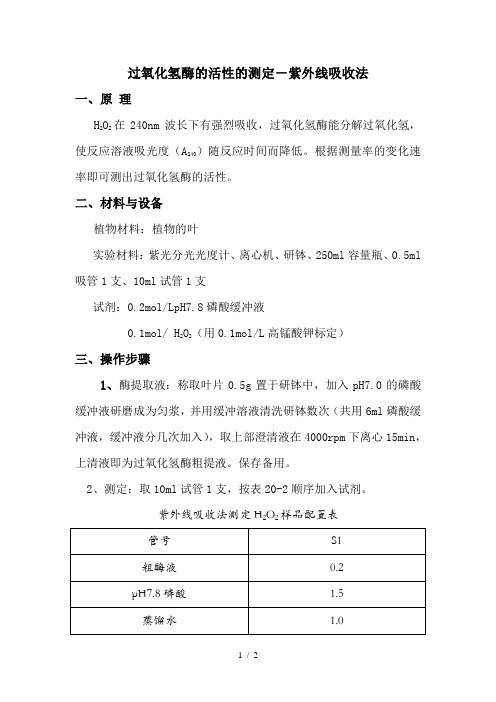
过氧化氢酶的活性的测定-紫外线吸收法一、原理H2O2在240nm波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液吸光度(A240)随反应时间而降低。
根据测量率的变化速率即可测出过氧化氢酶的活性。
二、材料与设备植物材料:植物的叶实验材料:紫光分光光度计、离心机、研钵、250ml容量瓶、0.5ml 吸管1支、10ml试管1支试剂:0.2mol/LpH7.8磷酸缓冲液0.1mol/ H2O2(用0.1mol/L高锰酸钾标定)三、操作步骤1、酶提取液:称取叶片0.5g置于研钵中,加入pH7.0的磷酸缓冲液研磨成为匀浆,并用缓冲溶液清洗研钵数次(共用6ml磷酸缓冲液,缓冲液分几次加入),取上部澄清液在4000rpm下离心15min,上清液即为过氧化氢酶粗提液。
保存备用。
2、测定:取10ml试管1支,按表20-2顺序加入试剂。
紫外线吸收法测定H2O2样品配置表在管中加入0.3ml0.1mol/L的H2O2,加完后立即计时,并迅速倒入石英比色杯中,240nm下测定吸光度,每隔一分钟读数一次,共测三分钟,测完后,按下式计算酶活性。
四、结果计算以1min内减少0.1的酶量为一个酶活单位(u)△A240×V T过氧化氢酶活性(u/gFW/min)=0.1×V×t×FW=0.043×4.6÷0.1÷0.2÷0.3÷3 =10.99五、实验反思1、影响过氧化氢酶活性测定的因素有哪些?过氧化氢酶提取自植物的新鲜叶片中,新叶与旧叶的酶活性存在差异,所以叶片的选择会影响酶活性的测定。
温度的变化也会引起酶活性的测定研磨是否充分,洗涤是否洗干净也会影响。
2、实验测得的吸光度较小(吸光度的起始值较低),酶活性较小,可能是选取的叶片较老,实验中的失误,用滴定管滴定时,滴定的蒸馏水超过了1ml,造成了过氧化氢酶的浓度偏低,用紫外线吸收法测定时造成吸光度值偏低。
过氧化氢酶活力的测定实验报告

过氧化氢酶活力的测定实验报告竭诚为您提供优质文档/双击可除过氧化氢酶活力的测定实验报告篇一:实验35过氧化氢酶的活性测定植物在逆境下或衰老时,由于体内活性氧代谢加强而使h2o2发生累积。
h2o2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除h2o2,是植物体内重要的酶促防御系统之一。
因此,植物组织中h2o2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
一、过氧化氢含量的测定【原理】h2o2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被h2so4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与h2o2浓度呈线性关系。
【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/Lh2o2丙酮试剂:取30%分析纯h2o257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(w/V)硫酸钛;丙酮;浓氨水。
【方法】1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。
待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml 刻度,415nm波长下比色。
2.样品提取和测定:(1)称取新鲜植物组织2~5g(视h2o2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(完整版)逆境生理指标的测定

逆境生理指标的测定要求:选三个指标一、植物组织中超氧物歧化酶活性的测定催化下列反应: 2 +2H + → H 2O 2 + O 2 反应产物H 2O 2可被过氧化氢酶进一步分解或被过氧化物酶利用。
因此SOD 有保护生物体免受活性氧伤害的能力。
已知此酶活力与植物抗逆性及衰老有密切关系,故成为植物逆境生理学的重要研究对象。
原理本实验依据超氧化物歧化酶抑制氮蓝四唑(NBT )在光下的还原作用来确定酶活性大小。
在有可被氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生 , 可将氮蓝四唑还原为蓝色的化合物,蓝色化合物在560nm 处有最大吸收,而SOD 可清除 从而抑制了蓝色化合物的形成。
因此光还原反应后,反应液蓝色愈深说明酶活性愈低,反之酶活性愈高。
据此可以计算出酶活性大小。
试剂0.05mol/L 磷酸缓冲液(pH7.8);130mmol/L 甲硫氨酸(Met )溶液:称1.9399g Met 用磷酸缓冲液定容至100ml ;750μmol/L 氮蓝四唑溶液:称取0.06133g NBT 用磷酸缓冲液定容至100ml 避光保存; 100μmol/L EDTA-Na 2溶液:取0.03721g EDTA -Na 2用磷酸缓冲液定容至100ml ;20μmol/L 核黄素溶液:取0.00753g 核黄素用磷酸缓冲液定容至1000ml 避光保存(当天配制)。
方法1、酶液提取 取一定部位的植物叶片(视需要定,去叶脉)0.5g 于预冷的研钵中,加1ml 磷酸缓冲液在冰浴下研磨成浆,加缓冲液使终体积为5ml 。
取2~3ml 于10000rpm 下离心10分钟,上清液即为SOD 粗提液。
2、显色反应 取5ml 试管(或指形管,要求透明度好)7支,3支试管为测定管,另4支为对照管,按表1加入各溶液。
混匀后将1支对照管置暗处,其他各管置于4000lx 日光灯下反应20min (要求各管受光情况一致,反应室的温度高时反应时间可以缩短,温度低时反应时间可适当延长(温度范围30~37℃)。
过氧化氢酶活力的测定实验报告doc

过氧化氢酶活力的测定实验报告doc过氧化氢酶活力的测定实验报告篇一:过氧化氢酶活性测定实验29 过氧化氢酶活性测定(高锰酸钾滴定法)过氧化氢酶普遍存在于植物的所有组织中,其活性与植物的代谢强度及抗寒、抗病能力有一定关系,故常加以测定。
一、原理过氧化氢酶(catalase)属于血红蛋白酶,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。
可根据H2O2的消耗量或O2的生成量测定该酶活力大小。
在反应系统中加入一定量(反应过量)的过氧化氢溶液,经酶促反应后,用标准高锰酸钾溶液(在酸性条件下)滴定多余的过氧化氢。
即可求出消耗的H2O2的量。
二、材料、仪器设备及试剂(一)材料:小麦叶片(二)仪器设备:1. 研钵;2. 三角瓶;3. 酸式滴定管;4. 恒温水浴;5. 容量瓶。
(三)试剂:1. 10%H2SO4;2. 0.2 mol/L pH7.8磷酸缓冲液;3. 0.1mol/L 高锰酸钾标准液称:取KMnO4(AR)3.1605g,用新煮沸冷却蒸馏水配制成1000ml,再用0.1mol/L 草酸溶液标定;4.0.1mol/L H2O2市售30%H2O2大约等于17.6mol/L,取30%H2O2溶液5.68ml,稀释至1000ml,用标准0.1mol/L KMnO4溶液(在酸性条件下)进行标定;5.0.1mol/L 草酸:称取优级纯H2C2O4.2H2O 12.607g,用蒸馏水溶解后,定容至1000ml。
三、实验步骤(一)酶液提取:取小麦叶片2.5g加入pH7.8的磷酸缓冲溶液少量,研磨成匀浆,转移至25ml容量瓶中,用该缓冲液冲洗研钵,并将冲洗液转至容量瓶中,用同一缓冲液定容,4000rpm离心15min,上清液即为过氧化氢酶的粗提液。
(二)取50ml三角瓶4个(两个测定,另两个为对照),测定瓶加入酶液2.5ml,对照加煮死酶液2.5ml,再加入2.5ml 0.1mol/L H2O2,同时计时,于30℃恒温水浴中保温10min,立即加入10%H2SO42.5ml。
过氧化物酶、过氧化氢酶活性测定方法及试剂配制
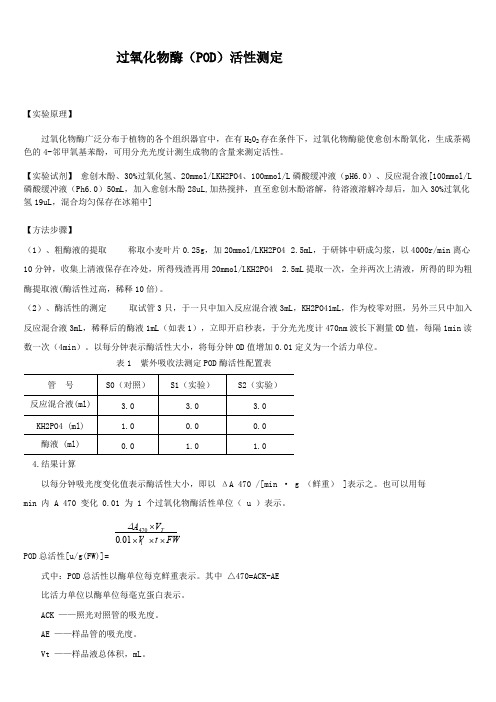
过氧化物酶(POD)活性测定【实验原理】过氧化物酶广泛分布于植物的各个组织器官中,在有H202存在条件下,过氧化物酶能使愈创木酚氧化,生成茶褐色的4-邻甲氧基苯酚,可用分光光度计测生成物的含量来测定活性。
【实验试剂】愈创木酚、30%过氧化氢、20mmol/LKH2PO4、100mmol/L磷酸缓冲液(pH6.0)、反应混合液[100mmol/L 磷酸缓冲液(Ph6.0)50mL,加入愈创木酚28uL,加热搅拌,直至愈创木酚溶解,待溶液溶解冷却后,加入30%过氧化氢19uL,混合均匀保存在冰箱中]【方法步骤】(1)、粗酶液的提取称取小麦叶片0.25g,加20mmol/LKH2PO4 2.5mL,于研钵中研成匀浆,以4000r/min离心10分钟,收集上清液保存在冷处,所得残渣再用20mmol/LKH2PO4 2.5mL提取一次,全并两次上清液,所得的即为粗酶提取液(酶活性过高,稀释10倍)。
(2)、酶活性的测定取试管3只,于一只中加入反应混合液3mL,KH2PO41mL,作为校零对照,另外三只中加入反应混合液3mL,稀释后的酶液1mL(如表1),立即开启秒表,于分光光度计470nm波长下测量OD值,每隔1min读数一次(4min)。
以每分钟表示酶活性大小,将每分钟OD值增加0.01定义为一个活力单位。
表1 紫外吸收法测定POD酶活性配置表管号S0(对照)S1(实验)S2(实验)反应混合液(ml) 3.0 3.0 3.0KH2PO4 (ml) 1.00.00.0酶液 (ml)0.0 1.0 1.04.结果计算以每分钟吸光度变化值表示酶活性大小,即以ΔA 470 /[min · g (鲜重) ]表示之。
也可以用每min 内 A 470 变化 0.01 为 1 个过氧化物酶活性单位( u )表示。
POD总活性[u/g(FW)]=FWtV.VA T⨯⨯⨯⨯147001∆式中:POD总活性以酶单位每克鲜重表示。
(完整版)实验35过氧化氢酶的活性测定
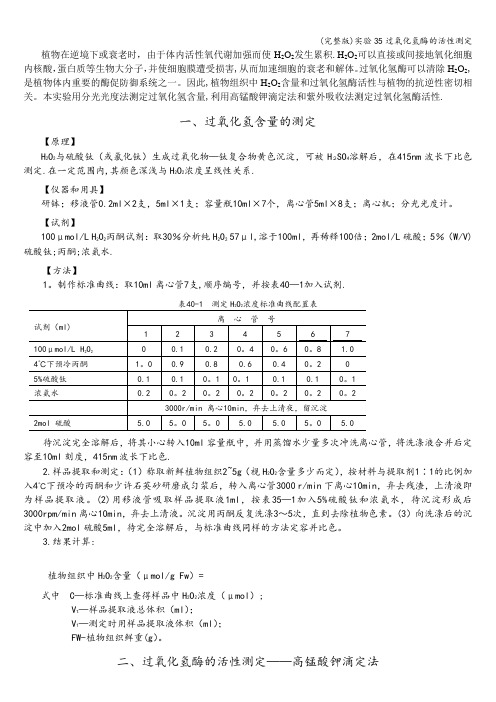
植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积.H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性.一、过氧化氢含量的测定【原理】H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定.在一定范围内,其颜色深浅与H2O2浓度呈线性关系.【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/L H2O2丙酮试剂:取30%分析纯H2O257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水.【方法】1。
制作标准曲线:取10ml离心管7支,顺序编号,并按表40—1加入试剂.待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色.2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35—1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
3.结果计算:植物组织中H2O2含量(μmol/g Fw)=式中 C—标准曲线上查得样品中H2O2浓度(μmol);V t—样品提取液总体积(ml);V1—测定时用样品提取液体积(ml);FW-植物组织鲜重(g)。
过氧化氢酶活性的测定

过氧化氢酶活性的测定过氧化氢酶(catalase)是一种重要的酶类,在多种生物体和植物中广泛存在。
其主要作用是将氧化还原反应中产生的过氧化氢(H2O2)转化成水(H2O)和氧气(O2)。
这个反应是非常重要的,因为H2O2是一种有害物质,会破坏细胞内的蛋白质、脂质和DNA等结构。
因此,过氧化氢酶不仅保护生物体内部结构的完整性,还保护它免受外部环境的伤害。
本文将介绍过氧化氢酶活性的测定方法。
实验材料:1. 1.5 mL离心管;2. 10% 过氧化氢溶液;3. 100 mM 磷酸缓冲液(pH 7.0);4. 视网膜素(1 mg/mL)。
实验步骤:1. 将取自动物或植物的新鲜组织(例如肝脏、叶片、果实)切成小块,加入绞肉机中充分研磨,随后用冷水冲洗,挤出汁液,离心5分钟,去除颗粒,收集上清液作为酶提取物;2. 准备一组试管,分别加入0.1 mL酶提取物、0.5 mL100 mM磷酸缓冲液和0.4 mL 10% 过氧化氢溶液,并加入0.1 mL纯水作为对照试验管;3. 在试管中迅速混合,放在37℃恒温水浴中反应15分钟;4. 反应结束后,加入1 mL苯酚酐试剂,盖上盖子,轻轻颠倒,立即读取吸光度A405,并计算过氧化氢酶活性。
计算过氧化氢酶活性的公式为:过氧化氢酶活性(U/mg)= [(对照A405 - 试验A405)/ 对照A405] × 1000/ [反应体系总反应时间(分钟)÷ 酶提取体积(mL)] × 酶提取物的蛋白质浓度(mg/mL)其中,对照是不加入酶提取物的试验管,试验则是加入酶提取物的试验管。
以对照的A405为100%活性,试验管的活性则为相对活性。
过氧化氢酶的活性单位为U/mg,也可以表示为U/g或U/L。
本实验中,苯酚酐试剂可以与酶提取物中产生的H2O2发生氧化反应,形成深蓝色产物,进而测量吸光度,从而计算出过氧化氢酶的活性。
总之,本实验的目的是测定过氧化氢酶的活性,以此来了解生物体内的氧化还原反应是否正常,并研究它在细胞生物学中的作用。
过氧化氢酶活性测定

过氧化氢酶活性测定引言过氧化氢酶是一种广泛存在于生物体中的重要酶类。
它能够催化过氧化氢(H2O2)与还原物质反应,将H2O2分解成水和氧气。
过氧化氢酶在细胞中起着调节氧化应激及清除有害过氧化氢的作用。
因此,测定过氧化氢酶活性对于研究生物体的氧化应激反应以及评估细胞状态具有重要意义。
原理过氧化氢酶的活性可以通过测定其催化过氧化氢分解反应速率来确定。
本实验以庚酮过氧化物(DPI)为底物,通过酶反应将庚酮过氧化物氧化为二氧化碳和乙酰乙醛。
乙酰乙醛的生成量与过氧化氢酶的活性成正比。
实验中,首先准备一定浓度的庚酮过氧化物溶液,并将待测酶样品与庚酮过氧化物混合。
在特定条件下,观察反应体系中庚酮过氧化物的消耗程度。
通过测定庚酮过氧化物消耗量的变化,可以计算出过氧化氢酶的活性。
实验步骤1.准备实验所需试剂和仪器:庚酮过氧化物溶液、酶样品、缓冲溶液、试管、分光光度计等。
2.设置实验条件:温度、pH值等。
3.分别取适量的庚酮过氧化物溶液和酶样品,加入相应的缓冲溶液,混合均匀。
4.在一组对照实验中,将庚酮过氧化物溶液替换为缓冲溶液,以消除庚酮过氧化物自身的分解。
5.在指定的时间间隔内,从不同实验体系中取出一定量的反应液,用分光光度计测定庚酮过氧化物的吸光度。
6.计算不同时间点庚酮过氧化物消耗量的变化,并绘制庚酮过氧化物消耗曲线。
7.根据庚酮过氧化物的消耗速率计算过氧化氢酶的活性。
数据处理根据庚酮过氧化物的消耗曲线,可以确定反应速率。
通过比较对照组与实验组的反应速率,计算过氧化氢酶的活性。
过氧化氢酶的活性计算公式如下:活性(μmol/min/mg)= (△A/min * Vt) / (ε * d * Venz * t * Venz)其中,△A/min为每分钟庚酮过氧化物的吸光度变化量,Vt为总体系体积,ε为庚酮过氧化物的摩尔吸光系数,d为光程,Venz为酶样品的体积,t为反应时间。
结论通过测定过氧化氢酶的活性,可以评估生物体内的氧化应激程度以及细胞的状态。
过氧化氢酶活力的测定实验报告

过氧化氢酶活力的测定实验报告实验目的,通过测定过氧化氢酶活力的实验,掌握酶活力的测定方法,了解酶活性受到什么因素的影响,为进一步研究酶的特性和应用提供理论基础。
实验原理,过氧化氢酶是一种催化过氧化氢分解的酶,其活性可通过测定其催化分解过氧化氢的速率来间接反映。
该实验采用比色法,通过观察过氧化氢酶催化分解过氧化氢后生成的物质对底物的吸光度变化来测定过氧化氢酶的活力。
实验步骤:1. 预先配制好过氧化氢酶的不同浓度溶液。
2. 在试管中分别加入过氧化氢酶溶液、过氧化氢底物和磷酸盐缓冲液,混合均匀。
3. 将混合液放入分光光度计中,记录吸光度随时间的变化。
4. 根据吸光度变化曲线,计算出不同浓度过氧化氢酶的活力。
实验结果与分析:通过实验测定,得到了不同浓度过氧化氢酶的活力数据。
分析数据发现,过氧化氢酶活力随着浓度的增加呈现出一定的变化规律。
随着过氧化氢酶浓度的增加,其活力也随之增加,但当浓度达到一定范围后,活力增加速率逐渐减缓,最终趋于稳定。
这说明过氧化氢酶的活力受到其浓度的影响,但存在一定的饱和效应。
实验结论,通过本次实验,我们成功测定了过氧化氢酶的活力,并对其活力受浓度影响的规律进行了分析。
实验结果表明,过氧化氢酶的活力随着浓度的增加呈现出一定的变化规律,但存在饱和效应。
这对于我们进一步研究酶的特性和应用具有一定的指导意义。
实验意义,本次实验通过测定过氧化氢酶的活力,掌握了酶活力的测定方法,了解了酶活性受到浓度影响的规律。
这对于深入研究酶的特性和应用具有一定的理论意义和实践价值。
总结,通过本次实验,我们成功测定了过氧化氢酶的活力,并对其受浓度影响的规律进行了分析。
这为我们进一步研究酶的特性和应用提供了理论基础,也为我们掌握了酶活力的测定方法提供了实验经验。
希望通过今后的实验研究,能够更深入地了解酶的特性和应用,为科学研究和实践应用提供更多有益的信息。
过氧化氢酶活性的测定

植物体内过氧化氢酶活性的测定一、目的过氧化氢酶普遍存在于植物组织中,其活性与植物的代谢强度及抗寒、抗病能力均有关系,故常加以测定。
通过实验可了解过氧化氢酶的作用,并掌握测定过氧化氢酶活性的原理和方法。
二、原理过氧化氢酶把过氧化氢分解为水和氧,其活性大小,以一定时间内分解的过氧化氢量来表示,当酶与底物(H2O2)反应结束后,用碘量法测定未分解的H2O2量。
以钼酸铵作催化剂,使H2O2与KI反应,放出游离碘,然后用硫代硫酸钠滴定碘,其反应式为:H2O2+ 2KI + H2SO4—→I2+ K2SO4+ 2H2OI2+ 2Na2S2O3—→2NaI + Na2S4O6根据空白和测定二者硫代硫酸钠滴定用量之差,即可求出过氧化氢酶分解H2O2的量。
三、材料、仪器设备及试剂1. 材料:水稻叶、甘蔗叶及其他植物叶片。
2. 仪器设备:分析天平;恒温水浴;研钵;100ml容量瓶;100ml三角瓶;滴定管;滴定管架;移液管;移液管架;漏斗;洗耳球等。
3. 试剂及配制1.8mol·L-1H2SO410﹪(NH4.)6MO7O40.02 mol·L-1 Na2S2 O320﹪KI1﹪淀粉液CaCO3粉石英砂0.018﹪H2O2溶液配制:吸取30﹪H2O2原液0.3ml至50ml容量瓶中,加蒸馏水至刻度,摇匀后再稀释10倍。
四、实验步骤1. 过氧化氢酶的提取选取甘蔗功能叶片,擦净去主脉剪成碎片,混匀后迅速称取1g放入经冷冻过的研钵中,加少量CaCO3粉末及石英砂,并加入3~4ml蒸馏水,在冰浴上研磨至匀浆,用蒸馏水将匀浆通过漏斗洗入100ml容量瓶中,加蒸馏水定容至刻度,摇匀后过滤。
然后再取滤液10ml 至100ml容量瓶中,加蒸馏水至刻度,摇匀即为酶稀释液。
2. 酶活性测定2.1取100ml容量瓶4个,编号,向各瓶准确加入稀释后的酶液10ml,立即向3、4号瓶中加入1.8mol·L-1H2SO45ml以终止酶活性,作为空白测定。
植物组织中过氧化氢含量测定

植物组织中过氧化氢含量测定I. IntroductionHydrogen peroxide (H2O2) is a ubiquitous molecule found in all plant tissues, and its content varies widely among species. It is an important factor in plant growth and development, as well as in defense against biotic and abiotic stressors. The measurement of hydrogen peroxide concentration is important for understanding the role of plants in various environmental processes.This paper presents a method for quantifying hydrogen peroxide content in plant tissues. The method involves the use of a spectrophotometer to measure the absorbance of hydrogen peroxide at a wavelength of 240 nm. Our results show that this method can accurately and precisely quantify hydrogen peroxide concentrations in plant tissues.II. Materials and MethodsA. Materials1. Spectrophotometer2. Test tubes3. Plant tissue4. Re Agents: H2O2, KI, and HCl5. 10 mL graduated cylinder6. BeakersB. Methods1. Collect plant tissue samples and cut into small pieces.2. Place the samples in a test tube.3. To the tube, add 10 mL of distilled water.4. Add 0.1 mL of KI and HCl to the tube.5. Vortex the tube to mix the reagents and tissue samples.6. Add 1 mL of H2O2 and mix.7. Place the tube in the spectrophotometer and read the absorbance at 240 nm.III. ResultsThe results of our experiment are presented in Table 1. Our data show that the hydrogen peroxide concentrations in the plant tissues vary widely, ranging from 0.3 to 7.4 μM.Table 1: Hydrogen peroxide concentration in plant tissues Sample Hydrogen Peroxide (μM)1 0.32 2.33 4.24 5.15 7.4IV. DiscussionOur data show that hydrogen peroxide concentrations can vary greatly among different plant species. This is an important factor to consider when studying the role of hydrogen peroxide in plant growth and development.The results of this experiment demonstrate the usefulness of spectrophotometry for quantifying hydrogen peroxide concentrations in plant tissues. Our method is simple, reliable, and cost-effective. We believe this method could be applied to other types of plants to further understand hydrogen peroxide’s role in plant physiology.。
过氧化氢酶的活性测定

过氧化氢酶的活性测定方法一:高锰酸钾滴定法1、实验目的:掌握高锰酸钾滴定法测定过氧化氢酶的活性的原理和方法。
2、实验内容:实验原理:过氧化氢酶属于血红蛋白酶,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。
据此,可根据H2O2的消耗量或O2的生成量测定该酶活力大小。
在反应系统中加入一定量的H2O2溶液,经酶促反应后,用标准高锰酸钾溶液(在酸性条件下)滴定多余的H2O2。
即可求出消耗的H2O2的量。
试剂:10%H2SO4;0.2mol/L磷酸缓冲液pH7.8;0.02mol/L高锰酸钾标准液:称取KMnO4(AR)3.1605g,用新煮沸冷却蒸馏水配制成1000mL,用0.1mol/L草酸溶液标定;0.1mol/L H2O2:市售30%H2O2大约等于17.6mol/L,取30%H2O2溶液5.68mL,稀释至1000mL,用标准0.02molKMnO4溶液(在酸性条件下)进行标定;0.1mol/L草酸:称取优级纯H2C2O2·2H2O 12.607g,用蒸馏水溶解后,定容至1L。
操作步骤:3.1酶液提取:取高羊茅草叶片2.5g加入pH7.8的磷酸缓冲液少量,研磨成匀浆,转移至25mL 容量瓶中,用该缓冲液冲洗研钵,并将冲洗液转入容量瓶中,用同一缓冲液定容,4000r/min离心15min,上清液即为过氧化氢酶的粗提液。
3.2酶反应过程取50mL三角瓶4个(3个测定,1个对照),测定瓶中加入酶液2.5mL,对照瓶中加入煮死酶液2.5mL,再加入2.5mL 0.1mol/L H2O2,同时计时,于30℃恒温水浴中保温10min,立即加入10%H2SO4 2.5mL。
3.3标定用0.02mol/L KMnO4标准溶液滴定H2O2,至出现粉红色(在30s内不消失)为终点。
3.4结果计算酶活性用每克鲜重样品1Min内分解H2O2的毫克数表示:酶活(mg/g·min)=(A-B)×V T×1.7FW×V1×t(3-2)式中:A:对照KMnO4滴定毫升数(mL);B:酶反应后KMnO4滴定毫升数(mL);V T:酶液总量(mL);V1:反应所用酶液量(mL);W:样品鲜重(g);1.7:1mL 0.1mol/L的KMnO4相当于1.7mg H2O2。
(完整word版)过氧化氢酶CAT活性测定

过氧化氢酶活性测定------------紫外吸收法过氧化氢酶普遍存在于植物的所有组织中,其活性与植物的代谢强度及抗寒、抗病能力有一定关系,故常加以测定。
一、原理】H 2O 2在240nm 波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液吸光度(A 240)随反应时间而降低。
根据测量吸光率的变化速度即可测出过氧化氢酶的活性。
【仪器与设备与试剂】 1、材料小麦叶片等。
2、仪器设备研钵;离心机;250ml 容量瓶;移液管(0.5ml 、2ml 各2支);10ml 试管3支;恒温水浴;紫外分光光度计; 3、试剂0.2mol/L pH7.8磷酸缓冲液(内含1%聚乙烯吡咯烷酮); 0.1mol/L H 2O 2(用0.1mol/L 高锰酸钾标定)。
【方法】 1.酶液提取:藻液接种后每隔1d ,取40ml 藻液(取时需摇匀),于4℃,于8 500 r/min (10 000g )下离心10min 收集藻体,用0.1mol/L 、pH7.8磷酸钠缓冲液3mL 重悬浮,然后用冰浴超声破碎细胞,破碎液在4℃下10200 r/min 离心10min,上清液即为SOD 和CAT 粗酶液。
2.酶活性测定取10ml 试管3支,其中2支为样品测定管,1支为空白管,按表2-14-1顺序加入试剂。
表2-14-1 紫外吸收法测定H 2O 2样品液配置表管 号 S1 S2 S3 管号 S0 S1 S2 粗酶液(ml) 0.2 0.2 0.2 蒸馏水/ml 1.0 1.0 1.0 pH7.8磷酸(ml)1.51.51.5将S0号管在沸水浴煮1min 以杀死酶液,冷却。
然后将所有试管在25℃预热后,逐管加入0.3ml 0.1mol/L 的H 2O 2,每加完一管立即记时,并迅速倒入石英比色皿中,240nm 下测定吸光度,每隔1min 读数1次,共测4min ,待3支管全部测定完后,按下式计算酶活性。
3.结果计算:以每分钟A 240减少0.1的酶量为1个酶活单位(U )。
植物生理学 过氧化氢酶的活性的测定

过氧化氢酶的活性的测定-紫外线吸收法一、原 理H 2O 2在240nm 波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液吸光度(A 240)随反应时间而降低。
根据测量率的变化速率即可测出过氧化氢酶的活性。
二、材料与设备植物材料:植物的叶实验材料:紫光分光光度计、离心机、研钵、250ml 容量瓶、0.5ml 吸管1支、10ml 试管1支试剂:0.2mol/LpH7.8磷酸缓冲液0.1mol/ H 2O 2(用0.1mol/L 高锰酸钾标定)三、操作步骤1、酶提取液:称取叶片0.5g 置于研钵中,加入pH7.0的磷酸缓冲液研磨成为匀浆,并用缓冲溶液清洗研钵数次(共用6ml 磷酸缓冲液,缓冲液分几次加入),取上部澄清液在4000rpm 下离心15min ,上清液即为过氧化氢酶粗提液。
保存备用。
2、测定:取10ml 试管1支,按表20-2顺序加入试剂。
紫外线吸收法测定H 2O 2样品配置表在管中加入0.3ml0.1mol/L的H2O2,加完后立即计时,并迅速倒入石英比色杯中,240nm下测定吸光度,每隔一分钟读数一次,共测三分钟,测完后,按下式计算酶活性。
四、结果计算以1min内减少0.1的酶量为一个酶活单位(u)△A240×V T过氧化氢酶活性(u/gFW/min)=0.1×V×t×FW=0.043×4.6÷0.1÷0.2÷0.3÷3 =10.99五、实验反思1、影响过氧化氢酶活性测定的因素有哪些?过氧化氢酶提取自植物的新鲜叶片中,新叶与旧叶的酶活性存在差异,所以叶片的选择会影响酶活性的测定。
温度的变化也会引起酶活性的测定研磨是否充分,洗涤是否洗干净也会影响。
2、实验测得的吸光度较小(吸光度的起始值较低),酶活性较小,可能是选取的叶片较老,实验中的失误,用滴定管滴定时,滴定的蒸馏水超过了1ml,造成了过氧化氢酶的浓度偏低,用紫外线吸收法测定时造成吸光度值偏低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验40 植物组织中过氧化氢含量及过氧化氢酶活性测定
植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积。
H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
一、过氧化氢含量的测定
【原理】
H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与H2O2浓度呈线性关系。
【仪器和用具】
研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】
100μmol/L H2O2丙酮试剂:取30%分析纯H2O257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水。
【方法】
1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。
待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色。
2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min 下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
3.结果计算:
植物组织中H 2O 2含量(μmol/g Fw)=C Vt
FW V ⨯⨯1
式中 C —标准曲线上查得样品中H 2O 2浓度(μmol ); V t —样品提取液总体积(ml ); V 1—测定时用样品提取液体积(ml ); FW —植物组织鲜重(g )。
二、过氧化氢酶的活性测定——高锰酸钾滴定法
【原理】
过氧化氢酶(CA T )属于血红蛋白酶,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。
22==R(Fe +3+OH -
)
22O 2==R(Fe +2)2+2H 2O+O 2
据此,可根据H 2O 2的消耗量或O 2的生成量测定该酶活力大小。
在反应系统中加入一定量(反应过量)的H 2O 2溶液,经酶促反应后,用标准高锰酸钾溶液(在酸性条件下)滴定多余的H 2O 2
5H 2O 2+2KMnO 4+4H 2SO 4 5O 2+2KHSO 4+8H 2O+2MnSO 4
即可求出消耗的H 2O 2的量。
【仪器和用具】
研钵;三角瓶50ml ×4;酸式滴定管(10ml );恒温水浴;容量瓶25ml ×1。
【试剂】
10% H 2SO 4;0.2mol/L 磷酸缓冲液pH7.8;
0.1mol/L 高锰酸钾标准液:称取KMnO 4(AR )3.1605g ,用新煮沸冷却蒸馏水配制成1000ml ,用0.1mol/L 草酸溶液标定;
0.1mol/L H 2O 2:市售30% H 2O 2大约等于17.6mol/L ,取30% H 2O 2溶液5.68ml ,稀释至1000ml ,用标准0.1mol/ KMnO 4溶液(在酸性条件下)进行标定;
0.1mol/L 草酸:称取优级纯H 2C 2O 4 ·2H 2O 12.607g ,用蒸馏水溶解后,定容至1L 。
【方法】
1.酶液提取 取小麦叶片
2.5g 加入pH7.8的磷酸缓冲溶液少量,研磨成匀浆,转移至25ml 容量瓶中,用该缓冲液冲洗研钵,并将冲洗液转入容量瓶中,用同一缓冲液定容,4000rpm 离心15min ,上清液即为过氧化氢酶的粗提液。
2.取50ml 三角瓶4个(两个测定两个对照),测定瓶中加入酶液2.5ml ,对照瓶中加入煮死酶液2.5ml ,再加入2.5ml 0.1mol/L H 2O 2,同时计时,于30℃恒温水浴中保温10min ,立即加入10% H 2SO 4 2.5ml 。
3.用0.1mol/L KMn O4标准溶液滴定H 2O 2,至出现粉红色(在30min 内不消失)为终点。
4.结果计算:
-
酶活性用每克鲜重样品1min内分解H2O2的毫克数表示:
酶活(mgH2O2/gFW·min)=().
A B V
FW V t
T
-⨯⨯
⨯⨯
17
1
式中A—对照KMnO4滴定毫升数;
B—酶反应后KMnO4滴定毫升数;
V T—酶液总量(ml);
V1—反应所用酶液量(ml);
W—样品鲜重(g);
1.7—1ml 0.1mol/L的KMnO4相当于1.7mg H2O2。
【注意】
所用KMnO4溶液及H2O2溶液临用前要经过重新标定。
三、过氧化氢酶的活性测定——紫外吸收法
【原理】
H2O2在240nm波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液吸光度(A240)随反应时间而降低。
根据测量吸光率的变化速度即可测出过氧化氢酶的活性。
【仪器与用具】
紫外分光光度计;离心机;研钵;250ml容量瓶1个;0.5ml刻度吸管2支,2ml刻度吸管1支;10ml试管3支;恒温水浴;
【试剂】
0.2mol/L pH7.8磷酸缓冲液(内含1%聚乙烯吡咯烷酮);
0.1mol/L H2O2(用0.1mol/L高锰酸钾标定)。
【方法】
1.酶液提取:称取新鲜小麦叶片或其它植物组织0.5g置研钵中,加入2~3ml 4℃下预冷的pH7.0磷酸缓冲液和少量石英砂研磨成匀浆后,转入25ml容量瓶中,并用缓冲液冲洗研钵数次,合并冲洗液,并定容到刻度。
混合均匀将量瓶置5℃冰箱中静置10min,取上部澄清液在4000rpm下离心15min,上清液即为过氧化氢酶粗提液。
5℃下保存备用。
2.测定:取10ml试管3支,其中2支为样品测定管,1支为空白管,按表40-2顺序加入试剂。
25℃预热后,逐管加入0.3ml 0.1mol/L的H2O2,每加完一管立即记时,并迅速倒入石英比色杯中,240nm下测定吸光度,每隔1min读数1次,共测4min,待3支管全部测定完后,按下式计算酶活性。
3.结果计算:
以1min内A240减少0.1的酶量为1个酶活单位(u)。
过氧化氢酶活性(u/gFW/min)=FW t V .V A T
⨯⨯⨯⨯124010∆
式中 ∆A 240 = A S0-()
A A S S 122+
A S0—加入煮死酶液的对照管吸光值; A S1, A S2—样品管吸光值; Vt —粗酶提取液总体积(ml ); V 1—测定用粗酶液体积(ml ); FW —样品鲜重(g );
0.1—A 240每下降0.1为1个酶活单位(u ); t —加过氧化氢到最后一次读数时间(min )。
【注意事项】
凡在240nm 下有强吸收的物质对本实验有干扰。
【思考题】
1.影响过氧化氢酶活性测定的因素有哪些?
2.过氧化氢酶与哪些生化过程有关?。
