碱金属元素PPT优选课件
合集下载
碱金属元素PPT精品课件

2. 纸的发明 西汉前期,人们从“积漂絮成絮 片”中得到启示,发明了纸
西汉早期麻纸(甘肃放马滩出土) (质脆、书写不流畅)
二、医学
张仲景 东汉末年
著名的医学家。著有 《伤寒杂病论》,全面 阐述了中医理论和治病 原则,奠定了我国中医 治疗的基础。后世尊称 他为“医圣”。
《伤寒杂病论》书影
医圣——张仲景
轻微的爆炸,遇水立即燃烧,遇水立即燃烧,
生成H2
爆炸
爆炸
递变性 反应由剧烈到更剧烈,生成的氧化物由简单到复杂
结论
金属性逐渐增强
化学性质
碱金属原子最外层电子数都为1, 容易失去电子被氧化,具有较 强的还原性。并且,从Li到Cs, 随着核电荷数的逐渐增多,电 子层数逐渐增多,原子半径逐 渐增大,核对外层电子的引力 逐渐减弱,失电子的能力逐渐 增强,金属性逐渐增强。
3. 蔡伦改进造纸术
公元105年,蔡 伦改进造纸术。他用 树皮、麻头、破布和 旧鱼网做造纸原料, 扩大了原料来源,降 低了造纸的成本,同 时又提高了纸的产量 和质量。从此,纸逐 步取代竹木简和帛。 为纪念蔡伦的功绩, 人们把这种纸叫作 “蔡侯纸”。
科技领域 代表人物 时 期
主要成就
造纸术
劳动人民
按从Li到Cs的顺序
核电荷数逐渐增大 核外电子层数逐渐增多 原子半径逐渐增大
碱金属原子半径与离子半
径有何关系?
以钠为例:
Na
Na+
图示:
结论:原子半径大于相应 的阳离子半径
原子结构
Li Na K Rb Cs
相同点 递 变 性
最外层都有1个电子 核电荷数逐渐增大
电子层数逐渐增大 原子半径逐渐增大
碱金属元素物理性质有哪 些相同点?
碱金属元素ppt10 人教版优质课件

第三节 碱金属元素
碱金属元素包含哪些元素?
锂钠
钾
铷
铯
钫
Li Na
K
Rb
Cs
Fr
放射性元素
第三节 碱金属元素
{ 一、物理性质 相似性:白 软 小 低 导 规律性
{ 二、原子结构 相似性:最外层都只有1e规律性
{ 三、化学性质 相似性:都具有强还原性 规律性 1、与非金属的反应(O2 、Cl2、S、)
越
来 越 剧 烈
}Rb 反应比钾更剧烈,遇到空气就燃烧,生成 更复杂的氧化物。 Cs
钠、钾与水的反应
Na 现象
K
Na 化学方 程式
K
浮熔 游
浮熔 游 燃
2Na + 2H2O
2K + 2H2O
红响
红响 爆
2NaOH + H2
2KOH + H2
2、碱金属与水的反应
碱 Li
金
属
都 能
Na
与
水
反
K
应
,
2、与H2O的反应
锂(Li) ※Li是最轻的金属
钠(Na)
钾(k)
铷(Rb)
铯(Cs)
第三节 碱金属元素
元素 名称
元素 符号
核电 荷数
颜色和 状态
密度 g/cm3
熔点 ℃
沸点 ℃
锂 Li
3 银白色 0.534 180.5 1347
柔软
钠
Na
11
随 着
银白色
00..9977 密97.81
882.9
不可以。因锂的密度是0.534g /cm3, 小于煤油的密度,它不会浸没在煤油里。
少量的锂可保存在密度更小的石蜡油里。
碱金属元素包含哪些元素?
锂钠
钾
铷
铯
钫
Li Na
K
Rb
Cs
Fr
放射性元素
第三节 碱金属元素
{ 一、物理性质 相似性:白 软 小 低 导 规律性
{ 二、原子结构 相似性:最外层都只有1e规律性
{ 三、化学性质 相似性:都具有强还原性 规律性 1、与非金属的反应(O2 、Cl2、S、)
越
来 越 剧 烈
}Rb 反应比钾更剧烈,遇到空气就燃烧,生成 更复杂的氧化物。 Cs
钠、钾与水的反应
Na 现象
K
Na 化学方 程式
K
浮熔 游
浮熔 游 燃
2Na + 2H2O
2K + 2H2O
红响
红响 爆
2NaOH + H2
2KOH + H2
2、碱金属与水的反应
碱 Li
金
属
都 能
Na
与
水
反
K
应
,
2、与H2O的反应
锂(Li) ※Li是最轻的金属
钠(Na)
钾(k)
铷(Rb)
铯(Cs)
第三节 碱金属元素
元素 名称
元素 符号
核电 荷数
颜色和 状态
密度 g/cm3
熔点 ℃
沸点 ℃
锂 Li
3 银白色 0.534 180.5 1347
柔软
钠
Na
11
随 着
银白色
00..9977 密97.81
882.9
不可以。因锂的密度是0.534g /cm3, 小于煤油的密度,它不会浸没在煤油里。
少量的锂可保存在密度更小的石蜡油里。
〈碱金属元素〉精品PPT教学课件

日期:
演讲者:蒝味的薇笑巨蟹
沾取另一种待测 物灼烧观察焰色
存放
例: K (K+ ): 紫色 (透过蓝色钴玻璃) Na (Na+) 黄色 Li (Li+) : 紫红色 Ca ( Ca2+) 砖红色 Ba (Ba2+) : 黄绿色 Cu(Cu2+) 绿色
2020/12/6Fra bibliotek2应用 : A , 鉴定 K ,Na 等元素 B,节日燃放的焰火
肥料
农家肥 化肥 (氮肥 , 磷肥 , 钾肥 , 复合肥)
草木灰: 有效成分 K2CO3 (主要) , KCl , K2SO4 .
2020/12/6
3
感谢你的阅览
Thank you for reading
温馨提示:本文内容皆为可修改式文档,下载后,可根据读者的需求 作修改、删除以及打印,感谢各位小主的阅览和下载
2020/12/6
1
3、焰色反应:
定义: 多种金属及它们的化合物在灼烧时使火焰呈现 特殊的颜色
用品: 铂丝 (或铁丝) ,酒精灯 ,火柴 ,蓝色钴玻璃 , 盐酸, 待 检物 (溶液或固体)
步骤: 点燃酒精灯
沾取待测物灼 烧观察焰色
用盐酸洗净铂 丝 ,灼烧至原色
灼烧铂丝至原色
用盐酸洗净铂 丝 ,灼烧至原色
第三节 碱金属元素
1、碱金属的物理性质及变化规律 ( Li→Cs )
①色状: 银白色金属 (Cs 略带金色光泽) ②硬度: 柔软 ,有展性(大→小) ③密度: 小→大 (Li ,Na , K <1 ; Rb, Cs >1 ) ④熔、沸点: 高 → 低 , ⑤导性: 热 、电的良导体
2、化学性质:
都是活泼的金属,从Li到Cs金属性增强, 铯是最活泼的金属 K,Rb ,Cs 等和O2反应一般生成过氧化物 或 超氧化物 。碱 金属的氢氧化物 都是强碱 ,碱性逐渐增强 ,CsOH 的碱性最 强。
碱金属元素 PPT课件10 人教版

•
15、所有的辉煌和伟大,一定伴随着挫折和跌倒;所有的风光背后,一定都是一串串揉和着泪水和汗水的脚印。
•
16、成功的反义词不是失败,而是从未行动。有一天你总会明白,遗憾比失败更让你难以面对。
•
17、没有一件事情可以一下子把你打垮,也不会有一件事情可以让你一步登天,慢慢走,慢慢看,生命是一个慢慢累积的过程。
不可以。因锂的密度是0.534g /cm3, 小于煤油的密度,它不会浸没在煤油里。
少量的锂可保存在密度更小的石蜡油里。
练习一
1、下列元素中,原子半径最小的是( B ), 最易失电子的是( D )
A、Na
B、Li
C、Rb D、Cs
2、金属钠比钾( D ) A、金属性强
C、原子半径大
B、还原性强 D、熔点高
•
10、有些事想开了,你就会明白,在世上,你就是你,你痛痛你自己,你累累你自己,就算有人同情你,那又怎样,最后收拾残局的还是要靠你自己。
•
11、人生的某些障碍,你是逃不掉的。与其费尽周折绕过去,不如勇敢地攀登,或许这会铸就你人生的高点。
•
12、有些压力总是得自己扛过去,说出来就成了充满负能量的抱怨。寻求安慰也无济于事,还徒增了别人的烦恼。
2、与H2O的反应
锂(Li) ※Li是最轻的金属
钠(Na)
钾(k)
铷(Rb)
铯(Cs)
第三节 碱金属元素
元素 名称
元素 符号
核电 荷数
颜色和 状态
密度 g/cm3
熔点 ℃
沸点 ℃
锂 Li
3 银白色 0.534 180.5 1347
柔软
钠
Na
11
随 着
银白色
00..9977 密97.81
碱金属元素PPT课件

2020年10月2日
11
三 物理性质
元素 元素 核电 颜色和状态 名称 符号 荷数
锂 Li 3 银白色,柔软
密度 熔点℃ 沸点℃
g/cm
3
0.534 180.5 1347
钠 Na 11 银白色,柔软 0.97 97.81 882.9
钾 K 19 银白色,柔软 0.86 63.65 774
铷 Rb 37 银白色,柔软 1.532 38.89 688
2020年10月2日
7
回忆: 钠与溶液反应的顺序?
先酸 后水 再盐 钾与溶液反应的顺序与钠是相似的 也是 先酸 后水 再盐
2020年10月2日
8
二 碱金属的化学性质
1.与非金属反应
碱金属的化学性质十分活泼,在空气中燃烧生成不同的产物
点燃
4Li + O2 = 2Li2O
注意:锂与其它碱金属不同,与氧气反应只生成氧化锂。
2020年10月2日
4
思考:
元素的性质和什么有关
和元素原子的最外层电子的数目有密切关系。 推论一:看书37页。
2020年10月2日
5
推论二:
核电荷数增加
原子的电子层数增加
原子半径增大
原子核对最外层电子的引力减弱
还原性增强
失去电子是什么性质? 最外层电子容易失去
2020年10月2日
6
请大家仔细观察实验现象!
钠(Na)
+19 2 8 8 1
+37 2 8 18 8 1
钾(K)
铷(Rb)
+55 2 8 18 18 8 1 铯(Cs)
请大家比较他们的异同?
相同点: 最外层都只有一个电子。
八年级物理《碱金属》ppt课件

与酸反应实验
分别取少量碱金属单质,加入盛有稀酸的试管中,观察并 记录反应现象。
火焰颜色实验
用铂丝蘸取少量碱金属化合物,在无色火焰上灼烧,观察 并记录火焰颜色。
3. 安全注意事项
由于碱金属元素性质活泼,与水或酸反应时可能产生剧烈 现象,因此实验过程中需佩戴防护眼镜和手套,确保操作 安全。
数据记录与结果分析
配合物及其性质
配合物的形成
碱金属离子可以与某些阴离子或分子形成配合物。例如,钠离子可以与氯离子 形成氯化钠配合物(Na[Cl])。
配合物的性质
配合物通常具有与简单离子不同的物理和化学性质。例如,配合物的颜色、溶 解度和稳定性等可能与相应的简单离子有所不同。此外,配合物在化学反应中 可能表现出特殊的反应活性。
盐类化合物
碳酸盐
碱金属的碳酸盐易溶于水,且 稳定性随金属活泼性增强而降 低。例如,碳酸钠(Na2CO3) 和碳酸钾(K2CO3)是常见的 碱金属碳酸盐。
硫酸盐
碱金属的硫酸盐多数易溶于水, 且具有较高的稳定性。例如, 硫酸钠(Na2SO4)和硫酸钾 (K2SO4)在农业和工业上有 广泛应用。
硝酸盐
碱金属的硝酸盐易溶于水,且 多数具有氧化性。例如,硝酸 钾(KNO3)是一种常用的氧化 剂。
由于碱金属单质都是强还原剂,很容易与空气中的氧 气等反应,故一般应密封保存;
在运输过程中要防止撞击和摩擦,避免与易燃易爆物 品混装。
03
碱金属化合物性质
氧化物和氢氧化物
氧化物
碱金属氧化物具有碱性,能与酸反应生成盐和水。例如,钾的氧化 物(K2O)可以与水反应生成氢氧化钾。
氢氧化物
碱金属的氢氧化物都是强碱,易溶于水并放出大量热。例如,氢氧 化钠(NaOH)和氢氧化钾(KOH)是实验室和工业上常用的强碱。
新版第三节-碱金属元素课件.ppt

2、实验演示 步骤:洗、烧→蘸、烧→洗、烧
精选
练习:
1、判断下列说法是否正确? ① 钠、钾保存在煤油中,故锂也可保存在煤油中。 ②钠、钾合金可做原子反应堆的导热剂。 ③钠与水反应 比钾与水反应剧烈。 ④锂离子与钾离子最外层电子数相同。 ⑤某物质灼烧时,焰色反应为黄色,则该物质一定是 钠的化合物。 ⑥焰色反应不是化学反应,而是一种物理现象。
钾 K 19 银白色,柔软 0.86 63.65 774
铷 Rb 37 银白色,柔软 1.532 38.89 688
铯 Cs 55 略带金色光泽, 1.879 28.40 678.4 柔软
精选
二、碱金属元素的递变性
1、原子结构: Li→Cs,核电荷数逐渐增加,核 外电子层数逐渐增多,原子半径 逐渐增大。
电子 层数 2层
3 4 5 6
原子半径
0.152nm 0.186 0.227 0.248 0.265
3
精选
碱金属的主要物理性质
元元核 素素电 名符荷 称号数
颜色 和
状态
密度 熔点 沸点
g·cm-3 ℃
℃
锂 Li 3 银白色,柔软 0.534 180.5 1347
钠 Na 11 银白色,柔软 0.97 97.81 882.9
第三节 碱金属元素
郴州市一中 王海燕
精选
放烟花
一、碱金属元素的相似性:
1、原子结构: 最外层电子数都是1 2、单质物理性质: 白(铯略带金色)、软、
小、低、良 3、单质化学性质:还原性(与钠相似)
精选
碱金属元素的原子结构
元素 核电 电子层结构 符号 荷数
Li 3 2 1 Na 11 2 8 1 K 19 2 8 8 1 Rb 37 2 8 18 8 1 Cs 55 2 8 18 18 8 1
碱金属元素PPT课件1

科学方法小结:
事实分析 (分析原子结构) 进行推论 (预测化学性质)
结论 (推论是正确的)
实验探究 (碱金属与O2、 H2O反应)
钾燃烧的火焰是什么颜色 钠燃烧的火焰又是什么颜色 在北京奥运会开幕式上, 及节日 燃放的绚丽焰火,又是怎样产生的 呢
二.碱金属的焰色反应
1.焰色反应: 很多金属或他们的化合物在灼烧时都会呈现出特殊的 颜色,这在化学上叫做焰色反应.
推测
化学性质 相递 似变 :: 似金 金属 属性 钠递 增
探究
实 验
二.碱金属的焰色反应 钠元素: 黄色 钾元素:紫色(透过篮色钴玻璃,以便滤掉黄光 的干扰)
随堂练习 1.下列物质与水反应最剧烈的是( D ) A. Li B. Na C. K D. Rb 2.K和Na有相似的化学性质,下列说法中能较好的 解释这个事实的( C ) A. 都是碱金属 B. 原子半径相差不大 C. 最外层电子数均为1 D. 化合价相同
节碱金属元素
第三节 碱金属元素
碱金属元素的原子结构 碱金属元素的化学性质 碱金属元素的焰色反应
一.碱金属元素的原子结构及化学性质
请阅读教材P33表格及表格 下面全部内容.然后归纳出 碱金属元素原子结构的相 似性和递变规律
一.碱金属元素的原子结构及化学性质
结构 1 相似性: 最外层电子数都是 增大 决 递变性 : (从Li到Cs) 原子 半径
2.焰色反应是物理现象.
3.焰色反应是元素的性质:
钠元素: 钾元素: 紫色(透过篮色钴玻璃,以便滤掉黄光的干扰)
黄色
二.碱金属的焰色反应
4.实验步骤: 洗
烧 蘸
观察 颜色 5.应用于鉴别物质 如:区别
烧 NaCl和KCl
碱金属完整版ppt课件
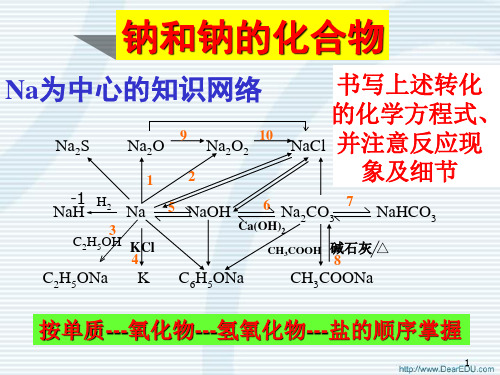
干燥氢气,防止水分损失.
偏大. 12
思考: 若把钠投入到硫酸铜溶液中,可观察 到有蓝色沉淀生成。 那么钠为什么不能大量置换硫酸铜溶 液中的铜,却产生蓝色沉淀?由此推 测,钠和硫酸铜溶液发生了哪些反应?
13
3、钠与盐溶液反应
把小块金属钠分别投入饱和NaCl溶液、NH4Cl 溶液、CuSO4溶液的烧杯里的现象和反应
• 当过氧化钠遇到还原性物质如:I-、Fe2+、SO2、 SO32-等物质时,表现出氧化性,其还原产物是水 (或碱);当过氧化钠遇到强氧化性的物质如酸 性条件下的高锰酸钾,则过氧化钠体现出还原性, 其氧化产物为氧气。
21
1、过氧化钠的强氧化性
(1) Na2O2与SO3反应: Na2O2+SO3=Na2SO4 (2) Na2O2投入FeCl2溶液中,可将Fe2+氧化成Fe3+, 同时生成Fe(OH)3沉淀 (3) Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液 变浑浊。 (4)Na2O2投入Na2SO3溶液中,可将SO32-氧化成SO42(5) Na2O2投入品红溶液中,因其有氧化性,所以有漂 白性,可使品红溶液褪色.
30
Na2O2和NaHCO3两固体混合物于密闭容器中 加热后残留固体的成分判断
当两种固体加热时,NaHCO3先分解,所产生的H2O和 CO2均能被Na2O2吸收,在此可以看成Na2O2先吸收CO2 生成Na2CO3,而后再吸收H2O生成NaOH。同时注意分 解时的温度,若在100℃以上,H2O是以气态形式存在, 但不管是什么温度,产生的气体中总有O2存在。
SiO2 + 2NaOH === Na2SiO3 + H2O 盛装NaOH的试剂瓶不能用玻璃塞。
36
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
点燃
2Na + O2 = Na2O2
钾、铷、铯等碱金属与氧气反应生成更复杂的氧化物。
2020/10/18
9
碱金属与氯气反应:
设R为碱金属,和氯气反应的方程式为:
点燃
2R + Cl2 = 2RCl
2020/10/18
10
2. 碱金属与水的反应
设R为碱金属,和水反应的通式为: 2R + 2H2O = 2ROH + H2↑
铯 Cs 55 略带金色光泽, 1.879 28.40 678.4 柔软
2020/10/18
12
谢谢您的聆听与观看
THANK YOU FOR YOUR GUIDANCE.
感谢阅读!为了方便学习和使用,本文档的内容可以在下载后随意修改,调整和打印。欢迎下载!
汇报人:XXX 日期:20XX年XX月XX日
2020/10/18
11
三 物理性质
元素 元素 核电 颜色和状态 名称 符号 荷数
锂 Li 3 银白色,柔软
密度 熔点℃ 沸点℃
g/cm
3
0.534 180.5 1347
钠 Na 11 银白色,柔软 0.97 97.81 882.9
钾 K 19 银白色,柔软 0.86 63.65 774
铷 Rb 37 银白色,柔软 1.532 38.89 688
2020/10/18
7
回忆: 钠与溶液反应的顺序?
先酸 后水 再盐 钾与溶液反应的顺序与钠是相似的 也是 先酸 后水 再盐
2020/10/18
8
二 碱金属的化学性质
1.与非金属反应
碱金属的化学性质十分活泼,在空气中燃烧生成不同的产物
点燃
4Li + O2 = 2Li2O
注意:锂与其它碱金属不同,与氧气反应只生成氧化锂。
钠(Na)
+19 2 8 8 1
+37 2 8 18 8 1
钾(K)
铷(Rb)
+55 2 8 18 18 8 1 铯(Cs)
请大家比较他们的异同?
相同点: 最外层都只有一个电子。
不同点: 核电荷数不同。 电子层数不同。
2020/10/18
3
思考:
他们的原子半径怎样递变
按Li. Na.K.Rb.Cs的顺序半径越来越大。 因为电子层数越来越多的缘故。
回忆: 碱金属的家庭成员有那些
碱金属包括:
锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr)
由于它们氧化物的水化物都是可溶性强碱, 因此又将它们称为碱金属.
2020/10/18
1
第三节 碱金属元素
2020/10/18
2
一、 碱金属元素的原子结构
+3 2 1
+11 2 8 1
锂(Li)
2020/10/18
4
思考:
元素的性质和什么有关
和元素原子的最外层电子的数目有密切关系。 推论一:看书37页。
2020/10/185Βιβλιοθήκη 推论二:核电荷数增加
原子的电子层数增加
原子半径增大
原子核对最外层电子的引力减弱
还原性增强
失去电子是什么性质? 最外层电子容易失去
2020/10/18
6
请大家仔细观察实验现象!
