大学物理之热学公式篇
第三章 热力学第二定律重要公式

第三章 热力学第二定律1. 卡诺定理卡诺热机效率hc h c h 11T T Q Q Q W−=+=−=η 卡诺定理:工作于高温热源T h 与低温热源T c 之间的热机,可逆热机效率最大。
卡诺定理推论:所有工作于高温热源T h 与低温热源T c 之间的可逆热机,其热机效率都相等,与热机的工作物质无关。
卡诺循环中,热温商之和等于零0cch h =+T Q T Q 任意可逆循环热温商之和也等于零,即0R=⎟⎟⎠⎞⎜⎜⎝⎛∑i iiT Q 或 0δR =⎟⎠⎞⎜⎝⎛∫T Q 2. 热力学第二定律的经典表述克劳休斯说法:不可能把热由低温物体传到高温物体, 而不引起其他变化。
开尔文说法:不可能从单一热源吸热使之完全转化为功, 而不发生其他变化。
热力学第二定律的各种说法的实质:断定一切实际过程都是不可逆的。
各种经典表述法是等价的。
3. 熵的定义TQ S revδd =或∫=ΔB ArevδTQ S熵是广度性质,其单位为。
系统状态变化时,要用可逆过程的热温商来衡量熵的变化值。
1K J −⋅4. 克劳修斯不等式T QS δd irrev ≥ 或 ∫≥ΔB A ir rev δT Q S 等号表示可逆,此时环境的温度T 等于系统的温度,为可逆过程中的热量;不等号表示不可逆,此时T 为环境的温度,为不可逆过程中的热量。
Q δQ δ5. 熵增原理0)d (irrev≥绝热S 或0)(irrev≥Δ绝热S 等号表示绝热可逆过程,不等号表示绝热不可逆过程。
在绝热条件下,不可能发生熵减少的过程。
0)d (irrev≥孤立S 或0)(irrev≥Δ孤立S 等号表示可逆过程或达到平衡态,不等号表示自发不可逆过程。
可以将与系统密切相关的环境部分包括在一起,作为一个隔离系统,则有:0irrev sur sys iso ≥Δ+Δ=ΔS S S6. 熵变计算的主要公式计算熵变的基本公式: ∫∫∫−=+=δ=−=Δ2 12 12 1rev12d d d d TpV H T V p UTQ S S S 上式适用于封闭系统,一切非体积功过程。
大学物理化学热力学第一定律

dT
C T2
T1 p
dT
系统焓变ΔH 等于过程的热效应 Qp 非恒压过程
Q ΔH
n T2
T1
Cp.m
dT
C T2
T1 p
dT
系统焓变ΔH不等于过程的热效应 Q
注意:利用热容进行计算,要求必须是 无相变、无化学变化的单纯PVT变化过程
§2-6 理想气体体积功的计算
体积功定义式 δWe =-P环 ·dV
1)理想气体 2) 恒T 3)可逆
P1
P2 V1
理气恒温可逆膨胀过程, 系统反抗了它所能 反抗的最大外压,
故对环境作了最大功 。 相当于 P-V 线
下阴影部分面积。
V2
P1
P1
P1
Pa
Pb
P2
P2
P2
V1
V2
V1 Va Vb V2
V1
V2
一次恒外压膨胀 三次恒外压膨胀
等温可逆膨胀
We,1 P2 V2 V1
在整个膨胀过程中 P外 P dP
过程每一步 We P环 dV (P dP) dV
W V2 PdV V1
P dV
过程的任一瞬间,系统压力
P环 与都只相差一个无限
理想气体等温可逆过程: 小量,则用 P系 代替
Wr
nRT
ln
V2 V1
nRT
ln
P1 P2
注意公式应用条件,缺一不可:
限缓慢,需要时间无限长,过程的
每一步,都是由一个平衡态变到极
邻近的另一平衡态,称为可逆过程
回顾:可逆过程 体系与环境的相互作用无限接近于 平衡条件下进行的过程
可逆过程的四个特点: ①每一步无限接近平衡 ②无限缓慢 ③可步步回复,原路返回,体系和环境可同时复原 ④效率最大
大学物理常用公式(电场磁场 热力学)

第四章 电 场一、常见带电体的场强、电势分布2)均匀带电球面(球面半径 )的电场:3)无限长均匀带电直线(电荷线密度为): E = ,方向:垂直于带电直线。
2r( rR ) 4)无限长均匀带电圆柱面(电荷线密度为):E =2r (rR )5)无限大均匀带电平面(电荷面密度为)的电场: E =/20 ,方向:垂直于平面。
二、静电场定理 1、高斯定理:e = ÑE v dS v = q 静电场是有源场。
Sq 指高斯面内所包含电量的代数和;E 指高斯面上各处的电场强度,由高斯面内外的全 部电荷产生; Ñ E vdS v 指通过高斯面的电通量,由高斯面内的电荷决定。
2、环路定理: Ñ E v dl v =0 静电场是保守场、电场力是保守力,可引入电势能三、求场强两种方法1、利用场强势叠加原理求场强 分离电荷系统: E v = E v i ;连续电荷系统: E v = dE v i =12、利用高斯定理求场强 四、求电势的两种方法n1、利用电势叠加原理求电势 分离电荷系统:U =U i ;连续电荷系统: U = dU i =1电势零点v v 2、利用电势的定义求电势 U =电势零点Edl五、应用vv b点电荷受力: F = qE电势差: U ab =U a -U b = b EdraE =1 qU =q4r 24r1)点电荷:E =0 (rR ) q2 (rR ) 4r 2U =q (r R ) 4r q (r R ) 4Ra 点电势能:W a = qU a由 a 到 b 电场力做功等于电势能增量的负值 A ab = -W = -(W b -W a )六、导体周围的电场1、静电平衡的充要条件: 1)、导体内的合场强为 0,导体是一个等势体。
2)、导体表面的场强处处垂直于导体表面。
E v ⊥表面。
导体表面是等势面。
2、静电平衡时导体上电荷分布: 1)实心导体: 净电荷都分布在导体外表面上。
物理化学笔记公式c超强

热力学第一定律功:δW =δW e +δW f(1) 膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2) 非膨胀功δW f =xdy 非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q +W =Q —W e =Q —p 外dV (δW f =0) 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1) 等压热容:C p =δQ p /dT = (∂H/∂T )p (2) 等容热容:C v =δQ v /dT = (∂U/∂T )v理想气体ΔU,ΔH 的计算: 对理想气体的简单状态变化过程:定温过程:Δ U =0; Δ H =0变温过程:对理想气体, 状态变化时 dH=dU+d(PV) 若理想气体的摩尔热容没有给出,常温下有:理想气体绝热可逆过程方程式:标准态:气体的标准态:在任一温度T 、标准压力 P 下的纯理想气体状态;液体(或固体)的标准态:在任一温度T 、标准压力下的纯液体或纯固体状态。
标准态不规定温度,每个温度都有一个标准态。
摩尔反应焓:单位反应进度(ξ=1mol)的反应焓变Δr H m 。
标准摩尔生成焓:一定温度下由热力学稳定单质生成化学计量数 νB=1的物质B 的标准摩尔反应焓,称为物质B 在该温度下的标准摩尔生成焓。
用 表示 (没有规定温度,一般298.15 K 时的数据有表可查)标准摩尔燃烧焓:一定温度下, 1mol 物质 B 与氧气进行完全燃烧反应,生成规定的燃烧产物时的标准摩尔反应焓,称为B 在该温度下的标准摩尔燃烧焓。
用 表示.单位:J mol-1为可逆过程中体积功的基本计算公式,只能适用于可逆过程。
计算可逆过程的体积功时,须先求出体系的 p~V 关系式,然后代入积分。
⎰-=21d V V V p W 2112ln ln p pnRT V V nRT W -=-=适用于理想气体定温可逆过程。
大学物理热学知识点整理

大学物理热学知识点整理热运动:物质世界的一种基本运动形式,是构成宏观物体的大量微观粒子的永不停息的无规则运动。
热现象:构成宏观物质的大量微观粒子热运动的集体表现。
宏观量:表征系统状态的物理量。
微观量:描写单个分子特征的物理量。
热力学系统,简称系统:一些包含有大量微观粒子(如分子、原子)的物体或物体系。
外界或环境:系统以外的物体。
孤立系统:与外界没有任何相互作用的热力学系统。
封闭系统:与外界没有物质交换但有能量交换的系统。
开放系统:与外界既有物质交换又有能量交换的系统。
平衡态:对于一个孤立系,经过足够长的时间后,系统必将达到一个宏观性质不随时间变化的状态,这种状态称为平衡态。
热动平衡:在平衡态下,组成系统的微观粒子仍处在不停的无规则热运动之中,只是它们的统计平均效果不变,这是一种动态的平衡,又称为热动平衡。
状态参量:在平衡态下,热力学系统的宏观性质可以用一些确定的宏观参量来描述,这种描述系统状态的宏观参量称为状态参量。
态函数:由平衡态确定的其他宏观物理量可以表达为一组独立状态参量的函数,这些物理量称为“态函数”。
体积V :气体分子所能到达的空间,即气体容器的容积。
单位立方米( m^{3} ),也用升( L )为单位。
压强p :气体作用与容器壁单位面积上的压力,是大量分子对器壁碰撞的宏观表现。
SI单位制中单位是帕斯卡,简称帕( Pa ), 1\;Pa=1\;N/m^{2} 。
有时压强的单位还用大气压( atm )和毫米汞柱( mmHg )表示。
换算关系为1\;atm=1.013\times10^{5}\;Pa1\;mm\Hg=\frac{1}{760}\;atm=1.33\times10^{2}\;Pa温度:表征物体的冷热程度的物理量。
热平衡:在与外界影响隔绝的条件下,使两个热力学系统相互接触,让它们之间能发生传热,热的系统会慢慢变冷,冷的系统会慢慢变热,经过一段时间后,它们会达到一个共同的平衡状态,称这两个系统达到了热平衡。
大学物理热学知识点整理

大学物理热学知识点整理系统吸收的热量,一部分转化成系统的内能;另一部分转化为系统对外所作的功。
Q=\Delta E+A上式的各量均为代数量,其正负号规定为:系统从外界吸热时, Q 为正,向外界放热时, Q 为负;系统对外作功时,A 为正。
外界对系统作功时, A 为负;系统内能增加时,\Delta E 为正,系统的内能减少时, \Delta E 为负。
对于状态的微小变化过程,热力学第一定律的数学表达式dQ=dE+dA第一类永动机:一种不需要外界提供能量而连续不断对外作功,系统又能复原的机器。
等体过程:dV=0 ,系统作功dA=pdV=0dQ_v=dE=\frac{M}{M_{mol}}\frac{i}{2}RdT所以 Q_v=\Delta E=E_2-E_1=\frac{M}{M_{mol}}\frac{i}{2}R(T_2-T_1)在等体过程,外界传给气体的热量全部用来增加气体的内能,系统对外不作功。
等压过程: p =恒量,当气体体积从 V_1 膨胀到 V_2 时,系统对外作功为A_p=\int_{V_1}^{V_2}pdv=p(V_2-V_1)=\frac{M}{M_{mol}}R(T_2-T_1)系统吸收的热量为Q_p=\Delta E+p(V_2-V_1)=\frac{M}{M_{mol}}(\frac{i}{2}+1)R(T_2-T_1)等温过程: \Delta E=0Q_T=A_T=\int_{V_1}^{V_2}pdv=\frac{M}{M_{mol}}RT\ln\fra c{V_2}{V_1}因为 pV=常量,即 p_1V_1=p_2V_2所以 Q_T=A_T=\frac{M}{M_{mol}}RT\ln\frac{p_1}{p_2}摩尔热容 C_m: 1mol 物质温度升高(或降低) 1K 时所吸收(或放出)的热量,单位为 J/mol\cdot K 。
C_m=\frac{(dQ)_m}{dT}理想气体等体摩尔热容:C_V=\frac{dQ_V}{dT}=\frac{dE}{dT}=\frac{\frac{i}{2}RdT }{dT}=\frac{i}{2}Ri 为分子自由度; R 为普适气体常量。
大学物理常用公式(电场磁场-热力学)
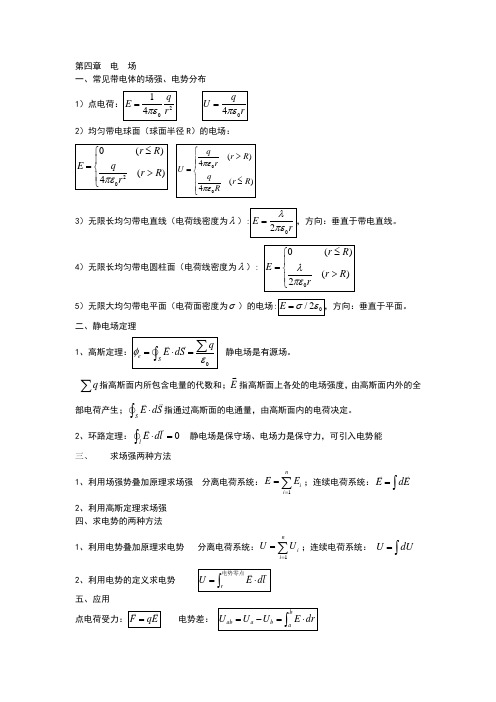
第四章 电 场一、常见带电体的场强、电势分布 1)点电荷:2014q E r πε=04q U rπε=2)均匀带电球面(球面半径R )的电场:200()()4r R E qr R r πε≤⎧⎪=⎨>⎪⎩00()4()4qr R r U q r R R πεπε⎧>⎪⎪=⎨⎪≤⎪⎩3)无限长均匀带电直线(电荷线密度为λ):02E rλπε=,方向:垂直于带电直线。
4)无限长均匀带电圆柱面(电荷线密度为λ): 00()()2r R E r R rλπε≤⎧⎪=⎨>⎪⎩5)无限大均匀带电平面(电荷面密度为σ)的电场:0/2E σε=,方向:垂直于平面。
二、静电场定理 1、高斯定理:0e Sq E dS φε=⋅=∑⎰静电场是有源场。
q ∑指高斯面内所包含电量的代数和;E指高斯面上各处的电场强度,由高斯面内外的全部电荷产生;SE dS ⋅⎰指通过高斯面的电通量,由高斯面内的电荷决定。
2、环路定理:0lE dl⋅=⎰ 静电场是保守场、电场力是保守力,可引入电势能三、求场强两种方法1、利用场强势叠加原理求场强 分离电荷系统:1ni i E E ==∑;连续电荷系统:E dE =⎰2、利用高斯定理求场强 四、求电势的两种方法1、利用电势叠加原理求电势 分离电荷系统:1nii U U==∑;连续电荷系统: U dU =⎰2、利用电势的定义求电势 rU E dl =⋅⎰电势零点五、应用点电荷受力:F qE = 电势差: bab a b aU U U E dr =-=⋅⎰a由a 到b六、导体周围的电场1、静电平衡的充要条件: 1)、导体内的合场强为0,导体是一个等势体。
2)、导体表面的场强处处垂直于导体表面。
E ⊥表表面。
导体表面是等势面。
2、静电平衡时导体上电荷分布: 1)实心导体: 净电荷都分布在导体外表面上。
2)导体腔内无电荷: 电荷都分布在导体外表面,空腔内表面无电荷。
3)导体腔内有电荷+q ,导体电量为Q :静电平衡时,腔内表面有感应电荷-q ,外表面有电荷Q +q 。
大学物理化学公式大全

热力学第一定律功:δW =δW e +δW f(1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA 。
热 Q:体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能与焓只就是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (∂H/∂T)p (2)等容热容:C v =δQ v /dT = (∂U/∂T)v 常温下单原子分子:C v,m =C v,m t =3R/2常温下双原子分子:C v,m =C v,m t +C v,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V)T ](∂V/∂T)p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =H p T ⎪⎪⎭⎫⎝⎛∂∂=-()pT C p H ∂∂ 实际气体的ΔH 与ΔU:ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫⎝⎛∂∂+dp p H T ⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BAB A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式:(1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2)Maxwell 关系:T V S ⎪⎭⎫⎝⎛∂∂=VT p ⎪⎭⎫ ⎝⎛∂∂Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫ ⎝⎛∂∂ (3)热容与T 、S 、p 、V 的关系:C V =T V T S ⎪⎭⎫ ⎝⎛∂∂ C p =T pT S ⎪⎭⎫⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap,fus,sub 。
大学物理热学部分
(3)求电子的 v p , v, vrms。
解:(2)归一化条件(3)vp vF
vF f vdv vF Av2dv v = vF v f vdv
0
0
0
f v
AvF2
1 3
AvF 3
1
A 3vF 3
v2
vF 0
=
Av3dv vF v2 f
1 4
AvF 4
v dv
vF
3 4
vF
Av4dv
3RT
2021/4/17
7
热学习题课
四、麦克斯韦速率分布律 2.速率分布曲线
dN:v v dv区间内的分子数 (1)f v v 曲线
dN :v v dv区间内的分子
f (v)
N 数占总分子数的百分比
dN f v dv
N
1.速率分布函数:
f v dN
Ndv
dS
o v v dv
v
2021/4/17
3
热学习题课
❖ 气体动理论
一、状态方程
R 8.31J mol1 K1
pV RT
——气体的普适常量
p
nkT
其中:
k R 1.381023 J K1 NA
m ' ——气体的物质的量 ——玻尔兹曼常数
M
二、理想气体的压强公式与温度公式
m ' ——气体的总质量
M ——气体的摩尔质量 n——分子数密度
温度升高 温度降低 系统吸热 系统放热
T 0, E 0 T 0, E 0 Q0 Q0
2021/4/17
过程
等体
17
热学习题课
等压
等温
绝热
大学物理 第21章 热力学第一定律
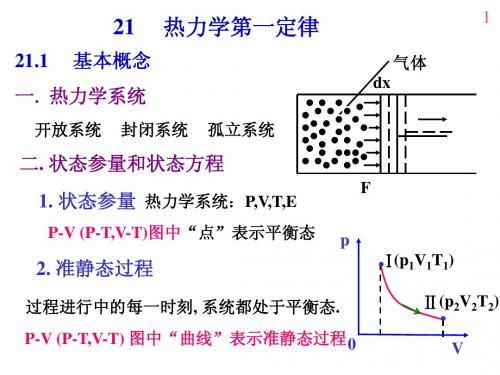
.Ⅰ(p V T )
1 1 1
Ⅱ(p2V2T2)
.
V
21.3 热力学第一定律
一. 功
系统对外做功(体积功) dx 气体 F
2
A Fdx PSdx PdV
A dA PdV
V1 V2
讨论:
1)A > 0 系统对外界做正功; A < 0 系统对外界做负功。 2)P-V 图上曲线下面积表示体积功大小。 3) 功是过程量。
CV (
定体摩尔热容量 CV , m
1 Q 摩尔热容量 C m dT
Q>0 Q<0
从外界吸收热量 系统向外界放热
dT dT 1 Q 1 dE ( )V ( ) dT dT
)V (
)V
三、内能
系统内所有粒子各种能量的总和。 热力学领域:系统内所有分子热运动动能和分子间 相互作用势能之和。 通常
绝热线比等温线陡
p1 p2 p2
0
等温线
( 1)
V
p nkT
{
等温: T不变,n
绝热: T ,n
p p
V1
V2
9
11
用比较曲线斜率的方法证明在p---V图上相交于任一点的理想 气体的绝热线比等温线陡。
证明:过p---V图上任一点(p,V)点,等温线的斜率为:
dp d C C pV p ( )T [ ( )]T 2 2 dV dV V V V V
4
E E (T ,V )
——内能是状态量。
理想气体内能:仅为分子热运动的各种动能之和。
——理想气体的内能是温度的单值函数。
M i E RT M mol 2
大学物理(热学知识点总结)

v
5、一定量理想气体从体积V1 膨胀到体积V2 分别经历的过程是: A→B等压过程;A→C等温过程;A→D绝热过程。其中吸 P 热最多的过程: A)是A→B。 √
A
B)是A→C 。 C)是A→D。
D)既是A→B,也是A→C, 两过程吸热一样多。
o
V1
V2 V
B C D
6、一定量的理想气体,经历某过程后,它的温度升高了。则 根据热力学定律可以断定: ① 理想气体系统在此过程中吸了热。 ② 在此过程中外界对理想气体系统作了功。 ③ 理想气体系统的内能增加了。 ④ 理想气体系统既从外界吸了热,又对外作了功。 A) ① ③ B) ② ③ C) ③ √ D) ③ ④ E) ④
1 1 b( P1 ,V1 ) c( P1 ,4V1 ) 4 4 P 1 4
P P1
a
c
b
Q A (3 / 4 ln4) p1V1
[2]. (8-4)0.02kg的氦气(视为理想气体),温度由170C升为270C, 若在升温过程中,(1)体积保持不变;(2)压强保持不变;(3) 不与外界交换热量,试分别求出气体内能的改变、吸收的热量、 外界对气体所作的功。
3kT 3 RT RT v 1.73 m0 M M
2
3、麦克斯韦速度分布函数
m0 f (v x , v y , v z ) e 2πkT
4、玻耳兹曼分布律 重力场中粒子按高度的分布
大气压强随高度的变化 5、准静态过程的功 6、热力学第一定律:
3 2
2 2 m0 ( v 2 x v y vz )
p nkT
√
3 A)n 不同, (EK / V )不同, ρ不同。 E K nw n kT B)n 不同, (EK / V )不同, ρ相同。 V 2 C)n 相同, (EK / V )相同, ρ不同。 M pV RT D)n 相同, (EK / V )相同, ρ相同。 M
大学物理(热学篇)

v1
v´1
x
A1 y °
z
1秒钟A1受到分子的总冲量
2mv x
vx 2x
mv
2 x
x
第三步 N个分子在1秒内对A1的碰撞
A1在1秒内受到的冲量——平均作用力F
F 2mv1x
v1 x 2x
2mv2x
v2x 2x
2mv Nx
vNx 2x
m x
(v12x
v22x
vN2 x )
m x
N
即在平衡态,一个自由度,代表一种独立的 运动和一份能量
如某种分子有t个平动自由度,r个转动自由度v振动 自由度,则分子具有:
平均平动动能 平均转动动能 平均振动动能
为什么均分到各自由度所对应的运动能量都 是二分之一KT呢? 主要是分子不断碰撞以达到平衡态的结果。
注意
1、 一般温度下(T <10 3 K)振
(1)每个分子作用于气壁的冲量I
解(1)每个分子作用于气壁的冲量等于气体 分子动量增量的负值
I 2mv 1.21024kgm/ s
(2)每秒钟碰在器壁单位面积上的分子数n0
解(2)器壁ΔA面积上在Δt时间内碰撞的分子数
N A vt n
z
6
n0
N At
nv 6
n0
1 6
nv
0.31028
/
m3
物体运动形式:平动、转动、振动
自由度数目 i t r v
平转振 动动动
例1 自由运动的质点 (三维空间) 3 个 平动自由度 记作 t = 3
若受到限制,自由度降低 平面上 : t=2 直线上 :t=1
例2 自由运动刚体 (如手榴弹)自由度。
(完整版)大学物理热力学

①:
A
CV
T2
T1
dT
CV (T2 T1) CV (T1 T2 )
②:
A
V2
V1
PdV
P V V2
V1 1 1
dV V
1
1
(
P1
V1
P2V2
)
③:
A
R 1
(T2
T1 )
(4)、绝热线与等温线比较
等温过程: PV = C
P dV + V dP = 0
等温线上A点的斜率
(
dP dV
)
T
[例1]下面理想气体的各种过程是否可能? (1)内能减少的等容加热过程。
(不可能。dV=0,dA=0
dQ=dE,加热则dQ>0,dE>0)
(2)吸收热量的等温压缩过程。
(不可能.等温过程PV=C, dA<0, dT=0,
dE=0, dQ=dA<0,只能放热。)
(2)、定容摩尔热容
1mol理想气体在等容过程中升温1K时所吸收的热量。
CV
dQV dT
对于等容过程,有 dQV dE
所以
CV
dQV dT
dE dT
d dT
(
i 2
RT
)
i 2
R
刚性分子 C V 的数值 ( 单位: J.K .mol )
单原子
双原子
多原子
3 2
R
=
12.5
5 2
R
=
20.8
6 2
CV R CP 定压摩尔热容
Qp
M
Cp (T2
T1)
Cp (T2
T1)
(3)、定压摩尔热容
大学物理化学公式总结

大学物理化学公式总结物理化学作为一门综合性的学科,涉及到丰富而复杂的理论和实验内容。
公式作为物理化学研究的重要工具,既能简化问题的处理过程,又能揭示事物背后的规律和原理。
在这篇文章中,我们将总结一些大学物理化学中常见的公式,并探索它们背后的意义和应用。
1. 经典力学公式经典力学是物理学的基础,它研究物体在力的作用下的运动规律。
在这个领域中,公式起到了关键的作用,其中最基本的公式就是牛顿第二定律:F = ma该公式表示物体的加速度(a)与作用在物体上的力(F)的关系。
通过这个公式,我们可以推导出许多与运动相关的公式,如位移-时间关系、速度-时间关系等。
2. 热力学公式热力学研究物质的热现象和能量转化规律,是理解自然界中热现象的重要工具。
其中最基本的公式是热力学第一定律,也被称为能量守恒定律:ΔU = q + W该公式表示系统的内能(U)的变化等于系统所吸收的热量(q)与对外做功(W)的和。
这个公式揭示了能量在系统中的转化关系,并为热力学研究提供了基础。
3. 电磁学公式电磁学是物理学中的重要分支,研究电、磁场的相互作用及其规律。
其中,麦克斯韦方程组是电磁学研究的核心公式,它由四个方程组成:∇·E = ρ/ε₀∇·B = 0∇×E = -∂B/∂t∇×B = μ₀J + μ₀ε₀∂E/∂t这四个方程描述了电场(E)和磁场(B)的产生和相互作用,是现代电磁学研究的基础。
它们揭示了电磁波传播的规律,为电磁学中很多应用提供了理论依据。
4. 量子力学公式量子力学作为最前沿的物理学分支,研究微观世界的行为。
其中最著名的公式是薛定谔方程:Ĥψ =Eψ这个方程描述了量子系统的波函数(ψ)和能量(E)之间的关系。
它是揭示原子、分子结构和行为的关键公式,让我们能够理解原子和分子的性质,同时也为应用于量子计算和量子通信等领域提供了基础。
总结:在这篇文章中,我们总结了大学物理化学中的一些重要公式,并探讨了它们背后的意义和应用。
大学物理(热学知识点总结)

7、bca为理想气体绝热过程,b1a和b2a是任意过程,则上述两 过程中气体作功与吸收热量的情况是: A) b1a过程放热,作负功;b2a过程放热,作负功. B) b1a过程吸热,作负功;b2a过程放热,作负功. C)b1a过程吸热,作正功;b2a过程吸热,作负功. D) b1a过程放热,作正功;b2a过程吸热,作正功.
[1]、有一定量的理想气体,从初状态 a (P1 、V1 )开始, 经过一个等容过程达到压强为P1 / 4 的 b 态,再经过一个等 压过程达到状态C ,最后经过等温过程而完成一个循环, 求:该循环过程中系统对外作的功A 和所吸收的热量Q。 解:由已知可得: a( P 1 ,V1 )
循环过程
E 0 Q A V V1 1) a b A 0 2) b c A p1 (4V1 V1 ) / 4 3 p1V1 / 4 3) c a A p1V1 ln( V1 / 4V1 ) p1V1 ln4
p (105 Pa) 3 2 1 O A 1 2 C V (103 m3) B
解:(1) A→B:
A1
ΔE1= CV (TB-TA)=3(pBVB-pAVA) /2=750 J Q=A1+ΔE1=950 J. B→C: A2 =0 ΔE2 = CV (TC-TB)=3( PCVC-PBVB ) /2 =-600 J. Q2 =A2 +ΔE2 =-600 J. C→A: A3 = PA (VA-VC)=-100 J.
解( : 1) 等 容 过 程 , A 0, 外 界 对 气 体 作 功 A 0 M i Q E CV T RT M mol 2 0.02 3 8.31 ( 300 290 ) 623 ( J ). 0.004 2 (2)等压过程, E 与 ( 1) 同 。
大学物理热力学公式(2024)

2024/1/30
1
目录
2024/1/30
• 热力学基本概念与公式 • 热力学第一定律 • 热力学第二定律 • 气体动理论基础与公式 • 相变与潜热公式 • 热力学循环与效率公式
2
01
热力学基本概念与公式
Chapter
2024/1/30
3
热力学系统与环境
01
热力学系统
所研究的对象,与周 围环境有物质和能量 的交换。
14
热力学第二定律表述及意义
克劳修斯表述
热量不能自发地从低温物体传到 高温物体。它说明在没有外界影 响的条件下,热传导过程是不可 逆的。
开尔文表述
不可能从单一热源吸收热量,使 之完全变成功,而不产生其他影 响。它说明功转变为热的实际宏 观过程是不可逆的。
热力学第二定律的意义
揭示了自然界中与热现象有关的 宏观过程的不可逆性,反映了宏 观自然过程的方向性。
自由膨胀过程
气体在真空中自由膨胀时,不受外界约束,体积自发增大。该过程中,系统的熵增加,表明自由膨胀是一个 不可逆过程。
17
04
气体动理论基础与公式
Chapter
2024/1/30
18
气体分子运动论概述
气体分子运动论是研究气体分子热运动的宏观规律和微观机制的理论基础。
气体分子运动论的基本假设包括:气体分子是由大量不断运动的质点组成,分子间的作用力可以忽略不 计,分子与器壁之间的碰撞是完全弹性的。
朗肯循环
朗肯循环是一种蒸汽动力循环,由锅 炉、汽轮机、凝汽器和给水泵等设备 组成。朗肯循环在火力发电厂、核电 站等领域得到广泛应用。其优点是可 以利用低品位的热能;缺点是需要消 耗大量的水资源,并且对环境有一定 影响。
大学物理:第七章 热力学定律

功
做功可以改变系统的状态
做功是系统与外界交换能量的一种方式 在热学中,它是外界有序运动能量与系
统无序运动能量间的转换。过程量
摩擦升温(机械功) 电加热(电功)
上海交通大学 物理系
准静态过程的功
dA PSdl PdV 若A>0系统对外界作功.
A dA v2 PdV v1
若A<0外界对系统作功
上海交通大学 物理系
准静态过程
可以用P-V图描述准静态的变化过程,这P-V图上的每 上点都可表示系统的一个平衡态。
准静态做功:气体膨胀过程
P
P1
P
P2
12
V1 V2 V
上海交通大学 物理系
准静态过程
作功是系统与外界交换能量的一种方式,是力 学相互作用下的能量转移。作功是通过宏观的 有规则运动来完成的。
上海交通大学 物理系
理想气体
严格满足玻意耳定律 pV = vRT
压强趋向于零极限状态下的气体
满足道尔顿分压定律 满足阿伏伽德罗定律 满足焦耳定律 U=U(T) 内能由系统的状态唯一地确定,并随状态变化而变化, 是状态的单值函数
E E(2) E(1)
上海交通大学 物理系
理想气体的内能 焦耳实验
上海交通大学 物理系
气体实验定律
关于气体热学行为的5个基本实验定律, 也是建立理想气体概念的实验依据。
玻意耳定律
盖·吕萨克定律 查理定律。 阿伏伽德罗定律 道耳顿定律
上海交通大学 物理系
§9.1 热力学第一定律
包括热现象在内的能量守恒和 转换定律
热力学第一定律
Q U2 U1 W
系统从外界吸热 Q
处于平衡态系统的内能是确定的;
大学物理之热学公式篇

热 学 公 式令狐采学1.理想气体温标定义:0273.16limTPp TPp T K p →=⋅(定体)2.摄氏温度t 与热力学温度T 之间的关系:0//273.15t C T K =-华氏温度F t 与摄氏温度t 之间的关系:9325F t t =+3.理想气体状态方程:pV RT ν=1mol 范德瓦耳斯气体状态方程:2()()m map V b RT V +-= 其中摩尔气体常量8.31/R J mol K =⋅或28.2110/R atm L mol K -=⨯⋅⋅4.微观量与宏观量的关系:p nkT =,23kt p n ε=,32kt kT ε=5.标准状况下气体分子的数密度(洛施密特数)2530 2.6910/n m =⨯6.分子力的伦纳德-琼斯势:126()4[()()]p E r rrσσε=-,其中ε为势阱深度,σ=,特别适用于惰性气体,该分子力大致对应于昂内斯气体;分子力的弱引力刚性球模型(苏则朗模型):6000, ()(), p r r E r r r r rφ+∞<⎧⎪=⎨-≥⎪⎩,其中0φ 为势阱深度,该分子力对应于范德瓦耳斯气体。
7.均匀重力场中等温大气分子的数密度(压强)按高度分布:00()mgz Mgz kTRTn z n en e--==,//00()mgz kT Mgz RT p z p e p e --==,大气标高:RTH Mg=。
8.麦克斯韦速率分布函数:23/222()4()2mvkT dN m f v e v Ndv kTππ-==;其简便形式:22()u f u du e du -=,其中p v u v =。
9.三个分子速率的统计平均值:最概然速率:p v ==平均速率:v ==;方均根速率:rms v ===10.分子通量14nv Γ=:单位时间内,单位面积容器壁所受到的分子碰撞次数。
12.能量均分定理:在温度为T 的平衡态下,物质分子的每一个自由度都具有相同的平均动能,其大小都等于/2kT 。
《大学物理》第19章 热力学第一定律

O
V
dV 0 dW 0
dT 0 dEint 0 dQ 0
O
V
dV 0 dW 0
dT 0 dEint 0 dQ 0
上页 下页 返回 退出
热力学第一定律
dEint dQ dW
dQp
dE
dW
m M mol
(CV
R)dT
在等压过程中,理想气体吸热的一部分用于 增加内能,另一部分用于对外作功。
上页 下页 返回 退出
此外, 由于
可知
也与实验结果相符.
对于分子结构更复杂的气体,分子热容变大。 这是因为存在其他形式的内能(转动,振动等)
上页 下页 返回 退出
自由度
每一个转动或振动模式对应一个自由度。
能够描述整个运动过程的维度
上页 下页 返回 退出
z
z
C(x, y, z)
y x
单原子分子
C(x, y, z)
气体向外界释放的净热 量为多少?
上页 下页 返回 退出
系统
1
P
b
s2
膨胀过程
a
2
s1
压缩过程
外界
W1a2 s1 0 W2b1 (s1 s2) 0
O V1
V2 V
W1a2b1 W1a2 W2b1 s2 0
DEint Q W
0
S2 S2
上页 下页 返回 退出
理想气体
Q0
上页 下页 返回 退出
§19-8 气体分子热容与能量均分定理 气体的摩尔热容
气体的比热与热力学过程有关
对于气体而言,等体过程和等压过程的比热是不同的
大学物理基本公式(二)

大学物理基本公式(二)引言概述:大学物理中,物理基本公式是学习和应用物理学概念和原理的基础。
本文将重点介绍大学物理中的一些基本公式(二),包括力学、电磁学和波动光学等领域的公式。
通过学习这些公式,能够更好地理解和应用物理学知识。
正文:1. 力学公式:1.1 牛顿第二定律: F = ma,描述物体在外力作用下的加速度。
1.2 动能公式: E_k = (1/2)mv^2,计算物体的动能。
1.3 势能公式: Ep = mgh,计算物体在重力场中的势能。
1.4 动量公式: p = mv,描述物体的动量。
1.5 万有引力定律: F = G(m1m2/r^2),计算两个物体之间的引力。
2. 电磁学公式:2.1 库仑定律: F = k(q1q2/r^2),描述两个电荷之间的作用力。
2.2 电场强度公式: E = F/q,描述电荷在电场中所受的力。
2.3 电压公式: V = IR,描述电流通过导体时的电势差。
2.4 磁场强度公式: B = µ0(I/2πr),计算在电流通过导线时的磁场强度。
2.5 磁感应强度公式: B = µ0N/lI,计算螺线管中的磁感应强度。
3. 波动光学公式:3.1 光速公式: c = λν,描述光的传播速度。
3.2 折射定律: n1sinθ1 = n2sinθ2,描述光在两种介质中的折射现象。
3.3 成像公式: 1/f = 1/v + 1/u,计算透镜成像的距离。
3.4 焦距公式: f = R/2,计算球面镜的焦距。
3.5 干涉公式: Δd = mλ,描述两束光相干干涉时的光程差。
4. 其他公式:4.1 热力学公式: Q = mcΔT,计算物体的热量变化。
4.2 波函数公式: Ψ(x,t) = A sin(kx - ωt + φ),描述波动的波函数。
4.3 相对论能量公式: E = mc^2,描述物体的能量与质量之间的关系。
4.4 等离子体频率公式: ω^2 = (e^2n)/(ε0m),计算等离子体中的电磁波频率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热 学 公 式
1.理想气体温标定义:0
273.16lim
TP p TP
p
T K p →=⋅(定体) 2.摄氏温度t 与热力学温度T 之间的关系:0
//273.15t C T K =- 华氏温度F t 与摄氏温度t 之间的关系:9325
F t t =+ 3.理想气体状态方程:pV RT ν=
1mol 范德瓦耳斯气体状态方程:2()()m m
a
p V b RT V +
-= 其中摩尔气体常量8.31/R J mol K =⋅或2
8.2110/R atm L mol K -=⨯⋅⋅
4.微观量与宏观量的关系:p nkT =,23kt p n ε=
,32
kt kT ε= 5.标准状况下气体分子的数密度(洛施密特数)2530 2.6910/n m =⨯
6.分子力的伦纳德-琼斯势:12
6
()4[()()]p E r r
r
σ
σ
ε=-,其中ε为势阱深度,
6
2
r σ=
,特别适用于惰性气体,该分子力大致对应于昂内斯气体;
分子力的弱引力刚性球模型(苏则朗模型):06
000, ()(), p r r E r r r r r
φ+∞<⎧⎪
=⎨-≥⎪⎩,其中0φ 为势阱深度,该分子力对应于范德瓦耳斯气体。
7.均匀重力场中等温大气分子的数密度(压强)按高度分布: 00()mgz Mgz kT
RT
n z n e
n e
--
==,//00()mgz kT Mgz RT p z p e p e --==, 大气标高:RT
H Mg
=。
8.麦克斯韦速率分布函数:2
3/222
()4()2mv
kT dN m f v e v Ndv kT ππ-==;其简便形式:
2
24()u f u du u e du π
-=,其中p v u v =。
9.三个分子速率的统计平均值:最概然速率:22p kT RT
v m M
==
; 平均速率:88kT RT
v m M ππ=
=;方均根速率:233rms
kT RT
v v m M
===。
10.分子通量1
4
nv Γ=:单位时间内,单位面积容器壁所受到的分子碰撞次数。
12.能量均分定理:在温度为T 的平衡态下,物质分子的每一个自由度都具有相同
的平均动能,其大小都等于/2kT 。
分子平均能量:1
(2)22
i kT t r v kT ε==++,其中t 、r 、v 分别为平动、转动、振动自由度。
单原子分子:3i =;刚性双原子分子:5i =;刚性线型多原子分子:5i =;刚性非线型多原子分子:6i =;以上刚性分子均不包含振动自由度v ;对于非刚性分子,振动自由度数v 一般不是整数,须经量子力学计
算。
13.热传导的傅里叶定律:热流密度dT
q dz
κ
=-;⇒ 热传导的热欧姆定律:热流量1T
L A
φκ∆=
,其中κ为热导率。
14.关于自然对流的牛顿冷却定律:hA T φ=∆,其中h 为自然对流系数,T ∆是固
体表面和流体主体间的温差。
15.黑体的总辐出度(辐射热流密度)4()b R T T σ=,其中斯特藩-玻尔兹曼常量
8245.6710/W m K σ-=⨯⋅。
一般物体(可近似视为灰体)的总辐出度4()R T T ασ=,其中α为灰体的吸收率或发射率(两者相等)。
16.黑体辐射的维恩位移定律:32.910m T m K λ-=⨯⋅
17.热力学第一定律:Q U W =∆+,其微分形式:đQ dU đW =+。
18.定体摩尔热容:,,()(
)V m
m
V m V dQ U C dT T
∂=
=∂,
对于常温附近的理想气体,()2m i U T RT =,,2
V m i
C R =。
19.定压摩尔热容:,,()()p m m p m p dQ H
C dT T
∂=
=∂, 对于常温附近的理想气体,()()(1)22
m m m i i
H T U T pV RT RT RT =+=+=+,
,(1)2
p m i
C R =+。
20.摩尔热容比,,p m V m
C C γ=。
对于常温附近的理想气体,2i i γ+=,,1V m R
C γ=-,
,,p m V m C C R -=(迈尔公式)。
21.理想气体的基本过程
等体过程:0W =,,V m Q U C T ν=∆=∆;
等压过程:W p V R T ν=∆=∆,,V m U C T ν∆=∆,,p m Q C T ν=∆;
等温过程:0U ∆=,2
1
ln
V Q W RT V ν==; 绝热过程:0Q =,,V m W U C T ν=-∆=-∆,
绝热过程方程:pV γ=常量,或1
TV γ-=常量;
多方过程:n pV =常量,或1
n TV
-=常量,
,n m Q C T ν=∆,其中多方摩尔热容,11
n m R R
C n γ=
-
--, ,V m U C T ν∆=∆,
112211p V p V R
W Q U T n n ν-=-∆=-∆=--。
22.介质中纵波传播速度:1()S S p
u ρκρ
∂==∂,其中S κ为绝热压缩系数,
理想气体声速:RT
u M
γ=。
23.热机效率的一般公式:1221111Q Q Q W Q Q Q η-=
==-,其中1Q 为整个热机循环的所有吸热之和,2Q 为整个热机循环的所有放热之和。
可逆卡诺热机效率2
1
1T T η=-
卡。
24.制冷机的制冷系数一般公式:22
12
Q Q COP W Q Q =
=
-制冷, 可逆卡诺制冷机的制冷系数2
12
T COP T T =
-卡诺制冷。
25.克劳修斯等式:
0R đQ T =⎰ ,下标R 表示可逆循环。
熵变计算的一般式:f f i iR đQ
S S T
-=⎰,下标R 表示可逆过程。
26.理想气体熵变的一般表达式:,ln ln f f
V m i i
T V S C R T V νν∆=+;其中
等体过程:,()ln f V V m i T S C T ν∆=;等压过程:,()ln f
p p m i T S C T ν∆=;
等温过程:()ln f T i V S R V ν∆=;可逆多方过程:,()ln f
n n m i
T S C T ν∆=;
可逆绝热过程:()0S S ∆=。
27.固体和液体的熵变公式:ln f i
f
T f iR T i
T đQ
cmdT S cm T T T ∆===⎰⎰,其中c 为固体
或液体的比热容。
28.热源的熵变:()Q S T ∆=
热源
热源热源
,其中Q 热源指热源吸收的热量。
说明:热源的 温度几乎不变,因此它的变化总是准静态可逆过程。
29.熵增加原理:()0S ∆≥绝热(可逆取等号,不可逆取不等号)。
30.热力学第二定律的数学表达式:f
f i i
đQ
S S S T
∆=-≥
⎰
(可逆取等号,不可逆取不等号)。
31.克劳修斯不等式:
0đQ
T ≤⎰ (可逆循环取等号)。
注:29,30,31三不等式相互等价!彼此间可以相互推导。
32.p V T --系统的热力学基本(中心)方程:TdS dU pdV =+。
33.玻尔兹曼熵公式:ln S k W =,其中W 是某宏观状态的微观状态数或称热力学
概率。
34.气体分子的平均碰撞频率2Z vn σ=;平均自由程12v Z n
λσ=
=。
其中 2d σπ=为分子的碰撞截面。
