2016人教版化学选修4第二章测试题
人教版化学选修4第二章 《化学反应速率和化学平衡》单元测试题(含答案)

第二章《化学反应速率和化学平衡》单元测试题
一、单选题(每小题只有一个正确答案)
1.下列事实能用勒夏特列原理解释的是( )
A、合成氨工业采用高温条件
B、配制FeSO4溶液时在溶液中加入稀硫酸
C、H2、I2、HI 平衡混合气体加压后颜色变深
D、工业制硫酸中,SO2氧化成SO3,往往需使用催化剂
2.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
A.C0
2(g)+H
2
(g) CO(g)+H
2
0(g) △H>0
B.CH
3CH
2
0H(g) CH
2
=CH
2
(g)+H
2
0(g) △H>0
C.2C
6H
5
CH
2
CH
3
(g)+0
3
(g) 2C
6
H
6
CH=CH
2
(g)+2H
2
O(g) △H<0
D.C0
2(g)+2NH
3
(g) CO(NH
2
)
2
(s)+H
2
0(g) △H<0
3.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中发生反应X (g)+Y(g)2Z(g)△H<0,一段时间后达到平衡。反应过程中测定的数据如下( )
A.反应前2min的平均速率v(Z)=2.0×10-5mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
4.两气体A、B分别为0.6mol、0.5mol。在0.4L密闭容器中发生反应:3A+B mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为
0.1mol·L-1·min-1,以下结论正确的是()
人教版高中化学选修四测试题及答案解析全套.doc

最新人教版高中化学选修四测试题及答案解析全套
模块综合测评
(时间45分钟,满分100分)
一、选择题(本题包括12小题,每小题4分,共48分)
1・下列关于反应热的说法正确的是()
A.已知C(石墨,s)=C(金刚石,s) AH= + 1.9 kJ-moF1,说明金刚石具有的能量比石墨低
B.已知H+(aq) + OH (aq)=H2O(l) A//=-57.4 kJ mol-1, 20 g 氢氧化钠固体溶于稀盐酸中恰好完全反应吋放出的热量大于28.7 kJ
C・已知甲烷的燃烧热为890.3 kJ moF1,则表示甲烷燃烧热的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) AH= —890.3 kJ-mol-1
D.将0.5 mol N2和1.5 mol出置于密闭容器中充分反应生成N比仗),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) AH=—38.6kJ molT
【解析】A项,题给反应吸热,故金刚石能量比石墨高;C项,生成的H2O(g)不是稳定氧化物;D项,合成氨反应为可逆反应,0.5molN2和1.5 mol H2不能完全反应,故无法判断的数值。
【答案】B
2.把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中,使它们发生如下反应:3X(g)
+Y(g>=〃Z(g)+2W(g), 5 min末已生成0.2 mol W,若测知以Z表示的化学反应速率为0.01 mol
L-^min-1,则上述反应中〃的值是( )
A. 1
最新人教版高中化学选修四测试题全套带答案解析

最新人教版高中化学选修四测试题全套带答案解析
章末综合测评(第一章)
(时间45分钟,满分100分)
一、选择题(本题包括10小题,每小题5分,共50分)
1.下列变化属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④KClO 3分解制取O 2 ⑤
生石灰与水反应生成熟石灰 ⑥CaCO 3高温分解 ⑦CO 2+C=====高温 2CO ⑧Ba(OH)2·
8H 2O 与固体NH 4Cl 混合 ⑨C +H 2O(g)=====高温 CO +H 2 ⑩Al 与盐酸反应
A .①②④⑥⑦⑧⑨
B .②④⑥⑦⑧⑨
C .①③④⑤⑥⑧⑩
D .①②④⑧⑨
【解析】 ③⑤两项变化均放出能量,ΔH <0。
【答案】 B
2.下列关于反应热的叙述正确的是( )
A .当ΔH <0时,表示该反应为吸热反应
B .由C(s)+1/2O 2(g)===CO(g)的反应热为110.5 kJ·mol -1,可知碳的燃烧热为110.5 kJ·mol -1
C .反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D .1 mol NaOH 分别和1 mol CH 3COOH 、1 mol HNO 3反应放出的热量:CH 3COOH<HNO 3
【解析】 A 项,ΔH <0时表示反应为放热反应;B 项,CO(g)不是稳定的氧化物;C 项,反应热等于反应物总能量与生成物总能量的差值,故与二者的能量有关;D 项,CH 3COOH 电离时吸热,故正确。
【答案】 D
3.下列依据热化学方程式得出的结论正确的是( )
人教版化学选修4第一二章测试题(含答案)

人教版化学选修 4 第一二章测试题(带答案)
一、选择题(有一个或两个正确选项)
1.以下说法正确的选项是
A.化学反响必定陪伴有热量的变化
B.活化能越大的化学反响其反响热数值也越大
C.反响热的产生是因为生成物与反响物的总能量不一样
D.放热反响是因为反响物键能总和大于生成物键能总和
2.有关化学反响的说法中,正确的选项是
A.自觉反响都是放热反响
B.自觉反响都是熵增大的反响
C.能自觉进行的吸热反响必定是熵增大的反响
D.非自觉反响在任何条件下都不可以实现
3.以下不属于自觉进行的变化是
A .红墨水加到清水使整杯水变红B.冰在室温下消融成水
C .石墨变为金刚石D.铁器在湿润的空气中生锈
4.依据相应的图像,判断以下有关说法正确的选项是
.......
( A)(B)(C)(D)
A.密闭容器中反响达到均衡,t 0时改变某一条件犹如图变化所示,则改变的条件只好是加入催化剂
B.反响达到均衡时外界条件对均衡影响关系以下图,则正反响为放热反响,且a> b
C.物质的量和温度关系以下图,则该反响的正反响为放热反响
D 反响速率和反响条件变化关系以下图,则该反响的正反响为放热反响,且A、 B、C、 D 均为
气体
5.在必定温度下,向一个容积为 2 L 的密闭容器内(早先加入催化剂)通入2mol NH3,经过一段时间后,测得容器内的压强为开端时的倍。则NH3的转变率为
A. 25% B .20%C. 10% D . 80%
6.以下反响中生成物总能量高于反响物总能量的是
A.碳酸钙受热分解B.乙醇焚烧
C.铝粉与氧化铁粉末反响D.煤的气化
化学选修4第二章测试题

第二章练习题:
1.化学平衡问题研究对象主要是
A.化学反应B.可逆反应C.离子反应D.气态物质的反应
(g)+I2(g)2HI(g)的平衡常数为49,则该温度下2HI(g)H2(g)+
2.已知428℃时,H
I2(g)的平衡常数是
A.1/49 B.1/7 C.492 D.无法确定
3.下列事实不能
..用勒夏特列原理来解释的是
A.高压有利于氢气与氮气合成氨
B.实验室中常用排饱和食盐水的方法收集Cl2
C.用V2O5催化二氧化硫氧化为三氧化硫
D.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度
4.对于2A(g)+B(g) 2C(g)(正反应为放热反应),下列图像正确的是
5.某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
A.该反应的化学方程式为A = 2B+C B.4 min末A的转化率约为31%
C.4 ~ 6min时,反应停止了D.正反应是吸热反应
(g) + 3H2(g) 2NH3(g),2 min末N2的物质的量由
6.在10 L的密闭容器中进行反应N
20 mol减小到8 mol,则2 min末N2的反应速率为
A.1.2 mol/(L·min) B.1 mol/(L·min) C.0.6 mol/(L·min) D.0.4 mol/(L·min) 7.下列措施中,一定能使化学平衡移动的是
A.改变温度B.改变压强C.使用催化剂D.改变容器体积
8.在一定条件下,把一定量NH3充入容积固定的密闭容器中,发生反应2NH3 (g)3H2(g)+N2(g)。达到平衡时,如果保持温度不变,增加N2的浓度。下列说法正确的是A.平衡向正反应方向移动B.化学平衡常数不变
高中化学选修四第二章《化学反应速率和化学平衡》单元测试题(解析版)

第二章《化学反应速率和化学平衡》单元测试题
一、单选题(每小题只有一个正确答案)
1.下列有关化学平衡常数的描述中正确的是()
A.化学平衡常数的大小决定于化学反应的内因,与其他外界条件无关
B.相同温度下,反应A+B C与反应C A+B的化学平衡常数相同
C.反应2SO 2(g)+O2(g)2SO3(g) ΔH<0 温度升高,此反应的化学平衡常数不变
D.反应A(g)+B(g)2C(g)的平衡常数表达式为K=c2(C)/[c(A)·c(B)]
2.在一定温度、一定体积条件下,能说明下列反应达到平衡状态的是()
A.反应2SO 2(g)+O2(g)2SO3(g)容器内的密度不随时间变化
B.反应A 2(g)+B2(g)2AB(g)容器内A2的消耗速率与AB消耗速率相等
C.反应N 2+3H22NH3容器内气体平均相对分子质量不随时间变化
D.反应4A(s)+3B(g)2C(g)+D(g)容器内气体总压强不随时间变化
3.可逆反应a A(g)+b B(g)c C(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系式中能说明反应已达到平衡状态的是()
A.av(A)正=bv(B)正
B.bv(A)正=av(B)逆
C.cv(C)正=av(A)逆
D.av(A)正=bv(B)逆
4.已知2SO 2(g)+O2(g)2SO3(g)ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙)
2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是()
高中化学选修4《第二章测试题》

高中化学选修4《第二章测试题》
(总7页)
-CAL-FENGHAI.-(YICAI)-Company One1
-CAL-本页仅作为文档封面,使用请直接删除
《化学反应速率和化学平衡》测试题
一、选择题(每小题只有1-2个选项符合题意)
1.下列说法中有明显错误的是
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
2.用3g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是:①再加入30mL3mol/L盐酸②改用30mL6mol/L盐酸③改用3g粉末状大理石④适当升高温度
A.①②④ B.②③④ C.①③④ D.①②③
3.下列情况下,反应速率相同的是
A.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
4.在一个不传热的固定容积的密闭容器中发生可逆反应:
mA(g) +nB(g)
pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是 A.体系的压强不再改变 B.各组分的浓度不再改变
人教版高中化学选修四第二章《化学反应速率和化学平衡》单元检测题(含答案)

10
20
30
40
I
0.80
0.68
0.60
0.56
0.54
II
1.60
1Βιβλιοθήκη Baidu34
1.20
1.08
1.02
III
1.60
1.26
1.08
0.94
0.94
下列说法不正确的是
A. 温度下水样I中, 之间X分解的平均反应速率为
B. 温度下水样Ⅱ中, 时X的浓度小于
C. 温度下水样Ⅲ中,从反应开始到达到平衡,X分解的平均反应速率为
《化学反应速率和化学平衡》单元检测题
一、单选题
1.在四个不同的容器中,在不同条件下利用N2+3H2==2NH3反应来合成氨,根据下列在相同时间内测定的结果判断,生成氨的速率最大的是()
A.v(H2)=0.1 mol·(L·min)−1B.v(N2)=0.01 mol·(L·s)−1
C.v(N2)=0.2 mol·(L·min)−1D.v(NH3)=0.3 mol·(L·min)−1
C.W(s) + I2(g) WI2(g)为放热反应
D.碘蒸气的作用是延长灯丝的使用寿命
6.反应2SO2(g)+O2(g) 2SO3(g)经一段时间后,SO3的浓度增加了0.3mol/L,在这段时间内用O2表示的反应速率为0.03mol/(L·s),则这段时间为()
化学选修4第二章测试卷

化学反应速率与化学平衡
一、选择题(每小题只有一个选项符合题意,每小题2分,计18分)
1、下列说法中正确的是()
A.非自发反应在任何条件下都不能实现
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.凡是放热反应都是自发的,吸热反应都是非自发的
D.熵增加且放热的反应一定是自发反应
2、下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(l);△H52H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
3、下列说法或表示法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石) ΔH = +119 kJ·mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H++OH-===H2O ΔH = -57.3 kJ· mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)===2H2O(l)ΔH = +285.8 kJ· mol—1
化学选修四测试题(含答案)

化学选修四测试题(月考题)
高二级化学科试题
本试卷共5页,满分为100分,考试用时60分钟
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 K-39 I-127
第I卷选择题共50分
一、单选择题(本大题共10小题,每小题3分,共30分。)
1.反应4NH3+5O24NO+6H2O在一定体积的密闭容器中进行,30s后NO的物质的量浓度增加了3mol/L,则下列反应速率正确的是
A. v(NO)=0.1mol·(L·s)-1
B. v(O2)=0.02mol·(L·s)-1
C. v(NH3)=0.01mol·(L·s)-1
D. v(H2O)=0.2mol·(L·s)-1
2.恒温恒压的密闭容器中发生反应A(g)+2B(g)3C(g),能说明反应达到平衡状态的是
A.容器内的压强不再变化
B.混合气体的密度不再变化
C.单位时间消耗amolA,同时消耗3amolC
D.混合气体的平均相对分子质量不再变化
3.对于给定的可逆反应的平衡常数(K)的说法正确的是
A.K只与温度有关,温度不变,K不变
B.改变条件,反应物的转化率增大,K也一定增大
C.温度一定时,其正、逆反应的K相等
D.若正反应△H<0,升高温度,该反应的K增大
4.25℃时,把下列物质加入水中能促进水的电离的是
A.NaCl
B.HCl
C.NH4Cl
D.KHSO4
5.下列各组离子在溶液中能大量共存的是
A.Na+、Fe3+、I-、SCN-
B.H+、NH4+、NO3-、CH3COO-
C.K+、Ba2+、Cl-、Br-
D.Ag+、NO3-、CO32-、Al3+
人教版化学选修四第二章《化学反应速率和化学平衡》测试题(含答案)

第二章《化学反应速率和化学平衡》测试题
一、单选题
1.在恒温恒容的密闭容器中发生反应H2(g)+I2(g)⇋2Hl(g),下列说法正确的是A.达到平衡时,正、逆反应速率相等且等于零
B.达到平衡时,H2(g)和I2(g)浓度不再变化
C.若充入稀有气体,体系压强增大,反应速率变大
D.H2(g)的消耗速率与HI(g)的生成速率之比为2: 1
2.下列说法不正确的是
A.焓变是一个与反应能否自发进行有关的因素,放热反应具有自发进行的倾向B.在同一条件下物质有不同的熵值,其体系的混乱程度越大,熵值越大
C.自发反应是指不需要条件就能发生的反应
D.—个反应能否自发进行与焓变和熵变的共同影响有关
3.下列对化学反应方向的叙述正确的是()
A.室温下不能自发进行的反应,在高温下有可能自发进行
B.熵增加有利于反应的自发进行,熵减小的反应常温下都不会自发进行C.非自发反应在任何情况下都不会发生
D.凡是放热反应都是自发的,吸热反应都是非自发的
4.某温度下,H 2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K=9
4
,该温度下在甲、乙、
丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
下列判断不正确的是()
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中CO2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
5.下图是金属镁和卤素反应的能量变化图(反应物和生成物均为298 K时的稳定状态)。下列选项中不正确的是()
人教版高中化学选修4第二章第三节化学平衡图像题训练
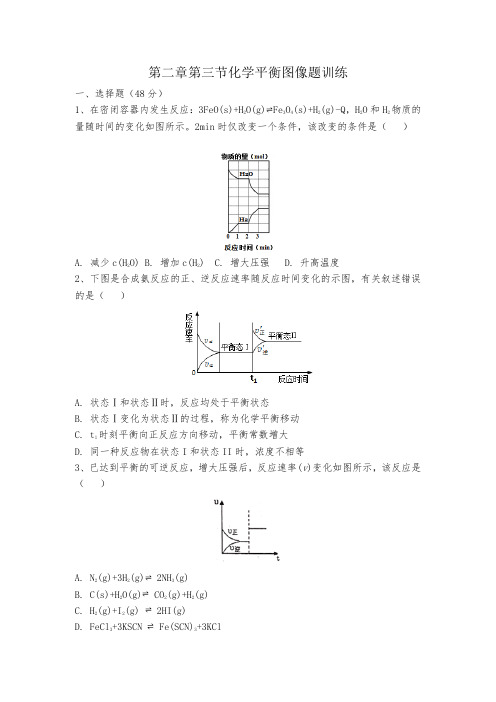
第二章第三节化学平衡图像题训练一、选择题(48分)
1、在密闭容器内发生反应:3FeO(s)+H
2O(g)Fe
3
O
4
(s)+H
2
(g)-Q,H
2
O和H
2
物质的
量随时间的变化如图所示。2min时仅改变一个条件,该改变的条件是()
A. 减少c(H
2O) B. 增加c(H
2
) C. 增大压强 D. 升高温度
2、下图是合成氨反应的正、逆反应速率随反应时间变化的示图,有关叙述错误的是()
A. 状态Ⅰ和状态Ⅱ时,反应均处于平衡状态
B. 状态Ⅰ变化为状态Ⅱ的过程,称为化学平衡移动
C. t
1
时刻平衡向正反应方向移动,平衡常数增大
D. 同一种反应物在状态I和状态II时,浓度不相等
3、已达到平衡的可逆反应,增大压强后,反应速率(v)变化如图所示,该反应是()
A. N
2(g)+3H
2
(g) 2NH
3
(g)
B. C(s)+H
2O(g) CO
2
(g)+H
2
(g)
C. H
2(g)+I
2
(g) 2HI(g)
D. FeCl
3+3KSCN Fe(SCN)
3
+3KCl
4、一定条件下,在容积不变的密闭容器中进行如下反应:2NO(g)+2CO(g)ƒN2(g)+2CO2(g)+Q(Q>0),图曲线a表示该反应过程中NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是()
A. 降低温度
B. 加催化剂
C. 增大反应物中NO的浓度
D. 向密闭容器中加入氩气
5、对于可逆反应,以下相关图像正确的是()
A. B.
C. D.
6、CH
3OH是重要的化工原料,工业上用CO与H
2
在催化剂作用下合成CH
3
人教版化学选修4:第二章章末综合检测

(时间:90分钟,满分:100分)
一、单项选择题(本题包括11小题,每小题3分,共33分。在每小题给出的四个选项中,只有一个选项符合题目要求)
1.本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不.正确的是()
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
解析:选C。C项错,怎样提高原料转化率是化学平衡理论要解决的内容。
2.下列叙述中,不.能用勒夏特列原理解释的是()
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.加入催化剂有利于氨的合成
D.工业制取金属钾Na(l)+KCl(l)NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
解析:选C。勒夏特列原理是用来解释化学平衡移动的,加入催化剂,平衡不移动。
3.在恒温恒压、不做功时,反应A+B====C+D在下列哪种情况下,一定能自发进行() A.ΔH<0、ΔS<0B.ΔH>0、ΔS<0
C.ΔH<0、ΔS>0 D.ΔH>0、ΔS>0
解析:选C。当ΔH<0,ΔS>0时,ΔH-TΔS<0,反应一定能自发进行。
4.5.6 g 铁粉投入到盛有100 mL 2 mol/L 稀硫酸的烧杯中,2 min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是()
A.v(Fe)=0.5 mol/(L·min)
人教版化学选修4复习题精编二(可做测试卷)
第 1 页 共 4 页 第 2 页 共4 页
化学选修四复习题(二)
组卷:陈敦君
一.选择题
( )1.对可逆反应:
A(g)+3B(g)
2C(g) ∆H <0,下列叙述错误的是
A. 升高温度v (正)、v (逆)都增大,但v (正)增的更大
B. 增大压强v (正)、v (逆)都增大,但v (正)增的更大
C. 增大A 的浓度v (正)会增大,但v (逆)会减小
D. 采用催化剂一般v (正)、v (逆)同时增大,而且增大的倍数相同
( )2.以N A 代表阿伏加德罗常数,则关于热化学方程式222225
C H (g)O (g)2CO (g)H O(l)2
+=+;△H =-1300kJ/mol 的说法中,正确的是
A .有10N A 个电子转移时,放出1300kJ 的能量
B .有1N A 个水分子生成且为液体时,吸收1300kJ 的能量
C .有2N A 个碳氧共用电子对生成时,放出1300kJ 的能量
D .有8N A 个碳氧共用电子对生成时,放出1300kJ 的能量 ( )3.下列说法不正确...
的是 A .变色硅胶干燥剂含有CoCl 2,干燥剂呈蓝色时,表示不具有吸水干燥功能
B .“硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触
C .“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用
D .除去干燥CO 2中混有的少量SO 2,可将混合气体依次通过盛有酸性KMnO 4溶液、浓硫酸的洗气瓶
( )4.不能..鉴别AgNO 3、BaCl 2、K 2SO 3和Mg(NO 3)2四种溶液(不考虑他们间的相互反应)的试剂组是
化学选修四第二章单元测试卷(含详细答案)

安阳县实验中学高一19班化学试卷
第I卷(选择题)
单项选择
1.用CH4催化还原NO x可以消除氮氧化合物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
下列说法中错误的是()
A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol B.等物质的量的CH4在反应①、②中转移电子数相同
C.若用标准状况下4.48L CH4把NO2还原为N2(生成的水为气态),放出热量173.4kJ D.若用标准状况下4.48L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6mol 2.下列有关热化学方程式或反应热的说法正确的是()
A.已知:H2(g)+1
2
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1,则H2的燃烧热为-241.8
kJ·mol-1
B.已知:S(g)+O2(g)=SO2(g)ΔH1=-Q1;S(s)+O2(g)=SO2(g)ΔH2=-Q2(Q1、Q2均正值),则Q1<Q2
C.已知:1
2
H2SO4(浓)+NaOH(aq)=
1
2
Na2SO4(aq)+H2O(l)ΔH1;CH3COOH(aq)+
NH3·H2O(aq)=CH3COONH4(aq)+H2O(l)ΔH2,则有|ΔH1|<|ΔH2|
D.已知:Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1;CO(g)+1
(完整版)高中化学选修四第二章练习题(含答案),推荐文档

2C(g)(正反应放热)。这个可逆反应的正确图象是(
6.α1 和 α2 分别为 A 在两个恒容 容器中平衡 体系 A(g)
2B(g)和 2A(g)
的转化率,在温度不变的情况下,均增加 A 的物质的量,下列判断正确的是(
B(g) )
A. α1、α2 均减小 C.α1 减小,α2 增大
B.α1、α2 均增大 D.α1 增大,α2 减小
7.2 mol A 与 2 mol B 混合于 2 L 的密闭容器中,发生如下反应:2A(g)+3B(g)
2C(g)+zD(g),若 2s 后,A 的转化率为 50%,测得 v(D)=0.25 mol·L-1·s-1,下列推断正确
的是( )
A.v(C)=v(D)=0.25 mol·L-1·s-1
B.z=3
再通入 4molH2O(g),当再次达到平衡后,CO2 的物质的量可能是
A.n(CO2)=0.6 mol C.1 mol<n(CO2)<4 mol
B.n(CO2)=1 mol D.0.6 mol<n(CO2)<1 mol
11. 根据下图填空。
(1) 反应物是
,生成物是
。
(2) 在 2 min 内 A、B、C 三者的反应速率值各是
“
”
“
”
At the end, Xiao Bian gives you a passage. Minand once said, "people who learn to learn are very happy people.". In every wonderful life, learning is an eternal theme. As a professional clerical and teaching position, I understand the importance of continuous learning, "life is diligent, nothing can be gained", only continuous learning can achieve better self. Only by constantly learning and mastering the latest relevant knowledge, can employees from all walks of life keep up with the pace of enterprise development and innovate to meet the needs of the market. This document is also edited by my studio professionals, there may be errors in the document, if there are errors, please correct, thank you!
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2016人教版化学选修4第二章测试题
第二章《化学反应速率》测试题
一、选择题
1.下列情况下,反应速率相同的是
A.等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
2.在一密闭容器中充入一定量的N2和H2,经测定反应
开始后的2s内氢气的平均速率:ν(H2)=0.45mol/
(L·s),则2s末NH3的浓度为
A.0.50mol/L B.0.60mol /L
C.0.45mol/L D.0.55mol /L
3.下列各组实验中溶液最先变浑浊的是()
A.0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度10℃
B.0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度10℃
C.0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,
8.对于在一密闭容器中进行的下列反应:C(s)+ O2(g)
CO2(g)下列说法中错误的是( )
A.将木炭粉碎成粉末状可以加快化学反应速率
B.升高温度可以加快化学反应速率
C.增加压强不能加快化学反应速率
D.增加木炭的量可以加快化学反应速率
9. 100 mL 6 mol·L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
A.碳酸钠溶液B.水C.硫酸钾溶液D.硝酸钠溶液
10. 已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如右图。下列说法不正确的是
A.图中的两条曲线,X是表示NO2
浓度随时间的变化曲线
B.前10 min内用v(N2O4)表示的化
学反应速率为0.2 mol/(L·min)
C.25 min时,NO2转变为N2O4的反应速率增大,其原因是将密闭容器的体积缩小为1L
D.前10 min内用v(NO2)表示的化学反应速率为0.04 mol/(L·min)
二、非选择题
11.在一密闭容器中充入1molH2和1molI2蒸气,压强为p(Pa),并在一定温度下使其发生反应:
H2(g)+I2(g)==2HI(g) △H<0
(1)保持容器容积不变,向其中加入1molH2,反应速率(填加快、减慢、不变、不确定),
理由是
。
(2)保持容器气体压强不变,向其中加入1molH2,反应速率(填加快、减慢、不变、不确定),理由是
。
12.影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、、
18.4mol/LH2SO4
甲同学研究的实验报告如下表:
实验步骤现象结论
①分别取等体
积的2mol/L的
硫酸于试管中
②
反应速率镁>
铁,铜不反应
金属的性质
越活泼,反应
速率越快
(1)甲同学表中实验步骤②为
。
(2)甲同学的实验目的是
;要的出正确的实验结论,还需控制的实验条件
是
。
乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行实验,
(3)乙同学在实验中应该测定的数据
是
。
(4)乙同学完成该实验应选用的实验药品
。该实验中不选用某浓度的硫酸,理由是
。
13.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成
2
CO和2N,化学方程式如下:
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:时间
/s
0 1 2 3 4 5
C (N O)/mol 1.00
×
10-3
4.50
×
10-4
2.50
×
10-4
1.50
×
10-4
1.00
×
10-4
1.00
×
10-4
·L-1
C (C O)/mol ·L-13.60
×
10-3
3.05
×
10-3
2.85
×
10-3
2.75
×
10-3
2.70
×
10-3
2.70
×
10-3
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的H 0(填写“>”、“<”、“=”。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)计算4s时NO的转化率。
(4)下列措施能提高NO和CO转变成
2
CO和2N的反应速率的是。
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验
证温度、催化剂比表面积对化学反应速率的影
响规律,某同学设计了三组实验,部分实验条
