螯合剂课件
常用螯合剂

常用螯合剂螯合剂是一类能与金属离子形成稳定络合物的化合物。
螯合剂可以通过给予金属离子一个或多个配体上的电子对来形成配位键。
常用的螯合剂有以下几种。
1. 乙二胺四乙酸(EDTA)乙二胺四乙酸(EDTA)是一种多功能螯合剂,广泛用于化学分析和工业生产中。
它能与多种金属离子形成稳定的络合物,并能有效螯合和去除金属离子,起到去污和稳定作用。
EDTA还可用作破坏细胞壁、抑制酶活性等方面的实验试剂。
2. 氰化物(CN-)氰化物(CN-)是一种强碱性的螯合剂,它能与金属离子形成氰化物络合物。
氰化物络合物通常具有较高的稳定性和溶解度,在金属提取和电镀等领域有广泛应用。
然而,氰化物具有强毒性和致命性,需在使用时小心操作,避免接触和吸入。
3. 亚硝酸盐(NO2-)亚硝酸盐(NO2-)也是一种常用的螯合剂,它能与金属离子形成亚硝酸盐络合物。
亚硝酸盐络合物通常具有较高的稳定性和溶解度,广泛用于水处理、金属腐蚀抑制和环境污染治理等领域。
亚硝酸盐还可用作爆炸物和药物的原料。
4. 有机酸有机酸是一类含有羧基的有机化合物,它们可以与金属离子形成稳定的络合物。
常用的有机酸螯合剂包括乙酸、苯甲酸、柠檬酸等。
有机酸络合物在食品、化妆品和医药等领域有广泛应用,可以起到抗氧化、保存、稳定等作用。
5. 胺类化合物胺类化合物是一类含有氮原子的有机化合物,它们可以与金属离子形成稳定的络合物。
常用的胺类螯合剂包括乙二胺、三乙矿、二乙矿等。
胺类螯合剂在化学分析、金属提取和催化反应等领域有广泛应用,可以提高反应的选择性和效率。
螯合剂在化学、生物和环境科学等领域发挥着重要作用。
通过与金属离子形成稳定络合物,螯合剂可以改变金属的性质和行为,扩展其应用范围。
不同的螯合剂适用于不同的金属离子和应用领域,选择合适的螯合剂可以提高实验和生产的效果。
然而,在使用螯合剂时,需要注意其毒性和环境影响,并遵循安全操作规程,以确保实验和生产的安全性和可持续性。
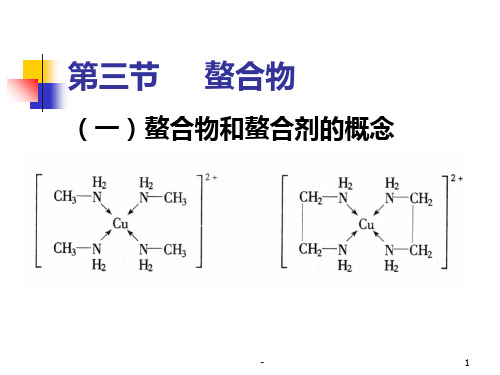
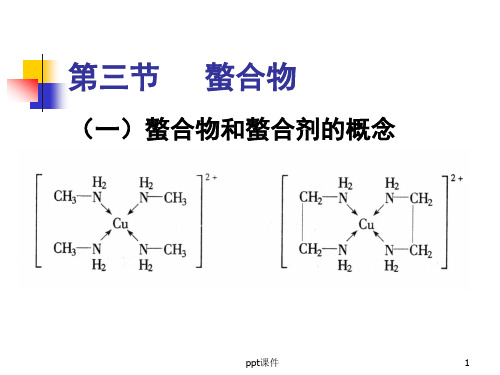
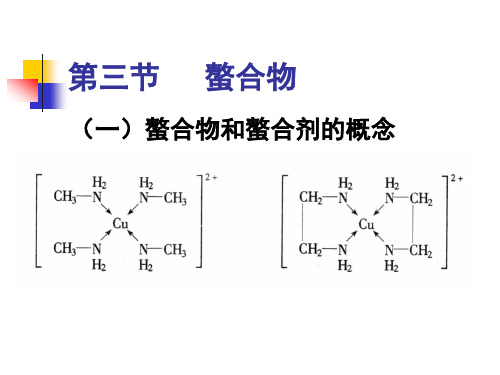
(一)螯合物和螯合剂的概念PPT课件
CaY2- > MgY2- >MgIn - > CaIn-
-
20
反应式如下:
加指示剂时:
Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 紫红
滴定终点前:
-
22
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
-
21
水的总硬度按下式计算:
总硬度= 式中:
CEDTVAEDTA V水样 1000
CEDTA: EDTA 标准溶液的浓度( mol ·L-1 ) VEDTA : 消耗EDTA标准溶液的体积(L) V: 滴定时水样的体积(L)
-
2
形成的螯合环以五元环和六元环 最稳定。常见的螯合剂大多是有机化 合物,特别是具有氨基N和羧基O的 一类氨羧螯合剂使用得更广。
-
3
二、氨羧螯合剂及氨羧 螯合滴定
(一)氨羧螯合剂的结构和特点 氨羧螯合剂中最重要同时应用最
广的是乙二氨四乙酸(EDTA)及其 二钠盐 (EDTA-2Na),统称为 EDTA。结构如下:
二氨羧螯合剂及氨羧螯合滴定一氨羧螯合剂的结构和特点氨羧螯合剂中最重要同时应用最氨羧螯合剂中最重要同时应用最广的是乙二氨四乙酸edta及其二钠盐edta2na统称为edta
EDTA与螯合剂 ppt课件
ppt课件
10
溶液中螯合物的稳定性除决定于螯 合物稳定常数的大小外,还与溶液 的pH值有关。不同的金属离子与 EDTA生成的螯合物的稳定性不同, 滴定时所需溶液的pH值也不同。因 此,在两种以上金属离子的混合溶 液中,常可以通过调节溶液的pH值, 用EDTA进行选择滴定。
ppt课件
11
例如,在Mg2+离子和Zn2+离子的混合
测定水的总硬度时加NH3-NH4Cl缓 冲溶液调节pH ≈ 10,以铬黑T为指 示剂,用EDTA标准溶液滴定。溶液 中有关配合物的稳定性有如下顺序:
CaY2- > MgY2- >MgIn - > CaIn-
ppt课件
20
反应式如下:
加指示剂时:
Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 紫红
ppt课件
18
可加入某种掩蔽剂(此试剂能与干 扰离子结合成更稳定的配合物,而 对被测离子无影响),把干扰离子 掩蔽起来,再滴定被测离子。例如 EDTA滴定Ca2+ Mg2+时,少量Fe3+, Al3+有干扰,可加入三乙醇胺消除 干扰。
ppt课件
19
(三)EDTA螯合滴定
示例-水的总硬度测定
水的总硬度是指水中Ca2 + , Mg2+ 的总硬度(以为mmol ·L-1单位)
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
(一)螯合物和螯合剂的概念PPT课件

-
6
CaY2-的结构
-
7
EDTA与金属离子的配合有以下特点:
1.螯合能力强 除碱金属以外,能与 几乎所有的金属离子形成稳定的螯 合物。
2.与金属离子形成的螯合物大多带 有电荷,因此易溶于水。
-
8
3.简单的螯合比 不论几价的金属离子, 它们与EDTA总是1:1螯合。例如:
M2++H2Y2--MY2 - +2H + M3++H2Y2--MY - +2H + M4++H2Y2--MY +2H +
-
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
-
13
作为金属指示剂必须具备以下条件: 1.与金属离子形成的配合物的颜色 与其本身(即未配合时)的颜色有 明显不同;
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
-
21பைடு நூலகம்
水的总硬度按下式计算:
总硬度= 式中:
CEDTVAEDTA V水样 1000
CEDTA: EDTA 标准溶液的浓度( mol ·L-1 ) VEDTA : 消耗EDTA标准溶液的体积(L) V: 滴定时水样的体积(L)
螯合剂

螯合剂又名络合剂,是一种能和重金属离子发生螯合作用形成稳定的水溶性络合物,而使重金属离子钝化的有机或无机化合物。
这种化合物的分子中含有能与重金属离子发生配位结合的电子给予体,故有软化、去垢、防锈、稳定、增效等一系列特殊作用。
印染工艺中常见的螯合剂有以下几种:(1)磷酸盐类:主要有三聚磷酸钠、多聚磷酸钠、六偏磷酸钠、焦磷酸钠等。
此类螯合剂因有离子交换能力,是最早用于印染工业的水质软化剂,焦磷酸钠可与三价铁离子形成络合离子,故可用于双氧水稳定剂中。
但无机磷酸盐在一些地区已被禁用。
(2)氨基羧酸类:主要有乙二胺四乙酸’(ED—TA),即软水剂B;氮川三乙酸(NTA),即软水剂A。
此外还有二乙撑三胺五乙酸(DTPA)、N一羟乙基乙胺三乙酸(HEDTA)、乙二醇一双一(B一氨基乙醚)一N,N一四乙酸(EGTA)等。
氨基羧酸型螯合剂的配位体是氮原子和带负电荷的羧酸根离子(COO—)。
其配位体数目越多,与金属离子的络合作用越强。
其中DTPA和大多数金属离子络合作用最强,其次是EDTA和HEDTA,NTA最差。
其中DTPA 作为双氧水稳定剂效果最好。
但NTA、EDTA、DTPA等因螯合金属后生物降解性极差,近年来欧洲一些国家已严禁使用。
(3)有机膦酸型类:主要有氨基三亚甲基膦酸(ATMP)、1一羟乙叉一1,1一二膦酸(HEDP)、乙二胺四甲叉膦酸(EDTMP)、二乙烯三胺五甲叉膦酸(DTPMP)、氨基三甲叉膦酸(ATP)等。
此类螯合剂具有使污垢分散、悬浮的能力,在高温下不易水解,对防止产生锅垢效果优良,亦可作锅炉清洗剂。
DTPMP是一种比DTPA效果更好的双氧水稳定剂,DTPA 只是在有硅酸钠存在下,对Ca、Mg盐有较好稳定作用,而DTPMP在不加硅酸钠条件下,也能对双氧水起稳定作用。
这类螯合剂既有较好的螯合、除垢作用,又易于被生物降解,目前使用较多。
(4)羟基羧酸类:主要有葡萄糖酸、聚丙烯酸(PAA)、马来酸(MAO)等。
螯合物ppt课件

在光谱分析中的作用
形成配合物
螯合物可以与金属离子形成配合物,改变金属离 子的光谱特征,使其更容易被检测和分析。
提高灵敏度
螯合物的形成可以降低光谱散射和背景干扰,提 高分析的灵敏度和准确性。
增加选择性
某些螯合物具有特殊的光谱特征,可以用于区分 不同的金属离子,增加分析的选择性。
通过离心、过滤、蒸馏等 方法将生成的螯合物与其 他反应物分离,并进行纯 化。
影响因素与优化
配体与金属离子的匹配程度
不同的配体与金属离子形成的螯合物稳定性不同,因此需要根据 目标螯合物的稳定性要求选择合适的配体和金属离子。
反应条件
反应温度、压力、时间等条件都会影响螯合物的合成与制备效率, 因此需要根据实际情况进行优化。
。
农业领域
一些螯合物可以作为农药和肥 料,提高农作物的产量和品质 。
环境领域
螯合物可用于水处理、土壤修 复等领域,如利用螯合物去除 重金属离子等污染物。
工业领域
螯合物可用于催化、电镀、印 染等领域,如利用螯合物作为
催化剂加速化学反应。
02
螯合物的合成与制备
合成方法
01
02
03
配体设计
根据目标螯合物的结构特 点,选择合适的配体进行 设计。
生物医药领域
研究螯合物在药物输送、诊断和治疗方面的应用,提高疗效和降低 副作用。
环境领域
开发用于水处理、土壤修复和环境保护的螯合物。
未来发展的挑战与机遇
挑战
随着科技的快速发展,对螯合物的性能和功能要求越来越高,需要不断研究和 创新。
机遇
随着绿色合成、高通量合成和组合合成等技术的发展,可以发现更多新的螯合 物,并应用于更多领域。
常用螯合剂

常用螯合剂1. 什么是螯合剂?螯合剂是一种能够与金属离子形成稳定络合物的化合物。
它们通常含有多个配体基团,这些基团可以通过配位键与金属离子结合。
螯合剂的主要作用是增强金属离子的稳定性和溶解度,并改变其化学性质。
2. 螯合剂的分类根据配体基团的性质和数量,螯合剂可以分为不同的类别:•单齿螯合剂:只有一个配体基团与金属离子形成配位键。
•多齿螯合剂:含有多个配体基团,可以形成多个配位键。
•菁环类螯合剂:由大环结构组成,能够通过π-π堆积与金属离子相互作用。
•线性多齿螯合剂:含有一系列线性排列的配体基团。
•多功能螯合剂:除了与金属离子形成络合物外,还具有其他功能。
3. 常见的螯合剂3.1 EDTA(乙二胺四乙酸)EDTA是一种六齿螯合剂,由乙二胺和四乙酸形成。
它可以与多种金属离子形成稳定的络合物。
EDTA的络合能力非常强,可以与钙、镁、铁等金属离子形成稳定的络合物,从而起到螯合剂的作用。
3.2 DTPA(二氨三丙酸)DTPA是一种五齿螯合剂,由二氨和三丙酸形成。
它与金属离子形成络合物的能力比较强,特别适用于配位数为六的过渡金属离子。
3.3 NTA(N,N-乙二胺四乙酸)NTA是一种四齿螯合剂,由N,N-乙二胺和四乙酸组成。
它可以与多种金属离子形成络合物,并且具有良好的水溶性。
3.4 Phthalocyanine(菲菜纳)Phthalocyanine是一种菁环类螯合剂,由苯并二氮杂菲和金属离子组成。
它具有良好的光电性能和化学稳定性,在催化、电化学和光学领域有广泛应用。
3.5 Crown ether(冠醚)Crown ether是一种多齿螯合剂,由多个环状结构组成。
它可以与金属离子形成稳定的络合物,并且在配位化学和分离技术中有重要应用。
4. 螯合剂的应用螯合剂在许多领域都有广泛的应用,包括:4.1 化学分析螯合剂可以与金属离子形成络合物,从而提高其溶解度和稳定性。
这使得它们在化学分析中起到重要作用,例如配位滴定、离子选择电极等。
EDTA与螯合剂
反应式如下: 加指示剂时: Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 滴定终点前: Ca2++H2Y2紫红
⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
⇌MgY2- +HIn- +H+
蓝
滴定终点时: MgIn-+ H2Y2紫红
水的总硬度按下式计算: 总硬度= 式中: CEDTA: EDTA 标准溶液的浓度( mol ·L-1 ) VEDTA : 消耗EDTA标准溶液的体积(L) V: 滴定时水样的体积(L)
第三节
螯合物
(一)螯合物和螯合剂的概念
螯合物:由中心原子与多齿配体形
成的环状配合物
螯合剂:能与中心原子形成螯和物 螯合效应:这种由于螯和物的生成 而使配合物的稳定性大大增加的作 用配合物中形成的鏊合环数目越多 其稳定性越强。
形成的螯合环以五元环和六元环 最稳定。常见的螯合剂大多是有机 化合物,特别是具有氨基N和羧基O 的一类氨羧螯合剂使用得更广。
C
EDTAV EDTA V水样
1000
9~10.5,一般用NH3-NH4Cl缓冲溶液 控制溶液pH值在10左右进行滴定。
对于含有两种或两种以上金属离子 的混合溶液,可以通过调节溶液的
pH值,选择性地滴定其中某一离子。例 如,在Mg2+离子和Zn2+离子的混合溶液 中,可首先调节溶液pH ≈ 6.8,用铬黑
T作指示剂,用EDTA滴定Zn2+离子,
此时Mg2+离子不干扰。然后再调节溶液 pH ≈ 10,用EDTA滴定Mg2+离子。
螯合剂

螯合剂
一、产品性能:
螯合剂主要成分为乙二胺四乙酸钠与稳定剂配合而成的液体高效络合剂。
能与各种金属螯合成盐,在工业上,主要用于水处理剂,以防止水中钙、镁、锰等金属离子带来的各种麻烦问题。
螯合剂进行化学清洁剂使用,可除去氧化铁、垢类等物质。
二、质量指标:主要成分符合GB13171401-1998.
三、应用范围与使用方法:
①螯合剂可用于工业水处理剂。
防止钙、镁、铁等金属离子
的不冷溶性盐类的析出。
②化学清洁。
对金属表面进行清洁,除去钙、镁的垢质及氧
化铁垢等难溶物。
③纸浆工业。
在打浆机中加入螯合剂,完全清除存在于纤维
中的金属离子,增加纸的白度,防止硬度组分结垢。
根据水中钙、镁等阳离子浓度来确定具体用量,工业水处理剂使用时一般为20~40g/吨水。
四、包装与贮存:
本品采用25kg塑料桶包装。
贮存于阴凉通风、防潮、防晒、防冻,远离火源,贮存期半年。
功能高分子材料课件第二章-高分子螯合剂及离子交换膜

本章将介绍高分子螯合剂和离子交换膜的相关知识。高分子螯合剂的种类和 应用领域,以及其合成方法。离子交换膜的定义、结构和在能源领域的应用。 让我们深入了解这些高分子材料的特点和制备方法。
高分子螯合剂介绍
螯合剂的定义和特点
螯合剂是一种能与金属离子或其他化学物质形成稳 定络合物的化合物。其特点包括高选择性和可控性。
高分子螯合剂的种类和应用领域
高分子螯合剂可以根据它们的结构和功能进行分类, 常见的类别包括聚合物螯合剂和功能化高分子螯合 剂。它们在环境保护、医学、催化剂等领域有广泛 的应用。
高分子螯合剂的合成方法
传统方法
传统方法包括络合反应、溶液聚合和固相聚合等。这些方法可以通过控制反应条 件和原料比例来合成不同性能的高分子螯合剂。
功能化高分子螯合剂可以具有特定的功能,如吸附、分离和催化等。应用示例包括水处理、 废弃物处理和有机合成等领域。
离子交换膜的概述
1 离子交换膜的定义和结构
离子交换膜是一种具有特殊结构的膜材料,能够通过电荷交换实现离子的选择性传输。 它们包含离子交换基团,如阴离子交换基团和阳离子交换基团。
2 离子交换膜在能源领域的应用
离子交换膜在能源领域具有重要的应用,如燃料电池、电解水制氢和储能等。它们能够 实现离子的传输和分离,提高能源转化效率。
离子交换膜的制备方法
1
膜材料的选择
制备离子交换膜时需要选择合适的膜材料,包括聚合物和无机材料。不同的材料 具有不同的温度稳定性和化学稳定性。
2
制备方法
离子交换膜的制备方法包括溶液浸渍、膜相转移、膜交联和模板法等。这些方法 可以实现离子交换膜的控制制备和特定结构的设计。
螯合物

O C
CH2
CH2
O O
ON Fe
N
CH2 CH2
C CH2
O
O
CH2 C
O
EDTA与Fe3+的配合物的结构示意图
其中EDTA应用最广。
§3 螯合物
三、 EDTA的性质及其配合物
1. EDTA的性质
乙二胺四乙酸,简称EDTA(Ethylene Diamine Tetraacetic Acid),
(1) 结构 HOOCH2C
CH2COO-
:: ::
··
· ·
NH+ C
C
NH+
H2 H2
-OOCH2C
CH2COOH
2、EDTA的离解 当EDTA溶于较高酸度的溶液时,其两羧基上可以再
接受两个H+,形成H6Y2+,这样EDTA相当于一个六元酸 (EDTA本身为四元酸),在溶液中存在六级离解平衡。在 不同的酸度下EDTA能以七种型体存在。
§3 螯合物
离解反应
离解常数
H6Y2+
H+ + H5Y- Ka1=1.26×10-1=10-0.90 pKa1=0.90
§3 螯合物
螯合剂类型: 1、“OO”型, 配位原子:2个O, 多元醇,羧基酸 2、“NN”型, 配位原子:2个N, 乙二胺等胺类,含氮杂
环化合物 3、 “NO”型, 配位原子:N和O,氨羧配位剂 4、含硫螯合剂
氨羧配位剂:
氨羧配位剂是指含有-N(CH2COOH)2基的有机化合物。
其分子中含有氨氮( N )和羧氧(
在水溶液中,两个羧基上的氢转移到氮原子上形成双偶
极离子结构
EDTA有 6 个配位原子
金属螯合剂

金属螯合剂金属螯合剂是一类化学物质,可以用来螯合金属离子,以及与溶液中的金属离子结合,形成化学键。
从技术上讲,它是一类特殊的螯合剂,也是精细化学中最重要的一类物质。
螯合剂的种类有很多,但是金属螯合剂的用途最广泛,最常见的是硼酸钙、硼酸钠、萘锶酸钾、硫酸钠、硼酸镁等等。
它们可以在其他反应物的作用下,迅速吸附溶液中的金属离子,从而融化金属离子,并分解一些混合溶液。
金属螯合剂也可以用于合成一些新的金属离子和化合物,使分析和合成精细化学产品变得更加容易。
金属螯合剂的主要用途是配制金属离子溶液和解决金属离子溶液中的盐析反应。
金属螯合剂的融合程序,可以将复杂的金属离子溶液分解成各种类型的离子,便于后续的分析和利用。
由于金属螯合剂的作用,可以融化金属离子,这使得在各种实验中更容易进行混合反应,以便得到有用的金属离子,并且还可以提高反应产物的纯度。
金属螯合剂还被广泛应用于实验室及工业生产中,如分析化学实验、纳米材料研究、以及电解技术、污染物处理等,可以达到更加精确的反应效果。
金属螯合剂在电解技术中发挥着重要作用,因为它可以将高电位的金属离子融化,使电解过程更高效,并且改变电解液中金属离子的电位,影响反应产物的类型。
金属螯合剂具有非常独特的性质,以及在各种反应中特殊的作用,它不仅可以用来融化金属离子,还可以用来配制各种金属离子溶液,从而分离金属离子,分离出各种有用的金属离子溶液,被广泛应用于精细化学领域,用于实验室和工业生产中。
另外,金属螯合剂也可以用作作为一种抗氧化剂,衰老抑制剂,去除水中的金属离子,以及其它各种医用和化妆品中的添加剂,以改善和保护产品的外观和功能。
总而言之,金属螯合剂无处不在,具有重要的作用,不仅可以用于实验室研究和工业生产,还可以用作作为抗氧化剂,衰老抑制剂,去除水中的金属离子,以及其它各种医用化妆品中的添加剂,为精细化学领域的发展贡献了重要的力量。
螯合剂螯合原理

螯合剂螯合原理
螯合剂是一种具有配位能力的化合物,能够与金属离子形成稳定的配位化合物。
螯合剂的配位原理是通过与金属离子中的空位轨道形成配位键,从而形成稳定的金属螯合物。
具体而言,螯合剂中的化学团通常是以带有富电子的原子(如氮、氧、硫等)作为配位原子,通过孤对电子或π电子与金属离子形成化学键。
这种配位键的形成是通过配位基中配位原子的孤对电子或非键电子与金属离子中的空位轨道相互重叠而实现的。
螯合剂与金属离子的配位反应通常以配位数和配位键的形态多样性为特征。
配位数是指一个金属离子能够与螯合剂形成的配位键的数目,常见的配位数有2、4、6等。
配位键的形态多样性包括阴离子配位键、配体配位键、桥键等形态。
螯合剂的螯合原理使得金属离子可以在溶液中形成稳定的配合物,改善其化学稳定性、溶解性和活性等。
因此,螯合剂在许多领域中有广泛的应用,如催化剂、药物、环境污染治理等。
材料工程技术专业《EDTA与螯合物》

乙二胺四乙酸的螯合物
螯合物是一类具有环状结构的配合物。
螯合即指成环,只有当一个配位体至少含有两个可配位的原子时才能与中心原子形成环状结构,螯合物中所形成的环状结构常称为螯环。
能与金属离子形成螯合物的试剂,称为螯合剂。
EDTA就是一种常用的螯合剂。
EDTA与Ca2形成的螯合物
EDTA分子中有六个配位原子,此六个配位原子恰能满足它们的配位数,在空间位置上均能与同一金属离子形成环状化合物,即螯合物。
图3-2所示的是EDTA与Ca2形成的螯合物的立体构型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•
CaY2-的结构
• EDTA与金属离子的配合有以下特点: • • 1.螯合能力强 除碱金属以外,能与几 乎所有的金属离子形成稳定的螯合物。 2.与金属离子形成的螯合物大多带有电 荷,因此易溶于水。
• 3.简单的螯合比 不论几价的金属离子, 它们与EDTA总是1:1螯合。例如: • • • M2++H2Y2--MY2 - +2H + M3++H2Y2--MY - +2H + M4++H2Y2--MY +2H +
• 4.由于EDTA与金属离子螯合可形成5个五元环, 故生成的螯合物十分稳定。常见金属离子的 EDTA螯合物的lgKs • • 见表5-2。 表5-2 EDTA与部分金属离子螯合物的稳定常 数对数值
•
溶液中螯合物的稳定性除决定于螯合 物稳定常数的大小外,还与溶液的pH值 有关。不同的金属离子与EDTA生成的螯 合物的稳定性不同,滴定时所需溶液的 pH值也不同。因此,在两种以上金属离 子的混合溶液中,常可以通过调节溶液 的pH值,用EDTA进行选择滴定。
pH值为9~10.5,一般用NH3-NH4Cl缓冲溶液控 制溶液pH值在10左右进行滴定。
•
对于含有两种或两种以上金属离子的 混合溶液,可以通过调节溶液的pH值,选
择性地滴定其中某一离子。例如,在Mg2+离子 和Zn2+离子的混合溶液中,可首先调节溶液pH
≈ 6.8,用铬黑T作指示剂,用EDTA滴定
•
常用的指示剂有铬黑T,钙指示剂, 二甲酚橙,PAN等。现以铬黑T为例,说 明金属指示剂的变色原理。铬黑T为弱酸 性偶氮染料,能随溶液pH值变化而显示 不同的颜色。如用符号表示铬黑T。 在溶液中有下列平衡:
•
铬黑T能与许多金属离子如Ca2+ Mg2+ Zn2+Cd2+ 等形成红色的配合物。在pH为 7~11时,铬黑T显兰色,与形成配合物的 红色有明显区别,则终点时颜色变化明 显。因此,用铬黑T作指示剂时最适宜的
例如,在Mg2+离子和Zn2+离子的混合溶液 中,调节溶液的pH ≈ 6.8, 这时EDTA仍可与 Zn2+离子完全螯合,而与Mg2+离子则完全不螯 合,即Mg2+离子的存在不会干扰EDTA 对Zn2+ 离子的螯合滴定。 • 由于滴定时不断有离子的生成,为了保持 合适的pH值,使反应进行完全,滴定前必须加 入合适的缓冲溶液控制溶液的pH值。 •
第三节
螯合物
• (一)螯合物和螯合剂的概念
二、氨羧螯合剂及氨羧 螯合滴定
• (一)氨羧螯合剂的结构和特点 • 氨羧螯合剂中最重要同时应用最广 的是乙二氨四乙酸(EDTA)及其二钠盐 (EDTA-2Na),统称为 EDTA。结构如 下:
•
EDTA在水中溶解度小,故配制标准 溶液时,常用它的二钠盐。 EDTA的分 子或离子中含有2个氨基氮和4个羧基氧 可与金属离子配合,生成具有5个五元环 的稳定性很高的螯合物。如下图:
Zn2+离子,此时Mg2+离子不干扰。然后再调节 溶液pH ≈ 10,用EDTA滴定Mg2+离子。
•
可加入某种掩蔽剂(此试剂能与干扰 离子结合成更稳定的配合物,而对被测 离子无影响),把干扰离子掩蔽起来, 再滴定被测离子。例如EDTA滴定Ca2+ Mg2+时,少量Fe3+, Al3+有干扰,可加 入三乙醇胺消除干扰。
• 水的总硬度按下式计算: • 总硬度= • 式中:
C
EDTAV EDTA V水样
×1000
• CEDTA: EDTA 标准溶液的浓度( mol L-1 ) • VEDTA : 消耗EDTA标准溶液的体积(L) • V: 滴定时水样的体积(L)
• (三)EDTA螯合滴定 • 示例-水的总硬度测定 • 水的总硬度是指水中Ca2 + , Mg2+的 总硬度(以为mmol L-1单位) • 测定水的总硬度时加NH3-NH4Cl缓冲溶 液调节pH ≈ 10,以铬黑T为指示剂,用 EDTA标准溶液滴定。溶液中有关配合物 的稳定性有如下顺序: • CaY2- > MgY2- >MgIn - > CaIn-
• (二)EDTA螯合滴定的基本原理 • EDTA螯合滴定就是基于EDTA与金属
离子螯合反应的一种重要的滴定分析方法,常 用于测定溶液中金属离子的含量。 • •
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。它 们是一类能与金属离子形成有色配合物的水溶 性有机染料。
作为金属指示剂必须具备以下条件:1. 与金属离子形成的配合物的颜色与其本 身(即未配合时)的颜色有明显不同; • 2.与金属离子形成的有色配合物具有足 够的稳定性; • 3.与金属离子形成配合物的稳定性必须 小于EDTA与金属离子形成螯合物的稳定 性。 •
• 反应式如下: • 加指示剂时: • Mg2+ + HIn2- MgIn - + H+ ⇌
• 蓝 • 滴定终点前: • Ca2++H2Y2• + H2Y • 滴定终点时: • MgIn-+ H2Y2• 紫红 Mg2+
2-
紫红 CaY2- +2H+
⇌ Y2- +2H+ Mg ⇌
MgY2- +HIn- +H+ 蓝 ⇌
• • • • • • •
螯合物:由中心原子与多齿配体形 成的环状配合物 螯合剂:能与中心原子形成螯和物 螯合效应:这种由于螯和物的生成 而使配合物的稳定性大大增加的作 用配合物中形成的鏊合环数目越多 其稳定性越强。
•
形成的螯合环以五元环和六元环最稳 定。常见的螯合剂大多是有机化合物,特 别是具有氨基N和羧基O的一类氨羧螯合 剂使用得更广。
