化学式和化学方程式练习题
初二化学式的练习题

初二化学式的练习题化学式是化学物质的一种表示方式,通过化学式可以简明地表示出化学物质的组成元素和原子数目。
初二学生在学习化学时,练习化学式的题目可以帮助他们加深对化学式的理解和掌握。
下面是一些初二化学式的练习题,供学生进行练习:1. 根据元素符号填写化学式的正确名称:a) NaCl:_______b) H2O:________c) CO2:________d) Fe2O3:________e) NH3:________2. 根据化学名字写出相应的化学式:a) 氯化钠:_______b) 二氧化碳:_______c) 水:________d) 亚硝酸:_______e) 硫酸:_______3. 化学式求摩尔质量:a) H2O的摩尔质量是多少?b) CO2的摩尔质量是多少?c) NaCl的摩尔质量是多少?d) Ca(OH)2的摩尔质量是多少?e) Al2(SO4)3的摩尔质量是多少?4. 化学式求元素的摩尔数:a) 在H2O中,氢元素的摩尔数是多少?b) 在CO2中,碳元素的摩尔数是多少?c) 在CaCl2中,钙元素的摩尔数是多少?d) 在H2SO4中,氢元素的摩尔数是多少?e) 在Al2O3中,铝元素的摩尔数是多少?5. 化学式求物质的摩尔比:a) C2H5OH中碳、氢、氧的摩尔比分别是多少?b) NH4NO3中氮、氢、氧的摩尔比分别是多少?c) Al(OH)3中铝、氢、氧的摩尔比分别是多少?d) K2Cr2O7中钾、铬、氧的摩尔比分别是多少?e) MgSO4·7H2O中镁、硫、氧、氢的摩尔比分别是多少?通过练习化学式的题目,初二学生可以加深对化学式的理解,从而提高化学知识的掌握程度。
希望以上练习题能对学生们有所帮助。
化学中的化学式与化学方程试题

化学中的化学式与化学方程试题一、选择题1. 化合物X的分子式是C3H8O2,下列物质可能是X的是:A. 丙酮B. 甲醛C. 乙醇D. 甲乙醚2. 以下反应中,正确配对的化学方程和反应类型是:A. 2KClO3 → 2KCl + 3O2,合成反应B. Fe + 2HCl → FeCl2 + H2,置换反应C. CaCO3 → CaO + CO2,分解反应D. C6H12O6 + 6O2 → 6CO2 + 6H2O,氧化反应3. 能使溶液电导能力增强的化学式是:A. AgNO3B. H2SO4C. C12H22O11D. NaCl4. 反应方程式:2H2 + O2 → 2H2O是下列反应之一:A. 催化剂反应B. 加热反应C. 光合作用D. 氧化反应5. 化学方程式:2HCl + Ba(OH)2 → BaCl2 + 2H2O表示以下反应类型:A. 酸碱中和反应B. 双替换反应C. 氧化还原反应D. 分解反应二、填空题1. 羧酸的通式为CnH2n+1COOH,若它是一个二元羧酸,则n的值为____。
2. 铜的4价化合物的化学式为CuOx,若氧原子数为1,则其化学式为____。
3. 按摩尔计算,1g氮的摩尔数是____。
4. 丙烯酸的结构式中含有____个碳原子。
5. NaOH + HCl → ____ + H2O。
三、简答题1. 什么是化学式?请举例说明。
2. 化学方程式中主要包含哪些元素?它们分别代表什么含义?3. 请解释酸碱中和反应的特点和应用。
4. 当铁与酸反应时,产生了氢气,写出该反应方程式,并解释其反应类型。
5. 分解反应与合成反应有何区别?请列举一个分解反应和一个合成反应的例子。
四、计算题1. 在以下分解反应中,假设完全反应,请计算需要分解的物质的摩尔质量:CaCO3 → CaO + CO22. 燃烧100g苯(C6H6),需要多少克氧气(O2)?C6H6 + O2 → CO2 + H2O3. 某种盐酸的浓度为0.25 mol/L,某学生希望制备200 mL浓度为0.1 mol/L的盐酸溶液,请计算他需要取多少毫升的0.25 mol/L盐酸溶液来配制。
【化学】化学《化学方程式》练习题及答案

【化学】化学《化学方程式》练习题及答案一、选择题1.煤的气化是提高煤的利用率、减少环境污染的有效措施。
煤的气化过程中发生了化学反应C+H 2O (气)H 2+CO ,反应前后,发生了变化的是A .元素的种类B .分子的种类C .原子的数目D .物质的总质量【答案】B 【解析】试题分析:在化学反应中元素的种类、原子的数目和物质的总质量都不发生改变,分子的种类发生了变化. 考点:化学变化的实质;点评:参加反应的各种物质的质量总和等于反应后各种物质的质量总和,理解质量守恒定律的特征和本质是解题的关键.2.如图表示某个化学反应,据图分析判断,下列各项中,不正确的是A .该反应属于置换反应B .反应中乙、丙两物质质量比为2: 7C .图示中x 的数值为4D .反应前后氢元素的化合价发生了改变【答案】B 【解析】 【分析】由化学反应的微观模型图可知,该反应是在一定条件下氢气与四氯化硅(SiCl 4)反应生成了硅和氯化氢气体,反应的化学方程式为:42SiCl +2H Si+4HCl 一定条件,由方程式可知: 【详解】A 、该反应是一种单质和一种化合物反应生成了另一种单质和另一种化合物,属于置换反应,故A 正确;B 、反应中乙、丙两物质质量比就是氢气和硅的质量比为:(2×1×2):28=1:7,故B 不正确;C 、由方程式可知,图示中x 的数值为4,故C 正确;D 、由方程式可知,氢元素的化合价由0价变成了+1价,故D 正确。
故选B 。
3.食盐不仅可以做调味品,还是一种重要的化工原料。
电解饱和食盐水,不可能得到的产物是( ) A .H 2B .Cl 2C.NaOH D.Na2CO3【答案】D【解析】【分析】根据化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变进行分析。
【详解】饱和食盐水中不含有碳元素,所以电解饱和食盐水不可能得到碳酸钠,故选D。
化学方程式的计算练习题40道

化学方程式的计算练习题40道化学方程式的计算练习题40道一、根据化学方程式进行计算1、在一个有6克氧气的密闭容器中,有5克铁粉和足量的硫,加热使之充分反应,问生成多少克固体混合物?2、现有10克氢气和氧气混合气体,点燃使之充分反应,得到5克水蒸气,问原来混合气体中各成分的质量?3、欲制得100千克碳酸钙含量为80%的石头灰,需要煅烧含碳酸钙含量为85%的石灰石多少千克?4、在一定条件下,11.2克金属钠与氧气完全反应,生成16.6克氧化物,求氧化物的化学式。
5、现有硫酸铜溶液20千克,其中含铜的质量分数为6%,现欲采用电解的方法除去其中的水分,问需要除去的水分质量为多少千克?(设水的质量分数为99%)二、物质的量在化学方程式计算中的应用6、在39千克过氧化氢溶液中,加入0.5千克二氧化锰,充分反应后可以得到多少摩尔氧气?61、在标准状况下,11.2升一氧化碳和13.2升氢气混合,充分反应后得到多少克产物?611、一定量的乙醇在氧气不足的情况下燃烧,得到二氧化碳、一氧化碳和水的总质量为50.4克,其中水的质量为25.2克,求二氧化碳的质量。
6111、在一个密闭容器中,有适量铜与一定量氧气反应,生成氧化铜的质量为16克,问消耗氧气的质量为多少?三、有关溶液的计算10、在20℃时,将33克食盐放入100克水中,充分溶解后得到溶液。
已知在该温度下,食盐在水中的溶解度为36克,求所得溶液的质量分数。
101、将58.5克食盐全部溶于200克水中,求该食盐溶液的质量分数。
1011、在20℃时,将40克硝酸钾溶于100克水中,已知在该温度下,硝酸钾在水中的溶解度为60克,求所得溶液的质量分数。
四、综合计算13、工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。
现称取纯碱样品12克,全部溶解在94.7克水中。
当加入稀盐酸73克时,恰好完全反应。
生成的气体全部逸出,所得溶液质量为170.2克。
计算反应后所得溶液中溶质的质量分数。
化学式与化学方程式的计算

化学式计算化学式是初中化学重要的知识点,对化学式概念的理解及有关化学式的计算技能的掌握,具有承上启下的作用。
不仅是分子、元素、原子知识的巩固、应用、加深,而且是继续学习氢、碳、铁、酸、碱、盐、化学方程式内容的基本工具。
一、计算元素种类、原子个数例1、NH4NO3中共有____种元素,_____个原子。
例2蔗糖在充足的氧气中燃烧,生成二氧化碳和水,则蔗糖中一定有_____元素,可能有_____元素。
将蔗糖隔绝空加热生成碳和水,则蔗糖中含有的元素是_____。
二、计算相对质量1、计算相对分子质量:化学式中各原子的相对原子质量的总和,符号:Mr例1、(NH4)2SO4的相对分子质量=_____,CuSO4•5H2O的相对分子质量=______。
2、计算相对原子质量例1mg化学式为RO的氧化物中含有ngR,则R的相对原子质量为____。
例2、某物质化学式为H2RO4,相对分子质量为98,则R的相对原子质量为_____,该元素1个原子中有16个中子,该元素的符号为_____.三、原子个数之比例1、Cu2(OH)2CO3中铜、氧、氢、碳原子个数之比为_____。
例2、由A、B两元素组成的化合物,A与B的质量比为1∶16,相对原子质量之比为1∶32,则A与B组成原子个数之比为_____。
练习:已知某物质由C、H、O三种元素组成,其中C、H、O三种元素的质量比为12∶3∶8,求C、H、O三种元素的原子个数比为_____。
四、计算某元素的质量分数(1)纯物质某元素的质量分数=某元素的相对原子质量×化学式中该元素的原子个数/化学式中相对分子质量×100%例1、求(NH4)2SO4中氮元素的质量分数练习1:Fe2O3中铁元素的质量分数。
练习2:计算CaSO4•2H2O中氧元素的质量分数。
(2)不纯物质中某元素的质量分数=纯物质的质量分数×纯度例2、求含Fe2O360%的铁矿石中铁的质量分数练习1:求含CaCO3 80%的石灰石中钙元素的质量分数。
化学式书写、化学方程式配平及计算等练习

化学式书写、化学⽅程式配平及计算等练习⼀、填空题(共20⼩题)1.写出下列物质的化学式:(1)氧⽓(2)氢⽓(3)氖⽓(4)铁(5)硫(6)氯⽓(7)铜(8)铝(9)氦氖(10)红磷(11)银(12)碳(13)氯化钾(14)氧化镁(15)四氧化三铁(16)⼆氧化碳(17)⼆氧化锰(18)氟化钙(19)三氧化⼆铁(20)五氧化⼆磷(21)⼆氧化硫(22)⾼锰酸钾(23)氯酸钾(24)过氧化氢2.根据化合价写出下列物质的化学式(在化合物中正三价的铁⼀般读作铁,正⼆价的铁读作亚铁.)(1)氧化锌(2)氧化钠(3)氧化铝(4)氧化汞(5)氧化镁(6)氧化钾(7)氧化铜(8)氧化亚铁(9)氯化氢(10)氯化铝(11)氯化钙(12)氯化镁(13)氯化铜(14)氯化锌(15)氯化银(16)氯化铁(17)氯化钠(18)氟化钙(19)硫化锌(20)硫化铜(21)硫化氢(22)硫化钠(23)氮化镁(24)硫化亚铁3.已知酸根前加氢元素的名称读作“某酸”如H2SO4读作硫酸;请根据以上提⽰写出下列物质的化学式:(1)硝酸(2)碳酸(3)磷酸(4)氯酸4.已知含有酸根的化合物(酸除外)的名称读作“某酸某”如Na2SO4读作硫酸钠;请根据以上提⽰写出下列物质的化学式:(1)硫酸锌(2)硫酸镁(3)硫酸铁(4)硫酸钾(5)硫酸钠(6)硫酸亚铁(7)硫酸铜(8)硫酸钙(9)碳酸铜 10)碳酸钙(11)碳酸钠(12)碳酸钾(13)碳酸钡(14)碳酸镁(15)硝酸铝(16)硝酸钠(17)硝酸钾(18)硝酸亚铁(19)硝酸铁(20)硝酸铜(21)磷酸铝(22)磷酸镁(23)磷酸钠5.已知含有氢氧根的化合物的名称读作“氢氧化某”如NaOH读作氢氧化钠;请根据以上提⽰写出下列物质的化学式:(1)氢氧化钾(2)氢氧化钙(3)氢氧化镁(4)氢氧化锌(5)氢氧化铜(6)氢氧化亚铁(7)氢氧化铁(8)氢氧化铝6.已知含有NH4的化合物的名称读作“某化铵”或“某酸铵”如NH4NO3读作硝酸铵;NH4Cl读作氯化铵;请根据以上提⽰写出下列物质的化学式:(1)硫酸铵(2)碳酸铵(3)磷酸铵(4)硫化铵7.元素M的硫酸盐的化学式为M2(SO4)3,则它的氧化物的化学式为_____________________8.X、Y、Z三种元素组成的化合物⾥,Y为+2价,Z为+5价,X为-2价.X、Z 两元素在化合物⾥组成的原⼦团为-3价,且有5个原⼦.则此化合物的化学式为 _________________⼆、写出下列反应的化学⽅程式:1、镁在空⽓中燃烧:______________________ _____2、铁在氧⽓中燃烧:____________________ _______3、铜在空⽓中受热:______________ _____________4、铝在氧⽓中燃烧:_________________ __________5、氢⽓在氧⽓/空⽓中燃烧:__________ _______________6、红磷在氧⽓/空⽓中燃烧:_______________ ___ ______7、硫粉在氧⽓/空⽓中燃烧:__________________ _______11、利⽤过氧化氢和⼆氧化锰的混合物制氧⽓:__________________________________________________________12、⽔在直流电的作⽤下分解:___________________________________________________________13、加热氯酸钾:_______________________________________________________________ 14、加热⾼锰酸钾:____________________________________________________三、配平下列化学⽅程式:(⼀)1、 Al + O2—— Al2O32、 Al + Fe3O4—— Fe + Al2O33、 Fe + O2—— Fe3O44、 Al + MnO2—— Mn + Al2O35、 N2 + H2—— NH36、 Al + H2SO4—— Al2(SO4)3 + H2(⼆):1、 CO + Fe2O3 —— Fe + CO22、 C + Fe2O3—— Fe + CO23、 CO + Fe3O4 —— Fe + CO24、 C + Fe3O4—— Fe + CO25、 H2 + Fe2O3—— Fe + H2O6、 H2 + Fe3O4—— Fe + H2O10、H2+ WO3——W + H2O 11、CO + O2——CO212、 Fe + H2O—— H2 + Fe3O413、 Al(OH)3+ HCl —— AlCl3 + H2O(三)1、 FeS2 + O2 —— Fe2O3 + SO22、 C2H2 + O2——CO2+ H2O3、 C + Fe2O3—— Fe + CO24、 MnO2 + HCl—— MnCl2 + Cl2 + H2O5、 Cl2 + Ca(OH)2—— CaCl2 + Ca(ClO)2 + H2O(四)1、 C2H2 + O2——CO2 + H2O2、C6H6 + O2—— CO2 + H2O3、 C22H46 + O2——CO2 + H2O4、 NH3 + Cl2 —— NH4Cl + N25、 As2O3+ Zn + HCl——AsH3+ ZnCl2+ H2O6、 C X H Y+ O2——CO2+ H2O四、题型变化:1、3Cu+8HNO3 ==3Cu(NO3)2+2X↑+4 H2O,求X的化学式为。
初中历史常见物质化学式书写练习

初中历史常见物质化学式书写练习
在研究历史的过程中,了解常见物质的化学式是十分重要的。
通过了解这些物质的化学式,我们可以更好地理解它们的性质和作用。
以下是一些常见物质的化学式书写练。
1. 氧气:
氧气是一种气体,化学式为O2。
氧气是生物体进行呼吸所必需的。
它还与其他物质反应,例如火焰燃烧以及金属氧化。
2. 二氧化碳:
二氧化碳是一种无色无味的气体,化学式为CO2。
它是空气中的一部分,也是动物呼吸排出的废气。
二氧化碳还参与植物光合作用,并在燃烧过程中产生。
3. 水:
水是一种无色透明的液体,化学式为H2O。
水是地球上最常见的物质之一,也是生命存在的基础。
它具有很高的溶解性,是许多化学反应的媒介。
4. 盐:
盐是一种晶体,化学式为NaCl。
它是一种常见的调味品,同时也是一种重要的食物添加剂。
盐在食物加工和保存中起到了重要作用。
5. 金属铁:
金属铁是一种坚固的金属,化学式为Fe。
它是地球上最常见的金属之一,被广泛用于制造工具和建筑材料。
铁还参与了一些重要的化学反应,例如铁的氧化和腐蚀。
通过对这些常见物质的化学式书写练,我们可以更深入地了解它们的性质和作用。
这有助于我们在研究历史时更好地理解其中的化学过程和联系。
人教版初三化学九上《化学式与化学方程式》练习题

化学式与化学方程式一、单选题1.小明对二氧化硫(SO2)化学式表示的意义有如下四种理解,你认为不正确...的是A.表示二氧化硫这种物质B.表示一个二氧化硫分子C.表示二氧化硫分子由1个碳原子和2个氧原子构成D.表示二氧化硫由硫元素和氧元素组成2.下列推理或归纳合理的是A.因为水和冰的状态不同,所以两者的化学性质不同B.氧化物中含有氧元素,但含有氧元素的化合物不一定是氧化物C.单质是由同种元素组成的,所以只含一种元素的物质一定是单质D.在化合物中金属元素一定是正价,非金属元素一定都是负价3.下列物质的化学式书写正确的是A.硫酸钾KSO4B.氢氧化铝AlOH3C.硝酸铜CuNO3D.碳酸钠Na2CO34.酚酞溶液是比较常见的酸碱指示剂之⼀,酚酞是白色或微带黄色的结晶粉末,无臭,无味,它的化学式是C20H14O4,关于酚酞的下列说法正确的是A.酚酞由碳原子、氢原子、氧原子构成B.酚酞分子中氧元素质量分数最大C.酚酞属于氧化物D.每个酚酞分子中含有38个原子5.下列化学用语中。
关于数字“2”表示的意义正确的是A.2H:表示两个氢元素B.Mg2+:表示镁元素的化合价为+2价C.2CO2:前面的2表示两个二氧化碳分子D.NO2:表示二氧化氢中含有两个氧原子6.某市有大量温泉,泉水中含有有益于人体健康的硅酸盐,其中一种物质的化学式为Na SiO,则该物质中硅元素的化合价为23A.+3B.+4C.+5D.+67.下列关于质量守恒定律的说法正确的是A.根据质量守恒定律,1 L氢气和1 L氧气反应能生成2 L水B.蜡烛完全燃烧后,蜡烛没有了,这违背了质量守恒定律C.10 g冰受热熔化成10 g水,符合质量守恒定律D.铁丝在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝与氧气的质量之和8.在A+B=C+D的反应中,9.8gA和8gB完全反应生成14.2gC,同时得到D的质量为A.1.8g B.3.6g C.7.2g D.14.4g9.将甲、乙、丙、丁四种物质置于一个完全密闭的容器中,在一定条件下反应,已知反应前后各物质的质量如下:下列有关说法不正确的是A.m=5B.发生反应的甲、乙质量之比为3:1C.该反应为化合反应D.丙可能为该反应的催化剂10.二氧化碳和氢气在一定条件下生成甲醇(一种燃料)和水,反应的微观示意图如下、有关说法正确的是A.甲醇的化学式为CH3O B.甲醇中碳元素的质量分数最小C.反应前后原子数目不变D.参加反应的二氧化碳和氢气的分子个数比为1:411.下列关于S+O2点燃SO2的描述不正确的是A.表示硫和氧气在点燃条件下反应生成二氧化硫B.二氧化硫分子中硫元素和氧元素的质量比是1:1 C.反应前后硫原子、氧原子的个数均不变D.参加反应的氧气与生成的二氧化硫的分子个数比为1:112. 在反应2X+3O 点燃222CO +3H O 中,X 的化学式是A .CH 4OB .C 2H 4O C .C 2H 6OD .C 3H 6O 213. 下列反应的化学方程式书写正确的是A .铁在氧气中燃烧: 2234Fe+3O 2Fe O 点燃B .实验室用过氧化氢溶液制氧气: 222222H O 2O H n O M ↑+↑ C .镁条在空气中燃烧: 22Mg+O 2MgO 点燃D .红磷在空气中燃烧: 2254P+5O 2P O 点燃14. 如图四位同学正在讨论某一个化学方程式表示的意义,他们所描述的化学方程式是A .S+O 2点燃SO 2B .2CO+O 2点燃2CO 2C .2Mg+O 2点燃2MgO D .C 2H 5OH+3O 2点燃2CO 2+3H 2O二、填空题 15. 写出下列反应的化学方程式。
化学式练习题初二

化学式练习题初二化学式是化学领域中用来表示物质组成的重要工具。
初二的学生需要通过大量的练习掌握化学式的写法和原子之间的组合关系。
本文将提供一些适合初二学生的化学式练习题,帮助他们巩固知识和提高解题能力。
练习题一:确定化合物的化学式1. 氯化钠是由钠和氯两种元素组成的化合物,请写出氯化钠的化学式。
2. 三氧化二铝是由铝和氧两种元素组成的化合物,请写出三氧化二铝的化学式。
3. 硫化铝是由铝和硫两种元素组成的化合物,请写出硫化铝的化学式。
4. 氧化铁是由铁和氧两种元素组成的化合物,请写出氧化铁的化学式。
练习题二:根据化学式确定化合物的名称1. 化学式为NaCl的化合物是什么?2. 化学式为Fe2O3的化合物是什么?3. 化学式为H2O的化合物是什么?4. 化学式为CO2的化合物是什么?练习题三:配平化学方程式1. 将化学方程式H2 + O2 → H2O进行配平。
2. 将化学方程式Fe + Cl2 → FeCl3进行配平。
3. 将化学方程式CH4 + O2 → CO2 + H2O进行配平。
4. 将化学方程式Al + CuCl2 → AlCl3 + Cu进行配平。
练习题四:根据化学式判断化合物的种类1. 化学式为H2O的化合物属于什么类别?2. 化学式为CH4的化合物属于什么类别?3. 化学式为CO的化合物属于什么类别?4. 化学式为C6H12O6的化合物属于什么类别?练习题五:写出以下化合物的化学式1. 氯化氢2. 二氧化碳3. 硝酸4. 氧化钙以上是一些适合初二学生的化学式练习题,通过解答这些问题,学生可以巩固所学知识,提高化学式写作和解题的能力。
希望这些练习题能够帮助初二学生更好地理解化学式的概念和应用。
化学式推导与化学方程式的平衡练习题

化学式推导与化学方程式的平衡练习题化学式推导是化学中非常重要的一项技能,它可以帮助我们预测化学反应的产物以及了解反应的平衡情况。
而化学方程式的平衡则是化学式推导的延伸,它要求反应物和生成物的数目要相等,以满足质量守恒定律和化学反应速率的平衡。
下面将给出一些化学式推导和化学方程式平衡的练习题,帮助大家巩固这一重要知识点。
1. 给定反应:氢气与氧气反应生成水,写出该反应的化学方程式。
解答:氢气与氧气反应生成水的化学方程式为:2H2 + O2 → 2H2O2. 已知反应物为硫酸铜和氢氧化钠,求反应物之间的化学式。
解答:硫酸铜与氢氧化钠反应的化学式为:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO43. 已知反应物为三氧化硫和水,求反应物之间的化学式。
解答:三氧化硫与水反应的化学式为:SO3 + H2O → H2SO44. 给定反应:乙烯与氯气反应生成1,2-二氯乙烷,写出该反应的化学方程式。
解答:乙烯与氯气反应生成1,2-二氯乙烷的化学方程式为:C2H4 + Cl2 → C2H4Cl25. 已知反应物为硫酸钠和氯化铜,求反应物之间的化学式。
解答:硫酸钠与氯化铜反应的化学式为:Na2SO4 + CuCl2 → CuSO4 + 2NaCl6. 已知反应物为氧化钙和二氧化碳,求反应物之间的化学式。
解答:氧化钙与二氧化碳反应的化学式为:CaO + CO2 → CaCO37. 给定反应:五氧化二磷与水反应生成磷酸,写出该反应的化学方程式。
解答:五氧化二磷与水反应生成磷酸的化学方程式为:P4O10 + 6H2O → 4H3PO48. 已知反应物为甲醇和乙酸酐,求反应物之间的化学式。
解答:甲醇与乙酸酐反应的化学式为:CH3OH + (CH3CO)2O → CH3COOCH3 + CH3COOH通过以上练习题的解答,我们可以加深对化学式推导和化学方程式平衡的理解。
掌握这一基础知识,可以帮助我们更好地理解和预测化学反应,从而提高实验操作的准确性和安全性。
化学式计算的练习题与答案

化学式计算的练习题与答案化学式计算的练习题与答案化学式计算是化学中的一项基础技能,它涉及到了元素的相对原子质量、化合价以及化学反应的平衡等知识。
通过化学式计算,我们可以推导出物质的化学式和化学方程式,进而深入了解化学反应的本质和特点。
下面,我们将介绍几个化学式计算的练习题,并给出详细的解答。
1. 计算氧化铁的化学式。
氧化铁是由铁和氧两种元素组成的化合物。
根据氧化铁的化学性质,我们可以推测它的化学式为FeO。
在FeO中,铁的化合价为+2,氧的化合价为-2,两者化合后电荷相互抵消,形成了中性的化合物。
2. 计算硫酸铜的化学式。
硫酸铜是由铜、硫和氧三种元素组成的化合物。
根据硫酸铜的化学性质,我们可以推测它的化学式为CuSO4。
在CuSO4中,铜的化合价为+2,硫的化合价为+6,氧的化合价为-2。
根据化合价的平衡原则,硫的化合价需要乘以2,使得硫酸铜的总电荷为0。
3. 计算硝酸铵的化学式。
硝酸铵是由铵离子(NH4+)和硝酸根离子(NO3-)组成的化合物。
根据硝酸铵的化学性质,我们可以推测它的化学式为NH4NO3。
在NH4NO3中,铵离子的化合价为+1,硝酸根离子的化合价为-1。
根据化合价的平衡原则,铵离子的数量需要与硝酸根离子的数量相等,使得硝酸铵的总电荷为0。
4. 计算硫酸钠的化学式。
硫酸钠是由钠、硫和氧三种元素组成的化合物。
根据硫酸钠的化学性质,我们可以推测它的化学式为Na2SO4。
在Na2SO4中,钠的化合价为+1,硫的化合价为+6,氧的化合价为-2。
根据化合价的平衡原则,钠的数量需要乘以2,使得硫酸钠的总电荷为0。
5. 计算硫酸铁的化学式。
硫酸铁是由铁、硫和氧三种元素组成的化合物。
根据硫酸铁的化学性质,我们可以推测它的化学式为Fe2(SO4)3。
在Fe2(SO4)3中,铁的化合价为+3,硫的化合价为+6,氧的化合价为-2。
根据化合价的平衡原则,铁的数量需要乘以2,使得硫酸铁的总电荷为0。
通过以上几个化学式计算的练习题,我们可以发现化学式计算是根据元素的化合价和电荷平衡原则进行推导的过程。
初三化学第二单元练习题及答案

初三化学第二单元练习题及答案练习题一:化学方程式1.将以下化学方程式平衡:(1)Fe + O₂ → Fe₂O₃(2)NaOH + H₂SO₄ → Na₂SO₄ + H₂O(3)Al + CuCl₂ → AlCl₃ + Cu答案:(1)4Fe + 3O₂ → 2Fe₂O₃(2)2NaOH + H₂SO₄ → Na₂SO₄ + 2H₂O(3)2Al + 3CuCl₂ → 2AlCl₃ + 3Cu练习题二:元素周期表1.根据元素周期表回答以下问题:(1)氧气的化学式是什么?(2)氯气的原子序数是多少?(3)镁的原子质量是多少?答案:(1)氧气的化学式是O₂。
(2)氯气的原子序数是17。
(3)镁的原子质量是24.31。
练习题三:化学反应1.将以下化学反应方程式补充完整:(1)H₂ + Cl₂ → ?(2)Ca + H₂O → ?(3)C + O₂ → ?答案:(1)H₂ + Cl₂ → 2HCl(2)Ca + H₂O → Ca(OH)₂ + H₂(3)C + O₂ → CO₂练习题四:离子反应1.将以下离子反应方程式写出并平衡:(1)氯离子与银离子的反应(2)钙离子与碳酸根离子的反应(3)铜离子与氢氧根离子的反应答案:(1)Ag⁺ + Cl⁻ → AgCl(2)Ca²⁺ + CO₃²⁻ → CaCO₃(3)Cu²⁺ + 2OH⁻ → Cu(OH)₂练习题五:酸碱中和反应1.下列物质中,哪些可以用来中和盐酸(HCl)?(1)NaOH(2)H₂O(3)NH₄OH(4)Na₂CO₃答案:(1)NaOH和(3)NH₄OH可以用来中和盐酸(HCl)。
练习题六:化学计算1.计算以下化学反应中所需的氧气体积:CH₄ + 2O₂ → CO₂ + 2H₂O已知反应中产生的二氧化碳气体体积为20L,计算所需的氧气体积。
答案:根据化学方程式中的比例关系,需要的氧气体积为40L。
练习题七:质量计算1.已知反应方程式为2Mg + O₂ → 2MgO,若反应时有8g的氧气,计算生成的MgO的质量。
高一化学化学方程式编写练习题及答案

高一化学化学方程式编写练习题及答案1. 将下列化学反应用化学方程式表示,并标明该反应属于氧化还原反应、酸碱反应、还是置换反应。
(1) 氯气与氢气反应生成盐酸。
(2) 硫酸与铜反应生成硫酸铜。
(3) 锌与硫酸反应生成氢气和硫酸锌。
(4) 氢氧化钠与盐酸反应生成氯化钠和水。
答案:(1) 2HCl + Cl2 → 2HCl属于氧化还原反应。
(2) Cu + H2SO4 → CuSO4 + H2O属于氧化还原反应。
(3) Zn + H2SO4 → ZnSO4 + H2属于氧化还原反应。
(4) 2NaOH + HCl → 2NaCl + H2O属于酸碱反应。
2. 写出下列化学方程式的化学式,并标明反应物和生成物的物态。
(1) 氢气与氧气反应生成水。
(2) 二氧化碳溶于水生成碳酸溶液。
(3) 金属钠与水反应生成氢气和氢氧化钠溶液。
(4) 氢氧化铝溶液与盐酸反应生成氯化铝溶液和水。
答案:(1) 2H2(g) + O2(g) → 2H2O(l)反应物的物态:氢气和氧气为气体。
生成物的物态:水为液体。
(2) CO2(g) + H2O(l) → H2CO3(aq)反应物的物态:二氧化碳为气体,水为液体。
生成物的物态:碳酸溶液为溶液。
(3) 2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)反应物的物态:金属钠为固体,水为液体。
生成物的物态:氢氧化钠溶液为溶液,氢气为气体。
(4) Al(OH)3(aq) + 3HCl(aq) → AlCl3(aq) + 3H2O(l)反应物的物态:氢氧化铝溶液和盐酸均为溶液。
生成物的物态:氯化铝溶液为溶液,水为液体。
3. 编写化学方程式,表示以下化学反应。
(1) 锌和二氧化碳反应生成碳酸锌。
(2) 铝和氯气反应生成三氯化铝。
(3) 氯化铝与氢气反应生成氯化氢和铝。
(4) 钙和硫酸反应生成硫酸钙和氢气。
答案:(1) Zn + CO2 → ZnCO3(2) 2Al + 3Cl2 → 2AlCl3(3) AlCl3 + 3H2 → Al + 3HCl(4) Ca + H2SO4 → CaSO4 + H2以上是高一化学化学方程式编写的练习题及答案。
五年级化学化学式计算练习题及讲解

五年级化学化学式计算练习题及讲解化学式计算是化学中非常重要的基础知识,通过计算不同元素之间的化学式,我们可以准确地表示出不同物质的组成与结构。
对于五年级的学生而言,了解和掌握化学式计算的方法,是培养科学思维和提升化学素养的重要一环。
本文将为五年级学生提供一些化学式计算的练习题及其详细讲解,帮助他们更好地掌握这一知识点。
练习题一:求下列物质的化学式。
1. 氢气和氧气混合后所得的物质。
2. 一氧化氮和二氧化氮混合后所得的物质。
3. 青石和稀硫酸反应后所得的物质。
4. 金属锌和硫酸反应后所得的物质。
5. 乙醇和醋酸反应后所得的物质。
讲解一:化学式的计算是根据不同元素的化合价进行的。
化合价是指一个元素在化合物中所呈现的价态,化合价可以是正的也可以是负的。
根据化合价,我们可以推导出不同元素之间的化学式。
1. 氢气和氧气是两种气体,混合后得到的物质是水。
水的化学式为H2O,其中氢的化合价为+1,氧的化合价为-2。
2. 一氧化氮和二氧化氮是由氮和氧组成的气体。
根据化合价的规律,氮的化合价为+1或-3,氧的化合价为-2。
由于一氧化氮和二氧化氮是由相同的元素组成,它们的化合价之和应为0。
因此,一氧化氮的化合价为+1,二氧化氮的化合价为-2,它们的化学式分别为NO和NO2。
3. 青石是由铜、氧和硅组成的矿石,化学式为Cu2SiO4。
根据化合价的规律,铜的化合价为+2,氧的化合价为-2,硅的化合价为+4。
在化学式中,化合价的绝对值应当相互抵消,得到Cu2SiO4。
4. 金属锌和硫酸反应后生成硫酸锌。
硫酸锌的化学式为ZnSO4。
锌的化合价为+2,硫的化合价为+6,根据电中性原理,硫酸锌的化合价应为0,因此硫酸锌的化学式为ZnSO4。
5. 乙醇和醋酸反应后生成乙酸。
乙酸的化学式为CH3COOH。
乙醇和醋酸的共同结构为CH3,而乙酸是在此基础上添加一个COOH基团而形成的。
根据化合价的规律,碳的化合价为+4,氧的化合价为-2,氢的化合价为+1。
初二化学化学方程式练习题及答案

初二化学化学方程式练习题及答案一、填空题1. 氢气燃烧会生成__________。
答案:水2. 铁(Fe)和硫(S)反应会生成__________。
答案:硫化铁(FeS)3. 氧气和铁(Fe)反应会生成__________。
答案:氧化铁(Fe2O3)4. 碳(C)和氧气反应会生成__________。
答案:二氧化碳(CO2)5. 氯气和钠(S)反应会生成__________。
答案:氯化钠(NaCl)6. 氧气和氢气反应会生成__________。
答案:水7. 氢气和氯气反应会生成__________。
答案:氯化氢(HCl)8. 碳酸氢钠(NaHCO3)分解会生成__________。
答案:二氧化碳(CO2)、水(H2O)、碳酸钠(Na2CO3)9. 氯化铜(CuCl2)和氢气反应会生成__________。
答案:铜(Cu)和盐酸(HCl)10. 二氧化硫(SO2)加水会生成__________。
答案:亚硫酸(H2SO3)二、简答题1. 什么是化学方程式?请用一个例子解释。
答案:化学方程式是用化学符号和化学式来表示化学反应的式子。
例如:化学方程式2H2 + O2 → 2H2O可以用来表示氢气和氧气反应生成水的化学反应。
2. 化学方程式中的反应物和生成物分别是什么?答案:反应物是化学反应开始时存在的物质,生成物是化学反应结束时产生的物质。
3. 如何平衡化学方程式?请以氮气和氢气反应生成氨气的方程式为例说明。
答案:平衡化学方程式需要保持反应物和生成物的质量守恒和电荷守恒。
以氮气和氢气反应生成氨气的方程式为例:N2 + H2 → NH3。
这个方程式已经平衡,因为反应物和生成物中的氮原子数目和氢原子数目已经相等。
4. 请列举三种化学反应类型及其示例。
答案:三种化学反应类型包括置换反应、双替反应和氧化还原反应。
- 置换反应的示例:AgNO3 + Cu → Cu(NO3)2 + Ag氯化银和铜反应生成硝酸铜和银。
化学课练习题化学反应方程练习

化学课练习题化学反应方程练习化学课练习题:化学反应方程练习一、填空题:1. 氮气和氢气反应生成氨气的化学方程式是______。
2. 磷和氧气反应生成五氧化二磷的化学方程式是______。
3. 钠和氯气反应生成氯化钠的化学方程式是______。
4. 硫磺和氧气反应生成二氧化硫的化学方程式是______。
5. 镁和氧气反应生成氧化镁的化学方程式是______。
二、选择题:1. 下列化学方程式中,表示不完全燃烧的是______。
A. CH4 + 2O2 → CO2 + 2H2OB. 2C3H7OH + 9O2 → 6CO2 + 8H2OC. 2Na + Cl2 → 2NaClD. 4Fe + 3O2 → 2Fe2O32. 化学反应中发生电子转移的是______。
A. 酸碱中和反应B. 酸酸反应C. 过氧化氢分解反应D. 硫酸与铜的反应3. 酸碱反应中,下列哪个是酸的性质?A. 产生氢气B. 呈酸性溶液C. 腐蚀金属D. 回应呈红色4. 下列化学反应中,属于氧化反应的是______。
A. 2H2 + O2 → 2H2OB. Fe + 2HCl → FeCl2 + H2C. CuO + H2 → Cu + H2OD. Mg + 2HCl → MgCl2 + H25. 以下哪一种化学反应不会发生火焰?A. 燃烧反应B. 酸碱中和反应C. 合成反应D. 酸酸反应三、简答题:1. 说明酸碱中和反应的特点。
2. 为什么氧化反应常常伴随着放热现象?3. 解释燃烧反应中的氧化作用和还原作用。
4. 如何判断一个物质在化学反应中起到催化剂的作用?5. 举例说明还原反应在生活中的应用。
四、计算题:1. 硫酸和氢氧化钠反应生成硫酸钠和水,若有50g的硫酸和50g的氢氧化钠参与反应,计算反应结束后硫酸钠的质量。
2. 氨气和氧气反应生成二氧化氮和水,若有36g的氨气和32g的氧气参与反应,计算反应结束后二氧化氮的质量。
3. 铁和硫反应生成硫化铁,若有80g的铁和60g的硫参与反应,计算反应结束后硫化铁的质量。
化学式与化学方程式课外作业.doc

化学试与化学方程式课外作业班级姓名识记1—元素符号:氢H;氦He;碳C;氮N;氧O;氟F;氖Ne;钠Na;镁Mg;铝Al;硅Si;磷P;硫S;氯Cl;氩Ar;钾K;钙Ca;锰Mn;铁Fe;铜Cu;锌Zn;钡Ba;碘I;汞Hg;银Ag;铂Pt;金Au;识记2—化合价规律:1.单质中元素化合价为02.在化合物中,金属元素只显正价,非金属元素有时显负价,有时也显正价3. 化合物中,氧元素通常显-2价,氢元素通常显+1价4.化合物中,正负化合价代数和为0识记3—化合价口诀:一价钾钠氯氢银,二价氧钙钡镁锌,三铝四硅五价磷,二三铁,二四碳,二四六硫都齐全,铜汞二价最常见。
【+2价的Fe读‘亚铁’,+3价的Fe读‘铁’】识记4—原子团:氢氧根OH;硝酸根NO3;碳酸根CO3;硫酸根SO4;铵根NH4原子团化合价:负一氢氧硝酸根,负二碳酸硫酸根,正一价,是铵根。
识记5—强记的化学式:过氧化氢H2O2 氯酸钾KClO3高锰酸钾KMnO4锰酸钾K2MnO44一、读出下列化学式的名称1.读出下列各化学式的名称:(1) Fe3O4, (2) K2S , (3) NaCl ,(4) KClO3, (5) Al2O3, (6) HCl ,(7) C u(O H)2, (8) KOH , (9) CaCO3,(10) Na2CO3,(11) CuSO4,(12) Al2(SO4)3, (13) KNO3, (14) NH4NO3, (15) (NH4)2SO4.2.读出下列各组物质的名称:(1) CO , (2) FeO , (3) FeCl2,CO2, Fe2O3, FeCl3, (4) H2O , (5) KMnO4, (6) BaS ,H2O2, K2MnO4, BaSO4.二、写出下列单质的化学式(1) 氢气,氧气,氮气,氟气,氯气;(2) 氦气,氖气,氩气,硫磺,木炭,磷,硅,铝,铁,汞,锌。
三、写出下列化合物的化学式(1) 氯化镁,(2) 氯化钙,(3)硫化银,(4)硫化亚铁,(5) 氧化镁,(6) 五氧化二磷,(7) 二氧化锰,(8)氢氧化亚铁,(9)氢氧化钡,(10)氢氧化钠,(11)碳酸钾,(12)碳酸钙,(13)硫酸铝,(14)硫酸铵,(15)硝酸银,(16)硝酸铜。
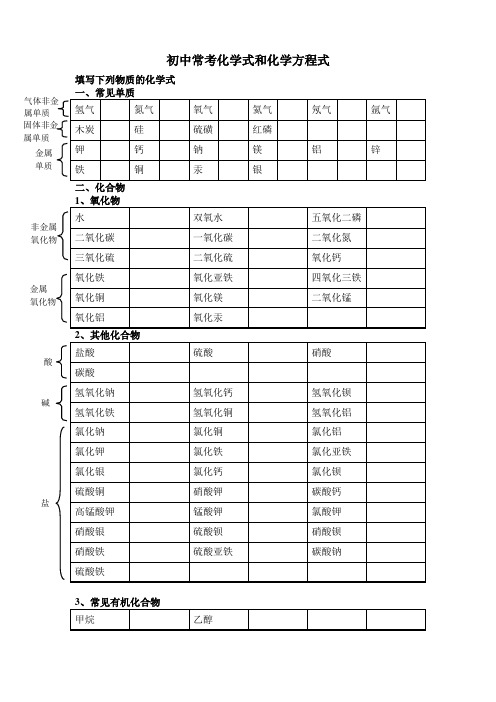
初中常考化学式和化学方程式
初中常考化学式和化学方程式填写下列物质的化学式属单质 属单质 金属单质酸碱盐金属写出下列化学反应的化学方程式一、化合反应1、氢气在空气中燃烧生成水:2、红磷在空气中燃烧:3、硫磺在空气(或氧气)中燃烧:4、镁条在空气中燃烧:5、铁丝在氧气中燃烧:6、木炭在空气(或氧气)中完全燃烧:7、木炭不充分燃烧:8、一氧化碳燃烧:9、二氧化碳和水反应生成碳酸:10、二氧化碳通过灼热的炭层:二、分解反应11、高锰酸钾制氧气:12、氯酸钾制氧气:13、双氧水制氧气:14、电解水:15、碳酸分解:16、高温煅烧石灰石:三、置换反应:单质 + 化合物→另一种单质 + 另一种化合物17、木炭还原氧化铜:18、铁和硫酸铜溶液反应:19、锌和硫酸反应制取氢气:20、铝和稀硫酸反应:21、铜和硝酸银溶液反应:四、复分解反应:(一)酸 + 碱→盐 + 水22、氢氧化钠与盐酸反应:23、氢氧化钠与硫酸反应:24、氢氧化铝治疗胃酸过多:25、氢氧化镁与硫酸反应:(二)酸 + 盐→另一种酸 + 另一种盐26、氯化钡溶液与硫酸溶液反应:27、石灰石与稀盐酸反应制取二氧化碳:28、碳酸钠与稀盐酸:(三)碱+ 盐→另一种碱 + 另一种盐29、硫酸铜溶液和氢氧化钠溶液反应:30、氯化铁溶液和氢氧化钠溶液反应:(四)盐 + 盐→两种新盐31、硝酸银溶液与氯化钠溶液反应:32、氯化钡溶液与碳酸钠溶液反应:(五)金属氧化物 + 酸→盐 + 水33、稀盐酸清洗铁锈:34、氧化铜与稀硫酸反应:五、其他反应类型35、甲烷燃烧:36、酒精燃烧:37、一氧化碳还原氧化铁:38、二氧化碳通入澄清石灰水中:39、氢氧化钠在空气中变质:。
化学公式练习题

化学公式练习题
化学是一门研究物质组成、性质以及变化规律的科学。
在学习化学的过程中,掌握化学公式是非常重要的。
化学公式可以精确地描述物质所含元素的种类和比例,帮助我们理解化学反应的过程和结构。
本文将为您提供一些化学公式的练习题,帮助您巩固对化学公式的理解。
1. 以下物质的化学公式是什么?
a) 二氧化碳
b) 硫酸
c) 氨水
d) 氯化钠
2. 写出以下离子的符号和化学式:
a) 铁(Ⅲ)离子
b) 高锰酸钾离子
c) 硝酸根离子
d) 高锰酸根离子
3. 根据以下化学方程式,回答问题:
a) 酸性环境下,还原亚硝酸根离子(NO2-)可以被什么物质氧化为亚硝酸(HNO2)?
b) 氧化亚氮(N2O)的分解反应可产生什么物质?
c) 如何将硝酸(HNO3)转化为亚硝酸(HNO2)?
4. 根据以下化学式,判断以下化合物是否为氧化物:
a) CO2
b) H2O2
c) Na2O
d) MgSO4
5. 对于以下反应,写出化学方程式:
a) 氢氧化钠与盐酸反应产生水和氯化钠。
b) 氧气与氢气反应产生水。
c) 氯气与氢气反应产生盐酸。
以上是化学公式的练习题,希望能够帮助您巩固对化学公式的理解和运用。
在解答问题的过程中,可以查阅化学知识书籍或者参考互联网上的资料,以加深对化学公式的理解。
祝您学习愉快,取得成功!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学式和化学方程式练习题
一、写出下列各物质的化学式:
1、硫磺_______ 锌粒_____ 白磷______ 氦气______氯气______ 氧气____
氩气_______ 氮气_____ 铁丝_______ 氢气________ 氖气_________ 2、氧化铜_______ 氧化钙_______ 氯化钾_______ 氯化铵__________
氢氧化钠_______ 氢氧化钙______ 氢氧化钡_________,氢氧化铜________ 氢氧化铁_________,氢氧化亚铁__________,氢氧化铝___________
3、硫酸钠_______ 硫酸铝______ 硫酸钡________,硫酸铁__________
碳酸钠__________, 碳酸钾_________,碳酸钡_______,碳酸钙___________ 硝酸钡_________ 硝酸铜_________ 硝酸镁__________
氯酸钾________锰酸钾_________ 高锰酸钾______
4、水_______双氧水________ 水银___________金刚石________,石墨_______ 干冰________,盐酸________,硫酸_________,硝酸_________,碳酸_______ 二、写出下列各要求的符号:
钙元素________ 一个锌原子_________ n个亚铁离子________
三个硫原子_________一个氯离子_________二氧化硫中的硫为+4价_________ +2价的铜元素_________四个氮分子_______五个磷原子_________
三个双氧水分子_________ 四个铵根离子________两个氯原子_________ 三个氢分子_________ 四个铝离子_________,两个氮分子____________
三、写出下列各反应的化学方程式:
1、木炭充分燃烧__________________;不充分燃烧___________________
2、铁丝燃烧____________________
3、镁带燃烧______________________ 4.、红磷燃烧______________________ 5、硫粉燃烧______________________ 6、氢气燃烧_____________________9、铜丝在空气中受热变黑________________
10、拉瓦锡实验_____________________________
11、实验室制取氧气______________________,_______________________
____________________________
12、实验室制取二氧化碳_________________________________
13、工业上制取二氧化碳_________________________________
14、实验室制取氢气_______________________________
15、氢气还原氧化铜_______________________________
16、单质碳还原氧化铜_____________________________
17、一氧化碳的燃烧___________________
18、一氧化碳还原氧化铜_______________________________
19、单质碳还原二氧化碳________________________________
20、甲烷的燃烧____________________________________
21、乙醇的燃烧____________________________________
22、水的电解_____________________
23、工业上冶炼生铁___________________________。
