鲁教版高中化学必修2第一章第三节元素周期表的应用教学课件共17张PPT含视频
合集下载
鲁科版化学必修二132《元素周期表的应用》PPT课件

10
实验步骤
• 分别向两只培养皿中加水至其体积的1/2, 然后分别加入绿豆大小的一块金属钾和金 属钠,用表面皿盖在培养皿口上,注意观 察反应的剧烈程度,记录所发生的现象。 待冷却后,分别向两只培养皿中加入2~3滴 酚酞,观察实验现象。
23.09.2020
11
实验现象
• 钠跟水剧烈反应,钠浮在水的表面,并迅速 的熔成一个闪亮的小球,在水面四处游动,
卤族元素单质与氢气化合的反应条件
反应条件 反应程度
F2 暗处 爆炸
Cl2
Br2
光照或 加热 点燃
剧烈 缓慢
I2 不断 加热
缓慢
氢化物的 稳定性
很稳定
稳定
较稳定
不稳定 易分解
23.09.2020
8
小结
•
对ⅦA族元素原子从上到下,电子层数依
次增多,原子半径逐渐增大,失电子能力逐渐
增强,得电子能力逐渐减弱。其单质的熔、沸
You Know, The More Powerful You Will Be
16
谢谢你的到来
学习并没有结束,希望大家继续努力
Learning Is Not Over. I Hope You Will Continue To Work Hard
演讲人:XXXXXX 时 间:XX年XX月XX日
17
色态
淡黄绿色 气体 黄绿色 气体 深红棕色 液体 紫黑色 固体
依次加深
密度
1.69g\L (15℃) 3.214 g\L (0℃) 3.119 g\cm3 (20℃) 4.93 g\cm3
熔点℃ 沸点℃
-219.6 -188.1
-101
-34.6
-7.2
鲁科版高中化学必修二《元素周期表的应用》原子结构元素周期律PPT(第2课时)

的金属易与H2O反应,故不能从盐溶液中置换出不活泼的金属,
错误;B项,锂在空气中燃烧生成的是氧化锂,而不是过氧化锂,
错误;D项,碱金属单质的熔、沸点随着原子序数的递增而降低
,错误;C项,碱金属都能与水反应生成对应的碱和氢气,只是反
应越来越剧烈,正确。
第三十页,共九十三页。
【误区警示】碱金属元素性质的差异性 同主族元素的性质,不但要记住其相似性和递变性,还要
1.原子结构特点 (1)原子结构
第三页,共九十三页。
(2)对比归纳 ①相似性:最外层电子数都是__1。
②递变性:随着核电荷数的增加,电子层数_____逐__渐__增, 多
原子半径__逐__渐__增_大__。
第四页,共九十三页。
2.单质及化合物性质的递变性
第五页,共九十三页。
3.碱金属元素的性质与原子结构之间的关系
质具有相似性。同主族元素原子的电子层数逐渐增多,原子半 径增大,所以元素原子失电子能力增强,得电子能力减弱,元素 的金属性增强,非金属性减弱。
第二十页,共九十三页。
知识点一 碱金属元素单质化学性质的相似性和递变性
【重点释疑】 1.相似性(R表示碱金属元素)
第二十一页,共九十三页。
第二十二页,共九十三页。
C.碱金属单质都能与水反应生成碱和氢气 D.碱金属单质的熔、沸点随着原子序数的递增而升高
第二十八页,共九十三页。
【解题指南】解答本题需注意以下两点: (1)明确碱金属的物理和化学性质; (2)明确碱金属性质上的差异性。
第二十九页,共九十三页。
【解析】选C。A项,碱金属元素的单质具有强还原性,但活泼
颜色
状态 密度 熔、沸点
F2
浅黄 绿色 气体
Cl2
错误;B项,锂在空气中燃烧生成的是氧化锂,而不是过氧化锂,
错误;D项,碱金属单质的熔、沸点随着原子序数的递增而降低
,错误;C项,碱金属都能与水反应生成对应的碱和氢气,只是反
应越来越剧烈,正确。
第三十页,共九十三页。
【误区警示】碱金属元素性质的差异性 同主族元素的性质,不但要记住其相似性和递变性,还要
1.原子结构特点 (1)原子结构
第三页,共九十三页。
(2)对比归纳 ①相似性:最外层电子数都是__1。
②递变性:随着核电荷数的增加,电子层数_____逐__渐__增, 多
原子半径__逐__渐__增_大__。
第四页,共九十三页。
2.单质及化合物性质的递变性
第五页,共九十三页。
3.碱金属元素的性质与原子结构之间的关系
质具有相似性。同主族元素原子的电子层数逐渐增多,原子半 径增大,所以元素原子失电子能力增强,得电子能力减弱,元素 的金属性增强,非金属性减弱。
第二十页,共九十三页。
知识点一 碱金属元素单质化学性质的相似性和递变性
【重点释疑】 1.相似性(R表示碱金属元素)
第二十一页,共九十三页。
第二十二页,共九十三页。
C.碱金属单质都能与水反应生成碱和氢气 D.碱金属单质的熔、沸点随着原子序数的递增而升高
第二十八页,共九十三页。
【解题指南】解答本题需注意以下两点: (1)明确碱金属的物理和化学性质; (2)明确碱金属性质上的差异性。
第二十九页,共九十三页。
【解析】选C。A项,碱金属元素的单质具有强还原性,但活泼
颜色
状态 密度 熔、沸点
F2
浅黄 绿色 气体
Cl2
鲁科版化学必修2《元素周期表的应用》PPT

S Na
H
H
O
O
Na
Na
S
S
强
O、S同主族,O的原子半径小于S,原子核对最外层电子的吸引大于S,得电子能力强
产生白色沉淀
ቤተ መጻሕፍቲ ባይዱSO2+Ba2++2OH-==BaSO3↓+H2O
Li
Be
B
Mg
Ca
(1)正确。Be、B电子层数相同,Be核电荷数小,对外层电子吸引作用弱,原子 半径大 (2)错误。Li、Be同周期,失电子能力Li比Be强,单质Li与酸反应更剧烈。
双选
BD
思路: 由物质性质→元素原子得失电子能力→元素其它性质
A、氢化物稳定性(正相关):X>Y>Z B、得电子能力:X>Y>Z C、单质氧化性(正相关):X>Y>Z D、原子序数相邻,最外层电子数不同
D
AP一1>项.原S、>错子C比l:误>较O同、微周粒P、期氧左S化、→性注C右(l同::得周得氧电电期化子子,能性能力左关力)→系增:右F强,> O氧>化Cl性> PB<rS><IC>l,S半径减小
同主族上→下:得电子能力减弱
2B.项阳离错子误:、元还素原原性子失,电K>子B能a>力Ca越>A强l,对应氧离化子性得:电子能力越弱 K+<Ba2+ < Ca2+ < Al3+ 半径Ba2+>K+>Ca2+>Al3+
二、微粒半径大小的比较规律
1C.项一错看误电:子R层b数、K、Na、Li、同主族, 电还子原层性数R不b>同K>、N最a>外Li层,电半子径数R相b>同K时>N,电a>子Li层数越多,半径越大; 2电D.子项二层:看数还核相原电同荷性时数:,核K电>M荷g数>越Al大>H,半,氧径化越性小; 3K.+<三M看g2电+<子Al数3+<H+,半径,K+、Mg2+、Al3+电子层 核数电相荷同数,相核同时电,电荷子数数A越l>M多g,半>K径,半越径大; K+<Mg2+<Al3+,H+半径最小
鲁科版化学必修2《元素周期表》课件

半金属元素
总结词
半金属元素在周期表中位于金属和非 金属之间,它们的性质介于金属和非 金属之间。
详细描述
半金属元素通常表现出一些金属和非 金属的特性,例如硅、锗和锡等。它 们在电子工业和半导体行业中有着广 泛的应用。
05
元素周期表中的元素性质变化规律
原子半径的变化规律
总结词
随着原子序数的递增,元素原子的半径呈现周期性变化。
鲁科版化学必修2《元素 周期表》课件
• 引言 • 元素周期表简介 • 元素周期表的应用 • 元素周期表中的元素分类 • 元素周期表中的元素性质变化规律 • 元素周期表的未来发展
01
引言
课程简介
课程背景
介绍元素周期表的发展历程,以 及在化学学科中的重要地位。
课程目标
阐述本课件的教学目的,旨在帮 助学生掌握元素周期表的结构、 性质和应用。
电负性的变化规律
要点一
总结词
电负性呈现周期性变化,氟的电负性最强,铯的电负性最 弱。
要点二
详细描述
在元素周期表中,随着原子序数的递增,同周期元素的电 负性逐渐增加,而同主族元素的电负性逐渐减小。这是因 为电负性受到原子半径和核电荷数的影响,随着原子半径 的减小和核电荷数的增加,电子云的密度增加,使得电子 更加稳定,从而提高电负性。在元素周期表中,氟的电负 性最强,铯的电负性最弱。
在化学实验中,元素周期表可以帮助 实验者了解所需试剂的性质和反应条 件,预测实验结果和安全风险。
元素周期表还广泛应用于医药、农业、 环保等领域,为解决实际问题提供科 学依据和技术支持。
04
元素周期表中的元素分类
金属元素
总结词
金属元素在周期表中占据了大部分,它们具有导电、导热和延展性等特性。
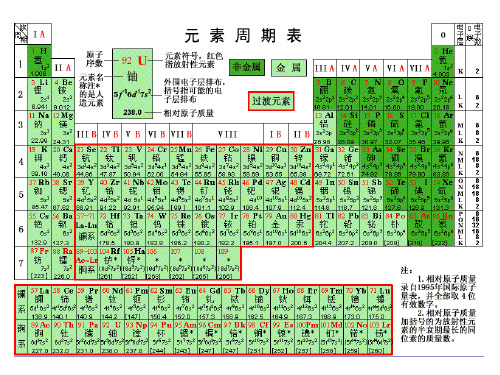
鲁科版必修2第一章第三节元素周期表的应用共3课时.ppt
元素周期表的应用
第二课时
二、预测同主族元素的性质
1、碱金属元素
(1)碱金属的原子结构
碱金属元素原子结构 原子结构 决定 化学性质
1.相同点:原子最 外层电子都只有一 个电子。
2.递变规律:Li Cs , 电子层数递增,原子半 径渐大,核对最外层电 子的引力下降。
都易失电子, 具强还原性。
Li Cs越来 越容易失电 子,还原性 逐渐增强。
(3) Br2+ 2I- ===== 2Br-+I2 思考:根据上述实验,排出Cl2、Br2、I2的 氧化性强弱顺序及Cl-、Br-、I-的还 原性强弱顺序
结论: 氧化性:Cl2>Br2>I2
还原性:I->Br->Cl-
小结
卤素原子结构的相似性,决定了单质化学性质的
相似性。 与金属反应,生成卤化物。
周期
periods
(横向)
短周期
short periods
第1周期:2 种元素 第2周期:8 种元素 第3周期:8 种元素
长周期
long periods
第4周期:18 种元素 第5周期:18 种元素 第6周期:32 种元素
不完全周期 第7周期:
uncompleted period
主族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
与氢气反应,生成卤化氢。
与水反应,生成卤化氢和次卤酸。
卤素原子结构的差异性,决定了单质化学性质的
差异性和递变性
与氢反应的能力渐弱
氢化物的稳定性渐弱
与水反应的能力渐弱
特性
碘遇淀粉显蓝色。 氟气和水的反应: 2F2 +2H2O=4HF+ O2
请您小结
化学课件《元素周期表的应用》优秀ppt 鲁科版

渐增__强_
规律总结
同周期元素从左到右随核电荷数的___递__增___,原 子半径逐渐__减__小___(稀有气体元素除外),原 子核对最外层电子的吸引力逐渐__增__强____,原子 的失电子能力逐渐___减__弱___,得电子能力逐渐 ___增__强___,元素的金属性逐渐__减__弱_____,非金 属性逐渐__增__强____。
例3.短周期元素Q、R、T、W在元素 C N
周期表中的位置如右图所示,其中T
所处的周期序数与主族序数相等, Al
S
请回答下列问题:
(1)T的原子结构示意图为
。
(2)元素的非金属性为(原子的得电子能力):
Q 弱于 W(填“强于”或“弱于”)。
三、原子结构、元素的性质、元素在周期表中的 位置间的相互关系
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
化学2(必修)第1章第3节 元素周期表的应用
一、同周期元素性质的递变规律
(1)金属元素:钠、镁、铝元素性质的比较
元素
钠(Na) 镁(Mg)
单质与水 现象 与冷水 与冷水__不__反应
反应
__迅__速__反应 与热水反应缓__慢__
铝(Al)
单质与盐 现象 酸反应
规律总结
同周期元素从左到右随核电荷数的___递__增___,原 子半径逐渐__减__小___(稀有气体元素除外),原 子核对最外层电子的吸引力逐渐__增__强____,原子 的失电子能力逐渐___减__弱___,得电子能力逐渐 ___增__强___,元素的金属性逐渐__减__弱_____,非金 属性逐渐__增__强____。
例3.短周期元素Q、R、T、W在元素 C N
周期表中的位置如右图所示,其中T
所处的周期序数与主族序数相等, Al
S
请回答下列问题:
(1)T的原子结构示意图为
。
(2)元素的非金属性为(原子的得电子能力):
Q 弱于 W(填“强于”或“弱于”)。
三、原子结构、元素的性质、元素在周期表中的 位置间的相互关系
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
化学2(必修)第1章第3节 元素周期表的应用
一、同周期元素性质的递变规律
(1)金属元素:钠、镁、铝元素性质的比较
元素
钠(Na) 镁(Mg)
单质与水 现象 与冷水 与冷水__不__反应
反应
__迅__速__反应 与热水反应缓__慢__
铝(Al)
单质与盐 现象 酸反应
鲁科版高中化学必修二课件第1章第3节第3节元素周期表的应用第1课时

②AlCl3 溶液中逐滴加入 NaOH 溶液 AlCl3+3NaOH===Al(OH)3↓+3NaCl Al(OH)3+NaOH===Na[Al(OH)4]
结论:碱性强弱顺序为 NaOH>Mg(OH)2>Al(OH)3
(3)钠、镁、铝失电子能力的比较
钠、镁、铝失电子能力由强到弱的顺序依次为:
Na>Mg>Al
下列叙述能肯定金属 A 比金属 B 更活泼的是 ()
A.A 原子的最外层电子数比 B 原子的最外层电子数少 B.A 原子电子层数比 B 原子的电子层数多 C.1 mol A 从酸中置换生成的 H2 比 1 mol B 从酸中置 换生成的 H2 多 D.常温时,A 能从水中置换出氢,而 B 不能
【解析】 金属 A 比金属 B 活泼的依据是 A 比 B 更易 失去电子,而失电子的能力并不取决于最外层电子数的多 少、电子层数的多少以及与酸反应置换出 H2 的多少,而是 取决于其与酸(或 H2O)反应置换出氢的难易程度。
高价氧化物对应的水化物的碱性比 A 的最高价氧化物对应
的水化物的碱性强;A 可以从 C 的盐溶液中置换出 C。则这
三种金属元素的失电子能力由强到弱的顺序是( )
A.A>B>C
B.B>A>C
C.B>C>A
D.C>B>A
【解析】 在相同条件下,B 的最高价氧化物对应的水 化物碱性比 A 的强,则 B 的金属性强于 A;A 可从 C 的盐 溶液中置换出 C,则 A 的金属性强于 C。
【答案】 B
1.下列能说明非金属性S强于P的是( ) A.S的颜色比P4的颜色深 B.P4能在常温下自燃,而S不能 C.酸性:H2S<H3PO4 D.酸性:H2SO4>H3PO4
鲁教版高中化学必修二第一章第3节元素周期表的应用第二课时公开课教学课件共23张PPT (共23张PPT)

强碱 中强碱 两性氢 弱酸 中强 强酸 最强
氧化物
酸
酸
得失电子能 失电子能力逐渐减弱,得电子能力逐渐增强 力递变
原子序数依次递增,原子半径逐渐减小
原子失电子能力逐渐减弱,得电子能力逐渐增强
1、下述事实能说明硫原子得电子能力比氯弱的是( B )
A.硫酸比盐酸稳定
B.氯化氢比硫化氢稳定
C.盐酸酸性比氢硫酸强 D.硫酸酸性比高氯酸强
知识支持
元素原子失电子能力的强弱,可以采用下 列方法间接判断:
1、比较元素单质与水(或酸)反应置换出 氢的难易程度。置换反应越容易发生,元素 原子的失电子能力越强。
2、比较元素最高价氧化物对应水化物的碱 性强弱。一般说来,碱性越强,元素原子失 电子的能力越强。
钠、镁、铝失电子能力比较 试剂:
面积相同的镁条和铝条,金属钠、MgCl2 溶液 、酚酞、盐酸(1mol/L),NaOH溶液、 AlCl3溶液、蒸馏水. 仪器:
2、按C、N、O、F的顺序,下列递变规律错误的是 (A) A.原子半径逐渐增大 B.元素原子得电子能力逐渐增强 C.最外层电子数依次增大 D.气态氢化物稳定性逐渐增强
3、在第三周期中,置换氢能力最强的元素的符号 为 Na ,化学性质最稳定的元素的符号为_Ar,最高 价氧化物的水化物酸性最强的酸的化学式是_H_ClO_4 , 碱性最强的化学式是___Na,OH显两性的氢氧化物的 化学式是___A_l(O,H该)3 两性氢氧化物与盐酸、烧碱 溶液分别反应的离子方程式为: _Al_(O_H)_3+3_H+_=A_l3+_+3_H2_O 、_Al_(O_H)_3+O_H_-=[_Al(_OH_)4_] - , 原子半径最大的金属元素的名称是_钠_。
氧化物
酸
酸
得失电子能 失电子能力逐渐减弱,得电子能力逐渐增强 力递变
原子序数依次递增,原子半径逐渐减小
原子失电子能力逐渐减弱,得电子能力逐渐增强
1、下述事实能说明硫原子得电子能力比氯弱的是( B )
A.硫酸比盐酸稳定
B.氯化氢比硫化氢稳定
C.盐酸酸性比氢硫酸强 D.硫酸酸性比高氯酸强
知识支持
元素原子失电子能力的强弱,可以采用下 列方法间接判断:
1、比较元素单质与水(或酸)反应置换出 氢的难易程度。置换反应越容易发生,元素 原子的失电子能力越强。
2、比较元素最高价氧化物对应水化物的碱 性强弱。一般说来,碱性越强,元素原子失 电子的能力越强。
钠、镁、铝失电子能力比较 试剂:
面积相同的镁条和铝条,金属钠、MgCl2 溶液 、酚酞、盐酸(1mol/L),NaOH溶液、 AlCl3溶液、蒸馏水. 仪器:
2、按C、N、O、F的顺序,下列递变规律错误的是 (A) A.原子半径逐渐增大 B.元素原子得电子能力逐渐增强 C.最外层电子数依次增大 D.气态氢化物稳定性逐渐增强
3、在第三周期中,置换氢能力最强的元素的符号 为 Na ,化学性质最稳定的元素的符号为_Ar,最高 价氧化物的水化物酸性最强的酸的化学式是_H_ClO_4 , 碱性最强的化学式是___Na,OH显两性的氢氧化物的 化学式是___A_l(O,H该)3 两性氢氧化物与盐酸、烧碱 溶液分别反应的离子方程式为: _Al_(O_H)_3+3_H+_=A_l3+_+3_H2_O 、_Al_(O_H)_3+O_H_-=[_Al(_OH_)4_] - , 原子半径最大的金属元素的名称是_钠_。
鲁科版化学必修2《元素周期律与元素周期表》课件

原子序数与核外电子排布
原子序数
原子序数是一个整数,表示原子 核中的质子数,决定了元素的种 类。
核外电子排布
核外电子排布是指电子在原子核 外空间的分布情况,遵循泡利不 相容原理、能量最低原理和洪特 规则。
元素性质的周期性变化
01
02
03
原子半径
随着原子序数的递增,同 周期元素的原子半径逐渐 减小,同主族元素的原子 半径逐渐增大。
最外层电子数变化规律
同一族中的元素具有相同的最外层电子数,但自上而下, 最外层电子数从1递增至8。
元素周期表的应用
预测元素性质
根据元素在周期表中的位 置,可以预测其化学性质 和物理性质。
指导合成新物质
通过了解元素在周期表中 的排布规律,可以指导合 成具有特定性质的新物质。
发现新元素
科学家通过研究元素周期 表的空位或异常现象,发 现新元素或合成新的化合 物。
合成新材料
利用元素周期表中的元素,通过 不同组合和排列,可以合成具有 特殊性质和用途的新型材料,如
超导材料、纳米材料等。
元素周期表在生产生活中的应用
指导农业生产
通过了解元素周期表中元素的生理作用,可以合理施肥和改良土 壤,提高农作物的产量和质量。
指导医药研发
药物成分通常由多种元素组成,通过研究元素周期表,可以发现具 有治疗作用的元素组合,进而开发新药。
鲁科版化学必修2《元素周期律与 元素周期表》课件
contents
目录
• 引言 • 元素周期律 • 元素周期表 • 元素周期律与元素周期表的关系 • 实践应用
01 引言
课程简介
课程背景
介绍元素周期律与元素周期表在化学 学科中的重要地位,以及其在日常生 活和工业生产中的应用。
鲁科版高中化学必修二课件1.2.1《元素周期律》课件

12/30/2016
原子序数
原子序数与原子半径折线图
12/30/2016
原子序数与元素化合价折线图
12/30/2016
随原子序数的递增,元素化合价 呈现什么规律性的变化?
12/30/2016
元素主要化合价的周期性变化
12/30/2016
原子序数
化合价的变化
1——2 3——10
11——18 +1
1——2
1→2
2
3——10 11——18
2
3
1→8
1→8
8 8
结论:1、随着原子序数的递增,元素原子的 最外层电子排布呈现( 周期性 )的变化。
12/30/2016
原子序数与最外层电子数柱形图
10
最外层电子数
8 6 4 2 0
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
原子序数:按核电荷数由小到大 的顺序给元素编号,这种编号, 叫做原子序数
元素的原子序数=
核电荷数 ( Z)
= 核内质子数
12/30/2016
= 核外电子数
一、元素周期律
12/30/2016
12/30/2016
K
12/30/2016
Ca
原子序数
电子层数 1
最外层电子 数
达到稳定结构 时的最外层电 子数
12/30/2016
比较下列微粒半径的大小 (1)O 和F (2)Na和Mg (3)Cl和F(4)Na+和Mg2+ (5)Na和Na+ (6)Cl和Cl(1)核电荷数不同,电子层数越多,半径越大。 如Cl>F。 (2)电子层数相同,核电荷数越大,半径越小。 如Na>Mg,Na+>Mg2+。 (3)同种元素的原子半径>阳离子半径。 Na>Na+ (4)同种元素的原子半径<阴离子。如Cl<Cl-。
新鲁科版必修2第1章第3节元素周期表的应用第2课时课件(32张)

B是氢化物的沸点问题,如果Y的 氢化物是HF,X的氢化物是 HCl,HCl的沸点比HF的沸点低,但 Cl的非金属性比F弱,氢化物的沸 点与非金属性没有必然的联系,B 选项有一定的干扰性;
新课探 究 例3 X、Y是元素周期表中ⅦA族中的两种 元素,下列叙述中能说明X的非金属性比Y 强的是C( ) A.X原子的电子层数比Y原子的电子层数 多 B.X的氢化物的沸点比Y的氢化物沸点低 C.X的气态氢化物比Y的气态氢化物稳定 D.Y的单质能将X从NaX的溶液中置换出来
[解析] 同周期从左到右元素非金属性 逐渐增强,单质与氢气化合越来越容 易,生成的气态氢化物越来越稳定,简 单阳离子的氧化性依次增强、阴离子 还原性逐渐减弱,故A、D项错误,C项 正确。 同主族元素从上到下最高价氧化物对 应水化物的碱性逐渐增强,故B项错误。
新课探 究 例3 X、Y是元素周期表中ⅦA族中的两种 元素,下列叙述中能说明X的非金属性比Y 强的是C( ) A.X原子的电子层数比Y原子的电子层数 多 B.X的氢化物的沸点比Y的氢化物沸点低 C.X的气态氢化物比Y的气态氢化物稳定 D.Y的单质能将X从NaX的溶液中置换出来
课堂评 价4.下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是( A )
A
B
C
D
[解析] 随着核电荷数的递增,卤族元素的非金属性逐渐减弱,A正确;
随着核电荷数的递增,卤族元素单质的氧化性减弱,即氧化性:F2>Cl2>Br2,B错误; 随着核电荷数的递增,卤族元素的非金属性减弱,则气态氢化物的稳定性减弱,C错误;
新课探
究②原子半径和离子半径依次增大。
③最高价氧化物对应水化物的碱性逐渐增强,酸性逐渐减弱。
④气态氢化物的热稳定性逐渐减弱,还原性逐渐增强。
鲁科版高中化学必修二《元素周期表的应用》课件
力_____ 2越.比强较元素最__高__价_氧化物对应水化物—酸的酸性。 一般说来,酸性越强,元素原子得电子能力
越强
______
【阅读】教生材活便P2是1寻、求22新页的“知阅识—读—探门究捷”列。夫
元素
硅
磷
硫
氯
单质与氢气反应难 易
高温
磷蒸气
加热 点燃或光
照爆炸
气态氢化 物
化学 式
SiH4
PH3
生活便是寻求新的知识——门捷列夫
1、不能根据得电子的多少来判断非金属强弱 2、不能根据气态氢化物水溶液的酸性强弱判 断非金属性强弱 3、必须是最高价氧化物水化物酸性比较才能 说明非金属性强弱
生活便是寻求新的知识——门捷列夫
在同一周期中,各元素原子的电子层数相同,但从左 到右核电荷数依次增多,原子半径逐渐 减小(稀 有气体除外),原子核对外层电子的吸引能力逐 渐 增强 ,原子的失电子能力渐 减弱 ,得电子能力 逐渐 增强 。元素单质的还原性逐渐减弱,氧化性 逐渐 增强;最高价氧化物对应水化物的碱性减弱, 酸性 增强 ;气态氢化物的稳定性 增强 。
最高 价氧 化物 对应 水化
物
化学式 碱性
与冷水剧烈 反应
NaOH
强碱
与热水反应 迅速
Mg(OH)2
Al(OH)3
中强碱 两性氢氧化物
结 论
钠、镁、铝三种元素原子失去电子能力逐渐减弱
生活【便拓是寻展求研新究的知】识——门捷列夫
判断元素原子失电子能力强弱的方法还有: (3)比较元素在金属活动性顺序表中的相对位 置,金属元素越靠前,其失电子能力 越强 ; (4)依据金属单质间的置换反应,作还原剂的 金属的失电子能力大于作还原产物的金属的失电 子能力。 (5)比较简单金属阳离子的氧化性强弱,简单 金属阳离子的氧化性越强,对应金属元素的失电 子能力越 弱 。
越强
______
【阅读】教生材活便P2是1寻、求22新页的“知阅识—读—探门究捷”列。夫
元素
硅
磷
硫
氯
单质与氢气反应难 易
高温
磷蒸气
加热 点燃或光
照爆炸
气态氢化 物
化学 式
SiH4
PH3
生活便是寻求新的知识——门捷列夫
1、不能根据得电子的多少来判断非金属强弱 2、不能根据气态氢化物水溶液的酸性强弱判 断非金属性强弱 3、必须是最高价氧化物水化物酸性比较才能 说明非金属性强弱
生活便是寻求新的知识——门捷列夫
在同一周期中,各元素原子的电子层数相同,但从左 到右核电荷数依次增多,原子半径逐渐 减小(稀 有气体除外),原子核对外层电子的吸引能力逐 渐 增强 ,原子的失电子能力渐 减弱 ,得电子能力 逐渐 增强 。元素单质的还原性逐渐减弱,氧化性 逐渐 增强;最高价氧化物对应水化物的碱性减弱, 酸性 增强 ;气态氢化物的稳定性 增强 。
最高 价氧 化物 对应 水化
物
化学式 碱性
与冷水剧烈 反应
NaOH
强碱
与热水反应 迅速
Mg(OH)2
Al(OH)3
中强碱 两性氢氧化物
结 论
钠、镁、铝三种元素原子失去电子能力逐渐减弱
生活【便拓是寻展求研新究的知】识——门捷列夫
判断元素原子失电子能力强弱的方法还有: (3)比较元素在金属活动性顺序表中的相对位 置,金属元素越靠前,其失电子能力 越强 ; (4)依据金属单质间的置换反应,作还原剂的 金属的失电子能力大于作还原产物的金属的失电 子能力。 (5)比较简单金属阳离子的氧化性强弱,简单 金属阳离子的氧化性越强,对应金属元素的失电 子能力越 弱 。
