【K12学习】2019高考化学一轮复习知识点:钠及其化合物的重要性质
钠及其重要化合物知识点汇总

钠及其重要化合物知识点汇总钠是一种常见的金属元素,原子序数为11,在周期表中位于第三周期的左侧,是一种非常活泼的金属元素。
钠在生活中具有非常重要的作用,广泛应用于食品加工、制药、化学工业等领域。
本文将从钠的物理性质、化学性质、重要化合物等方面进行全面汇总,带领读者深入了解钠及其化合物。
一、钠的物理性质1. 外观:钠是一种银白色的金属元素,有一定的延展性和可塑性。
2. 密度:钠的密度较小,约为0.97g/cm³,是常见金属中密度最小的。
3. 熔点和沸点:钠的熔点较低,为97.8℃,沸点也不高,为883℃。
4. 导电性:钠是一种良好的导电金属,电子亦能良好地传导。
5. 可燃性:钠是一种极容易燃烧的金属元素,与水接触时可以迅速剧烈地反应,甚至能够产生爆炸。
二、钠的化学性质1. 与氧反应:钠与氧反应后能够生成氧化钠(Na2O)和过氧化钠(Na2O2)两种化合物。
其中,氧化钠能够与水反应,产生氢氧化钠(NaOH)。
2. 与酸反应:钠可以与酸反应,产生氢气和相应的钠盐。
例如,当钠与盐酸反应时可以产生氢气和氯化钠。
3. 与水反应:钠与水接触后可以迅速且剧烈地反应,产生氢氧化钠和氢气。
由于反应剧烈,钠和水一起使用时需要特别小心。
4. 氧化还原性:钠是一种良好的还原剂,可以将氧化性较强的物质还原。
例如,钠可以将氯气还原成氯化钠。
三、钠的重要化合物1. 氢氧化钠氢氧化钠(NaOH)是一种重要的化学品,也是钠最为重要的化合物之一。
氢氧化钠常常被用于金属清洗、纸浆生产、染料生产等行业。
2. 碳酸钠碳酸钠(Na2CO3)是一种常见的碳酸盐类化合物,广泛应用于玻璃制造、制药、生产洗涤剂等领域。
3. 氯化钠氯化钠(NaCl)是一种常见的盐类物质,是人体内必需的营养元素之一。
氯化钠广泛应用于食品加工、制盐和化学工业等领域。
4. 硫酸钠硫酸钠(Na2SO4)是一种重要的无机盐,在制造玻璃、纸张、化学品等方面具有广泛的应用。
2019高考化学知识点:钠及其化合物的重要性质语文

2019年高考化学知识点:钠及其化合物的重要
性质
钠及其化合物的重要性质
钠及其化合物的重要性质
(一)钠的反应
1.钠跟氧气常温下一般认为生成氧化钠,加热(或点燃)生成过氧化钠.(钠的保存)
2.钠及其化合物的重要性质:钠跟硫研磨能剧烈反应,甚至爆炸
3.钠跟水反应(现象?)
4.钠跟硫酸铜溶液反应(现象?)
5.钠跟乙醇反应(与跟水的反应比较?)
(有机物中的醇羟基、酚羟基、羧基都跟钠反应生成氢气,但剧烈程度不同。
)
(二)氧化钠和过氧化钠
1.都是固态物,颜色不同。
氧化钠是白色,过氧化钠是淡黄色;
2.氧化钠是典型的碱性氧化物,跟酸、酸性氧化物、水反应都符合碱性氧化物的通性;
3.过氧化钠不属于碱性氧化物。
(电子式?阴阳离子个数比?) 过氧化钠与水反应:过氧化钠与二氧化碳反应(用作供氧剂):※作呼吸面具上述两个反应均存
在过氧化钠有漂白作用(强氧化性)
(三)氢氧化钠的性质
1.白色固体,易潮解,溶解放热,强腐蚀性(使用中注意安全、称量时应注意?)
2.强碱,具有碱的通性:跟酸中和;跟酸性氧化物反应;跟某些盐反应生成沉淀;跟铵盐反应生成氨气
(实验中制取氨气用消石灰)
3.氢氧化钠跟两性氧化物(Al2O3)反应;跟两性氢氧化物[Al(OH)3]反应
4.氢氧化钠与金属铝反应生成氢气和偏铝酸钠.
5.腐蚀玻璃、陶瓷等硅酸盐制品,特别是熔融态的氢氧化钠强腐蚀性。
(保存中注意避免在有玻璃
塞、玻璃活塞的容器中时间过长;熔化氢氧化钠的容器选择等)。
2019届高考化学一轮复习 专题 钠及其重要化合物课件

(4)金属钠在石棉网上加热时,先熔化成银白色小球,然后剧烈 燃烧,产生黄色火焰。( ) (5)金属钠着火时,可用泡沫灭火器或干燥的沙土灭火。( ) (6)钠表面自然形成的氧化层能够保护内层金属不被空气氧化。 () (7)金属钠具有强还原性,可与 TiCl4 溶液反应制取金属 Ti。 ()
答案:(1)× (2)× (3)√ (4)√ (5)× (6)× (7)×
[自我检测] 1.判断正误(正确的打“√”,错误的打“×”)。 (1)(2017·高 考 江 苏 卷 ) 钠 与 水 反 应 的 离 子 方 程 式 : Na + 2H2O===Na++2OH-+H2↑。( ) (2)钠是银白色金属,熔点低,硬度大。( ) (3) 在 氧 气 中 加 热 时 , 金 属 钠 剧 烈 燃 烧 , 生 成 淡 黄 色 的 固 体 Na2O2。( )
与非金属单质反应O2常点温燃::____24__NN__aa+__+__OO__22__==点==__==__燃=2__=N__Na__2aO2__O__2_____________
Cl2:___2_N_a_+_C_l_2=_=点_=_燃=_=__2N_a_C_l_________
Na 与水反应:____2N_a_+__2H__2O_=_=_=_2N__aO_H__+_H_2_↑_____
与酸(如HCl)反应:__2_N_a_+_2_H_C_l_==_=_2_N_a_C_l+__H_2↑____
与盐溶液(如CuSO4溶液)反应:____2_N_a_+_C_u_S_O_4_+_____ __2H__2O_=_=_=_C_u_(O_H_)_2↓__+_N_a_2_SO__4+__H_2↑________
题组一 钠的性质 1.(教材改编题)下列关于钠的叙述中,正确的是( ) A.钠是金属元素,单质的熔点很高 B.钠在空气中燃烧,生成淡黄色的过氧化钠 C.钠在盐酸中反应与在水中反应剧烈程度应相同 D.钠与 FeSO4 溶液反应,可置换出单质铁
钠及其化合物知识点 高一化学

钠及其化合物复习要点一、Na 的性质1.物理性质:化合态、银白色、质软、ρ水<ρ<ρ煤油,熔沸点低,导电性良好2. 化学性质:① O 2等单质: 4Na +O 2=2Na 2O 切面银白色-迅速变暗-失去金属光泽2Na +O 2∆=====Na 2O 2 (黄色火焰,黄色固体)(和Cl 2. S 生成对应的盐 )② 与H 2O : 2Na +2H 2O =2NaOH +H 2↑ (浮熔游响红) 芙蓉又想红 ③ 与H + : 2Na +2HCl =2NaCl +H 2↑ 与酸置换④ 与盐溶液: 2Na +CuSO 4 +2H 2O =2NaCl +Cu(OH)2 ↓+H 2↑(Fe 3+ Mg 2+ Al 3+ 的盐)二、Na 2O 与Na 2O 2 的化学性质1.方程式记忆技巧:Na 2O == CaO ( 可以和CO 2 , H 2O ,H +反应) Na 2O 2 == H 2O 2==O 2 (生氧剂)Na 2O 2比Na 2O 多个O, 产物多个O 2 2.化学性质:① 与CO 2 : Na 2O + CO 2= Na 2CO 3(SO 2) 2Na 2O 2+ 2CO 2=2Na 2CO 3 +O 2↑② 与H 2O : Na 2O + H 2O =2NaOH2Na 2O 2+2H 2O =4NaOH +O 2↑O 2NaNa 2ONaHCO 3 Na 2CO 3 NaOHNa 2O 2NaClNaNa 2O Na 2O 2Na 2CO 3NaHCO 3O 2CO 2CO 2NaOHH 2OH 2OH 2OCO 2NaClHCl 或Cl 2HCl或CuCl 2 FeCl 3等HClHClHCl或CuCl 2 FeCl 3等CO 2CO 2OH-或有酸先酸遇盐先水③ 与H +: Na 2O + 2HCl = 2NaCl+ H 2O2Na 2O 2+4HCl = 4NaCl +2H 2O + O 2↑ ④ 与盐溶液: Na 2O + CuSO 4 + H 2O =Na 2SO 4+Cu(OH)2 ↓2Na 2O 2+2CuSO 4 +2H 2O =2Na 2SO 4+2Cu(OH)2 ↓ +O 2↑(Fe 3+ Mg 2+ Al 3+ 的盐)三、Na 2CO 3 与NaHCO 3的性质1.物理性质:化学式 Na 2CO 3 NaHCO 3 俗名 纯碱 苏打 小苏打 色态 白色(粉末)白色(晶体)溶解性 Na 2CO 3 > NaHCO 3 碱性Na 2CO 3 > NaHCO 32. 化学性质:① 热稳定性: Na 2CO 3 > NaHCO 3不分解 2NaHCO 3∆===== Na 2CO 3+H 2O↑+CO 2↑② 与H +: Na 2CO 3 慢 < NaHCO 3 快Na 2CO 3+2HCl =2NaCl +H 2O +CO 2↑ CO -23+2H +=H 2O +CO 2↑NaHCO 3+HCl =NaCl +H 2O +CO 2↑ HCO -3+H +== H 2O +CO 2↑③ 与NaOH : Na 2CO 3 NaHCO 3不反应 NaHCO 3+NaOH=Na 2CO 3+H 2O HCO -3+OH —== H 2O +CO 32—↑④ 与Ca(OH)2: Na 2CO 3 + Ca(OH)2 = 2NaOH+ Ca CO 3↓或Ba(OH)2 2NaHCO 3+Ca(OH)2 =Na 2CO 3+ Ca CO 3↓+2H 2O ⑤ 与可溶性Ca 盐或Ba 盐:NaHCO 3 Na 2CO 3不反应 Na 2CO 3+ CaCl 2=Ca CO 3+NaCl 23. 两者的鉴别: ① Na 2CO 3 Ca(OH)2 无现象NaHCO 3 石灰水变浑浊 ② Na 2CO 3 过量酸 慢 NaHCO 3 快 ③ Na 2CO 3 逐滴酸 后出气体NaHCO 3 先出气体有酸先酸 遇盐先水④可溶性Ca盐或Ba盐:Na2CO3 盐溶液↓NaHCO3 无现象4. 两者的相互转化CO2+H2ONa2CO3 NaHCO3①液OH- ②固四、焰色反应(物理方法)Na+ 黄K+ (紫--蓝色钴玻璃)(1)待测液:含有某元素的溶液(不能判别是分子,原子还是离子,只能判断元素种类)(2)金属丝:铂丝(铁丝、镍丝、钨丝等来熔点高金属丝代替).但不能用铜丝(绿色火焰干扰).(3)盐酸:去除金属丝表面的氧化物.(4)蓝色的钴玻璃:观察钾的焰色(因为钾中常混有钠的化合物杂质,蓝色钴玻璃可以滤去黄色火焰,以看清钾的紫色火焰)(5)操作过程:洗烧蘸烧金属丝金属丝至无色待测液金属丝,看颜色。
高一钠及其化合物的知识点总结

高一钠及其化合物的知识点总结钠(Na)是一种常见的金属元素,位于元素周期表的第11组。
下面是对高一学生有关钠及其化合物的一些重要知识点进行总结。
一、钠的性质和用途1. 物理性质:钠是一种银白色金属,具有良好的延展性和导电性。
在常温下是固态,但与空气中的氧气反应会产生氧化钠(Na2O)。
2. 化学性质:钠具有很强的活泼性,与水反应能剧烈放出氢气并产生碱性溶液氢氧化钠(NaOH)。
钠还能与非金属元素如氯气(Cl2)反应,生成氯化钠(NaCl)。
3. 用途:钠广泛应用于制备金属钠化合物、制造钠光谱灯、生产肥皂和纤维素等工业领域。
此外,氯化钠是重要的食盐,在生物体内发挥着平衡体液、调节神经传导等作用。
二、钠的离子化和原子结构1. 离子化:钠在化学反应中容易失去一个电子,形成带正电荷的钠离子(Na+)。
2. 原子结构:钠原子的电子结构为2-8-1,其中最外层的电子称为价电子,决定了钠的化学性质。
三、钠的化合物1. 氧化物:钠与氧反应形成多种氧化物,例如Na2O、Na2O2和NaO2。
这些氧化物常用于制备其他钠化合物。
2. 氯化物:氯化钠是钠的最常见化合物,具有广泛的应用,如食盐、制备其他氯化物等。
3. 氢氧化物:氢氧化钠(NaOH)是一种强碱,常用于化学实验和工业生产中。
4. 碳酸盐:碳酸钠(Na2CO3)在工业上被称为纯碱,常用于玻璃制造和水处理。
5. 硝酸盐:硝酸钠(NaNO3)在肥料生产和烟火制造中有重要作用。
四、钠的化学反应1. 与非金属元素反应:钠可以与氧、氯、溴和硫等非金属元素直接反应,生成相应的化合物。
2. 与水反应:钠与水反应会剧烈放出氢气,并且反应会放出大量热,形成氢氧化钠。
3. 与酸反应:钠可以与酸反应,产生盐和氢气。
4. 与氨反应:钠与氨气(NH3)在高温下反应,生成钠氨化合物(NaNH2)。
总结:钠是一种活泼的金属元素,具有很强的化学反应性。
它与氧、氢、氯和其他非金属元素反应,形成不同的化合物。
钠及其化合物知识点总结

钠及其化合物知识点总结钠是第11个元素,属于金属元素。
在化学反应中,钠常被用作还原剂,因为它对氧化物具有强烈的还原性。
钠是一种非常活泼的金属,它可以在接触空气时产生火花并起火,因此必须以特殊的方式储存和处理。
钠的物理特性:钠是一种银白色的金属,具有非常低的密度,因此它可以漂浮在水上。
它的熔点为97.8°C,沸点为882°C,密度为0.97克/毫升。
钠的化学特性:钠具有非常高的反应性,它能够与许多元素和化合物反应,生成各种类型的化合物。
钠和氧气反应时,会产生白色的氧化钠(Na2O)。
钠还可以与水反应,生成氢氧化钠(NaOH)和氢气(H2)。
当钠和氯气反应时,会生成白色的氯化钠(NaCl)。
氢氧化钠:氢氧化钠(NaOH)是一种强碱性化合物,是钠最常见的化合物之一。
它可以通过将钠金属直接与水反应得到。
氢氧化钠在工业上用于生产肥皂、卫生纸和清洁剂等。
氯化钠:氯化钠(NaCl)也被称为食盐,是钠最常见的化合物之一。
氯化钠在食品中被广泛使用,也用于制药、化工和水处理等领域。
碱性火箭燃料:钠也可以被用作火箭燃料的成分之一,其中钠与液氧混合在一起。
这种混合物的燃烧产生了非常高的温度和火焰速度,可以使火箭运行更有效率。
钠的危害:钠在人体内必须以适量的方式摄入,过量的摄入会对健康造成危害,包括增加血压、心脏病、肥胖和骨质疏松等疾病。
总之,钠是一种非常活泼的金属,它具有强烈的还原性和反应性,可以与许多元素和化合物反应生成多种类型的化合物。
它的化合物包括氢氧化钠、氯化钠等,在工业生产和日常生活中都具有重要的应用价值。
同时,过量的摄入会对人体健康造成危害,应注意控制摄入量。
除了以上介绍的氯化钠和氢氧化钠,钠还有一些常见的化合物,如硫酸钠、磷酸钠、碳酸钠等,它们在工业生产、医药和日常生活中都有重要的用途。
硫酸钠:硫酸钠(Na2SO4)是一种无色无臭的结晶体,它是一种重要的工业化学品,用于制造玻璃、纸张、墨水、清洁剂等。
高中化学-钠及其化合物的性质最全知识点总结

高中化学-钠及其化合物的性质最全知识点总结1、知识点1:钠原子结构从钠的原子核外电子排布看,其最外电子层上只有一个电子,因此,极易将这一电子失去,而达到稳定结构,形成+1价的钠阳离子(Na+)。
即金属钠的原子结构决定了其性质的活泼。
因其易失电子被氧化,故金属钠是还原剂。
2、知识点2:钠的物理性质钠是银白色金属,质软(可用刀切割),密度小(0.97g/cm3),熔点低,是电和热的良导体。
3、知识点3:钠的化学性质由于钠原子最外层只有一个电子,在化学反应中容易失去最外层的一个电子变为钠离子:Na-e-→Na+所以钠的化学性质极活泼,具有强还原性,是强还原剂,具有金属的典型性质。
(1)与非金属反应A、与氧气的反应常温下能与空气中的氧气化合,表面变暗。
4Na+O2=2Na2O 在空气或氧气中燃烧,发出黄色火焰,生成淡黄色固体。
2Na+O2Na2O2B、与硫反应2Na+S=Na2S(研磨易爆炸)C、与氯气反应2Na+Cl22NaCl(发出黄色火焰,产生白烟)(2)与水反应钠与水反应的实验现象及现象解释如下:注:钠与水反应在钠的周围有白雾生成,此白雾是氢气燃烧产生的水蒸气。
钠与水反应的化学方程式为: 2Na+2H2O=2NaOH+H2↑该反应的实质是钠原子与水电离出的H+发生氧化还原反应,其离子方程式为: 2Na+2H2O=2Na++2OH-+H2↑注:钠与水反应的现象可概括为“浮、熔、游、响、红”,并结合钠的性质进行记忆。
(3)与酸反应钠与酸反应比与水反应更加激烈,极易爆炸。
钠与盐酸反应 2Na+2HCl=2NaCl+H2↑钠与稀硫酸反应 2Na+H2SO4 =Na2SO4 +H2↑钠与酸溶液反应的实质是:钠与酸电离出来的H+直接反应,而不是钠先与水反应,生成的氢氧化钠再和酸溶液反应。
因为钠与水反应时,得电子的是水电离的H+,而酸中H+浓度大于水中H+的浓度。
(4)与盐的反应与熔融盐的反应4Na+TiCl4(熔融)==Ti+4NaCl与盐溶液反应将钠加到盐溶液中,首先是钠与水反应,若生成的氢氧化钠与盐能发生复分解反应,生成难溶物或弱电解质等,则氢氧化钠和盐再反应;否则钠只与水反应。
高考化学一轮复习:钠及其化合物的性质知识点总结
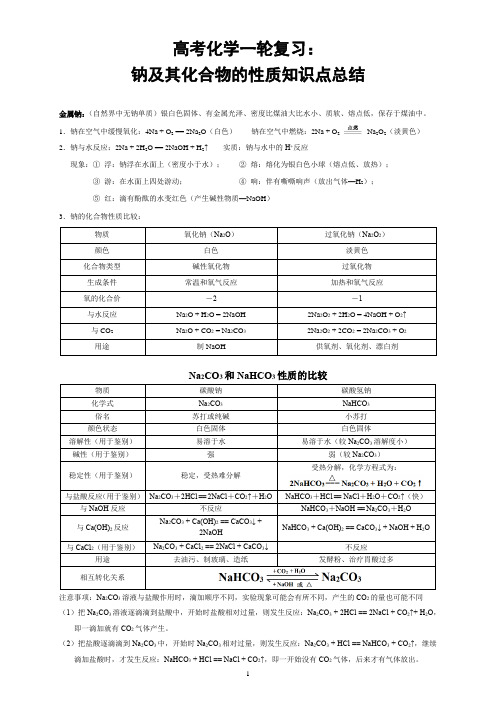
高考化学一轮复习:
钠及其化合物的性质知识点总结
1.钠在空气中缓慢氧化:4Na + O2 == 2Na2O(白色)钠在空气中燃烧:2Na + O2Na2O2(淡黄色)
Na2CO3和NaHCO3性质的比较
受热分解,化学方程式为:
NaHCO+HCl == NaCl+H O+CO↑(快)
去油污、制玻璃、造纸发酵粉、治疗胃酸过多
注意事项:Na2CO3溶液与盐酸作用时,滴加顺序不同,实验现象可能会有所不同,产生的CO2的量也可能不同(1)把Na2CO3溶液逐滴滴到盐酸中,开始时盐酸相对过量,则发生反应:Na2CO3 + 2HCl == 2NaCl + CO2↑+ H2O,即一滴加就有CO2气体产生。
(2)把盐酸逐滴滴到Na2CO3中,开始时Na2CO3相对过量,则发生反应:Na2CO3 + HCl == NaHCO3 + CO2↑,继续滴加盐酸时,才发生反应:NaHCO3 + HCl == NaCl + CO2↑,即一开始没有CO2气体,后来才有气体放出。
1。
高考化学一轮复习辅导:钠及其化合物的重要性质

高考化学一轮复习辅导:钠及其化合物的重要性质由查字典化学网编辑教员精心提供,2021年高考化学一轮温习辅导:钠及其化合物的重要性质,因此考生及家长请仔细阅读,关注孩子的学习生长。
钠及其化合物的重要性质(一)钠的反响1.钠跟氧气常温下普通以为生成氧化钠,加热(或扑灭)生成过氧化钠.(钠的保管)2.钠跟硫研磨能猛烈反响,甚至爆炸3.钠跟水反响(现象?)4.钠跟硫酸铜溶液反响(现象?)5.钠跟乙醇反响(与跟水的反响比拟?)(无机物中的醇羟基、酚羟基、羧基都跟钠反响生成氢气,但猛烈水平不同。
)(二)氧化钠和过氧化钠1.都是固态物,颜色不同。
氧化钠是白色,过氧化钠是淡黄色;2.氧化钠是典型的碱性氧化物,跟酸、酸性氧化物、水反响都契合碱性氧化物的通性;3.过氧化钠不属于碱性氧化物。
(电子式?阴阳离子个数比?) 过氧化钠与水反响:过氧化钠与二氧化碳反响(用作供氧剂):※作呼吸面具上述两个反响均存在过氧化钠有漂白作用(强氧化性)(三)氢氧化钠的性质1.白色固体,易潮解,溶束缚热,强腐蚀性(运用中留意平安、称量时应留意?)2.强碱,具有碱的通性:跟酸中和;跟酸性氧化物反响;跟某些盐反响生成沉淀;跟铵盐反响生成氨气(实验中制取氨气用消石灰)3.氢氧化钠跟两性氧化物(Al2O3)反响;跟两性氢氧化物[Al(OH)3]反响4.氢氧化钠与金属铝反响生成氢气和偏铝酸钠.5.腐蚀玻璃、陶瓷等硅酸盐制品,特别是熔融态的氢氧化钠强腐蚀性。
(保管中留意防止在有玻璃塞、玻璃活塞的容器中时间过长;熔化氢氧化钠的容器选择等)2021年高考化学一轮温习辅导:钠及其化合物的重要性质是由编辑教员整理的高考温习相关信息,希望对您有所协助,更多信息查找请关注查字典化学网高考频道!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019高考化学一轮复习知识点:钠及其化合
物的重要性质
019高考化学一轮复习知识点:钠及其化合物的重要性质
高考化学需要考生掌握的知识点较多,因此大家在一轮复习的时候要多下功夫,下面为大家带来2019高考化学一轮复习知识点【钠及其化合物的重要性质】,希望对大家掌握好高考化学知识点有帮助。
钠的反应
钠跟氧气常温下一般认为生成氧化钠,加热生成过氧化钠.
钠跟硫研磨能剧烈反应,甚至爆炸
钠跟水反应
钠跟硫酸铜溶液反应
钠跟乙醇反应
氧化钠和过氧化钠
都是固态物,颜色不同。
氧化钠是白色,过氧化钠是淡黄色;
氧化钠是典型的碱性氧化物,跟酸、酸性氧化物、水反应都符合碱性氧化物的通性;
过氧化钠不属于碱性氧化物。
过氧化钠与水反应:过氧化钠与二氧化碳反应:※作呼吸面具上述两个反应均存在过氧化钠有漂白作用
氢氧化钠的性质
白色固体,易潮解,溶解放热,强腐蚀性
强碱,具有碱的通性:跟酸中和;跟酸性氧化物反应;跟某些盐反应生成沉淀;跟铵盐反应生成氨气
氢氧化钠跟两性氧化物反应;跟两性氢氧化物[Al3]反应
氢氧化钠与金属铝反应生成氢气和偏铝酸钠.
腐蚀玻璃、陶瓷等硅酸盐制品,特别是熔融态的氢氧化钠强腐蚀性。
氢氧化钠跟氯气等非金属单质反应;实验室制得的溴苯有红褐色,可用氢氧化钠除去。
氢氧化钠跟苯酚反应
酯的碱性水解;油脂的皂化反应
根据生成沉淀的现象作判断几例:
①、加氢氧化钠生成白色沉淀,继续加氢氧化钠沉淀不消失—可能是镁盐
②、加氢氧化钠生成白色沉淀,继续加,白色沉淀逐渐消失—常见为铝盐
③、加氢氧化钠生成白色沉淀,沉淀迅速变灰绿色,最后变成红褐色—亚铁盐
④、加盐酸生成白色沉淀,继续加,沉淀逐渐消失—偏铝酸钠
⑤、加盐酸,生成白色沉淀,继续加,沉淀不消失—可能是硝酸银或硅酸钠或苯酚钠
⑥、加氨水生成白色沉淀氢氧化银继续加,沉淀消失—硝酸银
⑦、加氢氧化钠生成红褐色沉淀—铁盐;生成蓝色沉淀—铜盐
⑧、石灰水中通入气体,能生成沉淀,继续通时沉淀逐渐消失,气体可能是二氧化碳或二氧化硫。
⑨、通二氧化碳能生成白色沉淀,继续通,沉淀能逐渐消失的溶液:石灰水,漂白粉溶液,氢氧化钡溶液;继续通二氧化碳时沉淀不消失的有硅酸钠溶液,苯酚钠溶液,饱和碳酸钠溶液。
既跟酸反应又跟碱反应的物质小结
金属铝
两性氧化物
两性氢氧化物
弱酸的酸式盐
弱酸弱碱盐2S;NH4Hco3等)
氨基酸、蛋白质
以上就是为大家带来的2019高考化学一轮复习知识点
【钠及其化合物的重要性质】,希望我们能够好好掌握这些高考化学知识点,从而在考试中取的好的化学成绩。
