第三章 电解质溶液 - 上海交通大学医学院精品课程
合集下载
基础化学:第三章 电解质溶液

第一节 强电解质溶液
É lectrolyte 电解质
—substance qui conduit le courant électrique en solution aqueuse ou à l’état de fusion.
Le rôle de solution électrolytique : maintenir la concentration osmotique des liquides du corps humain, valeur de pH et les autres fonctions physiologiques et biochimiques
为了表达溶液中离子氛或离子对的影响,引入活度 活度(activité)a :concentration effective des ions 离子有效浓度
aΒ=γB ·cB / cθ
量纲:一
γB :活度因子 coefficient d’activité Cθ:标准摩尔浓度, 1 mol·L-1
∵aB< cB,∴γ B <1
les électrolyte fort se dissocient complètement dans l’eau. la force électrostatique inter ionique forme l’atmosphère
ionique离子氛, empêche le mouvement libre des ions.
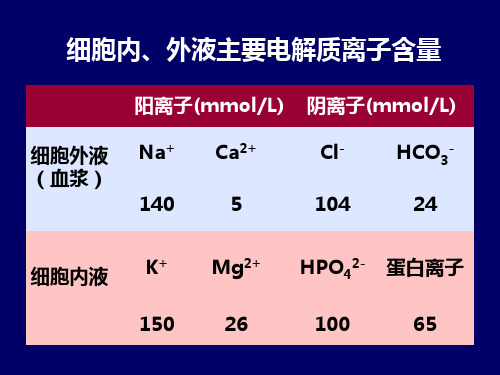
体液(血浆、胃液、泪水、尿液)含有许多 电解质离子,如Na+、K+、Ca2+、Mg2+、Cl-、 HCO3-、CO32-、HPO42-、H2PO4-、SO42- 等, 它们维持着体液渗透浓度、pH值.
一、Électrolyte 电解质 et degréde dissociation 解离度
基础化学课件:第三章电解质溶液

二、Debye-Huckcl 离子互吸理论 ⒈ 强电解质在水中完全解离 ⒉ 阴、阳“离子氛”互相牵制,离子运动不完全自由。
+
+-
-
-
-
+++ -
++
-
++
+
+-
-+
- +-
+
+
“离子氛”( ion atmosphere )
三、离子的活度和活度因子
⒈ 活度(activity) a
离子的有效浓度
aB =B(bB / b)
NH3·H2O
NH4+ + OH-
平衡移动方向 变化 pH变化
+ NH4Cl
←
降低 降低
+ NaOH
←
降低 升高
+ HCl
→
增大 下降
+ NaCl
→
稍增 稍增
+ H2O
→
增大 下降
第四节 酸碱溶液pH 的计算
一、强酸或强碱溶液
HNO3、HCl、H2SO4;NaOH、Ca(OH)2等
HNO3 + H2O
Kb,2
Kb,3
三、酸碱平衡的移动
1. 浓度对酸碱平衡的影响
HAc + H2O
H3O+ +
Ac
设HAc的起始浓度为c mol·L-1,解离度为
HAc
+
H
+
Ac
起始浓度/mol·L-1 c
00
平衡浓度/mol·L-1 c-c
c c
Ka
医用化学 电解质溶液课件

进行治疗。
感谢观看
THANKS
电导的应用
在医学、生物、环保等领域,电导可 以用于检测水质、生物体液的离子浓 度等。
电导滴定法
电导滴定法原理
利用电导变化与滴定剂加入量的关系来确定 滴定终点的方法。
电导滴定法的应用
在化学分析中,电导滴定法可用于测定物质 的含量,如酸碱滴定、氧化还原滴定等。
06
电解质溶液与生命活动
人体内的电解质平衡
医用化学 电解质溶液 课件
• 电解质溶液基本概念 • 电解质溶液的渗透压 • 酸碱平衡 • 沉淀溶解平衡 • 电解质的导电性 • 电解质溶液与生命活动
目录
01
电解质溶液基本概念
电解质
总结词
电解质是指在溶液中或熔融状态下能够导电的化合物。
详细描述
电解质是化合物的一种,其在水溶液中或熔融状态下能够电离出自由移动的离 子,从而具有导电性。电解质在水中的电离程度决定了其导电能力的强弱。
详细描述
酸碱质子理论认为,任何能释放质子(H+)的物质是酸,任 何能接受质子的物质是碱。酸和碱之间的反应是质子的转移 ,反应的实质是质子的转移。
水的离子自解离平衡
总结词
水是一种极弱的电解质,它会发生自 解离,产生氢离子和氢氧根离子。
详细描述
水是一种极弱的电解质,它可以在水 溶液中发生自解离,产生氢离子和氢 氧根离子。在常温常压下,水的自解 离平衡常数约为10^-7。
透压平衡具有重要作用。
电解质平衡紊乱与疾病
要点一
电解质平衡紊乱的原因
饮食不均衡、消化系统疾病、肾脏疾病、内分泌疾病等都 可能导致电解质平衡紊乱。
要点二
电解质平衡紊乱的症状
低钠血症、高钠血症、低钾血症、高钾血症等都是常见的 电解质平衡紊乱症状。这些症状可能表现为恶心、呕吐、 乏力、心律失常等,严重时可能导致昏迷甚至死亡。
感谢观看
THANKS
电导的应用
在医学、生物、环保等领域,电导可 以用于检测水质、生物体液的离子浓 度等。
电导滴定法
电导滴定法原理
利用电导变化与滴定剂加入量的关系来确定 滴定终点的方法。
电导滴定法的应用
在化学分析中,电导滴定法可用于测定物质 的含量,如酸碱滴定、氧化还原滴定等。
06
电解质溶液与生命活动
人体内的电解质平衡
医用化学 电解质溶液 课件
• 电解质溶液基本概念 • 电解质溶液的渗透压 • 酸碱平衡 • 沉淀溶解平衡 • 电解质的导电性 • 电解质溶液与生命活动
目录
01
电解质溶液基本概念
电解质
总结词
电解质是指在溶液中或熔融状态下能够导电的化合物。
详细描述
电解质是化合物的一种,其在水溶液中或熔融状态下能够电离出自由移动的离 子,从而具有导电性。电解质在水中的电离程度决定了其导电能力的强弱。
详细描述
酸碱质子理论认为,任何能释放质子(H+)的物质是酸,任 何能接受质子的物质是碱。酸和碱之间的反应是质子的转移 ,反应的实质是质子的转移。
水的离子自解离平衡
总结词
水是一种极弱的电解质,它会发生自 解离,产生氢离子和氢氧根离子。
详细描述
水是一种极弱的电解质,它可以在水 溶液中发生自解离,产生氢离子和氢 氧根离子。在常温常压下,水的自解 离平衡常数约为10^-7。
透压平衡具有重要作用。
电解质平衡紊乱与疾病
要点一
电解质平衡紊乱的原因
饮食不均衡、消化系统疾病、肾脏疾病、内分泌疾病等都 可能导致电解质平衡紊乱。
要点二
电解质平衡紊乱的症状
低钠血症、高钠血症、低钾血症、高钾血症等都是常见的 电解质平衡紊乱症状。这些症状可能表现为恶心、呕吐、 乏力、心律失常等,严重时可能导致昏迷甚至死亡。
第三章电解质溶液演示文稿

第34页,共63页。
(二)酸碱质子传递平衡及其平衡常数
HB 平衡时
+ H2O
H3O+
Ki
[H3O ][B ] [HB][H 2O]
Ka
[H ] [B ] [HB ]
+ B-
Ka :弱酸的质子传递平衡常数 酸的解离常数,简称酸常数
Ka越大,酸给出质子的能力越强,酸越强
第35页,共63页。
B - + H2O
第三章电解质溶液演示文稿
第1页,共63页。
优选第三章电解质溶液
第2页,共63页。
第一节 强电解质溶液理论 一、电解质和非电解质
电解质:在水溶液中或在熔融状态下能导电的化 合物
根据解离程度大小,可将电解质分为: 强电解质 完全解离 强酸、强碱、大多数盐 弱电解质 部分解离 弱酸、弱碱、部分盐
第3页,共63页。
1
0
0
%
已解离的电解质浓度 α 电 解 质 的 原 始 浓 度 100%
解离度可通过测定电解质溶液的电导或依数 性来测定
第5页,共63页。
影响解离度大小的因素
➢ 本性:电解质的结构 ➢ 外因:溶剂性质、溶液温度、溶液浓度
第6页,共63页。
一些电解质溶液的凝固点降低值
bB mol∙kg-1
0.100
γi
A
z
2 i
I
适用条件:溶液非常稀,I小于0.01 mol·Kg-1
浓度较大时,可修正为:
lg γ i
A
z
2 i
1 I
I
无限稀溶液,I→0,lgγ→0,则γ→1,a=c
第16页,共63页。
酸碱理论的发展
➢ 1789年,提出氧元素是酸的必要成分,所有酸必须含有
(二)酸碱质子传递平衡及其平衡常数
HB 平衡时
+ H2O
H3O+
Ki
[H3O ][B ] [HB][H 2O]
Ka
[H ] [B ] [HB ]
+ B-
Ka :弱酸的质子传递平衡常数 酸的解离常数,简称酸常数
Ka越大,酸给出质子的能力越强,酸越强
第35页,共63页。
B - + H2O
第三章电解质溶液演示文稿
第1页,共63页。
优选第三章电解质溶液
第2页,共63页。
第一节 强电解质溶液理论 一、电解质和非电解质
电解质:在水溶液中或在熔融状态下能导电的化 合物
根据解离程度大小,可将电解质分为: 强电解质 完全解离 强酸、强碱、大多数盐 弱电解质 部分解离 弱酸、弱碱、部分盐
第3页,共63页。
1
0
0
%
已解离的电解质浓度 α 电 解 质 的 原 始 浓 度 100%
解离度可通过测定电解质溶液的电导或依数 性来测定
第5页,共63页。
影响解离度大小的因素
➢ 本性:电解质的结构 ➢ 外因:溶剂性质、溶液温度、溶液浓度
第6页,共63页。
一些电解质溶液的凝固点降低值
bB mol∙kg-1
0.100
γi
A
z
2 i
I
适用条件:溶液非常稀,I小于0.01 mol·Kg-1
浓度较大时,可修正为:
lg γ i
A
z
2 i
1 I
I
无限稀溶液,I→0,lgγ→0,则γ→1,a=c
第16页,共63页。
酸碱理论的发展
➢ 1789年,提出氧元素是酸的必要成分,所有酸必须含有
上海交通大学医学院精品课程

大叶性肺炎
lobar pneumonia
病原:肺炎链球菌等 病理:渗出性病变累及整个肺叶或肺段 主要临床表现:
好发于青壮年,儿童不少见 高热、咳嗽、咳铁锈色痰
X线表现出现晚于临床症状,消散也晚于 临床
学习改变命运,知 识创造未来
上海交通大学医学院精品课程
右肺中叶大叶肺炎
PA位:右侧中下野见大片状阴影,上緣以水平裂为界,下緣模糊,右心緣消失 学识习创改造变未命来运侧,知位片:病变位于横裂与斜裂间,呈均匀一上致海性交通阴大影学医学院精品课程
学习改变命运,知 识创造未来
上海交通大学医学院精品课程
Complication
脓胸、脓气胸、肺脓肿 肺不张、肺大泡 其他:败血症、化脓性心包炎
学习改变命运,知 识创造未来
上海交通大学医学院精品课程
实验室检查
Laboratory Exmination
外周学检查 血常规
C反应蛋白 四唑氮蓝试验
上海交通大学医学院精品课程
Summary
上呼吸道感染是小儿时期最常见的疾病,以
病毒感染为主。临床表现轻重不一,与年龄有
关。婴幼儿局部症状轻,而全身症状重;年长
儿则全身症状轻,以局部症状为主;三个月以
内的小婴儿鼻塞严重。治疗以对症为主,对年
幼、体弱和可疑合并细菌感染的患儿应适当给
予抗生素治疗。
学习改变命运,知 识创造未来
上海交通大学医学院精品课程
Category
按病因分类:病毒性肺炎、细菌性肺炎、支原
体肺炎等。
按病理分类:支气管肺炎、大叶性肺炎、间质
性肺炎
按病程分类:急性肺炎(<1月)、迁延性肺炎
(1~3月)、慢性肺炎(>3月)。
电解质溶液课件

REPORTING
电导的定义与测量
总结词
电导是衡量电解质溶液导电能力的物理量,其测量方法包括 电导率仪直接测量和电导池法。
详细描述
电导是电解质溶液导电能力的量度,定义为单位时间内通过 电导池的两个电极之间的电流与电位差的比值。电导率则是 指电解质溶液的电导值与其截面积和长度之比。
电导率与电导的关联
详细描述
在工业上,电导可用于监测和控制电解、电镀等工业过程,保证产品质量和节约能源。在环保领域, 电导可用于水质监测,评估水体的污染程度。在医疗领域,电导可用于研究生物体的生理和病理状态 ,如监测病人电解质平衡和肾功能等。
PART 05
电极过程动力学
REPORTING
电极过程动力学基础
定义
电极过程动力学是研究电极反应 速度以及影响电极反应速度因素
电解质溶液的性质
总结词
电解质溶液的性质主要包括导电性、离子反应和渗透压等。
详细描述
导电性是电解质溶液最基本的性质,其导电能力与电解质的种类、浓度和温度等因素有关。离子反应是电解质溶 液中的离子之间相互作用的过程,涉及到离子之间的结合、交换和分离等。渗透压是指电解质溶液对于半透膜的 压强,与电解质的种类和浓度有关,对于维持细胞内外平衡具有重要意义。
解离平衡常数(Ka或Kb)是描述解离平衡的重要参数,其值越大,解离程度越大。
解离常数
解离常数是平衡常数的一种,表 示电解质在水中解离成离子的平
衡状态。
解离常数的大小取决于电解质的 性质和温度,是判断电解质强弱
的重要依据。
解离常数的应用广泛,可以用于 计算电解质的浓度、比较不同浓
度电解质溶液的解离程度等。
温度对电极反应速率的影响比较复杂。一 般来说,温度越高,电极反应速率越快, 但也有例外情况。
电导的定义与测量
总结词
电导是衡量电解质溶液导电能力的物理量,其测量方法包括 电导率仪直接测量和电导池法。
详细描述
电导是电解质溶液导电能力的量度,定义为单位时间内通过 电导池的两个电极之间的电流与电位差的比值。电导率则是 指电解质溶液的电导值与其截面积和长度之比。
电导率与电导的关联
详细描述
在工业上,电导可用于监测和控制电解、电镀等工业过程,保证产品质量和节约能源。在环保领域, 电导可用于水质监测,评估水体的污染程度。在医疗领域,电导可用于研究生物体的生理和病理状态 ,如监测病人电解质平衡和肾功能等。
PART 05
电极过程动力学
REPORTING
电极过程动力学基础
定义
电极过程动力学是研究电极反应 速度以及影响电极反应速度因素
电解质溶液的性质
总结词
电解质溶液的性质主要包括导电性、离子反应和渗透压等。
详细描述
导电性是电解质溶液最基本的性质,其导电能力与电解质的种类、浓度和温度等因素有关。离子反应是电解质溶 液中的离子之间相互作用的过程,涉及到离子之间的结合、交换和分离等。渗透压是指电解质溶液对于半透膜的 压强,与电解质的种类和浓度有关,对于维持细胞内外平衡具有重要意义。
解离平衡常数(Ka或Kb)是描述解离平衡的重要参数,其值越大,解离程度越大。
解离常数
解离常数是平衡常数的一种,表 示电解质在水中解离成离子的平
衡状态。
解离常数的大小取决于电解质的 性质和温度,是判断电解质强弱
的重要依据。
解离常数的应用广泛,可以用于 计算电解质的浓度、比较不同浓
度电解质溶液的解离程度等。
温度对电极反应速率的影响比较复杂。一 般来说,温度越高,电极反应速率越快, 但也有例外情况。
922898-医用化学-第三章 电解质溶液

对于纯的弱酸、弱碱,如起始浓度为c,则有解离
度
Ka
c0
称稀释定律,表明 c
该式的使用必须十分小心,它只适用于纯的弱
电解质,有同离子效应(如HAc+NaAc)发生时不
适用。
Ka
c2 (1 ) c (1)
c
,
Ka c
3.二元弱酸、弱碱溶液
二元弱酸、弱碱在水溶液中是分级离解的。若 一级离解常数与二级离解常数之比大于或等于 102,说明二级离解困难,在实际计算[H+] 时, 通常忽略二级离解,从而把二元弱酸、弱碱当 作一元弱酸、弱碱近似处理。
一、强电解质和弱电解质 1、定义
强电解质: (例如NaCl) 在水溶液中能完全解离成离子的化合物。
弱电解质: (例如HAC) 在水溶液中只能部分解离成离子的化合物。
2、解离度的计算
解离度的定义:电解质达到解离平衡时,
已解离的浓度和初始浓度之比。
•
表示:
已解离浓度 初始浓度
100%
➢对于不同的电解质,由于其本性不同,解 离度有很大差别。通常按解离度大小,把 质量摩尔浓度为0.1 mol/Kg的电解质溶液 中解离度(表观解离度)大于30%的称为 强电解质,小于5%的称为弱电解质,介 于二者之间的称为中强电解质。
➢酸(HA)与碱(B- )会发生质子传递反
应,反应达平衡后反应物和产物的浓度都
不变。
HCl
NH 3
NH
4
Cl
➢达到平衡时,产物浓度(以计量系数为幂)的乘 积与反应物浓度的乘积之比为一常数,称 为质子传递平衡常数。
K
[
NH
4
][Cl
]
[ HCl ][ NH3 ]
基础化学(第3版)课件:第三章 电解质溶液

则
Kw = [H+] ·[OH-] = 1.00×10-14
2021年6月24日星期四
第二章 电解质溶液
30
(二)酸碱质子传递平衡及其平衡常数
一元弱酸或弱碱与水分子的质子传递反应是可逆的,
当进行到一定程度时就建立平衡。用HB表示一元弱酸,
B-表示其共轭碱,则
HB + H2O
B- + H3O+
Ki
[H3O ][B ] [HB][H2O ]
2021年6月24日星期四
第二章 电解质溶液
8
活度(activity):离子的有效浓度或表观浓度 离子的有效浓度是指电解质溶液中实际上可起作用 的离子浓度。 活度通常用a表示,它的单位为1(one)。液态、固态 纯物质及稀水溶液中的水,活度视为1。 活度aB与溶液浓度cB的关系为
aB γB cB c γB称为溶质B的活度因子(activity factor);c 为标准态
2021年6月24日星期四
第二章 电解质溶液
20
两性物质(amphoteric substance): 既可作为酸给出 质子,又可作为碱接受质子的物质,如HCO3-、H2O。
共轭酸碱对: 把组成上仅相差一个质子的一对酸碱 称为共轭酸碱对。如:
H2CO3 和 HCO3HCO3- 和 CO32-
NH4+ 和 NH3 H3O+ 和 H2O H2O 和 OH-
H+
H2O + H2O 酸1 碱 2
H3O+ + OH酸2 碱1
2021年6月24日星期四
第二章 电解质溶液
29
平衡时
Kw = [H+][OH-] Kw称为水的质子自递平衡常数,又称为水的离子积 (ion product of water),其数值与温度有关,当温度为
基础化学第三章(电解质溶液)5演稿课件(1)
=1.33×10-3mol·L-1 = 1.33%
0.1mol·L-1 HAc+ 0.1mol·L-1 NaAc
离子氛作用:离子自由运动能力下降,离子 的有效浓度减低。
判断:由于离子氛的影响, 0.1mol·L-1
NaCl解离了87%
(-)
三、离子的活度和离子强度
1.离子活度 离子的有效浓度(a)
γ -----活度因子 a = γ·c
a-----离子活度(有效浓度)
c-----离子真实浓度(理论浓度)
活度因子γ反映了溶液中离子之间作用力的大 小;活度因子越小,作用力越大;
[Ac -] = [H+ ] + c (NaAc) = c (NaAc)
[HAc] = c (HAc ) - [H+ ] = c (HAc )
[H+][Ac-] [H+] c(NaAc) Ka = [HAc] = c(HAc )
c(HAc ) [H+ ] = Ka c(NaAc)
c(NaAc ) pH =pKa + lg c(HAc)
NaAc
(碱)
Ac-:离子碱 Na+:中性
NH4Ac (两性物质) NH4+:离子酸 Ac-:离子碱
NaCl
(中性物质 )
Na+、Cl-:中性物质
共轭关系: 酸 ⇌ 质子 + 碱 HB ⇌ H+ + B-
1.有酸必有碱,有碱必有酸 2.共轭酸碱对只能相差一个质子 3. 酸强碱必弱,碱强酸必弱;
酸的强度用Ka 表示,碱的强度用Kb 表示, 且 Ka ·Kb = Kw = 10-14 H2CO3的共轭碱是HCO3-,不是CO32例如:HCl > HAc Cl- < Ac-
0.1mol·L-1 HAc+ 0.1mol·L-1 NaAc
离子氛作用:离子自由运动能力下降,离子 的有效浓度减低。
判断:由于离子氛的影响, 0.1mol·L-1
NaCl解离了87%
(-)
三、离子的活度和离子强度
1.离子活度 离子的有效浓度(a)
γ -----活度因子 a = γ·c
a-----离子活度(有效浓度)
c-----离子真实浓度(理论浓度)
活度因子γ反映了溶液中离子之间作用力的大 小;活度因子越小,作用力越大;
[Ac -] = [H+ ] + c (NaAc) = c (NaAc)
[HAc] = c (HAc ) - [H+ ] = c (HAc )
[H+][Ac-] [H+] c(NaAc) Ka = [HAc] = c(HAc )
c(HAc ) [H+ ] = Ka c(NaAc)
c(NaAc ) pH =pKa + lg c(HAc)
NaAc
(碱)
Ac-:离子碱 Na+:中性
NH4Ac (两性物质) NH4+:离子酸 Ac-:离子碱
NaCl
(中性物质 )
Na+、Cl-:中性物质
共轭关系: 酸 ⇌ 质子 + 碱 HB ⇌ H+ + B-
1.有酸必有碱,有碱必有酸 2.共轭酸碱对只能相差一个质子 3. 酸强碱必弱,碱强酸必弱;
酸的强度用Ka 表示,碱的强度用Kb 表示, 且 Ka ·Kb = Kw = 10-14 H2CO3的共轭碱是HCO3-,不是CO32例如:HCl > HAc Cl- < Ac-
电解质溶液---精品医学课件

2.下列各组物质不属于共轭酸碱对的是(D )
A. HCO3--CO32- B. NH4+-NH3•H2O
- PO43-
二、酸碱反应的实质
酸碱反应的实质是两对共轭酸碱对之间的质 子传递: H+
A1 B2
B1 A2
两个半反应同时发生,可以在非水溶剂或气相 中进行。
通常说某种电解质的电离度都是指一 定温度和一定浓度时的电离度。
2.电离平衡和电离平衡常数:
(1)电离平衡:在一定温度下,当弱电解质 分子电离成离子的速度与离子又结合成分子的 速度相等状态。
HAc
H+ + Ac-
(2)电离常数:在一定温度下,弱电解质在 水溶液中达到电离平衡时,电离所生成的各种 离子浓度的乘积与溶液中未电离的分子的浓度 之比是一个常数,称为电离平衡常数,简称电 离常数(Ki)。弱酸的电离常数用Ka表示,弱碱 的电离常数用Kb表示。
质子酸、碱的关系可表示为:
酸 例:+ 碱 HCl
HAc
H2CO3 HCO3- NH4+
H3O+ H2O
H+
H+ + Cl- H+ + Ac- H+ + HCO3- H+ + CO32- H+ + NH3 H+ + H2O H+ + OH-
课堂练习
1.下列物质在水溶液中具有两性的是( B )
A. NaOH B. H2PO4- C.HCl D. HAc
弱电解质的电离程度可以用电离度来表示:
已电离的电解质分子数
a
100 %
电解质分子总数
例如 在298.15K时,0.1mol·L-1的HAc溶液 里,每1000个乙酸分子里大约有13个分子电离成 H+和Ac-离子,故其电离度大约是1.3%。
A. HCO3--CO32- B. NH4+-NH3•H2O
- PO43-
二、酸碱反应的实质
酸碱反应的实质是两对共轭酸碱对之间的质 子传递: H+
A1 B2
B1 A2
两个半反应同时发生,可以在非水溶剂或气相 中进行。
通常说某种电解质的电离度都是指一 定温度和一定浓度时的电离度。
2.电离平衡和电离平衡常数:
(1)电离平衡:在一定温度下,当弱电解质 分子电离成离子的速度与离子又结合成分子的 速度相等状态。
HAc
H+ + Ac-
(2)电离常数:在一定温度下,弱电解质在 水溶液中达到电离平衡时,电离所生成的各种 离子浓度的乘积与溶液中未电离的分子的浓度 之比是一个常数,称为电离平衡常数,简称电 离常数(Ki)。弱酸的电离常数用Ka表示,弱碱 的电离常数用Kb表示。
质子酸、碱的关系可表示为:
酸 例:+ 碱 HCl
HAc
H2CO3 HCO3- NH4+
H3O+ H2O
H+
H+ + Cl- H+ + Ac- H+ + HCO3- H+ + CO32- H+ + NH3 H+ + H2O H+ + OH-
课堂练习
1.下列物质在水溶液中具有两性的是( B )
A. NaOH B. H2PO4- C.HCl D. HAc
弱电解质的电离程度可以用电离度来表示:
已电离的电解质分子数
a
100 %
电解质分子总数
例如 在298.15K时,0.1mol·L-1的HAc溶液 里,每1000个乙酸分子里大约有13个分子电离成 H+和Ac-离子,故其电离度大约是1.3%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章 电解质溶液
酸碱质子理论认为:凡能给出质子(H +)的物质都是酸(acid),凡能接受质子的物质都是碱(base)。
酸与碱的关系可用下式表示为 酸
质子+ 碱
酸碱质子传递平衡和平衡常数
K ]B ][HA []HB ][[A -−= 在水分子间也可发生质子传递反应,称为水的质子自递反应,K w 称为水的质子自递平衡常数,又称水的离子积。
酸的解离平衡常数K a 与共轭碱的解离平衡常数K b 之间有确定的对应关系:
w b a K K K =⋅
一元弱酸或弱碱溶液
[H +]=c a α, 或 a a ]H [c K =+ 对一元弱碱溶液b b ]OH [c K =− 对多元酸溶液)A H (]A H []H [21a 21a c K K ==+ 两性阴离子溶液2a 1a ]H [K K =+ 或 pH=2
1(p K a1+p K a2) 对由弱酸和弱碱组成的两性物质溶液
'a a ]H [K K =+ 或 pH=21(p K a +p K a ′)。
