有机化学之碳碳重键的加成反应
第九十章碳碳双键的加成反应

CH3CHCH3 Br
δ +δ -
H 3 C C C 2 + H B r H H
H 3 C C +C H 3 + B H r - H 3 C C C 3 H B r
正碳离子稳定性得影响:
H H 3 C C H C H 2 + H X HH++ HH33CC CC+H2 CC+HH32
如顺-2-丁烯与四氧化锇加成生成顺式环状锇酸酯,后者水解生成内 消旋1,2-二醇,总得结果就是羟基化,具有顺式立体选择性。
许多加成反应具有立体选择性,但对于某些加成反应则只有很小 得立体选择性,如Z-1,2-二甲基环已烯得酸性水解反应,生成大约等 量得顺和反1,2二甲基环已醇。如:
烯烃加成得立体选择性就是可变得,她与亲电试剂得性 质、烯烃得结构和反应条件等因素有关。
按鎓型离子历程进行得反应,通常就是反式加 成产物。
二、三分子亲电加成反应
▪ 三分子亲电加成反应速度为υ=κ[烯烃][亲电 试剂]2,为三级反应,以AdE3表示。
▪ 当烯烃与卤化氢得加成,若生成比较不稳定 得正碳离子时,则倾向于按三分子亲电加成 反应历程进行。因另一HX分子得X-与之结 合,可生成稳定得产物。
▪ C=C双键与卤化氢加成得立体选择性主要 依赖于烯烃得结构。
▪ 非共轭环状烯烃如环已烯、1,2-二甲基环戊 烯、1,2-二甲基环已烯和异丁烯与HX得加 成主要就是反式加成。如:
反式加成 反式加成
▪ 当双键碳原子之一与一个能稳定生成得正碳离子 得中间体得基团如苯基共轭时,则立体选择性将发 生变化。
三、溶剂得影响
▪ 溶剂对亲电加成反应得立体化学也有影响。
▪ 如顺-1,2-二苯乙烯与溴在不同溶剂中进行加成时, 内消旋和外消旋产物得比例不同,即顺式和反式加 成产物比例不同。
第十章 碳碳重键的加成反应

CH3CH CH2 > CH2 CH2 > BrCH CH2 > CH2 CHCOOH
CH CH2 > CH2 CH2
从反应的过渡状态或活性中间体来看,无论是鎓离 子还是碳正离子,都是带正电荷的,因此,若正电 荷能得到分散,其反应速率也一定加快。
CH CH2
CH3 2C
H
Ph CH CH3
C CH3 2 > CH3 2C CHCH3 > CH3 2C CH2
C 6H 5 C C CH 3
2、亲电试剂的影响
不同亲电试剂与C=C双键的加成,其立体选择性 也不同。
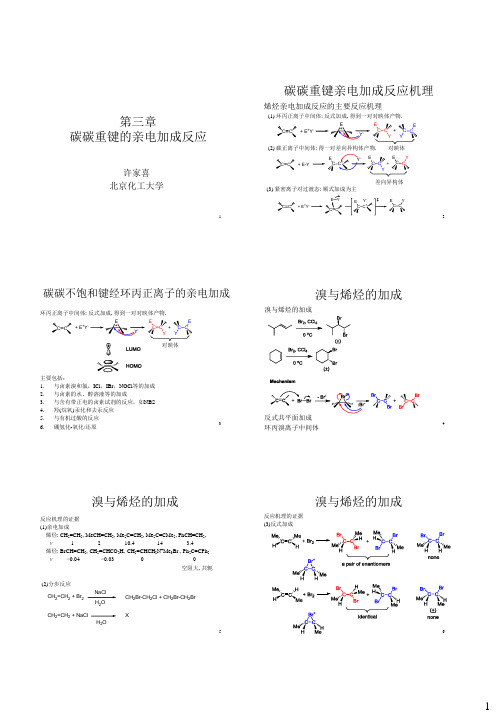
Br + Br 2 H C CH 3 C H Br Br C C C6 H5 88%
反式加成
H C C C6 H 5 H Cl + Cl2 H C 6H 5 C CH3 C H Cl 33% + HBr Br H C 6H 5 C CH3 C H H 12%
相反,当双键碳原子连有吸电子基团时,随其数目 的增多,或吸电子效应增强,反应速率减慢,甚至 会改变反应机理。 一般,若双键碳原子连有三个或四个强吸电子基团 时,反应通常是按亲核加成机理进行的。
> ClH 2C C CH2 H > Cl2HC C CH2 H > Cl3C C CH2 H
H3C C CH2 H
CH 3 Br H R H Br R CH 3
苏式 ( 外消旋体)
溴与环己烯的加成
溴与具有光活性的4-甲基环己烯进行加成
(2)当双键与一个稳定碳正离子中间体的基团共 轭时,顺式加成趋势明显增加。
H C C H 3C C 6H5 H DCl CH3COOD D H H 3C C C Cl H C6 H 5 + D H H 3C C C H C 6H 5 Cl
碳碳重键的加成反应

Ph C C H Ph CCl4 1:9
C
e H M e H M H O A c C C l4 C C l4 > 100:1 很 大 83:17
Me Me C C Ph H C C Ph H
H Me Ph H HOAc CCl4 63:37 >10:1
加溴反应的机理:烯烃与溴首先生成π络合物,π络合物转变为σ 络合物,即环状溴鎓离子和Br–的离子对,最后再结合成邻二溴 化物:
C l
最后一个反应说明碘比 氯更容易生成鎓离子:
S b F ,S O ( l ) 5 2 X C H C H I 2 2 o 7 8 C X = C l ,I来自X H C C H 2 2
I
1985年测定了下列化合物的晶体结构,进一步证实了环状溴鎓离 子的存在:
Br Br3
但上面这些例子中底物都是对称的结构。如果底物结构不对称, 溴鎓离子的结构会怎么样?如果有能稳定碳正离子的取代基存在, 会不会以碳正离子作为反应的中间体而不是溴离子?在下面的反 应中,如果碳正离子是反应的中间体,两个原料应得同样的产物:
相 对 反 应 速 率 1 . 0 ( 过 量 烯 烃 ) 1 . 1 5
C H M e
6 3
C C HM e H H
5 0 5 8
C C H M e M eM e
5.1不饱和碳-碳重键的加成反应

Br
Br
(±) Br H Br 唯一产物 H
(±) Br H H Br
H
H
没有发现
一、烯烃的亲电加成——X2和XOH
2.3 与XOH的加成(X2 + H2O → XOH + HX) ——加XOH机理与X2类似,经过环卤鎓离子 ——加XOH遵守马氏规则:亲电试剂中的带 正电荷部分即X加在含氢较多的碳上。
—— reaction activity: HI > HBr > HCl ——烯烃与水加成反应活性低,一般在酸催化下进行
一、烯烃的亲电加成——HX 和H2O
1.3 Regioselectivity Markovnikov’s rule(马氏规则)
—— when an alkene undergoes electrophilic addition, the less highly substituted position is attached by the electrophile (亲电试剂).
一、烯烃的亲电加成——X2和XOH
2.1 Mechanism of Br2 Addition
——经过环溴鎓离子 (cyclic bromonium ion) ——反式(anti-)加成,无重排产物。
一、烯烃的亲电加成——X2和XOH
Addition of Cl2
氯或碘的加成中也可形成环卤鎓离子,但是 氯的立体选择性不高,而碘的反应活性差。
Br
B r 2 ,H 2 O
OH
一、烯烃的亲电加成——羟汞化-脱汞反应
Mechanism of Oxymercuration-Demercuration (溶剂汞化反应)
(1 )H g ( O A c ) 2
碳碳双键的加成原理

碳碳双键的加成原理碳碳双键的加成原理是有机化学中的一个重要概念,它指的是在碳碳双键上进行化学反应时,发生的两个原子团的直接相互作用。
碳碳双键是有机化合物中常见的结构基团,其反应机理的理解对于有机合成和有机反应的研究具有重要意义。
碳碳双键的加成反应是指在碳碳双键上发生的加成反应,其中一个或多个原子或基团与双键上的两个碳原子形成新的化学键。
这种反应可以在碳碳双键上的任何一个碳原子上进行,形成两个不同的反应产物。
碳碳双键的加成反应可以分为电子亲攻型加成反应和亲电型加成反应两种基本类型。
电子亲攻型加成反应是指一个原子或基团通过共用电子对与双键上的一个碳原子形成新的化学键。
在这类反应中,一般会形成一个新的碳碳单键,同时产生一个带正电荷的中间体。
这类反应通常涉及碳原子上的π电子云的重排,常见的例子包括烯烃的氢化反应、卤代烃的消除反应等。
亲电型加成反应是指一个带正电荷的原子或基团与双键上的一个碳原子形成新的化学键。
在这类反应中,通常会形成一个新的碳碳单键,同时产生一个带负电荷的中间体。
这类反应通常涉及碳原子上的π电子云的离域,常见的例子包括烯烃的酸催化加成反应、烯烃的卤代反应等。
碳碳双键的加成原理是通过共用电子对或电荷分布的重新排列实现的。
在共用电子对的重新排列中,双键上的π电子云会重新组合,形成一个新的σ键。
在电荷分布的重新排列中,双键上的π电子云会向带正电荷或带负电荷的原子或基团转移,形成新的化学键。
碳碳双键的加成反应在有机化学中具有广泛的应用。
它可以用于构建碳骨架,形成新的化学键,实现有机物的合成。
通过选择不同的反应条件和反应物,可以控制加成反应的位置和产物的选择性。
此外,加成反应还可以用于合成复杂有机分子,如天然产物、药物和材料等。
碳碳双键的加成原理是有机化学中重要的基础概念。
通过了解和掌握加成反应的原理和机制,可以为有机合成和有机反应的研究提供理论基础和实验指导,推动有机化学领域的发展和应用。
有机化学反应方程式总结加成反应

有机化学反应方程式总结加成反应加成反应是有机化学中常见的一种反应类型,它是指两个或多个有机物通过共用键形成新的化合物。
加成反应可以分为电子亲和加成反应和亲核加成反应两种类型。
在这篇文章中,我们将对常见的加成反应进行总结,并列举相应的反应方程式。
1. 电子亲和加成反应电子亲和加成反应是指一个互补电子结构的分子结合,其中一个分子是亲(电子负)而另一个是亲(电子正)。
常见的电子亲和加成反应包括羰基化合物的加成反应和亲电子烯烃的加成反应。
1.1 羰基化合物的加成反应羰基化合物的加成反应是指亲核试剂与羰基化合物发生反应,通过形成C-O或C-N键来形成新的化合物。
常见的羰基化合物的加成反应有亲核试剂的加成反应、亚硫酸盐的加成反应、氰化物的加成反应等。
例如,醛和酮的羰基化合物与亲核试剂水合氨反应,生成醇或胺的产物。
反应方程式如下:RCHO + NH3 → RCH2OH1.2 亲电子烯烃的加成反应亲电子烯烃的加成反应是指亲核试剂与烯烃发生反应,通过形成C-C键或C-X键来形成新的化合物。
常见的亲电子烯烃的加成反应有氢氯酸的加成反应、水的加成反应、卤素的加成反应等。
例如,溴和丙烯通过加成反应生成2,3-二溴丁烷的产物。
反应方程式如下:CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH32. 亲核加成反应亲核加成反应是指亲核试剂以捐赠电子对的形式与亲电子试剂发生反应。
亲核试剂通常是负离子或带有孤对电子的中性分子。
常见的亲核加成反应包括亲核试剂与烷基卤化物的加成反应、亲核试剂与酰卤的加成反应等。
例如,氨离子与甲基氯化物发生亲核加成反应生成甲胺的产物。
反应方程式如下:CH3Cl + NH3 → CH3NH2总结:加成反应在有机化学中起着重要的作用,它可以构建分子骨架并生成新的化合物。
本文总结了电子亲和加成反应和亲核加成反应的反应方程式,并对其进行了简要解释。
通过理解和掌握这些反应,可以帮助我们在有机化学领域中更好地设计和预测化学反应。
高等有机化学3
O
R
(CH3CH2CH2)2B + CH3CH2CH3
O O
R
B与手性碳相连时, 重排时构型保持不变.
B(O2CR)3 + CH3CH2CH3 32
烯烃的硼氢化反应
烯烃的硼氢化反应的应用 (1)由烯烃制备醇, 特别是由端基烯烃制备一级醇. (与烯烃直接水合的区域选 择性相反). (2)还原烯烃.
炔烃的硼氢化反应
CH2CH2CH3
O OH (CH3CH2CH2)2B
CH2CH2CH3
(CH3CH2CH2)2B-OCH2CH2CH3
(CH3CH2CH2O)3B
H2O
CH3CH2CH2OH + B(OH)3
(CH3CH2CH2)2B CH2CH2CH3
OH O
R
H3CH2CH2C H3CH2CH2C B
O
CH2CH3 H H H
v
1
2
10.4
14
3.4
烯烃: BrCH=CH2, CH2=CHCO2H, CH2=CHCH2N+Me3Br-, Ph2C=CPh2
v <0.04
<0.03
0
0
空阻大, 共轭
(2)分步反应 CH2=CH2 + Br2
NaCl H2O
CH2Br-CH2Cl + CH2Br-CH2Br
CH2=CH2 + NaCl
O-
Br Br
O
H3C
炔烃的硼氢化-氧化:使用位阻大的含有单氢的硼烷试剂
33
34
炔烃的硼氢化反应
炔烃的硼氢化-还原:使用位阻大的含有单氢的硼烷试剂
35
36
有机化学基础知识点整理有机化合物的碳碳键形成反应

有机化学基础知识点整理有机化合物的碳碳键形成反应有机化学基础知识点整理——有机化合物的碳碳键形成反应有机化学是研究碳元素及其化合物的科学,而碳碳键是有机化合物中常见且重要的键。
本文将整理有机化学中常见的碳碳键形成反应,以帮助读者更好地理解和掌握相关知识。
1. 烷烃类化合物的碳碳键形成反应烷烃是由碳和氢组成的最简单的有机化合物,其碳原子上只有单键。
烷烃类化合物的碳碳键形成反应主要包括以下几种:1.1 卤代烷与金属的取代反应卤代烷与金属(如锂、镁等)反应,生成相应的有机金属化合物。
例如,卤代烷与镁反应,生成有机镁化合物。
这些有机金属化合物可以进一步与其他化合物反应,形成新的碳碳键。
1.2 亲电加成反应亲电加成反应是碳碳键形成的常见机制之一。
在亲电加成反应中,亲电试剂攻击不饱和键(如烯烃、炔烃等),形成新的碳碳键。
例如,烯烃与卤代烷反应,生成新的碳碳键。
1.3 自由基取代反应自由基取代反应是碳碳键形成的另一种常见机制。
在自由基取代反应中,自由基试剂攻击卤代烷的碳原子,形成新的碳碳键。
例如,卤代烷与卤代烷反应,生成新的碳碳键。
2. 烯烃类化合物的碳碳键形成反应烯烃是含有双键的有机化合物,其碳原子上存在一个或多个双键。
烯烃类化合物的碳碳键形成反应主要包括以下几种:2.1 电环化反应电环化反应是碳碳键形成的重要途径之一。
在电环化反应中,烯烃会发生环化反应,形成新的碳碳键。
例如,烯烃与亲电试剂反应,发生环化反应,生成新的碳碳键。
2.2 烯烃与亲电试剂的加成反应烯烃与亲电试剂发生加成反应,形成新的碳碳键。
例如,烯烃与卤代烷反应,亲电试剂攻击双键,生成新的碳碳键。
2.3 氢化反应烯烃与氢气反应,发生氢化反应,双键上的两个碳原子与氢原子形成新的碳碳键。
氢化反应常采用催化剂(如铂、钯等)催化。
3. 芳香化合物的碳碳键形成反应芳香化合物是含有芳香环的有机化合物,其碳原子上存在一定的π电子体系。
芳香化合物的碳碳键形成反应主要包括以下几种:3.1 亲电芳烃取代反应亲电试剂攻击芳香环上的碳原子,置换掉原有的基团,形成新的碳碳键。
有机化学基础知识点加成反应的机理和规律

有机化学基础知识点加成反应的机理和规律有机化学是研究有机物的合成、结构、性质和反应规律的学科。
其中,加成反应是有机化学中最常见和重要的反应类型之一。
本文将介绍有机化学基础知识点加成反应的机理和规律。
一、加成反应的基本概念加成反应是指两个或多个亲电体或亲核体通过共用或转移共用键的方式结合成为一个新的分子。
通常情况下,亲电体是电子亏损的,而亲核体则是电子富集的。
加成反应可以分为亲电加成和亲核加成两种类型。
亲电加成是指亲电体攻击亲核体的反应,通常发生在亲电性较强的反应物之间。
亲电体可以是群基或离子,如卤代烃、酸酐等。
亲核体则是电子丰富的反应物,如双键化合物、亲核试剂等。
亲电加成反应的机理通常通过质子转移或亲电物种中间体来实现。
亲核加成是指亲核体攻击亲电体的反应,通常发生在亲核性较强的反应物之间。
亲核体可以是碱、醇、胺等,而亲电体则是电子不足的反应物,如羰基化合物、卤代烃等。
亲核加成反应的机理通常通过亲核物种中间体来实现。
二、加成反应的机理1. 亲电加成反应机理亲电加成反应的机理通常分为两步:攻击和解离。
在第一步攻击中,亲电体通过接触或近距离攻击亲核体的亲核中心,形成共价键。
这个过程中,亲电体亲核中心上的正电荷被亲核体的电子对所攻击,形成新的中间态。
在第二步解离中,中间态的反应物通过质子转移或亲电物种中间体的相互作用,形成产物。
质子转移可以通过迁移原子或群基来实现。
2. 亲核加成反应机理亲核加成反应的机理通常涉及四个步骤:一个亲核物种的进攻、质子转移、解离和质子移位。
在第一步进攻中,亲核物种通过攻击亲电体的亲电中心,形成新的单线性中间体。
这个过程中,原有单线性中间体的离去反离子被亲核物种攻击,形成一个新的中间态。
在第二步质子转移中,中间态的亲反离子通过质子转移到亲核物种上,产生新的离子。
在第三步解离中,离子经历解离过程,生成产物。
在第四步质子转移中,产物通过质子转移重新排列,形成最终的产物。
三、加成反应的规律1. 酯酰类加成反应规律酯酰类化合物在亲电加成反应中通常发生C=O双键的受攻击。
碳碳重键的加成反应

H N
N CH2 CH COOEt
N CH2CH2COOEt
仲胺
H
碳碳叁键的亲核加成反应
HC CH
C2H5OH KOH CH2 CH
炔烃不易进行亲电加成反应的原因:
CC
E
E CC
OC2H5
正电荷处于 sp2轨道上, 不稳定
CC
E
CC E
正电荷处 于p轨道上, 稳定
PhC CH PhSH KOH PhCH CHSPH
H2O2, OH ,。H2O 25 ~ 30 C
CH3(CH2)3CH2CH2OH
电子因素
R' δ+ δ H
CC
R
H
+
2.1 δ
H
δ+ 2.0
BH2
位阻小(空间因素)
R'
H
R CC H
H
BH2
硼氢化反应的机理
B2H6
CH3CH=CH2 + H-BH2 亲电加成
硼接近空阻小、电荷密 度高的双键碳,并接纳 电子。
CH3
H+
CH3 + H2O
CH3
H CH3
E
CC
Nu
H2O
OH HCCHH33 +
碳碳双键的加成反应 有机化学课件

高等有机化学
加成反应:催化氢化、亲电加成、亲核加成和自由基
加成。 4.1 催化氢化
催化氢化分为非均相催化(多相催化)和均相催化。
非均相催化的催化剂为固体,均相催化的催化剂溶于
介质成液相,整个反应体系为一相。
4.1.1 多相催化氢化
氢和烯烃吸附在催化剂表面,使π键和H-H键断裂,形 成金属氢化物和配合物,氢原子再分别转移到双键碳 原子. 立体化学为顺式加成,反应收率高,速度快。
CH3 δ+ - H δ C C + CH3 CH3
δ- δ+ HO-Cl
HO-
CH3 CH CHCH3 CH3 Cl
OH CH3 C CHCH3 CH3 Cl
CF3
δ- δ+ CH=CH2 +
δ+ δ- AlBr3 CF3 CH2 CH2Br H Br
H C Br
-I
H2C CH
H C H Br + H Br
C
C
+ H2
Pd,BaSO4 喹啉
C=C
OH
OH Pd,BaSO 4 喹啉 30℃
OH OH
4.底物结构
空阻大的底物催化氢化比较困难。
活性
RCOCl (RCHO) > RNO2(R-NH2) > RC
CR'
(RCH=CHR’) > RCHO ( RCHOH ) >RCH=CHR’ (RCH2CH2R’)>RCOR’>RCH (OH) R’>ArCH2OR (ArCH3) >RCN (RCH2NH2)
H H
C C
吸附
H H
有机化学中的加成反应

有机化学中的加成反应有机化学是研究有机物的结构、性质、合成和反应机理的学科,而其中的加成反应是有机化学中常见且重要的一类反应。
本文将介绍加成反应的定义、机理以及一些重要的加成反应类型。
第一部分:加成反应的定义和机理加成反应是指两个或多个物质中的化学键断裂的同时在其间形成新的化学键,生成一个或多个产物的反应。
通常来说,加成反应发生在不饱和有机化合物中,也可以涉及到其他类型的化合物。
加成反应可以通过催化剂的存在或者无催化剂的情况下进行。
加成反应的机理基于键断裂、中间体形成和新键形成。
一般情况下,该反应可以分为两个主要步骤:生成中间体和从中间体形成新的化学键。
第二部分:常见的加成反应类型1. 碳碳双键加成反应碳碳双键加成反应是有机化学中最常见的一类加成反应。
其中,氢化加成反应是最基本的碳碳双键加成反应。
它是指在双键的一个碳原子上加入氢原子,同时在另一个碳原子上形成新的化学键。
此外,还有氟化加成反应、水化加成反应、卤化加成反应等。
2. 碳氧双键加成反应碳氧双键加成反应是另一类常见的加成反应。
醇和醛酮的生成常常通过碳氧双键加成反应进行。
醇的生成通常通过水合反应实现,醛酮的生成则可以通过氢氧化反应或者硫酸氧化反应来完成。
3. 碳氮双键加成反应碳氮双键加成反应也是有机化学中重要的反应类型之一。
其中,脱氧反应是最基本的碳氮双键加成反应。
它是指在双键中的一个碳原子上形成新的化学键,同时在氮原子上形成新的化学键。
此外,还包括亲核加成反应和亲电加成反应等。
第三部分:加成反应的应用加成反应在有机合成和药物化学中具有广泛的应用。
它可以用于合成有机物的特定结构、功能的引入以及确定性的转化等。
通过合理设计加成反应的反应条件和催化剂,可以高效地合成目标有机物,减少副产物的生成,提高反应产率。
此外,加成反应在药物化学中的应用也非常重要。
通过加成反应可以引入药物分子中的不同基团,从而改变其生物活性、药性和代谢性质。
加成反应也可以用于合成药物的中间体,进一步用于合成药物的最终目标。
《有机化学基础》官能团——碳碳双键、碳碳三键

《有机化学基础》官能团——碳碳双键、碳碳三键一、介绍1.碳碳双键(-C=C-)是烯烃的官能团,烯烃的通式符合Cn H2n,其代表物是乙烯。
2.碳碳三键(-C C-)是炔烃的官能团,炔烃的通式符合Cn H2n-2,其代表物是乙炔。
二、性质碳碳双键、碳碳三键的性质类似。
1.加成反应(与H2、HX、X2、H2O等加成,X表示卤素元素)(1)CH2=CH2+H2→一定条件→CH3CH3、CH≡CH+H₂→ CH₂=CH₂(2)CH2=CH2+HX→一定条件→CH3CH2X、CH≡CH+HX→一定条件→CH2=CHX(3)CH2=CH2+X2→CH2XCH2X、CH≡CH+X2→CHX=CHX(4)CH2=CH2+H2O→一定条件→CH3CH2OH2.氧化反应(1)在氧气中燃烧生成二氧化碳CH2=CH2+3O2→点燃→2CO2+2H2O、2CH≡CH+5O2→点燃→4CO2+2H2O(2)能被强氧化剂所氧化如乙烯能被高锰酸钾氧化为二氧化碳。
3.加聚反应(1)单烯烃、单炔烃nCH2=CH2→一定条件→-[-CH2-CH2-]-n、n CH≡CH→一定条件→-[-CH=CH-]-n(2)其他如:nCH2=CH-CH=CH2→一定条件→-[-CH2-CH=CH-CH2 -]-n。
高等有机化学 第四章 亲电加成反应(2010)

implies formation of a complex between one
molecule of the reagent and the reactant and also
is expected to result in anti addition.
11
(2)双分子历程 ① 碳正离子历程
H
+
+
13
CH3 C C H H
DCl CH3COOD
D
+C
D Cl C C CH3 H H
C CH3 H
H
通常不具有立体选择性
CH CH3 3 + CH3 + H2O CH3 H
+
CH3 CH3 顺式 OH HO + H CH3
H
OH
OH CH3 H CH3
反式
CH3 H
14
有时有重排产物出现
鎓离子存在的直接证据?
Biadamantylidene bronomium
19
(3)三分子历程(AdE3)
某些非共轭烯烃与HX加成按AdE3历程进行。
立体化学通常为反式加成
20
complex
21
HBr + H3C C C H H H CH3 H3C C C CH3 H
22
2. 烯烃亲电加成反应的立体化学
5
(2) Formation of carbocation ion pair from
alkene and electrophile.
6
Mechanism(2)also involves a carbocation intermediate, but it is generated in the presence of an anion and exists initially as an ion pair. Depending on the mutual reactivity of the two ions, they might or might not become free of one another before combining to give product.
高等有机化学5[1]2 碳-碳重键的加成反应
![高等有机化学5[1]2 碳-碳重键的加成反应](https://img.taocdn.com/s3/m/36e547025f0e7cd18525360c.png)
BH3
R H
R H
C C
C C
R'
R' OH
3B
H2O2 , HO-
O RCH2CR’ =
(四)Diels-Alder reaction
+
思考题:
写出主要产物,并推测反应机理
1. 2.
H3C CH CH2
IN3
OH
CH3
PhSCl
EtN(i-Pr)2
3.
H3C
B2H6 H2O2, OH
5.2 Addition to C,C multiple bonds
• 5.2.1 Electrophilic addition to C,C multiple bonds • 5.2.2 Nucleophilic addition to C,C multiple bonds • 5.2.3 Concerted addition to C,C multiple bonds
Addition to conjugated dienes
C C C X2 X C CH C C C E-Nu C E C C C Nu C C C C E Nu 1,2-addition C C C C E Nu 1,4-addition
Me H2C C CH
CH2
HCl
Me H3C C CH Cl
*3 空阻小的一侧优先
*1 CH2=CH-CH2CH2-CCH + H2 (1mol)
Ni
CH3CH2CH2CH2-CCH
烯烃比炔烃更易氢化 *2 CH2=CH-CCH + H2 (1mol)
Ni
CH2=CH-CH=CH2
共轭双键较稳定
用Lindlar催化剂还原
碳碳双键的加成原理

碳碳双键的加成原理碳碳双键是有机化学中重要的反应类型之一,也是有机分子中最常见的化学键之一。
它的加成反应原理是指在碳碳双键上发生的加成反应,即将两个碳原子之间的双键断裂,并与其他原子或基团形成新的化学键。
碳碳双键的加成反应可以分为两类:电子亲和性试剂的加成和亲核试剂的加成。
电子亲和性试剂的加成通常发生在双键的两侧,而亲核试剂的加成则通常发生在双键中间。
在电子亲和性试剂的加成反应中,试剂中的原子或基团具有较强的亲电子性,能够从双键上吸引电子。
这种试剂可以是正电荷离子、电子亲和性较强的分子或自由基。
在加成反应中,双键上的π电子与试剂中的原子或基团结合,形成新的化学键。
这种加成反应通常会产生稳定的化合物,并且往往是可逆的。
亲核试剂的加成反应则是指试剂中的原子或基团具有较强的亲核性,能够攻击双键中的电子。
这种试剂可以是负电荷离子、含有不稳定电子对的分子或具有强亲核性的分子。
在加成反应中,试剂中的亲核性原子或基团攻击双键中的电子,形成新的化学键。
这种加成反应通常会产生不稳定的中间体,并且往往是不可逆的。
碳碳双键的加成反应在有机合成中具有广泛的应用。
通过这种反应,可以构建复杂的有机分子结构,合成具有特定功能的化合物。
例如,通过碳碳双键的加成反应,可以将不饱和化合物转化为饱和化合物,或者将两个碳原子之间的双键断裂,形成新的化学键。
这种反应不仅可以在实验室中进行,还可以在工业上进行大规模的生产。
碳碳双键的加成反应是有机化学中的基础知识,也是有机化学实验中常用的实验操作之一。
通过掌握碳碳双键的加成原理,可以更好地理解和解释有机反应的机理和规律。
此外,还可以根据加成反应的原理,设计和合成新颖的有机化合物,为有机合成化学提供新的思路和方法。
碳碳双键的加成原理是有机化学中重要的反应类型之一。
通过这种反应,可以构建复杂的有机分子结构,合成具有特定功能的化合物。
掌握碳碳双键的加成原理对于理解和解释有机反应的机理和规律具有重要意义,也为有机合成化学提供了新的思路和方法。
化学反应的加成重排机理

化学反应的加成重排机理化学反应是物质之间相互转化的过程,而加成重排反应则是其中一种重要的反应类型。
它涉及到分子中的化学键的断裂和形成,以及原子之间的重新排列。
本文将对加成重排反应的机理进行探讨。
一、加成重排反应的定义加成重排反应是指在反应中,最初发生加成反应,之后伴随着分子内成键原子的重排。
这种重排通常使得生成的化合物更加稳定。
二、加成反应的机理加成反应是加成重排反应的第一步。
在加成反应中,两个分子之间发生键的形成,产生新的化学键。
这通常涉及到电子的重新分布和元素之间的键形成。
以烯烃和卤代烃反应为例,烯烃分子中的一个π键与卤代烃中的C-X(X为卤素)键发生加成反应。
该反应通常需要一个催化剂的存在,如酸或过渡金属络合物。
加成反应中,π键的电子或电子密度会转移到卤代烃上,形成一个新的碳碳化学键。
同时,卤素原子与烯烃分子中的一个氢原子发生反应,生成相应的卤化烷。
三、重排反应的机理在加成反应之后,接下来发生的是分子内的重排反应。
这种重排使得生成的化合物更加稳定,通常是通过原子或基团的迁移来实现的。
重排反应的机理通常取决于化合物的结构和键的稳定性。
有三种常见的重排类型:烷基重排、氢转移和异构化。
1. 烷基重排:在烷基重排中,化合物中的一个烷基基团在分子内移动,形成更稳定的共轭体系。
这种重排通常是通过σ键的旋转和破裂来实现的。
2. 氢转移:氢转移是指氢原子从一个原子或基团转移到另一个原子或基团上。
这通常通过共有键的形成来实现。
3. 异构化:异构化是指在分子内发生原子或基团的重新排列,从而形成不同构的同分异构体。
四、加成重排反应的应用加成重排反应在有机合成中具有广泛的应用。
它可以用于构建碳碳键和构建复杂的有机分子。
例如,Diels-Alder反应和Bergman环化反应等都是加成重排反应的典型例子。
Diels-Alder反应是一种重要的加成重排反应,它可以构建六元环的芳香化合物。
该反应涉及到共轭二烯与烯基或炔基化合物之间的加成和重排。
第六章_碳碳加成反应

例1
HBr
H
Me
(± )
Me
H+
Me
Me Br
反式加成产物
Br Me Me + Me Br H
+ Me H
Me
BrMe H
反式加成
顺式加成
例2
CH3 H3CCCH CH3 CH3
H Cl CH2 - H3CC Cl
CH3 Cl CHCH3 CH3
Cl- H CC CHCH3 3
CH3
17% %
CH3 H3CC CH3
Br SbF6 C C
立体化学 Br2与顺 丁烯加成,得>99% 与顺-2-丁烯加成 丁烯加成, % 反式加成物(一对苏式外消旋体) 反式加成物(一对苏式外消旋体), < 1%的 % 赤式产物( 内消旋体) , 由此说明其反应机 赤式产物 ( 内消旋体 ) 环状鎓离子中间体机理。 理为环状鎓离子中间体机理 理为环状鎓离子中间体机理。
CH3 CHCH3 Cl CH3
83% %
Cl- H CC CHCH3 3
例3
HBr HOAc
Br-
Br
85% %
HOAc
OAc
15% %
H+
2.三分子亲电加成反应 AdE3 三分子过渡态(反式加成),v=k[烯烃 烯烃][ENu]2 三分子过渡态(反式加成), ), 烯烃
ENu
Nu E
≠
C C
C=C
碳正离子
Cl
+
-
Cl CHCH3
C6H5CH
离子对
按离子对中间体机理反应的体系结构特点 若开链的离子对能被共轭或诱导效应( 若开链的离子对能被共轭或诱导效应(或两 种同时)稳定(通常为芳香基取代的双键) 种同时)稳定(通常为芳香基取代的双键)时, 对Cl2和HX等亲电试剂来说,多数按离子对中间 等亲电试剂来说, 等亲电试剂来说 体机理进行反应, 主要得顺式加成产物。 体机理进行反应 , 主要得顺式加成产物 。 若是 HX, 由于碳正离子中心的稳定性较高, 碳氢键 , 由于碳正离子中心的稳定性较高 , 的形成也不需要卤离子的协同进攻。 的形成也不需要卤离子的协同进攻。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
子云密度较大;
R CH CH2 E
R CH CH2 动态:
E
哪个C+稳定。
R CH CH2 空间效应 E
共轭二烯烃的亲电加成反应
C C C C E Nu
X2 Cl2, Br2 X CCC C
C C C C Nu E
CC C C E Nu
C C CC
E
Nu
Ph CH CH CH CH2 H
Ph CH CH CH CH3 Ph CH2 CH CH CH2
H Cl
CH3
D
+
H CH3 Ph D
H
Ph H
Cl
按正碳离子机理进行反应的底物结构是: ① 环状非共轭烯烃 ② 正电荷能够离域在碳骨架的体系 2) 重排产物的生成
2.鎓型离子的机理
C
δ
δ
C
C
Br Br
Br + Br C
Br
C
C
Br
Br C
C Br
反式加成
按鎓型离子机理进行反应的事实:
CH3
Br Br
不饱和碳-碳键的加成反应概述
1、与HX反应(亲电加成,自由基加成)
CC
加成 H
+ H Cl
B 消去
X H
2、水合反应(亲电加成)
CC
H2O, H2SO4 H2SO4
CC H OH
不饱和碳-碳键的加成反应概述
3、加X2反应(亲电加成)
CC
X2
CC XX
4、加XOH反应(亲电加成)
CC
X OH
CC X OH
负离子先进攻、同时进攻……
可能的反应历程
• 负离子先进攻
X--
X+
CHX2C=HCH2C2H2X XCH2CH2--
• 正离子先进攻
X+
X--
CH2=CH2
XCH2CH2+
XCH2CH2X
可能的反应历程
• 正负离子同时进攻
X-- X+
CH2=CH2 • 协同反应
CH2—CH2
XX
XCH2CH2X
当吸电子基团与双键上C原子直接相连时,亲电 加成反应活性明显减小。
试剂:与HX的酸性顺序一致, 给出质子能力越大, 亲电性越强。
HI > HBr > HCl > HF
同理: ICl > IBr > I2
溶剂:
溶剂极性越强,①利于E-Nu的异裂;
三. 亲②电利加于成C+、反翁应型的离定子的向生成。静态哪:个C原子上电
Ph CH CH CH CH3 Cl
Ph CH2 CH CH CH2 Cl
共轭双烯的加成
H+
20烯丙型碳正离子 Cl -
10烯丙型碳正离子
Cl -
单取代双键 动力学控制 Cl
1,2-addition
双取代双键 热力学控制 Cl
1,4-addition
(共轭双烯的亲电加成)
不同的共轭双烯, 是1,2-还是1,4-加成产物 需要作出具体分析
CH3 2C C CH3 2 > CH3 2C CHCH3 > CH3 2C CH2
CH3CH CH2 > CH2 CH2 > BrCH CH2 > CH2 CHCOOH
CH CH2 > CH2 CH2 >
CH CH
芳基的+C效应使正碳离子稳定
CH CH2 H Ph CH CH3
对称二芳基烯烃,芳基使双键稳定, 使亲电加成反应活性降低。
3. 溶剂 ( ) (三).亲电加成反应的定向 (Orientation) ( )
区域选择性 (Regioselective) (四). 共轭二烯烃的亲电加成 ( )
碳碳重键的加成
π电子易于极化, 利于亲电试剂的进攻, 容易发生亲电加成反 应。
CC
Y
叁键可以发生 亲电加成反应, 但更易发生亲 核加成反应。
反应事实
Cl
H3C—C—- Cl2 H3C—C—CO
-OOC—C—CH3
-OOC—C—O
CH3
反应产物中含有内酯。
推理
反应中是正离子先进攻,形成碳正离子, 羧基上的氧原子(带负电荷)就近进攻碳正离 子,得到内酯。如果负离子先进攻,不可能发 生同样反应。
Cl H3C—C—COO-OOC—C—CH3
C
C
CH3
SbF5 SO2
60
.
C
CH3 CH3
H3C Br CC
H3C
CH3 CH3
按鎓型离子机理进行反应的体系结构特点:
1) 底物是简单的烯烃或非共轭链的烯烃, 即C + 不稳定的体系;
2) 亲电试剂的进攻原子是第二周期以上的元素。
炔烃的亲电加成
CH3 C C CH3 HCl 反式加成
H3C C
CH2=CH2
CH2—CH2
XCH2CH2X
反应事实
CXHC2H=2CCHHX22O2,HH20XCH2CH2X + CXHC2H=X2CC2,HHN22aCCll XCH2CH2X + CXHC2H=X2CC2,HHH220OMMe eXCH2CH2X +
推理
反应分两步进行,一步反应不会形成 XCH2CH2OH、XCH2CH2Cl、 XCH2CH2OMe等产物。只会有 CH3CH2OH、CH3CH2Cl、 CH3CH2OMe等产物与XCH2CH2X同时 存在。
试剂
亲电部分E+ 亲核部分Nu-
E
CC
E Nu
C C + Nu
第二步:
E
C C + Nu
E
Nu
CC
反应特点:
1) 产物是大约定量的顺反异构体:
CH3 CH3
+
H2O
H+
CH3
H CH3
E
CC
Nu
H2O
OH HCCHH33 +
COHH3 HCH3
Ph H
H CH3 Cl
H
+ DCl CH3
D Ph H
+
反应事实
• 动力学二级反应 V=k[CH2=CH2][X2]
吸引电子基团存在减慢反应速度。
反应机理
分两步反应,正离子先进攻,中间体是碳 正离子,第一步为控制步骤。
X+
X--
CH2=CH2
XCH2CH2+
XCH2CH2X
一. 亲电加成反应
反应机理:
1. 正碳离子机理
E Nu
E+ Nu-
第一步:
不饱和碳-碳键的加成反应概述
5、硼氢化-氧化反应 (亲电加成)
CC
(1)B2H6 Et2O (2) -OH,H2O2
CC H OH
6、羟汞化-脱汞反应(亲电加成)
CC
(1)Hg(OAc)2 (2)NaBH4
CC H OH
亲电加成反应机理探讨
反应机理
CH2=CH2 + X2
XCH2CH2X
可能有多种反应历程,正离子先进攻、
Cl C
H
CH3
HOOC C C COOH Br2
HOOC
Br
Br
Br
CC
Br
COOH
CC
HOOC
COOH
70%
30%
C2H5 C
Br
C C2H5 H5C2 C Br
Br2 CH3COOH
Br
CC
H5C2
C2H5
Br
C C2H5 ( )
二. 亲电加成反应的活性
底物
a. 双键上的电子云密度越大,越利于亲电试剂 的进攻。
