重组人骨形态发生蛋白4说明书
人免疫球蛋白G4(IgG4)说明书
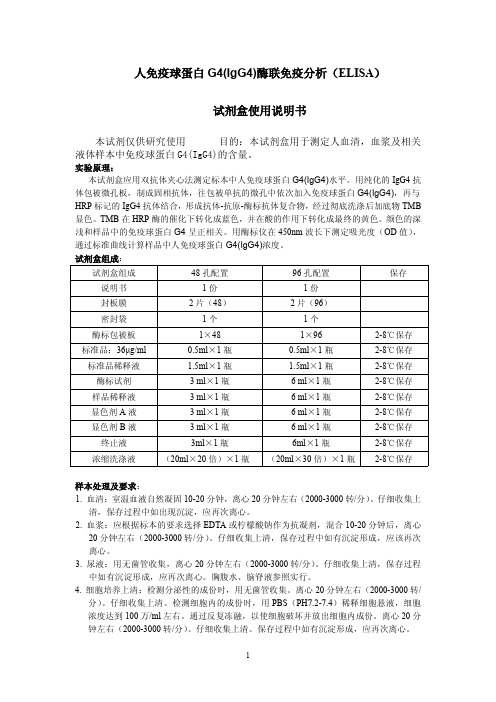
人免疫球蛋白G4(IgG4)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中免疫球蛋白G4(IgG4)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人免疫球蛋白G4(IgG4)水平。
用纯化的IgG4抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入免疫球蛋白G4(IgG4),再与HRP标记的IgG4抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的免疫球蛋白G4呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人免疫球蛋白G4(IgG4)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:36μg/ml0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
人源重组骨形态发生蛋白

人源重组骨形态发生蛋白
人源重组骨形态发生蛋白(Human Recombinant Bone Morphogenetic Protein,简称rhBMP)是一种在骨组织工程中广泛应用的生物活性物质。
它是一种生长因子,能够刺激骨组织的形成和修复,常用于骨折、骨不连等骨疾病的临床治疗。
人源重组骨形态发生蛋白是在实验室中通过基因工程技术生产的,与天然骨形态发生蛋白在结构和功能上非常相似。
这种蛋白具有强烈的骨诱导活性,能够诱导未分化的间充质细胞向骨细胞分化,促进骨组织的形成和修复。
人源重组骨形态发生蛋白在临床上的应用主要有两个方面。
一方面是局部注射治疗骨折、骨不连等骨疾病。
这种治疗方法可以刺激局部的骨组织快速形成和修复,加速骨折的愈合,提高治疗效果。
另一方面是将人源重组骨形态发生蛋白与生物材料相结合,制作成骨形态发生蛋白复合物,用于骨组织工程中的种子细胞诱导和骨组织再生。
这种复合物可以促进骨组织的形成和修复,提高骨组织的生物力学性能和耐久性。
虽然人源重组骨形态发生蛋白在临床治疗中取得了很好的效果,但也存在一些问题。
其中最主要的问题是它的生产成本较高,导致价格昂贵,限制了其在临床上的广泛应用。
此外,对于人源重组骨形态发生蛋白的安全性和长期使用效果等方面还需要进一步的研究和探讨。
总之,人源重组骨形态发生蛋白是一种具有重要临床应用价值的生物活性物质。
它能够刺激骨组织的形成和修复,用于治疗骨折、骨不连等骨疾病。
虽然存在一些问题需要解决,但随着科学技术的发展和应用研究的深入,相信其应用前景将会越来越广阔。
重组人骨形态发生蛋白异源二聚体蛋白及高效表达和复性方法[发明专利]
![重组人骨形态发生蛋白异源二聚体蛋白及高效表达和复性方法[发明专利]](https://img.taocdn.com/s3/m/ebd8a2f56037ee06eff9aef8941ea76e59fa4a5b.png)
(10)申请公布号 (43)申请公布日 2015.01.14C N 104277118A (21)申请号 201410334579.5(22)申请日 2014.07.14C07K 19/00(2006.01)C12N 1/21(2006.01)C12N 15/70(2006.01)C12N 15/62(2006.01)(71)申请人天津科技大学地址300457 天津市滨海新区经济技术开发区十三大街29号(72)发明人刁爱坡 党建利 李玉银 时威威罗深恒(74)专利代理机构天津盛理知识产权代理有限公司 12209代理人赵瑶瑶(54)发明名称重组人骨形态发生蛋白异源二聚体蛋白及高效表达和复性方法(57)摘要本发明涉及一种重组人骨形态发生蛋白异源二聚体蛋白及高效表达和复性方法,方法包括以下步骤:利用融合PCR 技术通过编码(GlyGlyGlyGlySer)3的DNA 片段将BMP7和BMP2基因连接,将融合基因插入pHis-NusA 质粒中,构建重组质粒,重组质粒导入大肠杆菌BL21(DE3)中,37℃培养,0.5mM IPTG 诱导表达,结果表明此方法高效表达BMP7/BMP2异源二聚体蛋白,表达蛋白以包涵体形式存在,经过简便的包涵体纯化和复性即能得到大量复性蛋白,本方法获得BMP活性蛋白操作简单,极大地降低了制备成本,适合大规模发酵生产,为BMP 在临床上治疗骨损伤的广泛应用提供了可能。
(51)Int.Cl.权利要求书1页 说明书7页序列表3页 附图3页(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书1页 说明书7页序列表3页 附图3页(10)申请公布号CN 104277118 A1.一种重组人骨形态发生蛋白异源二聚体蛋白,其特征在于:所述蛋白从N端到C端的顺序是BMP7-连接肽-BMP2,所述连接肽是由3个GlyGlyGlyGlySer重复氨基酸序列组成。
2.表达权利要求1所述蛋白的基因工程菌,其特征在于:所述宿主菌为大肠杆菌感受态BL21(DE3),所述表达载体为pHis-NusA,所述载体的目的序列为BMP7和BMP2成熟肽基因通过编码连接肽的DNA片段连接,获得编码BMP异源二聚体的核苷酸序列。
利用重组人骨形态发生蛋白-2诱导椎间盘成骨的实验研究

m eia sh o h s i l f ig a n vri 2 6 0 dc lc o l op t o qn d ou ies ̄ 6 0 3 a
[ bt c O jc v T e r n e es it o uig h MP2ietioi e e erl i t dc t - A sat r ] bet e o t mieh ai ly f s B 一 jc t n r r bads t ir ue e i de t f b i nr n s t v t con o n n i r
h nrdmio B 一 sn c dnoh t vr bads o nt aN wZ a n b i e r op I u de c go r MP2 j t ttene et rli f a rl e el d ab s t sg u . r fh wa ie e i i r a c u a r n i h f tr i n
h n l o p n r l l 0 1 t e o to r u 。 o a aie2 0 s e f r e . h nmas r l we d o r p ia l da i l wee i e c r g m s n wa ro p m d T ea i l we f l dr ig a h c l a mas r l d e oo a yn n kl
Ha oZh ng , e g n a g Li ,e a he o e shopia o a ou d pa t e o rh a i. 4 02 e e ke Zh n Yigg n , Li t LJT pe pl s tl fc oc r t e rm nt fo tpe dc27 40
骨形态发生蛋白BMP和骨形成的研究进展

骨形态发生蛋白BMP与骨形成的研究进展1陈于东2陈锦平1义乌市中医院2浙江省人民医院1965年,Urist等人将脱钙牛骨基质植入皮下和肌内后发现能够诱导新骨形成,他们认为脱钙骨基质中存在能诱导骨生长的未知物质,称之为BMPs。
其后的研究表明BMPs是一组复合物,迄今为止,人们己经成功分离出了40余种这类蛋白质,而且通过DNA重组技术,人的9种不同的BMP (1-9)己经得到了清楚的解释。
Wozney等曾详细报道了BMP1、BMP2、BMP3的分子克隆和分子结构与活性的关系。
BMPs是一个重要的骨相关细胞因子家族,除BMP-1外均属于TGF-B超家族,可由间充质细胞、成骨细胞及软骨细胞产生。
BMPs家族的成员通过结合I型和II型丝氨酸2苏氨酸激酶受体发挥作用,BMPs是目前发现的唯一能在体内异位诱导化骨与软骨的细胞因子,能诱导未分化的间充质细胞分化为骨软骨母细胞并产生骨软骨基质,还能刺激成骨细胞和软骨细胞分化,在骨和软骨的生长和发育中起重要作用。
1 BMP-2的理化性质人类成熟的BMP-2是一种可溶的、低分子跨膜糖蛋白,分子量约为32Kd,包括N端疏水性分泌性引导序列、中间区域的前肽和C端成熟区。
具有活性的BMP-2分子是由两个相同亚基形成的二聚体,两个亚基之间以二硫键相连,它的C-端拥有七个高度同源性的半胱氨酸残基片段,其中六个半胱氨酸残基在多肽链内形成二硫键,依赖半胱氨酸二硫键维持特定构象并保持一定的生理活性,N-端的10个碱基序列是肝素的结合位点,与细胞外的肝素特异性结合,可影响BMP-2受体激活,并调节其生物活性。
Tabas等利用体细胞杂交株,用cDNA探针杂交技术确定了BMP-2基因定位于20p-12p。
2 内源性BMP来源BMP分布于各种动物的硬组织,且骨皮质含量高于骨松质,其它组织含量甚少,但内源性BMP 确切来源目前没有完整的结论,原位杂交分析和免疫组化研究发现BMP-2的mRNA可在骨组织和多种间充质组织中表达,如肢芽、心脏、和颌骨滤泡等,但BMP-2的mRNA在骨组织中表达水平比在其它组织高40倍。
人源重组骨形态发生蛋白

人源重组骨形态发生蛋白人源重组骨形态发生蛋白(BMP)是一种重要的生物活性蛋白质,对骨骼生长、愈合和再生具有重要的作用。
BMP最早是从动物骨细胞的培养上分离出来的,后经过基因重组技术,可以在大肠杆菌、哺乳动物细胞等生物系统中大规模表达。
BMP作为一种多功能性生长因子,对于促进成骨细胞的增殖和分化,以及在骨骼生长、愈合过程中的相关信号传导起着关键作用。
BMP不仅在骨骼组织中具有重要的生物学功能,而且还能够促进软骨、齿、肌肉以及神经组织的形态生成和修复,因此在医学领域有着广泛的应用前景。
BMP通过与细胞表面的受体结合,激活细胞内信号通路,促进转录因子的激活,进而调控相关基因的表达,从而影响细胞增殖、分化和骨基质的沉积。
在临床上,BMP已经被广泛应用于骨科领域,用于骨折愈合、骨缺损修复,以及脊柱融合手术等方面。
通过外源性的BMP,可以促进骨细胞的增殖和分化,加速骨折的愈合,减少骨折的愈合时间,同时也可以用于治疗骨缺损和进行脊柱融合手术。
这些临床应用有效地提高了骨骼组织的再生和修复能力,使得一些原本难以治愈的骨科疾病得到了有效的治疗,对于患者的康复具有重要的意义。
此外,BMP还被广泛应用于组织工程和再生医学领域。
在组织工程中,通过载体材料载体等途径将BMP导入到受损组织中,可以促进受损组织的修复和再生,为组织工程的应用提供了有力的支持。
在再生医学领域,BMP可以用于促进肌骨组织的再生和修复,为一些临床难题提供新的治疗思路。
同时,BMP也为器官移植、皮肤再生、血管再生等领域提供了新的可能性和方法。
不过,尽管BMP在临床和研究中有着广泛的应用前景,但是其在临床应用中也存在一些问题。
一方面,目前尚缺乏对BMP临床应用的有效标准和规范,导致一些不规范的使用,容易出现不当使用和副作用等问题。
另一方面,在大规模生产BMP的过程中,也存在成本高、纯度低、活性不稳定等问题,限制了其在临床中的应用。
因此,未来需要加强对BMP的研究和开发,提高其纯度和活性,建立有效的临床应用标准和规范,以便更好地发挥其在医学领域的作用。
人(Human)免疫球蛋白G4(IgG4)ELISA试剂盒说明书

本试剂盒只能用于科学研究,不得用于医学诊断人(Human)免疫球蛋白G4(IgG4)ELISA检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被免疫球蛋白G4(IgG4)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的免疫球蛋白G4(IgG4)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
样品收集、处理及保存方法1.血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1.试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4.严格按照说明书中标明的时间、加液量及顺序进行温育操作。
5.所有液体组分使用前充分摇匀。
试剂盒组成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL3mL无检测抗体-HRP10mL5mL无20×洗涤缓冲液25mL15mL按说明书进行稀释底物A6mL3mL无底物B6mL3mL无终止液6mL3mL无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、50、100、200、400、800μg/mL试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
【国家自然科学基金】_骨形态发生蛋白-4_基金支持热词逐年推荐_【万方软件创新助手】_20140802
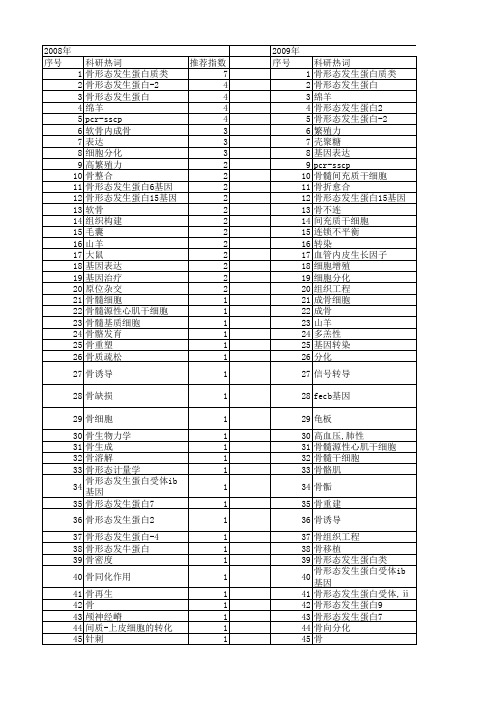
转化生长因子β 1 转化生长因子 质粒 衰老 血管钙化 蒙古羊 舌 腺病毒 腰椎融合 脐动脉 脊柱融合术 脉冲电刺激 脂肪间充质干细胞 脂肪生成 脂肪前体细胞 胶原基纳米骨 胚胎发育 胃癌 股骨头缺血性坏死 肝硬化 肝星状细胞 肌细胞,平滑肌 聚丙交酯-乙交酯 羟基磷灰石 结肠癌 结直肠癌 结构 纳米微球 纤维蛋白胶 糖皮质激素 粒细胞集落刺激因子 突变 碱性磷酸酶 白细胞介素6 甲状旁腺 生物陶瓷 牙周膜干细胞 煤 滑膜 流式细胞术 活性氧 氟化物中毒 椎间盘退变 核心结合因子α 1亚基 明胶海绵,吸收性 扩髓 成骨诱导 成肌细胞 成体干细胞 微球 异位成骨 序列分析 干细胞 少突胶质细胞
2009年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52
107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125
免疫组织化学 信号通路 体内组织工程骨 人骨髓间充质干细胞 人甲状旁腺素相关蛋白 主效基因 丝氨酸/苏氨酸蛋白激酶 vegf smad4 pcdna3-hbmp2 osterix nf-κ b fecxl突变 dna多态性 bmp2基因 bmp2 bmp-7 bmp-4 4
科研热词 骨形态发生蛋白质类 骨形态发生蛋白 绵羊 骨形态发生蛋白2 骨形态发生蛋白-2 繁殖力 壳聚糖 基因表达 pcr-sscp 骨髓间充质干细胞 骨折愈合 骨形态发生蛋白15基因 骨不连 间充质干细胞 连锁不平衡 转染 血管内皮生长因子 细胞增殖 细胞分化 组织工程 成骨细胞 成骨 山羊 多羔性 基因转染 分化 信号转导 fecb基因 龟板 高血压,肺性 骨髓源性心肌干细胞 骨髓干细胞 骨骼肌 骨骺 骨重建 骨诱导 骨组织工程 骨移植 骨形态发生蛋白类 骨形态发生蛋白受体ib基因 骨形态发生蛋白受体,ⅱ型 骨形态发生蛋白9 骨形态发生蛋白7 骨向分化 骨 音猬因子 非创伤性股骨头坏死 间质干细胞 重组人骨形态发生蛋-2 软骨细胞蛋白多糖 软骨形成 转录因子
骨形态发生蛋白4在诱导人乳牙牙髓干细胞形成牙结构中的作用

解剖学杂志
2 0 1 3 年第 3 6 卷第 1 期
骨 形态 发 生 蛋 白 4在诱 导 人 乳 牙 牙 髓 干细 胞 形成 牙结 构 中的 作用
Ab s t r a c t Ob j e c t i v e :To s t u d y t h e r o l e o f BMP 4 i n t h e d i f f e r e n t i a t i o n o f s t e m c e l l s f r o m h u ma n e x f o l i a t e d d e c i d u o u s t e e t h
刘 晓影 林 维平 齐 爽。 孙 岩 王 国辉 △
( 潍坊 医学院 , 1细胞生物学教研室 ,2口腔研究所 , 潍坊 2 6 1 0 4 2 ;3淄博第 十中学生物学教研室 ,淄博 2 5 5 1 2 9 )
Байду номын сангаас
摘要 目的 : 研究骨形态发 生蛋 白 4 ( B MP 4 ) 在 诱 导人 乳 牙 牙髓 干 细胞 ( S HE D) 形 成 牙结 构 中 的作 用。方 法: 分离、 培 养 S HE D, 并通过组织重组 、 器官培养及组 织形态学分析等方法 , 研究 S HE D 的成牙潜能及 B MP 4在其 中的作用 ; 结果 : 体外 培养 的S HE D 具有分化能力 , 但并不能直接被有诱导成牙能力的牙上皮诱 导成牙 , 然 而在 B MP 4的作用 下 , 鼠牙 源性 上皮能够诱
导S HE D 形成牙结构。结论 : B MP 4能够协助 鼠牙源性上皮诱导 S HE D 分化为成牙本质细胞 , 并形成牙本质及 牙髓腔结构 。
人骨形态发生蛋白2,3,6,12对大鼠骨肉瘤细胞株UMR106的作用

( B s / / n o s oacma cl U h MP )2 3 6 ad 1 n ot sro e MR1 6 M eh d A e oi s B 2 3 6 ad 2 e l . to s 0 d A B 2 3 6 ad w r ue o t a te cl l e hi po f a o 2 1 2) ee sd t r t h e i .T e rle t n,ao t i,a d e l n r ir i ppo s n s
ta s g a in we e d t ce y a l e e cu i n ts ,Td me itd bo i yae d r n mir t r ee td by Tr p n b u x lso e t o T- d ae itn lt d. UTP c n nik e d
L n xn I Xi g i g, HE u n i g, W U i i MA e , CHEN n h n, H a ln L me , W n Yi g a
W EIJa,MI i g u i AO Jn k n.Z HOU L n a
( eat etfBo d a E gne n Dp r n i i l n i r g,C og i dclU i rt m o e m c ei hnqn Mei nv sy;KyL brt yo B m dcl g a ei e a oa r i ei o f o a E gne n hnqn n e r g o C ogig;Sa e a oa r d a Ut sud E gne n ofudd b i i f tt KyL brt o Mei l laon ni r g C - n e y e o f y c r ei o
骨形态发生蛋白.pptx

谢谢!
第17页/共18页
感谢您的观看!
第18页/共18页
• Geraghty等人最近发表的一项研究描述了一种新的,可行的骨软骨异体移植物,其包含 能够刺激MSC的细胞外基质(ECM)蛋白和软骨形成生长因子(即TGF-β1和3, BMP2,4,7,bFGF和IGF1),完成山羊模型中的体内软骨修复。
第11页/共18页
上述研究显示使用与MSC相关的BMP促进关节软骨修复带来有限的有利结果。同时, 使用其他软骨形成诱导因子例如TGF-β蛋白或者诸如PRP或Geraghty等人描述的嵌 入新的骨软骨同种异体移植物中的因子的异质混合物已经证明了更好的结果。可能是 因为这些因素以及包含BMPs,比单独使用BMPs软骨修复更有希望。事实上,BMP 与MSC一起在体内显示比成软骨细胞更高的骨诱导能力。
第15页/共18页
结论
BMP已经在再生医学和组织工程领域中展示出巨大的潜力。它们已经在许多临床前和临床研 究中测试,探索它们在几种动物模型缺陷和人类疾病中的软骨形成或骨诱导潜能。特别是 BMP2和BMP7,已经被完全用于治疗许多软骨和骨缺损,并且最近被批准用于不连骨断裂 的协议作为辅助治疗。 该领域目前仍是分子细胞研究领域的热门,越来越多的文献和近年来的研究结果表明,为骨 替换生产理想的移植物这一目标确实可以实现,并且未来的BMP和MSC将参与特别设计的 植入物的生产用于骨组织工程。
1、由于对调节其活性的因素的理解有限; 2、缺乏对这些细胞和它们的生态微环境的组分之间的复杂相互作用的了解。 由于以上两个因素,MSC的临床应用受到限制。仍有待相关研究进一步探索。
第7页/共18页
MSCS在致癌和生殖细胞分化中的应用
• 当在一个或多个(转化生长因子-β)TGF-β超家族成员的存在下将MSC以无血清的3D培 养形式(为细胞提供一个更加接近体内生存条件的微环境的培养技术)接种时,发生软骨 形成分化。在该条件中,细胞放弃典型的成纤维细胞形态并开始产生软骨特异性基质组分。 细胞通常在不超过2-3周内分化成分泌蛋白多糖的软骨细胞样细胞。
新手丨重组人二肽基肽酶4(DPP4)说明书

新手丨重组人二肽基肽酶4(DPP4)说明书
二肽基肽酶-4(英语:Dipeptidyl peptidase-4)(DPP4),是一种人类体内的蛋白质,由DPPP4基因编码。
DPP4与ATRN、FAP、DPP8和DPP9有关联。
【DPP4】重组人二肽基肽酶4,又称腺苷脱氨酶复合蛋白-2,T细胞活化抗原CD26是一种丝氨酸外肽酶和复合酶,在大多数细胞表面均有表达。
DPPIV是一种内源性膜糖蛋白和丝氨酸外肽酶,能从多肽的N端切割X-脯氨酸二肽。
DPP4在t细胞活化中起作用。
DPP4与细胞内信号转导、细胞凋亡有关,参与肿瘤生物学。
至少有63种底物能与DPP4酶特异结合,包括生长因子、趋化因子、神经肽等。
此外,DPP4通过切割肠促胰岛素样多肽(GIP)和胰高血糖素样肽-1(GLP-1)等肠促胰岛素在葡萄糖代谢中发挥重要作用。
人pf4蛋白序列

人pf4蛋白序列人pf4蛋白(Platelet factor 4,简称pf4)是一种由血小板特异性细胞因子家族(CXC趋化因子家族)成员组成的蛋白。
它由基因PF4编码,是一种小分子肽链,具有强烈的趋化活性和抑制血管生成的能力。
本文将对人pf4蛋白序列进行详细描述,包括其结构、功能以及在疾病中的作用。
一、人pf4蛋白的结构人pf4蛋白由70个氨基酸组成,具有相对分子质量为7.8kDa。
其序列包含了一个信号肽序列和一个成熟蛋白序列。
成熟蛋白序列由连接两个半胱氨酸的一个二硫键以及四个胺基酸残基的磷酸化位点组成。
人pf4蛋白的三维结构为单链折叠成两个平行的α螺旋。
二、人pf4蛋白的功能人pf4蛋白在血小板活化和血液凝块形成中起着重要作用。
它能够通过与血小板表面的GPIIb/IIIa受体结合来促进血小板聚集和凝集。
此外,pf4蛋白还可以与凝血因子Xa结合,抑制凝血过程。
它还具有抑制血管内皮细胞增生和血管生成的能力。
三、人pf4蛋白在疾病中的作用pf4蛋白在炎症和免疫反应中发挥重要作用。
研究发现,pf4蛋白在炎症反应过程中能够吸引和激活中性粒细胞,并参与调节炎症介质的释放。
此外,pf4蛋白还参与调节血管内皮细胞的功能,抑制血管生成和肿瘤发展。
pf4蛋白在许多疾病的发展中起到重要的作用。
例如,在血小板相关疾病中,pf4蛋白的异常表达与血栓形成和血小板异常聚集有关。
此外,在炎症性疾病中,pf4蛋白参与调节炎症反应和免疫细胞的活化。
研究还发现,pf4蛋白在某些肿瘤中的表达增加,与肿瘤的侵袭和转移有关。
四、结论人pf4蛋白是一种在血小板激活、血液凝块形成以及炎症调节中起重要作用的蛋白。
它具有强烈的趋化活性和抑制血管生成的能力。
在疾病中,pf4蛋白的异常表达与血栓形成、炎症反应以及肿瘤的进展有关。
对于了解pf4蛋白的结构和功能,有助于研究其在疾病发展中的作用机制,为疾病的预防和治疗提供新的思路和方法。
骨形态发生蛋白与组织工程:本刊中文部

po rm. p e(hl P 9 6. 0 53 (0:1 8 19 . rga S i P i a1 7 )2 0 ;01 ) 8 .16 n a 1 【5 A nU Ah , alms et L e l h t lg f 1 1 h M, nNU N l a h t . t eeio yo y a T o a oe c n ip tis oi i A JOr o B l a J. d ls e td ahc c lss m t p(el Me dN ) io o h e
n t a it r . p o p c ie e d a ur I s o y A r s e t piemi o c l t d . n o n h v olgia u y J Bo e J i t s
S r m 7 ;0 2 :7 —7 . ugA 1 86 ( ) 3 1 6 9 1
c TR0g R E .r
李 I 平,等 j
目斟觏f铺市青少年 』誊奢柱蚀凸患穗率调套
[3 Z a gY Z a , S e l h n g oGu h n . 0 72 () 1】 h n t h oL MaZ , t o g u s a g 2 0 ;04: aZ
后 ,这一 技 术逐渐 受 到人 们 的关 注 ,但 因该过
推 荐理 由 :采 用人 工 月骨假 体 置换 .掌 长
肌腱和 豆状 骨移 位 等作 为 月骨替 代 物 ,费用 较
高 、创 伤 大 , 易出现并 发症 ,疗 效 不确 切 。为
程 持 续 时间较 长 ,容 易引起 固定 螺钉松 脱 、伤
2 7 2 0. 3 —4
张勇 , 黎, 真胜 , 炙具治疗 女性 青少 年特 发性 脊柱侧 凸畸 形加 赵 等. 重的危 险 素分析 【 .1 J 1国骨 伤 ,0 72 () 3 。4 I} 2 0 .04 : 72 0 2 [4 Wo gH , u J , aa e 1Iip tis ois ig p r 1】 n K H i H R jnU. t .d ahc c l i iSn a oe a o o sn
骨形态发生蛋白诱导髓外造血的实验研究

Em p r c l sud o n u i g e t a e u l r e a o o e i y i i a t y n i d c n x r m d l y h m t p i ss b a b ne m o p o e tc pr t i o r h g ne i o en
W ANG n ’ Pi g
,
F ANG B i u ONG Yo gpn a. n ,S j n . ig ,DONG Z . n i mig
( . aiMei l oee Z eghuU i ri , hnzo 50 2 hn 2 Dp r etfH m tl yH nnT m r o i l 1 B s dc lg , hn zo nv sy Z egh u 0 5 ,C i c aC l e t 4 a; . eat n e aoo ea u o s t , m o g H pa
Z eg h u4 0 0 C ia h n z o 5 0 8, hn )
Abta t bet e T x lr teef t fbn rh gnt rti( MP oid c xr src :O jc v : oepoe h f c o oemo oe e cpoe B )t n u eet i e p i n -
摘 要 :目的 : 讨 骨 形 态 发 生 蛋 白 ( MP 诱 导髓 外 造 血 以 拯 救 骨 髓 造 血 衰 竭 的作 用 。 方 法 : 用 c 一 + 探 B ) 采 o
氯霉 素 ( H) C +环 磷 酰 胺 ( Y) 方 法 诱 导 小 鼠致 死 性 再 生 障 碍 性 贫 血 模 型 ,实 验 组 于 诱 导 再 障 前 6 C 的 d肌 肉
重组人骨形成蛋白成熟肽-4对辐射小鼠骨髓造血损伤的修复作用

的修 复作用 , 从而 为进一 步研 究 B MP 4促 进造 血 的机制及 未
来 的 临床 应 用 提 供 一 定 的理 论 依 据 。
1 材 料 与 方 法 1 . 1 材 料
1 . 3 . 2 骨 髓 单 个 核 细胞 的分 离 和 纯 化
照射后第 1 、 3 、 5 、 7 、 9
检 验 医学 与 临 床 2 0 1 3年 1 0月 第 1 O卷 第 1 9期
L a b Me d C l i n , Oc t o b e r 2 0 1 3 , Vo 1 . 1 0 , N o . 1 9
・
论 著 ・
重 组 人 骨形 成 蛋 白成 熟 肽一 4对 辐 射 小 鼠骨 髓造 血 损伤 的修 复作 用
r o w we r e d e t e c t e d . Re s u l t s Th e n u mb e r o f WB C, mo n o n u c l e a r c e l l s a n d t h e p r o p o r t i o n o f CD3 4 c e l l s i n e x p e r i me n t
1 . 1 . 2 主要 试 剂 和仪 器 r h B MP 一 4 m 为本 室保 存 ; F i c o l l 淋 巴 细胞分离液 , 比重 ( 1 . 0 7 7 ±0 . 0 0 1 ) , 购 自华 美 公 司 ; C D 3 4单 抗 及I g G对 照抗 体 均 购 自 Ab c a m 公 司; 动 物 血 细 胞 计 数 仪 ME — D ON I C C A 6 2 0 ( 瑞典 B o u l e Me d i c a l AB公 司 ) ; 流 式 细 胞 仪
【BMP 2】重组人骨形态发生蛋白-2研究工具

【BMP 2】重组人骨形态发生蛋白-2研究工具骨形态发生蛋白(bone morphogenetic protein,BMP)又称骨形成蛋白,是一组具有类似结构的高度保守的功能蛋白,属于TGF-β家族。
BMP能刺激DNA的合成和细胞的复制,从而促进间充质细胞定向分化为成骨细胞。
它还是体内诱导骨和软骨形成的主要因子,并在肢体生长、软骨内骨化、骨折早期、软骨修复时表达,对骨骼的胚胎发育和再生修复起重要作用。
如今BMP家族已有43个成员,广泛地存在于猪、牛、羊、兔、鼠及人的胚胎、血细胞、肾和脾脏等组织中,且在不同种属间有较高的同源性。
BMP不仅参与骨骼的调节,而且对脂肪、肾脏、肝脏、骨骼及神经系统发育也起到一定作用。
BMP分泌后既能与细胞外基质及可溶性拮抗剂结合,还能与多种细胞膜表面的蛋白受体相互作用。
它不仅具有区别于其他骨生长因子的独特结构和理化性质,而且其家族中不同成员的基因定位及成骨机制等也不尽相同。
BMP主要通过依赖Smad途径和p38 -MAPK途径两条信号通路发挥作用,且信号转导过程受细胞外拮抗剂、膜受体、细胞质微环境和转录水平4个层次的调节控制。
在治疗上,BMP不仅能单独介导促成骨作用,而且还能与其他骨生长因子混合,从而增强其恢复疾病的疗效。
骨生长因子共同存在的一个缺陷即为其半衰期短,在体内易降解,因此多采取缓释技术局部用药,延缓其衰解。
骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)是转化生长因子B超家族成员之一,具有诱导未分化间充质干细胞向成软骨细胞和成骨细胞定向分化与增殖能力,促进成骨细胞分化成熟,参与骨和软骨生长发育及其重建过程,进而加速骨缺损修复.BMP-2在体内以前体形式合成,经蛋白酶切去除信号肽和前肽,得到由114个氨基酸残基组成成熟肽.成熟肽通过7对二硫键将其保守结构正确折叠.成熟肽同源或异源二聚体才具有生物活性.ProSpec人骨形态发生蛋白-2(BMP 2)#CYT-261为过滤灭菌的白色冻干粉末;该冻干粉末是从含1mg/ml人骨形态发生蛋白-2(BMP 2)的20mM NaAc(pH 4)溶液中过滤灭菌并冻干产生的.建议加无菌的20mM AcOH(乙酸)以配制工作储存液到不低于100ug/ml,后继实验过程中可根据实验要求进一步稀释.此人骨形态发生蛋白-2(BMP 2)冻干粉末在室温可保存3周,或置于-18℃冻存用于长期保存.重新溶解后可以在4℃冷藏保存至少2-7天以上;如果想延长保存时间,建议分装(加载体蛋白如0.1% HSA或BSA)后置于-18℃冻存.请避免反复冻融.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重组人骨形态发生蛋白4说明书
产品名称
通用名称:重组人骨形态发生蛋白4
骨形态发生蛋白是TGF-β超家族的成员之一,最初因其能诱导骨和软骨的形成而得名,对骨骼的胚胎发育
和再生修复其重要作用。
随着研究的深入,发现BMPs参与调节多种细胞的增殖、分化和凋亡的生物学国
产,在胚胎发育、出生后个组织器官内环境稳定及多种肿瘤的发生中都有重要作用,BMP4与人类肿瘤密切
相关。
近期研究显示,BMP4在乳腺、前列腺及肝脏等多种肿瘤组织中的表达均高于正常组织,并与肿瘤的
侵袭和转移以及患者的生产期呈正相关。
使用说明
如需分装,可用注射用水、生理盐水、培养基或PBS稀释,稀释后浓度保持在100ug/mL以上。
稀释后置于-20℃保存期6个月,-80℃保存期12个月。
参考文献
1、van den Wijngaard A, Weghuis DO, Boersma CJ, van Zoelen EJ, Geurts van Kessel A, Olijve W (Nov
1995). "Fine mapping of the human bone morphogenetic protein-4 gene (BMP4) to chromosome 14q22-
q23 by in situ hybridization". Genomics 27 (3): 559–60. doi:10.1006/geno.1995.1096. PMID 7558046.
2、 Oida S, Iimura T, Maruoka Y, Takeda K, Sasaki S (Nov 1995). "Cloning and sequence of bone
morphogenetic protein 4 (BMP-4) from a human placental cDNA library". DNA Seq 5 (5): 273–5.
doi:10.3109/10425179509030980. PMID 7579580.
3、Knöchel S, Dillinger K, Köster M, Knöchel W (November 2001). "Structure and expression of
Xenopus tropicalis BMP-2 and BMP-4 genes". Mech. Dev. 109 (1): 79–82.。
