美国药典36-碘帕醇
碘海醇注射液使用说明

碘海醇注射液说明书【药品名称】通用名:碘海醇注射液曾用名:商品名:英文名:Iohexol Injection汉语拼音:Diɑnhɑichun Zhusheye本品主要成份及其化学名称为:N,N'-双(2,3-二羟基丙基)-5-[N-(2,3-二羟基丙基)乙酰胺基]-2,4,6-三碘-1,3-苯二甲酰胺。
结构式:分子式:C19H26I3N3O9分子量:821.14【性状】本品为无色至淡黄色的澄明液体。
本品是一种含有三个碘原子的非离子水溶性造影剂,碘含量为46.4%。
它以经过消毒的水溶液为剂型,随时可用,并有不同的碘浓度,分别为每毫升浓度含有140、180、240、300或350mg碘。
【药理毒理】药理学本品为X光及CT检查常用的造影剂,可供血管内、椎管内和体腔内使用。
动物试验结果表明本品对犬肝脏、腹主动脉、CT扫描影像有增强效应。
毒理学犬肾动脉造影时有蛋白尿发生的现象。
【药代动力学】通过静脉注射到体内的碘海醇,于24小时内几乎全部药物以原形经尿液排出。
注射后一小时,尿液中浓度最高。
无代谢物产生。
健康志愿者接受静脉内注射碘海醇后,其血流动力学参数、临床化学参数及凝结参数与接受注射前的数值差别甚微,其改变无临床意义。
大鼠、兔及犬静脉注射时主要从尿中排出,小部分(大鼠5%,犬1%)从粪中排出,尚未发现任何器官吸收的现象,也未在动物中检测到任何代谢产物。
本品蛋白结合率少于2%或几乎不与蛋白结合。
【适应症】1.血管内应用临床应用本品于成人及儿童的尿路造影和心血管造影,以及成人的大脑血管造影,外周及各种动脉造影、静脉造影、数字减影和CT增强扫描。
2.蛛网膜下应用适用于成人及儿童的脊髓造影,以及应用于蛛网膜下注射后进行脑池CT扫描检查。
3.体腔内应用适用于各种体腔检查,包括口服。
如关节造影;内窥镜逆行胰胆管造影(ERCP);疝囊造影;尿路造影;子宫输卵管造影;涎管造影以及各种使用口服水溶造影剂进行的胃肠道检查等。
碘过敏试验ppt课件

验,有的则仅限于过敏史的患者,尤其是非离子型碘 造影剂推广使用以后。
18
我们的问题
• 闫国兴等研究认为,采用30%离子型造影剂(泛影
葡胺)行过敏试验对非离子型造影剂不良反应没有 预测价值。
• 劳海燕等提出应用1 ml 30%泛影葡胺注射剂(离
子型造影剂)做过敏试验预测非离子型造影剂是危 险的,也是不合理的。
• 皮内注射由于局部刺激(造影剂本身、消毒液、针头等)、
个体差异、有些病人呈现迟发反应,在常规时间内,呈阴 性表现等原因不能达到碘过敏试验意义
• 静脉注射试验精确性高,假阳性率低,结果可靠。
蔡秀芬.对三种碘过敏试验方法应用体会【J】.青海医药杂志, 2002,32(9):57—58.
10
碘过敏试验方法选择
• 最新的护理学教科书无对碘过敏试验的要求进行阐述。
11
碘过敏试验方法选择
• 梁嘉定、周少萍等对广东省44家医院进行问卷调
查碘过敏试验方法,结果显示广东省不同医院根 据习惯和经验采用不同的方法。
• 44家医院在试剂的选用方面,32家主要用离子型
造影剂,并用相同的试剂实施碘过敏试验。12家 选用非离子型造影剂造影,(其中50%选用非离子 型造影剂,50%选用离子型造影剂进行碘过敏试 验阴性后再用非离子型造影剂试验)
• 碘帕醇(典比乐)药品说明书中提出,无绝对禁忌证。 • 碘比醇(三代显)药品说明书中提出,用碘试验或同时做
的其他试验不能检测出药物的过敏反应。
17
碘过敏试验意义?
• 对于过敏试验的可靠性,国外的学者们存在争议 • 多数人认为价值有限,只有极少数严重反应患者
有可能通过过敏试验阳性而检出(即符合IgE介导 的速发型变态反应发病机理),试验阴性者仍有 可能发生严重过敏样反应。
碘帕醇-370和碘克沙醇-320在多排CT检查患者中的有效性和安全性比较

碘帕醇-370和碘克沙醇-320在多排CT检查患者中的有效性和安全性比较Dushyant V. Sahani, MD, Gilles Soulez, MD, Ke-min Chen, MD, Luigi Lepanto, MD, Jian-rong Xu, MD, Rendon C. Nelson, MD, Luigi Grazioli, MD, Angelo Vanzulli, MD, Jay P. Heiken, MD 及参加IMP ACT研究的研究者目的:在对比增强多排计算机断层扫描(CE-MDCT)检查中,前瞻性地比较碘帕醇-370和碘克沙醇-320对患者心率(HR)和对比增强有效性的影响。
方法:IMPACT是一项多中心、双盲研究,包括166例经随机化分配,按4 mL/秒静脉注射等碘剂量(40 gI)的碘帕醇-370或碘克沙醇-320进行肝脏(n = 121)或外周动脉(n = 45)CE-MDCT检查的患者。
CE-MDCT检查采用16排MDCT扫描仪,按照预定成像方案进行。
患者取仰卧位,在注射对比剂前测量心率并持续监测至给药后5分钟。
比较两组患者的HR均值和峰值增加量、以及HR增加量达到预定范围(>5且<10、≥10且<15、≥15且<20、>20 bpm)的受试者比例。
由两位处于盲态的独立阅片人评估肝脏图像,通过预设定感兴趣区在动脉期和门脉期的表现评价对比增强[Hounsfield单位(HU)]。
结果:对HR的影响:84例患者使用碘帕醇-370,82例接受碘克沙醇-320。
两组的平均年龄、性别分布、体重、总碘剂量、剂量/体重、合并用药及β阻滞剂使用情况均可比。
两组的基线HR平均值(碘帕醇-370组:72.3 ±12.5 bpm;碘克沙醇-320组:74.5 ±11.9 bpm)和给药后峰值HR较基线值的平均变化量(碘帕醇-370组:8.0 ±9.3 bpm,而碘克沙醇-320组为8.4 ±14.7 bpm,P = 0.72)均相似。
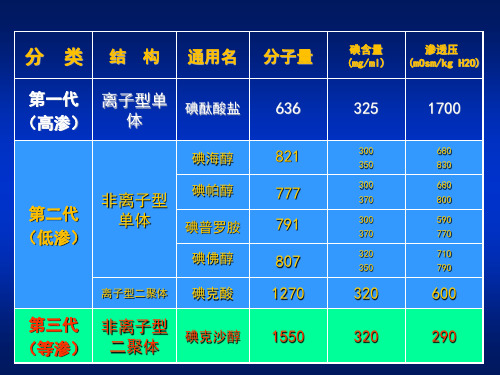
不同对比剂造影剂特点及应用选择
医源性急性肾功能衰竭的第三位常见原因 (Hou et al. Am J Med 1983. Nash et al. Am J Kidney Dis 2002 ) 25%的患者遗留肾功能不全 延长住院时间 增加医疗费用 增加呼衰、败血症等并发症的危险 发生CIN的病死率比未发生CIN患者的病死率高出4倍 ( Levy EM, Viscoli CM, Horwitz RI. JAMA, 1996, 275:1489~1494)
III
III
IIa
IIa
IIa
IIb
IIb
IIb
III
III
III
I
I
I
IIa
IIa
IIa
IIb
IIb
IIb
III
III
III
I
I
I
IIa
IIa
IIa
IIb
IIb
IIb
III
III
III
I
I
I
IIa
IIa
IIa
IIb
IIb
IIb
III
III
III
IIa
IIa
IIa
IIb
IIb
IIb
III
III
III
Iodixanol(威视派克)
Ioxaglate(海赛显)
Coronary, CKD, 46%DM
No difference
Hardiek (2008)
Iodixanol(威视派克)
Iopamidol(碘比乐)
Coronary, 100%DM
No difference
CONTRAST 2008
制备液相色谱法分离纯化碘帕醇

制备液相色谱法分离纯化碘帕醇李华军;陈茜【摘要】基于制备液相色谱法,开发与优化了碘帕醇的分离纯化工艺,制备得到高纯度碘帕醇样品.实验首先在分析水平发展碘帕醇的反相分离方法,考察了两种不同键合量的反相C18固定相、柱温和上样量对碘帕醇的保留、分离度和峰形等的影响.结果表明,碘帕醇在键合量为13.7%的反相C18-1分析柱(250 mm×4.6mm,10μm)上保留较好,且可与杂质有效分离;柱温升高,碘帕醇保留变弱,和杂质之间的分离度降低,最终选用20~25℃作为分离纯化的温度;上样量增加,碘帕醇出峰时间提前,不利于前杂的去除.在制备水平上,以水和甲醇为洗脱剂,在20℃条件下使用装填C18-1固定相的制备柱(270 mm×50 mm,10μm)对碘帕醇进行分离纯化,制备的碘帕醇样品的色谱纯度可达98.97%,回收率为93.44%,各项有关物质均符合限量规定.该方法可以在保证高回收率的条件下有效降低杂质水平,为碘帕醇分离纯化生产工艺的开发提供新方法.【期刊名称】《色谱》【年(卷),期】2018(036)010【总页数】6页(P1061-1066)【关键词】制备高效液相色谱;C18;碘帕醇;纯化【作者】李华军;陈茜【作者单位】浙江司太立制药股份有限公司,浙江台州 317300;浙江司太立制药股份有限公司,浙江台州 317300【正文语种】中文【中图分类】O658碘帕醇是一种非离子型水溶性碘造影剂,具有良好的显影作用,对血管壁及神经组织毒性小,不良反应少,性质稳定,适用范围广,主要用于神经放射学、血管造影术、泌尿系统造影术、CT检查中增强扫描、关节造影术、数字减影血管造影术[1-3]。
美国药典(USP)40版[4]、欧洲药典(EP)9.0版[5]和日本药典(JP)17版[6]均收录了此品种。
碘帕醇分离纯化困难,原因在于粗品中含有较多结构相似的杂质(A~K结构见图1[5])。
美国药典[4]和欧洲药典[5]都对其含量做了严格的限定。
美国药典——精选推荐

美国药典──羟丙基甲基纤维素CA登记号[9004-65-3]原文页号:774-775羟丙基甲基纤维素是甲基纤维素的丙二醇醚,当在105 ℃下干燥2h,其所含的甲基团(-OCH3)和羟丙氧基团(-OCH 2CHOHCH3)符合附表所列羟丙基甲基纤维素品种的范围。
包装及储存─保存在密封良好的容器中。
标签─标签应表明取代类型及粘度类型(2%水溶液的粘度)鉴别─A:将1g样品轻轻加到装有100ml水的烧杯的水面上,让其在水表面上分散,轻敲烧杯上部,使样品均匀分散,将烧杯放置一段时间,直到杯中物变透明及有粘性(大约需要5h),摇晃烧杯以润湿剩余物,放入一搅棒,搅拌至溶解完毕,当加入一份与溶液等体积的1N氢氧化钠或1N盐酸时,溶液保持稳定状态。
B:将1g 样品加到100ml沸水中,搅拌之,形成淤浆,但粉末料并未溶解,将淤浆冷至20℃,搅拌之,所得液体清彻或者呈乳白色胶状。
C:将数毫升上述B款所得混合物滴到玻璃板上,让水蒸发,得到一自生的薄膜。
表观粘度在一已称重过的250ml 广口离心瓶中放入准确称量过的相当于2g干物质样品,将98g予先加热到80~90℃的水一并加入,用推进式搅拌器搅拌10min,将瓶置于冰浴中,继续搅拌,让瓶在冰浴中保留40min,以保证水合作用,得到完全溶解,如果必要时,将溶液重量调整到100g,将溶液离心以排除可能带进溶液的空气,将溶液温度调整到20±0.1℃,在合适的乌氏(Ubbelohde)粘度计中测定粘度(粘度计参见[911]纤维素衍生物之粘度条目)。
对于标签所标100厘泊以下之产品,测定的粘度应不小于80.0%及不大于120.0%标签值,对于标签所标高于100厘泊之产品,测定的粘度应不小于75. 0% 以及不大于140.0%标签值。
干燥失重[731]─在105℃下干燥2h,失重不大于5.0%。
燃烧后残渣[281]─对于标签粘度值大于50 厘泊之羟丙基甲基纤维素,应不大于1.5%;对于标签粘度值为50厘泊更低之产品,燃烧后残渣应不大于3%;对于1828(型)羟丙基甲基纤维素,不论什么标签粘度值,燃烧后残渣应不大于5%。
美国药典-中英文对照(翻译资料)

美国药典-中英文对照译文美国药典中记载的辣椒碱资料辣椒碱(辣椒素)分子结构式:C18H27NO3,分子量:305.41,化学名:(反)-N-[(4-N-羟基-3-甲氧基苯基)-甲基]-8-甲基-6-壬烯基酰胺以干燥提取物计算,辣椒碱含辣椒二萜类化合物总量为标示量的90%-100%,其中辣椒素的含量达到50%以上,辣椒素和二氢辣椒素总量超过75%,其它辣椒素类化合物总量不足15%。
注意事项:小心处置辣椒碱,谨防吸入辣椒碱微粒,勿使身体接触辣椒碱。
包装贮藏:密封包装,置避光,阴凉处保存。
标示量:以辣椒二萜类化合物总百分含量表示。
美国药典参考标准:美国药典辣椒素标准规范,美国药典二氢辣椒素标准规范。
鉴别:配制1.0mg/ml辣椒碱甲醇溶液,配制符合美国药典标准的辣椒碱1.0mg/ml甲醇溶液作为对照液,分别点样于0.25mm厚硅胶、凝胶混合薄层板上,点样量为10礚,将薄层板放于乙醚-甲醇(19:1)展开剂中展开,待展开剂前沿至薄层板3/4处时将薄层板取出,晾干,用0.5% 2,6-二溴苯醌-氯化亚胺甲醇溶液喷雾显色,放于氨气中片刻,取出,鉴别色谱图:供试液主要斑点颜色(兰色)及R值与对照液主要斑点颜色(兰色)及R值一致。
熔点〈741〉: 57°-66°, 一般熔融起始温度至结束温度温差不超过5°。
干燥失重〈731〉: 置40°P2O5真空干燥器中干燥5小时,失重不超过1.0%。
灼烧残渣:≤1.0%。
辣椒素,二氢辣椒素及其它辣椒二萜类化合物含量测定:流动相:磷酸水溶液(l :1000,V/V):乙腈(600:400)混匀,0.5祄微孔滤膜滤过,脱气。
流动相视色谱行为可作适当调整。
辣椒素对照液:精密称取美国药典标准的辣椒碱适量溶于甲醇中,配制约0.1 mg/mL的辣椒甲醇溶液。
二氢辣椒素对照液:精密称取美国药典标准的辣椒碱适量溶于甲醇中,配制约0.025mg/mL的辣椒甲醇溶液。
奥氮平片美国药典36版质量标准USP36

4562Olanzapine / Official Monographs USP 36C U= concentration of Olanzapine in the Sample C U= concentration of Olanzapine in the Samplesolution (mg/mL)solution (mg/mL)Acceptance criteria:98.0%–102.0% on the anhydrous,F= relative response factor for each impurity from solvent-free basis Table 2Acceptance criteria:See Table 2.IMPURITIES•R ESIDUE ON I GNITION〈281〉:NMT 0.1%Table 2•H EAVY M ETALS, Method II〈231〉:NMT 10ppmRelative Relative AcceptanceRetention Response Criteria, Change to read:Name Time Factor NMT (%)Olanzapine related•O RGANIC I MPURITIES compound Ba0.3 2.30.10 Buffer:Dissolve 13g of sodium dodecyl sulfate inOlanzapine related1500mL of water. Add 5mL of phosphoric acid, andcompound A b0.8v2.3v USP360.10 adjust with a sodium hydroxide solution to a pH of 2.5.Olanzapine 1.0——Solution A:Acetonitrile and Buffer (48:52)Solution B:Acetonitrile and Buffer (70:30)•ChloromethylMobile phase:See Table 1.olanzapiniumchloride c (if pres-0.15•(RB 1-Jun-ent) 1.1 1.02012)Table 1Any individual, un-——Time Solution A Solution B specified impurity0.10(min)(%)(%)Total impurities——0.4 01000a2-Methyl-10H-thieno-[2,3-b][1,5]benzodiazepin-4[5H]-one.101000b5-Methyl-2-((2-nitrophenyl)amino)-3-thiophenecarbonitrile.200100•c1-Chloromethyl-1-methyl-4-(2-methyl-10H-benzo[b]thieno[2,3-e][1,2501004]diazepin-4-yl)piperazin-1-ium chloride.•(RB 1-Jun-2012)271000SPECIFIC TESTS351000•W ATER D ETERMINATION, Method I〈921〉[N OTE—A suitable solvent system for water determina-Edetate disodium solution:37mg/L of edetate diso-tion in ketones and aldehydes (e.g., Hydranal compos-dium in Buffer ite 5K-working medium K or Aquastar composite 5K-Diluent:Acetonitrile and Edetate disodium solution solvent KC or equivalent) is recommended.](40:60)Acceptance criteria:NMT 1.0%System suitability solution:20µg/mL of USPOlanzapine RS and 2µg/mL each of USP Olanzapine ADDITIONAL REQUIREMENTSRelated Compound A RS and USP Olanzapine Related•P ACKAGING AND S TORAGE:Preserve in well-closed contain-Compound B RS in Diluent ers, and store at room temperature.Standard solution:2µg/mL of USP Olanzapine RS in•USP R EFERENCE S TANDARDS〈11〉Diluent USP Olanzapine RSSample solution:0.4mg/mL of Olanzapine in Diluent USP Olanzapine Related Compound A RSChromatographic system5-Methyl-2-((2-nitrophenyl)amino)-(See Chromatography 〈621〉, System Suitability.)3-thiophenecarbonitrile.Mode:LC C12H9N3O2S259.28Detector:UV 220 nm USP Olanzapine Related Compound B RSColumn:4.6-mm × 25-cm; 5-µm packing L72-Methyl-10H-thieno-[2,3-b][1,5]benzodiazepin-4[5H]-Temperatures one.Column:35°C12H10N2OS230.29Sample:5°Flow rate:1.5mL/minInjection volume:20µLSystem suitabilitySample:System suitability solution Olanzapine Tablets[N OTE—Identify the peaks using the Relative RetentionTime values given in Table 2.]DEFINITIONSuitability requirements Olanzapine Tablets contain NLT 90.0% and NMT 110.0% Resolution:NLT 3.0 between olanzapine related com-of the labeled amount of olanzapine (C17H20N4S).pound A and olanzapineTailing factor:NMT 1.5 for the olanzapine peak IDENTIFICATIONRelative standard deviation:NMT 2.0% from fourreplicate injections for the olanzapine peakChange to read:AnalysisSamples:Standard solution and Sample solution•I NFRARED A BSORPTION〈197S〉Calculate the percentage of each impurity in the portionStandard solution:v30v USP36 mg/mL of USP Olanzapine of Olanzapine taken:RS in chloroformResult = (r U/r S) × (C S/C U) × (1/F) × 100Sample solution:Dissolve a quantity of powdered Tab-lets, equivalent to 30mg of olanzapine, in 30mL of r U= peak response of each impurity from the chloroform, and filter. Evaporate completely to dryness Sample solution with the aid of a current of air. Redissolve the residue in r S= peak response of olanzapine from the1mL of chloroform.Standard solutionC S= concentration of USP Olanzapine RS in theStandard solution (mg/mL)USP 36Official Monographs / Olanzapine4563ASSAY Standard solution:An amount, in mg, corresponding tothe Tablet label claim, of USP Olanzapine RS in1000mL of Medium. Transfer 5.0mL of this solution to Change to read: a tube, and add 2.0mL of Mobile phase.Sample solution:Pass a portion of the solution under •P ROCEDURE test through a suitable filter of 0.45-µm pore size.•[N OTE—A few drops of acetonitrile, not to exceed 5%Transfer 5.0mL of the filtrate to a tube, and add 2.0mL of the final volume, may be added to the Standard of Mobile phase.solution and Sample solution before final dilution to Chromatographic systemreduce foaming.]•(RB 1-Jul-2012)(See Chromatography 〈621〉, System Suitability.) Buffer 1:6.9g/L of monobasic sodium phosphate. Ad-Mode:LCjust with phosphoric acid to a pH of 2.5.Detector:UV 260 nmBuffer 2:12g/L of sodium dodecyl sulfate in Buffer 1Column:4.6-mm × 15-cm; 5-µm packing L10Mobile phase:Acetonitrile and Buffer 2 (1:1)Flow rate:1.5mL/minSystem suitability solution:0.1mg/mL of USP Injection volume:50µLOlanzapine RS and 0.01mg/mL of USP Olanzapine Re-System suitabilitylated Compound A RS in Mobile phase Sample:Standard solutionStandard solution:0.1mg/mL of USP Olanzapine RS in Suitability requirementsMobile phase Relative standard deviation:NMT 2.0%Sample solution:Transfer a known quantity of Tablets Analysis•(NLT 5)•(RB 1-Jul-2012), equivalent to NLT 25mg of Calculate the percentage of olanzapine (C17H20N4S) olanzapine, to a suitable volumetric flask. Dilute with dissolved:Mobile phase to volume, mix, and sonicate for 10 min.Centrifuge a portion of this solution, and dilute the Result = (rU/r S) ×C S× (V/L) × 100 clear supernatant with Mobile phase to obtain a solutioncontaining about 0.1mg/mL of olanzapine. [N OTE—Agi-r U= peak response from the Sample solutiontation of the flask may be necessary before sonication r S= peak response from the Standard solution to prevent Tablets from adhering to the flask, making C S= concentration of USP Olanzapine RS in the disintegration and dissolution difficult.]Standard solution (mg/mL)Chromatographic system V= volume of Medium, 900mL(See Chromatography 〈621〉, System Suitability.)L= label claim (mg/Tablet)Mode:LC Tolerances:NLT 80% (Q) of the labeled amount of Detector:UV 260 nm olanzapine (C17H20N4S) is dissolved.Column:4.6-mm × 15-cm; 5-µm packing L7•U NIFORMITY OF D OSAGE U NITS〈905〉:Meet theFlow rate:1.5mL/min requirementsInjection volume:20µLIMPURITIESSystem suitabilitySamples:System suitability solution and Standardsolution Change to read:[N OTE—The relative retention times for olanzapine re-lated compound A and olanzapine are 0.89 and 1.0,•O RGANIC I MPURITIESrespectively.]•[N OTE—A few drops of acetonitrile, not to exceed 5% Suitability requirements of the final volume, may be added to the Standard Resolution:NLT 2.0 between olanzapine and solution and Sample solution before final dilution to olanzapine related compound A, System suitability reduce foaming.]•(RB 1-Jul-2012)solution Buffer 1:3.3mL/L of phosphoric acid. Adjust with 50% Tailing factor:NMT 1.8, Standard solution sodium hydroxide to a pH of 2.5.Relative standard deviation:NMT 2.0%, Standard Buffer 2:8.7g/L of sodium dodecyl sulfate in Buffer 1 solution Buffer 3:18.6mg/L of edetate disodium (EDTA) in Analysis Buffer 2Samples:Standard solution and Sample solution Solution A:Acetonitrile and Buffer 2 (12:13)Calculate the percentage of olanzapine (C17H20N4S) in Solution B:Acetonitrile and Buffer 2 (7:3)the portion of Tablets taken:Diluent:Acetonitrile and Buffer 3 (2:3)System suitability solution:20µg/mL of USP Result = (r U/r S) × (C S/C U) × 100Olanzapine RS, and 2µg/mL each of USP OlanzapineRelated Compound B RS and USP Olanzapine Related r U= peak response from the Sample solutionCompound C RS in Diluentr S= peak response from the Standard solutionStandard solution:2µg/mL of USP Olanzapine RS inC S= concentration of USP Olanzapine RS in theDiluentStandard solution (mg/mL)Sensitivity solution:0.4µg/mL of USP Olanzapine RS inC U= concentration of olanzapine in the SampleDiluent from the Standard solutionsolution (mg/mL)Sample solution:Transfer a known quantity of Tablets Acceptance criteria:90.0%–110.0%to a suitable volumetric flask, and dilute with Diluent to PERFORMANCE TESTS volume to obtain a solution containing either 375 or •D ISSOLUTION〈711〉500µg/mL of olanzapine (based on the label claim).Medium:0.1 N hydrochloric acid; 900mL Centrifuge a portion of this solution, and use the super-Apparatus 2:50 rpm natant. [N OTE—Immediate agitation of the flask may be Time:30 min necessary to prevent Tablets from adhering to the flask, Mobile phase:10g/L of ammonium acetate in a mix-making dissolution and disintegration difficult. [C AU-ture of methanol and water (2:3). Adjust with hydro-TION—Do not sonicate.] The Sample solution is stable for chloric acid to a pH of 4.0.12 h at room temperature and 48 h if refrigerated.]4564Olanzapine / Official MonographsUSP 36Mobile phase:See Table 1.Table 2 (Continued)Relative Relative Acceptance Table 1Retention Response Criteria,NameTimeFactorNMT (%)Time Solution ASolution BAny individual un-(min)(%)(%)specified impuri-—01000ty1.00.20101000Total impurities—— 1.5200100a (Z )-4-(4-Methylpiperazin-1-yl)-3-(2-oxopropylidene)-1H -benzo[b ][1,2501004]diazepin-2(3H )-one.271000b 2-Methyl-10H -thieno-[2,3-b ][1,5] benzodiazepin-4[5H ]-one.c (Z )-1-{4-(4-Methylpiperazin-1-yl)-2-thioxo-1H -benzo[b ][1,4]diazepin-351003(2H )-ylidene}propan-2-one.d 2-Methyl-4-(4-methylpiperazin-1-yl)-10H -benzo[b ]thieno[2,3-e ][1,Chromatographic system4]diazepine 4’-N -oxide.(See Chromatography 〈621〉, System Suitability .)Mode:LCADDITIONAL REQUIREMENTSDetector:UV 220 nm•P ACKAGING AND S TORAGE : Preserve in tight, light-resistant Column:4.6-mm × 25-cm; 5-µm packing L7containers, and store at controlled room temperature.Column temperature:35°•USP R EFERENCE S TANDARDS 〈11〉Flow rate:1.5mL/min USP Olanzapine RSInjection volume:20µL USP Olanzapine Related Compound A RS System suitability5-Methyl-2-((2-nitrophenyl)amino)-Samples:System suitability solution , Standard solution ,3-thiophenecarbonitrile.and Sensitivity solution C 12H 9N 3O 2SSuitability requirementsUSP Olanzapine Related Compound B RSResolution:NLT 3.0 between olanzapine and2-Methyl-10H -thieno-[2,3-b ][1,5]benzodiazepin-4[5H ]-olanzapine related compound C, System suitability one.solutionC 12H 10N 2OSTailing factor:NMT 1.5 for the olanzapine peak, Sys-USP Olanzapine Related Compound C RStem suitability solution2-Methyl-4-(4-methylpiperazin-1-yl)-10H -benzo[b ]thieno Relative standard deviation:NMT 2.0%, Standard [2,3-e ][1,4]diazepine 4′-N -oxide.solutionC 17H 20N 4OS 328.43Signal-to-noise ratio:NLT 10, Sensitivity solution AnalysisSamples:Standard solution and Sample solutionCalculate the percentage of each impurity in the portion of Tablets taken:Olanzapine and Fluoxetine CapsulesResult = (r U /r S ) × (C S /C U ) × (1/F ) × 100DEFINITIONOlanzapine and Fluoxetine Capsules contain an amount of r U= peak response of each impurity from theolanzapine and fluoxetine hydrochloride equivalent to Sample solutionNLT 90.0% and NMT 110.0% each of the labeled r S = peak response from the Standard solution amount of olanzapine (C 17H 20N 4S) and fluoxetine C S = concentration of USP Olanzapine RS in the(C 17H 18F 3NO).Standard solution (µg/mL)C U = concentration of olanzapine in the SampleIDENTIFICATIONsolution (µg/mL)•The retention times of the major peaks in the Sample solu-F = relative response factor for each impurity listedtion correspond to those in the Standard solution , as ob-in Table 2tained in the Assay.Acceptance criteria:See Table 2.ASSAY•P ROCEDURETable 2Buffer:37mg/L of disodium ethylenediaminetetraace-Relative Relative Acceptance tate in water. Add 3.3mL of phosphoric acid, and ad-Retention Response Criteria,just with 50% sodium hydroxide to a pH of 2.5. Dis-Name TimeFactorNMT (%)solve 8.7g of sodium dodecyl sulfate in the resulting Olanzapine solution.lactam a0.26 1.00.50Mobile phase:Acetonitrile and Buffer (1:1)Olanzapine relat-•0.50•(RB 1-Standard solution:0.12mg/mL of USP Olanzapine RS ed compound B b 0.30 2.3Jul-2012)and 0.45mg/mL of USP Fluoxetine Hydrochloride RS in Olanzapine thio-Mobile phaselactam c0.34 1.00.50Sample solution:0.06–0.18mg/mL of olanzapine and 0.25-0.5mg/mL of fluoxetine in Mobile phase from a Olanzapine relat-counted number of Capsules ed compound C d 0.83v0.71v USP360.50Chromatographic systemOlanzapine1.0——(See Chromatography 〈621〉, System Suitability .)a (Z )-4-(4-Methylpiperazin-1-yl)-3-(2-oxopropylidene)-1H -benzo[b ][1,Mode:LC4]diazepin-2(3H )-one.Detector:UV 227 nmb 2-Methyl-10H -thieno-[2,3-b ][1,5] benzodiazepin-4[5H ]-one.Column:4.6-mm × 7.5-cm; 3.5-µm packing L7c (Z )-1-{4-(4-Methylpiperazin-1-yl)-2-thioxo-1H -benzo[b ][1,4]diazepin-Column temperature:40°3(2H )-ylidene}propan-2-one.d 2-Methyl-4-(4-methylpiperazin-1-yl)-10H -benzo[b ]thieno[2,3-e ][1,4]diazepine 4’-N -oxide.。
碘佛醇说明书

【药品名称】通用名称:碘佛醇注射液英文名称:Ioversol Injection汉语拼音:Dianfuchun Zhusheye【成份】本品主要成份为碘佛醇,其化学名称为5-[N-(2-羟乙基)羟乙酰胺基]-N,N'-双(2,3-二羟丙基)-2,4,6-三碘-1,3-苯二甲酰胺。
分子式:C18H24I3N3O9分子量:其辅料为氨基丁三醇和依地酸钙钠。
【性状】本品为无色至淡黄色的澄明液体。
【适应症】适用于(1)成人心血管系统的血管造影;适用范围包括脑动脉、冠状动脉、外周动脉、内脏和肾脏动脉造影、静脉造影、主动脉造影和左心室造影;(2)头部和体部CT增强扫描及静脉排泄性尿路造影;(3)儿童心血管造影、头部和体部CT增强扫描及静脉排泄性尿路造影。
【规格】50ml: (每1ml含320mg碘)。
【用法用量】一般原则对于所有放射摄影造影剂,应仅使用能满足造影要求的最低剂量。
较低剂量可以减少发生不良反应的可能性。
碘佛醇注射液剂量和浓度的选择应结合患者的具体情况,如年龄、体重、血管的大小、血流速度等,并需同时考虑到预期的病理学特征所需要的显影的程度和范围,待检的结构和部位,病变对患者的影响,所采用的设备和技术等。
在血管注入时,建议含碘造影剂的温度等于或接近体温。
如在注射过程中发生不良反应,应立即停止注射,直至反应消退。
注入碘佛醇注射液前后病人都应充分补足水份。
和其他造影剂一样,碘佛醇注射液不能与其他药物混合使用,因为可能产生化学不相容的情况。
在注射血管造影剂时必须符合无菌操作规定。
如果使用一次性器械,应注意认真清洗,以防止清洁剂残留的污染。
从容器内吸取造影剂必须在严格的无菌条件下进行并使用灭菌注射器和移液装置进行,移至其它输注系统中的造影剂必须马上使用。
非胃肠道使用的造影剂在使用前应检查是否有颗粒和变色。
如果有以上两种情况发生,则不应再继续使用。
碘佛醇注射液采用单次剂量包装,未用完部分应予丢弃。
一般血管造影采用任何放射影像技术都可以对心血管系统显影。
美国药典36版目录

固体的疏松密度和叩击密 度测定
色谱法 呈色与消色 溶解的完全性检查 总有机炭测定 水导电性测定 冻凝温度的测定 包转和贮藏要求 玻璃容器 塑料容器 附加包装构成 容器性能检测
用于无菌固体和液体溶剂 形式的单独单位容器和单 位剂量容器的重新分配
<691> 棉花
<695> <696> <698>
<55>
生物指示剂:耐受性能检 测
<61>
非无菌制品的微生物检 查:计数试验
<62>
非无菌制品的特定菌检查
<63>
支原体检测
<71>
无菌检测
生物学试验和检定
<81>
抗生素微生物检定
<85>
细菌内毒素检测
如大肠 杆菌、 金葡菌 、沙门 氏菌等
<87>
体外生物反应性试验
<88>
体内生物反应性试验
<90> <91> <92> <111> <115> <121> <123> <130> <151>
美国药典目录
检测和含量分析的一般要求
<1>
注射剂
<3>
局部和经皮的药物产品-产 品质量检测
<11>
USP对照标准品
检测和含量分析的仪器
<16>
自动分析方法
<17>
处方容器具标签
<21>
测温仪
碘造影剂过敏反应临床表现抢救流程及相关处理-医学资料

最大剂量为1 mg;(4)静脉注射糖皮质激素,在5~10
min后见效。多巴胺200 mg加入250 ml溶液,15~
30滴/min,静脉滴注,剂量视效果而定。(5)支气管
痉挛、喘鸣、哮喘急性发作时患者置于座位,面罩
吸氧,氨茶碱0.25 g静脉注射,肾上腺素0.1~0.3
mg静脉注射,必要时加量至1 mg烈呕吐、广泛性荨麻疹、头痛、
面部水肿、喉头水肿、轻度支气管痉挛或呼吸困难、心悸、心动过 速或心动过缓、轻度和暂时性低血压、腹痛。此类反应表现较危急 ,应立即停止注射造影剂。 处理方法:(1)吸氧,保持呼吸道通畅,患者平躺并保持新鲜空气 ,鼻导管给氧或面罩给氧。(2)抗过敏药,如非那根25 mg肌注,地 塞米松5~10 mg静滴。(3)对无高血压、心脏病、甲亢患者,用肾上 腺素0.25~0.50 mg皮下或肌内注射,危急时可稀释后缓慢静脉注 射,地塞米松10 mg静脉注射,可反复给药。(4)当血压下降合并心 动过缓(血管迷走神经反应)时,快速滴注血浆代用品500~1 000 ml,阿托品0.5~3.0 mg,静脉注射;异丙肾上腺素0.25~0.50 mg ,缓慢静脉注射。(5)出现呼吸困难,痉挛性咳嗽可用氨茶碱0.25 g 静脉注射(0.25~0.50 g/次,以50%葡萄糖溶液20~40 ml稀释后缓 慢静注,不得少于5 min注完;糖皮质激素250~500 mg泼尼松龙, 静脉注射,5~10 min后起效。(6)必要时可静脉给予安定10 mg以 镇静。(7)喉头水肿者用地塞米松5 mg,加肾上腺素1 mg作喉头喷 雾。(8)呼吸抑制时,给呼吸中枢兴奋剂,如尼克刹米(0.25~0.50 g/次,皮下或肌内间歇静注。
10 mg静脉注射。(6)喉头水肿出现可行气管插管或
大针头穿刺气管给氧,必要时将气管切开。(7)肺水
碘佛醇说明书

碘佛醇注射液【药品名称】通用名称:碘佛醇注射液英文名称:Ioversol Injection汉语拼音:Dianfuchun Zhusheye【成份】本品主要成份为碘佛醇,其化学名称为5-[N-(2-羟乙基)羟乙酰胺基]-N,N'-双(2,3-二羟丙基)-2,4,6-三碘-1,3-苯二甲酰胺。
分子式:C18H24I3N3O9分子量:其辅料为氨基丁三醇和依地酸钙钠。
【性状】本品为无色至淡黄色的澄明液体。
【适应症】适用于(1)成人心血管系统的血管造影;适用范围包括脑动脉、冠状动脉、外周动脉、内脏和肾脏动脉造影、静脉造影、主动脉造影和左心室造影;(2)头部和体部CT增强扫描及静脉排泄性尿路造影;(3)儿童心血管造影、头部和体部CT 增强扫描及静脉排泄性尿路造影。
【规格】50ml: (每1ml含320mg碘)100ml:(每1ml含320mg碘)【用法用量】一般原则对于所有放射摄影造影剂,应仅使用能满足造影要求的最低剂量。
较低剂量可以减少发生不良反应的可能性。
碘佛醇注射液剂量和浓度的选择应结合患者的具体情况,如年龄、体重、血管的大小、血流速度等,并需同时考虑到预期的病理学特征所需要的显影的程度和范围,待检的结构和部位,病变对患者的影响,所采用的设备和技术等。
在血管注入时,建议含碘造影剂的温度等于或接近体温。
如在注射过程中发生不良反应,应立即停止注射,直至反应消退。
注入碘佛醇注射液前后病人都应充分补足水份。
和其他造影剂一样,碘佛醇注射液不能与其他药物混合使用,因为可能产生化学不相容的情况。
在注射血管造影剂时必须符合无菌操作规定。
如果使用一次性器械,应注意认真清洗,以防止清洁剂残留的污染。
从容器内吸取造影剂必须在严格的无菌条件下进行并使用灭菌注射器和移液装置进行,移至其它输注系统中的造影剂必须马上使用。
非胃肠道使用的造影剂在使用前应检查是否有颗粒和变色。
如果有以上两种情况发生,则不应再继续使用。
碘佛醇注射液采用单次剂量包装,未用完部分应予丢弃。
西药19造影剂

第21章X线造影与诊断用药核准日期:20061222修改日期:20081013碘帕醇注射液【药物名称】通用名称:碘帕醇注射液商品名称:典比乐英文名称:Iopamidol injection【成份】本品主要成份为碘帕醇辅料:氨基丁三醇,依地酸钙钠,盐酸及注射用水【性状】本品为无色澄明液体。
【适应证】神经放射学:脊髓神经根造影术、脑池造影和脑室造影术。
血管造影术:脑动脉造影术、冠状动脉造影术、胸主动脉和腹主动脉造影术、心血管造影术、选择性内脏动脉造影术、周围动脉造影术和静脉造影术。
泌尿系统造影术:静脉尿路造影术。
CT检查中增强扫描。
关节造影术。
瘘道造影术。
数字减影血管造影术【规格】(1)9g(I)/30 ml/瓶(2)15 g(I)/50 ml/瓶(3)30 g(I)/100 ml/瓶(4)11.1 g(I)/30 ml/瓶(5)18.5 g(I)/50 ml/瓶(6)37 g(I)/100 ml/瓶【用法用量】根据不同的X线检查需要,选择不同的浓度与剂量。
神经放射学浓度(mg/ml)推荐剂量(ml)脊髓神经根造影200-300 5-15脑池和脑室造影200-300 5-15血管造影脑血管造影300 5-10(团注)冠状动脉造影370 8-15(团注)心血管造影370 1.0-1.2/公斤胸主动脉造影370 1.0-1.2/公斤腹主动脉造影370 1.0-1.2/公斤选择性内脏动脉造影300-370 取决于检查需要周围动脉造影300-370 40-50数字减影血管造影150-370 取决于检查需要静脉造影300 30-50尿路造影碘帕醇浓度为300-370毫克碘/毫升的典帕醇注射液(典比乐300-370)均可使用。
建议剂量为30至50毫升。
碘帕醇浓度370毫克碘/毫升因引起的渗透性利尿作用较低,特别适用于轻或中度肾功能不全者和新生儿。
甚至对严重肾功能不全者仍可获取有价值的肾造影。
其它诊断检查浓度(mg/ml)推荐剂量(ml)CT增强扫描300-370 0.5-2.0/公斤关节造影300 取决于检查需要瘘管造影300 取决于检查需要用于CT增强扫描,对比剂可静脉滴注或静脉滴注。
西药19造影剂

第21章X线造影与诊断用药核准日期:20061222修改日期:20081013碘帕醇注射液【药物名称】通用名称:碘帕醇注射液商品名称:典比乐英文名称:Iopamidol injection【成份】本品主要成份为碘帕醇辅料:氨基丁三醇,依地酸钙钠,盐酸及注射用水【性状】本品为无色澄明液体。
【适应证】神经放射学:脊髓神经根造影术、脑池造影和脑室造影术。
血管造影术:脑动脉造影术、冠状动脉造影术、胸主动脉和腹主动脉造影术、心血管造影术、选择性内脏动脉造影术、周围动脉造影术和静脉造影术。
泌尿系统造影术:静脉尿路造影术。
CT检查中增强扫描。
关节造影术。
瘘道造影术。
数字减影血管造影术【规格】(1)9g(I)/30 ml/瓶(2)15 g(I)/50 ml/瓶(3)30 g(I)/100 ml/瓶(4)11.1 g(I)/30 ml/瓶(5)18.5 g(I)/50 ml/瓶(6)37 g(I)/100 ml/瓶【用法用量】根据不同的X线检查需要,选择不同的浓度与剂量。
神经放射学浓度(mg/ml)推荐剂量(ml)脊髓神经根造影200-300 5-15脑池和脑室造影200-300 5-15血管造影脑血管造影300 5-10(团注)冠状动脉造影370 8-15(团注)心血管造影370 1.0-1.2/公斤胸主动脉造影370 1.0-1.2/公斤腹主动脉造影370 1.0-1.2/公斤选择性内脏动脉造影300-370 取决于检查需要周围动脉造影300-370 40-50数字减影血管造影150-370 取决于检查需要静脉造影300 30-50尿路造影碘帕醇浓度为300-370毫克碘/毫升的典帕醇注射液(典比乐300-370)均可使用。
建议剂量为30至50毫升。
碘帕醇浓度370毫克碘/毫升因引起的渗透性利尿作用较低,特别适用于轻或中度肾功能不全者和新生儿。
甚至对严重肾功能不全者仍可获取有价值的肾造影。
其它诊断检查浓度(mg/ml)推荐剂量(ml)CT增强扫描300-370 0.5-2.0/公斤关节造影300 取决于检查需要瘘管造影300 取决于检查需要用于CT增强扫描,对比剂可静脉滴注或静脉滴注。
