生物无机化学8第七章 锌酶
化学与生物学的交叉:生物无机化学

生物学和化学是两门紧密相关的科学,它们在许多领域有着深刻的交叉。
其中一个交叉学科就是生物无机化学,它探索和研究的是生物体内的无机物质及其与生物体活动之间的相互作用。
生物无机化学主要关注的是无机元素在生物体内的重要性以及它们在生命过程中的功能。
无机元素是构成生物体的重要成分之一,它们参与了生物体内的许多基本过程,例如能量转化、物质运输、信号传导等等。
生物无机化学通过研究这些无机元素的作用机制和相互作用,揭示了生物体内的复杂生物化学过程。
在生物无机化学中,金属元素是一个重要的研究对象。
金属元素在生物体内广泛存在,并且扮演着重要的角色。
例如,铁元素在血红蛋白中的存在使其能够运输氧气。
锌元素参与了许多酶的催化反应,起到了关键的作用。
钙元素则在神经传递和肌肉收缩中发挥着重要的功能。
这些金属元素与蛋白质以及其他生物分子之间的相互作用,决定了其在生物体内的生理功能。
不仅金属元素,在生物无机化学中还研究了其他一些无机物质的作用。
例如,硫化物在生物体内与铁元素结合形成铁硫簇,参与了一系列生化反应。
氧化物则在呼吸过程中发挥着重要的作用。
硝酸盐则是植物体内一种重要的氮源。
这些无机物质和生物体内的其他分子之间的相互作用,为生命的维持提供了必要的条件。
生物无机化学的研究方法包括许多化学和生物学的技术手段。
化学合成、光谱分析、电化学方法等是生物无机化学的常用技术手段。
同时,生物学的方法也被应用于生物无机化学的研究中。
例如,结构生物学的技术可以解析无机物质与生物大分子之间的空间结构,从而揭示其相互作用机制。
生物无机化学的研究对于理解生命的本质和其发生的机制具有重要意义。
它可以揭示生物体内许多关键过程的底层原理,为生物学和医学的发展提供重要的基础。
例如,通过对金属元素在神经细胞中的作用的研究,我们可以更好地理解神经递质的信号传导机制,并为相关疾病的治疗提供新的思路。
综上所述,生物无机化学是化学与生物学的交叉学科之一,研究了无机元素在生物体内的功能和相互作用。
化学中的生物无机化学知识点

化学中的生物无机化学知识点一、介绍生物无机化学是化学与生物学的交叉学科,研究化学在生物体内的应用及相关的生物化学过程。
本文将介绍几个重要的生物无机化学知识点。
二、生物无机离子1. 钠离子(Na+)和钾离子(K+)钠离子和钾离子是细胞内外的主要无机离子,维持细胞内外的离子平衡,调节细胞内外的渗透压,参与神经传导和肌肉收缩等生理功能。
2. 钙离子(Ca2+)钙离子是维持骨骼健康和骨代谢的关键离子,参与血液凝固、神经传递、肌肉收缩等生理过程。
3. 铁离子(Fe2+和Fe3+)铁离子是血红蛋白和肌红蛋白中的关键成分,参与氧气的运输和储存,是体内能量代谢的重要催化剂。
4. 锌离子(Zn2+)锌离子是近百个酶的辅助因子,参与体内各种物质的代谢、细胞分裂和免疫功能等。
三、生物无机化合物1. 水水是生物体内最重要的无机化合物,构成了生物体的主要组成部分,参与生物体内的代谢过程和维持生理平衡。
2. 磷酸磷酸在生物体内起着重要的催化、存储和能量转换的作用,是细胞内ATP(三磷酸腺苷)等重要物质的组成部分。
3. 含氮化合物生物体中的氨基酸、核苷酸和蛋白质等含氮化合物在生物体内具有重要的结构和功能作用。
四、生物矿物元素1. 钙(Ca)钙是骨骼和牙齿中最主要的矿物元素,对于维持骨骼的健康和生长发育至关重要。
2. 锌(Zn)锌是许多酶和蛋白质中的辅助成分,对于免疫系统的正常功能和维持皮肤的健康有重要影响。
3. 铜(Cu)铜是体内一些重要酶的组成部分,如铜锌超氧化物歧化酶,对维持生物体内氧化还原平衡具有重要作用。
4. 碘(I)碘是甲状腺激素的组成部分,对人体的正常生长和发育、代谢和神经系统的正常功能至关重要。
五、生物金属蛋白1. 血红蛋白和肌红蛋白血红蛋白和肌红蛋白是含有铁离子的生物金属蛋白,负责运输氧气和储存氧气。
2. 胰岛素胰岛素是含有锌离子的生物金属蛋白,调节血糖水平,参与糖代谢。
3. 细胞色素细胞色素是含有铁离子的生物金属蛋白,参与电子传递链中的电子转移。
生物无机化学8第七章 锌酶

核酸酶P1是一种含有三个锌离子的糖
蛋白,其分子质量约为36000 Da,其中碳 水化合物含量大约占17%,酶蛋白部分由
270个氨基酸残基组成,富含疏水氨基酸。
核酸酶P1的活性中心存在一个三锌结构,
其中两个Zn(II)通过一个天冬氨酸和一个水
分子桥联在一起,形成一个双核中心(Zn1、
Zn3)。Zn1-Zn3大约相距0.32 nm,而Zn2 -Zn1相距0.58 nm,Zn2-Zn3相距0.47 nm。 两个水分子(W2和W3)与Zn2配位,一个 水分子(W1)桥联Zn1和Zn3。
氨酸和一个天冬氨酸配位,而另一个锌离子 与一个组氨酸和两个天冬氨酸配位。
双核锌单元构成了碱性磷酸酯酶的催化
活性位点,直接与底物的末端磷酸根基团结
合。碱性磷酸酯酶的底物通常是一个单酯,
如硝基苯基磷酸酯。镁离子与三个氨基酸残
基和三个水分子配位,它似乎不直接参与催
化作用,而只是起到稳定酶结构的作用。
二、核酸酶P1
第一节 第二节
概述 锌肽酶
第三节
第四节
碳酸酐酶
核酸酶
第五节
第六节
锌指蛋白
锌与健康
第一节
一、锌的化学功能
概述
Zn2+在锌酶或锌蛋白中主要发挥催化和
结构调控功能:
1、直接催化功能,这是Zn2+在锌酶中发挥 的最重要的功能,Zn2+可以催化酯键、肽键 等底物的水解;
2、间接催化功能,Zn2+活化与之配位的水 分子去质子,由配位的氢氧根对底物进行亲 核进攻; 3、共催化功能,酶的每个亚基中含有两个 或三个Zn2+,其中一个发挥催化功能,而另 一个发挥活性调节功能;
Zif268蛋白的3个锌指均结合到DNA双
含锌酶pdf

展望
• 获得大量的羧肽酶:由于从动物组织中提 取的羧肽酶价格昂贵,如何通过借助基因 重组技术和生化工程的高密度发酵技术, 获得专一、纯度高的羧肽酶,对于拓展其 应用领域,具有重要的现实意义;
羧肽酶分类
• 丝氨酸羧肽酶 • 金属羧肽酶 • 半胱氨酸羧肽
丝氨酸羧肽酶
• 丝氨酸羧肽酶(SCP) 又称酸性羧肽酶,是一类真核生物蛋白水 解酶,亚基相对分子质量40000-7500,广 泛存在于真菌、高等植物和动物组织中。
• 由于位切点不同,丝氨酸羧肽酶又分为溶 酶体Pro-Xaa羧肽酶、丝氨酸D-Ala-Dala羧肽 酶、羧肽酶C、羧肽酶D。
1.多肽链进入活性部位, Arg145的侧链移动与带 负电的羧基端生成盐键
催化机理
羟基亲核进 攻羰基碳原 子,肽键断 裂
Tyr248的羟基给予被裂 开的肽键的-NH一个质 子
由于谷氨酸羰基端负电荷的静电 斥力与产物羧基端负电荷的静电 斥力,产物被驱出活性部位。
锌离子的作用
• 被裂解的肽键的羰基指向锌离子,锌离子 起吸电子的作用,使C=O键比正常的更为极 化,使羰基C原子更易接受亲核进攻
• 在动物、植物的组织器官中,羧肽酶发挥 着重要的生理功能,如胰腺羧肽酶A和B 可用于消化食物,羧肽酶M选择性地参与 肽类激素的加工,羧肽酶D和羧肽酶N参 与肽和蛋白质加工等。
羧肽酶的用途
• 医药领域 • 食品工业 • 胰岛素生产 • 多肽合成(生物工程) • 固定化的羧肽 • 早期胰腺癌的监测的血清标志
• 解析羧肽酶的生理作用:目前羧肽酶的应 用范围主要集中在医药和食品加工中,由 于酿酒酵母与人具有较高的同源性,如能 以酿酒酵母为研究模型,解析羧肽酶在人 体内生理作用,及如何影响疾病的发生发 展过程,以对疾病进行预防和治疗;
《无机化学》第8章

钴(Ⅲ)
Co3+ NH3 N 6
+2
溴化二(乙二胺)
④[Cu(en)2]Br2 合铜(Ⅱ) Cu2+ en N 4 +2
二、2、
① 六氯合铂(Ⅳ)酸 ② 硫酸四氨合铜(Ⅱ) ③ 四硫氰·二氨合钴(Ⅲ)酸铵 ④ 五羰基合铁 ⑤ 二氢氧化四氨合铜(Ⅱ) ⑥ 一氯化二氯·一水·三氨合钴(Ⅲ)
习题:
一、选择题。
(2)形成体:(中心离子或中心原子)
接受孤对电子的阳离子或原子 ①特点:具有接受孤对电子的空轨道 ②常见中心原子:过渡元素(特别是ⅧB族)
或具有高氧化态的P区非金属元素
③举例:
形成体 (中心离子或中心原子)
[Cu(NH3)4]2+ [Fe(CN)6]3[PtCl2(NH3)I2] [Fe(CO)5] [SiF6]2-
Cu2+ Fe3+ Pt4+ Fe原子 Si4+
(3)配位体和配位原子:
①配位体:(配体) 在配合物中,与中心离子(或原子)
相结合的分子或离子,称为配位体,简 称配体。 例如:
[Cu(NH3)4]SO4 配体: NH3
②配位原子: 在配体中,与中心离子(或原子)
相结合的原子,称为配位原子。
❀常见配位原子:X、O、S、N、C
一、指出下列配合物的配位原子和配位数:
配合物
[PtCl2(NH3)2]2+ [Fe(en)3] 3+ [Ag(NH3) 2] [Pt (NH3)6] 4+ [Cr Cl2 (en)2] 2+
配位原子 Cl、N
N N N Cl、N
配1、配合物的内界和外界以_离__子__键相结合。 2、配合物的配体和中心离子(或原子)以
第七章 含锌蛋白和含锌酶

第三节 碳酸酐酶, Carbonic anhydrase, CA
1940 年发现的第一个锌酶,也是最重要的锌酶。碳酸酐酶 是红细胞的主要蛋白质成分之一,在红细胞中的地位仅次于血 红蛋白。 碳酸酐酶广泛存在动物、植物及微生物中。人体内,在红 细胞、肺泡、破骨细胞、肾小管、脑、胰腺、胃粘膜、食管、 骨骼肌、视网膜及睫状体等几乎所有组织及细胞类型中,与人 体酸碱平衡、青光眼、骨质疏松症、癌症等多种生理或病理过 程密切相关, 多年来一直备受关注。 在没有催化剂的情况下 ,CO2 和 HCO3-的转换非常慢,而碳 酸酐酶的存在可以使CO2水合和脱水反应的速度分别加快13000 倍和 25000 倍。碳酸酐酶是已知金属酶中催化转换数最高的之 一。它可以在2ms内使95%得CO2转换为HCO3-,即: CO2 + H2O ↔ HCO3- + H+
第一节 概述 第二节 锌肽酶
第三节 第四节 第五节 第六节
碳酸酐酶
核酸酶
锌指蛋白
金属硫蛋白
A mechanism for phosphodiesterase catalysis
第一节 概述
水解酶( hydrolase ),六大酶类之一,催化水解反应的
酶;也可以说它们是一类特殊的转移酶,用水作为被转移 基团的受体。 A–B + H2O → A–OH + B–H 水解酶( hydrolase )是六大酶中研究得最多应用最广泛 的一类。根据水解键的类型分为肽酶 (peptidase) 、酯酶 (esterase)、糖苷酶(glycosidase)等多个亚类。 不少水解酶的活性与金属离子有关; 水解金属酶中很多与Zn2+有关,其次是Ca2+、Mg2+,还 有少数酶含Mn2+,Ni2+。 水解过程不发生电子转移,所以金属离子的氧化态在催化 过程中不变化。
化学与生命 第8章 含锌酶和含

第八章 含锌酶和含锌蛋白
Zn2+形式存在 (四配位) 咪唑氮原子、巯基硫原子、羧基氧原子 第一节 概述 一、锌的化学功能 1. 直接催化功能:肽键、酯键 2. 间接催化功能:活化水分子 3. 共催化功能:调节功能 4. 结构功能:锌指蛋白
催化:(配位水分子) ↔ 结构(氨基酸残基取代)
一、锌指蛋白的分类: 9大类: 表8.2。
二、与DNA、RNA的结合
• 锌指识别DNA • 三维结构确定 • 互补的的区域
第六节 金属硫蛋白
• 一、金属硫蛋白结构 • 单链蛋白质结构: 金属-巯基簇合物
二、金属硫蛋白的生物功能和调控
• 生物作用: 1. 参与微量元素的储存、运输和代谢以及 重金属的解毒作用 2. 自由基清除作用 3. 参与激素与发育过程的调节、增强机体 对各种应激的反应 4. 金属硫蛋白与金属代谢紊乱而引起的疾 病有关
• 调控作用: 1. 参与遗传物质的构成 2. 参与DNA的复制、转录 3. 结合蛋白形式发挥作用
二、小分子模型
满足的条件: 配合物的稳定性 溶液的pH值
第四节 核酸酶
ROPO(OH)OR’ + H2O ROPO(OH)2 + R’OH 一、碱性磷酸酯酶:2 Zn2+, Mg2+
• 二、磷酸酶P1:3 Zn2+: • 五配位: 三角双锥
温度、pH金属离子 和一些有机试剂
第五节 锌指蛋白
第二节 锌 肽 酶
一、羧肽酶、 300个氨基酸残基。 一个锌离子 催化蛋白质或多肽的羰基末断肽键的水解, 酯类水解
• 二、口耆 热菌蛋白酶 切断蛋白质分子中的肽链
第三节 碳酸酐酶
锌酶和超氧化物歧化酶

来源 大肠杆菌
酵母
猪肾 猪肾
生物学功能
碳酸单酯水解
果糖1,6-二磷酸酯 = 二羟丙酮磷酸酯 +甘油醛-3-磷酸酯
肽键水解
水解肽链N-末端
水解二肽
酶
醇脱 氢酶
谷氨酸 脱氢酶
苹果酸 脱氢酶
D-乳酸 细胞色 素还原
酶
分子量
80000 87000 1000000 40000 50000
酶分子中 含锌和辅 基的数目
蛋白质或肽C-末 端氨基酸的水解
羧肽酶B
36000
1Zn
哺乳动物胰脏 蛋白质或肽C-末
端氨基酸的水解
酶
碱性磷 酸酯酶 醛缩酶
分子量 89000 65000-75000
酶分子中 含锌和辅 基的数目
4Zn
1Zn
嗜热菌 蛋白酶 氨肽酶
二肽酶
35000 300000 47200
1Zn, 2Ca 4-6Zn 1Zn
活性中心空穴结构
广泛存在氢键网络
可分为疏水区与亲水区两部分
疏水区
*由疏水性侧链芳香环簇组成
*稳定活性中心 容纳非极性底物 亲水区
*存在少量水分子 *可通过氢键结构传递质子
碳酸酐酶的结构与性质
3. Co(II)碳酸酐酶的电子光谱特征 及其在水溶液中的结构
Zn2+ :3d10 无d-d电子跃迁吸收, 无磁性质
4Zn, 2NAD >2Zn, 2NAD
2-6Zn, 1NAD
1Zn, 1NAD
4-6Zn, 1FAD
来源
生物学功能
马肝 人肝
牛肝 牛心 酵母
R-CH2OH+NAD+ =
p-CHO+NADH+H+
锌依赖酶锌浓度-概述说明以及解释

锌依赖酶锌浓度-概述说明以及解释1.引言1.1 概述概述部分的内容可以按照以下方式编写:概述部分旨在介绍锌依赖酶锌浓度这个主题的背景和重要性。
随着对锌依赖酶的研究不断深入,科学家们逐渐认识到锌浓度对于锌依赖酶活性的调控起着至关重要的作用。
锌作为微量元素,对于生物体的正常生理功能起着重要的调节作用。
然而,过高或过低的锌浓度都会对生物体的健康产生不良影响。
在正常生理条件下,锌依赖酶在维持细胞正常代谢过程中起着重要的作用。
它们能够催化化学反应,并调节细胞内的信号传导。
不同类型的锌依赖酶对锌浓度的要求各不相同,一些锌依赖酶对锌具有较高的亲和力,而另一些则对锌浓度较高的要求较低。
当前的研究表明,锌浓度对锌依赖酶的活性有着直接的影响。
当锌浓度不足时,会导致锌依赖酶的功能受到限制,从而影响细胞正常的代谢与调节过程。
相反,当锌浓度过高时,也可能会引起反应的不平衡和异常活性,进而对细胞造成损害。
因此,研究锌依赖酶锌浓度的调节机制具有重要的生物意义和理论价值。
深入探究锌依赖酶锌浓度的调控机制,不仅可以帮助人们更好地理解锌元素的生理功效,还能为科学家们开发新型的治疗手段和药物提供理论依据。
在下文中,我们将详细探讨锌依赖酶锌浓度的定义和功能,以及锌浓度对锌依赖酶活性的影响。
同时,我们还将介绍锌浓度对锌依赖酶的重要性以及相关的调控机制。
通过这篇文章的阅读,读者将能够更深入地了解锌依赖酶锌浓度这一领域的最新研究进展。
1.2文章结构1.2 文章结构本文将就锌依赖酶锌浓度的相关研究进行探讨。
文章分为引言、正文和结论三个部分。
在引言部分,我们将首先对锌依赖酶和锌浓度的基本概念进行概述,介绍锌依赖酶在生物体中的重要性和功能。
同时,我们将说明本文的研究目的,即研究锌浓度对锌依赖酶活性的影响,并探究锌浓度调控这一机制。
接下来,在正文部分,我们将详细讨论锌依赖酶的定义和功能。
我们将介绍锌依赖酶在生物体中起到的关键作用,以及其与锌浓度之间的相互关系。
配位化学——锌酶(C9组)

19
图-6
碱性磷酸酯酶催化 第一步是锌-烷氧基负离子进攻酶-底物结合 形成的复合物(E·RO-PO32- )中的P原子,并在 Zn12+的作用下削弱与其配位的O和P之间的键,从 而使RO-离去,并形成磷酯-丝氨酸中间体,磷酸 酯水解完成第一步。 第二步由配位于Zn12+ 上的H2O脱去质子形成 的亲核基团锌-羟基负离子(Zn-hydroxide)进 攻磷酯-丝氨酸中间体,导致磷酯-丝氨酸之间的 O-P键断裂,从而生成无机磷酸根离子,完成第 二步水解。
5
图-1
碳酸酐酶及活性部位Zn2+周围的结构
(a)碳酸酐酶
(b)活性部位Zn2+周围的结构
6
Zn2+催化CO2水合的作用原理: 研究方法与手段: 锌酶一般为无色,难以用谱学方法对其深入研 究。采用化学方法将天然碳酸酐酶中的Zn2+用Co2+取 代,因为四配位高自旋的Co2+ 有与天然碳酸酐酶中 Zn2+相似的扭曲四面体的配位构型,而电子构型为d7 的Co2+有较为丰富的谱学性质。具体做法是先用化学 方 法 除 去 天 然 碳 酸 酐 酶 中 的 Zn2+ 得 到 脱 辅 基 蛋 白 (apo-protein),后者再与Co2+ 结合得到Co2+ 取代 的碳酸酐酶[Co2+-CA]。 碳酸酐酶CA
磷酸单酯的水 解 氧化醇成为醛
4
Ⅰ
碳酸酐酶
1933年发现,能够催化CO2的可逆水合,因而被 命 名 为 碳 酸 酐 酶 ( carbonic anhydrase , CA ) , 1940年确定其中含有Zn2+,并且证明Zn2+在该酶的催 化过程中不可缺少,广泛存在于绝大多数生物体内, 催化的反应为 CO2 + H2O HCO3- + H+ 酶存在,pH=9,25℃条件下,反应速率约为 106M/s;无酶时同条件下只有7.0×10-4M/s。由此 可见,碳酸酐酶中的Zn2+在催化CO2水合的反应中起 到的不可替代的作用。
7. 锌酶和钴酶

Bioinorganic Chemistry
Carboxypeptidase, CP
This enzyme is a digestive enzyme. It hydrolyses the peptide bond nearest to the terminal carbonyl group in polypeptide chains. The reaction occurs most readily if the carboxylterminal residue contains a bulky aliphatic or an aromatic side chain. Esters are also cleaved but by a different mechanism. Zn2+ binds three enzymatic groups (His-156, Glu-72 and His-69) and water. The structure of a complex of the enzyme with glycyl(氨基乙酰)-L-tyrosine has been (氨基乙酰) determined.
Bioinorganic Chemistry
Bioinorganic Chemistry
Arg145带正电的胍基向底物移动 带正电的胍基向底物移动0.2nm,Glu带正电的胍基向底物移动 , 270羧基阴离子移动 羧基阴离子移动0.2nm,Tyr-248酚羟基移动了 羧基阴离子移动 酚羟基移动了 1.2nm,从亲水分子表面移到底物肽链疏水区。 ,从亲水分子表面移到底物肽链疏水区。 原来与Zn配位的水分子被肽键的羧基氧取代, 原来与 配位的水分子被肽键的羧基氧取代, 配位的水分子被肽键的羧基氧取代 这些过程使水解肽链进入催化活性位置,活性中 这些过程使水解肽链进入催化活性位置, 心的酶蛋白的两个氨基酸即酪氨酸Tyr-284和谷 和谷 心的酶蛋白的两个氨基酸即酪氨酸 氨酸Glu-270起协同催化作用。 起协同催化作用。 氨酸 起协同催化作用
锌酶和超氧化物歧化酶

SOD的种类与性质
种类
CuZnSOD
存在部位
哺乳动物的组织 酵母 绿色植物等 通气厌氧性杆菌 大肠杆菌 鸡的肝脏线粒体 酵母杆菌
金属含量 2Cu2Zn 1Cu2Zn 1.4Mn 2.1Mn 4Mn 1Fe 1Fe
分子量 32000 33100 39500 80000 96000 38700 37400
或脂肪基的 脂肪基 L-氨基酸的肽键水解
羧肽酶A
单链蛋白 含307个氨基酸残基 1个Zn(II) M~34000
1. 结构 5 × 4.2 × 3.8 nm椭球体 Zn2+位于接近椭球表面的疏水沟槽中 Zn2+为活性部位 10个水分子被包围在酶结构中
Zn2+为四配位 高度畸变的 四面体 蛋白链中 水或底物 69, 196组氨酸 72谷氨酸 活性部位
(2) 溶液中的结构模型
Co(II)-HCAB在不同pH值下的 电子吸收光谱
*pH:9→6 两个长波长谱带消失 → 这两个吸收对pH极敏感 *λ=640nm 处吸收ε ~pH的变化曲线 相似于pka≈7.1弱酸的滴定曲线 弱酸 → 存在pka≈7.1的基团
许多大环Zn配合物中配位水的解离常数 pka7~8 配位水 Zn(II)-OH2 Zn(II)-OH- + H+ 键合羟基是比游离羟基 更强烈酶 SOD Superoxide Dismutase
SOD 是一类金属酶 1. 含Cu和Zn CuZn-SOD CuZn 主要存在于真核细胞的细胞浆中 2. 含Mn Mn-SOD Mn 存在于真核细胞的线粒体和原核细胞中 3. 含Fe Fe-SOD Fe 只存在于原核细胞中 毒物清除过程 2O2-+ 2H+ ·O2H2O2 + O2 H2O + 1/2O2
Zn酶

陈老师说的好像是Zn酶,郑老师题上的是碳酸酐酶,不过也是Zn的一种,也不知道具体是哪个,你们看看有印象就行。
呵呵。
陈:Zn酶在人体中有很多种,比如DNA聚合酶、RNA聚合酶、转录酶、羧肽酶氨基肽酶、碳酸酐酶等,锌在锌酶中有两个基本作用,分别是维持酶蛋白的三级或四级结构和构成酶的催化中心,后者是主要作用。
锌通常被3~4个氨基酸侧链和1个水分子以四面体结构配位,形成一个球状或棒状配位体。
1个锌离子可能形成多个锌配位体。
数个配位体组成锌催化中心,即酶的活性部位。
锌酶活性部位是酶进行催化反应的区域,其催化反应的功能单位是锌配位体。
锌配位体通过3种方式完成催化反应:离子化反应,极化反应和置换反应。
锌在这些反应中形成氢氧化锌或产生亲核基团或被底物置换而发挥催化作用。
郑:以碳酸酐酶为例,CO2 + H2O HCO3- + H+组成:碳酸酐酶相对分子量是30000,单一肽链组成,含一个Zn2+离子,酶蛋白含约260个氨基酸残基。
结构:在碳酸酐酶中Zn2+是活性中心,Zn(II)由三个组氨酸残基的咪唑氮原子和一个水分子或氢氧根离子配位,形成一个畸变的四面体结构。
结构与功能的关系:在配位原子附近的一个苏氨酸和一个谷氨酸组成一个氢键网络稳定His3Zn-OH结构,由两个缬氨酸、色氨酸和亮氨酸构成一个疏水口袋,能够结合底物CO2,是催化底物的预催化结合位点。
强大的氢键网状系统及疏水袋的存在能够增加酶分子中Zn2+链接的稳定性,很好地固定底物,加强与Zn2+ H2O/HO-对CO2的亲核能力。
碳酸酐酶主要生物功能是:1.在血液和其他组织中维持酸碱平衡。
2.帮助内组织排除二氧化碳。
3.确保以CO2和HCO3-为催化底物的酶保持适度的底物浓度。
第八章-含锌酶和含锌蛋白

金属激活酶
柠檬酸合成酶 丙酮酸激酶 丙酮酸羧化酶 精氨酸酶 磷酸水解酶 蛋白激酶 磷酯酶C 磷酯酶A2
金属 离子 K+ K+ Mg2+ Mn2+Zn2+ Mn2+ Mg2+ Mg2+Mn2+ Ca2+ Ca2+
一些酶含有机分子辅酶和金属离子
酶名称
细胞色素氧化酶 醇脱氢酶 黄嘌呤氧化酶 丁酰CoA脱氢酶 琥珀酸脱氢酶 NADH细胞色素还原酶 甲基丙二酰CoA异构酶
• Zn2+在碳酸酐酶中是活性中心。
一、碳酸酐酶的组成、结构和 功能
碳酸酐酶对于人和动物的呼吸作用极为重要。在 人与动物体内,由碳酸酐酶催化CO2和H2O合成HCO3-, 当HCO3-随血液循环到肺泡后,又由碳酸酐酶催化使它 解离为CO2排出体外。
CO2
+
H 2O
=
HCO3-
+
H+
羧肽酶
碳酸酐酶
醇脱氢酶
(2)、多位点亲和理论 (3)、诱导契合学说
Enzymes
• Active Site- the specific portion of an enzyme that attaches to the substrate • Substrate- the reactant on which an enzyme works
• 酯酶 作用于酯键, 使其水解为酸和醇 • 糖苷酶 作用于糖基化 合物,使糖苷键水解 • 醚酶 作用于醚键, 使其水解 • 肽酶 作用于肽键, 使其水解 • C-N酶 作用于其它C-N 键 • 酸酐酶 作用于酸酐 对肽酶及酯酶作一些介绍
1.肽酶
• 蛋白质为高分子物质,不能透过细胞膜, 必须水解成小分子才能被肠吸收。蛋白 质由各种肽酶催化,水解成小分子,被 肠吸收。
含锌金属酶

含锌金属酶是指那些在其活性中心含有一个或多个锌离子(Zn^2+)的酶。
这些酶在生物体中扮演着多种关键角色,包括催化反应、转录调控和信号传导等。
锌离子因其独特的化学性质,如对配体的高亲和力和灵活的配位几何,成为许多酶的必需辅因子。
以下是一些重要的含锌金属酶的例子:1. 碳酸酐酶(Carbonic anhydrase):这种酶催化二氧化碳(CO2)与水(H2O)之间的可逆反应,生成碳酸(H2CO3)。
它在维持酸碱平衡和产生生物所需的碳酸根离子中起重要作用。
2. 醇脱氢酶(Alcohol dehydrogenase):这类酶参与醇类化合物的氧化还原反应,例如乙醇到乙醛的转化。
3. DNA聚合酶(DNA polymerase):这是一类关键的酶,用于DNA复制和修复过程中的核苷酸聚合。
4. RNA聚合酶(RNA polymerase):这种酶负责转录DNA序列生成RNA分子。
5. 肽酶(Peptidase):这类酶能够切割肽键,从而降解蛋白质或多肽。
6. 超氧化物歧化酶(Superoxide dismutase, SOD):SOD是一种抗氧化酶,它催化超氧阴离子(O2^-)的歧化反应,将其转化为氧气(O2)和过氧化氢(H2O2),从而保护细胞不受自由基的损害。
7. 基质金属蛋白酶(Matrix metalloproteinases, MMPs):MMPs是一组能够降解细胞外基质组分的酶,对于组织重塑、伤口愈合和肿瘤转移等过程至关重要。
8. 锌指蛋白(Zinc finger proteins):虽然不是传统意义上的酶,但锌指蛋白在基因表达调控中起到关键作用,它们通过结合DNA或RNA来影响转录或翻译。
含锌金属酶中的锌离子通常与蛋白质的氨基酸残基(如半胱氨酸或组氨酸)形成配位键,这种结构对于酶的催化活性和稳定性至关重要。
由于锌在生物体内的不可替代性和其对健康的重要性,锌的摄入和代谢在营养学和医学研究中受到高度重视。
无机化学在生物催化中的应用

无机化学在生物催化中的应用随着人类科技的不断发展,对于充分利用化学的特性来促进生命体系中的化学反应,成为了人们探索的一个重要方向。
特别是在无机化学方面,自然界中丰富的元素和离子,以及它们的化合物在生物体内也扮演着重要角色。
因此,本文将探讨无机化学在生物催化中的应用,以及它们在促进生命体系中的作用。
一、锌离子在生物体中的应用锌(Zn)是一种重要的微量元素,而锌离子在生物体内多种生化反应中扮演重要角色,它们作为许多酶的辅助因子,可以调节酶的活性。
比如,锌离子是碳酸酐酶(carbonic anhydrase, CA)的重要组成部分。
该酶负责水合物质的分解(CO2和H2O),以及acid-base反应的催化作用。
在人体内,碳酸酐酶的催化作用非常重要,因为它使得CO2的运输和转化变得更加高效。
另外还有骨上钙含量的维持、蛋白质的合成、免疫系统的调节等重要作用,而这些作用都需要锌离子的参与。
锌离子还可以参与到DNA和RNA的合成和代谢过程中。
在DNA的螺旋结构中,锌离子可以稳定DNA结构并防止一些基元内部的反应。
而在RNA合成中,锌离子作为酶催化反应的辅助因子,也发挥了重要作用。
因此,锌离子在生物体内代谢和免疫系统的功能方面,扮演着重要的角色。
二、铜离子在氧化还原反应中的应用铜(Cu)也是一个重要的元素,它在生物体内的化学反应中,扮演着重要的催化作用。
尤其是在氧化还原反应中,铜离子的能力可以促进一些重要反应的发生。
比如,铜离子可以参与到细胞色素c氧化酶中的反应。
该酶通过促进氢离子和电子的转移,将免疫系统中的细胞色素c氧化,从而使得人体免疫系统的反应更加高效有力。
此外,铜离子也可以通过催化反应,在生命体系中起到重要作用。
比如,铜离子在人体内催化某些蛋白质的氧化,使之成为更加活性化的酶,从而促进更多的化学反应发生。
而这种酶的活性和稳定性,也可能深度影响细胞中许多的生化反应过程。
三、钙离子对于生命体系的作用钙(Ca)是人体内最丰富的元素之一,在人体内扮演着非常重要的角色。
生物无机化学8-金属水解酶

Ser102
NH
NH
PROBE ION Cobalt for Zinc Replacement
Practical Problems: The Zn2+ ion is d10 is “transparent” Enzyme cannot be probed by spectroscopic techniques such as UV-vis absorption or magnetic measurements. Practical Solution Substitute Zn(II) for Co(II) which is d7. The ionic radii are very similar. Co(II) can tolerate similar coordination environments. Can be done without disrupting the protein. Similar catalytic activities. This gives a complex with UV-vis sensitive to coordination geometry and effects of pH change on bound H2O.
N
NH
His370
HO N H H HN
Arg166
Asp 天冬氨酸 Arg 精氨酸 Ser 丝氨酸
H NH
Ser102
NH
Zinc polarises the substrate making it a better electrophile Asp-51 also coordinated to magnesium cation
O N H R' + H2O CO2H R
ZFN锌指核酸酶
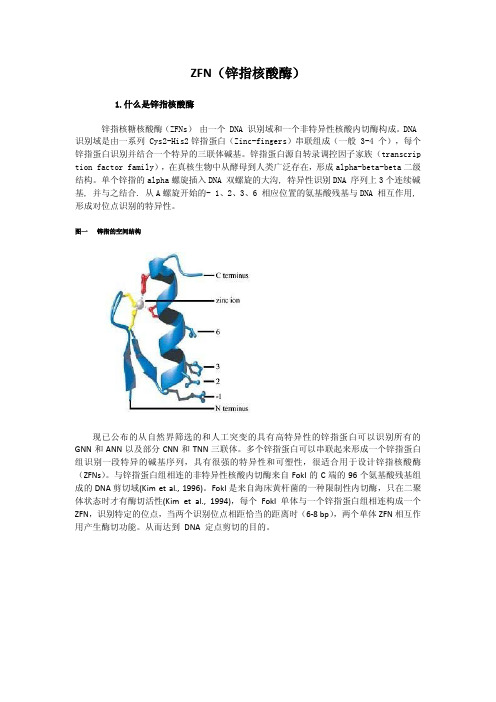
ZFN(锌指核酸酶)1.什么是锌指核酸酶锌指核糖核酸酶(ZFNs)由一个 DNA 识别域和一个非特异性核酸内切酶构成。
DNA 识别域是由一系列 Cys2-His2锌指蛋白(Zinc-fingers)串联组成(一般 3-4 个),每个锌指蛋白识别并结合一个特异的三联体碱基。
锌指蛋白源自转录调控因子家族(transcrip tion factor family),在真核生物中从酵母到人类广泛存在,形成alpha-beta-beta二级结构。
单个锌指的alpha螺旋插入DNA 双螺旋的大沟, 特异性识别DNA 序列上3个连续碱基, 并与之结合. 从A螺旋开始的- 1、2、3、6 相应位置的氨基酸残基与DNA 相互作用, 形成对位点识别的特异性。
图一锌指的空间结构现已公布的从自然界筛选的和人工突变的具有高特异性的锌指蛋白可以识别所有的GNN和ANN以及部分CNN和TNN三联体。
多个锌指蛋白可以串联起来形成一个锌指蛋白组识别一段特异的碱基序列,具有很强的特异性和可塑性,很适合用于设计锌指核酸酶(ZFNs)。
与锌指蛋白组相连的非特异性核酸内切酶来自FokI的C端的96个氨基酸残基组成的DNA剪切域(Kim et al., 1996)。
FokI是来自海床黄杆菌的一种限制性内切酶,只在二聚体状态时才有酶切活性(Kim et al., 1994),每个FokI单体与一个锌指蛋白组相连构成一个ZFN,识别特定的位点,当两个识别位点相距恰当的距离时(6-8 bp),两个单体ZFN相互作用产生酶切功能。
从而达到DNA 定点剪切的目的。
图2 ZFNs识别结合特异序列示意图2.锌指核酸酶有什么用ZFNs有助于建立完整的基因knockout和knock-in体细胞,胚胎细胞,原代细胞系,从而使研究者能更精确鉴定基因的生物功能。
ZFN介导的基因组编辑,有望用于产生新的能更接近地模仿人类疾病的疾病动物模型,以及为新的药物化合物潜在毒性提供更多真实数据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳酸酐酶中配位水分子的pKa值大约为 6.8,对催化功能至关重要,如果将水分子 从第四配位点取代,碳酸酐酶的催化活性 会受到抑制。常见的碳酸酐酶抑制剂包括 卤素离子、羧酸根、酚、醇、咪唑、羧酸 酰胺、硫酰胺、硫氰酸根等,这些分子或 离子能不同程度地抑制碳酸酐酶的催化活 性。
第四节
核酸酶
双链DNA中的磷酸二酯键极其稳定,
约含300个氨基酸残基,每个酶分子含有一
个Zn2+作为辅基。羧肽酶A主要催化蛋白质
或多肽的羰基末端肽键的水解反应。除了 脯氨酸之外,羧肽酶A能不同程度地催化具 有各种C末端氨基酸的肽链水解。此外,羧 肽酶A还能催化酯类水解。
X射线结构分析表明,羧肽酶分子呈椭
圆球形,在酶分子中部有一条狭长的空腔,
这是底物结合的位置。底物的C末端沿着这
第三节
碳酸酐酶
在没有催化剂的情况下,CO2和HCO3的转换非常慢,而碳酸酐酶的存在可以使二
氧化碳水合和脱水反应的速度分别加快
13000倍和25000倍。碳酸酐酶是已知金属酶 中催化转换数最高的酶之一,它可以在2 ms 内使95%的CO2转换为HCO3-,即 CO2 + H2O == HCO3- + H+
C为Cys 半胱氨酸 H为His 组氨酸
不同种属中典型锌指的数目和相邻锌
指间连接的长度有很大不同。锌指不仅可 结合于DNA和RNA,还能与DNA-RNA 杂交体和其他锌指蛋白结合,控制生物体 中蛋白的转录和翻译过程。
在锌指蛋白中,锌的地位是不可替代的, 只有锌指蛋白才具有选择结合核酸的能力, 脱锌或用铁、铜、锰、钴、镍等金属离子置 换锌离子都将可能丧失其功能。由于锌提供 的链间交联以及锌结合位点侧面保守的疏水 核使得锌指蛋白能够维持稳定的折叠成螺旋 结构体系。锌离子缺乏会导致锌指结构及其 生理活性丧失。
第五节
锌指蛋白
锌指蛋白是最重要的一类DNA结合蛋
白。一般锌指蛋白含有多个结构域,每个
结构域由30~50个氨基酸组成,并具有多
个半胱氨酸和多个组氨酸残基,它们与锌 离子配位形成类似于手指状结构,称为 “锌指”结构,含有锌指结构的蛋白称为 锌指蛋白。
近20年来,已发现10多种不同种类的
锌指结构,约占人类基因产物的1%。锌 指蛋白存在于动物、植物和真菌中。锌指 结构由多个半胱氨酸和(或)多个组氨酸 组成,通过锌离子形成四面体结构。
核酸酶P1是一种含有三个锌离子的糖
蛋白,其分子质量约为36000 Da,其中碳 水化合物含量大约占17%,酶蛋白部分由
270个氨基酸残基组成,富含疏水氨基酸。
核酸酶P1的活性中心存在一个三锌结构,
其中两个Zn(II)通过一个天冬氨酸和一个水
分子桥联在一起,形成一个双核中心(Zn1、
Zn3)。Zn1-Zn3大约相距0.32 nm,而Zn2 -Zn1相距0.58 nm,Zn2-Zn3相距0.47 nm。 两个水分子(W2和W3)与Zn2配位,一个 水分子(W1)桥联Zn1和Zn3。
所有三个Zn(II)在酶中均呈变形的三
角双锥五配位构型,其中单核Zn(II)部位
(Zn2)为酶的催化活性中心,而双核
Zn(II)部位(Zn1、Zn3)为酶的辅助催化 中心,起维持结构功能的作用。水分子 W2在催化过程中可能起亲核试剂的作用。
三锌活性中心处于核酸酶P1中一个
口袋形结构的附近,该结构只允许单链 的RNA或DNA进入,所以核酸酶P1只能 催化单链的核酸,对碱基没有特异性。
在25 ℃、pH为7.0的水溶液中,其半衰期
长达1011 a,因此磷酸二酯键的高度稳定
性被认为是核酸作为遗传物质的重要原因 之一。天然核酸酶能使磷酸二酯键水解速 度加快1012~1017倍: ROPO(OH)OR’ + H2O == ROPO(OH)2 + R’OH
一、碱性磷酸酯酶
碱性磷酸酯酶因为它在pH为8时活性
以通过设计锌指蛋白中的DNA结合区域来识
别特定的DNA序列,如特定基因的启动子序 列。设计的大部分锌指转录因子主要是C2H2 型,因为C2H2型锌指的序列适用于识别很大 范围的特异的DNA序列。
椭球形,分子中部有一个袋形空腔,深约
1.5 nm,腔口宽约2.0 nm,Zn2+就结合在这
个空腔底部。
在碳酸酐酶的活性中心,Zn(II)由三个 组氨酸残基的咪唑氮原子和一个水分子或氢 氧根离子配位,形成一个畸变的四面体结构。 在配位原子附近的一个苏氨酸和一个谷氨酸 组成一个氢键网络稳定His3Zn-OH结构,由 两个缬氨酸、色氨酸和亮氨酸构成一个疏水 口袋,其功能被认为是将CO2固定在该疏水 空腔内,使His3Zn-OH对CO2直接进行亲核 进攻。
2、参与对基因表达的调控。锌与遗传物质
的相互联系是以蛋白质为基础的,并从不同 层面对基因表达调控起作用。锌可以稳定染 色质的结构,锌可以对DNA的复制、转录进 行调控;
3、锌对细胞凋亡具有双重作用,既可以抑
制细胞凋亡,又能够诱导细胞凋亡。
三、锌酶
在六大类金属酶(氧化酶、转移酶、 水解酶、裂合酶、异构酶、合成酶)中, 都包含有含锌酶,但以水解酶为主。
碳酸酐酶广泛分布在动物的上皮细胞、
胃黏膜、胰腺、红细胞和中枢神经等组织中,
在植物、微生物体内也存在,是最早发现的
锌酶。碳酸酐酶在红细胞中的含量仅次于血
红蛋白。在哺乳动物的碳酸酐酶中,以人碳
酸酐酶II、III和牛碳酸酐酶II研究较多。
碳酸酐酶最重要的生理功能是催化二氧
化碳的水合作用。在人和动物体内,由碳酸
分子多肽。嗜热菌蛋白酶的肽链上有316个 氨基酸残基,含有一个Zn2+和四个Ca2+。分 子中部有一条口袋形空腔,Zn2+就位于这个 空腔内。
晶体结构表明,Zn2+处于四配位状态, 与两个组氨酸的咪唑氮原子、一个谷氨酸的 羧基氧原子及一个水分子配位,这与羧肽酶 A中Zn2+的配位状态十分相似。四个Ca2+中有 两个相距0.38 nm,另外两个则距离较远。嗜 热菌蛋白酶的热稳定性非常好,在80 ℃加热 一小时仍然保持一半活性,Ca2+是嗜热菌蛋 白酶具有较高热稳定性的因素之一。
锌指能识别DNA主要是由于它的三维
结构,锌指的DNA结合区域有着与DNA双 螺旋结构互补的特殊的表面结构,通常包 含一个α螺旋,能够与DNA的主要沟槽相 吻合。
一个具有代表性的例子是锌指蛋白
Zif268与DNA双螺旋的结合。Zif268蛋白含
有3个锌指结构单元,每一个锌指形成两个
β折叠和一个α螺旋,锌指之间由接头连接, β折叠和α螺旋以及接头内的氨基酸具有保 守性。3个锌指在蛋白内串联排列,并且具 有相同的跨度与间隔。
第一节 第二节
概述 锌肽酶
第三节
第四节
碳酸酐酶
核酸酶
第五节
第六节
锌指蛋白
锌与健康
第一节
一、锌的化学功能
概述
Zn2+在锌酶或锌蛋白中主要发挥催化和
结构调控功能:
1、直接催化功能,这是Zn2+在锌酶中发挥 的最重要的功能,Zn2+可以催化酯键、肽键 等底物的水解;
2、间接催化功能,Zn2+活化与之配位的水 分子去质子,由配位的氢氧根对底物进行亲 核进攻; 3、共催化功能,酶的每个亚基中含有两个 或三个Zn2+,其中一个发挥催化功能,而另 一个发挥活性调节功能;
核酸酶P1具有两种酶的活性:
一是磷酸二酯酶活性,作用于RNA或DNA
单链中的3’,5’-磷酸二酯键,生成5’,2-核苷
酸; 二是3’,2-磷酸单酯酶活性,分解单核苷酸 或寡聚核苷酸中的3’,2-磷酸单酯键。
影响核酸酶P1催化活性的因素很多,
主要有温度、pH、金属离子和一些有机试 剂。总的来说,核酸酶P1的稳定适用范围 比较广,是一种热稳定酶,在45~75℃都 有催化活性。核酸酶P1的最适合pH因底物 而异,一般在pH 5~8都有较强的活性,而 且与溶液中的离子种类和离子强度有关。
一、锌指蛋白的分类与结构特征
根据锌指结构序列和功能的不同
可以分为9大类。C2H2型锌指是目前研
究最多的锌指结构。
锌指蛋白有不同的分类方法,下图显
示的是根据锌指的空间结构不同所分成的 8组不同的折叠群。每一个锌指蛋白都应 该能够从中找到相应的归类,其中前三个 组群包含了大多数的锌指。
二、与DNA、RNA的结合
Zif268蛋白的3个锌指均结合到DNA双
螺旋的“大沟”内,通过氢键与核苷酸的
磷酸骨架结合包绕在DNA外围,而DNA的
构象介于B型与A型之间,大沟依旧较宽并 变深。由于一次螺旋运动可使一个锌指挪 动3个碱基,使得相邻锌指以此形式叠加, 从而导致相邻锌指间相隔3个碱基对的距离。
TF-IIIA是第一个被发现的不仅能与
第七章
含锌酶和含锌蛋白
锌是生物体中第二丰富的过渡金属,在
生物学中的重要性仅次于铁,在生物体内几
乎都以Zn2+形式存在。Zn2+具有较强的吸引
电子的能力,是强的Lewis酸,可广泛地与 蛋白质中的某些氨基酸残基的咪唑氮原子、 巯基硫原子、羧基氧原子等配位生成配位数 低的键合中心。
在生理条件下,Zn2+不会被氧化或还原, 能在生物介质中始终保持二价离子态。与其 他金属离子相比,Zn2+的毒性非常低,并且 生物体对Zn2+摄入、排出与体内分配的调节 机制非常有效,很少出现锌中毒现象。由于 锌具有独特的优越性,因此广泛地参与了蛋 白质、酶、核酸、糖类、脂类的代谢与基因 转录的调控等最基本、最重要的生化过程。
氨酸和一个天冬氨酸配位,而另一个锌离子 与一个组氨酸和两个天冬氨酸配位。
双核锌单元构成了碱性磷酸酯酶的催化
活性位点,直接与底物的末端磷酸根基团结
合。碱性磷酸酯酶的底物通常是一个单酯,
