有机A第三章立体化学
有机立体化学

S-对映体反应速度比R-对映体快,当反应进行过半时(例如 转化率60%)使反应停止,便获得高光学纯度的R-对映体和环 氧醇。反之,若用D-(-)-DIPT,则获得S-对映体。
上述为经典动力学拆分,缺点为:
1、从起始外消旋原料出发,得到的光学纯产物最 大产量为 50%。
2、回收底物和产物的对映体纯度及拆分反应的选 择性与时间有关,底物转化为产物的量越少,ee 值越低。
丁基锂,甲苯
-78度
CH3
H2C C
CO O Ph Ph Ph
乙烯聚合链形成手性环,可用于拆分醇、酯、胺等。
3)由手性联萘衍生的光活性冠醚
聚 苯 乙 烯 (硅胶)
CH3
H3C
O
O OO
O O
O
CH3
H3C
(可用于拆分一些氨基酸)
4) 抗体模拟聚合物
以双官能团交联剂与其它的带有官能团的单 体在以待拆分物的一个手性异构体为模板的 情况下共聚,所生成的手性聚合物在脱去模 板化合物之后即成为抗体模拟聚合物。
R
S
S
R SS
RR R SS
4.诱导不对称转化与优先结晶法结合
理论上外消旋体的拆分对于其中的每一 种对映体的最大得率不超过50 %,但如动力 学控制与构型转化同时进行,在适宜条件下 可获得高产率的拆分效果。该方法称为不对 称转化——优先结晶法。该法适于易消旋化 的化合物,阻转异构化合物及含三价杂原子 的化合物。
O
H OH
+
CH3 CH3
CH3 H3C
(-)-还原产物
动力学拆分的结果,一方面回收(-)-对映体,另一 方面生产对映体过量的(-)-还原产物。
动力学拆分的某些代表性例子: 1、手性仲醇(胺)的不对称酰化 2、手性仲醇的不对称氧化 3、 Sharpless不对称环氧化 4、不对称双羟基化法 5、手性催化剂控制下的动力学拆分
高等有机-3立体化学

CH2CH2CH2Br
H C CH3
CH2CH2Br
H3CH2CH2C
H
C OH
D
12
2.分子中含有一个四个键指向四面体四个顶点 的原子,若 四个基团不同就有旋光性。
16O
CH3
C6H5CH2 S C6H5 18O
C2H5 N C6H5 I CH2CH CH2
3. 棱锥结构的分子中,若中心原子与三个不同的
• 适用范围:外消旋混合物 • 优点:将该法与重结晶等其他方法合用可获
得较好的分离效果
43
实际工作中有时多余的S型还要进行消旋化,使 产物重复回到外消旋混合物状态后再次进行诱导晶种 分离。 例: 合霉素中分离氯霉素。方法经济.
(±)-氯霉素 + D-氯霉素
100g
1g
80℃ 溶于100 ml水中
冷却 至20℃
H
C H3 H
H C H3
18
NO2 NO2
COOH COOH
ac
NO2 NO2 COOHCOOH
bd
(1) No rotation found when a+c or b+d > 0.29 nm (2) rotation difficult when a+c or b+d 0.29 nm (3) rotation easy when a+c or b+d < 0.29 nm
E
H2C
H2 N
F
F
C
Co
H2C
D F
N H2
H2N H2N
CH2
C H2
顺二氟双(乙二胺)钴(III)
17
6.含手性轴的分子
立体化学基础.
丙 丙 异构
二,对映异构体和手性分子 (一)对映异构体和手性分子
下图为一对互为镜像关系的乳酸分子的立体结构式(透视式 : 下图为一对互为镜像关系的乳酸分子的立体结构式 透视式): 透视式
镜子 C2OH C HO H CH3
a
C2OH H C CH3 OH
b
a和b互为镜像的一对乳酸分子 实线代表位于纸平面上的键; 实线代表位于纸平面上的键; 虚线… 代表伸向纸平面后面的键, 虚线… 代表伸向纸平面后面的键, 楔形线代表伸向纸平面前方的键
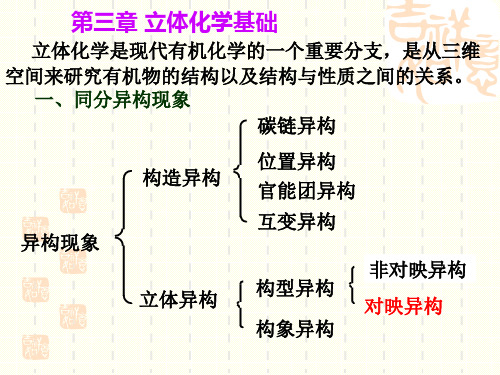
第三章 立体化学基础
立体化学是现代有机化学的一个重要分支, 立体化学是现代有机化学的一个重要分支,是从三 维空间来研究有机物的结构以及结构与性质之间的关系. 维空间来研究有机物的结构以及结构与性质之间的关系. 一,同分异构现象 碳 链异 构
构 造异 构 异 构现 象 立 丙异 构
位 置异 构 官 能团 异构 互 变异 构 构 丙 异构 构 象 异构
12
可用不同的方法表示同一立体异构体的立体结构 三羟基丁醛: 例:2R, 3S-2, 3, 4-三羟基丁醛: 三羟基丁醛
CHO H OH HO H CH2OH HO H HOH OH CHO H CH2OH OHC CH2OH H OH
Fischer投影式 投影式
锯架式
Newman投影式 投影式
13
-CH3 < -CH2CH3 < -CH2CH2CH3 < -CH(CH3)2
H3C C2H5 H OH
-OH >-CH2CH3 >-CH3 > H
R-2-丁醇 丁醇
18
(3)若手性碳连有含重键的基团时,则可看 若手性碳连有含重键的基团时, 作多次与同一原子相连.例如: 作多次与同一原子相连.例如:
第三章 立体化学

立体化学
Stereochemistry
主要内容
• 一、手性和手性分子
• 二、含不对称碳原子的分子的立体化学
• 三、不含不对称碳原子的分子的立体化学
• 四、 构象与构象分析
• 五、 立体化学的应用
构造 (Constitution)
官能团异构 碳骨架异构 官能团位置异构
互变异构
分子式相同,原子 的成键顺序不同。
二、含不对称碳原子的分子的立体化学
1、具有一个手性中心的对应异构体
对映异构体的构型和描述
注意:分子的旋光度符号和构型(D,L)之间没 有简单的关系。不是都象甘油醛那样D-是右旋, L-是左旋;例如,L-丙氨酸这个氨基酸是右旋的。
2、具有两个手性中心的对应异构体
例如:
旋光异构体的数目
三、不含不对称碳原子的光活异构体
1.丙二烯型的旋光异构体 (A)两个双键相连
实例:a=苯基,b=萘基,1935年拆分。
(B)一个双键与一个环相连(1909年拆分)
H H3C
COOH H
H CH3
H C CH3
(C)螺环形
H H3C
NH2 H
H COOH
NH2 H
2. 联苯型的旋光异构体
X1 X2
3. 对动态反应选择性的影响
立体专一反应和立体选择反应 • 立体专一反应是指:在相同的反应条件下, 由立体异构的起始物得出立体异构的不同产 物。 • 立体选择性反应是指:在特定反应中,单一 一种反应物能够形成两种或更多种立体异构 产物,但观察到的是其中一种异构体的形成 占优势。
某些立体专一反应
对烯的立体专一加成反应:
5 6 3 4 2 1
0.18nm 4 5 6 1
有机化学第三章立体化学

HO Cl COOH H H COOH ( I ) (2R,3R)
2-羟基-3-氯丁二酸总共有几种立体异构体?
COOH H HO Cl H COOH (I) (2R,3R)
COOH H OH H Cl COOH I) (I (2S,3S)
COOH H HO H Cl COOH I I) (I (2R,3S)
COOH C H CH3 镜象
分子式和构造相同:
C3H6O3
CH3CHCOOH OH
Locating a Stereocenter (Chiral Carbon)
标出手性碳
H N
*
CH 2 CH 2
CH 3
毒芹碱
判断下列化合物是否有手性碳? 是否是手性分子?
有两个手性碳却不是手性分子!
含一个手性碳原子的分子一定是个手性分子。 含多个手性碳原子的分子不一定是个手性分子.
标记: H
OH CH3 (a)
C
根据次序规则:OH>COOH>CH3>H
直接从Fischer投影式判断R/S构型
概括地说:“横变竖不变”
补充:各构型式间转换: (1)透视式或纽曼投影式改写成费歇尔投影式时,先把交叉式构象 旋转成重叠式构象,然后按投影要求写出相应的费歇尔投影式。 (2)判断每一个手性碳的R,S构型。
有旋光性的必要条件。
对映异构体
--互为实物与镜象的两个构型异构体.又称对 映体。它们构造相同。互相对映却不能叠合。
COOH H3C OH H 实物 C HO 镜子
COOH C CH3 H 镜象
乳酸分子的一对对映体
不对称碳原子
——与四个不同的原子或原子团相连的碳原子。 用“ * ”号标出。又叫手性碳。 例 手性碳
高等有机化学课件3-第三章 立体化学

NO2 CO2H
NO2 CO2H
有对称面(能同镜影分子重选),非手性。
NO2 CO2H
CO2H NO2
CO2H NO2
NO2 CO2H
手性分子
6
Br Br 6'
Br
Br
2' 2 Cl Cl
Cl
Cl
(R)-2,2’-二氯-6,6’-二溴联苯
(R)-2,2’-dibromo-6,6’-dichlorobiphenyl
构型异构: 顺反异构: H
Cl CH3 Cl H
COOH H OH CH3 HO
CH3 H
COOH H CH3
H
对映异构:
D-(-)-乳酸 mp: 52.8° 非对映异构: H
H COOH OH OH CH3
L-(+)-乳酸
COOH H HO OH H CH3
构象异构:
H H
CH3 H H CH3
V U X
R R
V W Z W Z
S S
V
V W X W X
S R
U X
U Z
R S
U Z
Y (A)
Y ( B)
Y (C)
Y ( D)
A和B(C和D)为对映异构体,A和C或者D(B和 C或者D)为非对映异构体。
• 对映异构体之间有相同的性质(除了对偏 振光和手性环境),然而非对映异构体具 有不同的熔点、沸点、溶解度、反应性等 物理、化学及光谱性质。 • 多手性中心的分子最多具有2n个异构体(n =分子中手性中心数),但有时分子内存 在着对称面,这时异构体数减少。
今有两试管分别置入(-)乳酸和(+)乳酸,我 们如何知道它们的构型?
有机化学第三章立体化学详解演示文稿

缩短一个C接到相应缩短后的碳链上:
C C C C C C 2 C C C C C C3
C
C
C CCCC 9
CC
CCCC 同4
CCC
缩短二个C接到相应缩短后的碳链上:
C
C C C C 同3
CCC
C C C C C4 C C C C C 5C C C C C 6
CC
CC
C
C C C C 同4 CCC
C
C C C C C8
E标记。在命名时,将Z,E放到括弧中,写在名称前面。
H
CH3
CC
C2H5
Cl
(Z)-2-氯-2-戊烯
H
Cl
CC
C2H5
CH3
(E)-2-氯-2-戊烯
第9页,共63页。
分子中有一个以上双键时,分别判断每个双键是Z还是E, 命名时低位号者写在前,高位号者写在后,中间用逗号隔 开,放到括弧中,写在名称之前。
为同一化合物
CH3 HO 2 H
H 3 OH
C2H5 I
OH
H2
CH3
和
HO 3
C2H5
H
II
用基团交换法(C2和C3都要交换)
CH3 HO 2 H
H 3 OH
C2 CH3与OH 交换 1 次
OH
2
H3C
H
H 3 OH
C2 CH3与H 交换 2 次
C2H5 I
C2H5 I 的非对映异构体
(接下页)
如:-CH2CH3 > -CH3 -CH2Cl > -CH2F
-CH2OCH3 > -CH2OH -CH(CH3)2 > -CH2CH(CH3)2
有机化学中的立体化学

有机化学中的立体化学立体化学是有机化学中的重要分支,研究有机化合物中分子的空间结构和立体构型的相关规律。
随着分析仪器和实验技术的发展,立体化学在有机合成和药物研发等领域中具有重要的应用价值。
一、立体化学的基本概念立体化学关注有机分子中的空间结构和分子的各个部分的排列方式。
在立体化学中,我们关注的主要是手性和立体异构体。
1. 手性:手性是指一个分子无法与其镜像重叠的特性。
具有手性的分子称为手性分子,两个互为镜像的手性分子称为对映异构体。
例如,氨基酸和糖类等有机分子都有手性。
2. 立体异构体:立体异构体是指拥有相同分子式但不同立体结构的化合物。
立体异构体分为构象异构体和对映异构体两种。
构象异构体是由于分子的旋转或扭曲而产生的不同构型,它们在空间结构上有一定的自由度。
例如,环状化合物的立体异构体就是构象异构体,如环己烷的椅式和船式异构体。
对映异构体是由于分子的立体中心存在不对称而产生的异构体。
对映异构体在物理和化学性质上通常非常相似,但与其他对映异构体之间的相互作用却往往存在巨大差异。
拥有对映异构体的有机分子是手性分子,也是立体化学中研究的重点。
二、立体化学的研究方法立体化学的研究方法主要包括实验方法和理论方法。
实验方法主要包括X射线衍射、核磁共振(NMR)光谱、圆二色光谱、旋光度测量和质谱等技术。
这些技术通过测量和分析分子的物理性质来确定其立体结构,为揭示分子构形提供了重要的实验依据。
理论方法主要包括量子化学、分子力学和分子动力学等。
量子化学通过计算分子在不同构型下的能量和性质来预测和解释分子的立体结构、反应机理和性质。
分子力学和分子动力学通过计算机模拟方法模拟和预测分子的构型和动态行为。
三、立体化学的应用立体化学广泛应用于有机合成、药物研发和生物化学等领域,并取得了重要的研究成果。
1. 有机合成:立体化学对于有机合成的研究具有重要的指导意义。
在合成有机化合物的过程中,了解分子的立体结构能够预测和解释反应的立体选择性和对称性。
第三章 立体化学讲解

优势构象
叔丁基是一个很大的基团,一般占据e键。
某些取代环己烷,张力特别大时,环 己烷的椅式构象会发生变形,甚至会 转变为船式构象
CH3
H
H3C
CH3
C
H
C(CH3)3 C(CH3)3
C(CH3)3 H
椅式
船式 优势构象
一般对优势构象的讨论,只是从取代 基的体积影响进行分析,对于烷基这类基 团来说是正确的。但有时非键合原子间的 其它作用力 如偶极-偶极间的电效应也会 影响分子的构象稳定性。
109o28'
60o
105o
3.3.1Baeyer张力学说
当碳原子的键角偏离109°28′时,便会产生一种 恢复正常键角的力量。这种力就称为张力。键角偏离 正常键角越多,张力就越大。
偏转角度=
109°28′内角
2
N=3 4 5 6 7
偏转角度
24o44’ 9o44’ 44’ -5o16’ -9o33’
…… n个C*
…………
AB+ B-
C+ C- C+ C-
D+D- D+D-D+D-D+D-
…………
2 4
8 16 …… 2n
例如: 一个C* 二个C* 三个C*
R\S RR\SS RS\SR RRR\SSS RRS\SRR RSR\SRS RSS\RRS
(2)非对映体
不呈镜影关系的旋光异构体为非对映异构体。非对映体具有不 同的旋光性,不同的物理性质和不同的化学性质。
立体异构体的定义:分子中的原子或原子团互相连接的 次序相同,但在空 间的排列方向不同而引起的异构体。
3.1 轨道的杂化和碳原子价键的方向性
高等有机化学第三章立体化学

contents
目录
• 立体化学基本概念 • 碳原子立体化学 • 手性分子结构与性质 • 立体化学在有机合成中应用 • 立体化学在药物设计中的应用 • 实验方法与技巧
01
立体化学基本概念
立体异构现象
立体异构体
分子式相同,但空间排列不同的化合 物,具有不同的物理和化学性质。
碳原子手性判断
对称面与对称中心
若一个分子中存在一个对称面或对称中心,则该分子不具有旋光性。对称面是指能将分子分为两个互为镜像的部 分的平面;对称中心是指能将分子中任意一点与另一点重合的点。
潜手性与非对映异构体
潜手性是指分子中某些基团可以围绕单键旋转而产生手性的现象。非对映异构体是指具有相同分子式、不同结构 且不能通过旋转操作相互转化的立体异构体。
感谢观看
。
化学性质差异
手性分子在化学反应中可能表 现出不同的反应速率和选择性
。
生物活性差异
许多生物活性物质都是手性的 ,其生物活性与手性密切相关 ,不同手性分子的生物活性可
能存在显著差异。
手性识别与拆分方法
手性识别
通过对手性分子的结构和性质进行分析,确定其手性特征。常见的方法包括X射线晶体学、圆二色光 谱、核磁共振等。
构型与构象
构型
分子中原子或基团在空间中的相 对位置关系,是固定的空间排列
。
构象
由于单键旋转而产生的不同空间排 列,是动态的空间排列。
构型与构象的关系
构型是构象的基础,构象是构型的 动态表现。不同的构型可能产生不 同的构象,而同一构型也可能产生 多种不同的构象。
02
碳原子立体化学
碳原子杂化类型
sp杂化
03
高等有机第三章++立体化学

马来酸
HOOC
H
富马酸
催化剂或光都有可能引发顺反异构体的转变
H
COOH
H
COOH
催化量HCl或HBr
或紫外光
H
COOH
HOOC
H
HCOOEtFra bibliotekHI2
H
COOEt
EtOOC
COOEt H
4.4 C=N和N=N双键的顺反异构 N原子上的孤电子对相当于一个最小的基团。
H
CN
Me
OH
(Z) - 乙醛肟
H
OH
的对映体,则Ha和Hb是异位的(heterotopic),他们不能通
过C2 轴互换,但是可以由对称面反映,互换位置。因此称为 对映异位配体(enantiotopic).
OH
OH
OH
DC Hb
CH 2CH 2OH
Ha C Hb
CH 2CH 2OH
Ha C D
CH 2CH 2OH
S-
R-
将两个对映异位配体,如Ha和Hb,其中任一个用其它基团 取代,产生新的手性中心,得到一对对映体。则对映异位配 体所连碳原子称为前手性中心。
P512习题 21.2
3、对称中心 (i):center of symmetry
Ph COOH HH H F COOH Ph
Cl C
H
H C
Cl
具有对称中心的分 子是对称分子。非 手性分子。
P513习题 21.3
4、交替对称轴 (Sn):alternating axis of
symmetry
第三章
立体化学
构造异构
分子式相 同,原子
碳骨架异构
官能团异构 官能团位置异构
有机化学基础知识点立体化学的基本概念

有机化学基础知识点立体化学的基本概念立体化学是有机化学中非常重要的一个概念,它涉及到分子的空间结构和构象。
在有机化学反应中,分子的立体构型对反应的速率和产物的选择性有着重要的影响。
本文将介绍立体化学的基本概念,包括立体异构、手性分子、构象等知识点。
1. 立体异构立体异构是指化学物质的分子在空间中的排列方式不同,从而导致其化学性质与物理性质的差异。
立体异构可以分为构造异构和空间异构两种类型。
1.1 构造异构构造异构是指分子结构的连接方式不同,分为链式异构、官能团异构和位置异构三种类型。
链式异构:同分子式下,碳骨架的排列方式不同,如正丁烷和异丁烷就是一对链式异构体。
官能团异构:同分子式下,分子中的官能团位置不同,如乙醇和甲醚就是一对官能团异构体。
位置异构:同分子式下,官能团位置相对于主链排列的位置不同,如2-丁醇和3-丁醇就是一对位置异构体。
1.2 空间异构空间异构是指分子在空间中的三维排列方式不同,分为立体异构和对映异构两种类型。
立体异构:分子中存在非自由旋转的键,由于旋转受限,使得分子结构不同,如顺式-反式异构。
对映异构:对称分子具有镜像关系,不能通过旋转重叠,如手性分子。
2. 手性分子手性分子是指与其镜像物不可重叠的化合物,也称为不对称分子。
手性分子通常包含一个或多个手性中心,手性中心是一个碳原子,与四个不同的基团连接。
手性分子的最重要特征是其对映异构体的存在。
对映异构体具有相同的分子式、相同的化学键,但是无法通过旋转或平移重叠。
这种现象称为手性体。
手性分子有很多实际应用,如生物活性物质、药物、拆分光等。
同时,手性分子还涉及到光学活性、旋光度等概念。
3. 构象构象是指分子在空间中的不同取向,由于化学键的旋转、振动等运动而引起的。
构象是立体化学中的重要概念之一,它与立体异构密切相关。
分子的构象由于化学键的自由旋转而产生,通常与键长、键角、键的取代基团等因素有关。
构象的改变可能会导致分子性能的变化。
有机化学第三章立体化学基础(2024)

手性药物的合成。手性药物是指具有手性中心的药物分子。在合成手性药物时,需要利用 立体化学原理来控制产物的立体构型。例如,通过引入手性辅剂或利用不对称催化等方法 ,可以实现手性药物的高效合成。
22
06
2024/1/25
立体化学在药物设计中的重要性
23
药物活性与手性关系
手性对药物活性的影响
手性药物的两个对映异构体可能具有 不同的生物活性,其中一个可能具有 治疗效果,而另一个可能无效或有毒 。
手性中心判断方法
7
2024/1/25
03
观察碳原子连接的四个基团或 原子是否相同,若不相同则为 手性中心。
04
使用Cahn-Ingold-Prelog规则 (CIP规则)进行判断。
9
手性分子表示方法
2024/1/25
Fischer投影式
01
将碳链竖直表示,横前竖后,横向基团朝右,纵向基团朝上。
透视式
一个物体不能通过旋转和平移操作与其镜 像完全重合的性质。
对称性的定义
一个物体可以通过旋转和平移操作与其镜 像完全重合的性质。
手性与对称性的关系
手性是对称性的一个特例,即没有对称中 心或对称面的物体具有手性。
手性在化学中的应用
手性化合物在生命体系中具有重要的作用 ,如氨基酸、糖类等。
5
构型与构象
构型的定义
02
将碳链放平,基团朝向观察者方向。
Newman投影式
03
沿碳-碳键的键轴方向观察,将碳原子和与之相连的基团放在纸
平面上,其他基团则竖立在纸平面上。
10
2024/1/25
03
对称性与对称操作
11
对称元素及类型
有机化学中的立体化学

有机化学中的立体化学引言立体化学是有机化学中的重要分支,研究有机化合物中空间结构的特征和影响。
通过对分子的空间构型和立体异构体的研究,不仅可以揭示分子性质和反应行为的规律,还可以为合成有机化合物提供理论指导。
本文将从立体化学的基本原理、立体异构体的分类和确定、立体化学对反应活性的影响以及实际应用领域等方面,对有机化学中的立体化学进行介绍。
一、立体化学的基本原理立体化学的基本原理主要涉及空间构型和立体异构体。
空间构型是指有机分子中各原子相对位置的排列方式,而立体异构体则是指在相同化学式下,分子结构不同但化学性质相似的化合物。
在理解立体化学的基本原理之前,先介绍几个重要的概念:1.手性:手性是立体化学中的重要概念,指的是一种非对称性质,分为左右手两种。
在有机分子中,手性常常体现为碳原子上的四个不同基团的排列方式。
2.手性中心:手性中心是指四个不同基团连接到一个碳原子上,使得该碳原子具有手性的特征。
手性中心的碳原子常常被表示为“*”符号。
3.对映异构体:对映异构体是立体异构体的一种,指的是具有相同化学式的分子,但其所有手性中心上的基团排列顺序完全相反。
在有机分子中,立体异构体主要通过手性中心的存在而产生。
而对于没有手性中心的分子,它们也可以存在立体异构体,但是不能形成对映异构体。
二、立体异构体的分类和确定立体异构体主要分为构象异构和配置异构。
构象异构指的是分子空间结构的不同,但它们可以通过旋转而互相转换,并且化学性质相似。
配置异构是指分子结构中存在手性中心,所以它们不可以通过旋转而互相转换。
1.构象异构体最常见的构象异构体是顺反异构体。
顺异构体是指两个取代基围绕于碳链的同一侧,而反异构体则是指两个取代基围绕于碳链的相对侧。
2.配置异构体配置异构体主要包括对映异构体和顺反异构体。
对映异构体是两个或多个手性中心构成的异构体,它们在空间构型上是镜像关系。
而顺反异构体则指的是有手性中心但不形成对映异构体的异构体。
第三章 立体化学

尼可尔棱镜
平面偏振光
平面偏振光的模型
旋光性与旋光性物质
装入水、或乙醇
光源 自然光 尼科尔 偏振光 样品管 尼科尔
偏振面不改变
偏振面发生偏转
装入葡萄糖水溶液
旋光性——物质使偏振光偏转面发生旋转的特性 ➢ 旋光 性 物 质 ——使偏振光偏转面发生旋转的物质 ➢ 非旋光性物质——不能使偏振光偏转面发生旋转的物质
构造 constitution 构型 configuration 构象 conformation
同分异构 isomerism
构造异构 constitutional
碳架异构 官能团异构 位置异构 互变异构
立体异构 Stereo-
构型异构
顺反异构
configurational 手性异构
构象异构
旋转异构
1902年获诺贝尔化学奖
In recognition of the extraordinary services he has rendered by his work on sugar and purine syntheses
埃米尔·费雪 Hermann Emil Fisher
1852~1919 Germany
COOH
H
OH
H
OH
COOH
COOH
H
OH
HO
H COOH
COOH
H *C OH
H C OH COOH
COOH
HO
H
H
OH
COOH
* H
OH
H
OH
COOH COOH
H
OH
COOH
H
OH
COOH
第二节 立体化学中的顺序规则
有机化学第三章立体化学基础

H
HO
CHO
C H2O H
R
H
HO
CHO
C H2O H
结论:当最小基团处于竖键位置时,其余三个基 团从大到小的顺序若为顺时针,其构型为R;反 之,构型为S。
判断基团大小的依据是我们已经熟悉的顺 序规则
OH
COOH
COOH
COOH
CH HOOC CH3
(S)-
CH
CH3
OH
(S)-
C H
HO CH3 (R)-
Cl
Cl
H
H
-
H
(二) 判别手性分子的依据
A.有对称面、对称中心、交替对称轴的分子均可 与其镜象重叠,是非手性分子;反之,为手性分子。
至于对称轴并不能作为分子是否具有手性的判据。
B.大多数非手性分子都有对称轴或对称中心, 只有交替对称轴而无对称面或对称中心的化合物是 少数。
∴既无对称面也没有对称中心的,一般 判定为是手性分子。
如果在两个棱镜之间放一个盛液管,里面装 入两种不同的物质。
亮
丙酸
α
暗
亮
乳酸
结论: 物质有两类:
(1)旋光性物质——能使偏振光振动面旋转的性质, 叫做旋光性;具有旋光性的物质,叫做旋光性物质。
(2)非旋光性物质——不具有旋光性的物质,叫做 非旋光性物质。
旋光性物质使偏振光旋转的角度,称为旋光度,
以“α”表示。
COOH
H CH3CH2 COOH
CH3
COOH H CH2CH3
CH3
CH3 H COOH
CH2CH3
S
S
S
S
试判断下列Fischer投影式中与(s)-2-甲基丁酸成对 映关系的有哪几个?
有机化学第三章-立体化学

顺 _1,2_二氯乙烯 Z _1,2_ 二氯乙烯
H
Cl
C=C
Cl
H
反_ 1,2 _ 二氯乙烯 E _1,2_ 二氯乙烯
3.顺 / 反标记法和Z/E标记法一致吗?
两种标记方法绝大多数情况下一致,即顺式 就是Z 式,反式就是E式。但有时却刚好相反。
H
COOH
C=C
CH3
CH3
顺 _ 2 _ 甲基 _ 2 _ 丁烯酸
合霉素 —— 外消旋体 已淘汰
手性药物 ——二十一世纪的宠儿
第五节 构象异构
构象异构产生的原因:
由于以σ键 连接的两个原子可以相对的自由旋转,
从而使分子中的原子或基团在空间有不同的排布方式。
2、每个双键或环上碳原子上连接两个不 同基团
顺反异构体的命名:
1. 顺/反构型标记法:
a
a
C=C
b
b
a
b
C=C
b
a
a
a
b
b
顺式 (cis_)
反式 (trans_ )
顺式 (cis_)
a
b
b
a
反式 (trans_ )
相同的原子或基团位于双键(或环平面)的同侧为 “顺式”;否则为“反式”。
2. Z /E构型标记法:
CH3 H Cl
C2H5
C2H5
旋转180°Cl
H
构型保持
CH3
旋转90°
C2H5
H CH3
Cl
构型改变
2 投影式不能离开纸面翻转。
3 投影式手性C原子上所连的原子或基 团,可以两—两相互交换偶数次,不能 交换奇数次。
CH3 H Cl
C2H5
有机化学第三章 立体化学

H C H3 CO O H C H3 H C H3 C H3 CO O H
C=C
C=C
_ _ _ _ 顺 2 甲基 2 丁烯酸 _ _ _ _ 2 甲基 2 丁烯酸 (E)
_ _ _ _ 反 2 甲基 2 丁烯酸 _ _ _ _ (Z) 2 甲基 2 丁烯酸
1、测得一个葡萄糖溶液的旋光角为+3.4°,而 葡萄糖的比旋光度为+ 52.7(°)· ml· g-1· dm-1,若 盛液管长度为1dm,计算出葡萄糖的浓度为
3.4 1 B 0.0646 ( g.m l ) m· l 52.7 1
同样也可通过已知旋光度物质的浓度而求得该 物质的比旋光度。
(-)-麻黄碱 (1R,2S)
2
1
H C OH H C NHCH3 CH3
(+)-麻黄碱 (1S,2R)
2
1
HO C H H C NHCH3 CH3
2
1
H C OH H3CHN C H CH3
(+)-伪麻黄碱
(1S,2S)
2
1
(-)-伪麻黄碱 (1R,2R)
说明:
1、n个不同C* , 产生 2n 个对映异构体
L-(-)-甘油醛
CHO HO H CH2OH
Br2/H2O
COOH HO H CH2OH
L-(-) -甘油醛
L-(+) -甘油酸
说明:D,L-构型与旋光方向无简单对应关系, 旋光方向是由旋光仪实际测得的。
(二) R、S 标记法
(序旋标记法)
1.排序:将四个基团按顺序规则排序,a>b>c>d。 2.定向:从最小基团d的对面进行观察,C-d键。
石河子大学大学有机化学第三章 立体化学

COOH HS HR CH3
H被OH取代 取代
COOH HO H CH3
S-(+)-乳酸 乳酸
COOH or H OH CH3
R-(-)-乳酸 乳酸
潜非对称分子 原手性分子) (原手性分子)
潜不对称碳原子(原手 潜不对称碳原子( 性碳原子) 性碳原子)
2.含两个或多个不对称碳原子的手性分子 含两个或多个不对称碳原子的手性分子 (1)旋光异构体的数目 ) (2)非对映体 ) (3)赤式和苏式 ) (4)差向异构体 )
1.含一个手性碳原子的化合物 含一个手性碳原子的化合物 (1)手性碳原子 ) (2)对映体 ) (3)外消旋体 ) (4)Fischer投影式 ) 投影式 (5)相对构型和绝对构型 ) (6)旋光度的表示(偏振光) )旋光度的表示(偏振光) (7)分子的潜非对称性 )
(1)手性碳原子(已讲) )手性碳原子(已讲) (2)对映体 )
pKa=3.79(25oC)
(R)-(-)-乳酸 乳酸 mp 53oC [α]D=-3.82 α 15
pKa=3.83(25oC)
特
*1 结构:镜影与实物关系 结构:
点
*2 内能:内能相同。 内能:内能相同。
*3 物理性质和化学性质在非手性环境中相同,在手性环境 物理性质和化学性质在非手性环境中相同, 中有区别。 中有区别。
(±)木糖 ± 木糖
3.含两个或多个相同(相象)手性碳原子的化合物 含两个或多个相同(相象) 含两个或多个相同 (1)假不对称碳原子 ) (2)内消旋体 )
(1) 假不对称碳原子
一个碳原子( ) 一个碳原子(A)若和两个相同取代的不对称碳原子 相连而且当这两个取代基构型相同时。该碳原子为 相连而且当这两个取代基构型相同时。 对称碳原子,而若这两个取代基构型不同时, 对称碳原子,而若这两个取代基构型不同时,则该 碳原子为不对称碳原子, 碳原子为不对称碳原子,则(A)为假不对称碳原子。 )为假不对称碳原子。
[化学]第三章立体化学
![[化学]第三章立体化学](https://img.taocdn.com/s3/m/709be4fddd3383c4ba4cd248.png)
H Cl
H
H
H
Cl
Cl
H
Cl Cl HH
具有二重对 H 称轴,有旋 Cl 光性
更替对称轴(Sn)
如果一个分子沿一根轴旋转了360°/n的角度以 后,再用一面垂直于该轴的镜象将分子反射,所得 的镜象如能与原物重合,此轴即为该分子的n重更替 对称轴(用Sn表示)。
如果旋转的角度为90°(360°/4),就称为四 重更替对称轴(S4)。 如:
(N) (C)
CN>
> C CH > CH CH2
练习:
1.
C H
CH2
H3C CH CH3
HC C
3
4
1
CH3CH2
CH3
H
CH3 C CH3 CH3
2
5
6
7
O
O
O
2.
OR OH
C OR
C NH2 C OH
12
3
5
4
CH2OH
6
第三节 顺反异构
定义:有机物分子中如具有双键或环的存在,键的自由旋 转会受到阻碍,当双键或环上连接不同的原子或基团时, 就会产生顺式和反式的结构,这种异构现象称为顺反异构
第三章 立体化学基础
Organic Stereochemistry
(一) 分子模型的平面表示方法 (二) 立体化学的顺序规则 (三) 顺反异构 (四) 对映异构 (五) 构象异构
有机化合物异构现象的关系:
构造异构 异构现象
立体异构
碳架异构 官能团位置异构 官能团异构 互变异构
顺反异构 构型异构
对映异构 构象异构
ρB: 质量浓度(g/ml) l: 盛液管的长度(分米) t: 测定时的温度
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
COOH C CH3 OH
(S)-(+)-乳酸 mp 53oC []D=+2.6 pKa=3.79(25oC)
15
COOH H HO
(R)-()-乳酸 mp 53oC []D= - 2.6 pKa=3.83(25oC)
15
H
C
外消旋乳酸
CH3
()-乳酸 mp 18oC []D=0 pKa=3.86(25oC)
l 为旋光仪使用的光源的波长(通常用钠光,以D表示)。
比旋光度表示: 盛液管为1分米长,被测物浓度为1g/ml时的
旋光度。 纯液体时以ρ代替C. ρ一液体的密度(g/cm3)
§3.2手性和对映异构
• 那么,具有怎样结构的分子才具有旋光性呢? • 实验证明,如果某种分子不能与其镜影完全重叠,这种分子就具 有旋光性。分子这种实物与其镜影不能完全重叠的特殊性质叫做 分子的手征性,简称手性,就像人的左右手互为实物和镜影的关 系,但二者不能完全重叠一样。为什么有的物质没有旋光性,而 有的物质却有呢?物质的性质是与其结构紧密相关的,所以,物 质的旋光性必定是由于其分子的特殊结构引起.
判别手性分子的依据
对称元素
对称操作
判别手性的依据
对称面(m)
对称轴(Cn)
反映(射)
旋转
有对称面无手性
不能作为区别手性的依 据 有对称中心 无手性 有更迭对称轴 无手性
2 n
对称中心(i) (或反演中心)
更迭对称轴(Sn)(或旋转反 射轴)
倒反
2 n
旋转+反射
§3.4、含有一个手性碳原子化合物的对映异构
3
COOH CHOHCOOH
4
3
异构体数目—— 2n = 22 = 4 (n:手性碳原子数目)
H O
COOH
-
1
COOH
HO
1
COOH
-
1
COOH
1和2,3和4互为对映关系。1和3或4也不能重合,他们 是立体异构,但又不是镜像关系。这种不是镜像关系的旋光
异构称为非对映异构。非对映体具有不同的旋光能力,不同
CHO CHO H OH CH2OH H
H OH HO
CHO
R
CH2OH
CH2OH
注意:无论是D,L还是R,S标记方法,都不能通 过其标记的构型来判断旋光方向。因为旋光方 向使化合物的固有性质,而对化合物的构型标 记只是人为的规定。 目前从一个化合物的构型还无法准确地判断 其旋光方向,还是依靠测定。
H Cl
(4). 四重交替对称轴(旋转反映轴)
如果一个分子沿轴旋转90,再用一面垂直于 该轴的镜子将分子反射,所得的镜像如能与原物重 合,此轴即为该分子的四重交替对称轴(用S4表示)。
H Cl Cl H H Cl Cl H 。 旋转 90 Cl Cl H H -
H Cl Cl H
H Cl Cl H
meso-酒石酸 140oc
0
0
20.6
125
2.96
3.11
4.24
4.80
1和2,3和4互为对映关系,但仔细观察会发现
1和2可以重合,是同一物质。这是因为1和2分子中
有一个对称面,因此分子无手性。把分子内含有平
面对称性因素的没有旋光性的立体异构体称为内消
旋体(meso)。可见:分子有手性中心,分子不一定 有手性。 1和3或4是非对映体。等量的3和4构成外消旋体, 但外消旋体是混合物,可以拆分,在性质上不同于
Cl H Cl
-
H
结论:
A.有对称面、对称中心、交替对称轴的分子均可与
其镜象重叠,是非手性分子;反之,为手性分子。
对称轴并不能作为分子是否具有手性的判据。
B.大多数非手性分子都有对称轴或对称中心,只有
交替对称轴而无对称面或对称中心的化合物是少
数。
所以,既无对称面也没有对称中心的分子,一般可 判定为是手性分子。
第三章 立体化学
碳链(碳架)异构
异构体的分类
构造异构
官能团位置异构 官能团异构 互变异构
同分异构 顺反异构
构型异构 (互变需断键交换基团) 立体异构 光学异构 构象异构 (互变需扭转化学键)
§3.1偏振光和比旋光度
光是一种电磁波,光波的振动方向与光的前进方向垂直。
平面偏振光
19世纪后半叶,化学家们发现了一种特别奇妙的同分异构现象,后 来证明,这种现象在生命化学中是极其重要的。
15
对映异构体特点:
*1
*2 *3
结构:镜影与实物关系
内能:内能相同。 物理性质和化学性质在非手性环境中相同,在手性环境中有区别。
*4
旋光能力相同,旋光方向相反。
注意:手性分子在手性条件下有手性,在非手性条件下无手性,如: 加热和溶解于水都是非手性条件,因此对映异构体的熔点和在水里的 溶解度相同,对应异构体与无手性的试剂起反应速度相同,与有手性 的试剂反应速度不同。 人们经常使用的氯霉素,其左旋型是有效的, 其对映体却无效。有些药物如D-型青霉素胺是治疗中毒的药物,而L型对映体右旋型则会导致骨髓损坏,嗅觉和视觉衰退及过敏反应。只 有L-型氨基酸有生命活性.据统计,现有药物中具有手性的大约占3040%.
内消旋化合物。内消旋化合物是一种物质。
§3.7外消旋体拆分
将外消旋体拆分成左旋体和右旋体,称为外消 旋体的拆分。
1.化学拆分法—形成和分离非对映体异构体的拆分法
(±) -RCOOH + ()-RNH2 (+)-RCOO ()-RNH2 HCl ()-RCOO ()-RNH2
成盐
分级结晶
苏格兰物理学家尼科耳于1829年发明尼科耳棱 镜,只允许光在一个平面通过,其余的光都被 反射掉 。普通光通过一个特制的尼科尔棱镜的 晶体,它只允许振动平面与棱镜晶轴平行的光 线才能通过,这种能通过棱镜的光,其光振动 只限于某一个固定方向,只在某一个平面上振 动,这种光称为平面偏振光 。(
那么,偏振光能否透过第二个Nicol 棱镜 (检偏
§3.5 对映异构体构型的表示方法:
1. R/S标记法
R/S标记法是根据手性碳原子所连四个基团在空间的排列来标记的。其 方法是先把手性碳原子所连的四个基团按次序规则排队。把排在最后 的基团置于离观察者最远的位置,然后按先后次序观察其他三个基团。 即从排在最先的开始。如果轮转的方向是顺时针的,则将该手性碳原 子的构型标记为“R”,如果是反时针的,则标记为“S” 。
(2). 对称中心 若分子中有一点,通过该点画任何直线,如果 在离此点等距离的两端有相同的原子,则该点称为 分子的对称中心。
H H3C H H H H
H C H3
(3). 对称轴 以设想直线为轴旋转360 / n,得到与原分子相 同的分子,该直线称为n重对称轴(又称n阶对称轴)。
。
Cl C C H
2. 接种结晶析解法
一个例子:
1g R氨基醇 5g S +5g R 氨基醇饱和液 (80℃,100ml) 2g S 氨基 醇析出
冷却至 20℃
析出2g R 氨基醇 (余下4g R,5g S)
冷却至 加水至100ml 分去晶体,剩下母液 20℃ 80℃ 加2g消旋 体
过 滤
3.微生物或酶作用下的析解 生物体中的酶或细菌等具有旋光性,当它们与外
四面体翻转分子结构不变
2)
D / L标记法:在没有直接测定立体构型的方法之前,人为指定 右旋为D构型,左旋为L构型,起初只是相对构型。
对各种化合物的构型如果都这样任意地指定,必然会造成混乱。为此, 有必要选定一种化合物的构型作为确定其他化合物构型的标准,甘油醛
就是一个被选定作为构型标准的化合物
CHO H OH CH2OH
因此用这种方法标记的构型是真实的构型,叫做绝对构型。
OH
OH
C2H5 H H CH3
CH3 C2H5
R
S
2. D-L标记法
COOH
1)Fischer投影式
COOH
OH
H
H
C CH3
OH
CH3
立体结构
锲形式
COOH H C CH3
投影式
COOH H OH CH3
Fischer投影式
OH
主链纵向放置,氧化态高的基团放在上面
在菲舍尔投影中,规定将主碳链放在垂直方向上,其中氧化态高的基团放 在上面。两个竖立的键代表模型中向纸面背后伸去的键,两个横在两边的 键则表示模型中向纸面前方伸出出的键,而模型中的手性碳原子正好在纸 面上。 菲舍尔投影式翻转
CO O H H OH C H3
翻 转
CO O H HO H C H3
翻 转
旋光性物质使偏振光旋转的角度,称为旋光 度,以“”表示。
顺时针 右旋,以 “ d ” 或 “ + ” 表示。 其旋光方向 逆时针 左旋,以“ l ” 或 “ ” 表示。
但旋光度“”受温度、光源、浓度、管长等许多因素 的影响,为了便于比较,常用比旋光度[]来表示:
[ ]l
t
=
c× l
式中: α 为旋光仪测得试样的旋光度; c 为试样的质量浓度,单位 g . ml1; l 为盛液管的长度,单位 dm 。 t 测样时的温度。
镜) 取决于两个棱镜的晶轴是否平行,平行则可透过;
否则不能通过。如果在两个棱镜之间放一个盛液管,
里面装入两种不同的物质:
亮
α 丙 酸
暗 亮
乳酸
结论: 物质有两类: (1)旋光性物质——能使偏振光振动面旋转的性 质,叫做旋光性;具有旋光性的物质,叫做旋光性物 质。 (2)非旋光性物质——不具有旋光性的物质, 叫做 非旋光性物质。
§3.6、含两个手性碳原子化合物的对映异构
