2014_2015高中化学1.2.1原子结构与元素周期表同步练习(含解析)新人教版选修3
高一化学(必修二)《原子结构 元素周期律》练习题及答案解析

高一化学(必修二)《原子结构 元素周期律》练习题及答案解析一、单选题1.元素周期表和元素周期律可以指导人们进行规律性的推测和判断。
下列说法不合理的是 A .由水溶液的酸性:HCl >HF ,不能推断出元素的非金属性:Cl >FB .人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料C .原子半径随着周期序数的增加而增加D .短周期元素形成的微粒X 2-和Y 2+核外电子排布相同,离子半径:X 2->Y 2+ 2.下列说法正确的是A .SO 2能使酸性KMnO 4溶液褪色,故SO 2有漂白性B .NO 2与水反应生成HNO 3,故NO 2是酸性氧化物C .H 2SiO 3的酸性弱于H 2CO 3,故非金属性C 强于SiD .CaCO 3难溶于水,故CO 2能与CaCl 2溶液反应 3.下列关于物质应用错误的是 A .3NaHCO 用作烘焙糕点膨松剂 B .2SO 用作食品添加剂 C .34Fe O 用作磁性材料D .Si 做光导纤维4.下列关于硅酸的叙述,错误的是 A .硅酸是一种很弱的酸 B .硅酸的酸性比碳酸强C .硅酸不稳定,加热脱水会生成二氧化硅D .硅酸可以由可溶性硅酸盐与盐酸反应制得 5.下列有关物质的用途不正确...的是 A .用铁罐车贮存浓硫酸、浓硝酸、浓盐酸B .高纯度的硅可用于制作计算机的芯片和太阳能电池C .碳酸氢钠可用作焙制糕点的发酵粉,也可用作治疗胃酸过多的药剂D .金属镁常用来制造信号弹和焰火,氧化镁是优质的耐高温材料6.四种主族元素的离子a X m+、b Y n+、c Z n-和d R m-( a 、b 、c 、d 为元素的原子序数),它们具有相同的电子层结构,若m>n ,对下列叙述的判断正确的是①元素的原子序数:a>b>c>d ②a-b=m+n ③元素非金属性:Z R >④最高价氧化物对应水化物碱性:X Y > A .只有③B .①③C .①②③D .①②③④7.下列有关说法正确的是()A.元素周期表是元素按相对原子质量大小排列而成的B.元素周期表共有9个周期和18个族C.在金属元素与非金属元素的分界线附近寻找半导体材料D.第IA族元素,原子序数越大,金属性越弱8.下列关于元素周期律的叙述中不正确的是A.Na、Mg、Al最外层电子数依次增多,其单核离子的氧化性依次增强B.P、S、Cl最高正化合价依次升高,对应简单气态氢化物的稳定性依次增强C.原子半径大小关系为Na<Al<Si<ClD.Na、Mg、Al的氢氧化物的碱性依次减弱9.短周期元素 A、B、C、D 的原子序数依次增大,B 与C的简单离子具有相同的电子层结构,D 的最高正价与最低负价代数和为6。
高一化学原子结构与元素性质练习题及答案

高一化学原子结构与元素性质练习题及答案一、选择题1. 在下列元素中,原子半径最大的是:A. 氧B. 氮C. 氢D. 碳答案:B2. 元素周期表中位于同一周期的元素,其原子核中的________相同。
A. 质子数B. 中子数C. 电子数D. 能级数答案:A3. 以下哪个元素的原子序数最小?A. 铝B. 锌C. 钌D. 锆答案:A4. 元素周期表中,位于同一族的元素,其 ________ 相同。
A. 原子序数B. 原子半径C. 化合价D. 反应性答案:C5. 以下哪个说法是正确的?A. 低一周期的元素比高一周期的元素的电负性更大。
B. 低一周期的元素比高一周期的元素的原子半径更大。
C. 低一周期的元素比高一周期的元素的化合价更小。
D. 低一周期的元素比高一周期的元素的电离能更小。
答案:B二、填空题1. 原子核的组成粒子是 ________ 和 ________。
答案:质子,中子2. 原子的核外层电子数等于 ________。
答案:原子序数3. 以下元素原子序数依次为 5、6、7、8 的元素名称分别是________、氧、氮、 ________。
答案:硼、氖4. 原子半径的单位是 ________。
答案:皮米5. 元素周期表中,位于同一周期的元素具有相同的 ________。
答案:能级数三、简答题1. 什么是原子结构?答:原子结构是指元素中原子的组成和排列,主要包括原子核和核外电子。
原子核由质子和中子组成,并带有正电荷。
核外电子围绕原子核轨道运动,并带有负电荷。
原子中的质子数等于电子数,使得原子整体电荷为中性。
2. 原子的电子排布有什么规律?答:原子的电子排布遵循充满能级和奥布规则。
充满能级规则指的是电子依次填满能级,每个能级最多容纳一定数量的电子。
奥布规则是指电子填充到不同的轨道上时,尽量使各个轨道上的电子数量相同,遵循“少做多受益”的原则。
3. 什么是元素的化合价?答:元素的化合价是元素在化合物中所表现出的价态,用于表示元素与其他元素形成化合物时的化合能力。
高考化学 原子结构与元素周期表 综合题附答案解析
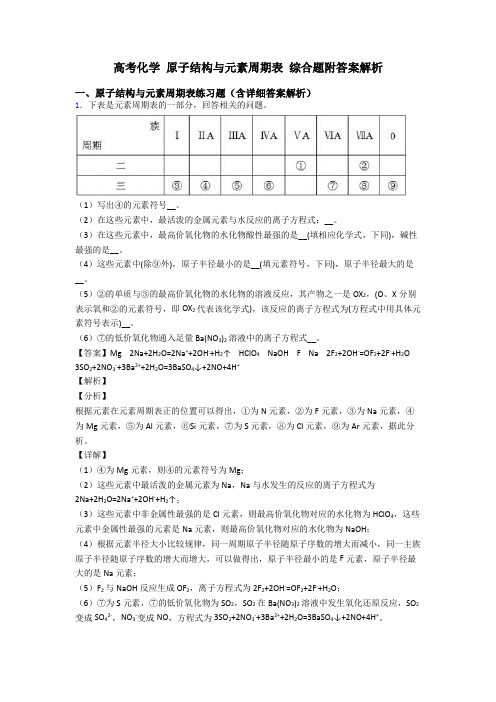
高考化学原子结构与元素周期表综合题附答案解析一、原子结构与元素周期表练习题(含详细答案解析)1.下表是元素周期表的一部分,回答相关的问题。
(1)写出④的元素符号__。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:__。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是__(填相应化学式,下同),碱性最强的是__。
(4)这些元素中(除⑨外),原子半径最小的是__(填元素符号,下同),原子半径最大的是__。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2,(O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)__。
(6)⑦的低价氧化物通入足量Ba(NO3)2溶液中的离子方程式__。
【答案】Mg 2Na+2H2O=2Na++2OH-+H2↑ HClO4 NaOH F Na 2F2+2OH-=OF2+2F-+H2O 3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+【解析】【分析】根据元素在元素周期表正的位置可以得出,①为N元素,②为F元素,③为Na元素,④为Mg元素,⑤为Al元素,⑥Si元素,⑦为S元素,⑧为Cl元素,⑨为Ar元素,据此分析。
【详解】(1)④为Mg元素,则④的元素符号为Mg;(2)这些元素中最活泼的金属元素为Na,Na与水发生的反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;(3)这些元素中非金属性最强的是Cl元素,则最高价氧化物对应的水化物为HClO4,这些元素中金属性最强的元素是Na元素,则最高价氧化物对应的水化物为NaOH;(4)根据元素半径大小比较规律,同一周期原子半径随原子序数的增大而减小,同一主族原子半径随原子序数的增大而增大,可以做得出,原子半径最小的是F元素,原子半径最大的是Na元素;(5)F2与NaOH反应生成OF2,离子方程式为2F2+2OH-=OF2+2F-+H2O;(6)⑦为S元素,⑦的低价氧化物为SO2,SO2在Ba(NO3)2溶液中发生氧化还原反应,SO2变成SO42-,NO3-变成NO,方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+。
高考化学原子结构与元素周期表的综合复习附详细答案
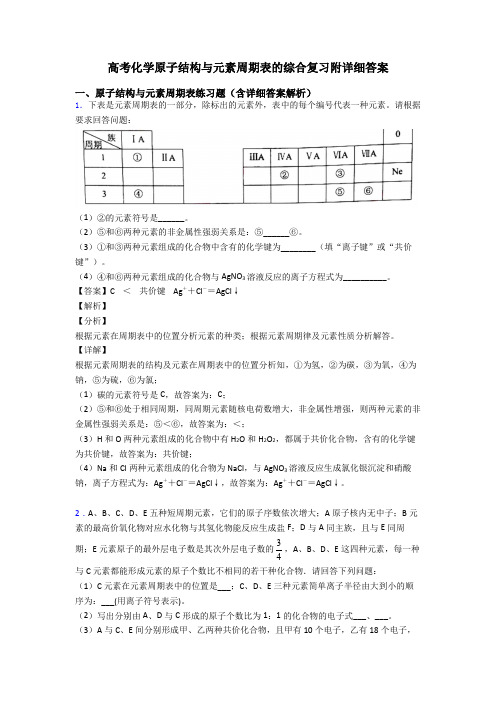
高考化学原子结构与元素周期表的综合复习附详细答案一、原子结构与元素周期表练习题(含详细答案解析)1.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。
请根据要求回答问题:(1)②的元素符号是______。
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤______⑥。
(3)①和③两种元素组成的化合物中含有的化学键为________(填“离子键”或“共价键”)。
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为__________。
【答案】C <共价键 Ag++Cl-=AgCl↓【解析】【分析】根据元素在周期表中的位置分析元素的种类;根据元素周期律及元素性质分析解答。
【详解】根据元素周期表的结构及元素在周期表中的位置分析知,①为氢,②为碳,③为氧,④为钠,⑤为硫,⑥为氯;(1)碳的元素符号是C,故答案为:C;(2)⑤和⑥处于相同周期,同周期元素随核电荷数增大,非金属性增强,则两种元素的非金属性强弱关系是:⑤<⑥,故答案为:<;(3)H和O两种元素组成的化合物中有H2O和H2O2,都属于共价化合物,含有的化学键为共价键,故答案为:共价键;(4)Na和Cl两种元素组成的化合物为NaCl,与AgNO3溶液反应生成氯化银沉淀和硝酸钠,离子方程式为:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓。
2.A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A原子核内无中子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的34,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:(1)C元素在元素周期表中的位置是___;C、D、E三种元素简单离子半径由大到小的顺序为:___(用离子符号表示)。
(2)写出分别由A、D与C形成的原子个数比为1:1的化合物的电子式___、___。
高中化学(新人教版)必修第一册课后习题:原子结构 元素周期表(课后习题)【含答案及解析】

第四章物质结构元素周期律第一节原子结构与元素周期表第1课时原子结构元素周期表课后篇素养形成合格考达标练1.元素X的原子有3个电子层,最外电子层上有4个电子。
则X元素位于元素周期表的()A.第四周期第ⅢA族B.第四周期第ⅦA族C.第三周期第ⅣB族D.第三周期第ⅣA族=电子层数,主族序数=最外层电子数,可知D项正确。
2.下列说法肯定错误的是()A.某原子K层上只有一个电子B.某原子M层上电子数为L层上电子数的4倍C.某离子M层上和L层上电子数均为K层上电子数的4倍D.某离子的核电荷数与最外电子层上的电子数相等层、L层、M层上最多能容纳的电子数分别为2、8、18。
K层上可排1个电子,也可排2个电子,A项有可能;当M层上排有电子时,L层已经排满电子,即排了8个电子,而M层最多可以排18个电子,B项不可能;符合“M层上和L层上电子数均为K层上电子数的4倍”的离子可以是S2-、Cl-、K+、Ca2+等,C项有可能;D项,最外电子层上的电子数可为2或8,核电荷数和最外层电子数均为2的只有He,不符合条件,核电荷数和最外层电子数均为8的为O2-,D项有可能。
3.下列各原子结构示意图中所表示的核外电子排布正确的是():①电子排布遵循能量最低原理;②各电子层最多所能容纳的电子数目为2n2;③原子最外层电子数不能超过8(K层为最外层时不能超过2)。
A项不符合能量最低原理,应该先排满K层再排L层,所以A项错误;B项不符合各层最多排2n2个电子,K层最多排2个电子,所以B项错误;D项不符合最外层最多只能排8个电子,所以D项错误。
4.(2020湖北天门、潜江、应城高一期中联考)元素周期表是学习化学的重要工具。
如图是元素周期表中的一格,从中获取的信息不正确的是()A.该元素的元素符号为TeB.该元素属于金属元素C.该元素的原子核外有52个电子D.该元素的相对原子质量为127.6,该元素的元素符号为Te,A项正确;根据元素周期表中的一格可知,该元素的名称是碲,带“石”字旁,属于非金属元素,B项错误;根据元素周期表中的一格可知,左上角的数字为52,表示原子序数为52,根据原子序数=核电荷数=质子数=原子核外电子数,则该元素的原子核外电子数为52,C项正确。
人教版高一上学期化学(必修一)《4.1原子结构与元素周期表》同步测试题及答案

人教版高一上学期化学(必修一)《4.1原子结构与元素周期表》同步测试题及答案一、单选题1.下列有关14C、14N这两种核素的说法正确的是:A.质量数不相同B.电子数相同C.中子数不相同D.质子数相同2.美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献,曾获得诺贝尔化学奖。
钯(Pd)元素的原子序数为46,下列叙述错误的是()A.10246Pd和10346Pd的化学性质几乎相同B.钯与铁是同族元素C.Pd2+核外有44个电子D.10846Pd的原子核内有52个中子3.核内中子数为N的R2+质量数为A,则ng它氧化物(RO)中所含质子的物质的量是A.nA+16(A-N+8)mol B.nA+16(A-N+10)molC.(A-N+2)rmol D.nA(A-N+6)mol4.据报道,在月球的土壤中含有较丰富的32He,它原子核内的中子数是A.1B.2C.3D.45.考古学上常用188O来测定文物的年代。
188O的原子核内中子数与质子数之差是()A.10B.8C.2D.16 6.下列说法正确的是A.146C和147N互为同位素B.石英与水晶互为同素异形体C.淀粉和纤维素互为同分异构体D.乙酸和硬脂酸互为同系物7.据凤凰网2018 年2 月1日报道:中科院研发出世界最强氘氚中子源,下列有关说法正确的是()A.氘、氚是两种不同的元素B.氘、氚的中子数分别为1、2C.氘、氚核外电子数不同D.中子带正电8.国庆期间,我国“嫦娥Ⅱ号”成功进入月球轨道。
据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。
下列说法正确的是A.32He原子的质量数为3B.32He和T(3H)互为同位素C.32He核聚变是化学变化D.32He原子核内含有3个质子9.卢瑟福的α粒子散射实验说明了Ⅱ原子中绝大部分是空的;Ⅱ原子中存在着体积很小的带正电的核;Ⅱ葡萄干面包原子模型的理论是错误的A.ⅡⅡB.ⅡⅡC.ⅡⅡⅡD.ⅡⅡ10.分类是科学研究的重要方法。
高中化学_原子结构_练习题及答案

第一章原子结构与元素周期律第一节原子结构原子是由居于原子中心的带电的和处于核外的高速运动带电的组成。
原子核是否还可以再分?原子核的内部结构是怎样的?电子在核外空间的运动状态又是怎样的呢?一、原子核:(一)原子核的构成1、原子核的构成:原子核由带正电的和不带电荷的构成。
2、对某一个原子来说核电荷数==3、原子的质量几乎全部集中在上(填原子核,电子,质子,中子),也就是说,电子的质量很小,不到一个质子或中子质量的千分之一,可以忽略不计,原子的质量可以看作是原子核中质子和中子的质量之和。
人们将原子核中质子数和中子数之和称为质量数,质量数(A)=()+()表示一个原子,A表示Z表4、原子的表示:通常用X AZ示。
(二)核素1、元素是指。
2、核素是指。
二、核外电子排布:1、.物质在化学反应中的表现与有着密切的联系,其中扮演着非常重要的角色。
2、在含有多个电子的原子里,能量低的电子通常在离核较的区域内运动,能量高的电子通常在离核较的区域内运动。
3、通常把能量最、离核最的电子层叫做第一层,能量稍高、离核较远的电子层叫做第二层,由里向外依次类推,共有个电子层。
用字母表示依次为。
4、每层最多容纳的电子数为,最外层电子数,通常用来表示电子在原子核外的分层排布情况。
5、元素的化学性质与相关,金属元素原子的最外层电子数一般,较易电子。
非金属元素原子最外层电子数一般,较易电子。
6、元素的化合价数值与有关。
【巩固练习】1、下列微粒结构示意图表示的各是什么微粒?2、下列微粒结构示意图是否正确?如有错误,指出错误的原因。
3、已知元素X、Y的核电荷数分别是a和b,它们的离子X m+和Y n-的核外电子排布相同,则下列关系中正确的是()A. a = b + m + nB. a = b – m + nC. a = b + m - nD. a = b – m - n4、下列关于核外电子排布的说法中不正确的是 ( ) A 、第n 电子层中最多可容纳的电子数为2n 2 B 、第二电子层中最多可容纳的电子数为8C 、最多可容纳8个电子的电子层一定是第二电子层D 、最多可容纳2个电子的电子层一定是第一电子层5、核内质子数不同,核外电子数相同的两种微粒,它们可能是( ) A 、同种元素的两种离子 B 、不同元素的离子C 、同种元素的原子和离子D 、不同种元素的原子和离子 6、在下列粒子中,中子数和质子数相等的是 ( )(1) 18O (2) 12C (3) 26Mg (4) 40K (5) 40Ca A. (5)和(2) B. (3)和(4) C. 只有(4) D. (1)和(2)7、有六种微粒,分别是M 4019、N 4020、X 4018、[]+Q 4019、[]+24020Y 、[]-Z 3717,它们隶属元素的种类是 。
人教版高一上学期化学(必修一)《4.1原子结构与元素周期表》同步练习题-附答案

人教版高一上学期化学(必修一)《4.1原子结构与元素周期表》同步练习题-附答案一、单选题1.元素周期表中某区域的一些元素多用于制造半导体材料,它们是A.左下方区域的金属元素B.金属元素和非金属元素分界线附近的元素C.右下方区域的非金属元素D.稀有元素2.电影《流浪地球》中为了拯救地球而点燃了木星大气,木星大气中含有H2和He。
下列说法不正确的是()A.H和He都是短周期元素B.H和He都是主族元素C.3He和4He是同种元素D.H﹣和He的核外电子排布相同3.短周期元素X、Y、Z在元素周期表中的位置关系如图所示。
Y、Z两元素的原子序数之和是X元素原子序数的4倍。
则X、Y、Z三元素应分别为()XY ZA.C,Al,P B.F,S,ArC.N,Si,S D.O,P,Cl4.92235U是重要的核工业原料,下列有关92235U的说法正确的是()A.92235U与92238U互为同素异形体B.92235U与92238U互为同位素C.92235U原子核中含有92个中子D.92235U原子核外有143个电子5.下列顺序表述正确的是()A.酸性:H3PO4> HNO3> HClO4B.稳定性:H2O > HF > H2SC .原子半径:Na > Mg > OD .还原性:F -> Cl -> S 2-6.已知R 2+离子核外有a 个电子,b 个中子.表示R 原子组成正确的是 ( )A .ab RB .a−2a+b−2 RC .a+2a+b+2 RD .a−2a+b R7.下列关于Li 、Na 、K 、Rb 、Cs 的叙述错误的是( )A .金属性最强的是CsB .在自然界中均以化合态形式存在C .它们的氧化物都只有M 2O 和M 2O 2两种形式D .形成的离子中氧化性最强的是锂离子8.已知33As 、35Br 位于同一周期.下列关系正确的是( )A .原子半径:Br >Cl >PB .热稳定性:AsH 3>PH 3C .碱性:CsOH >Ca (OH )2D .酸性:H 3AsO 4>H 3PO 49.下列原子或离子核外未成对电子数目为5的是( )A .Fe 3+B .PC .CrD .Cu10.铷(Rb)在元素周期表中位于IA 族,下列关于铷的叙述正确的是( )A .金属活动性比钠弱B .氢氧化铷是弱碱C .在钠、钾、铷三种单质中铷的熔点最高D .硝酸铷是离子化合物11.下列关于碱金属元素和卤素的说法中,错误的是( )A .随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大B .碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强C .钾与水的反应比钠与水的反应更剧烈D .溴单质与水的反应比氯单质与水的反应更剧烈12.元素周期表中铋元素的数据见图,下列说法正确的是( )A .Bi 元素的质量数是209B.Bi元素的相对原子质量是209.0C.Bi原子6p能级有一个未成对电子D.Bi原子最外层有5个能量相同的电子13.下列各组物质相互混合反应后,最终有白色沉淀生成的是()①金属钠投入到烧杯中的FeCl2溶液中②过量NaOH溶液和明矾溶液混合③少量Ca(OH)2投入过量NaHCO3溶液中④向NaAlO2溶液中滴入少量NaHSO4溶液⑤向饱和Na2CO3溶液中通入足量CO2A.①③④⑤B.只有①④C.只有③④⑤D.只有②③14.1891年Engel首次制得S6分子,1912年Beckmann获得S8分子。
高考化学原子结构与元素周期表综合题附答案

A元素原子M层电子数为K层电子数的12,则M层有1个电子,所以A元素为钠元素,其核电荷数为11;B元素原子M层电子数为次外层与最内层电子数之差,则M层电子数=8-2=6,所以B元素为硫元素,其核电荷数为16;C元素原子L层达稳定结构所需电子数为该层电子数的13,L层的稳定结构为8电子结构,则L层电子数为6,所以C元素为氧元素,其核电荷数为8,故A的元素名称为钠,B的元素名称为硫,C的元素名称为氧,故答案为11、钠;16、硫;8、氧。
【点睛】
本题考查了物质结构,涉及电离能的应用、作用力类型的判断、大π的分析、晶胞计算,掌握物质结构知识和晶体密度计算方法是解题关键,要注意电离能变化规律及特殊性,利用均摊方法分析判断晶胞中含有微粒数目,结合密度计算公式解答。
2.我国科学家受中医启发,发现As2O3(俗称砒霜)对白血病有疗效。氮、磷、砷(As)是VA族、第二至第四周期的元素,这些元素的化合物在研究和生产中有许多重要用途。
③N5-为平面正五边形,N原子的杂化类型是_______。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则N4-中的大π键应表示为_________。
③若原子采用sp3杂化,形成的物质结构为四面体形;若原子采用sp2杂化,形成的物质结构为平面形;若原子采用sp杂化,则形成的为直线型结构。N5-为平面正五边形,说明N原子的杂化类型为sp2杂化;在N5-中,每个N原子的sp2杂化轨道形成2个σ键,N原子上还有1个孤电子对及1个垂直于N原子形成平面的p轨道,p轨道间形成大π键,N5-为4个N原子得到1个电子形成带有1个单位负电荷的阴离子,所以含有的电子数为5个,其中大π键是由4个原子、5个电子形成,可表示为 ;
2021年高中化学 1.2.1原子结构与元素周期表同步练习(含解析)新人教版选修3

2021年高中化学 1.2.1原子结构与元素周期表同步练习(含解析)新人教版选修31.关于元素周期律和元素周期表的下列说法中正确的是( )A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现B.根据原子的电子排布,可将周期表分为s、d、ds、p、f五个分区C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献D.同一主族的元素从上到下,金属性呈周期性变化解析:现代元素周期表是按现在已知的112种元素编制,第七周期仍未排满。
随着科学技术的发展,一些新的元素将不断地被发现,现代元素周期表在不断完善和发展中。
在现代元素周期表中,根据原子的电子排布,可将周期表分为s、d、ds、p、f五个分区。
同一主族元素从上到下,金属性增强,非金属性减弱,属递变性质而不是周期性变化。
答案:B2.外围电子构型为4f75d16s2的元素在周期表中位置应是( )A.第四周期第ⅦB族B.第五周期第ⅢB族C.第六周期第ⅦB族D.第六周期第ⅢB族解析:最大能层数为6,所以在第六周期。
由5d16s2知在第ⅢB族。
答案:D3.下列关于价电子构型为3s23p4的粒子描述正确的是( )A.它的元素符号为OB.它的核外电子排布式为1s22s22p63s23p4C.它可与H2生成液态化合物D.其电子排布图为解析:价电子构型为3s23p4的粒子应是硫元素,H2S为气态。
D项其电子排布图的3p轨道违反了洪特规则。
答案:B4.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素在周期表中的位置是( )A.第三周期第Ⅷ族,p区B.第三周期第ⅤB族,ds区C.第四周期第Ⅷ族,d区D.第四周期第ⅤB族,f区解析:+3价离子的核外有23个电子,则原子核外有26个电子,26号元素是铁,位于第四周期第Ⅷ族,位于d区。
答案:C5.某元素基态原子的最外层电子排布式为n s2,该元素( )A.一定是第ⅡA族元素B.一定是金属元素C.不是第ⅡA族元素就是副族元素D.可能是金属元素也可能是非金属元素解析:由于最外层电子排布式为n s2,则该元素可能是He元素、第ⅡA族元素或是过渡金属元素,所以综合起来讲,可能是金属元素也可能是非金属元素,答案选D。
《4.1 原子结构与元素周期表》同步练习及答案解析

《4.1 原子结构与元素周期表》同步练习第1课时原子结构(30分钟50分)一、选择题(本题包括5小题,每小题4分,共20分)1.核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )A.1种B.2种C.3种D.4种2.原子的质量主要由原子核决定。
已知质量数为A的某阳离子R n+,核外有X 个电子,则核内中子数为( )A.A-XB.A-X-nC.A-X+nD.A+X-n【补偿训练】某元素的一种原子X的质量数为A,含N个中子,它与氢(不含中子)原子组成H m X分子,在a g HmX中所含质子的物质的量是( )A.(A-N+m) molB.(A-N) molC.(A-N) molD.(A-N+m)mol3.粒子结构示意图是表示原子核电荷数和电子层排布的图示形式。
根据粒子结构示意图:,,,下列判断正确的是( )A.它们都带有电荷B.它们原子的核外电子数相同C.它们都具有稳定结构D.它们表示同一种元素【补偿训练】已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质。
若氟元素原子的核外电子排布示意图为。
下列原子中,与氟元素原子的化学性质相似的是( )4.有A、B两种元素,已知元素A的核电荷数为a,且A3-与B n+的电子排布完全相同,则元素B的质子数为( )A.a-n-3B.a+n+3C.a+n-3D.a-n+35.原子核外电子是分层排布的,下列关于L层与M层的比较,不正确的是( )A.L层离核比M层离核近B.电子在M层上运动时所具有的能量高于L层C.当L层上的电子数为奇数时,M层上不可能有电子D.当L层上的电子数为偶数时,M层上一定有电子二、非选择题(本题包括1小题,共10分)6.A、B元素为1~20号元素。
(1)A元素原子的核电荷数为8,其原子核内的质子数为________,该元素原子的二价阴离子中,核外电子数为________。
(2)B元素原子的一价阳离子的核外有18个电子,质量数为40,该元素原子的原子核内中子数为____________________。
1.2.1《原子结构与元素周期表》教学设计(含解析)人教版高二化学选修3

(人教版选修3)第一章《原子结构与性质》教学设计第二节原子结构与元素的性质(第一课时原子结构与元素周期表)【情景导入】元素的性质跟其在周期表中的位置有相应的关系,所以要探究原子结构与元素的性质的关系首先得研究元素周期表。
本节课我们将对原子结构与元素周期表的关系做进一步探究。
【板书】一、原子结构与元素周期表【板书】活动一、周期与原子结构的关系【思考】阅读教材P13页内容,根据构造原理和碱金属元素原子电子排布式特点,思考元素周期系的形成及原因是什么?【交流1】碱金属元素基态原子的核外电子排布教材P13页:【投影】碱金属原子序数周期基态原子的电子排布式锂 3 二1s22s1或[He]2s1钠11 三1s22s22p63s1或[Ne]3s1钾19 四1s22s22p63s23p64s1或[Ar]4s1铷37 五1s22s22p63s23p63d104s24p65s1或[Kr]5s1铯55 六1s22s22p63s23p63d104s24p64d105s25p66s1或[Xe]6s1【交流2】(2)周期系的形成:随着元素原子核电荷数的递增,每到出现碱金属,就开始建立一个新的电子层,随后最外层上的电子逐渐增多,最后达到8个电子,出现稀有气体;然后又开始由碱金属到稀有气体,循环往复形成了周期系。
【交流3】(3)原因:元素周期系的形成是由于元素的原子核外电子的排布发生周期性的重复。
【投影】【讨论1】(1)核外电子排布与周期划分的关系是什么?【交流1】①根据构造原理,将能量相近的能级分为一组,按能量由低到高可分为七个能级组,同一能级组内,各能级能量相差较小,各能级组之间能量相差较大。
【交流2】②每一能级组对应一个周期,且该能级组中最大的能层数等于元素的周期序数。
【交流3】③周期的划分取决于元素原子的能层数(电子层数),同一周期元素原子的能层数(电子层数)相同。
【讨论2】元素周期系中各周期所含元素种类的变化规律是什么?【交流】随着核电荷数的递增,电子在能级里的填充顺序遵循构造原理;元素周期系的周期不是单调的;每一周期里元素的数目并不总是一样多,而是随周期序号的递增渐渐增多,同时,金属元素的数目也逐渐增多。
高考化学复习原子结构与元素周期表专项综合练附详细答案

高考化学复习原子结构与元素周期表专项综合练附详细答案一、原子结构与元素周期表练习题(含详细答案解析)1.同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列)。
该周期部分元素氟化物的熔点见下表。
氟化物AF BF2DF4熔点/K12661534183(1)A原子核外共有_______种不同运动状态的电子、_______种不同能级的电子;(2)元素C的最高价氧化物对应水化物的电离方程式为__________;(3)解释上表中氟化物熔点差异的原因:_______;(4)在E、G、H三种元素形成的氢化物中,热稳定性最大的是_______(填化学式)。
A、B、C三种原子形成的简单离子的半径由大到小的顺序为______(填离子符号)。
【答案】11 4 AlO 2-+H++H2O Al(OH)3Al3++3OH- NaF与 MgF2为离子晶体,离子之间以离子键结合,离子键是强烈的作用力,所以熔点高;Mg2+的半径比Na+的半径小,离子电荷比Na+多,故MgF2的熔点比NaF高;SiF4为分子晶体,分子之间以微弱的分子间作用力结合,故SiF4的熔点低 HCl Na+>Mg2+>Al3+【解析】【分析】图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,H、I的沸点低于0℃,根据气体的沸点都低于0℃,可推断H、I为气体,气体元素单质为非气体,故为第三周期元素,则A为Na,B为Mg,C为Al,D为Si,E为P、G为S,H为Cl,I为Ar。
(1)原子中没有运动状态相同的电子,由几个电子就具有几种运动状态;根据核外电子排布式判断占有的能级;(2)氢氧化铝为两性氢氧化物,有酸式电离与碱式电离;(3)根据晶体类型不同,以及同种晶体类型影响微粒之间作用力的因素解答;(4)同周期自左而右非金属性增强,非金属性越强氢化物越稳定;电子层结构相同核电荷数越大离子半径越小,据此解答。
《第一节 原子结构与元素周期表》(同步训练)高中化学必修第一册_人教版_2024-2025学年

《第一节原子结构与元素周期表》同步训练(答案在后面)一、单项选择题(本大题有16小题,每小题3分,共48分)1、下列关于原子结构的描述,正确的是()A. 原子由原子核和核外电子组成,原子核由质子和中子构成B. 原子核的电荷数等于核外电子数C. 原子核外电子层数与原子序数无关D. 原子核内的质子数等于原子核外的电子数2、下列哪项不是决定原子种类的粒子?A、质子数B、中子数C、电子数D、质量数3、下列有关元素周期表的描述中,正确的是()A、同一周期内,原子半径从左到右逐渐减小B、同一主族内,原子半径从上到下逐渐增大C、主族元素的最外层电子数等于其族序数D、金属元素的原子最外层电子数总是小于44、下列关于原子结构与元素周期表的描述中,正确的是()A. 原子核由质子和中子组成,质子带正电,中子不带电B. 元素周期表中,原子序数相同的元素位于同一周期C. 原子核外电子层数与元素所在的周期数相同D. 元素的化学性质主要决定于其原子核内的质子数5、下列关于元素周期表的说法中正确的是()A. 元素周期表共有7个横行,称为周期,每个周期都是从金属元素开始,到非金属元素结束。
B. 第一周期只有两种元素,分别是氢和氦,它们都是非金属。
C. 主族元素的最外层电子数等于其所在的族序数。
D. 过渡金属元素都具有相同的最外层电子数。
6、下列关于元素周期表的描述,正确的是()A. 元素周期表中,原子序数越大,原子半径越小B. 元素周期表中,同一周期的元素,其最外层电子数依次增加C. 元素周期表中,金属元素在周期表的下部D. 元素周期表中,非金属元素在周期表的上部7、下列关于原子结构与元素周期表的描述中,哪一项是正确的?A、氢元素位于元素周期表的第一周期,第一主族,其原子核外只有一个电子。
B、卤族元素位于元素周期表的第七周期,第十七主族,包括氟、氯、溴、碘和砹。
C、氧元素位于元素周期表的第二周期,第十六主族,氧原子的价电子排布为2s22p4,电子总数是8。
1.2.1 原子结构与元素周期表(备作业)(含答案)高二选择性必修2同步备课系列(人教版2019)

答卷时应注意事项1、拿到试卷,要认真仔细的先填好自己的考生信息。
2、拿到试卷不要提笔就写,先大致的浏览一遍,有多少大题,每个大题里有几个小题,有什么题型,哪些容易,哪些难,做到心里有底;3、审题,每个题目都要多读几遍,不仅要读大题,还要读小题,不放过每一个字,遇到暂时弄不懂题意的题目,手指点读,多读几遍题目,就能理解题意了;容易混乱的地方也应该多读几遍,比如从小到大,从左到右这样的题;4、每个题目做完了以后,把自己的手从试卷上完全移开,好好的看看有没有被自己的手臂挡住而遗漏的题;试卷第1页和第2页上下衔接的地方一定要注意,仔细看看有没有遗漏的小题;5、中途遇到真的解决不了的难题,注意安排好时间,先把后面会做的做完,再来重新读题,结合平时课堂上所学的知识,解答难题;一定要镇定,不能因此慌了手脚,影响下面的答题;6、卷面要清洁,字迹要清工整,非常重要;7、做完的试卷要检查,这样可以发现刚才可能留下的错误或是可以检查是否有漏题,检查的时候,用手指点读题目,不要管自己的答案,重新分析题意,所有计算题重新计算,判断题重新判断,填空题重新填空,之后把检查的结果与先前做的结果进行对比分析。
亲爱的小朋友,你们好!经过两个月的学习,你们一定有不小的收获吧,用你的自信和智慧,认真答题,相信你一定会闯关成功。
相信你是最棒的!第1章原子结构与性质1.2.1 原子结构与元素周期表一.选择题(共8小题)1.下列有关元素周期表的说法中不正确的是( )A.位于元素周期表ⅡA族左边的元素一定属于主族元素B.氯元素位于元素周期表中第三周期ⅦA族C.元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素D.目前使用的元素周期表中,包含元素种类最多的族为ⅥA【答案】D【解析】A、位于元素周期表ⅡA族左边的元素是第ⅠA族,一定属于主族元素,A正确;B、氯元素的原子序数是17,位于元素周期表中第三周期ⅦA族,B正确;C、元素周期表中ⅢB族到ⅡB族10个纵行的元素属于过渡元素,都是金属元素,C正确;D、目前使用的元素周期表中,包含元素种类最多的族为ⅢB族,因为还有镧系和錒系,D错误。
高考化学原子结构与元素周期表综合题汇编附答案解析

高考化学原子结构与元素周期表综合题汇编附答案解析一、原子结构与元素周期表练习题(含详细答案解析)1.完成下列问题:(1)氮和磷氢化物热稳定性的比较:NH3______PH3(填“>”或“<”)。
(2)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。
下列对PH3与HI反应产物的推断正确的是_________(填序号)。
a.不能与NaOH反应 b.含离子键、共价键 c.受热可分解(3)已知H2与O2反应放热,断开1 mol H-H键、1 mol O=O键、1 mol O-H键所需要吸收的能量分别为Q1 kJ、Q2 kJ、Q3 kJ,由此可以推知下列关系正确的是______。
①Q1+Q2>Q3②2Q1+Q2<4Q3③2Q1+Q2<2Q3(4)高铁电池总反应为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH,写出电池的正极反应:__________,负极反应 ________________。
【答案】> bc ② FeO42-+3e-+4H2O=Fe(OH)3+5OH- Zn+2OH--2e-=Zn(OH)2【解析】【分析】(1)根据元素的非金属性越强,其相应的简单氢化物越稳定分析;(2)PH3与HI反应产生PH4I,相当于铵盐,具有铵盐的性质;(3)根据旧键断裂吸收的能量减去新键生成释放的能量的差值即为反应热,结合燃烧反应为放热反应分析解答;(4)根据在原电池中,负极失去电子发生氧化反应,正极上得到电子发生还原反应,结合物质中元素化合价及溶液酸碱性书写电极反应式。
【详解】(1)由于元素的非金属性:N>P,所以简单氢化物的稳定性:NH3>PH3;(2) a.铵盐都能与NaOH发生复分解反应,所以PH4I也能与NaOH发生反应,a错误;b.铵盐中含有离子键和极性共价键,所以PH4I也含离子键、共价键,b正确;c.铵盐不稳定,受热以分解,故PH4I受热也会发生分解反应,c正确;故合理选项是bc;(3)1 mol H2O中含2 mol H-O键,断开1 mol H-H、1 mol O=O、1 mol O-H键需吸收的能量分别为Q1、Q2、Q3 kJ,则形成1 mol O-H键放出Q3 kJ热量,对于反应H2(g)+12O2(g)=H2O(g),断开1 mol H-H键和12mol O=O键所吸收的能量(Q1+12Q2) kJ,生成2 mol H-O新键释放的能量为2Q3 kJ,由于该反应是放热反应,所以2Q3-(Q1+12Q2)>0,2Q1+Q2<4Q3,故合理选项是②;(4)在原电池中负极失去电子发生氧化反应,正极上得到电子发生还原反应。
高考化学复习原子结构与元素周期表专项综合练附答案解析

高考化学复习原子结构与元素周期表专项综合练附答案解析一、原子结构与元素周期表练习题(含详细答案解析)1.正电子、负质子等都属于反粒子,它们跟普通电子、质子的质量、电荷量均相等,而电性相反。
科学家设想在宇宙的某些部分可能存在完全由反粒子构成的物质—反物质。
1997年年初和年底,欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子。
这是人类探索反物质的一大进步。
(1)你推测反氢原子的结构是(____)A.由1个带正电荷的质子与1个带负电荷的电子构成B.由1个带负电荷的质子与1个带正电荷的电子构成C.由1个不带电子的中子与1个带负电荷的电子构成D.由1个带负电荷的质子与1个带负电荷的电子构成(2)反物质酸、碱中和反应的实质是(____)A.H-+OH+ =H2O B.H++OH+ =H2OC.H-+OH- =H2O D.H++OH- =H2O(3)若有反α粒子(α粒子即氦核),它的质量数为_________电荷数为_______。
【答案】B A42【解析】【分析】根据反粒子特征和定义进行解答。
【详解】(1)A.由一个带正电荷的质子和一个带负电荷的电子构成的,这是正常氢原子的构成,故A 错误;B.由一个带负电荷的质子和一个带正电荷的电子构成的,符合反氢原子的构成, 故B正确;C.由一个不带电的中子和一个带负电荷的电子构成的,不正确,因为反氢原子中电子带正电,故C错误;D.由一个带负电荷的质子和一个带负电荷的电子构成,原子不显电性,不能都带负电荷。
故D错误。
答案:B。
(2)酸碱中和反应是H+ +OH-=H2O,根据反物质的定义特征,可知反物质酸碱中和反应为H- +OH+= H2O,所以A符合题意,答案:A;(3)已知a粒子质量数为4,带2个正电荷,因此反a粒子质量数为4, 电荷数为-2。
答案:4;2。
【点睛】根据反粒子的定义:正电子、负质子等都属于反粒子;反粒子的特征:它们跟普通电子、质子的质量、电荷量均相等,而电性相反进行解答。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时训练4 原子结构与元素周期表1.关于元素周期律和元素周期表的下列说法中正确的是( )A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现B.根据原子的电子排布,可将周期表分为s、d、ds、p、f五个分区C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献D.同一主族的元素从上到下,金属性呈周期性变化解析:现代元素周期表是按现在已知的112种元素编制,第七周期仍未排满。
随着科学技术的发展,一些新的元素将不断地被发现,现代元素周期表在不断完善和发展中。
在现代元素周期表中,根据原子的电子排布,可将周期表分为s、d、ds、p、f五个分区。
同一主族元素从上到下,金属性增强,非金属性减弱,属递变性质而不是周期性变化。
答案:B2.外围电子构型为4f75d16s2的元素在周期表中位置应是( )A.第四周期第ⅦB族B.第五周期第ⅢB族C.第六周期第ⅦB族D.第六周期第ⅢB族解析:最大能层数为6,所以在第六周期。
由5d16s2知在第ⅢB族。
答案:D3.下列关于价电子构型为3s23p4的粒子描述正确的是( )A.它的元素符号为OB.它的核外电子排布式为1s22s22p63s23p4C.它可与H2生成液态化合物D.其电子排布图为解析:价电子构型为3s23p4的粒子应是硫元素,H2S为气态。
D项其电子排布图的3p轨道违反了洪特规则。
答案:B4.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素在周期表中的位置是( )A.第三周期第Ⅷ族,p区B.第三周期第ⅤB族,ds区C.第四周期第Ⅷ族,d区D.第四周期第ⅤB族,f区解析:+3价离子的核外有23个电子,则原子核外有26个电子,26号元素是铁,位于第四周期第Ⅷ族,位于d区。
答案:C5.某元素基态原子的最外层电子排布式为n s2,该元素( )A.一定是第ⅡA族元素B.一定是金属元素C.不是第ⅡA族元素就是副族元素D.可能是金属元素也可能是非金属元素解析:由于最外层电子排布式为n s2,则该元素可能是He元素、第ⅡA族元素或是过渡金属元素,所以综合起来讲,可能是金属元素也可能是非金属元素,答案选D。
答案:D6.某元素位于周期表中第四周期第ⅤA族,则该元素的名称和价电子排布式均正确的是( )A.砷4s24p3B.溴4s24p5C.磷4s24p3D.锑5s25p3解析:由于该元素为主族元素,价电子数=主族序数,故价电子数为5,排除B项。
又因周期数=电子层数,排除D项。
由元素在周期表中的位置可知,元素的价电子排布式为4s24p3,电子排布式为1s22s22p63s23p63d104s24p3,为33号元素砷,故A项正确。
答案:A7.(双选)下列说法中错误的是( )A.原子及其离子的核外电子层数等于该元素所在的周期数B.元素周期表中从ⅢB族到ⅡB族10个纵列的元素都是金属元素C.除氦外的稀有气体原子的最外层电子数都是8D.同一元素的各种同位素的物理性质、化学性质均相同解析:A项钠原子最外层电子在第3层,确实是第三周期元素,但是钠离子的最外层电子却是在第二层,与题目叙述不符,所以A项错误;B项从ⅢB族到ⅡB族,共经过7个副族,另有Ⅷ族的3列,所以共有10个纵列,它们所包括的元素都是金属元素,正确;C项稀有气体原子中只有氦原子最外层是2个电子,其他元素都是8电子稳定结构,正确;D项同一元素可以有多种同位素,它们的质量数不同,化学性质相同,但物理性质不相同,所以D项说法错误。
答案:AD8.若某原子的外围电子排布式为4d15s2,则下列说法正确的是( )A.该元素在元素周期表中的位置为第五周期第ⅢB族B.该元素位于s区C.该元素原子为非金属D.该元素原子N能层共有8个电子解析:根据构造原理可知,该元素原子有5个能层,因此位于元素周期表第五周期第ⅢB族,故A项正确。
由于其最后1个电子填充在了4d能级上,故位于元素周期表d区,是一种金属元素,所以B、C、D项错误。
答案:A9.下列说法中正确的是( )A.所有非金属元素都分布在p区B.最外层电子数为2的元素都分布在s区C.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素D.同一主族元素从上到下,金属性呈周期性变化解析:非金属元素中氢在s区,其余非金属元素均分布在p区,A项错误;最外层电子数为2的元素可能在s区(如Mg)、p区(如He)或d区(如Ti、Fe)等,B项错误;同主族元素从上到下,金属性增强,非金属性减弱,属递变性质而不是周期性变化,D项错误。
答案:C10.某元素简化电子排布式为[Xe]4f46s2,其应在( )A.s区B.p区C.d区D.f区解析:元素在周期表中的分区,取决于元素原子的最后一个电子所进入的能级,因最后一个电子进入f能级,所以该元素为f区元素。
答案:D11.某元素的原子具有三个电子层,关于其外围电子排布的说法正确的是( )A.只有s电子B.只有p电子C.有s、p电子D.只有s电子或有s、p电子解析:由题意知,该元素的外围价电子排布为3s1~2或3s23p1~6,故该元素外围电子排布可能只有s电子或s、p电子。
答案:D12.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是( )A.电子排布式为1s22s22p63s23p63d34s2B.该元素为VC.该元素为ⅡA族元素D.该元素位于d区解析:该元素为同族元素中原子序数最小的,所以该元素为第二周期或第四周期元素。
又因其价电子数≠最外层电子数,可推出该元素并不是第二周期元素,应为第四周期元素。
价电子排布式为3d34s2,故为23号元素V,属于d区元素。
答案:C13.某元素的原子序数为29,试问:(1)此元素原子的电子总数是个。
(2)它有个电子层,有个能级。
(3)它的外围电子排布式是。
(4)它属于第周期第族。
(5)它有个未成对电子。
解析:根据核外电子排布原理,该元素的核外电子排布式应为1s22s22p63s23p63d104s1,共有29个电子,故为Cu元素。
从核外电子排布式中可以得出n=4,有四个电子层,所以为第四周期元素,外围电子排布式为3d104s1,所以在第ⅠB族。
外围电子的电子排布图为,所以有1个未成对电子。
答案:(1)29(2)4 7(3)3d104s1(4)四ⅠB(5)114.X、Y、Z是第ⅠA~ⅦA族的三种非金属元素,它们在周期表中的位置如图所示。
试回答:(1)X元素单质的化学式是。
(2)Y元素的原子结构示意图是。
Y与Na所形成化合物的电子式为。
(3)Z元素的名称是,从元素原子得失电子的角度看,Z元素具有性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是,其价电子排布式为。
解析:在元素周期表中,非金属位于元素周期表中的右上方,三种元素均为非金属,必位于ⅤA、ⅥA、ⅦA三个主族,则可认定X必为氟,Y为硫,Z为砷。
答案:(1)F2(2)(3)砷金属性和非金属(或两) Z位于元素周期表中金属与非金属交界线附近4s24p315.在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起。
据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示。
(1)在s区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为。
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为,其中较稳定的是。
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为。
(4)在p区中,第二周期第ⅤA族元素原子价电子排布图为。
(5)当今常用于核能开发的元素是铀和钚,它们在区中。
解析:(1)s区为第ⅠA族、第ⅡA族,符合条件的元素为Be,其电子排布式为1s22s2,价电子的电子云形状为球形;(2)d区为第ⅢB族~第ⅦB族、第Ⅷ族,族序数最大且原子序数最小的为Fe,常见离子为Fe2+、Fe3+,电子排布式为1s22s22p63s23p63d6、1s22s22p63s23p63d5,由离子的电子排布式可知Fe3+的3d轨道“半充满”,其稳定性强于Fe2+;(3)ds区符合条件的为Zn,其电子排布式为1s22s22p63s23p63d104s2,价电子排布式为3d104s2;(4)该题中符合题意的为N,电子排布图为:;(5)铀和钚均为锕系元素,位于f区。
答案:(1)球形(2)Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5Fe3+(3)3d104s2(4)(5)f16.如图所示为元素周期表的大致框架(1)在如图所示元素周期表中画出金属元素与非金属元素的分界线。
(2)鉴于NaH的存在,有人建议可把氢元素归到第ⅦA族。
但根据氢元素最高正化合价与最低负化合价的绝对值相等,可把氢元素归到元素周期表中的第族。
(3)现有甲、乙两种元素,甲元素原子核外3p能级上有5个电子,乙元素的焰色反应呈黄色。
①在如图所示的元素周期表中,将甲、乙两元素的元素符号填在元素周期表中相应的位置。
②甲元素与硫元素相比较,非金属性较强的是(填元素名称),写出可以验证该结论的一个化学方程式:。
(4)铬是重金属污染的元凶之一,铬的相关信息如图卡片所示。
24 Cr铬52.00 3d54s1下列叙述不正确的是( )A.铬元素位于第四周期第ⅥB族B.铬元素的质子数是24C.铬元素是ds区元素D.工业含铬废水有毒,排放前应进行处理解析:(1)在周期表中沿着H、B、Si、As、Te、At和Al、Ge、Sb、Po划一条折线,即为金属元素和非金属元素的分界线。
(2)首先要灵活接受信息,有人建议可把氢元素归到ⅦA族,是因为NaH中的H-与X-(F-、Cl-、Br-、I-)有相似之处,即最低化合价相等。
当氢元素最高正化合价与最低负化合价的绝对值相等时,可认为氢元素处在周期表中第ⅣA族。
(3)①甲元素原子核外3p轨道上有5个电子,即该元素原子的核外电子排布式为1s22s22p63s23p5,由此可知甲为Cl元素;乙元素的焰色反应呈黄色,说明乙元素是Na元素。
甲位于周期表中第三周期第ⅦA族,乙位于周期表中第三周期第ⅠA族。
②同一周期元素的非金属性随着核电荷数的递增而增强,所以氯、硫相比,非金属性较强的是氯元素。
例如,Cl 2可以与H2S发生置换反应:H2S+Cl22HC l+S↓。
答案:(1)如图所示(2)ⅣA(3)①如图所示②氯H 2S+Cl22HCl+S↓(4)C。
