大学物理热学复习提纲
大学物理A热学复习

总面积
v O v1 v2
v O
v
f ( v ) d v 1
曲线的物理意义? 曲线下包围的面积的物理意义?
0
归一化条件
三 种 平均速率: v 速 率 方均根速率:
* v
p
v 最概然速率:p
2 kT m
2 RT
1 . 41
RT
RT
8 kT
m
8 RT
3 RT
1 . 60
mol
压强、温度、内能等概念 关于温度的意义,有下列几种说法: (1) 气体的温度是分子平均平动动能的量度. (2) 气体的温度是大量气体分子热运动的集体表现,具有统计 意义. (3) 温度的高低反映物质内部分子运动剧烈程度的不同. (4) 从微观上看,气体的温度表示每个气体分子的冷热程度. 这些说法中正确的是 (A) (1)、(2) 、(4). (B) (1)、(2) 、(3). (C) (2)、(3) 、(4). (D) (1)、(3) 、(4).
《热学》要求:
1.能从宏观和统计意义上理解压强、温度、内能等概念。了解系统的 宏观性质是微观运动的统计表现。掌握理想气体的状态方程。
2.了解气体分子的热运动图象。理解理想气体的压强公式和温度公式 的物理意义。 通过推导气体压强公式,了解从提出模型、进行统计平均、建立宏 观量与微观量的联系到阐明宏观量微观本质的思想和方法。 3.理解麦克斯韦速率分布律及速率分布函数和速率分布曲线的物理意 义。了解气体分子热运动的算术平均速率、均方根速率和最可几速率 的求法和意义。 4.理解气体分子平均能量按自由度均分原则,并会用该定理计算理想 气体的内能。 5.掌握功和热量的概念。理解平衡过程。理解绝热过程的过程方程。 掌握热力学第一定律。能熟练地分析、计算理想气体各等值过程和绝 热过程的功、热量、内能改变量及循环的效率。理解卡诺循环。 6.理解可逆过程和不可逆过程。理解热力学第二定律的两种表述。了 解这两种表述的等价性。
大学物理热学知识点整理

大学物理热学知识点整理热运动:物质世界的一种基本运动形式,是构成宏观物体的大量微观粒子的永不停息的无规则运动。
热现象:构成宏观物质的大量微观粒子热运动的集体表现。
宏观量:表征系统状态的物理量。
微观量:描写单个分子特征的物理量。
热力学系统,简称系统:一些包含有大量微观粒子(如分子、原子)的物体或物体系。
外界或环境:系统以外的物体。
孤立系统:与外界没有任何相互作用的热力学系统。
封闭系统:与外界没有物质交换但有能量交换的系统。
开放系统:与外界既有物质交换又有能量交换的系统。
平衡态:对于一个孤立系,经过足够长的时间后,系统必将达到一个宏观性质不随时间变化的状态,这种状态称为平衡态。
热动平衡:在平衡态下,组成系统的微观粒子仍处在不停的无规则热运动之中,只是它们的统计平均效果不变,这是一种动态的平衡,又称为热动平衡。
状态参量:在平衡态下,热力学系统的宏观性质可以用一些确定的宏观参量来描述,这种描述系统状态的宏观参量称为状态参量。
态函数:由平衡态确定的其他宏观物理量可以表达为一组独立状态参量的函数,这些物理量称为“态函数”。
体积V :气体分子所能到达的空间,即气体容器的容积。
单位立方米( m^{3} ),也用升( L )为单位。
压强p :气体作用与容器壁单位面积上的压力,是大量分子对器壁碰撞的宏观表现。
SI单位制中单位是帕斯卡,简称帕( Pa ), 1\;Pa=1\;N/m^{2} 。
有时压强的单位还用大气压( atm )和毫米汞柱( mmHg )表示。
换算关系为1\;atm=1.013\times10^{5}\;Pa1\;mm\Hg=\frac{1}{760}\;atm=1.33\times10^{2}\;Pa温度:表征物体的冷热程度的物理量。
热平衡:在与外界影响隔绝的条件下,使两个热力学系统相互接触,让它们之间能发生传热,热的系统会慢慢变冷,冷的系统会慢慢变热,经过一段时间后,它们会达到一个共同的平衡状态,称这两个系统达到了热平衡。
大学物理热学知识点整理

大学物理热学知识点整理系统吸收的热量,一部分转化成系统的内能;另一部分转化为系统对外所作的功。
Q=\Delta E+A上式的各量均为代数量,其正负号规定为:系统从外界吸热时, Q 为正,向外界放热时, Q 为负;系统对外作功时,A 为正。
外界对系统作功时, A 为负;系统内能增加时,\Delta E 为正,系统的内能减少时, \Delta E 为负。
对于状态的微小变化过程,热力学第一定律的数学表达式dQ=dE+dA第一类永动机:一种不需要外界提供能量而连续不断对外作功,系统又能复原的机器。
等体过程:dV=0 ,系统作功dA=pdV=0dQ_v=dE=\frac{M}{M_{mol}}\frac{i}{2}RdT所以 Q_v=\Delta E=E_2-E_1=\frac{M}{M_{mol}}\frac{i}{2}R(T_2-T_1)在等体过程,外界传给气体的热量全部用来增加气体的内能,系统对外不作功。
等压过程: p =恒量,当气体体积从 V_1 膨胀到 V_2 时,系统对外作功为A_p=\int_{V_1}^{V_2}pdv=p(V_2-V_1)=\frac{M}{M_{mol}}R(T_2-T_1)系统吸收的热量为Q_p=\Delta E+p(V_2-V_1)=\frac{M}{M_{mol}}(\frac{i}{2}+1)R(T_2-T_1)等温过程: \Delta E=0Q_T=A_T=\int_{V_1}^{V_2}pdv=\frac{M}{M_{mol}}RT\ln\fra c{V_2}{V_1}因为 pV=常量,即 p_1V_1=p_2V_2所以 Q_T=A_T=\frac{M}{M_{mol}}RT\ln\frac{p_1}{p_2}摩尔热容 C_m: 1mol 物质温度升高(或降低) 1K 时所吸收(或放出)的热量,单位为 J/mol\cdot K 。
C_m=\frac{(dQ)_m}{dT}理想气体等体摩尔热容:C_V=\frac{dQ_V}{dT}=\frac{dE}{dT}=\frac{\frac{i}{2}RdT }{dT}=\frac{i}{2}Ri 为分子自由度; R 为普适气体常量。
大学热学物理知识点总结

大学热学物理知识点总结1.热力学基本定律热力学基本定律是热学物理的基础,它包括三个基本定律,分别是热力学第一定律、热力学第二定律和热力学第三定律。
(1)热力学第一定律热力学第一定律是能量守恒定律的热学表述,它规定了热力学系统能量的守恒性质。
简单地说,热力学第一定律表明了热力学系统能量的增减只与系统对外界做功和与外界热交换有关。
热力学第一定律的数学表达式为ΔU=Q-W,其中ΔU表示系统内能的增量,Q表示系统吸热的大小,W表示系统对外界所作的功。
由此可以看出,系统的内能变化量等于吸收热量减去做的功。
(2)热力学第二定律热力学第二定律是热力学系统不可逆性的表述,它规定了热力学系统内部的熵增原理,即系统的熵不会减小,而只会增加或保持不变。
简单地说,热力学第二定律表明了热力学系统内部的任何一种热力学过程都是不可逆的。
这意味着热力学系统永远无法使热量全部转化为功,总会有一部分热量被转化为无效热。
热力学第二定律还表明了热力学过程的方向性,即热量只能从高温物体传递到低温物体,而不能反向传递。
(3)热力学第三定律热力学第三定律规定了当温度趋于绝对零度时,任何物质的熵都将趋于一个有限值,这个有限值通常被定义为零。
简单地说,热力学第三定律表明了在绝对零度时,任何系统的熵都将趋于零。
热力学第三定律的提出对于热学物理的研究具有非常重要的意义,它为我们理解热学系统的性质提供了重要的基础。
2.热力学过程热力学过程是指热力学系统内部发生的一系列变化,包括各种状态参数的变化和热力学系统对外界的能量交换。
常见的热力学过程有等温过程、绝热过程、等容过程和等压过程等。
这些过程在日常生活以及工业生产中都有着广泛的应用。
(1)等温过程等温过程是指在恒定温度下进行的热力学过程。
在等温过程中,系统对外界做的功和吸收的热量之比是一个常数。
这意味着等温过程的压强和体积成反比,在P-V图上表现为一条双曲线。
常见的等温过程有等温膨胀和等温压缩等。
(2)绝热过程绝热过程是指在无热交换的情况下进行的热力学过程。
大学物理热学复习提纲

期 末 复 习理想气体状态方程一、 理想气体:温度不太低,压强不太高的实际气体可视为理想气体。
宏观上,在任何情况下都符合玻-马、盖-吕、查理三定律的气体。
二、 三个实验定律:(1)玻—玛定律: pV = 常数 或 T = 常数(2)盖.吕萨克定律:VT = 常数 或 p = 常数 (3)查理定律: TP = 常数 或 V = 常数 三、 理想气体状态参量:体积(V ),压强(p ),温度(T ) ;内能(E ),焓(H ),熵(S ),摩尔数(ν )四、 理想气体分子模型:①全同质点;②弹性碰撞;③除碰撞瞬间外无相互作用,忽略重力五、普遍适用112212T T = :状态变化中质量不变阿佛伽德罗定律: p nkT = 六、 道尔顿分压定律:● 混合气体的压强等于组成混合气体的各成分的分压强之和● (几种温度相同的气体混于同一容器中,各气体的平均平动动能相等)● 12112212222()333t t t p n n n n p p =++=++=++εεε七、 关于p nkT =:1. 是状态方程的微观式,大学物理中常用此式2. 式中N N n V V ==d d :气体的分子数密度,即单位体积内的分子数3. R = 8.31 J/(mol ·K) :普适气体常数4.231238.31 1.3810J K 6.0210A R k N --===⨯⋅⨯:玻耳兹曼常量八、 关于压强p :● Γ:单位时间内碰在单位面积器壁上的平均分子数(气体分子碰壁数)●压强p :单位时间内气体(全部分子)① 压强的定义体现了统计平均。
② V x >0的分子占总分子的一半,或分子速度在某方向的分量平均值为0 ● (例如:在x 方向,有0x v =;在y 方向,有0y v =;在z 方向,有0z v =)这是机会均等的表现。
③ 2213x v v = 也是机会均等的表现。
④ 22i ixx i n v v n =∑∑是统计平均的表现。
大学物理(热学知识点总结)

热力发电
利用高温热源和低温热源 之间的温差,通过热力循 环将热能转化为机械能, 再转化为电能。
04
热传递原理
导热、对流和辐射的原理
01 02
导热原理
导热是物质内部微观粒子(如分子、原子等)相互碰撞,将能量从高温 处传到低温处的现象。导热速率与物质的导热系数、温度梯度以及热流 路径的长度有关。
对流原理
热学的发展历程
古代对热现象的认识
01
人类很早就开始对热现象进行观察和利用,如火的使用、烧制
陶器等。
近代热学的形成
02
随着工业革命和科学技术的发展,热学逐渐形成一门独立的学
科,开始有越来越多的学者对热现象进行研究。
现代热学的应用
03
热学在能源利用、环境保护、航天航空等领域得到广泛应用,
成为推动人类社会发展的重要力量。
大学物理(热学知识点总 结)
• 热学概述 • 热力学第一定律 • 热力学第二定律 • 热传递原理 • 热力学与日常生活
01
热学概述
热学的定义与重要性
定义
热学是一门研究热现象的学科,主要 探讨热量传递、热力学过程和热力学 定律等方面的内容。
重要性
热学是物理学的重要分支之一,与日 常生活、工程技术和科学研究密切相 关,对于理解物质的基本性质和变化 规律具有重要意义。
证明
热力学第一定律也可以通过实验来证明。例如,通过测量封闭系统中热量转移和相应体积变化等实验数据,可以 验证热力学第一定律。
定律的应用实例
实例1
在汽车发动机中,燃料燃烧产生的热量转化为机械能,驱动汽车行驶。这正是 热力学第一定律的应用,即能量从一种形式(化学能)转化为另一种形式(机 械能)。
大一热学章节知识点梳理

大一热学章节知识点梳理
大一热学一般包括以下几个章节:热力学基本概念、热力学过程、气体分子动理论、杨氏模型、热传导、热辐射和热力学第一定律。
1.热力学基本概念:
a.热、温度、热平衡、热力学系统的概念及基本性质。
b.简单系统与复合系统。
c.宏观状态和微观状态的区别。
d.焓、压强、体积和温度的关系。
2.热力学过程:
a.等压过程、等容过程、等温过程、绝热过程的基本概念和性质。
b.理想气体状态方程和摩尔气体状态方程的推导和应用。
c.等温扩张、等容加热等过程的计算问题。
3.气体分子动理论:
a.理想气体模型的假设。
b.气体分子的运动状态和分布速率。
c.理想气体的分子平均动能和平均自由程。
4.杨氏模型:
a.杨氏模型的基本假设和推导过程。
b.真实气体与杨氏模型的比较。
c.统计力学与杨氏模型的关系。
5.热传导:
a.热传导的基本概念和机制。
b.热传导的数学模型。
c.热传导的应用和问题求解。
6.热辐射:
a.热辐射的基本概念和性质。
b.热辐射的黑体辐射和普朗克定律。
c.热辐射的应用和问题求解。
7.热力学第一定律:
a.热力学第一定律的基本概念和表述。
b.等温过程和绝热过程中的热量传递。
c.热力学第一定律的应用和问题求解。
以上是大一热学章节的主要知识点梳理,每个章节都有其重要性和应用性。
在学习过程中,可以结合实际应用和例题进行理解和掌握。
此外,还可以通过实验和实践来加深对热学知识的理解和应用能力。
大学物理总复习——热学

3 R 2
气体定体摩尔热容 :____________________ , 气体定压摩尔热容 :________________
(3)
5 R 2
P128二、19. 用绝热材料制成的一个容器,体积为2V0, 被绝热板隔成A、B 两部分,A 内储有1 mol单原子分子 理想气体,B 内储有2 mol 刚性双原子分子理想气体,A、 B 两部分压强相等均为p0,两部分体积均为V0,则 3p0V0/2 ;EB= (1)两种气体各自的内能分别为EA=________ 5p0V0/2 ________; (2) 抽去绝热板,两种气体混合后处于平衡时的温度为T =______。 8p0V0/13R
式中A为常数.则该电子气电子的平均速率为
A 2 (A) v m 3
(B)
A 4 vm 4
(C) v
m
A 2 (D) v m 3
答:[ B ]
P127二、7. 质量为 6.2×10−14 g 的某种粒子悬浮于 27℃的气体中,观察到它们的方均根速率为 1.4cm/s, 则该种粒子的平均速率为_________________。(设 粒子遵守麦克斯韦速率分布律)
P56 6. 用公式 E CV、m T 式中CV为定体摩尔热容 、m
量,视为常量,ν 为气体摩尔数)计算理想气体内能 增量时,此式 (A) 只适用于准静态的等体过程. (B) 只适用于一切等体过程. (C) 只适用于一切准静态过程. (D) 适用于一切始末态为平衡态的过程. 答:[ D ]
200
(C)
10 R
(B)
400
10 R
答:[ c ]
10 R 10 R 200 + 2 (D) 400 10 R + 10 R 2
大学物理热学复习参考

大学物理热学复习参考《热学》复习参考基本概念部分导论1.热学是研究什么的?(宏观:热现象;微观:热运动)2.什么是热运动?它的特点是什么?(粒子的大量性和运动的无规性)3.热学研究的对象是什么?(大量微观粒子组成的宏观系统)4.热学有哪些研究方法?(宏观:热力学;微观:统计物理)它们各自的特点是什么?5.热学是怎么分类的?(从方法分:热力学、统计物理学;从对象的状态分:平衡态、非平衡态、相变)第一章1.平衡态1.1 什么是力学中的平衡?1.2 什么是热学中的平衡态?1.3 平衡态是否只适用于孤立系?(一个处于平衡态的系统的子系统)1.4 平衡态是否适用于有外场的系统?1.5 在研究大气时,重力场算不算“外界影响”?1.6 平衡态是否只适用于均匀系?(两相平衡共存;或外力场中)1.7 系统处于平衡态时,其宏观性质是否一定各处相同?(有外场时)1.8 什么是热平衡和热动平衡?热动平衡的条件是什么?1.9 从微观量子统计的角度,所谓平衡指的是什么?(细致平衡、H定理、最概然分布、玻尔兹曼关系)1.10怎么区别热学中的平衡态和稳定态?(内部是否存在宏观的“流”)2. 温度2.1 由热0律怎样得出温度的宏观定义的?2.2 温度的基本特征是什么?2.3 从微观的角度,两个系统热平衡的实质是什么?2.4 温度的微观意义是什么?它是怎么得到的?2.5 温度是决定于分子的平均动能,还是平均平动能,或者平均能量?2.6 极稀薄的气体有稳定的温度吗?为什么?2.7 单个分子有温度吗?温度是宏观概念还是微观概念?2.8 地球外层的大气的温度很高(约103K),这时人是会热死还是会冻死?为什么?2.9 人对冷热的感觉与哪些因素有关?2.10 从量子统计的角度温度高意味着什么?2.11 电风扇的作用是降低温度吗?3. 温度的测量3.1 什么是温标?3.2 什么是经验温标?经验温标的主要缺点是什么?3.3 建立温标有哪些要素?3.4 有哪些常用温标?它们的关系怎样?3.5 为什么要引入理想气体温标?对气体温度计是否存在一种气体比另一种更好?3.6 什么是理论温标?有何优点?怎么实现?3.7 什么是国际温标(ITS -90)?3.8 你知道哪些常用温度计?它们的测温属性是什么?3.9 你认为应怎样测量下列物体的温度?(太阳、高空的大气、地心、昆虫、月球、海底、钢水……)4. 热量4.1 热的本质是什么?人们是怎么知道的?4.2 热量、温度和热能的区别是什么?4.3 “今天天气很热”这句话意味着什么?4.4 人们冬天在室外摸到金属比木头冷,说明金属比木头温度低吗?4.5 什么是热容量、比热、摩尔热容?4.6 什么是潜热?相变时为什么伴有潜热?4.7 相变时为什么吸收或放出潜热而温度不变?5. 分子动理论(运动论)5.1 理论的基本观点是什么?5.2 你怎么知道分子间存在着空隙?5.3 你怎么知道分子在不停地进行无规运动?5.4 你怎么知道分子间存在着相互作用力?6. 理想气体压强6.1 什么是理想气体?6.2 理想气体模型的基本假设是什么?6.3 理想气体压强的实质是什么?6.4 理想气体压强公式是怎么得到的?6.5 试由理想气体温度和压强的公式推导理想气体的状态方程。
大学物理热学部分复习资料
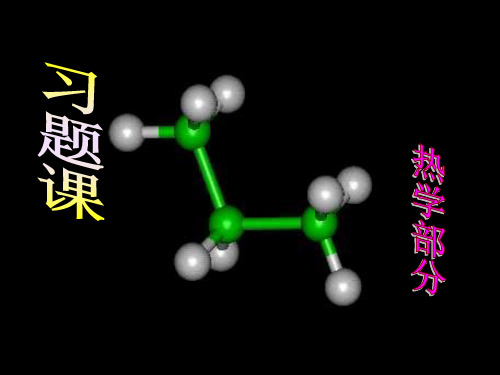
W净= 曲线所围的面积 = Q1 + Q2 + ⋯ + Qn
20122012-1-3
20
热学习题课
1. 热机循环
p a O Q 1 A Q 2 V
W = Q1 − Q2
高温热源 T1 Q1 热机 W Q2 低温热源 T2 逆循环: 逆循环: 逆时针 热机效率
W = 1 − Q2 η= Q1 Q1
正循环: 正循环: 顺时针
dN :v − v + dv区间内的分子 N 数占 总分 子数 的百 分比 dN = f ( v ) dv N
四、麦克斯韦速率分布律
f (v)
dS
1.速率分布函数: 速率分布函数: 速率分布函数
dN f (v) = Ndv
o
d S = f ( v ) dv
内的分子数占总分子数
的百分比
v v + dv
∞
3.麦氏分布函数 麦氏分布函数
8kT 8RT v= = πM πm
平方平均速率
v = ∫ v2 f ( v) dv
2 0 ∞
m f ( v ) = 4π 2kT f (v) f max
3/ 2
e
mv 2 − 2 kT
v2
方均根速率
vrms 3kT 3RT = v = = m M
平均自由程
λ =
1 = 2 2πd n
kT 2 πd2p
20122012-1-3
15
热学习题课
热力学基础 一、热力学第一定律 系统对外做功 ∆V > 0,W > 0 外界对系统做功 ∆V < 0,W < 0 系统从外界吸收的热量 从外界吸收的热量, 系统从外界吸收的热量, 内能增量 i ∆E = ν ⋅ R∆T = ν CV ∆T 一部分使系统的内能增加, 一部分使系统的内能增加,另 2 i 一部分使系统对外界做功. 一部分使系统对外界做功. 定体摩尔热容 CV = R 2 其中 定压摩尔热容 C p = CV + R dW = pdV
大学物理热学知识点

大学物理热学知识点一、理论基础力学1、运动学参照系。
质点运动的位移和路程,速度,加速度。
相对速度。
矢量和标量。
矢量的制备和水解。
匀速及匀速直线运动及其图象。
运动的合成。
抛体运动。
圆周运动。
刚体的对应状态和绕定轴的旋转。
2、牛顿运动定律力学中常用的几种力牛顿第一、二、三运动定律。
惯性参照系的概念。
摩擦力。
弹性力。
胡克定律。
万有引力定律。
光滑球壳对壳内和壳外质点的引力公式(不建议求出)。
开普勒定律。
行星和人造卫星的运动。
3、物体的平衡共点力促进作用下物体的均衡。
力矩。
刚体的均衡。
战略重点。
物体平衡的种类。
4、动量冲量。
动量。
动量定理。
动量守恒定律。
反冲运动及火箭。
5、机械能功和功率。
动能和动能定理。
重力势能。
引力势能。
质点及光滑球壳壳内和壳外的引力势能公式(不建议求出)。
弹簧的弹性势能。
功能原理。
机械能守恒定律。
相撞。
6、流体静力学恒定流体中的应力。
浮力。
7、振动简揩振动。
振幅。
频率和周期。
位相。
振动的图象。
参考圆。
振动的速度和加速度。
由动力学方程确认四极振动的频率。
阻尼振动。
受迫振动和共振(定性了解)。
8、波和声横波和纵波。
波长、频率和波速的关系。
波的图象。
波的干预和绕射(定性)。
声波。
声音的响度、音调和音品。
声音的共鸣。
乐音和噪声。
热学1、分子动理论原子和分子的量级。
分子的热运动。
布朗运动。
温度的微观意义。
分子力。
分子的动能和分子间的势能。
物体的内能。
2、热力学第一定律热力学第一定律。
3、气体的性质热力学温标。
理想气体状态方程。
普适气体恒量。
理想气体状态方程的微观解释(定性)。
理想气体的内能。
理想气体的等容、等压、等温和绝热过程(不要求用微积分运算)。
4、液体的性质流体分子运动的特点。
表面张力系数。
浸润现象和毛细现象(定性)。
5、液态的性质晶体和非晶体。
空间点阵。
液态分子运动的特点。
6、物态变化熔融和凝结。
熔点。
熔解热。
蒸发和凝结。
饱和汽压。
沸腾和沸点。
汽化热。
临界温度。
液态的升华。
空气的湿度和湿度计。
大学物理(热学篇)

v1
v´1
x
A1 y °
z
1秒钟A1受到分子的总冲量
2mv x
vx 2x
mv
2 x
x
第三步 N个分子在1秒内对A1的碰撞
A1在1秒内受到的冲量——平均作用力F
F 2mv1x
v1 x 2x
2mv2x
v2x 2x
2mv Nx
vNx 2x
m x
(v12x
v22x
vN2 x )
m x
N
即在平衡态,一个自由度,代表一种独立的 运动和一份能量
如某种分子有t个平动自由度,r个转动自由度v振动 自由度,则分子具有:
平均平动动能 平均转动动能 平均振动动能
为什么均分到各自由度所对应的运动能量都 是二分之一KT呢? 主要是分子不断碰撞以达到平衡态的结果。
注意
1、 一般温度下(T <10 3 K)振
(1)每个分子作用于气壁的冲量I
解(1)每个分子作用于气壁的冲量等于气体 分子动量增量的负值
I 2mv 1.21024kgm/ s
(2)每秒钟碰在器壁单位面积上的分子数n0
解(2)器壁ΔA面积上在Δt时间内碰撞的分子数
N A vt n
z
6
n0
N At
nv 6
n0
1 6
nv
0.31028
/
m3
物体运动形式:平动、转动、振动
自由度数目 i t r v
平转振 动动动
例1 自由运动的质点 (三维空间) 3 个 平动自由度 记作 t = 3
若受到限制,自由度降低 平面上 : t=2 直线上 :t=1
例2 自由运动刚体 (如手榴弹)自由度。
大学物理(热学知识点总结)

7、bca为理想气体绝热过程,b1a和b2a是任意过程,则上述两 过程中气体作功与吸收热量的情况是: A) b1a过程放热,作负功;b2a过程放热,作负功. B) b1a过程吸热,作负功;b2a过程放热,作负功. C)b1a过程吸热,作正功;b2a过程吸热,作负功. D) b1a过程放热,作正功;b2a过程吸热,作正功.
[1]、有一定量的理想气体,从初状态 a (P1 、V1 )开始, 经过一个等容过程达到压强为P1 / 4 的 b 态,再经过一个等 压过程达到状态C ,最后经过等温过程而完成一个循环, 求:该循环过程中系统对外作的功A 和所吸收的热量Q。 解:由已知可得: a( P 1 ,V1 )
循环过程
E 0 Q A V V1 1) a b A 0 2) b c A p1 (4V1 V1 ) / 4 3 p1V1 / 4 3) c a A p1V1 ln( V1 / 4V1 ) p1V1 ln4
p (105 Pa) 3 2 1 O A 1 2 C V (103 m3) B
解:(1) A→B:
A1
ΔE1= CV (TB-TA)=3(pBVB-pAVA) /2=750 J Q=A1+ΔE1=950 J. B→C: A2 =0 ΔE2 = CV (TC-TB)=3( PCVC-PBVB ) /2 =-600 J. Q2 =A2 +ΔE2 =-600 J. C→A: A3 = PA (VA-VC)=-100 J.
解( : 1) 等 容 过 程 , A 0, 外 界 对 气 体 作 功 A 0 M i Q E CV T RT M mol 2 0.02 3 8.31 ( 300 290 ) 623 ( J ). 0.004 2 (2)等压过程, E 与 ( 1) 同 。
热学总复习提纲

2009年 热学总复习提纲第一章 温度1、基本概念:孤立系;封闭系;开放系统;平衡态; 稳恒态;温度。
2、掌握:温标建立的三要素及类型;温度计类型;理想气体温标特点。
3、熟练掌握:理想气体状态方程。
4、熟练掌握常数:5、熟练掌握混合理想气体状态方程6、了解Van der Waals 方程:1mol 实际气体: 任意质量实际气体:第二章气体分子运动论的基本概念(气体动理论) 1. 了解物质微观模型2、熟练掌握理想气体微观模型(1) 分子本身的线度比起分子之间的距离小得对多而忽略不计。
(2) 除碰撞的一瞬间外,分子间相互作用力可忽略不计。
(3) 处于平衡态的理想气体,分子之间及分子与器壁间的碰撞是完全弹性的碰撞。
在标准状态下,1摩尔理想气体中的分子数:例如固体氮:分子紧密排列,分子的半径:3、熟练掌握理想气体的压强公式(气动理论的基本公式)4、熟练掌握温度的微观意义地球的逃逸速度=11.2km.s-1。
RT MRT PV μυ==RTP V M μρ==mol N A2310023.6⨯=K mol J R .31.8=K J N R k A231038.1-⨯==VV i i =α∑=ii μαμM M i i =β∑=ii μβμ1RT b v v a P =-+))((2RT M b M V Va M p μμμ=-+))((22232500107.2-⨯==m v N n A mn L 9310103.31-⨯≈⎪⎪⎭⎫ ⎝⎛=33.1000.1-⨯=m kg ρ3341r n π=m N n r A N 103131103.343432-⨯≈⎪⎪⎭⎫ ⎝⎛=⎪⎭⎫ ⎝⎛=πρμπεn P 32=nkT P =μRT m kT v v rms 332===22123mv kT ==ε计算大气中如下各分子逃逸速度与方均根速度之比(0℃)。
H2、He 、H2O 、N2、O2,试解释地球大气里H2、He 未能保住,主要成分是N2、O2的原因。
大学物理热学知识点归纳总结

大学物理热学知识点归纳总结在大学物理中,热学是一个重要的分支学科,研究热与能量的传递、转化以及物体的热性质。
下面将对大学物理热学的知识点进行归纳总结,帮助读者更好地理解和掌握这一领域的知识。
一、热传递1. 热传递方式热传递主要有三种方式:传导、对流和辐射。
传导是通过物质内部的分子碰撞传递能量;对流是通过流体的运动传递能量;辐射是通过波的传播传递能量。
2. 热传导定律热传导可以用傅里叶定律来描述,该定律表示热流密度与温度梯度成正比。
热传导系数是描述物质导热性能的物理量。
3. 对流换热对流换热是通过流体对流传热的现象,常见的例子包括空气对流、水的对流等。
对流换热可以通过牛顿冷却定律进行计算。
4. 辐射换热辐射换热是通过电磁波的辐射传递能量,不需要介质参与。
斯特藩-玻尔兹曼定律描述了辐射换热的关系,还有黑体辐射以及斯特藩定律可用于描述辐射换热的各种特性。
二、热力学1. 温度和热量温度是物体内部分子热运动的强弱程度的度量,用热力学温标来表示;热量是物体之间传递的热能。
2. 理想气体状态方程理想气体状态方程描述了气体的状态参数之间的关系,一般形式为PV = nRT,其中P是气体的压强,V是体积,n是物质的物质量,R是理想气体常数,T是温度。
3. 热力学第一定律热力学第一定律是能量守恒定律在热学过程中的表现,表示了热量与功的转化关系。
ΔU = Q - W,其中ΔU是内能变化,Q是吸收的热量,W是对外界做的功。
4. 热力学第二定律热力学第二定律描述了自然界热现象发生的方向性,主要有熵增定律和开尔文定律。
熵增定律指出自发过程的总熵增不会小于零,开尔文定律则根据热机和热泵的运行原理提出了热力学温标的概念。
三、热量传递的应用1. 热膨胀热膨胀是物体随着温度变化而引起的体积、长度等物理量的变化。
线膨胀、面膨胀和体膨胀是常见的热膨胀现象,可以通过热膨胀系数进行定量描述。
2. 热传感器热传感器是利用物体温度变化引起的一些物性变化进行温度测量的装置,如热电偶、热电阻等。
物理热学知识点复习

物理热学知识点复习物理热学是自然科学的重要分支,研究物质的热现象及其规律。
掌握物理热学的基本知识点,对我们理解并应用于日常生活和工程领域具有重要意义。
本文将对物理热学的几个重要知识点进行复习。
一、热力学基础概念1. 热量:物体之间的热能传递,通常以Q表示,单位为焦耳(J)。
2. 温度:反映物体分子运动热度的物理量,通常以T表示,单位为摄氏度(℃)或开尔文(K)。
3. 热平衡:指物体之间没有热量传递时的状态。
4. 冷热交换:两个物体之间的热量传递,从高温物体到低温物体流动。
根据热力学第一定律,热量输入等于热量输出。
二、热力学定律1. 热力学第一定律:能量守恒定律,即能量不会消失也不会产生,只会转化形式或者传递。
对系统而言,热量Q与内能增量ΔU以及对外做的功W之间的关系为:Q = ΔU + W。
2. 热力学第二定律:热量不会自行由低温物体传递到高温物体,热力学第二定律定义了熵(S)的概念,增加系统的熵要求系统内的能量转化成无用的热量。
3. 热力学第三定律:当温度接近绝对零度时,任何纯净物质的熵趋向于零。
这一定律描述了物体在绝对零度时不可能取得的状态。
三、热力学循环热力学循环是指在某些特定条件下,物体或者系统从一个状态经过一系列变化后最终回到初始状态的过程。
常见的热力学循环有卡诺循环、布雷顿循环等。
四、热力学性质1. 热容:物体在温度变化时吸收或释放的热量与温度变化之间的关系。
热容可分为常压热容和定容热容。
2. 热膨胀:物体体积随温度升高而增大的现象,分为线膨胀和体膨胀。
3. 相变:物质由一个相态转变为另一个相态的过程,例如固态与液态之间的熔化、液态与气态之间的汽化等。
4. 热导率:物质传导热量的能力,是描述物质导热性能的物理量。
5. 热辐射:物体通过辐射形式传递热量的现象,热辐射与物体温度及其表面特性有关。
五、热力学方程1. 理想气体状态方程:PV = nRT,其中P为气压,V为体积,n为物质的物质的摩尔数,R为气体常数,T为温度。
物理重点大纲热学基础

物理重点大纲热学基础热学是物理学中的一个重要分支,研究能量的传递、转化和储存以及与物质性质之间的关系。
本文将介绍物理重点大纲中热学的基础知识。
一、热量和温度热学的基础是研究热量和温度的关系。
热量是一种能量的传递形式,是由于物体之间的温度差异而发生的能量传递。
温度则是物体内分子或原子运动状态的一种度量。
温度的单位常用摄氏度(℃)或开尔文(K)来表示。
二、热力学定律热力学是热学的一个重要分支,主要研究热现象和能量转化的规律。
在物理重点大纲中,有三条热力学定律被广泛讨论。
1. 第一定律:能量守恒定律第一定律或能量守恒定律指出,能量不会凭空消失或产生,只能从一种形式转化为另一种形式。
热力学定律的基本假设是能量守恒。
2. 第二定律:熵增定律第二定律或熵增定律描述了自然界中热量传递的方向性。
熵是描述系统无序状态的物理量。
熵增定律指出,孤立系统中熵(无序度)永远不会减少,只会增加或保持不变。
3. 第三定律:绝对零度定律第三定律或绝对零度定律是热力学的基本原理之一。
它说明在温度绝对零度(0K)时,物质的熵趋近于零。
这意味着在绝对零度下,物质的分子停止运动,达到最低能量状态。
三、热力学过程热力学过程指的是物体经历的状态变化过程。
在物理重点大纲中,有几种常见的热力学过程需要重点关注。
1. 等压过程等压过程是指在恒定的压力下进行的热力学过程。
在等压过程中,系统对外做功的量等于系统吸收的热量。
2. 等体过程等体过程是指在恒定的体积下进行的热力学过程。
在等体过程中,系统不对外做功,能量转化仅发生在系统内部。
3. 等温过程等温过程是指在恒定的温度下进行的热力学过程。
在等温过程中,系统的内能变化为零,能量转化仅发生在系统与外界之间。
四、热力学系统热力学系统是指研究的对象,以及与系统相互作用的外部环境。
在物理重点大纲中,有几种常见的热力学系统需要了解。
1. 封闭系统封闭系统是与外界不进行物质交换,但可以进行能量交换的系统。
在封闭系统中,能量是系统与外界之间唯一的交换形式。
热学 提纲
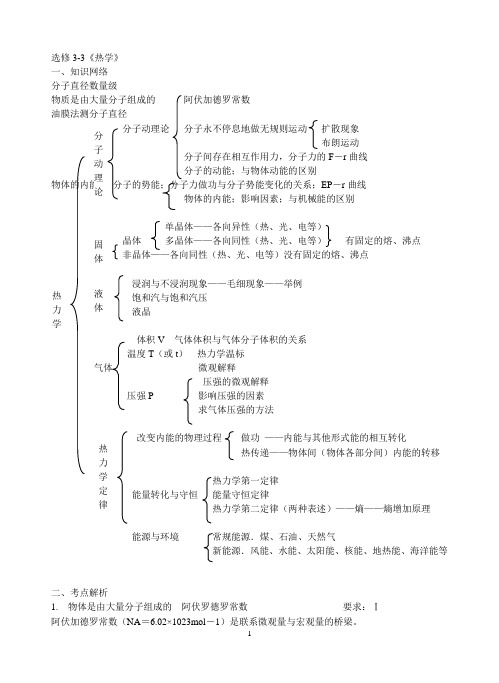
选修3-3《热学》一、知识网络分子直径数量级物质是由大量分子组成的 阿伏加德罗常数 油膜法测分子直径分子动理论 分子永不停息地做无规则运动 扩散现象 布朗运动 分子间存在相互作用力,分子力的F -r 曲线 分子的动能;与物体动能的区别 物体的内能 分子的势能;分子力做功与分子势能变化的关系;EP -r 曲线 物体的内能;影响因素;与机械能的区别单晶体——各向异性(热、光、电等)晶体 多晶体——各向同性(热、光、电等) 有固定的熔、沸点 非晶体——各向同性(热、光、电等)没有固定的熔、沸点浸润与不浸润现象——毛细现象——举例饱和汽与饱和汽压液晶 体积V 气体体积与气体分子体积的关系温度T (或t ) 热力学温标气体 微观解释压强的微观解释压强P 影响压强的因素求气体压强的方法改变内能的物理过程 做功 ——内能与其他形式能的相互转化热传递——物体间(物体各部分间)内能的转移热力学第一定律能量转化与守恒 能量守恒定律热力学第二定律(两种表述)——熵——熵增加原理能源与环境 常规能源.煤、石油、天然气新能源.风能、水能、太阳能、核能、地热能、海洋能等二、考点解析1. 物体是由大量分子组成的 阿伏罗德罗常数 要求:Ⅰ阿伏加德罗常数(NA =6.02×1023mol -1)是联系微观量与宏观量的桥梁。
分 子 动 理 论 热力 学固体 热力学定律 液体注意两个要求:①两个量中必须一个为宏观量,另一个为微观量②宏观量与微观量必须是同一物理量,如同为质量、同为体积(直径)等设分子体积V0、分子直径d 、分子质量m ;宏观量为.物质体积V 、摩尔体积V1、物质质量M 、摩尔质量μ、物质密度ρ。
(1)分子质量:A A ==N V N m ρμ(2)分子体积:A A 10PN N V V μ==(对气体,V0应为气体分子占据的空间大小)(3)分子直径:○1球体模型.V d N =)2(343A π303A 6=6=ππV N V d (固体、液体一般用此模型)○2立方体模型.30=V d (气体一般用此模型) (对气体,d 应理解为相邻分子间的平均距离)(4)分子的数量:A 1A 1A A ====N V V N V M N V N Mn ρμρμ固体、液体分子可估算分子质量、大小(认为分子一个挨一个紧密排列);气体分子不可估算大小,只能估算气体分子所占空间、分子质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
期 末 复 习理想气体状态方程一、 理想气体:温度不太低,压强不太高的实际气体可视为理想气体。
宏观上,在任何情况下都符合玻-马、盖-吕、查理三定律的气体。
二、 三个实验定律:(1)玻—玛定律: pV = 常数 或 T = 常数(2)盖.吕萨克定律:VT= 常数 或 p = 常数(3)查理定律: TP= 常数 或 V = 常数 三、 理想气体状态参量:体积(V ),压强(p ),温度(T ) ;内能(E ),焓(H ),熵(S ),摩尔数(ν )四、 理想气体分子模型:①全同质点;②弹性碰撞;③除碰撞瞬间外无相互作用,忽略重力五、普遍适用112212p V p V T T = :状态变化中质量不变阿佛伽德罗定律: p nkT = 六、 道尔顿分压定律:● 混合气体的压强等于组成混合气体的各成分的分压强之和● (几种温度相同的气体混于同一容器中,各气体的平均平动动能相等)●12112212222()333t tt p n n n n p p =++=++=++εεε七、 关于p nkT =:1. 是状态方程的微观式,大学物理中常用此式2. 式中N Nn V V==d d :气体的分子数密度,即单位体积内的分子数 3. R = 8.31 J/(mol·K) :普适气体常数 4. 231238.31 1.3810J K 6.0210A R k N --===⨯⋅⨯:玻耳兹曼常量 八、 关于压强p : ●Γ:单位时间内碰在单位面积器壁上的平均分子数(气体分子碰壁数)● 压强p :单位时间内气体(全部分子)① 压强的定义体现了统计平均。
② V x >0的分子占总分子的一半,或分子速度在某方向的分量平均值为0 ● (例如:在x 方向,有0x v =;在y 方向,有0y v =;在z 方向,有0z v =)这是机会均等的表现。
③ 2213xv v = 也是机会均等的表现。
④ 22i ix x in v v n=∑∑ 是统计平均的表现。
九、1. 压强是相应的微观量:分子数密度和平动动能的统计平均。
● 压强与分子数密度n 有关,与气体种类无关。
2. 温度是相应的微观量:平均平动能的统计平均值。
● 温度是大量气体分子热运动的外在表现,实质就是反映了气体内部分子热运动的剧烈程度。
◆ 对不同气体,平衡态时,若T 相同,表示kt ε相同,但2v或不一定相同,因为还要考虑分子的质量m;同样,若T 相同。
3. 只有宏观量才能被测量,微观量不能。
4. 压强和温度都是大数量分子的微观量的统计平均,对于少数分子没有压强和温度可言。
十、 分子力:分子力是由静电力、电子轨道不同状态的结合力等组成的,并非来自万有引力麦克斯韦分布律一、 速率分布函数()Nf v N v=d d :分布在速率v 附近的单位速率间隔内的分子数占总分子数的比例,是速率v 的函数。
1. 涨落现象:偏离统计平均值的现象2. 统计规律永远伴随着涨落现象(粒子数越少,涨落现象越明显)。
3. 是统计规律,只适用于大量分子组成的集体。
也有涨落,非常小。
二、 三种速率(理想气体、温度为T 的平衡态)(1)讨论速率分布(概率)时用到● (是速率分布中的最大速率吗?) (2)在讨论分子平均碰撞频率(平均自由程)时用到(3)在计算分子的平均平动动能时用到● 同一气体:P rms v v v << ● 不同气体:它们都∝输运过程1、 气体分子碰撞● 使平衡态下分子速度有稳定分布; ● 实现能量均分;● 使气体由非平衡态→平衡态。
(1) 描述的物理量有:碰撞截面σ;平均碰撞频率Z ;平均自由程λ (2) 刚球模型:把分子看作直径为d ,无引力作用的弹性刚球。
(3) 有效直径d :两分子在碰撞中其中心所能接近的最小距离,相当于完全弹性小球的直径d 。
它是统计平均值,可视为常数。
(4) 碰撞截面σ:以分子的有效直径d 为半径的球体的最大截面σ=πd 2.若两种不同的分子相碰,σ的半径为(d 1+d 2)/2(5) 平均碰撞频率z :一个分子在单位时间与其他分子的平均碰撞次数。
(∵v =,p nkT =)● z 一般109次/秒:即每秒碰几十亿次! ● 讨论:z 如何变化?● 温度不变时,z 随压强的增大而增大:z P ∝ ● 压强不变时,z 随温度的增大而减小:z ∝(6) 平均自由程λ:分子在相邻两次碰撞之间自由走过的平均路程 (是统计平均值)● λ一般10-8~10-9 m (nm 级),约为d 的200倍。
● 讨论:λ如何变化?● 温度不变时,λ随压强的增大而减小:1p λ∝● 压强不变时,λ随温度的增大而增大:T λ∝● z 和λ都反映了分子间碰撞的频繁程度:在v一定时,分子间的碰撞越频繁,z 就越大,λ就越小。
2、 三类输运过程:输运过程是指系统由非平衡态向平衡态的变化过程,其过程的快慢取决于分子间碰撞的频繁程度(即碰撞频率)。
输运过程中都有相应物理量的定向迁移。
(1) 粘滞现象:因各气层定向流速不均匀而使相邻两气层互现切向内摩擦力的现象。
◆ 宏观表现为分子定向运动的动量迁移。
(2) 热传导现象:因气体各层的温度不均匀而使相邻两气层有热量传递。
◆ 宏观表现为气体分子热运动能量迁移。
(3) 扩散:当气体的密度不均匀时,气体的质量将从密度大的区域向密度小的区域移动的现象。
单纯由热运动产生的扩散叫纯扩散。
◆ 宏观表现为由于分子热运动所产生的气体宏观粒子迁移或质量迁移。
● 分子的热运动和分子间的碰撞是输运过程的内因,是出发点。
密度不均匀温度不均匀流速不均匀定向运动动量 运动平均动能 质量 λρηv 31=13Vv C κρλ=13D v λ=扩散 热传导粘滞 现 象 原 因传递量 系数公式 d d d d M D A t z ρ=-d d d d Q T At zκ=-⋅d d d d K u A t z η=-动量沿流速减小的方向输运质量沿密度减小的方向输运 热量沿温度降低的方向输运输运定律 输运特征热力学第一定律一、正确理解:准静态与非准静态过程;可逆与不可逆过程;自发与非自发过程;绝热与非绝热过程(1)只有准静态过程才能用过程曲线表示(是否只能用p-V图?)(2)自然界的一切自发过程都是不可逆过程(3)一切与热有关的过程都是不可逆过程(4)准静态过程是否一定是可逆过程?(5)不可逆过程是否就是不能向相反方向进行?(6)绝热过程是否一定是等熵过程?例:图示的系统(做绝热自由膨胀的气体)。
1.初态、末态是平衡态2.但中间态不是平衡态,所以经历的是非准静态的过程这是一个自发、不可逆、绝热、非准静态过程3.该过程不能用过程曲线表示出来4.但初态与末态可以在过程曲线中表示出来(1)系统对外没有作功—隔板抽掉,自由膨胀(2)系统的内能减少——∵đQ=0,T减小(3)*系统的熵增加——∵是不可逆过程二、 能量均分定理和热容量1. 自由度i :决定一个物体的位置所需要的独立坐标数。
i = t (平动)+ r (转动)+ s (振动)。
当忽略振动自由度(经典热力学,常温):i = t+r自由度、比热容比、摩尔热容:2. 能量按自由度均分定理(能量均分定理)(1) 在温度为T 的平衡态下,物质每个分子的每一个自由度具有相同的平均动能kT /2。
(2) 1(2)2t r s kT ++•*(3) 1mol γ = C p ,m /C V ,mC p ,m =C V ,m +Ri=t+r C V ,m =iR /2 单原子 3(3+0) 5/3=1.67 3R /2 5R /2 刚性双原子 5(3+2) 7/5=1.4 5R /2 7R /2 刚性多原子6(3+3)4/3=1.333R4R但若系统做的是准静态绝热膨胀呢? 1. 初态、末态、中间态都是平衡态2. 是一个非自发的、可逆的、绝热的、准静态的过程3. 全过程、全部状态(初态、末态、中间态)都可以在过程曲线中表示出来4. 过程曲线可以用p-V 图反映,也可以画成p-T 图,或画T-V 图 (1) 系统对外作了功——不是迅速抽掉隔板,一定是气体缓缓地推动隔板 (2) 系统的内能减少——∵đQ=0,T 减小 (3) *系统的熵不变——∵đQ=0,又是可逆过程单原子 32kT =ε ,32m V m U RT C T == 常温双原子 52kT =ε 52m U RT =,V m C T = *高温双原子(考虑振动自由度s ) 72kT =ε 72m U RT =,V m C T =(4) M 千克物质的内能 ▲ 能量均分定理仅限于均分动能(含平动动能和转动动能)。
三、 热力学第一定律 21U U Q A -=+, d U = đQ + đA (微变式) 1. 21d V V A p V =-⎰:外界对系统作的功,是过程量。
● 外界对系统作功(体积压缩功)为正功;体积膨胀功为负功。
2. n 表示不同的过程,也是过程量● 系统吸热为正,放热为负。
3. ● 理想气体的内能仅是温度的单值函数(态函数)4. 仅有体积功时:d U =đQ ﹣p d V 四、 热力学第一定律的应用1. 等体过程:A V =0; ,2VV m M iQ U R T C T =∆=•∆=•∆νμ; pC T= 2. 等压过程:A p =-p △V =-νR △T ; ,m p p Q C T =∆ν ;,V m U C T ∆=•∆ν;VC T= 3. 等温过程:△U =0 ;1212ln ln T p V Q RT RT V p ==νν ;TT A Q =- ;pV C =4. 绝热过程:Q =0;,V m U C T ∆=•∆ν; A U =∆●绝热方程:1pV C γ= ; 12TV C γ-= ;13p T C γγ--= 或:1122pV p V γγ=; 111122TV T V γγ--= ;111122p T p T γγγγ----=●多方方程:——将绝热方程中的γ改做n 即可。
五、 热机:利用工作物质连续不断地把热转换为功的装置 1. 正循环:p-V 图中的顺时针闭合曲线 ▲ 系统经历一个循环之后,内能不改变 2.(1) Q 1: 热机从热源吸收的总热量;|Q 2|: 热机向热源放出的总热量(Q 2<0);A: 热机对外界所做的净功(2) 理想气体准静态过程的卡诺循环的效率只由高温热源和低温热源的温度决定,与工作物质无关。
(3)1(4) ηη≤不可逆可逆——卡诺定理2六、 制冷机:通过外界作功,从低温热源吸热的装置 1. 逆循环:p-V 图中的逆时针闭合曲线2. 制冷系数:2212Q Q A Q Q ==-ε;卡诺制冷机制冷系数212C T T T =-ε(1) |Q 1| : 制冷机向高温热源放出的总热量 (Q 1<0) (2) Q 2: 制冷机从低温热源吸收的总热量 (3) A: 外界对制冷机所做的功热力学第二定律一、 开尔文表述:不可能从单一热源吸收热量,使之完全变为有用功而不产生其它影响。
