注射用甲磺酸培氟沙星工艺验证方案0.2
甲磺酸培氟沙星注射液(成品)检验记录

装量
序号
1
2
3
4
5
装量
平均值
检验结果
检验人: 复核人:
有限公司
检验记录附页
文件编号:00
含量测定:甲磺酸培氟沙星注射液 室温: ℃ 湿度: %
主要分析仪器
名称
型号
精度
编号
分析天平
TG-328A
0.0001
紫外分光光度计
---------
样品制备:精密量取本品3ml,置250ml量瓶中,加盐酸液(0.1mol/L)稀释至刻度,摇匀。
(2)鉴别 1、成正反应。规定
2、取含量测定项下的溶液,
照分光光度法测定,在276、
318nm波长处有最大吸收,
在332nm处有一肩峰。规定
3、供试品溶液所显主斑点的
颜色与位置应与对照品溶
液的主斑点相同。规定
(3)检查:
1、PH值 PH应为3.5~5.0规定
2、颜色 应符合规定。规定
3、有关物质 应符合规定。规定
3、供试品溶液所显主斑点的
颜色与位置应与对照品溶
液的主斑点相同。规定
(3)检查:
1、PH值 PH应为3.5~5.0规定
2、颜色 应符合规定。规定
3、有关物质 应符合规定。规定
4、装量 应符合规定规定
(4)含量测定:
按干燥品计,含甲磺酸培氟沙星为
标示量的92.0%~108.0%规定
检验结论: 本品按<<甲磺酸培氟沙星注射液内控质量标准>>检验,
检验结果:
PH值
仪器型号
室温
湿度
校正用缓冲液pH值 Nhomakorabea样品溶液的
配制
注射用甲磺酸培氟沙星

[修订]
注射用甲磺酸培氟沙星
Zhusheyong Jiahuangsuan Peifushaxing
Pefloxacin Mesylate for Injection
书页号:2005年版二部-132
[修订]
【检查】溶液的澄清度与颜色取本品5瓶,分别按标示量加水制成每1ml含40mg的溶液,溶液应澄清无色;如显浑浊,与1号浊度标准液(附录Ⅸ B)比较,均不得更浓;如显色,与黄绿色5号标准比色液(附录ⅨA第一法)比较,均不得更深。
有关物质取本品适量,精密称定,用流动相溶解并稀释制成每1ml中约含培氟沙星0.2mg的溶液,作为供试品溶液;精密量取1ml,置100ml量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液。
照甲磺酸培氟沙星项下的方法测定,供试品溶液的色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的1/2,各杂质峰面积的和不得大于对照溶液主峰面积。
重金属取本品1.0g,依法检查(附录Ⅷ H第二法),含重金属不得过百万分之十。
无菌取本品,溶于不少于150ml 0.1%蛋白胨水溶液中,薄膜过滤后, 真菌培养管直接加入适宜的培养基;好氧菌、厌氧菌培养管及阳性对照管每膜采用不少于200ml的冲洗液冲洗后,再加入适宜的培养基,同时在两管培养基中分别加入0.5mol/L 硫酸锰溶液3ml,以大肠埃希菌作为阳性对照菌,依法检查(附录Ⅺ H),应符合规定。
【含量测定】取装量差异项下的内容物,混合均匀,精密称取适量,用流动相溶解并定量稀释制成每1ml中约含培氟沙星20μg的溶液,照甲磺酸培氟沙星项下的方法测定,即得。
甲磺酸培氟沙星车间工艺设计书

甲磺酸培氟沙星车间工艺设计书甲磺酸培氟沙星(Levofloxacin Hydrochloride)是一种广谱抗菌药物,通常用于治疗呼吸道、泌尿道、皮肤软组织感染等疾病。
车间工艺设计书是用于指导甲磺酸培氟沙星的生产过程,包括原料采购、工艺流程、控制参数、设备配置等一系列内容。
以下是甲磺酸培氟沙星车间工艺设计书的一个示例:1.项目背景2.原料采购注明甲磺酸培氟沙星原料的采购渠道、质量标准以及供应商的选择。
确保原料的质量符合药典要求,并注明原料的包装、运输和储存要求。
3.工艺流程描述甲磺酸培氟沙星的生产工艺流程,包括主要的反应步骤、温度、压力、pH值等操作条件。
确定每个步骤的反应时间,确保产品的质量和产量。
4.中间体制备详细描述甲磺酸培氟沙星的中间体制备过程。
包括原料的配比、混合、反应等步骤,注明每个步骤的温度、反应时间和反应物的摩尔配比。
5.纯化和结晶描述将产物纯化和结晶的过程。
包括主要的分离技术,如溶剂提取、洗涤、蒸馏等。
注明每个步骤的条件和操作要求,确保产物的纯度和结晶度。
6.干燥和包装说明产物的干燥和包装过程。
包括干燥设备的选择和操作条件,以及包装材料和工艺。
确保产品在储存和运输过程中的质量稳定性。
7.设备配置描述甲磺酸培氟沙星生产线的设备配置,包括反应釜、分离设备、干燥设备、包装设备等。
注明每个设备的规格和数量,以及设备的操作要求和维护计划。
8.质量控制详细说明甲磺酸培氟沙星生产过程中的质量控制要点。
包括原料检验、中间体分析、产成品检验等。
注明每个环节的检测方法、标准和频率,确保产品的质量符合要求。
9.安全与环保强调生产过程中的安全和环保要求。
注明操作人员的培训和保护措施,以及废物处理和环境保护措施。
确保生产过程的安全性和环保性。
10.生产计划说明甲磺酸培氟沙星的生产计划。
包括产量预测、生产周期、库存管理等。
确保生产线稳定运行和按时完成订单。
以上是甲磺酸培氟沙星车间工艺设计书的一个简要示例。
甲磺酸培氟沙星注射液无菌检查的方法学验证

mol・L。1无菌硫酸锰溶液)100 mL/次/膜,
冲9次,用力振摇,分别加硫乙醇酸盐流体培养基和改良马 丁培养基各100 m1.再逐一加入各实验菌1 ml(含菌10~
100
cfu・ml。)。阳性对照和阴性对照同方法验证试验1,按
表4甲磺酸培氟沙星注射液体外抑菌作用实验4结果
菌种
l d
+
ml。)。阳性对照:另取集菌培养器,不过滤供试品,其他操 作同上,作为阳性对照、阴性对照:另取集菌培养器分别加入 硫乙醇酸盐流体培养基和改良马丁培养基各100 ml,不加对 照菌液,作为阴性对照.按规定温度将上述集菌器培养5 培养结果见表1。
ml 0.1
m01.L。1无菌硫酸锰溶液)作为冲洗液,可完全消除药品的抑茵性。从而对建立甲磺酸培氟沙星注射液
的无菌检查法提供了依据。 关键词 甲磺酸培氟沙星注射液;无菌检查;薄膜过滤法 文献标识码:A
中图分类号:R927.11
文章编号:1008舭9X(20lO)09—1361_02
司生产的甲磺酸培氟沙星注射液2
参考文献
1 2
一
一
一
一
+
一
由表2可见,采用上述方法,金黄色葡萄球菌,大肠埃希 菌,枯草芽孢杆菌均不能正常生长。 2.2.3方法验证试验3 按《中国药典》2005年版规定…, 取少量冲洗液湿润滤膜,将处方2样品15支全量通过全封 闭三联集菌培养器,每筒滤过5支样品。按照此法备齐6支 过滤样品的滤筒,再用0.1%蛋白胨水冲洗液loo mL/次/膜, 冲洗滤膜9次,用力振摇,分别加硫乙醇酸盐流体培养基和 改良马丁培养基各100 m1。每筒加入0.1 mol・L“无菌硫酸 锰溶液5 ml,再逐一加入各实验菌l ml(含菌lO~loo 度将上述集菌器培养5 d,结果见表3。
甲磺酸培氟沙星车间工艺设计书

甲磺酸培氟沙星车间工艺设计书一、工艺流程设计1.原料准备:甲磺酸、培氟沙星原料准备,确保原料质量合格。
2.反应:将甲磺酸和培氟沙星按照一定的摩尔比加入反应釜中,在一定的温度和压力下进行反应,生成甲磺酸培氟沙星。
反应结束后,进行中和处理。
3.结晶:将反应产物经过过滤、洗涤、干燥等工序,得到甲磺酸培氟沙星的结晶体。
4.粉碎:将结晶体经过粉碎处理,得到符合要求的粉末产品。
5.包装:将粉末产品按照一定的包装要求,进行包装封装,以便运输和储存。
二、设备选型1.反应釜:根据反应容量、温度和压力要求,选择合适的不锈钢反应釜。
2.过滤设备:使用合适的过滤设备,如过滤机、过滤装置等,进行反应产物的过滤。
3.干燥设备:选择适合的干燥设备,如干燥机、干燥箱等,对结晶体进行干燥处理。
4.粉碎设备:选用适当的粉碎设备,如颚式破碎机、圆锥破碎机等,对结晶体进行粉碎处理。
5.包装设备:选择合适的包装设备,如包装机、封口机等,对产品进行包装封装。
三、操作条件设定1.反应条件:根据反应动力学及反应平衡,确定合适的温度、压力和反应时间,以达到最佳的反应效果。
2.过滤条件:根据产品的质量要求,在合适的过滤温度、压力和时间下进行过滤操作,确保产品的纯度和过滤效果。
3.干燥条件:根据产品的含水率和干燥要求,确定合适的干燥温度、时间和湿度,以达到产品的理想干燥状态。
4.粉碎条件:根据产品的粒度要求,确定合适的粉碎设备和工艺条件,进行粉碎操作,以获得符合要求的细粉末产品。
5.包装条件:根据产品的性质和包装要求,确定合适的包装材料、包装方式和包装封装条件,以确保产品的安全、卫生和质量。
四、安全措施1.原料和产物的储存和使用要符合相关安全规定,防止意外事故的发生。
2.工作人员必须穿戴合适的防护装备,如手套、防护眼镜、防护服等,以确保人身安全。
3.对每一个设备、仪器进行定期维护和保养,确保其正常运行和安全使用。
4.设备和管道必须安全可靠,防止泄漏、爆炸等事故的发生。
013甲磺酸培氟沙星注射液生产工艺规程

目录1 产品概述2 处方和依据3 工艺流程图4 制剂工艺过程及工艺条件5 原辅材料质量标准和检查方法6 中间产品质量标准和检查方法7 成品质量标准和检查方法8 包装规格、包装材料质量标准9 说明书、产品文字说明和标志10 工艺要求11 设备一览表和主要设备生产能力12 技术安全与劳动保护13 劳动组织14 技术经济指标计算15 原辅料消耗定额16 包装材料消耗定额17 动力消耗定额18 综合利用与环境保护1产品概述:本品为甲磺酸培氟沙星的灭菌水溶液,含甲磺酸培氟沙星(C17H20FN3O3·CH4O3S)应为标示量的93.0%~107.0%1.1产品特点:1.1.1性状:本品为淡黄色澄明液体。
1.1.2作用与用途:抗菌药主要用于畜禽细菌及支原体感染。
1.1.3用法用量:肌内注射一次量每1kg体重鸡2.5~5mg 一日2次连用3~5天1.1.4规格:100ml: 2g1.1.5:休药期:28日,产蛋鸡禁用。
1.1.6贮藏:遮光、密闭、在凉暗处保存1.1.7有效期:二年1.1.8批准文号:2 处方和依据:2.1处方:(1000ml)甲磺酸培氟沙星20g稀盐酸适量注射用水至1000ml2.2处方依据:《兽药国家标准(化学药品、中药卷)第一册》甲磺酸培氟沙星注射液3工艺流程图10000级区100000级区4 制剂工艺过程及工艺条件:4.1总述:4.1.1按生产指令单领取甲磺酸培氟沙星原料,在浓配灌中加入计算量30%的注射用水, 再加入计算量的盐酸搅拌使溶解;然后加甲磺酸培氟沙星原料搅拌15分钟至完全溶解,粗滤至稀配灌中,加注射用水近全量,调节PH在规定范围内(3.5~5.5),补加注射用水至足量;用孔径为0.22um的过滤器(使用前后经过完整性测试合格)精滤,检查澄明度、含量合格后,将药液输送至灌封岗位,充氮、灌封,100℃30分钟灭菌,灯检、印字包装成规定规格即可。
4.2分述4.2.1投料量:为处方量的整数倍量、但不超过稀配罐一次最大混合量。
HPLC测定注射用甲磺酸培氟沙星的含量

5溶 液稳 定 性操作 。取本 品适 量 ,加水制成 每 lml中含培 氟沙星
仪器 :Lab Alliance Series 11I型输 液泵 ;Lab Alliance model 2O g的溶液 ,作为供试 品溶液 ,室 内避光放 置 8小 时,分别于
500型紫外 检测器 ;ANASTAR色谱数据处理 系统。
北方药学 2013年第 1O卷第 1期
9
HPLC测定 注射用 甲磺酸培氟沙星 的含量
贾树娟 (辽宁中医药大学附属二院药品管理处 沈阳 110034)
摘要:目的 :对 注射 用甲磺酸培 氟沙星的含量 测定方法进行 方法学验 证。结果 :方法简便 易行 、重现性好 ,与杂质可达到 良好分 离。结论 :本文所采 用的方法可以作 为注射 用 甲磺 酸培 氟沙星的含量检测方法。 关键词 :甲磺 酸培 氟沙星 含量 高效 液相
匀。精 密吸取 201注入液相色谱 仪,由峰面积和进样 浓度计算线 仪 ,记 录色谱 图 ;另取培 氟沙星对 照品 ,加水制成 每 lml中含
性方程 ,Y=69148X+339009,r=0.9997;可见 ,本 品在4—36t ̄g/ml 20btg的溶液。同法测定 。回收率 RSD=0.42%,表明回收率 良
的范围内浓度与峰面积成 良好 的线性关 系。
好 ,符合含量测 定要 求。
4精 密 度 试 验
8讨 论
避光操作 。取培氟沙 星对 照品 10rag,精密 称定 ,置 50ml 经过对 注射 用甲磺酸培氟沙 星含量 测定的方法进行方 法
量瓶 中 ,加水溶解并稀 释至刻度 ,摇匀 ,量取 inil,置 10ml量瓶 学考察 验证 ,确定该方法可用 于注射 用 甲磺酸培氟沙星含量
甲磺酸培氟沙星工业生产工艺设计书

制药工艺学课程设计任务书一设计题目年产198吨甲磺酸培氟沙星的甲基化反应的反应器(釜)的设计二工艺条件该产品的年产量为198吨,终产品诺氟沙星甲基化物的纯度为98%,诺氟沙星投料富余系数为1.05,反应转化率为99.5%甲基化收率98%,用活性炭抽滤时,活性炭损失为20%(重量比),假设其他中间体及最终产品均无损失。
每年工作日为300天,每天24小时连续运行。
原料参数一览表原料名称配料比(重体比)原料规格诺氟沙星1Kg 药用98.5%乙醇1L 80.5%甲酸 1.5L 85.5%甲醛1L 36.9%活性炭0.05Kg 针用767型氨水13%—15%(自取)三设计项目1 设计内容1)确定反应器形式、材质2)进行物料衡算,确定反应釜的体积3)确定反应釜的台数和连接方式4)确定反应釜的直径和筒体高度5)进行热量衡算,确定反应釜的换热面积和传热装置6)转速、搅拌功率的计算,确定反应釜的搅拌器7)辅助设备的设计与选型2 设计说明书,包括如下内容1)目录2)设计方案简介3)设计内容4)收获感想5)参考文献3 设备图要求用CAD画出反应器的装配图目录一产品概述 (1)1.1产品名称、化学结构、理化性质 (1)1.1.1产品名称 (1)1.1.2化学结构和分子量 (1)1.1.3理化性质 (1)1.2临床用途 (1)1.3固体原料的密度、熔点 (2)二设计方案简介 (3)2.1本设计采用的工艺路线 (3)2.1.1甲基化 (3)2.1.2中和 (3)2.1.3成盐 (3)2.1.4精制 (4)2.1.5工艺路线的的主要依据 (4)三甲磺酸培氟沙星的甲基化反应的反应器设计 (5)3.1设计内容 (5)3.2反应器的形式与材质 (5)3.2.1甲磺酸培氟沙星的甲基化反应工艺流程图如下 (5)3.2.2搅拌釜式反应器的分类(按操作方式) (6)3.2.3反应器形式、材质的确定 (6)3.3物料衡算 (7)3.3.1物料平衡总线 (7)3.3.2反应器中的物料衡算 (7)3.4设备相关参数的计算和主要工艺设备的选型 (9)3.4.1工艺设备选型原则 (9)3.4.2反应器的台数和连接方式的确定 (9)3.4.3反应器的直径和筒体高度的确定 (10)3.5热量衡算 (11)3.5.1 各物质物化参数的查取与计算 (11)3.6反应器的换热面积和传热装置的确定 (17)3.7辅助设备的设计与选型 (19)3.7.1反应器的搅拌器的确定 (19)3.7.2 联轴器的型式及尺寸的设计 (20)3.7.3 传动装置的选型和尺寸计算 (21)3.7.4 减速器的选型及安装尺寸 (22)3.7.5 底座的设计 (22)3.7.6 反应釜轴封装置设计 (23)3.7.7 反应釜夹套及相关附件设计 (24)3.7.8 反应釜附件的选型及尺寸设计 (27)四收获感想 (29)五参考文献 (30)一产品概述1.1产品名称、化学结构、理化性质1.1.1产品名称1:中文名甲磺酸培氟沙星2:拉丁名PEFLOXACIN MESYLATE3:英文名pelfoxaein mesylate4:化学名1-乙基-6-氟-1、4-二氢-7-(4-甲基-1-哌嗪)-4-氧-3-喹啉羧甲磺酸盐1.1.2化学结构和分子量1:分子式C17H20FN3O3·C H3SO3H·2H2O2:结构式3:分子量465.491.1.3理化性质本产品是白色或微黄色晶体,没有臭,味苦,在水中极易溶解,在乙醇、氯仿或乙醚中几乎不会溶。
甲磺酸培氟沙星车间工艺设计书

甲磺酸培氟沙星车间工艺设计书(总88页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--题目:年产350吨甲磺酸培氟沙星车间精制段工艺设计学生姓名:吕玮学号: 0219班级: 化工0902班专业:化学工程与工艺指导教师:罗晓明2013 年 6 月题目年产350吨甲磺酸培氟沙星车间精制段工艺设计学生姓名:吕玮学号: 0219班级:化工0902所在院(系): 化学与生物工程学院指导教师: 罗晓明完成日期: 2013年6月4日1年产350吨甲磺酸培氟沙星车间甲化段工艺设计摘要本设计是年产350吨甲磺酸培氟沙星甲基化甲基化车间工艺设计。
甲基化工段是以诺氟沙星作为起始原物料,甲醛、甲酸、乙醇、氨水和活性炭作为辅料,生成培氟沙星。
本设计确定生产350吨甲磺酸培氟沙星的生产工艺流程;完成本工段的全部工艺计算(物料衡算,热量衡算),根据衡算结果选取适当的生产设备尺寸型号;绘制带控制点的工艺流程图、生产车间平面布置图、生产车间立面布置图和甲基化反应釜装配图。
本设计方案操作简单、原料廉价易得、能耗低、对环境的污染也较小、且“三废”易处理,是目前国内生产甲磺酸培氟沙星最成熟的合成路线。
关键字:甲磺酸培氟沙星;甲基化;诺氟沙星;工艺设计2THE SALT SEGMENT TECHNOLOGICAL DESIGN FOR ANNUAL OUTPUT OF 350 TONS MESYLATE PEFLOXACINABSTRACTThis work is about to salt segment process design of an annual 400 tons pefloxacin mesylate. The process use methyl salt as starting raw materials, methane sulfuric acid, ethanol, and activated carbon as accessories, generating mefloquine crude. The production of 350 tons designed to determine pefloxacin mesylate production process; complete this section in full process calculation (material balance, heat balance), according to the accounting results, the appropriate equipment size models was selected; layout, technology flow diagram and the methylation reactor assembly drawing were carried out.The design is simple, cheap raw materials, low energy consumption less environmental pollution, and the "three wastes" easy to handle, is the current domestic production of pefloxacin mesylate most sophisticated synthetic routes.Keywords: pefloxacin mesylate;salt reaction; mefloquine; technological design3目录课程设计任务 (1)前言 (2)1产品概述 (2)产品名称、化学结构、理化性质 (2)产品名称 (3)化学结构和分子量 (3)理化性质 (3)临床用途 (4)固体原料的密度、熔点 (4)2产品工艺简介 (4)本设计采用的工艺路线 (4)甲基化 (4)中和 (4)成盐 (4)精制 (5)工艺路线 (5)3工艺设计依据 (6)设计任务依据 (6)工艺路线的的主要依据 (6)质量标准 (7)包装规格要求及贮藏 (8)成品的包装规格 (8)贮藏 (8)原辅料、包装材料质量标准及规格 (8)4物料衡算 (9)计算方法与原则 (9)物料衡算的目的 (9)物料衡算的依据 (9)物料衡算基准 (9)甲磺酸培氟沙星收率与所用原料物性工艺参数 (10)物料平衡总线 (11)正批生产 (11)回收生产 (12)精制工段的物料衡算 (13)脱色 (13)压滤 (14)冷冻结晶 (15)离心甩料 (15)甲基回收工段的物料衡算 (16)精母液中和回收釜的物料衡算 (16)45能量衡算 (17)各物质物化参数的查取与计算 (17)原料比热的计算与查取 (17)液体原料比热的计算与查取 (18)部分原料燃烧热的计算和查取 (19)精制工段能量衡算 (20)精制反应阶段 (23)精制重结晶阶段 (24)回收系统能量衡算 (24)精母液的回收 (24)6设备选型(一) (25)选型方法和机理 (25)设备选型的目的 (25)设备选型的依据 (25)设备选型基准 (25)假设或经验工艺参数 (25)主要岗位的操作周期 (25)常规设备的选型 (26)精制罐的选型 (26)重结晶罐的选型 (29)精母液蒸馏釜的选型 (30)中和釜的选型 (30)冷凝器的选型计算 (31)7设备选型(二)中和反应釜的选型计算 (36)反应釜釜体的设计 (37)反应釜主要参数 (37)罐体几何尺寸计算 (37)确定筒体内径 (37)确定封头尺寸 (38)确定筒体的厚度H i (39)夹套几何尺寸计算 (39)夹套反应釜的强度计算 (39)按内压对圆筒和封头进行强度计算 (39)按外压对筒体和封头进行强度校核 (40)夹套厚度计算 (40)水压试验校核计算 (41)中和反应釜反应釜的搅拌装置 (41)搅拌器的安装方式及其与轴连接的结构设计 (42)搅拌轴设计 (42).反应釜的传动装置 (43)常用电机及其连接 (43)釜用减速机类型,标准及其选用 (43)凸缘法兰 (43)安装底盖 (44)5机架 (44)联轴器 (44)离心机 (44).反应釜的轴封装置 (44).反应釜的其他附件 (45)支座 (45)人孔 (45)设备接口 (45)其余设备选型 (48)管件选择以及剩余设备选型计算 (49)设备选型一览表 (51)8车间布置与管道设计 (53)车间布置 (53)车间布置概述 (53)厂房布置 (55)车间设备布置 (56)G M P洁净区的设计 (56)管道设计 (60)基本要求 (60)车间管道系统和工艺管道系统 (61)9生产控制与工时安排 (62)各岗位操作要点 (62)精制岗位 (62)蒸馏岗位 (62)操作工时与生产周期 (62)精制岗位 (62)10劳动组织 (64)人员总体配置 (64)各单位定员 (65)11劳动保障和安全生产 (66)安全保障措施 (66)车间安全生产原则 (66)个人防护守则 (66)动火规定 (67)安全用电 (67)动力使用 (67)环境卫生 (67)危险品的注意事项 (68)甲酸 (69)甲醛 (69)氨水 (69)甲磺酸 (70)乙醇 (71)12“三废”处理与综合利用 (72)6“三废”的处理 (72)废气的处理 (72)废水的处理 (72)废渣的处理 (72)回收利用 (73)13工程经济 (74)原料消耗定额 (74)能源消耗定额 (74)经济技术指标 (75)总结 (76)参考文献 (78)致谢 (80)附录 (81)7课程设计任务一设计题目诺氟沙星精制过程工艺设计二工艺条件表0-1原料参数一览表设产品的年产量为400吨,终产品诺氟沙星甲基化物的纯度为95%,诺氟沙星投料富余系数为,反应转化率均为100%,甲基化收率%,总收率为%,用活性炭抽滤时,活性炭损失为20%(重量比),假设其它中间体及最终产品均无损失。
甲磺酸培氟沙星检验SOP
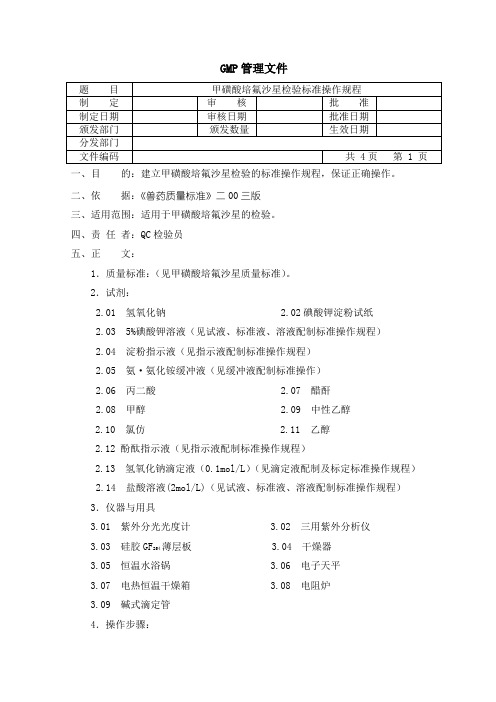
GMP管理文件一、目的:建立甲磺酸培氟沙星检验的标准操作规程,保证正确操作。
二、依据:《兽药质量标准》二00三版三、适用范围:适用于甲磺酸培氟沙星的检验。
四、责任者:QC检验员五、正文:1.质量标准:(见甲磺酸培氟沙星质量标准)。
2.试剂:2.01 氢氧化钠 2.02碘酸钾淀粉试纸2.03 5%碘酸钾溶液(见试液、标准液、溶液配制标准操作规程)2.04 淀粉指示液(见指示液配制标准操作规程)2.05 氨·氨化铵缓冲液(见缓冲液配制标准操作)2.06 丙二酸 2.07 醋酐2.08 甲醇 2.09 中性乙醇2.10 氯仿 2.11 乙醇2.12 酚酞指示液(见指示液配制标准操作规程)2.13 氢氧化钠滴定液(0.1mol/L)(见滴定液配制及标定标准操作规程) 2.14 盐酸溶液(2mol/L)(见试液、标准液、溶液配制标准操作规程)3.仪器与用具3.01 紫外分光光度计 3.02 三用紫外分析仪3.03 硅胶GF薄层板 3.04 干燥器2543.05 恒温水浴锅 3.06 电子天平3.07 电热恒温干燥箱 3.08 电阻炉3.09 碱式滴定管4.操作步骤:4.1 性状本品为白色或微黄色的结晶性粉末,则判定该项合格。
本品在水中极微溶解;在乙醇中极微溶解,在氯仿中几乎不溶。
4.2 鉴别:4.2.1 取本品约0.3g,加氢氧化钠0.2g,加水数滴,溶解后置酒精灯上小火蒸干至炭化,加水数滴与2mol/L盐酸溶液3-4ml,缓缓加热,即发生二氧化硫气体,能使湿润的碘酸钾淀粉试纸(取滤纸条浸入含有5%碘酸钾溶液与淀粉指示液的等体积混合液中,湿透后,取出干燥,即得)显蓝色。
4.2.2 取本品约50mg,置干燥试管中,加丙二酸约30mg与醋酐0.5ml,在80℃-90℃水浴中加热5-10分钟,显红棕色。
4.2.3取本品,加水制成每1ml中6ug的溶液,照分光光度法(详见分光光度法标准操作规程)测定,在276nm和318nm波长处有最大吸收。
注射用甲磺酸培氟沙星制备工艺

注射用甲磺酸培氟沙星制备工艺【摘要】目的:制备优良的注射用甲磺酸培氟沙星。
方法:采用正交设计试验,考察其影响因素,对工艺进行研究。
结果:最佳甘露醇的量、活性炭的加入量和抗氧剂分别为0.1g/瓶、0.05%、0.01%亚硫酸氢钠和0.01%依地酸钙钠。
结论:按该方法制备的注射用甲磺酸培氟沙星,完全符合质量标准。
【关键词】注射用甲磺酸培氟沙星、赋形剂、抗氧剂、有关物质;含量;处方甲磺酸培氟沙星是一种新型喹诺酮类药物,对肠杆菌科的大部分细菌有良好的抗菌活性,对β-内酰胺酶阳性或阴性的流感嗜血菌和黏膜炎莫拉氏菌及一些非典型病原体也均具有较强的杀伤作用。
该药可直接作用于细菌DNA螺旋酶的A 亚单位,通过抑制DNA的合成、复制导致其死亡。
甲磺酸培氟沙星是一种新型喹诺酮类药物,对肠杆菌科的大部分细菌有良好的抗菌活性,对β-内酰胺酶阳性或阴性的流感嗜血菌和黏膜炎莫拉氏菌及一些非典型病原体也均具有较强的杀伤作用。
该药可直接作用于细菌DNA螺旋酶的A亚单位,通过抑制DNA的合成、复制导致其死亡[1-2]。
主要用于敏感菌所致的尿路感染,呼吸道感染,耳、鼻、喉感染,妇科、生殖系统感染,腹部和肝、胆系统感染,骨和关节感染等[3-4]。
本文研制注射用甲磺酸培氟沙星,通过正交设计试验,对其处方进行筛选,并对优化处方进行了考察。
1 试验材料1.1 药品与试剂甲磺酸培氟沙星对照品(由中国药品生物制品检定所提供);注射用甲磺酸培氟沙星(自制);甲磺酸培氟沙星(湖北省人福药业有限责任公司);甘露醇(山东天力制药有限公司);焦亚硫酸钠(湖南尔康制药有限公司);针用活性炭(上海活性炭厂);醋酸铵(天津市科密欧化学试剂有限公司);甲醇(阿达玛斯公司)。
1.2 仪器高效液相色谱仪(安揭伦科技公司)、pH计(上海雷磁仪器厂)、紫外分光光度计(安揭伦科技公司)、不溶性微粒检测仪(北京东方森联自动化技术有限公司)、澄明度检测仪(天津大学精密仪器厂)和电子天平(梅特勒公司)。
注射用甲磺酸左氧氟沙星的无菌检查方法验证

注射用甲磺酸左氧氟沙星的无菌检查方法验证【摘要】目的:验证注射用甲磺酸左氧氟沙星的无菌检查方法。
方法:按《中国药典》2005版二部(附录XIH)所载“无菌检查法”项下进行试验。
通过对阳性对照菌条件的选择和每筒500ml0.1%蛋白胨(含1%0.1mol/LMnSO4)缓冲液的冲洗,建立了无菌检查方法。
结果:阴性、样品管无菌生长,六株阳性菌生长良好。
结论:经方法学验证该检验结果准确可靠。
可做为注射用甲磺酸左氧氟沙星的无菌检查方法验证的无菌检查。
【关键词】注射用甲磺酸左氧氟沙星无菌检查法(薄膜过滤法)方法验证注射用甲磺酸左氧氟沙星为喹诺酮类药物。
主要作用于革兰氏阴性菌,对革兰氏阳性菌作用弱,有的药物对金葡菌作用强,对其他病原微生物也有不同的作用。
它的主要作用机制为抑制细菌DNA旋转酶活性,抑制细菌DNA复制。
本品剂型属注射剂类,为了确保临床用药安全。
中国药典2005年版要求其做无菌检查。
本试验旨在按中国药典2005年版所载“无菌检查法”探索并建立注射用甲磺酸左氧氟沙星的无菌检查方法。
1.材料和试药1.1供试品注射用甲磺酸左氧氟沙星(规格:g/支,批号:,生产厂家:福建省闽东力捷迅药业有限公司)1. 2培养基、稀释液及冲洗液硫乙醇酸盐流体培养基(批号:);改良马丁培养基(批号:);营养肉汤培养基(批号:);营养琼脂培养基(批号:);蛋白胨 (批号:);玫瑰红钠琼脂培养基(批号:),上述试剂试药均由北京三药科技开发公司提供。
改良马丁琼脂培养基(批号:)上海中科昆虫生物开发有限公司提供。
0.9%NaCl注射液(批号:09011403)上海长征富民药业铜陵有限公司。
分析纯MnSO4(批号: )1. 3仪器和滤器HTY2000B型集菌仪及KSF型全封闭式无菌集菌培养器(厂家:)YXQ-LS-50立式压力蒸汽灭菌器(厂家:上海博迅实业有限公司医疗设备厂)SPX-250B-2生化培养箱(厂家:上海博迅实业有限公司医疗设备厂)MJP-150霉菌培养箱(厂家:上海精宏实验设备有限公司)20ml注射器(厂家:)1. 4菌种(第代)①金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]②大肠埃希菌(Escherichia coli)[CMCC(F)44102]③枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501]④生孢梭菌(Clostridium sporogenes)[CMCC(B)64941]⑤白色念珠菌(Candida albicans)[CMCC(F)98001]⑥黑曲霉(Aspergillus niger)[CMCC(F)98003]2. 试验前准备2.1培养基、冲洗液及稀释液的制备和灭菌本实验均采用市售干的培养基、冲洗液,按照说明书要求配制,并于灭菌器内121℃灭菌15min。
甲磺酸培氟沙星注射液(成品)检验操作规程

GMP管理文件一、目的:为规定甲磺酸培氟沙星注射液生产过程中的质量控制和检验操作要求,特制定此操作规程。
二、适用范围:适用于甲磺酸培氟沙星注射液半成品的检验。
三、责任者:生产部经理、检验员、生产人员四、正文:质量标准:见甲磺酸培氟沙星注射液(半成品)内控质量标准操作内容:1.1物理性状:本品为淡黄色澄明液体。
1.2该产品应符合以下标准:2鉴别2.1仪器与用具紫外线外光光度仪2.2操作方法2.2.1(1)取本品1ml,加碘化铋钾试液5滴,即产生橙黄色沉淀。
(2)取含量测定项下的溶液,照分光光度法测定,在276、318nm波长处有最大吸收,在332nm波长处有一肩峰。
(3)取本品与甲磺酸培氟沙星对照品,分别加甲醇-水(4:1)制成每1ml中含5mg的溶液。
照薄层色谱法试验,吸取上述两种溶液各5ul,分别点于同一硅胶GF254薄层板上,以氯仿-甲醇-氨·氯化铵缓冲液(PH10.0)(6:4:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的颜色与位置与对照品溶液的主斑点相同。
3.检查3.1仪器与用具酸度计、三用紫外线分光光度仪、100ml量筒、澄明度检测仪酸度取本品适量依法检查,PH值应为3.5~5.5.颜色取本品,与黄色4号标准比色液比较,不得更深。
有关物质取本品,加甲醇-水(4:1)制成每1ml中含5mg的溶液,作为供试品溶液。
精密量取适量,用甲醇-水(4:1)稀释成每1ml 中含0.1mg的溶液,作为对照溶液。
照薄层色谱法试验,吸取上述两种溶液各5ul,分别点于同一硅胶GF254薄层板上以氯仿-甲醇-氨·氯化铵缓冲液(PH10.0)(6:4:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液如显杂质斑点,与对照溶液的主斑点比较,不得更深。
装量取成品5瓶,用100ml量筒称量应符合规定。
4. 含量测定4.1仪器与用具分析天平,紫外线分不光度仪4.2试剂与用具取甲磺酸培氟沙星对照品48mg,精密称定,置200ml量瓶中,加盐酸液(0.1mol/l)振摇,使溶解,用盐酸(0.1mol/l)稀释至刻度,摇匀。
注射用甲磺酸培氟沙星无菌检查方法改进及验证

343314868@ qq com
通讯作者:彭诗富ꎬ男ꎮ 职称:工程师助理ꎬ实验员ꎮ 主要从事药品、食
号 APY220ꎬ批号 20170515ꎬ均来自杭州泰林生物技术设备有
限公司ꎮ
期及静止期菌株也有效ꎬ临床主要用于治疗敏感菌 所 致 感
1 2 试药 硫乙醇酸盐流体培养基中( 批号 3105592) 、胰酪
品ꎮ 笔者以« 中国药典»2015 年版中无菌检查法为基础 〔3〕 ꎬ分
( 批号 1070181) 、沙氏葡萄糖液体培养基( 批号 1071003) 、沙
Mesylate for Injection
SHI Rong1 ꎬPENG Shi ̄fu2∗ (1 Hunan Institute for Drug Control( Hunan Pharmaceutical Excipients Testing
and Inspection Center) ꎬHunan Engineering & Technology Research Center for Pharmaceutical Quality E ̄
甲磺酸培氟沙星属喹诺酮类第三代抗菌药ꎬ具有广谱抗
菌作用ꎬ对细菌肠杆菌科的大部分细菌ꎬ包括大肠埃希菌、克
雷伯菌属、变形杆菌属、志贺菌属、伤寒及沙门菌属都具有良
好的抗菌作用ꎬ对铜绿假单胞菌和金黄色葡萄球菌以及对青
霉素、头孢菌素、氨基苷类耐药的菌株均有抗菌效果ꎬ对复制
菌检查方法ꎮ
1 材料
1 1 仪器 集菌仪:型号 HTY ̄602ꎻ集菌器( 薄膜过滤器) :型
摘要:目的 改进注射用甲磺酸培氟沙星的无菌检查方法ꎮ 方法 通过比较采用薄膜过滤直接冲洗和加入中和剂两种方法ꎬ来探索消除样品
抑菌性的最佳方式ꎮ 结果 供试品溶液直接过膜后ꎬ至少需要 500mL 0 1% 蛋白胨水冲洗滤膜ꎬ才能消除样品抑菌性ꎻ而供试品溶液中加入
注射用甲磺酸左氧氟沙星无菌检查方法学验证

注射用甲磺酸左氧氟沙星(0.2g)无菌检查方法学验证方案1. 概述:公司根据市场发展需要拟计划规模化生产冻干粉针剂注射用甲磺酸左氧氟沙星(0.2g)产品,生产车间的洁净度等级与无菌操作、无菌保障等剂型产品的工艺验证、阶段性的无菌灌装试验过程验证等已经完成。
根据中国药典2005版要求,我司生产的注射用甲磺酸左氧氟沙星(0.2g)产品需做无菌等控制的检查,需对无菌检查方法学进行验证,以确保检验方法的准确可靠。
2. 项目名称:注射用甲磺酸左氧氟沙星(0.2g)无菌检查方法学验证。
3. 验证编号:VAL-JY-032(00)4. 验证形式:同步验证。
5. 验证目的:根据中国药典2005版要求,我司生产的注射用甲磺酸左氧氟沙星(0.2g)产品需做无菌等控制的检查,需对检验方法学进行验证,以确保检验方法的准确可靠。
6. 验证参加人员:根据验证项目,我们设立质控部注射用甲磺酸左氧氟沙星(0.2g)无菌检查方法学验证小组,明确各自责任与分工,具体如下表:质控部注射用甲磺酸左氧氟沙星(0.2g)无菌检查方法学验证小组各自责任与分工姓名部门小组职务责任与分工负责组织验证方案的起草,验证报告的编制,并组织实施负责验证方案和验证报告的审核负责验证方案和验证报告的审核负责验证方案和验证报告的审核负责验证方案和验证报告的校核负责在设备维修与校验方面提供支持和服务负责按相关标准检验其符合性实施验证负责按相关标准对生产过程与取样的监控管理7.文件依据:7.1.检验通用标准操作规程。
7.2.生测室用工器具清洁灭菌标准操作规程。
7.3.《中国药典》2005年版二部附录、通用检验操作规程和记录7.5.《药品生产质量管理规范实施指南》(2001版)。
7.6.《药品生产验证指南》(2003版)。
7.7.其它有关文件和记录。
8.验证条件:8.1.空气净化等级:生测室空气净化等级一万级,超净台空气净化等级一百级。
8.2检查用工器具已按清洁规程洗涤、干燥和灭菌。
注射用甲磺酸培氟沙星无菌检查法的确定

注射用甲磺酸培氟沙星无菌检查法的确定李昊;李旭;张亚杰【摘要】Objective To establish the sterile examination method for every company.Methods Add 0.05% manganese sulfate into the 0.1% peptone solution for dissolving and washing.Results The sterile examination of the thirty batches all meets the specification.Conclusion The method of the sterile examination is appropriate for all companies.%目的建立可行的适合所有生产单位的注射用甲磺酸培氟沙星无菌检查方法.方法采用含0.05%硫酸锰的0.1%蛋白胨水溶液作为溶剂和冲洗液进行无菌检查.结果对30批次样品进行无菌检查,均符合规定.结论该方法适用于所有厂家的注射用甲磺酸培氟沙星的无菌检查.【期刊名称】《中国抗生素杂志》【年(卷),期】2017(042)006【总页数】3页(P531-533)【关键词】注射用甲磺酸培氟沙星;无菌检查;冲洗液【作者】李昊;李旭;张亚杰【作者单位】辽宁省药品检验检测院,沈阳110036;辽宁省药品检验检测院,沈阳110036;辽宁省药品检验检测院,沈阳110036【正文语种】中文【中图分类】R917;R978.1注射用甲磺酸培氟沙星主要成分为甲磺酸培氟沙星,其化学名称为:1-乙基-6-氟-1,4-二氢-7-[4-甲基哌嗪-1-基]-4-氧-喹啉-3-羧酸甲磺酸盐,是氟喹诺酮类抗菌药,具有广谱抗菌作用。
《中国药典》2010年版二部本品质量标准虽然规定本品无菌检查方法为薄膜过滤法,但未规定冲洗液及冲洗量,市面上各厂家对于该品种无菌检查方法也各不相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
验证报告编号:2305·429-00注射用甲磺酸培氟沙星工艺验证方案起草人:日期:年月日审核人:日期:年月日批准人:日期:年月日×××药业有限公司注射用甲磺酸培氟沙星(0.2g规格)生产工艺验证方案目录2.验证目的3.验证范围4. 验证小组成员及职责范围4.1 验证小组成员4.2 验证小组成员职责范围5.验证进度计划6.粉针主要生产设备一览表7.生产洁净区的划分及工艺流程8.生产和检验标准文件的引用9.产品生产工艺过程综合指标确认10.验证内容11. 验证条件监控12.拟订验证周期13. 验证结果评价与结论14.验证会签1 概述:本公司生产的注射用甲磺酸培氟沙星,其规格为0.2/瓶。
为了证明在执行SP-MF-000-000-00注射用维生素B6生产工艺规程的情况下,能稳定地生产出符合质量标准的产品。
在这之前验证小组已对空调净化系统、纯化水和注射用水系统,以及在线设备分别进行了验证合格,同时对生产线也进行了验证合格,所以本方案主要就该产品生产工艺规程及其生产过程和最终产品质量等进行验证并作出评价。
2目的:为了证明在执行SP-MF-000-000-00注射用甲磺酸培氟沙星生产工艺规程的情况下,连续生产三批,最终产品稳定性、可靠性并符合标准要求。
3 范围: 本验证方案适用于冻干车间的厂房、设施、设备、工艺条件下注射用维生素B6(0.2g规格)的生产,当上述条件发生改变时,应重新验证。
4 验证小组成员及职责范围:4.1验证小组成员:4.2.1制造部:负责起草验证方案和有关规程,按批准的验证方案起草验证方案,组织培训考核人员,组织实施验证并同时收集验证资料,会签验证报告。
4.2.2 质量部:检验方法验证、取样、检验、结果评价,结果评价方案,验证文件的文件管理,对供应商的确认。
QA:负责悬浮粒子、沉降菌主要工序温度、相对湿度及压差检查、及设备、设施的无菌、原辅料、内外包材、中间产品、成品取样。
QC参加产品的检验工作。
4.2.3工程部:设备的预确认及安装确认,设备公用工程系统验证的确认,负责仪器、仪表的准备与校正,制定设备限度、能力和维修保养要求,培训维修人员,为设备安装及验证中提供技术服务。
同时负责验证过程中水、电、汽(气)的正常供应和调度工作,及相关技术参数的收集,确保验证顺利进行。
4.2.4 物资控制部:负责提供提供验证过程中所需的原辅料及包装材料及其它需要的物资。
4.2.5岗位操作者:负责验证过程中按相关规程对设备进行操作,执行SOP程序,认真做好原始记录。
5验证进度计划6.冻干主要生产设备一览表7.生产洁净区的划分及工艺流程控制点1:含量、内毒素、pH控制点2:无菌、内毒素、可见异物控制点3:无菌、内毒素、可见异物控制点4:装量、可见异物8.生产和检验标准文件的引用8.1原、辅、包装材料、中间体、半成品质量标准9.1涉及的批号及批生产、检验记录9.2生产工艺确认为了确认执行“注射用甲磺酸培氟沙星”生产工艺规程的适用性,选0.2g/瓶规格从2010年月日到2010年月日止连续生产三批,每批批量为瓶,在生产过程中各工序均应按标准要求进行操作,并按维生素B6生产工艺规程要求,对西林瓶、胶塞的洗涤、配制后药液的可见异物、PH值、主药含量、装量、轧盖、贴签和最终产品质量等进行取样检验规定的验证项目,以判断各工序在生产注射用维生素B6过程中半成品和最终产品质量是否稳定地达到工艺要求。
9.3物料生产瓶处方9.6成品国家标准及内控质量标准结论:结论人:日期:10.验证内容10.1西林瓶的洗涤、灭菌确认10.1.1目的:确认执行洗瓶灭菌岗位标准操作规程SOP-MF-000-000-00情况下,西林瓶质量是否符合要求。
10.1.2操作:按SOP-MF-000-000-00程序进行批量生产,每批洗瓶数量按计划产量的102%备瓶,同时按可见异物检查法操作规程取样检查洗西林瓶的水的可见异物,西林瓶的可见异物,灭菌后细菌内毒素,其中洗瓶水的可见异物每小时检查一次,细菌内毒素每批检查一次。
10.1.3工艺过程西林瓶→超声波振荡洗涤→纯化水冲洗一次→压缩空气吹干一次→注射用水冲洗一次→压缩空气吹干一次→灭菌干燥10.1.4工艺条件10.1.4.1洗瓶设备:KZCX1000型超声波洗瓶机。
10.1.4.2洗瓶机功率:6500W。
10.1.4.3电源电压:380V。
10.1.4.4洗瓶机生产能力: 0~60000只(10ml)/小时。
10.1.4.5西林瓶清洗灭菌后在层流下的存放时间不得超过24小时。
10.1.4.6纯化水:经80目不锈钢筛网过滤。
10.1.4.7注射用水:经0.22μm筒式过滤器过滤,压力为≥0.25MPa。
10.1.4.8压缩空气:经0.22μm筒式过滤器过滤,压力为≥0.25MPa。
10.1.4.9灭菌干燥设备:远红外隧道式灭菌烘箱。
10.1.4.10灭菌温度:350℃±15℃;灭菌时间:5-7分钟。
10.1.5验证方法10.1.5.1将注射用水经0.22μm筒式过滤器过滤至洁净的容器中,查可见异物合格后待用。
10.1.5.2在以上的工艺条件下按《KZCX1000型超声波洗瓶机SOP》进行西林瓶清洗操作,接着按《SH-6型远红外隧道式灭菌烘箱SOP》进行西林瓶灭菌干燥操作,洁净的的西林瓶立即进入分装间开启的局部100级层流罩下。
10.1.5.3在开启的局部100级层流罩下,取按上述清洗灭菌的10ml西林瓶作为验证用样品。
检查灭菌后的样品、细菌内毒素、可见异物、等项目;无菌1班/次;内毒素1班/次;可见异物40瓶/次;取样频次:15分钟/1次,连续取样3次。
10.1.5.4取样量:无菌:3支/次;细菌内毒素:3支/次;可见异物:20支/次。
10.1.6验证合格标准可见异物,应符合规定;细菌内毒素:<0.25EU/ml;无菌检查:应无菌。
验证结果:见附件1结论:结论人:日期:10.1.7灭菌西林瓶有效期的确定验证方法:取灭菌后的西林瓶40支,储存于开启的百级层流罩下,每12小时检测西林瓶的细菌内毒素及无菌一次,每次无菌检测取5支,细菌内毒素检测取5支,检测结果如下:结论:结论人:日期:10.2胶塞的清洗灭菌确认10.2.1目的:确认在执行SOP-MF-000-000-00程序的情况下,清洗和灭菌后的胶塞质量是否符合标准要求。
10.2.2操作:按SOP-MF-000-000-00程序进行,并连续三批生产,每批清洗数量按实际生产量的102%备塞,每批计只,清洗灭菌结束及时取样检查洗胶塞水的可见异物,可见异物、细菌内毒素和无菌等项目指标是否符合工艺要求。
10.3.3工艺过程胶塞自动进料→转鼓旋转喷淋清洗→气、水混合漂洗→排出杂质→均匀硅化→漂洗→蒸汽灭菌→真空干燥→冷却→自动卸料10.2.4工艺条件10.2.4.1胶塞清洗设备:KJCS-20型全自动胶塞清洗机。
10.2.4.2全自动胶塞清洗机功率为5000W,采用电源电压为380V。
10.2.4.3设备生产能力:200000只胶塞。
10.2.4.4生产环境:C洁净区。
10.2.4.5纯化水:经0.22μm筒式折叠过滤器过滤,压力为≥0.25MPa。
10.2.4.6注射用水:经0.22μm筒式折叠过滤器过滤,压力为≥0.25MPa。
10.2.4.7喷淋时间:15分钟。
10.2.4.8硅化温度:80℃;硅化时间15分钟。
10.2.4.9灭菌温度:121℃;灭菌时间40分钟。
10.2.4.10干燥时间:40分钟。
10.2.4.11胶塞必须在 24小时内用完,胶塞清洗灭菌后密封存放时间不得超过24小时。
10.2.5验证方法10.2.5.1在以上的工艺条件下按《胶塞清洗机SOP》和《胶塞清洗岗位SOP》进行胶塞清洗灭菌操作,用经灭菌胶塞验证用样品;检查灭菌胶塞的无菌、细菌内毒素、可见异物。
连续取样3次。
10.2.5.2取样量:无菌:2只/次;细菌内毒素:2只/次;可见异物:20只/次。
10.2.6验证合格标准无菌检查:应无菌;细菌内毒素:<0.25EU/ml;可见异物,应符合规定。
验证结果:见附件2结论:结论人:日期:10.2.7灭菌胶塞有效期的确定验证方法:取灭菌后的胶塞40只,储存于开启的百级层流罩下,每12小时检测胶塞的细菌内毒素及无菌一次,每次无菌检测取5只,细菌内毒素检测取5只,检测结果如下:结论:结论人:日期:10.3配液及过滤质量监控10.3.1目的:确认执行SOP-MF-000-000-00的情况下,配制的药液可见异物、pH值、含量、无菌等项目指标是否能稳定地达到工艺要求。
10.3.2工艺过程称量注射用水原料稀配罐搅拌、溶解称量活性炭制炭浆搅拌30分钟0.22μm除菌过滤过滤器灌装半压塞取样10.3.3工艺条件10.3.3.1配制设备:P600型稀配罐。
10.3.3.2维生素B6原料:符合维生素B6(供注射用)质量标准。
10.3.3.3活性炭:符合针用活性炭质量标准,用量为稀配体积的0.1%。
10.3.3.4原辅料称量应双人复核无误。
10.3.3.5配制用的注射用水:为经检验合格。
10.3.3.6原料加入稀配罐后,加注射用水搅拌约30分钟使溶解。
10.3.3.7稀配罐加入活性炭后循环搅拌30分钟。
配液罐加入活性炭后循环搅拌30分钟。
(按配液岗位标准操作规程进行操作)验证目的:检查搅拌不同时间,药液是否均匀。
验证搅拌30分钟是合理的,如需要调整,需提出数据作为变更的依据。
①取样计划:药液规定搅拌时间为30分钟,验证时间可设未10min、20min、30min必要时再设40min;②取样点:每次设置3个取样点;③取样量:每次取样10ml/取样点;④取样容器:灭菌干燥西林瓶⑤取样点编号:S1 、S2、 S3;⑥标准要求:含量、pH值(含量:37.2mg/g~42.8mg/g;pH值:6.2-7.8)取样记录搅拌验证结果批号:批号:批号:检测人:复核人:日期:结论:结论人:日期:10.3.3.8脱炭使用0.45μm筒式过滤器过滤。
10.3.3.9药液温度应为50℃ - 60℃以下10.3.3.10精滤用两道0.22μm除菌过滤器终端过滤。
10.3.3.11脱炭结束到粗滤间隔时间不得超过4小时;药液从配制至除菌过滤间隔时间不得超过8小时。
10.3.3.12称量间、稀配间为C级洁净区。
10.3.3.13过滤过程应遵守无菌操作,过滤前和过滤结束后都要对过滤器做起泡点实验10.3.4验证方法10.3.4.1 在以上工艺条件下,按下列方法进行验证。
10.3.4.2按《配液过滤岗位标准操作规程》及批生产指令准确称量所需的原辅料及活性炭。
10.3.4.3按《配液过滤岗位标准操作规程》进行配料操作。
