专题二 盐类水解的影响因素及应用
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题二盐类水解的影响因素及应用
知识梳理
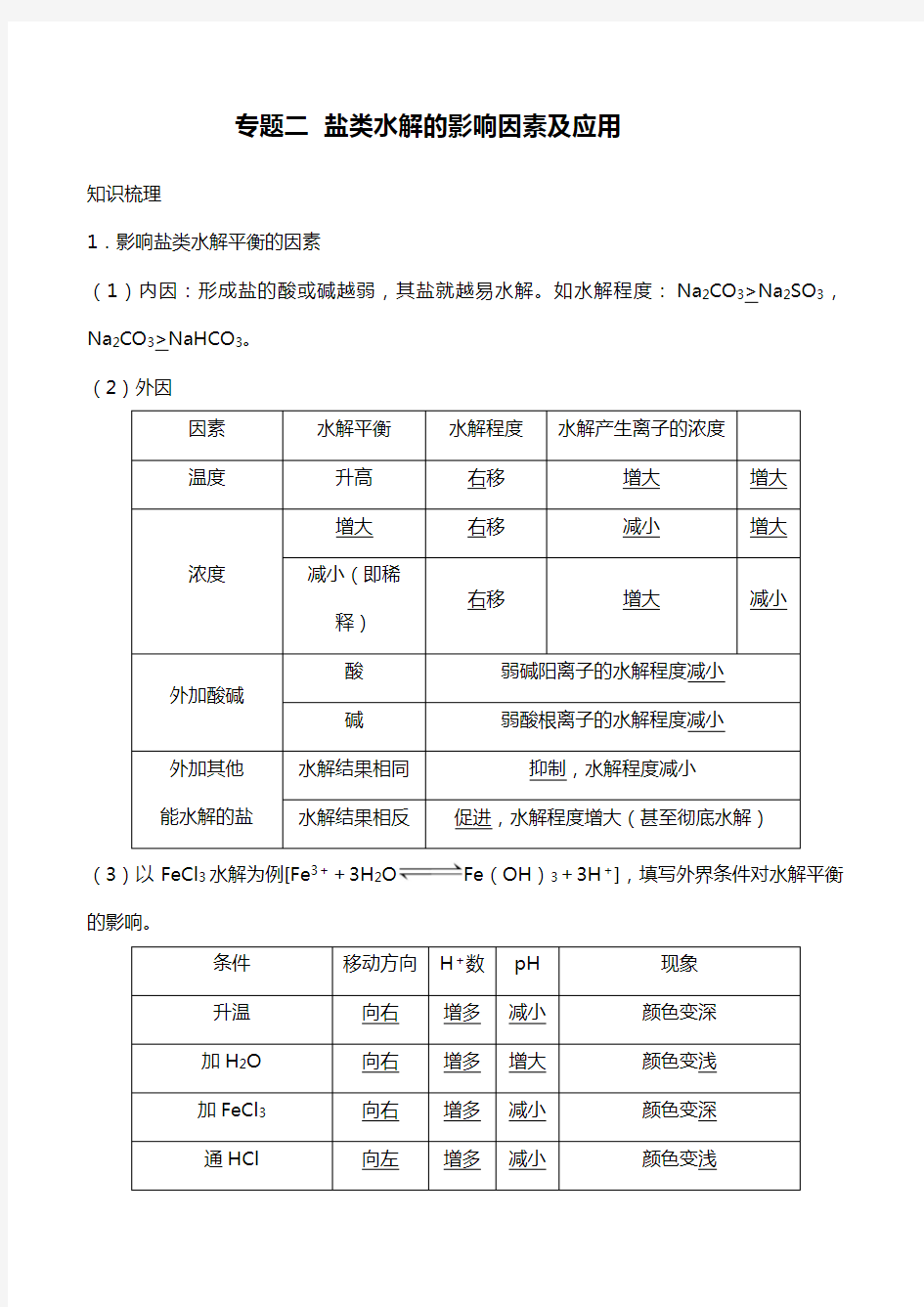
1.影响盐类水解平衡的因素
(1)内因:形成盐的酸或碱越弱,其盐就越易水解。如水解程度:Na2CO3>Na2SO3,Na2CO3>NaHCO3。
(2)外因
因素水解平衡水解程度水解产生离子的浓度
温度升高右移增大增大
浓度
增大右移减小增大减小(即稀
释)
右移增大减小
外加酸碱酸弱碱阳离子的水解程度减小碱弱酸根离子的水解程度减小
外加其他能水解的盐水解结果相同抑制,水解程度减小
水解结果相反促进,水解程度增大(甚至彻底水解)
(3)以FeCl3水解为例[Fe3++3H2O Fe(OH)3+3H+],填写外界条件对水解平衡的影响。
条件移动方向H+数pH现象
升温向右增多减小颜色变深
加H2O向右增多增大颜色变浅
加FeCl3向右增多减小颜色变深
通HCl向左增多减小颜色变浅
加NaHCO3向右减小增大生成红褐色沉淀,放出气体
加AlCl3向左增多减小颜色变浅
2.盐类水解的应用
应用举例
判断溶液的酸碱性FeCl3溶液显酸性,原因是(用离子方程式表示)Fe3++3H2O Fe(OH)3+3H+
判断酸性强弱NaX、NaY、NaZ三种盐溶液的pH分别为8、9、10,则酸性由强到弱的顺序为HX>HY>HZ
配制或贮存易水解的盐溶液配制FeCl3溶液,加入少量盐酸,贮存Na2CO3溶液、Na2SiO3溶液不能用磨口玻璃塞
胶体的制取制取Fe(OH)3胶体的离子方程式:Fe3++3H2O错误!Fe
(OH)3(胶体)+3H+
泡沫灭火器原理成分为NaHCO3溶液与Al2(SO4)3溶液,发生反应Al3++3HCO错误!===Al(OH)3↓+3CO2↑
作净水剂明矾可作净水剂,原理为Al3++3H2O Al(OH)3
(胶体)+3H+
化肥的使用铵态氮肥与草木灰不得混用
除锈剂NH4Cl与ZnCl2溶液可作焊接时的除锈剂
判断盐溶液蒸干时的产物
盐水解生成挥发性酸,蒸干灼烧后一般得氧化物。如
AlCl3→Al2O3
盐水解生成难挥发性酸,蒸干后得原物质。如
CuSO4→CuSO4
考虑盐受热时是否分解。如KMnO4→K2MnO4和MnO2
1、判断正误
(1)NaHCO3和NaHSO4都能促进水的电离(×)
(2)降低温度和加水稀释,都会使盐的水解平衡向逆反应方向移动(×)
(3)加热0.1 mol·L—1 Na2CO3溶液,CO错误!的水解程度和溶液的pH均增大(√)(4)水解平衡右移,盐的离子的水解程度一定增大(×)
(5)在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO—)(√)(6)AlO错误!与HCO错误!的水解相互促进而不能大量共存(×)
(7)NH4F水溶液存放于玻璃试剂瓶中(×)
(8)实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡胶塞,而不能用玻璃塞(√)(9)配制FeCl3溶液时,将FeCl3固体溶解在浓盐酸中,然后再用水稀释到所需的浓度(√)
(10)铁盐可以用于净水(√)
(11)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用(√)
(12)AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同(×)
2、拓展应用
(1)①含酚酞的0.01 mol·L—1 CH3COONa溶液显浅红色的原因为_______________
(用离子方程式表示)。
②向0.01 mol·L—1 CH3COONa溶液中分别加入NaOH固体、Na2CO3固体、FeSO4固体,
使CH3COO—水解平衡移动的方向分别为__________、____________、__________(填“左”、“右”或“不移动”)。
答案①CH3COO—+H2O CH3COOH+OH—,使溶液显碱性
②左左右
(2)一种常用的泡沫灭火器构造如图。
从长期放置的角度分析:a中盛________,b中盛________。
答案Al2(SO4)3溶液饱和NaHCO3溶液
3、思维探究
已知室温时,pH均为5的H2SO4溶液、NH4Cl溶液各取10 mL,分别加水稀释至100 mL。
(1)所得溶液中,pH较大的是________溶液。
(2)NH4Cl溶液,c(H+)________(填“>”“<”“=”)10—6mol·L—1,错误! ________(填“增大”“减小”或“不变”)。
(3)pH=5的H2SO4溶液中错误!=________,如加水稀释1 000倍,稀释后的溶液中错误!=________。
(4)配制Na2S溶液时,为什么不能将Na2S加入水中直接溶解,而是溶解在NaOH溶液中?
答案(1)H2SO4(2)> 减小
(3)2∶1 20∶1
(4)Na2S在水中会发生强烈水解生成H2S导致中毒,故应溶解在NaOH溶液中以防水解。
强化训练
1.(2021年北京海淀)在一定条件下,Na2S溶液中存在水解平衡:S2—+H2O HS—+OH—。下列说法正确的是()
A.稀释溶液,水解平衡常数增大
B.通入H2S,HS—浓度减小
C.升高温度,错误!增大
D.加入NaOH固体,溶液pH减小
答案C
2.(2021年湖北宜昌)已知NaHSO3溶液常温时显酸性,溶液中存在以下平衡:
HSO错误!+H2O H2SO3+OH—①
HSO错误!H++SO错误!②
向0.1 mol·L—1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是()A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO错误!)增大
B.加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO错误!)+c(OH—)+c (SO错误!)
C.加入少量NaOH溶液,错误!、错误!的值均增大
D.加入氨水至中性,则2c(Na+)=c(SO错误!)>c(H +)=c(OH—)
答案C
3.下列关于盐类水解的说法错误的是()
A.pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:①>②>③B.浓度均为0.1 mol·L—1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH错误!)的大小顺序为①>②>③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH错误!水解
